小分子肽WP在制备缓解阿尔茨海默症的功能性产品中的应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及小分子肽WP在制备缓解阿尔茨海默症的功能性产品中的应用,属于酶解加工产品技术领域。
背景技术
蜂王浆是由蜜蜂工蜂的咽下腺和下颌腺分泌而来的粘性浆状物,具有多种活性成分,以及多种生物学功能,如降压降脂、抗氧化和保护神经系统等。但是蜂王浆适口性低,加工利用度低,制约了利用价值。而多肽具有多种优势,如益于消化吸收且具有低敏性,易透过血脑屏障等。因此,对蜂王浆进行酶解得到蜂王浆酶解物,从蜂王浆酶解物中挖掘具有特殊生物活性的多肽是当前的研究热点。
阿尔茨海默症(AD)是老年人群中常见的不可逆的神经退行性疾病,临床表现为进行性记忆和认知能力减退、语言障碍、精神运动异常等症状。氧化应激作为阿尔茨海默病进展的主要因素,通过引起神经元线粒体功能障碍、大分子氧化、金属离子与Aβ斑块结合产生活性氧(ROS),以及过度磷酸化的tau蛋白和Aβ合成的上调促进病理学形成。目前治疗阿尔茨海默症的药物有胆碱酯酶抑制剂和n-甲基-d-天冬氨酸受体拮抗剂,其伴随较为严重的副作用。
发明内容
针对上述现有技术,本发明提供了小分子肽WP在制备缓解阿尔茨海默症的功能性产品中的应用,属于酶解加工产品技术领域。
本发明是通过以下技术方案实现的:
小分子肽WP在制备缓解阿尔茨海默症的功能性产品中的应用,所述小分子肽WP的氨基酸序列为Trp-Pro。
进一步地,所述功能性产品选自药物或功能性食品。
进一步地,所述缓解阿尔茨海默症的功能性产品的有效成分为小分子肽WP。
进一步地,所述缓解阿尔茨海默症的功能性产品中还含有药学上常用的辅料,所述辅料选自水、葡萄糖、硬脂酸镁等;所述缓解阿尔茨海默症的功能性产品的剂型选自常见剂型,如注射剂、口服液、片剂、胶囊等。
一种缓解阿尔茨海默症的功能性产品,其有效成分为小分子肽WP。
进一步地,所述缓解阿尔茨海默症的功能性产品中还含有药学上常用的辅料,所述辅料选自水、葡萄糖、硬脂酸镁等;所述缓解阿尔茨海默症的功能性产品的剂型选自常见剂型,如注射剂、口服液、片剂、胶囊等。
进一步地,所述缓解阿尔茨海默症的功能性产品由以下组分组成,按重量份计:小分子肽WP 0.2%~1.0%,木糖醇6%~10%,海藻糖1%~3%,无水柠檬酸0.5%~1.0%,β-环状糊精。0.5%~2.0%,山梨酸钾0.03%~0.08%,余量为水。优选的,由以下组分组成,按重量份计:小分子肽WP 0.5%,木糖醇8%,海藻糖2%,无水柠檬酸0.8%,β-环状糊精1%,山梨酸钾0.05%,余量为水。
本发明通过实验研究发现,蜂王浆多肽具有抗氧化活性,因此蜂王浆多肽具有作为缓解阿尔茨海默症的功能性产品的潜力。进一步地,经LC-MS/MS鉴定,利用分子对接从蜂王浆多肽中筛选得到了小分子肽WP(存在于蜂王浆多肽R4中),研究发现,小分子肽WP对氧化应激引起认知功能障碍的关键受体蛋白Fyn及Keap 1具有抑制活性,具有乙酰胆碱酯酶(AchE)抑制功效,对超氧化物歧化酶(SOD)的活力具有增强的效果,能上调早期生长反应因子1(egr 1)基因和下调半胱氨酸蛋白酶3(caspase 3)基因表达。因此,小分子肽WP具有作为缓解阿尔茨海默症的功能性产品的潜力。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
图1:蛋白酶对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、b、c、d、e表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图2:加酶量对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、b、c、d表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图3:初始pH对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、b、c、d表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图4:酶解温度对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、b、c、d表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图5:料液比对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、ab、b、c、d、e表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图6:酶解时间对还原力的影响示意图,其中,采用字母标注法标注差异结果,a、b、c、d、e表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
图7:标准品及蜂王浆酶解液的分子量分布图。
图8:酶解液经G-10葡聚糖凝胶柱层析的分离结果示意图。
图9:样品处理后斑马鱼乙酰胆碱酯酶荧光值比较示意图,其中,与模型对照组比较,*p<0.05,**p<0.01。
图10:样品处理后斑马鱼的超氧化物歧化酶活力比较示意图,其中,与模型对照组比较,**p<0.01,***p<0.001。
图11:egr 1基因相对表达量比较示意图,其中,与模型对照组比较,**p<0.01,***p<0.001。
图12:caspase 3基因相对表达量比较示意图,其中,与模型对照组比较,**p<0.01,***p<0.001。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域技术人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
下述实施例中所涉及的仪器、试剂、材料,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料,可通过正规商业途径获得。下述实施例中所涉及的实验方法、检测方法等,若无特别说明,均为现有技术中已有的常规实验方法、检测方法。
下述实施例所采用的蜂王浆,购自山东丰采健康产业有限公司,置于密封不透光袋中,置于-20℃环境,备用。
实施例1 蜂王浆酶解工艺的优化
1.筛酶
(1)准确称取蜂王浆1 g,加入10 ml蒸馏水配置成料液比为1:10的底物溶液,分别调节底物溶液至酸性蛋白酶、中性蛋白酶、木瓜蛋白酶、菠萝蛋白酶和碱性蛋白酶的最佳pH(分别为3.0~4.0、6.0~7.0、6.8~7.0、6.0~8.0和8.0~11.0),按加酶量2000 U/g(酶活/蜂王浆)加入五种蛋白酶,在水浴摇床50℃、200 rpm条件下酶解5小时;将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
(2)体外还原力的测定:取0.5 ml试样,与0.5 ml的0.2 M磷酸盐缓冲液(pH 6.6)和0.5 ml的1.0%(单位g/ml)铁氰化钾溶液混合,在50℃水浴条件中孵育20分钟。冷却至室温,加入0.5 ml的10%(单位g/ml)三氯乙酸溶液以停止反应。将混合物以1500 g离心10分钟,取1 ml上清液,与1 ml蒸馏水和0.2 ml的0.1%(单位g/ml)FeCl
体外还原力的计算公式如下:
体外还原力(%)=(Abs
(3)结果:蛋白酶对还原力的影响示意图如图1所示。由图1可知,中性蛋白酶酶解产物的体外还原能力最强,达107.82%,显著优于其他4种蛋白酶,因此选择中性蛋白酶进行单因素优化实验,详见下述。
2.加酶量的优化
准确称取蜂王浆1 g,加入10 ml蒸馏水配置成料液比为1:10的底物溶液,调节底物溶液初始pH为7.0,按加酶量1000、2000、3000、4000、5000 U/g(酶活/蜂王浆)加入中性蛋白酶,在水浴摇床50℃、200 rpm条件下酶解5小时。将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
结果:加酶量对还原力的影响示意图如图2所示。随着加酶量的升高,还原能力也逐渐增强,至加酶量为4000 U/g时还原力下降后又升高,加酶量为3000 U/g及5000 U/g时还原能力显著高于其他组(P<0.05)。出于经济考虑,选择中性蛋白酶加酶量为3000U/g进行下一步优化。
3.初始pH的优化
准确称取蜂王浆1 g,加入10 ml蒸馏水配置成料液比为1:10的底物溶液,以1 M盐酸和1 M的NaOH溶液调整底物溶液的初始pH值分别为4、5、6、7、8,按加酶量3000 U/g(酶活/蜂王浆)加入中性蛋白酶,在水浴摇床50℃、200 rpm条件下酶解5小时。将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
结果:初始pH对还原力的影响示意图如图3所示。随着pH的升高,酶解液的还原能力呈现先增强后减弱的趋势,其中当初始pH为6时,还原能力达到85.32%,显著高于其他组(P<0.05)。因此,选择初始pH为6进行下一步优化。
4.酶解温度的优化
准确称取蜂王浆1 g,加入10 ml蒸馏水配置成料液比为1:10的底物溶液,调整底物溶液的初始pH值为6,按加酶量3000 U/g(酶活/蜂王浆)加入中性蛋白酶,分别在30、40、50、60、70℃,200 rpm条件下酶解5小时。将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
结果:酶解温度对还原力的影响示意图如图4所示。随着温度的升高,酶解产物的还原能力呈现先增强后减弱的趋势,其中当酶解温度为50℃时,还原能力达到97.72%,显著高于其他组(P<0.05)。因此,选择酶解温度为50℃进行下一步优化。
5.料液比的优化
分别配置料液比为1:2、1:4、1:6、1:8、1:10、1:12的底物溶液,调整底物溶液的初始pH值为6,按加酶量3000 U/g(酶活/蜂王浆)加入中性蛋白酶,在水浴摇床50℃、200 rpm条件下酶解5小时。将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
结果:料液比对还原力的影响示意图如图5所示。酶解产物的还原能力随着料液比的增大而减弱,其中1:2、1:4之间没有显著性,还原能力达到113.55%及111.19%,但显著性高于其他组(P<0.05)。出于经济考虑,选择料液比1:4进行下一步优化。
6.酶解时间的优化
将蜂王浆配置成料液比为1:4的底物溶液,调整底物溶液的初始pH值为6,按加酶量3000 U/g(酶活/蜂王浆)加入中性蛋白酶,在水浴摇床50℃、200 rpm条件下分别酶解2、3、4、5、6小时。将样品煮沸15分钟灭酶,冷却至室温,以8000 rpm离心10分钟,测定酶解上清液的还原力。每组设三个平行。
结果:酶解时间对还原力的影响示意图如图6所示。随着酶解时间的延长,酶解产物还原能力呈现先增强后减弱的趋势。当酶解时间为3小时及4小时时没有显著性,还原能力达到141.93%及143.92%,但显著性明显高于其他时间组(P<0.05)。因此,出于经济考虑,选择酶解时间3小时进行下一步优化。
7.正交试验优化
根据单因素实验结果,确定料液比,初始pH值、温度及加酶量四个因素的水平,设置4因素3水平正交实验,测定还原能力,获得最佳酶解条件(酶解时间3小时)。正交实验设计因素水平表详见表1。
表1 正交实验设计因素水平表
蜂王浆酶解正交优化实验结果如表2所示,表2中采用字母标注法标注还原力的差异结果,a、b、c、d、f、g、h表示不同肽段之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。从R值分析可以看出,料液比、初始pH值、温度及加酶量对酶解效果影响的主次效应为:B>A>C>D,即料液比的影响最大,温度对酶解效果的影响最小。最终得到优化组合为A3B1C3D1,即料液比为1:3,初始pH为7, 酶解温度为45℃,加酶量4000 U/g,经过验证得还原能力为205.24%。
表2 蜂王浆酶解正交优化实验结果
实施例2 葡聚糖凝胶过滤层析及各组分活性分析
将蜂王浆配置成料液比为1:3的底物溶液,调整底物溶液的初始pH值为7,按加酶量4000 U/g(酶活/蜂王浆)加入中性蛋白酶,在水浴摇床45℃、200 rpm条件下酶解3小时,得蜂王浆酶解液。
使用Vivaflow 50R(Sartorius,德国)超滤膜包依次获得<10 KDa和<5 KDa的酶解液组分,将<5 KDa的酶解液组分冻干并在-20℃保存,称为R0,作为下述待测样品。超滤膜包经0.5 mol/l的NaOH溶液洗涤并用10%乙醇溶液密封置于4℃环境保存。
采用高效液相色谱法测定标准品及蜂王浆酶解液的分子量的分布情况,标准品及蜂王浆酶解液的分子量分布图如图7所示。设定色谱条件为:色谱柱,TSK gel 2000 SWXL300 mm×7.8 mm;流动相比例为乙腈:水:三氟乙酸=45:55:0.1(体积比);检测波长选择UV220 nm;流速设定为0.5 mL/min;柱温设定为30℃,进样体积为10μl。选择细胞色素C(12384Da),猪胰岛素(5733.49 Da),杆菌肽(1422.69 Da),谷胱氨肽(307.32Da)作为凝胶过滤色谱柱分子量的标准品。
用纯水配制流动相并超声至无气泡。将待测样品及混合标准品用流动相分别配制为10 mg/ml及8 mg/ml,0.22μm微孔滤膜过滤后进样。根据标准品的出峰时间绘制标准曲线,根据绘制的标准曲线拟合计算样品中多肽的分子量范围。蜂王浆酶解液中多肽分子量分布结果如表3所示,分子量主要集中在485.47 Da以下,故选择葡聚糖凝胶G-10(SephadexG-10)作为层析柱的填料。
表3 蜂王浆酶解液中多肽分子量分布结果
葡聚糖凝胶G-10加入适量超纯水,静置溶胀24小时,除去浮沫及杂质;反复加入超纯水搅拌、静置并除去上层杂质,重复至上层无破碎杂质。加入合适比例的水,将填料连续沿壁填入16 mm×70 cm层析柱,避免分层和气泡出现。待层析柱填料高度基本不再变化后,泵入超纯水将填料压实,直至层析柱高度不再发生变化。
上样:配制100 mg/ml的样品溶液,上样体积为3 ml;洗脱速度为1.5 ml/min;流动相为超纯水,收集出峰的组分并冻干,测定不同组分的抗氧化活性。
结果:酶解液经G-10葡聚糖凝胶柱层析的分离结果示意图如图8所示,5个洗脱峰分别命名为R1、R2、R3、R4、R5。依次收集R1~R5所对应的洗脱液并冻干。冻干粉加水复配成浓度为10 mg/ml的溶液,测定各组分的还原力(以0.1mg/ml BHA的百分比表示),各组分的还原力测定结果如表4所示,表4中采用字母标注法标注还原力的差异结果,a、b、c、d、e、f表示不同实验组之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。洗脱峰R4的还原能力最强,因此选择组分R4进行下一步的实验。
表4 各组分的还原力测定结果
实施例3 LC-MS/MS质谱鉴定组分R4的肽段组成
肽段脱盐:实施例2中组分R4冻干粉,加入适量8 M UA(尿酸)复溶,取适量溶液,加入适量(2-羧乙基)膦(TCEP)和氯乙酰胺(CAA),37℃孵育1 h,将上清转移至10 K超滤管,12000 g 离心 15 min,再加入200μl 8 M UA,12000 g离心 15 min,接着加入200μl 0.2%TFA(三氟乙酸),12000 g离心15 min,重复一遍;收集滤液,使用C18StageTip脱盐,真空干燥。干燥后肽段用0.1% FA(甲酸)复溶,OD280测定肽段浓度,以备LC-MS分析。
LC-MS/MS分析:每例样品取适量肽段使用纳升流速Easy nLC 1200色谱系统(Thermo Scientific,塞默飞世尔科技)进行色谱分离。缓冲液:A液为0.1%甲酸水溶液,B液为0.1%甲酸、乙腈和水的混合溶液(其中乙腈为80%)。色谱柱以100%的A液平衡。样品进样到Trap Column(捕集柱)(100μm*20 mm,5μm,C18,Dr.Maisch GmbH,德国迈克)后经过色谱分析柱(75μm*150 mm,3μm,C18,Dr.Maisch GmbH)进行梯度分离,流速为300 nl/min。
液相分离梯度如下:0 min~2 min,B液线性梯度从2%到5%;2 min~44 min,B液线性梯度从5%到28%;44 min~51 min,B液线性梯度从28%到40%;51 min~53 min,B液线性梯度从40%到100%;53 min~60 min,B液维持在100%。
肽段分离后用Q-Exactive Plus质谱仪(Thermo Scientific)进行DDA(数据依赖采集)质谱分析。分析时长为60min,检测模式:正离子,母离子扫描范围:50~750 m/z,一级质谱分辨率:60,000 @m/z 200,AGC target:3e6,一级 Maximum IT:50 ms。
肽段二级质谱分析按照下列方法采集:每次全扫描(full scan)后触发采集 20个最高强度母离子的二级质谱图谱(MS2 scan),二级质谱分辨率:15,000 @ m/z 200,AGCtarget: 1e5,二级 Maximum IT:50 ms,MS2 Activation Type: HCD,Isolationwindow:1.6 m/z,Normalized collisionenergy:28。
数据库检索:采用的质谱数据库检索软件为MaxQuant 2.1.2.0,分析参数设置如表5所示。使用如下蛋白质数据库:ncbi-Apis mellifera ligustica(Common honeybee)(Italianhoneybee)[7469]-1917-20230508.fasta和uniprot-Apismellifera ligustica(Common honeybee)(Italian honeybee)[7469]-111-20230508.fasta。
表5 MaxQuant 分析参数设置
R4组分经质谱数据检索后采用PSM FDR≤0.01和Protein FDR≤0.01分别为肽段、位点与蛋白鉴定的筛选标准,得到195条肽段和8条蛋白。
实施例4 肽段筛选、合成及验证
1.多肽的活性预测
首先根据肽段匹配错误的概率(PEP)、肽段匹配得分(Score)和肽段的峰强度值(Intensity)进行筛选,将得分和强度为零及匹配错误率过高的筛除。使用PeptideRanker评估肽具有生物活性的可能性并进行排序,195条肽中评分超过0.5的肽段有74条,大于0.9的肽段有21条。
通过搜索BIOPEP数据库来评估PeptideRanker(肽段评分的一个在线软件)评分大于0.5的74条短肽的生物活性,通过Toxin Pred(毒性预测的一个在线软件)毒性评价来评估74条短肽的毒性及PI值。大多数短肽潜在或具有降血压(ACE抑制、肾素抑制和血管活性物质的释放活性),降血糖(DPP-IV抑制、葡萄糖吸收刺激活性和α-葡萄糖苷酶抑制的活性),控制疼痛(DPP-Ⅲ抑制活性)和AChE抑制活性,少部分具有抗氧化活性。大量的研究统计结果发现,氨基酸的组成以及位点对多肽抗氧化活性起着至关重要的作用,活性肽 N末端的氨基酸残基为芳香族氨基酸或Pro可能是作用于自由基清除的关键位点。除此之外,末端含有疏水氨基酸更容易进入受体活性口袋并稳定结合,而上述多肽的疏水性氨基酸在N端的多肽占比72%。通过评估,发现74条短肽均无毒性,pI值范围多数在5~7,少数在9~11。通过上述条件筛选48条多肽进行分子对接。
2.分子对接
配体的处理:采用Chemdraw 19.0及Chem3D 19.0软件绘制多肽的分子结构式,通过MM2力场优化,保存为pdb文件。使用AutoDock软件(分子对接的一个软件),将pdb文件导入并加氢,保存为pdbqt配体文件。
受体的处理:从PDB数据库中下载Fyn(2DQ7)和Keap 1(6SP1)的晶体结构,采用PyMOL软件将多余的氯离子和水分子删除,保存为pdb文件。使用AutoDock Tools软件对受体2DQ7和6SP1进行去水加氢,保存为pdbqt受体文件备用。
分子对接:使用AutoDock Tools软件的vina功能进行分子对接,模拟多肽小分子与大分子蛋白质的相互作用。设置2DQ7的对接中心坐标为(-3.031,-9.266,39.033)(x,y,z),盒子大小为50×51×58,设置6SP1的对接中心坐标为(-26.315,20.346,-16.173)(x,y,z),盒子大小为51×51×49,其它参数采取默认值。然后,将氨基酸和多肽配体逐一与2DQ7晶体结构进行对接处理。
结果:将上述筛选的48条肽段分别与2DQ7和6SP1进行Vina模拟对接,根据Vina得分,筛选14条小分子肽进行合成验证。
实施例5 小分子肽的合成及活性验证
1.合成
小分子肽PYPDW、WP、FW等14条小分子肽均由生工生物工程(上海)股份有限公司合成。
2.活性验证
还原力的测定:将各小分子肽配成10 mg/ml溶液,根据实施例1中的方法测定小分子肽的体外还原力。还原力排名前8的小分子肽的相关性质及抗氧化活性验证结果如表6所示,表6中采用字母标注法标注还原力的差异结果,a、b、c、d、e、f、g表示不同小分子肽之间的差异显著性,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(p<0.05)。
表6 还原力排名前8的小分子肽的相关性质及抗氧化活性验证结果
注:(1)还原力以0.1 mg/ml BHA的百分比表示;(2)由于分子对接结果具有随机性,表中显示的Vina得分为9次对接结果最低值的平均值(注:得分越低表示对接结果越好)。
由表6可知,8条肽段中小分子肽WP具有较强的还原能力,选择小分子肽WP进行后续实验。
实施例6 蜂王浆酶解产物及肽段防治阿尔兹海默症功效检测
1.实验动物
野生型AB品系斑马鱼,以自然成对交配繁殖方式进行。年龄为受精后4天(4 dpf)的斑马鱼,用于防治阿尔兹海默症功效最大检测浓度(MTC)测定及乙酰胆碱酯酶抑制、对超氧化物歧化酶的影响和对相关基因影响评价。斑马鱼均饲养于28℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为450~550μS/cm;pH为6.5~8.5;硬度为50~100 mg/L CaCO
2.MTC测定
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼。分别水溶给予样品,样品的浓度详见表7,同时设置正常对照组和模型对照组,每孔容量为3 mL。除正常对照组外,其余实验组均水溶给予六水氯化铝建立斑马鱼痴呆模型。28℃处理48 h后,测定样品对模型斑马鱼的MTC。
结果:详见表7。在本实验条件下,小分子肽WP对防治阿尔茨海默症功效斑马鱼MTC为62.5μg/mL,因此选择浓度为62.5μg/mL进行后续实验。
表7 样品防治阿尔茨海默症功效最大检测浓度摸索实验结果(n=30)
3.乙酰胆碱酯酶抑制功效评价
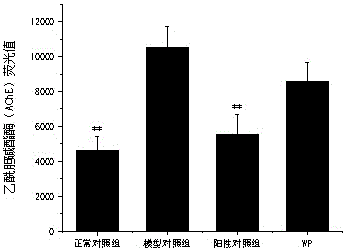
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼。分别水溶给予样品,阳性对照为盐酸多奈哌齐(浓度3.33μg/mL),同时设置正常对照组和模型对照组,每孔容量为3 mL。除正常对照组外,其余实验组均水溶给予六水氯化铝建立斑马鱼痴呆模型。28℃处理48 h后,采用乙酰胆碱酯酶测定试剂盒,利用多功能酶标仪采集数据,分析斑马鱼体内乙酰胆碱酯酶荧光值,以该指标的统计学分析结果评价样品对乙酰胆碱酯酶的抑制功效。统计学处理结果采用mean±SE表示。用SPSS 27.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
结果:在本实验条件下,小分子肽WP对乙酰胆碱酯酶抑制有一定功效。样品处理后斑马鱼乙酰胆碱酯酶荧光值比较示意图如图9所示。
4.对超氧化物歧化酶的影响
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼。分别水溶给予样品,阳性对照为盐酸多奈哌齐(浓度3.33μg/mL),同时设置正常对照组和模型对照组,每孔容量为3 mL,平行设置三个生物学重复实验。除正常对照组外,其余实验组均水溶给予六水氯化铝建立斑马鱼痴呆模型。28℃处理48 h后,采用SOD试剂盒(WST-1法),利用多功能酶标仪采集数据,分析斑马鱼分析斑马鱼体内SOD活性,以该指标的统计学分析结果评价样品对超氧化物歧化酶的影响。统计学处理结果采用mean±SE表示。用SPSS 27.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
结果:在本实验条件下,小分子肽WP对SOD活力增强的有一定功效。样品处理后斑马鱼的超氧化物歧化酶活力比较示意图如图10所示。
5.对相关基因的影响
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼。分别水溶给予样品,阳性对照为盐酸多奈哌齐(浓度3.33μg/mL),同时设置正常对照组和模型对照组,每孔容量为3 mL,平行设置三个生物学重复实验。除正常对照组外,其余实验组均水溶给予六水氯化铝建立斑马鱼痴呆模型。28℃处理24 h后,使用全自动核酸提取仪提取各组斑马鱼总RNA,利用紫外-可见光分光光度计对总RNA浓度进行测定。取2.00μg斑马鱼样品总RNA,按照cDNA第一链合成试剂盒说明操作,合成20.0μL cDNA,通过q-PCR检测β-actin、egr1基因和caspase 3基因的表达。用β-actin作为基因表达的内参,计算egr 1基因和caspase3基因的RNA相对表达量。统计学处理结果采用mean±SE表示。用SPSS 27.0软件进行统计学分析,p<0.05表明差异具有统计学意义。
研究表明,egr 1对学习和长期记忆具有重要作用,在神经退行性疾病中,认知障碍与egr 1的减少有关,AD小鼠中egr 1表达水平显著降低。生物信息学分析表明,egr 1表达水平降低与AD患者的认知障碍显著相关,是AD的生物标志物之一;egr 1通过与bace 1启动子结合并阻断APP信号的激活,最终抑制Aβ沉积并改善AD的认知功能。因此,通过上调egr1基因表达可改善AD认知功能障碍。Caspase 3是细胞凋亡的标志物,与AD密切相关。Caspase 3的激活通常被认为是海马区细胞凋亡的主要标志之一,AlCl
结果:在本实验条件下,小分子肽WP能上调egr 1和下调caspase 3基因表达。egr1基因相对表达量比较示意图如图11所示,caspase 3基因相对表达量比较示意图如图12所示。
实施例7 缓解阿尔茨海默症的功能性食品
一种缓解阿尔茨海默症的功能性食品,由以下组分组成,按重量份计:小分子肽WP0.5%,木糖醇8%,海藻糖2%,无水柠檬酸0.8%,β-环状糊精1%,山梨酸钾0.05%,余量为水;剂型为口服液。
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
- 一种检测阿尔茨海默症标志物的拉曼生物传感器及其制备方法和应用
- 一种检测阿尔茨海默症标志物的电化学免疫传感器的制备方法及应用
- 五羟色胺受体亚型6小分子激活剂及拮抗剂在防治阿尔茨海默症中的应用
- 牛蒡叶提取物在制备改善阿尔茨海默症产品中的应用
