一种c-Myc蛋白降解剂及其制备方法与应用、一种抗肿瘤药物
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于药物应用技术领域,具体涉及一种c-Myc蛋白降解剂及其制备方法与应用、一种抗肿瘤药物。
背景技术
c-Myc是一种转录因子,负责调节基本的细胞过程,包括增殖、新陈代谢、生物合成和细胞凋亡。研究表明,c-Myc的表达异常是肿瘤出现和维持的驱动因素。因此,抑制c-Myc的功能是实现肿瘤治疗的重要手段。
近年来,研究人员尝试从多个层次直接或间接抑制c-Myc的功能,虽然也取得了一些成果,但目前,如何在蛋白质水平上用临床级小分子靶向c-Myc仍然是一个巨大的挑战。c-Myc的重要功能域本质上是无序的并且缺乏酶活性位点,这一事实已经排除了结构指导的药物设计。此外,c-Myc与其专性伴侣MAX之间的高亲和力和相互作用以及不同Myc家族成员的部分功能冗余及其核定位对设计有效的c-Myc抑制剂构成持久的障碍,故而开发可特异性降解c-Myc蛋白的降解剂具有非常广泛的应用价值。
发明内容
本发明的目的在于提供一种c-Myc蛋白降解剂及其制备方法与应用、一种抗肿瘤药物。本发明提供的c-Myc蛋白降解剂性质稳定,可特异性降解c-Myc蛋白,从而实现肿瘤的治疗。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种具有式I所示结构的c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐;
式I中R为-F或-CF
优选地,所述c-Myc蛋白降解剂具有式II或式III所示结构:
本发明提供了所述c-Myc蛋白降解剂的制备方法,包括以下步骤:
将4-羟基苯乙酮、取代苯甲醛、催化剂与有机溶剂混合,进行缩合反应,得到c-Myc蛋白降解剂;所述取代苯甲醛具有式IV所示结构:
式IV中R为-F或-CF
优选地,所述4-羟基苯乙酮与取代苯甲醛的用量比为0.1~10g:0.1~10mL。
本发明提供了所述c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐在制备抗肿瘤药物中的应用。
优选地,所述肿瘤包括肝癌、肺癌、肾癌、食管癌或白血病。
优选地,所述抗肿瘤药物的给药方式包括口服、静脉注射或皮下注射。
本发明提供了一种抗肿瘤药物,包括第一药物活性组分和药学上可接受的辅料;所述第一药物活性组分为上述技术方案所述的c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐。
优选地,所述抗肿瘤药物还包括第二药物活性组分;所述第二药物活性组分包括阿糖胞苷、柔红霉素、去甲氧柔红霉素、阿霉素、5-氟尿嘧啶、多西紫杉醇、紫杉醇、顺铂、卡铂、吉西他滨、卡培他滨和索拉菲尼中的至少一种。
本发明提供了所述c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐在治疗c-Myc上调诱发类疾病中的应用;所述c-Myc上调诱发类疾病包括心脑血管疾病或病毒感染相关疾病。
本发明提供的c-Myc蛋白降解剂为4-羟基查尔酮的衍生物,性质稳定,可特异性降解c-Myc蛋白;在此基础上制备得到的抗肿瘤药物能够治疗多种肿瘤,具有良好的实用性和应用前景。实施例显示,本发明提供的c-Myc蛋白降解剂可以有效抑制多种肿瘤增殖,且对肝肾无显著损伤。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为实施例2所得c-Myc蛋白降解剂的核磁共振氢谱图;
图2为实施例2所得c-Myc蛋白降解剂的核磁共振碳谱图;
图3为实施例1和实施例2中不同浓度的c-Myc蛋白降解剂对786-O细胞(人肾透明细胞腺癌细胞)增殖影响结果图;
图4为实施例1和实施例2中不同浓度的c-Myc蛋白降解剂对786-O细胞(人肾透明细胞腺癌细胞)c-Myc蛋白表达影响结果图;
图5为不同浓度的c-Myc蛋白降解剂对不同肿瘤细胞增殖影响结果图;
图6为不同浓度的c-Myc蛋白降解剂抑制IC
图7为不同浓度的c-Myc蛋白降解剂抑制IC
图8为不同浓度的c-Myc蛋白降解剂处理后的裸鼠皮下瘤生长曲线;
图9为不同浓度的c-Myc蛋白降解剂处理后的裸鼠皮下瘤形态图;
图10为不同浓度的c-Myc蛋白降解剂处理后的裸鼠皮下瘤重量对比图;
图11为不同浓度的c-Myc蛋白降解剂对肝肾细胞的HE染色结果对比图。
具体实施方式
本发明提供了一种具有式I所示结构的c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐;
式I中R为-F或-CF
本发明所述c-Myc蛋白降解剂优选具有式II或式III所示结构:
本发明还提供了所述c-Myc蛋白降解剂的制备方法,包括以下步骤:
将4-羟基苯乙酮、取代苯甲醛、催化剂与有机溶剂混合,进行缩合反应,得到c-Myc蛋白降解剂;所述取代苯甲醛具有式IV所示结构:
式IV中R为-F或-CF
在本发明中,若无特殊说明,所需制备原料均为本领域技术人员熟知的市售商品。
在本发明中,所述4-羟基苯乙酮与取代苯甲醛的用量比优选为0.5~2g:0.5~1mL,更优选为1g:1mL。
在本发明中,所述催化剂优选为氢氧化钾水溶液和/或氢氧化钠水溶液,更优选为氢氧化钠水溶液。本发明所述催化剂的质量浓度优选为5~20%,更优选为10%。本发明所述催化剂和4-羟基苯乙酮的用量比优选为2~10:0.5~2,更优选为5mL:1.36g。
在本发明中,所述有机溶剂优选为乙醇,更优选为无水乙醇。
本发明优选在冰浴的条件下将4-羟基苯乙酮、取代苯甲醛、催化剂与有机溶剂混合;所述冰浴的温度优选为-10~8℃,更优选为0℃。在本发明中,所述缩合反应的温度优选为20~30℃,更优选为22~25℃;时间优选为1~4h,更优选为2~3h。本发明所述缩合反应优选在搅拌的条件下进行。本发明对搅拌的方式没有特殊限定,采用本领域技术人员熟知的搅拌方式即可。本发明在催化剂和有机溶剂的作用下,将4-羟基苯乙酮和取代苯甲醛为原料进行缩合反应。
本发明优选将缩合反应后所得混合物料的pH值调至5~6,进行固液分离,收集固体物料;将所述固体物料纯化,得到c-Myc蛋白降解剂。本发明对调节pH值的方式没有特殊限定,采用本领域技术人员熟知的调节pH值的方式即可。在本发明的实施例中,具体是采用质量分数为10%的稀盐酸将缩合反应所得混合物料的pH值调至5~6。在本发明中,所述固液分离的方式优选为过滤。本发明所述纯化的方式优选为重结晶;所述重结晶所用试剂优选为有机溶剂,所述有机溶剂优选为乙醇,具体可以为无水乙醇;所述重结晶优选在搅拌条件下进行。
本发明还提供了所述c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐在制备抗肿瘤药物中的应用。在本发明中,所述肿瘤优选包括肝癌、肺癌、肾癌、食管癌或白血病;更优选为肝癌、肾癌或食管癌。本发明所述抗肿瘤药物的临床使用范围优选为5~100mg/kg,更优选为20~50mg/kg。本发明所述抗肿瘤药物的给药方式优选包括口服、静脉注射或皮下注射,更优选为静脉注射或皮下注射。本发明所述抗肿瘤药物的剂型优选为颗粒剂、丸剂、片剂、胶囊剂、注射剂,更优选为颗粒剂。
本发明还提供了一种抗肿瘤药物,包括第一药物活性组分和药学上可接受的辅料;所述第一药物活性组分为上述技术方案所述的c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐。在本发明中,所述抗肿瘤药物还优选包括第二药物活性组分;所述第二药物活性组分优选包括阿糖胞苷、柔红霉素、去甲氧柔红霉素、阿霉素、5-氟尿嘧啶、多西紫杉醇、紫杉醇、顺铂、卡铂、吉西他滨、卡培他滨和索拉菲尼中的至少一种。在本发明中,所述第一药物活性组分和第二药物活性组分的质量比优选为0.5~2:1,更优选为1:1。
本发明还提供了所述c-Myc蛋白降解剂或其光学异构体、水合物、有机溶剂合物或药学上可接受的盐在治疗c-Myc上调诱发类疾病中的应用。在本发明中,所述c-Myc上调诱发类疾病优选包括心脑血管疾病或病毒感染相关疾病。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
在0℃的冰浴条件下,将氢氧化钠水溶液(5mL,质量浓度为10%)、4-羟基苯乙酮(1.36g,10mmol)、4-氟苯甲醛(1.36mL,10mmol)和无水乙醇混合,开启搅拌,在22℃的条件下反应2h;反应结束后,在所得混合物料中加入稀盐酸(质量浓度为10%)调节pH值至5~6,过滤得到固体物料;在搅拌的条件下将所得固体物料溶解到无水乙醇中,重结晶,收集析出的物料,即为c-Myc蛋白降解剂。
实施例2
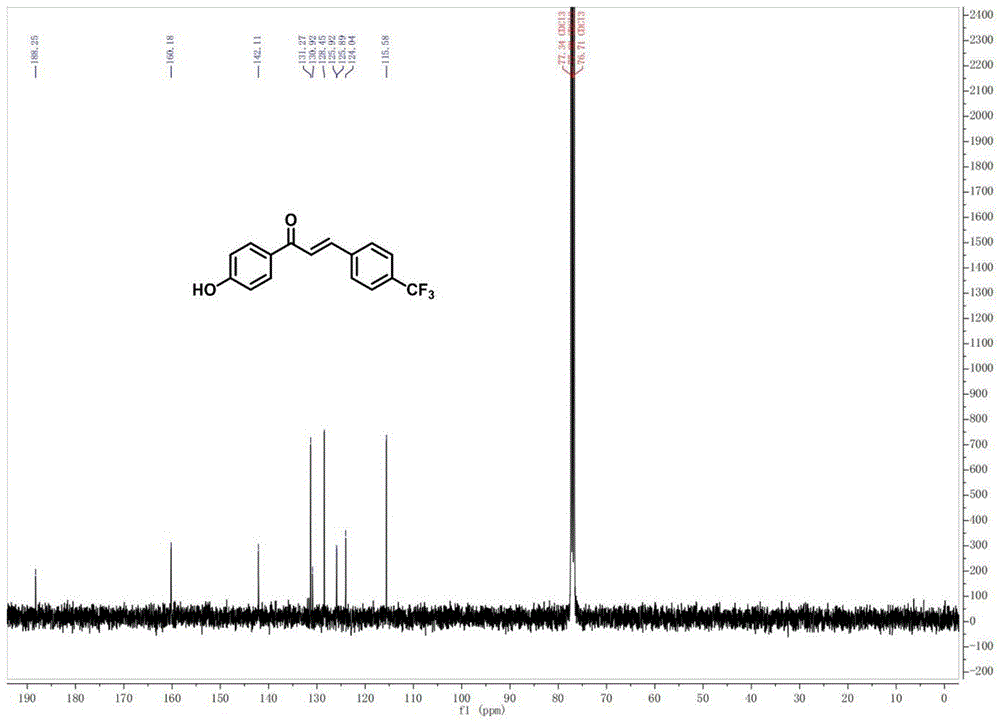
在0℃的冰浴条件下,将氢氧化钠水溶液(5mL,质量浓度为10%)、4-羟基苯乙酮(1.36g,10mmol)4-(三氟甲基)苯甲醛(1.36mL,10mmol)和无水乙醇混合,开启搅拌,在22℃的条件下反应2h;反应结束后,在所得混合物料中加入稀盐酸(质量浓度为10%)调节pH值至5~6,过滤得到固体物料;在搅拌的条件下将所得固体物料溶解到无水乙醇中,重结晶,收集析出的物料,即为c-Myc蛋白降解剂。
图1和图2为本发明实施例2所得c-Myc蛋白降解剂的核磁共振氢谱图和碳谱图。
核磁共振氢谱图显示:
核磁共振碳谱图显示:
由图1和图2可知,所合成的化合物具有式III所示结构:
应用例1
将实施例1和实施例2所得c-Myc蛋白降解剂分别溶解于二甲基亚砜,制成10mmol/L的溶液,记为c-Myc蛋白降解剂储备液,置于-80℃保存,使用时根据需要稀释。
按照1000个/孔的密度将786-O细胞(人肾透明细胞腺癌细胞)接种于含无血清培养基的96孔细胞培养板上;当786-O细胞贴壁后,加入浓度为0~100μmol/L的c-Myc蛋白降解剂溶液,在37℃的培养箱中培养72h。然后丢弃培养基,加入100μL的CCK-8反应液,再在37℃培养箱中培养0.5~4h,随后转移到酶标仪下检测450nm处吸光值,测试c-Myc蛋白降解剂对786-O细胞增殖。
图3为实施例1和实施例2中不同浓度的c-Myc蛋白降解剂对786-O细胞增殖影响结果图(左侧为实施例1,右侧为实施例2)。
应用例2
将实施例1和实施例2所得c-Myc蛋白降解剂分别溶解于二甲基亚砜,制成10mmol/L的溶液,记为c-Myc蛋白降解剂储备液,置于-80℃保存,使用时根据需要稀释。
按照20000个/孔的密度将786-O细胞(人肾透明细胞腺癌细胞)接种于含无血清培养基的6孔细胞培养板上;当786-O细胞贴壁后,加入浓度为0~20μmol/L的c-Myc蛋白降解剂溶液,在37℃的培养箱中培养72h。收集细胞,破碎裂解细胞,提取蛋白,应用WB检测c-Myc蛋白的表达,测定测试c-Myc蛋白降解剂对786-O细胞c-Myc蛋白表达的影响。
图4为实施例1和实施例2中不同浓度的c-Myc蛋白降解剂对c-Myc蛋白表达影响结果图(左侧为实施例1,右侧为实施例2)。由图4可知,实施例1~2中不同浓度的c-Myc蛋白降解剂对786-O细胞c-Myc蛋白表达均具有不同程度的抑制作用。
应用例3
将实施例2所得c-Myc蛋白降解剂溶解于二甲基亚砜,制成10mmol/L的溶液,记为c-Myc蛋白降解剂储备液,置于-80℃保存,使用时根据需要稀释。
按照1000个/孔的密度分别将不同肿瘤细胞(786-O细胞(人肾透明细胞腺癌细胞)、KYSE-150细胞(人食管鳞癌细胞)、U937细胞(人组织细胞淋巴瘤细胞)、HUH-7细胞(人肝癌细胞)和A549细胞(人非小细胞肺癌细胞))接种于含无血清培养基的96孔细胞培养板上;当肿瘤细胞贴壁后,加入浓度为0.5~20μmol/L的c-Myc蛋白降解剂溶液,再在37℃的培养箱中培养72h。然后丢弃培养基,加入100μL的CCK-8(Cell Counting Kit-8细胞计数试剂)反应液,再在37℃培养箱中培养0.5~4h,随后转移到酶标仪下检测450nm处吸光值,测试c-Myc蛋白降解剂对不同肿瘤细胞细胞增殖的影响。
图5为不同浓度的c-Myc蛋白降解剂对不同肿瘤细胞增殖影响结果图。由图5可知,随着c-Myc蛋白降解剂浓度的升高,不同肿瘤细胞(786-O细胞(人肾透明细胞腺癌细胞)、KYSE-150细胞(人食管鳞癌细胞)、U937细胞(人组织细胞淋巴瘤细胞)、HUH-7细胞(人肝癌细胞)和A549细胞(人非小细胞肺癌细胞))的增殖受到明显的抑制。
应用例4
将实施例2所得c-Myc蛋白降解剂溶解于二甲基亚砜,制成10mmol/L的溶液,记为c-Myc蛋白降解剂储备液,置于-80℃保存,使用时根据需要稀释。
按照1000个/孔的密度分别将不同肿瘤细胞(769-P细胞(人肾细胞腺癌细胞)、786-O细胞(人肾透明细胞腺癌细胞)、ACHN细胞(人肾细胞腺癌细胞)、Caki-1细胞(人肾透明细胞癌皮肤转移细胞)和RPTEC/TERT1细胞(肾-近端小管上皮细胞)接种于含无血清培养基的96孔细胞培养板上;当肿瘤细胞贴壁后,加入浓度为0~15μmol/L的c-Myc蛋白降解剂溶液,再在37℃的培养箱中培养72h。然后丢弃培养基,加入100μL的CCK-8(Cell CountingKit-8细胞计数试剂)反应液,再在37℃培养箱中培养0.5~4h,随后转移到酶标仪下检测450nm处吸光值,测试c-Myc蛋白降解剂对786-O细胞增殖。
将肾癌细胞系(769-P,786-O,ACHN,Caki-1)和肾上皮细胞RPTEC按照20000个/孔的密度接种与6孔板中,在37℃的培养箱中培养72h。收集细胞,破碎裂解细胞,提取蛋白,应用WB检测c-Myc蛋白的表达,测试不同肾细胞c-Myc蛋白的表达水平。
图6为不同浓度的c-Myc蛋白降解剂抑制IC
图7为c-Myc蛋白降解剂抑制IC
应用例5
c-Myc蛋白降解剂对皮下瘤生长的抑制作用
准备药物:将实施例2所得c-Myc蛋白降解剂溶解于聚乙二醇8000(PEG8000-NaCl溶液(30%))中,制得浓度为10mg/mL的溶液,记为c-Myc蛋白降解剂储备液,置于-80℃保存。
准备裸鼠:将4~6周的裸鼠置于SPF级动物实验室进行养殖。
分别准备ACHN肿瘤细胞悬浮液:取对数生长的ACHN肿瘤细胞,经消化、离心后计数。
接种皮下移植瘤:选择4~6周的裸鼠,并在裸鼠腹部后腿侧接种ACHN肿瘤细胞,每只裸鼠接种100μL(1~10×10
给药:接种ACHN肿瘤细胞后7天后开始给裸鼠注射药物,选择腹腔给药,并持续间隔2天注射;具体地,将裸鼠分为3组,其中,实验1组裸鼠按照20mg/kg的标准注射c-Myc蛋白降解剂溶液,实验2组裸鼠按照50mg/kg的标准注射c-Myc蛋白降解剂溶液;对照组注射同体积的聚乙二醇8000(PEG8000-NaCl溶液(30%));持续到实验1~2组和对照组的裸鼠皮下瘤大小出现3个时间点的差异。
收集皮下瘤:处死裸鼠,剥离皮下瘤,并拍照称重。
图8为本发明不同浓度的c-Myc蛋白降解剂溶液处理后的裸鼠皮下瘤生长曲线;图9为本发明不同浓度的c-Myc蛋白降解剂溶液处理后的裸鼠皮下瘤形态;图10为本发明不同浓度的c-Myc蛋白降解剂溶液处理后的裸鼠皮下瘤重量。
由图8可知,随着时间的增长,注射聚乙二醇8000的对照组裸鼠皮下瘤生长速度逐渐加快,而按照20mg/kg的标准注射c-Myc蛋白降解剂溶液的实验1组裸鼠皮下瘤生长曲线呈现缓慢上升的趋势,按照50mg/kg的标准注射c-Myc蛋白降解剂溶液的实验2组裸鼠皮下瘤生长曲线呈现先下降再缓慢上升后至逐渐稳定的趋势,实验1~2组的裸鼠皮下瘤生长曲线上升速率远远小于对照组。由图9~10可知,注射聚乙二醇8000的对照组裸鼠皮下瘤体积较大,而按照20mg/kg和50mg/kg的标准注射c-Myc蛋白降解剂溶液的实验1组裸鼠皮下瘤体积明显小于对照组。由此可证明本发明提供的c-Myc蛋白降解剂可以有效抑制肿瘤增殖。
从死亡裸鼠尸体上取下肝脏组织和肾脏组织,切片后进行HE染色,HE染色结果如图11所示。由图11可知,肝细胞和肾细胞的形态完整、细胞核没有明显增大。由此可见本发明提供的c-Myc蛋白降解剂对肝肾无显著损伤。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 一种基于VEGFR-2抑制剂S7的蛋白降解靶向嵌合体及制备方法和应用
- 一种光热增强降解化学战剂模拟物的纳米核壳复合物及其复合纤维膜的制备方法与应用
- 一种火驱井自降解暂堵剂及其制备方法与应用
- 一种可降解混凝土养护剂及其制备和应用方法
- 一种复合功能石油烃降解微生物菌剂及其制备方法与应用
- 一种靶向降解Gli1蛋白的降解剂及其制备方法和应用
- 一种GPX4蛋白降解剂及其制备方法和应用、一种抗肿瘤细胞药物
