一种基于DC Line诱导的CTL细胞及其制备方法
文献发布时间:2024-04-18 19:58:53
本申请要求于2023年01月18日提交中国专利局、申请号为2023100791810、发明名称为“CTL细胞的制备方法和应用”的中国专利申请的优先权,其全部内容通过引用结合在本申请中。
技术领域
本发明涉及生物技术领域,特别涉及一种基于DC Line诱导的CTL细胞及其制备方法。
背景技术
黑色素瘤是由位于表皮基底层的黑色素细胞恶性转化而引起的最具侵略性的癌症之一。黑色素瘤仅占所有皮肤癌的5%,但由于其高度转移潜力,导致约80%的皮肤癌引起的死亡。由于缺乏有效的治疗手段,转移性黑色素瘤患者的10年总生存率为10%至15%。近些年,免疫治疗异军突起,有望给黑色素瘤患者带来新的、有效的治疗手段。
美国食品药品监督管理局批准的用于治疗黑素瘤的免疫相关方法包括:(1)T细胞刺激细胞因子,如白介素2(IL-2);(2)检查点分子,如细胞毒性T细胞淋巴细胞相关蛋白4(CTLA-4)和程序性细胞死亡蛋白1(PD-1)阻断抗体,它们中和T细胞的抑制信号;(3)溶瘤病毒,引起粒细胞-巨噬细胞集落刺激因子分泌和树突状细胞激活,从而增加肿瘤抗原的加工和向T细胞的呈递。这些免疫疗法的共同特征是激活T细胞或者促进T细胞的激活。因此,近年来开发出另一种方法,即活化T细胞的过继细胞疗法(Adoptive Cell TransferTherapy,ACT)。
ACT需要在体外分离、鉴定(或产生)抗肿瘤淋巴细胞,然后体外扩增到一定数量后重新注入(“转移”)到患者体内。与主动免疫和非特异性免疫刺激相比,ACT具有理论和实践优势,包括能够识别能够体外杀伤的确切T细胞群,并选择它们进行扩增。这些细胞可以在体外被激活,脱离可能阻止它们完全发挥其抗肿瘤潜力的潜在抑制性肿瘤微环境。在抗肿瘤细胞转移之前立即对淋巴衰竭的宿主患者进行一定处理,可以消除潜在的抑制影响(如调节性T细胞),为细胞在体内增殖和被激活提供最佳环境。
ACT开发的一个热点方向,是DC-CTL技术。目前,利用DC、T细胞技术治疗肿瘤已成为一种疗效最佳的肿瘤生物疗法之一,但是仍存在一定的局限性。采用常规方法培育DC细胞,一方面需要使用的初始细胞量大、培育过程复杂,导致DC细胞获取困难、成本高;另一方面获得的DC细胞不均一,其成熟度差异较大且整体不高,导致抗原递呈能力较弱,致敏性差,并且没有合适的佐剂来提高DC对抗原的呈递作用,从而出现免疫作用低、免疫耐受等而导致肿瘤患者治疗效果不佳、术后存在复发及转移等问题。这些问题限制着DC-CTL技术的临床应用。
病毒感染(viral infection)是指病毒通过多种途径侵入机体,并在易感的宿主细胞中增殖的过程。人类病毒是指能感染人体或对人有致病作用的病毒。机体感染病毒后,可表现出不同的临床类型。依据有无症状,可分为显性感染和隐性感染;依据病毒滞留时间及症状持续时间长短,又可分为急性感染和持续性感染。
流行性感冒,简称流感,是由甲、乙、丙三型流感病毒分别引起的一种急性呼吸道疾病,属于丙类传染病。流感在中国以冬春季多见,临床表现以高热、乏力、头痛、咳嗽、全身肌肉酸痛等全身中毒症状为主,而呼吸道症状较轻。流感病毒容易发生变异,传染性强,人群普遍易感,发病率高,历史上在全世界引起多次暴发性流行,是全球关注的重要公共卫生问题。
虽然针对流感病毒感染引起的大流行病,我们已经开发出了疫苗进行保护,且取得了很好的效果,通过疫苗得到了有效控制。但是疫苗防护也有其局限性,对于健康人,疫苗效果好,但是对于已经被病毒感染的人群,疫苗并没有好的效果;尤其是病毒一旦潜伏下来,将基因整合进宿主基因组内部,此时基本没有有效的治疗手段。再有,流感病毒变异速度快,往往旧毒株的疫苗对新毒株并没有防护能力。
针对被病毒感染的细胞以及肿瘤细胞,我们人体内的免疫细胞是能够识别并清除这些细胞的。而且对于表面抗原变异的毒株侵染,免疫细胞能够在清除被感染细胞的同时,暴露这些变异抗原,从而一并将病毒清除。但是体内这种能清除特异性细胞的比例极低,导致病症反反复复发作。
近些年新兴起来的细胞治疗手段,就是利用我们自身的免疫细胞,在体外进行教化或者改造扩增,使其具有杀伤特定病毒感染细胞、肿瘤细胞的能力后,回输到体内后,杀伤病变细胞。细胞疗法用于抗病毒治疗有以下优点:1)可清除潜伏期感染-尤其像艾滋、乙肝等潜伏期长的病毒感染;2)对表面抗原变异快速的病毒同样有效-如流感、新冠等。
细胞治疗,属于免疫治疗的一种,使用患者自体的细胞(特殊情况下可以使用异体细胞),在体外定向培养、改造后回输,用于治疗、预防疾病的手段。目前热门的病毒、肿瘤预防和治疗的细胞类赛道主要基于巨噬细胞,DC(Dendritic cells,DC),NK(NaturalKillerCells,NK),T细胞开发的药物。
树突状细胞是人体内功能最强的专职抗原递呈细胞,DC相当于信使,将抗原信息传递给T细胞,并具有活化T细胞的功能,很少量就可以激发强大的T细胞反应。DC是人体最强大的抗原递呈细胞,可致敏辅助T细胞的多种细胞因子,显著刺激初始型T细胞增殖,以激活体内静止状态的初始型T细胞(而巨噬细胞、B细胞仅能刺激已活化的或记忆性T细胞)。
自DC细胞功能被验证后,应用DC细胞进行临床技术开发用于预防、治疗病毒感染及肿瘤进行的如火如荼,但是收效甚微,截止目前为止,全球仅有4个基于DC细胞获批的上市药物。究其原因,主要是DC细胞获取困难:1)DC细胞在PBMC中的含量极少,低于1%,且分离成本很高;2)DC细胞体外不具备增殖能力;3)现有基于诱导单核细胞获取MoDC(monocyte-derived DCs,MODC)的数量少、成本高。
发明内容
有鉴于此,本发明提供了一种基于DC Line诱导的CTL细胞及其制备方法。本发明提供了一个新的技术方向,采用DC细胞株诱导肿瘤抗原特异性杀伤细胞CTL。本方法对传统的DC-CTL技术进行改良,采用DC细胞株而不是单核细胞来源的树突状细胞(monocyte-derived DC,Mo-DC);使用的DC细胞数量少、获取简便、成本低,同时DC细胞株细胞均一,功能强,刺激CTL细胞扩增的倍数高,且其中的肿瘤抗原特异性T细胞比例高。该技术获得的黑色素瘤抗原特异性的CTL细胞可应用于黑色素瘤或流感病毒的预防和/或临床治疗。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了采用DC细胞株诱导抗原特异性杀伤细胞CTL的制备方法,包括如下步骤:
(1)抽取患者外周血,采用淋巴细胞分离液分离获得外周血单个核细胞(PBMC);
(2)复苏DC细胞株,培养至对数生长期,调整细胞密度为1~2×10
(3)将负载抗原肽的DC细胞与患者PBMC混合培养,DC细胞与PBMC的数量比为1:10~1:100,并向培养体系中加入IL-2,终浓度为200~1000IU/mL;
(4)培养过程中,每隔2~3天取样计数,用完全培养基补液或传代,维持细胞浓度为0.5~2×10
(5)在第7天和第14天,重复步骤(2)、(3)取DC细胞负载抗原多肽,向培养体系中补加负载抗原肽的DC细胞,负载抗原肽的DC细胞与培养体系中细胞的数量比为1:10~1:100,于第20~21天收集细胞,获得特异性杀伤细胞CTL;
所述步骤(1)和步骤(2)不区分先后顺序。
在本发明的一些具体实施方案中,所述完全培养基包括1640完全培养基。
本发明还提供了所述抗原限制性表位多肽包括黑色素瘤分化抗原MART-1限制性表位多肽或甲型流感病毒M1蛋白的限制性表位肽,由体外合成获得,其HLA分型包括:HLA-A*02:01;
所述黑色素瘤分化抗原MART-1限制性表位多肽具有:
(I)、如SEQ ID NO.1所示的氨基酸序列;或
(II)、在如(I)所示的氨基酸序列的基础上经取代、缺失、添加和/或替换1个或多个氨基酸的序列;或
(III)、与如(I)或(II)所示的氨基酸序列同源性90%以上的序列;
所述甲型流感病毒M1蛋白的限制性表位肽具有:
(I)、如SEQ ID NO.2所示的氨基酸序列;或
(II)、在如(I)所示的氨基酸序列的基础上经取代、缺失、添加和/或替换1个或多个氨基酸的序列;或
(III)、与如(I)或(II)所示的氨基酸序列同源性90%以上的序列。
在本发明的一些实施方案中,SEQ ID NO.1的序列为:EAAGIGILTV。
在本发明的一些实施方案中,SEQ ID NO.2的序列为:GILGFVFTL。
在本发明的一些实施方案中,上述制备方法中,所述限制性表位肽的浓度为10μg/mL;所述负载的时间为4h。
在本发明的一些实施方案中,上述制备方法中,所述混合培养的温度为37℃,时间为24h;所述DC细胞与所述PBMC细胞的数量比为1:100。
在本发明的一些实施方案中,上述制备方法中,所述DC细胞的制备方法包括以下步骤:
S1:取所述PBMC细胞接种培养后,保留贴壁细胞,刺激培养后,获得MODC细胞;
S2:取慢病毒载体转化或转染所述MODC细胞,培养,获得所述DC细胞。
在本发明的一些实施方案中,上述制备方法S1中所述接种时的细胞数为4×10
在本发明的一些实施方案中,上述制备方法S1中所述刺激培养包括第一刺激培养和第二刺激培养;所述第一刺激培养采用1000IU/mL的GM-CSF和500IU/mL的IL-4,时间为6d;所述第二刺激培养采用50μg/mL的TNF-a,时间为24h。
在本发明的一些实施方案中,上述制备方法S2中所述慢病毒载体包括:SV40大T抗原和Myc-ER融合蛋白。
本发明还提供了所述制备方法制得的特异性杀伤细胞CTL,
优选的,采用DC细胞株负载肿瘤抗原与受试者PBMC细胞共同孵育而获得。
本发明还提供了所述制备方法,或所述特异性杀伤细胞CTL在以下任意项中的应用:
(I)、制备预防和/或治疗黑色素瘤的药物;和/或
(II)、制备预防和/或治疗甲型流感的药物。
本发明包括但不限于取得了如下有益效果:
(1)本方法对传统的DC-CTL技术进行改良,采用DC细胞株而不是Mo-DC;使用的DC细胞数量少、获取简便、成本低,且细胞扩增倍数高、其中的肿瘤特异性杀伤细胞CTL比例高。
(2)、本发明立足于可体外增殖的DC细胞株技术,开发DC诱导的细胞毒性T细胞(Cytotoxic T Lymphocytes,CTL)的方法。以人甲型流感H1N1的M1蛋白的HLA-A*02:01限制性表位为靶点,培养CTL并验证其因子分泌和特异性杀伤能力,为预防、治疗流感病毒感染,尤其是潜伏感染、变异快速的毒株提供细胞治疗的新方法。
(3)、本发明结果证明,与现有MODC技术相比,本发明的DC细胞株可以诱导出更高高比例的抗病毒CD8T细胞,这些细胞扩增能力更强,且特异性T细胞的比例更高;采用多个供体进行验证,DC细胞株可以诱导多个功能供体产生具有抗病毒的CTL,CTL细胞能够分泌特异的细胞因子,并且可以特异性杀伤递呈病毒抗原肽的靶细胞。
(4)、本发明的DC细胞株可以通过HLA配型的形式使用,不局限于自体DC使用。
(5)、本发明提供的制备方法获得的CTL细胞未来可应用于乙肝、艾滋、梅毒、新冠、爱博斯坦病毒、人乳头病毒等严重威胁人类健康的病毒感染性疾病的预防、治疗中。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示Day21天的流式分型检测结果;
图2示Day21的Tetramer阳性率检测结果;
图3示Mo-DC诱导的CTL和DC细胞株诱导的CTL杀伤效果比较;
图4示MODC和DC细胞株流式检测;
图5示Day14的DC-CTL流式检测结果;其中:A示Day14细胞分型流式分型;B示Day14Tetramer染色结果;
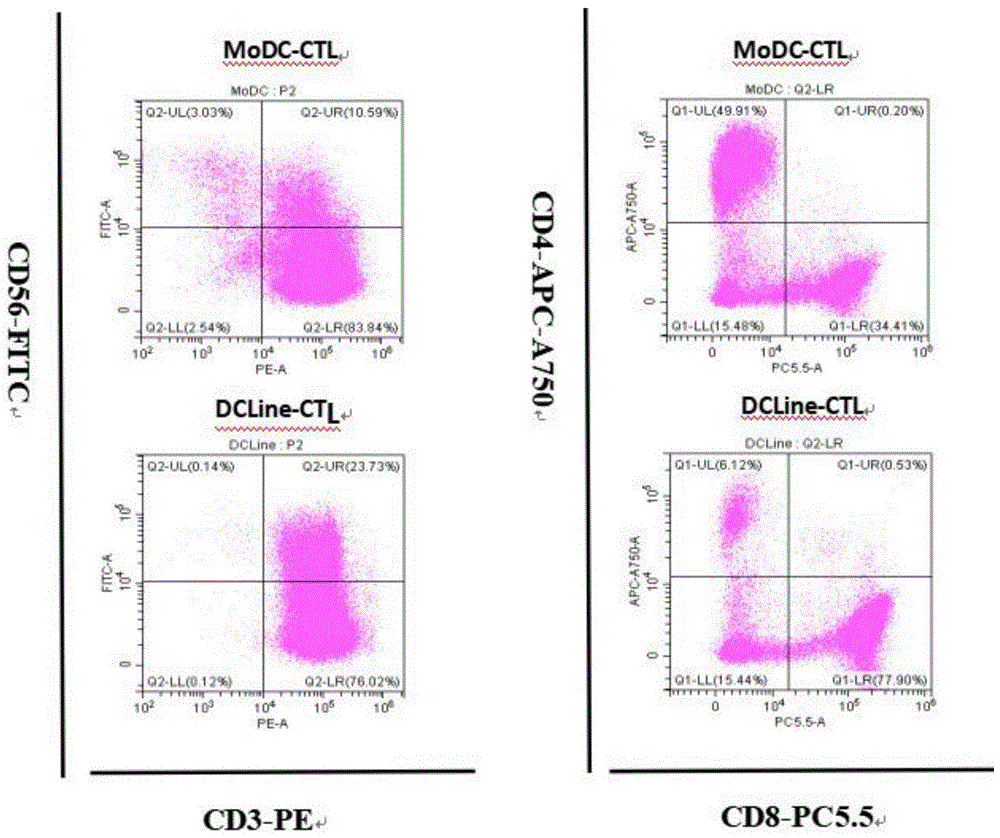
图6示Day14的流式检测;其中:横轴为CD3-PE,纵轴为CD8-PC5.5;
图7示Day14的流式检测结果;
图8示Day14 IFN-γ检测结果;其中:横坐标IFN-γ,纵坐标Tetramer;
图9示E:T=1:1下的杀伤效果。
具体实施方式
本发明公开了一种基于DC Line诱导的CTL细胞及其制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
如无特殊说明,本发明提供的一种基于DC Line诱导的CTL细胞及其制备方法中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1Mo-DC和DC细胞株细胞获取
Mo-DC的获取:将分离的PBMC(受试者签署知情同意书后,采集20ml外周血,用于分离PBMC),用无血清1640培养基重悬至4×10
DC细胞株获取:获取到Mo-DC后,通过慢病毒载体将SV40大T抗原和Myc-ER融合蛋白转入DC细胞内,即可获得能够增殖的DC细胞株。使用RPMI 1640培养基+10%FBS+200IU/mL的IL-2,培养。
其高表达CD80,83,86,CD40等共刺激分子(如图4所示)。
如图4所示,培养的MODC和DC细胞株,都高表达共刺激分子CD80、86,以及CD83。相较于MODC的获取,DC细胞株获取更为便捷,没有繁杂的分离,培养和刺激成熟步骤;DC细胞株可体外增殖,可获取到不限量的DC细胞;并且获取的DC细胞株,共刺激分子同样表达。
实施例2与Mo-DC相比,DC细胞株可诱导更高比例的CD8+T细胞
DC Line细胞使用前,用MART-1蛋白的HLA-A*02:01限制性表位多肽(EAAGIGILTV)(如SEQ ID NO.1所示),10μg/mL负载4h。
用1640完全培养基(含10%FBS)调整PBMC的密度至1×10
流式检测,取细胞样品至1.5mL Ep管中,约0.5~1×10
由Day21细胞分型流式分型结果看(如图1、表1所示),Mo-DC诱导的CTL,其CD3+CD8+T比例为34.41%;而DC细胞株诱导的CTL,其CD+CD8+T比例为77.90%。
流式结果比较,DC细胞株诱导的CTL,CD8+T细胞的比例,比Mo-DC诱导的CTL的CD8+T细胞比例要高。
表1Day21,CTL中的CD8+T比例统计
实施例3与Mo-DC相比,DC细胞株可诱导更高倍的CTL细胞扩增
为了比较Mo-DC诱导的CTL和DC细胞株诱导的CTL,其在细胞扩增倍数的差别,在Day21进行计数统计。如表2中所示,Mo-DC诱导的CTL,Day21的扩增倍数只有3.79;而DC细胞株诱导的CTL,Day21的扩增倍数可以达到165.9倍,远远超过前者。
表2Day21,CTL中的扩增倍数统计
实施例4同Mo-DC一样,DC细胞株同样可以诱导出MART-1特异性T细胞群体
取细胞样品至1.5mL Ep管中,约0.5~1×10
采用特异性T细胞检测的金标准,Tetramer检测法,Day21培养的DC-CTL,都可以检测到Tetramer阳性群体。且DC株诱导的特异性T细胞比例,高于Mo-DC诱导的特异性T的比例。
由图2、表3的结果看,Mo-DC诱导的CTL,Day21的总CTL中Tetramer阳性率有4.53%,而CD8+T细胞中Tetramer阳性率为13.10%;而DC细胞株诱导的CTL,Day21的总CTL中Tetramer阳性率有12.23%,而CD8+T细胞中Tetramer阳性率为15.10%,都超过前者。
表3Day21,CTL中的Tetramer阳性率统计
实施例5同Mo-DC一样,DC细胞株诱导的CTL具有特异性杀伤靶细胞的能力
我们DC细胞株诱导的CTL,是否同样可以杀伤靶细胞呢?使用A549(人非小细胞肺癌细胞系)(转有HLA-A*02:01分子),负载10μg/mL抗原2h后(阴性对照采用DMSO或EBV表位肽负载A549),和CTL共孵育4h后,检测杀伤效果。
取培养中的CTL细胞,300g 5min离心,收集细胞沉淀后,用无酚红的1640完全培养基调整细胞密度至4×10
表4Day21,CTL的靶细胞杀伤效率(%)
由表4和图3明显看到,DC细胞株诱导的CTL,同样具有杀伤靶细胞的能力,且杀伤能力比MoDC诱导的CTL更高。
实施例6与MODC相比,DC细胞株可诱导更高比例的CD8T细胞,更高倍的CD8T细胞扩增,更高的Tetramer阳性率
为了比较MODC和DC细胞株在诱导CTL能力之间的差异,分别用二者进行DC-CTL的诱导。
DC细胞使用前,用H1N1的M1蛋白的HLA-A*02:01限制性表位多肽(GILGFVFTL)(如SEQ ID NO:2所示),10μg/mL负载4h。
用1640完全培养基(含10%FBS)调整PBMC的密度至1×10
由Day14细胞分型流式分型结果看(如图5中A所示),MODC诱导的CTL,其CD8+T比例为32.91%;而DC细胞株诱导的CTL,其CD8+T比例为77.94%。由Day14 Tetramer染色结果看(如图5中B所示),MODC诱导的CTL,其CD8+T中Tetramer阳性率为0.62%;而DC细胞株诱导的CTL,其CD8+T中Tetramer阳性率为13.75%。
表5MODC诱导的CTL和DC细胞株诱导的CTL比较
由表5的结果看,经DC细胞株诱导的CTL,从Day14/21,其CD8+T占比、CD8+T扩增倍数、Tetramer阳性率都高于MODC诱导的CTL。
实施例7DC细胞株在多个供体都可以诱导CD8+T细胞扩增
为了评价DC细胞株在HLA-A抗原匹配情况下,异体诱导PBMC的特异性T细胞的诱导能力,以及用于抗流感药物开发的潜力,因此选择10个不同HLA型的供体(都含有HLA-A*02:01)的PBMC,通过HLA-A*02:01匹配的方式,诱导CTL。将DC细胞株细胞负载甲型流感病毒M1蛋白A02限制性表位(氨基酸序列GILGFVFTL)(如SEQ ID NO:2所示)以后,诱导CTL扩增。
采用10个HLA-A抗原匹配供体(HLA分型结果如表6),按照前述实验方法培养后,Day14/21流式检测,采用CD3、CD8抗体染色,发现都可以诱导出高比例的CD8T细胞(如图6、表6所示)。
由图6可以看到,经过14天培养以后,10个CTL,CD8T细胞群体占比很高,大部分都在70%以上。
表610个供体的HLA分型结果
10个供体都表达HLA-A*A 02:01分子。
表7Day0/14/21的CD8T细胞变化统计
由表7的统计结果显示,经培养后10个供体的CD8T细胞比例都提升了。
表8Day0/14/21的CD8T细胞扩增倍数统计
通过表8数据结果显示,在Day21的时候,CD8T细胞扩增倍数在50-100倍左右;个别供体如Donor3,Donor6超过200倍以上的扩增。
实施例8DC细胞株在多个供体都可以诱导出流感特异性T细胞群体
配型诱导的CTL,是否具有特异性T细胞群体,特通过Tetramer检测阳性率。
取细胞样品至1.5mL Ep管中,约0.5~1×10
采用特异性T细胞检测的金标准,Tetramer检测法(MBL,货号TS-0012-C),10个供体培养的DC-CTL,Day14、21检测,都具有很高的流感特异性Tetramer阳性率。
结果显示,DC细胞株可以在10个供体(如图7、表9所示)当中都诱导出流感特异性T细胞群体。
表9Day0/14/21的Tetramer阳性率统计
通过表9的结果,Tetramer阳性率相较于Day0都有极高的提升;部分供体的阳性率能达到20~60%之间,如Donor2,3,4,8。
实施例9DC细胞株诱导的CTL可以分泌IFN-γ
为了验证DC细胞株诱导的CTL的功能,特通过胞内染色的方法,检测CTL的特异性细胞因子IFN-γ的分泌情况。
取细胞样品,用1640完全培养基(+10%FBS+200IU/mL的IL-2)调整至1×10
Day 14,每份CTL取2×10
表10IFN-γ在总细胞占比和在Tetramer群体中占比差异
实施例10DC细胞株诱导的CTL具有特异性杀伤靶细胞的能力
DC-CTL具有特异性T且能够分泌细胞因子IFN-γ,但是是否具有特异性杀伤细胞的能力,需要进一步探索。为此,特使用A549(人非小细胞肺癌细胞系)(转有HLA-A*02:01分子),负载抗原2h后(阴性对照采用DMSO或EBV表位肽负载A549),和DC-CTL共孵育4h后,检测杀伤效果。
取培养中的CTL细胞,300g 5min离心,收集细胞沉淀后,用无酚红的1640完全培养基调整细胞密度至4×10
采用Donor1 Day21的样品,Tetramer阳性率为4.55%。采用效靶比1:1,结果表明DC细胞株诱导的CTL,具有特异性杀伤能力。
Donor1 Day21的CTL(流感M1的Tetramer阳性率4.55%),具有特异性杀伤负载流感M1抗原的靶细胞。而对无抗原负载-DMSO处理的靶细胞,和EBV抗原负载的靶细胞,杀伤效果要弱很多(如图9、表11所示)。
表11三个复孔细胞毒性结果
靶细胞经DMSO处理,CTL基本没有杀伤效果;经EBV抗原处理后,有6~10%的杀伤效果;经流感M1抗原处理后,有13~24%的杀伤效果,非常明显。说明CTL对流感M1负载的靶细胞,具有特异性杀伤能力。
本发明实施例1提供的DC细胞株,采用独创的培养方法,是具有诱导特异性T细胞扩增的能力,且比传统MODC方法诱导的CTL,CD8+T比例更高,扩增更高,Tetramer阳性率也更高。用10个供体进行配型使用,发现在21天的培养后,CD8T细胞比例在30~80%之间;且CD8T扩增倍数在50~100之间,部分供体可以达到200~600之间;本发明实施例1提供的DC细胞株,采用独创的培养方法,可以诱导CD8T细胞高倍扩增。通过流式检测流感H1N1的M1蛋白的HLA-A*02:01表位特异性Tetramer,发现10个供体都可以诱导出特异性T细胞,部分供体的阳性率可达到30%以上。而且诱导的CTL能够分泌特异性细胞因子,具有特异性杀伤靶细胞的能力。
因此,本发明实施例1提供的DC细胞株,采用独创的培养方法,具有体外诱导DC-CTL,产生具有抗病毒能力的CD8T细胞,用于治疗病毒感染的潜力。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种负载肿瘤细胞外泌体的DC-CTL细胞的培养方法
- 一种DC-CTL细胞的诱导活化试剂盒及其应用方法
- 一种肿瘤抗原复合物体外致敏DC、T细胞获得肿瘤特异性杀伤细胞CTL及其制备方法
