一种白细胞介素8在老年听力损失中作用的验证方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及细胞检测技术领域,具体而言,涉及一种白细胞介素8在老年听力损失中作用的验证方法。
背景技术
老年性耳聋,也被称为年龄相关性听力损失(ARHL),是世界范围内最常见的听觉功能障碍。据报道,65岁以上的人中约有三分之一患有严重的老年性耳聋。然而,除了使用助听器外,ARHL还无法治愈。除了生理和解剖变化,其他因素包括个体遗传易感性、环境因素、激素、耳部感染史和某些全身性疾病的存在与ARHL的发展密切相关。由于ARHL的多因素起源,目前还没有具体的方法来保护或延缓进展性ARHL。
ARHL的标志是血迷宫屏障(BLB)完整性的丧失。BLB由内皮细胞(ECs)、周细胞、基底膜和血管周围巨噬细胞样黑素细胞(PVM/Ms)紧密连接和粘附连接的结构完整性组成。ECs、周细胞和PVM/Ms之间的相互作用和串扰维持了血管通透性和听力完整性的精细调节。发生血管渗漏,血源性有毒物质流入内耳腔内,损害耳蜗内淋巴稳态,促进毛细胞凋亡,这与许多听力障碍有关,包括ARHL。然而,ECs和PVM/ms调节BLB通透性的确切机制尚不完全清楚。越来越多的证据证实,内源性白细胞介素包括白细胞介素8(interleukin 8,IL-8)加重内皮细胞的通透性,导致炎症性疾病和肿瘤的发生。顺铂诱导的PVM/Ms的激活与耳蜗纹血管损伤进展过程中IL-1β的增加有关。因此,白细胞介素可能对BLB的完整性起决定性作用,可作为ARHL的潜在治疗靶点。
IL-8,也称为CXCL-8,最初是从脂多糖(LPS)刺激的人血液单个核细胞的上清中纯化出来的。通常,在健康组织中检测不到IL-8,但在受伤和/或感染组织中其含量明显升高,可以吸引中性粒细胞在炎症部位积聚。分泌的IL-8通过与两个高亲和力的G蛋白偶联受体:cxc趋化因子受体CXCR1和CXCR2结合,迅速招募并激活炎症反应。实际上,小鼠缺乏IL-8的直接同源物,这导致在使用动物模型研究其功能时存在一些障碍。然而,趋化因子CXCL1和CXCL2作为功能性IL-8同源物,作用于CXCR1/2受体,参与多种嗜中性粒细胞依赖的病理性动物疾病模型的病理过程。因此,携带包含整个人类IL-8基因的细菌人工染色体的小鼠通常被用于研究其在多种疾病中的作用。有趣的是,在以发作性眩晕伴波动感音神经性听力损失为特征的梅尼埃病患者血清中观察到IL-8升高。IL-8/CXCR2信号通路促进内皮通透性增加。在听力障碍疾病中,IL-8与ECs通透性之间是否存在关联尚不清楚。
因此,设计一种白细胞介素8在老年听力损失中作用的验证方法,能够充分的证明白细胞介素8在ARHL进展中的作用,是目前亟待解决的问题。
发明内容
本发明的目的在于提供一种白细胞介素8在老年听力损失中作用的验证方法,通过建立合理的动物模型组来设置合理的参考信息,以为后续的数据分析对比提供基础,同时采用不同的方式对白细胞介素8在老年听力损失中的作用。以充分证明了白细胞介素8在ARHL进展中的作用。
第一方面,本发明提供一种白细胞介素8在老年听力损失中作用的验证方法,包括进行动物模型的建立,完成对动物模型组的分类处理,形成动物模型分类处理信息;根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据;获取动物模型中动物的耳蜗,并设置对照组对耳蜗进行提取处理,进行耳蜗细胞凋亡趋势的分析。
作为一种可能的实现方式,进行动物模型的建立,完成对动物模型组的分类处理,形成动物模型分类处理信息,包括:获取多个无噪声暴露史、无中耳炎史以及无耳毒性药物用药史的小鼠在设定光照和温度的低噪声环境中饲养,并保证小鼠自由饮水和食物;将多个小鼠进行分组,形成不同的动物模型组,并对不同的动物模型组进行对比处理,形成动物模型分类处理信息。
作为一种可能的实现方式,将多个小鼠进行分组,形成不同的动物模型组,并对不同的动物模型组进行对比处理,形成动物模型分类处理信息,包括:对多个小鼠按照数量均分为三组,保证每个动物模型组中小鼠的数量不少于15,并分别对不同的动物模型组进行以下处理:对动物模型组中的小鼠进行每月一次的等量生理盐水腹腔注射,形成基础动物模型组;对动物模型组中的小鼠进行对比时间间隔的等量病毒载体腹腔注射,形成对照动物模型组;对动物模型组中的小鼠进行对比时间间隔的等量携带白细胞介素8的病毒的腹腔注射,形成目标动物模型组。
作为一种可能的实现方式,根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据,包括:对基础动物模型组、对照动物模型组以及目标动物模型组中的小鼠进行麻醉后,放置在声音衰减舱中,使用扬声器在声音衰减舱中采用不同频率的纯音脉冲进行声音刺激,获取不同动物模型组对声音的范阔,形成第一听觉反应数据,其中:扬声器上使用到的频率包括4kHz、8kHz、16kHz、24kHz以及32kHz。
作为一种可能的实现方式,根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据,包括:对基础动物模型组、对照动物模型组以及目标动物模型组中的小鼠在每次到达测量周期后进行麻醉放置在声音衰减舱中,使用扬声器在声音衰减舱中采用不同频率的纯音脉冲进行声音刺激,获取不同动物模型组对声音的范阔,形成第二听觉反应数据,其中:测量周期从开始实验的第四个月开始,周期间隔时间为2个月。
作为一种可能的实现方式,获取动物模型中动物的耳蜗,并设置对照组进行原代细胞培养,进行耳蜗毛细胞凋亡趋势的分析,形成细胞凋亡分析结果数据,包括:分别获取动物模型组中的小鼠的耳蜗和野生型小鼠的耳蜗,制取初始样块;对初始样块进行包埋、切片,形成纵向样片;对纵向样片进行渗透,形成渗透样片;对渗透样片进行孵育,并对孵育后的渗透样片进行基于Phalloidin染色检测的细胞凋亡分析,形成第一细胞凋亡结果数据;从初始样块中提取蛋白,并进行基于WB检测的细胞凋亡分析,形成第二细胞凋亡结果数据。
作为一种可能的实现方式,分别获取动物模型组中的小鼠的耳蜗和野生型小鼠的耳蜗,制取初始样块,包括:在最后一次ABR记录后,用致死剂量的麻醉处死小鼠;快速获取小鼠的耳蜗,形成初始样块。
作为一种可能的实现方式,对初始样块进行包埋、切片,形成纵向样片,包括:将纵向样片用4%多聚甲醛在4℃固定12h,并用10%乙二胺四乙酸钠处理;将处理后的纵向切片在30%蔗糖中脱水2天,并在最佳切割温度化合物中包埋24h,并冷冻切片,获得纵向样片。
作为一种可能的实现方式,对纵向样片进行渗透,形成渗透样片,包括:通过孵育含有0.1%的Triton X-100和2%牛血清白蛋白溶液对纵向样片进行渗透,形成渗透样片。
作为一种可能的实现方式,将渗透样片与以下一抗phalloidin-iFluor488和4',6-二氨基-2-苯基吲哚在4℃下孵育过夜;用抗褪色培养基覆盖渗透片,将模型小鼠或野生型小鼠分离的PVM/Ms在Transwell装置的上腔预播种3天,将ECs预播种在24孔培养皿下表面的玻片上3天;将Transwell装置放置在24孔培养皿上,ECs和PVM/Ms共培养5天;经0.1%Triton X-100渗透后,用以下一抗ZO-1和Hoechst 33342在4℃下孵育过夜;在PBS中稀释1:400时,在室温下使用共聚焦显微镜系统获取图像。
本发明提供的一种白细胞介素8在老年听力损失中作用的验证方法的有益效果有:
该方法通过建立合理的动物模型组来设置合理的参考信息,以为后续的数据分析对比提供基础,同时采用不同的方式对白细胞介素8在老年听力损失中的作用。以充分证明了白细胞介素8在ARHL进展中的作用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例提供的白细胞介素8在老年听力损失中作用的验证方法的第一听觉反应图;
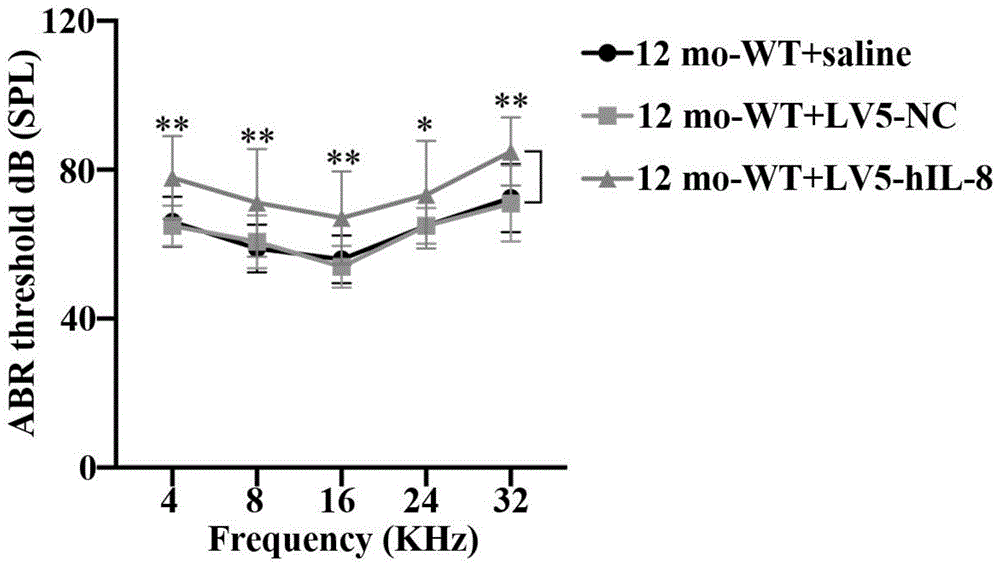
图2为本发明实施例提供的白细胞介素8在老年听力损失中作用的验证方法的第二听觉反应图;
图3为本发明实施例提供的白细胞介素8在老年听力损失中作用的验证方法的基于Phalloidin染色检测的细胞凋亡图;
图4为本发明实施例提供的白细胞介素8在老年听力损失中作用的验证方法的基于WB检测的细胞凋亡图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行描述。
参考图1-图4,本发明实施例提供一种白细胞介素8在老年听力损失中作用的验证方法。该方法通过建立合理的动物模型组来设置合理的参考信息,以为后续的数据分析对比提供基础,同时采用不同的方式对白细胞介素8在老年听力损失中的作用。以充分证明了白细胞介素8在ARHL进展中的作用。
白细胞介素8在老年听力损失中作用的验证方法具体包括以下步骤:
S1:进行动物模型的建立,完成对动物模型组的分类处理,形成动物模型分类处理信息。
进行动物模型的建立,完成对动物模型组的分类处理,形成动物模型分类处理信息,包括:获取多个无噪声暴露史、无中耳炎史以及无耳毒性药物用药史的小鼠在设定光照和温度的低噪声环境中饲养,并保证小鼠自由饮水和食物;将多个小鼠进行分组,形成不同的动物模型组,并对不同的动物模型组进行对比处理,形成动物模型分类处理信息。
其中,将多个小鼠进行分组,形成不同的动物模型组,并对不同的动物模型组进行对比处理,形成动物模型分类处理信息,包括:对多个小鼠按照数量均分为三组,保证每个动物模型组中小鼠的数量不少于15,并分别对不同的动物模型组进行以下处理:对动物模型组中的小鼠进行每月一次的等量生理盐水腹腔注射,形成基础动物模型组;对动物模型组中的小鼠进行对比时间间隔的等量病毒载体腹腔注射,形成对照动物模型组;对动物模型组中的小鼠进行对比时间间隔的等量携带白细胞介素8的病毒的腹腔注射,形成目标动物模型组。
S2:根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据。
根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据,包括:对基础动物模型组、对照动物模型组以及目标动物模型组中的小鼠进行麻醉后,放置在声音衰减舱中,使用扬声器在声音衰减舱中采用不同频率的纯音脉冲进行声音刺激,获取不同动物模型组对声音的范阔,形成第一听觉反应数据,其中:扬声器上使用到的频率包括4kHz、8kHz、16kHz、24kHz以及32kHz。
根据动物模型分类处理信息,进行听觉功能的测定,形成听觉功能测定结果数据,包括:对基础动物模型组、对照动物模型组以及目标动物模型组中的小鼠在每次到达测量周期后进行麻醉放置在声音衰减舱中,使用扬声器在声音衰减舱中采用不同频率的纯音脉冲进行声音刺激,获取不同动物模型组对声音的范阔,形成第二听觉反应数据,其中:测量周期从开始实验的第四个月开始,周期间隔时间为2个月。
S3:获取所述动物模型中动物的耳蜗,并设置对照组对耳蜗进行提取处理,进行耳蜗细胞凋亡趋势的分析,形成细胞凋亡分析结果数据。获取动物模型中动物的耳蜗,并并设置对照组对耳蜗进行提取处理,进行耳蜗毛细胞凋亡趋势的分析,形成细胞凋亡分析结果数据,包括:分别获取动物模型组中的小鼠的耳蜗和野生型小鼠的耳蜗,制取初始样块;对纵向样片进行渗透,形成渗透样片;对渗透样片进行孵育,并对孵育后的渗透样片进行基于Phalloidin染色检测的细胞凋亡分析,形成第一细胞凋亡结果数据;从初始样块中提取蛋白,并进行基于WB检测的细胞凋亡分析,形成第二细胞凋亡结果数据。
分别获取动物模型组中的小鼠的耳蜗和野生型小鼠的耳蜗,制取初始样块,包括:在最后一次ABR记录后,用致死剂量的麻醉处死小鼠;快速获取小鼠的耳蜗,形成初始样块,形成初始样块。对初始样块进行包埋、切片,形成纵向样片,包括:将纵向样片用4%多聚甲醛在4℃固定12h,并用10%乙二胺四乙酸钠处理;将处理后的纵向切片在30%蔗糖中脱水2天,并在最佳切割温度化合物中包埋24h,并冷冻切片,获得纵向样片。碳。对纵向样片进行渗透,形成渗透样片,包括通过孵育含有0.1%的Triton X-100和2%牛血清白蛋白溶液对纵向样片进行渗透,形成渗透样片。对渗透样片进行孵育,并对孵育后的渗透样片进行基于Phalloidin染色检测的细胞凋亡分析,形成第一细胞凋亡结果数据,包括:将渗透样片与以下一抗phalloidin-iFluor 488和4',6-二氨基-2-苯基吲哚在4℃下孵育过夜;用抗褪色培养基覆盖渗透片,将模型小鼠或野生型小鼠分离的PVM/Ms在Transwell装置的上腔预播种3天,将ECs预播种在24孔培养皿下表面的玻片上3天;将Transwell装置放置在24孔培养皿上,ECs和PVM/Ms共培养5天;经0.1%Triton X-100渗透后,用以下一抗ZO-1和Hoechst33342在4℃下孵育过夜;在PBS中稀释1:400时,在室温下使用共聚焦显微镜系统获取图像。
下面对方法步骤进行具体详细的说明。另外对于其他相关的内容说明与分析:
动物模型:
雄性小鼠C57BL/6近交系原来源于厦门大学实验动物中心。所有小鼠(8周龄)在控制光照(12h/d)和温度(22±2℃)的低噪声环境中饲养,自由饮水和食物。所有实验程序经厦门大学医学院厦门大学第一附属医院科研组织动物福利委员会批准。所有小鼠均无噪声暴露史、中耳炎史和耳毒性药物用药史。将小鼠随机分为3组,每组15只。对照组大鼠(12只mo-WT+生理盐水)自4月龄起,每月1次腹腔注射等量生理盐水。慢病毒载体阴性的模型组与对照组(12mo-WT+LV5-NC)在相同的时间间隔内腹腔注射相同体积的相应慢病毒载体。模型组小鼠腹腔注射含慢病毒载体的hIL-8,时间间隔与LV5-hIL-8组相同(mo-WT 12只+LV5-hIL-8)。生理盐水及相应的慢病毒载体连续注射8个月(每月1次)。体内抑制实验:从4个月开始皮下注射RGFP966(10mg/kg,HY-13909,MCE,US),之后隔日1次。分别在4、6、8、10、12月龄时用听觉脑干反应(ABR)测定C57BL/6J小鼠的听觉功能。在期望月龄时,处死动物,快速收集耳蜗并进行各种检查。
酶联免疫吸附测定:
对于人类,我们采集了参与者的血液样本。动物模型分别于注射LV5-hIL-8后1、2、3、4周对8周龄C57BL/6小鼠实施安乐死,并采集血样。人、小鼠血样离心后分离上清,采用酶联免疫吸附法(ab214030,Abcam,US)测定血清中hIL-8的浓度。
测定听性脑干反应(auditory brainstem response):
使用专用工作站(Tucker-Davis技术公司,Alachua,FL,US)通过检测听觉脑干反应(ABRs)来监测小鼠听觉功能,并使用BioSigRP软件进行分析。简而言之,所有小鼠都被麻醉,并使用加热垫维持在37℃。然后,所有小鼠被放置在一个声音衰减舱(ETS-Lindgren SDTest Enclosure,MDL技术有限公司,Hitchin,英国)中,使用MF1-M扬声器在自由场中传递4、8、16、24和32kHz纯音脉冲(上升-下降时间为1ms,平台时间为3ms)的声刺激。通过皮下注射针状电极(27gauge,13mm;猫。不。S83018-R9,Rochester)位于顶部、左耳腹外侧和尾部上方。我们以从100dB SPL到10dB SPL的5dB阶梯收集刺激水平的反应。听力阈值定义为平均ABR中能在噪声底(0.1μV)以上产生波I峰的最低声强。记录不同年龄(4、6、8、10、12月龄)的abr。实验为双盲实验。
免疫荧光分析:
在12个月时,在最后一次ABR记录后,用致死剂量的麻醉(70mg/g氯胺酮和1mg/g美托咪定)处死小鼠,快速获取耳蜗,并将样本用4%多聚甲醛在4℃固定12h。然后用10%乙二胺四乙酸钠(EDTA;pH值7.3--7.4)。然后,耳蜗在30%蔗糖中脱水2d,在最佳切割温度化合物(OCT)中包埋24h,并冷冻切片,获得沿耳蜗轴10μm的纵向切片。通过孵育含有0.1%Triton X-100和2%牛血清白蛋白的溶液来进行标本的渗透。然后将载玻片与以下一抗phalloidin-iFluor 488(Ab176753,Abcam,美国)和4',6-二氨基-2-苯基吲哚(DAPI,D1306,ThermoFisher,美国)(1:1000)在4℃下孵育过夜。随后,用抗褪色培养基(FluorSave
Transwell单层渗透率测定:
为了评估ECs的完整性,通过将PVM/M共培养与空白和仅单层(融合)对照进行比较,确定EC单层通透性。空单层对照组为纯化的3代ECs(密度为4×10
免疫印迹:
收集耳蜗或PVM/Ms,并在含有苯基甲基磺酰氟(PMSF)(Beyotime,中国)的放射免疫沉淀法(RIPA)缓冲液中裂解(Beyotime,中国)。蛋白浓度监测采用比辛胆酸(BCA)蛋白分析试剂盒(Beyotime,中国)。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量蛋白,并将其转移到聚偏二氟乙烯(PVDF)膜上(Millipore Corp,Billerica,USA)。膜用5%脱脂乳阻断,随后用抗BAX(abs130033,Absin,CN)、Bcl-2(NB100-56098,Novus biicals,美国)、HDAC3(ab137704,Abcam,美国)和RPL23A(GTX64876,GeneTex,Texas,美国)的抗体在4℃下孵育。β-Actin(20536-1-AP,ProteinTech,Illinois,US)被用作内部对照。第二天,将印迹与辣根过氧化物酶偶联二抗(1:3000)孵育1小时。使用增强型化学发光试剂盒(ECL,Thermo Scientific,USA)监测蛋白质水平,并使用凝胶成像设备(Bio-Rad,USA)进行可视化。以β-Actin和RPL23A为对照。
CCK8:
根据制造商的说明,使用细胞计数试剂盒-8(CCK-8)测定细胞活力(Dojindo,Japan)。将野生型小鼠或模型小鼠分离的PVM/Ms置于96孔板中培养24h。50%-60%合度的细胞再用IL-8处理72h。在所需的时间,每孔加入10μl CCK-8溶液,在37℃、5%CO2条件下孵育4h。使用Multiskan Spectrum(Thermo Fisher Scientific,USA)在450nm波长处测量吸光度值。
流式细胞术:
采用Annexin V-FITC/PI细胞凋亡检测试剂盒(Roche Diagnostics,Rotkreuz,Switzerland)检测IL-8处理的PVM/Ms细胞的凋亡情况。用冷PBS洗涤细胞,根据制造商的说明重悬并染色,随后立即用流式细胞术(BD,USA)分析细胞凋亡。RNA提取及实时定量PCR分析(qRT-PCR)耳蜗收集于无RNAase的PBS液中,在解剖显微镜下分离,置入TRIzol RNA提取液。收集ECs并采用TRIzol RNA提取法消化。用ReverTra Ace(Toyobo,Japan)合成cDNA。使用SuperScript II(Invitrogen)按照制造商的说明进行qRT-PCR。表1列出了Zo1、Occludin和VE钙黏蛋白的引物序列。扩增方案如下:50℃2min,95℃10min,95℃15s循环40次,60℃1min。
结果:
ARHL患者IL-8含量升高:
为了解IL-8在ARHL患者中的生物学意义,我们检测了临床ARHL患者和正常人的血清IL-8含量。ELISA结果显示,ARHL患者血清IL-8含量明显高于正常受试者。进一步研究发现,ARHL患者中听力损失越严重的患者血清IL-8水平也越高。这些结果表明IL-8在ARHL患者中高分泌。
人IL-8的表达加重了小鼠ARHL的进展:
基于上述观察结果,我们接下来研究了人类IL-8在ARHL进展中的作用。从4个月开始,每个月都腹腔注射hIL-8,随后在接下来的8个月检查hIL-8的效果。在野生型C57BL6/J小鼠中,首次注射1个月后测定血清IL-8含量。如补充图1所示,血清IL-8在大约2周时达到峰值,在接下来的2周内持续表达,在初始注射后4周时显示约0.10ng/ml的IL-8。结果表明,hIL-8慢病毒载体在小鼠体内成功表达。随后,在造模结束时,采用ABR试验评估C57BL6/J小鼠ARHL的进展情况。随着时间的增加,野生型C57BL6/J小鼠在造模结束时出现中度听力损失,在4、8、16、24和32kHz频率下ABR阈值较高。与此相反,注射慢病毒载体对ABR阈值没有影响。然而,LV5-hIL-8组小鼠在4、8、16、24和32kHz音爆刺激下的ABR阈值明显高于其他两个对照模型组。在建模过程中,还记录了4个月至12个月的平均ABR阈值。如图2所示,与其他两个对照模型组相比,LV5-hIL-8组对click、4kHz和8kHz声音刺激的8个月至12个月平均ABR阈值显著升高,说明在建模期间,注射hIL-8加重了C57BL6/J小鼠的听力损失。Phalloidin染色结果显示,与其他两组相比,LV5-hIL-8组耳蜗组织毛细胞凋亡明显增加。此外,与其他两个对照模型组相比,LV5-hIL-8组Bax的转录和翻译水平明显升高,Bcl-2水平明显降低。这些数据表明,过表达IL-8可导致耳蜗组织听觉功能受损和毛细胞凋亡增加。
hIL-8抑制PVM/Ms细胞活力,促进细胞凋亡:
BLB主要由ECs和PVM/Ms组成,其完整性与毛细胞的凋亡密切相关。随后,研究了hIL-8在PVM/Ms中的作用。离体PVM/Ms的形态见补充图2。一旦暴露于hIL-8,与对照PVM/Ms相比,野生型小鼠分离的PVM/Ms细胞活力急剧下降,PVM/Ms细胞凋亡明显增加。同样,与其他两个对照模型组相比,LV5-hIL-8注射小鼠产生的PVM/Ms细胞活力急剧下降,细胞凋亡明显增加。这些数据表明,hIL-8处理抑制了PVM/Ms的细胞活性并诱导了细胞凋亡。
暴露于hil-8的PVM/Ms存在时,EC单层具有高渗透性
考虑到ECs和PVM/Ms在BLB完整性中的作用,使用PVM/Ms与零和仅EC单层共培养来研究EC单层通透性。通过测定基底侧腔中fitc-葡聚糖荧光强度来测定EC单层渗漏程度。EC单层的通透性明显增加与从两个对照模型组分离的PVM/Ms相比,缺乏PVM/Ms。然而,与两个对照模型组产生的ECs和PVM/Ms共培养系统相比,来自LV5-hIL-8小鼠的PVM/Ms中存在更高的ECs荧光计数。也就是说,PVM/Ms与ECs共培养可适当降低ECs的通透性,而暴露于hil-8的PVM/Ms与ECs共培养可进一步提高ECs的通透性。随后,我们进一步研究了紧密连接相关分子的表达,以证明hIL-8对BLB完整性的作用。结果表明,与来自LV5-hIL-8小鼠的PVM/Ms共培养相比,与来自其他两个对照模型组的PVM/Ms共培养时,ECs中ZO-1、Occludin和VE-cadherin的水平明显受到抑制。结合IF染色,与其他两个对照模型组的PVM/Ms相比,hil-8暴露的PVM/Ms在ECs中进一步证实ZO-1表达降低。此外,与未经IL-8处理的ECs和PVM/Ms共培养相比,经IL-8处理的ECs和PVM/Ms共培养的荧光计数更高。随后,与仅与PVM/Ms共培养的ECs相比,PVM/Ms与IL-8处理的ECs中,ZO-1、Occludin和VE-cadherin的转录水平显著降低。与此一致的是,暴露于il-8处理的PVM/Ms的ECs中,ZO-1的表达分布明显少于单独暴露于PVM/Ms的ECs。总的来说,这些发现证实了IL-8处理通过诱导ECs的渗透性和破坏紧密连接破坏了BLB的完整性。
HDAC3抑制剂抑制hIL-8存在时PVM/ms诱导的ECs的通透性:
然后,研究了HADC3在il-8发射的ECs通透性中的功能作用。数据显示,IL-8处理PVM/Ms后,HADC3的表达明显增加。为了进一步阐明HDAC3的作用,构建了ECs和PVM/Ms共培养体系,即IL-8或IL-8加HDAC3抑制剂。在PVM/Ms存在下,与单独的EC单层相比,EC单层泄漏显著减少。IL-8或IL-8加DMSO处理的PVM/Ms共培养增加了EC单层的渗漏。然而,一旦用RGFP966处理,暴露于il-8的PVM/Ms对EC单层渗漏的促进作用被适度抑制。il-8的PVM/Ms引起的ECs中ZO-1、Occludin和VE-cadherin的下降通过添加RGFP966得到明显恢复。此外,IF实验证实,与仅IL-8处理的ECs和PVM/Ms共培养系统相比,IL-8加RGFP966处理的ECs和PVM/Ms共培养系统可以逆转ZO-1的表达。综上所述,这些结果证明IL-8引起的ECs通透性增加和BLB破坏可以通过HDAC3抑制剂得到缓解。
HDAC3的抑制作用抵消了hIL-8在ARHL中的进展作用:
接下来,构建IL-8或IL-8加RGFP966注射的ARHL模型,探讨HDAC3对IL-8发射的ARHL疾病的影响。LV5-hIL-8小鼠在4、8、16、24和32kHz音调爆发刺激下的ABR阈值显著高于对照组,RGFP966处理明显抑制了这一阈值。与其他两个对照模型组相比,LV5-hIL-8组在8个月至12个月期间对点击、4kHz和8kHz声音刺激的平均ABR阈值明显升高,而RGFP966则逆转了这一趋势,这表明HDAC3失活抑制了注射hIL-8介导的造模过程中听力损失的加重。Phalloidin染色结果显示,LV5-hIL-8组耳蜗组织毛细胞凋亡明显增加。然而,RGFP966的加入抵消了这些影响。此外,与对照组相比,LV5-hIL-8组Bax的转录和翻译水平升高,Bcl-2水平明显降低,IL-8引起的Bcl-2和Bax的表达变化被RGFP966抑制。因此,所有数据表明,IL-8过表达对加速ARHL症状的作用被抑制HDAC3所抵消。
循环上皮祖细胞减少是ARHL发病机制的一个重要标志。ECs和PVM/Ms之间的相互作用调节BLB的完整性和通透性,这有助于维持正常的耳蜗电位和听力阈值。使用药物操作或基因治疗靶向BLB可改善BLB分解和听力损失。结果表明,IL-8通过激活PVM/Ms的HDAC3,诱导PVM/Ms的凋亡,并促进ECs的通透性。抑制HDAC3对il-8诱导的ECs通透性增加、毛细胞凋亡和听力丧失具有保护作用。可能,IL-8发射的炎症反应显著增加ECs的通透性和渗漏,导致毛细胞凋亡和ARHL的发生。
脂多糖诱导的神经炎症促进了感音神经性听力损失的发病机制,并伴有IL-8的表达和分泌。n-乙酰半胱氨酸可减弱肿瘤坏死因子α及其下游信号IL-8的表达,保护自身免疫性内耳疾病的进展。在听力损失的中耳炎患者中,中耳积液和血清样本中的IL-8含量高于健康受试者。相反,与对照组相比,突发性感音神经性听力损失患者的IL-8水平没有升高。不同之处在于,本研究中ARHL患者血清IL-8显著升高,且呈疾病严重程度依赖性。在高水平的IL-8存在下,凋亡在许多类型的细胞中增加。重要的是,中耳腔中的IL-8能够通过改变频率为4,8,10,12,16和20kHz的ABR阈值来影响内耳功能。在本研究中,小鼠建模期间,外源性人IL-8在血液中显著升高并持续表达。hIL-8显著提高了不同频率下的ABR阈值和平均ABR阈值,同时增加了毛细胞凋亡。因此,hil-8介导的ARHL加速可能参与了内耳损伤。
PVM/Ms是胃内液血屏障的关键组成部分,对该屏障的完整性和功能至关重要。PVM/Ms负责维持血液屏障的完整性,并在前庭系统启动局部炎症反应。用于模拟听力损失的缺氧治疗可抑制细胞活力并促进PVM/Ms细胞凋亡。敲低在听力功能中起关键作用的巨噬细胞迁移抑制因子也会抑制PVM/Ms的细胞活力并诱导细胞凋亡。IL-8作用下,PVM/Ms细胞活力明显受到抑制,细胞凋亡明显增加,这在hIL-8注射小鼠PVM/Ms中也有观察到。IL-8在调节PVM/Ms细胞活性中首次被发现。越来越多的证据表明,PVM/Ms可以调节内皮屏障中紧密连接蛋白和粘附连接蛋白的表达。PVM/Ms可以增强ECs中紧密连接相关蛋白的表达。周细胞和PVM/Ms调节内皮细胞单层中的紧密连接基因表达,有助于提高内皮细胞单层的完整性并降低通透性。肝癌细胞中IL-8的下调可导致血管内皮细胞凋亡。在本研究中,il-8暴露的PVM/Ms或来自hIL-8注射小鼠的PVM/Ms促进了通透性,抑制了紧密连接相关基因如ZO-1的表达。因此,IL-8可能通过诱导PVM/Ms损伤和ECs通透性,破坏紧密连接,从而破坏BLB的完整性。
HDAC3主要被认为是细胞核中的表观基因组调节剂,调节大量发育和生理相关基因的转录。HDAC3水平主要在耳蜗细胞核中升高。ATP耗竭导致组蛋白去乙酰化,最终导致毛细胞死亡。氨基糖苷诱导HDAC3升高,导致小鼠耳蜗毛细胞死亡。因此,HDAC3是毛细胞死亡和听力损失进展的关键因素。在本研究中,使用RGFP966抑制HDAC3抑制il-8启动了小鼠ARHL的进展。IL-8诱导进行性ARHL可能是通过调节HDAC3活性实现的。HDAC3易位到线粒体,诱导巨噬细胞线粒体适应IL-1β的产生,导致慢性炎症。巨噬细胞中HDAC3的缺失可以保护小鼠免受LPS的致死暴露。HDAC3抑制剂RGFP966通过调节巨噬细胞信号传导对结核分枝杆菌具有抗菌活性(49)。重要的是,抑制HDAC3可阻止2型糖尿病雄性小鼠血脑屏障的通透性。这里,IL-8暴露增加了PVM/Ms中HDAC3的表达,PVM/Ms是一种巨噬细胞样细胞。此外,PVM/Ms中的HDAC3抑制剂也通过抑制ECs的通透性对BLB完整性具有保护作用。考虑到BLB完整性对ARHL的保护作用,我们的研究结果证实,血清IL-8通过上调HDAC3活性导致PVM/Ms损伤,进而促进ECs通透性,导致毛细胞凋亡。
综上所述,本发明实施例提供的白细胞介素8在老年听力损失中作用的验证方法的有益效果有:
该方法通过建立合理的动物模型组来设置合理的参考信息,以为后续的数据分析对比提供基础,同时采用不同的方式对白细胞介素8在老年听力损失中的作用。以充分证明了白细胞介素8在ARHL进展中的作用。
本发明中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,a,b,或c中的至少一项(个),可以表示:a,b,c,a-b,a-c,b-c,或a-b-c,其中a,b,c可以是单个,也可以是多个。
应理解,在本发明的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本发明实施例的实施过程构成任何限定。
本领域普通技术人员可以意识到,结合本文中所公开的实施例描述的各示例的单元及方法步骤,能够以电子硬件、或者计算机软件和电子硬件的结合来实现。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。
所属领域的技术人员可以清楚地了解到,为描述的方便和简洁,上述描述的系统、装置和单元的具体工作过程,可以参考前述方法实施例中的对应过程,在此不再赘述。
在本发明所提供的几个实施例中,应该理解到,所揭露的系统、装置和方法,可以通过其它的方式实现。例如,以上所描述的装置实施例仅仅是示意性的,例如,所述单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,例如多个单元或组件可以结合或者可以集成到另一个系统,或一些特征可以忽略,或不执行。另一点,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些接口,装置或单元的间接耦合或通信连接,可以是电性,机械或其它的形式。
所述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
另外,在本发明各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。
所述功能如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本发明的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本发明各个实施例所述方法的全部或部分步骤。而前述的存储介质包括:U盘、移动硬盘、只读存储器(read-only memory,ROM)、随机存取存储器(random access memory,RAM)、磁碟或者光盘等各种可以存储程序代码的介质。
以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 用于在电话系统和移动电话装置中补偿听力损失的方法
- 一种联邦学习中基于语义数据损失的遗忘验证方法
