一种肝胆系统肿瘤类器官培养基及培养方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及一种肝胆系统肿瘤类器官培养基及培养方法,属于生物工程技术领域。
背景技术
患者来源的肿瘤类器官(patient-derived organoids,PDOs)是近年来发展起来的一种新型肿瘤研究模型,其可以稳定地保留肿瘤细胞在体内的特征,在肿瘤诊断、个性化治疗、药物筛选等领域有着巨大的应用前景。据统计,肝癌目前是全球第六大常见恶性肿瘤和第三大肿瘤死亡原因,而我国肝癌新发病例约占全球的45.3%,死亡病例约占47.1%。因此,在我国建立稳定的肝癌类器官培养体系并进行相关研究势在必行。
目前,肿瘤类器官构建的基本流程为:新鲜肿瘤组织经机械剪切及胶原酶消化解离后,与基质胶混合,接种至低吸附培养板,然后加入肿瘤类器官培养液培养,生长到一定程度后传代培养。现有技术中,肿瘤类器官培养液一般都是在DMEM/F12基础培养基中添加各种细胞因子,所加细胞因子种类和浓度根据肿瘤类型有所变化(Weeber F,Ooft SN,Dijkstra KK,Voest EE.Tumor Organoids as a Pre-clinical.Cancer Model for DrugDiscovery.Cell Chem Biol.2017Sep 21;24(9):1092-1100.)。研究发现,肿瘤类器官培养成功率与其肿瘤类型和组织来源有关,如结直肠癌和前列腺癌培养成功率高达90%。与其它肿瘤相比,肝细胞肝癌(Hepatocellular Carcinoma,HCC)肿瘤类器官培养技术还很不成熟,构建成功率较低。例如,Nuciforo S等报道利用肝癌活检标本构建HCC类器官的成功率为26%(Nuciforo S,Fofana I,Matter MS,Blumer T,Calabrese D,Boldanova T,Piscuoglio S,Wieland S,Ringnalda F,Schwank G,Terracciano LM,Ng CKY,HeimMH.Organoid Models ofHuman Liver Cancers Derived from TumorNeedleBiopsies.Cell Rep.2018Jul 31;24(5):1363-1376.),而Xian L等利用手术切除标本构建HCC类器官的成功率为29%(Xian L,Zhao P,ChenX,Wei Z,Ji H,Zhao J,LiuW,Li Z,LiuD,Han X,Qian Y,Dong H,Zhou X,Fan J,Zhu X,Yin J,Tan X,Jiang D,Yu H,CaoG.Heterogeneity,inherent and acquired drug resistance in patient-derivedorganoid models ofprimary liver cancer.Cell Oncol(Dordr).2022Oct;45(5):1019-1036.)。关于肝内胆管癌(Intrahepatic Cholangiocarcinoma,ICC)类器官构建成功率文献报道不一,但均低于50%。其他肝胆系统肿瘤,如肝外胆管癌(extrahepaticcholangiocarcinoma,EHCC)和胆囊癌的类器官构建成功率为20%左右(Amato F,Rae C,Prete MG,Braconi C.CholangiocarcinomaDisease Modelling Through PatientsDerived Organoids.Cells,2020,9(4):832.)。
肝癌类器官构建成功率低一方面与肝癌本身的高度异质性和低干性有关,另一方面各个研究报道所用的HCC类器官培养基成份并不相同,目前还不确定什么样的培养条件最适合HCC类器官的生长,市面上也没有商品化的肝癌类器官培养基出售。因此,优化HCC类器官培养基成份,提高肝胆系统肿瘤类器官,特别是HCC类器官的构建成功率,将促进肝胆系统肿瘤类器官药物筛选模型的建立,从而推进肝胆系统肿瘤的新药发现及患者的个体化治疗。
发明内容
本发明的目的在于解决现有技术中肝胆系统肿瘤类器官构建成功率低的问题,提供一种肝胆系统肿瘤类器官培养基,其可以有效提高肝胆系统肿瘤类器官的构建成功率。
技术方案
一种肝胆系统肿瘤类器官培养基,由如下成分组成:基础培养基、条件培养基、青链霉素、谷氨酰胺、HEPES、B27、N2添加剂、N-乙酰半胱氨酸、烟酰胺、Gastrin I、EGF(重组人表皮生长因子蛋白)、FGF10(重组人成纤维细胞生长因子蛋白)、HGF(重组人肝细胞生长因子蛋白)、重组人Noggin蛋白、Forskolin、A83-01和Y-27632二盐酸盐;
所述基础培养基与条件培养基的体积比为3:2,所述基础培养基为AdvancedDMEM/F12,所述条件培养基为Wnt-3A条件培养基和Rspo-1条件培养基;
所述肝胆系统肿瘤类器官培养基中,青链霉素的浓度为50-150U/mL,谷氨酰胺的浓度为1-3mM,HEPES的浓度为5-15mM,B27的体积浓度为1-3%,N2添加剂的体积浓度为1-3%,N-乙酰半胱氨酸的浓度为1-1.5mM,烟酰胺的浓度5-15mM,Gastrin I的浓度为0-15nM,EGF的浓度为40-60ng/mL,FGF10的浓度为50-200ng/mL,HGF的浓度为0-30ng/mL,重组人Noggin蛋白的浓度为20-100ng/mL,Forskolin的浓度为10-12.5μM、A83-01的浓度为0.5-5μM,Y-27632二盐酸盐的浓度为5-10μM。
进一步,所述Wnt-3A条件培养基和Rspo-1条件培养基的体积比为3:1。
进一步,所述肝胆系统肿瘤类器官培养基中,青链霉素的浓度为100U/mL,谷氨酰胺的浓度为2mM,HEPES的浓度为10mM,B27的体积浓度为2%,N2添加剂的体积浓度为1%,N-乙酰半胱氨酸的浓度为1.25mM,烟酰胺的浓度10mM,Gastrin I的浓度为10nM,EGF的浓度为50ng/mL,FGF10的浓度为100ng/mL,HGF的浓度为25ng/mL,重组人Noggin蛋白的浓度为50ng/mL,Forskolin的浓度为10μM、A83-01的浓度为2.0μM,Y-27632二盐酸盐的浓度为10μM。
一种肝胆系统肿瘤类器官的培养方法,包括如下步骤:
(1)将肝胆肿瘤手术切除样本清洗后剪碎,得到样本组织碎块,加入肝脏组织消化液消化处理,然后过滤,离心取沉淀,再用Advanced DMEM/F12基础培养基清洗,获得细胞沉淀;
(2)往细胞沉淀中加入基质胶,混匀后,接种于培养板上的培养孔中,37℃下静置,待凝固后,再加入肝胆系统肿瘤类器官培养基,置于细胞培养箱中培养,每隔3-4天换液,10-14天后,获得原代肝胆系统肿瘤类器官;
(3)将原代肝胆系统肿瘤类器官进行传代培养。
进一步,步骤(1)中,所述消化处理的温度为37℃,时间为60-90min。
进一步,步骤(2)中,所述培养条件为:37℃,体积分数为5%的CO
进一步,步骤(3)中,将原代肝胆系统肿瘤类器官先用DispaseⅡ消化,然后离心取沉淀,再加入TrypLE Express继续消化,按1:3-1:5传代培养,每隔6-8d传代。
本发明的有益效果:
本发明公开了一种肝胆系统肿瘤类器官培养基,与现有的肝胆系统肿瘤类器官培养基相比,本发明的培养基具有优点:
1)本发明的培养基可有效提高HCC和ICC类器官的构建成功率,其中,HCC类器官构建成功率达40.6%,ICC类器官构建成功率达60%;
2)本发明的培养基为一种肝胆系统肿瘤通用型培养基,采用其可以同时构建肝胆系统不同的肿瘤类器官(例如HCC类器官、肝内胆管癌、CHC复合型肝癌及胆囊癌类器官),既简化了实验步骤,也节约了成本。
3)采用本发明的培养基构建的HCC类器官,可保留来源肝癌组织的组织病理学特征、遗传学变异及生物学特性,且在动物体内有很好的致瘤性。
4)采用本发明的培养基构建的HCC类器官可用于体外高通量筛选肝癌靶向药物,结合HCC类器官小鼠移植瘤模型,有可能发现肝癌新的靶向药物及新的靶点,具有良好的临床应用价值和转化价值。
附图说明
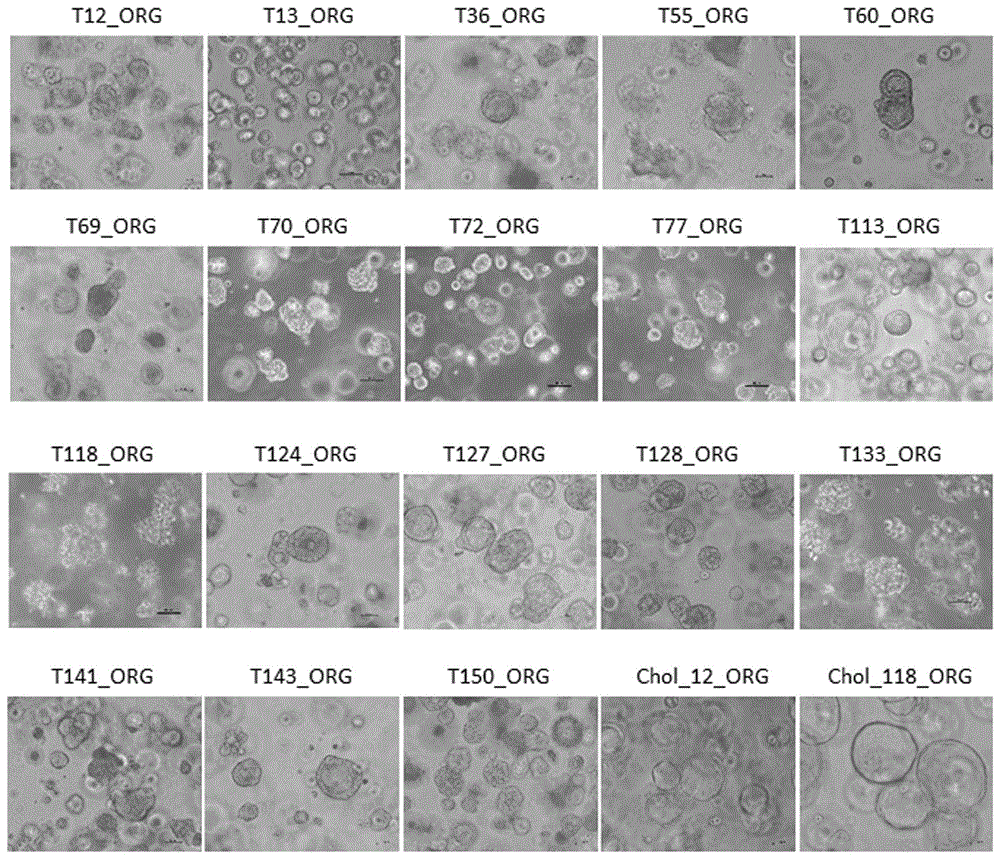
图1为实施例2培养的18例HCC类器官及对比例1培养的两例正常胆管类器官的光学显微镜图;
图2为实施例2培养的HCC肝癌类器官与相应肝癌组织基因组DNA的SNP相关性分析结果;
图3为实施例2培养的HCC类器官与相应肝癌组织及癌旁组织的RNA表达谱相关性分析结果;
图4为实施例2培养的4例HCC类器官及相应肝癌组织的HE染色图;
图5为实施例2培养的4例HCC类器官及相应肝癌组织的的免疫组化分析结果;
图6为实施例2培养HCC类器官及对比例1培养的正常胆管类器官经重组慢病毒CMV-GFP-Luc-Lentivirus感染后的荧光显微镜图;
图7为实施例2培养HCC类器官及对比例1培养的正常胆管类器官接种小鼠皮下后形成的移植瘤图片;
图8为HCC类器官、肝脏原位移植瘤PDO-PDXs及来源肝癌组织HE染色图;
图9为IHC分析AFP在HCC类器官、肝脏原位移植瘤PDO-PDXs及肝癌组织中的表达;
图10为实施例2培养的HCC类器官经靶向药物处理5天后的光学显微镜图;
图11为实施例3培养的12例ICC类器官的光学显微镜图;
图12为实施例4培养的3例CHC类器官的光学显微镜图;
图13为实施例5培养的2例GBC类器官的光学显微镜图。
具体实施方式
为了更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明的技术方案作进一步说明,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围。
下述实施例中的试验方法,如无特殊说明,均为本领域常规方法。
下述实施例中所用的实验材料,如无特殊说明,均可自常规生化试剂商店购买得到。
下述实施例中,所涉及的实验材料及来源如下:
1、实验动物
NCG小鼠,体重18-22g,由江苏集萃药康生物科技股份有限公司提供,合格证号:SCXK(苏)2018-0008。
2.实验用细胞系
⑴LWnt-3A(ATCC,CRL-2647);
⑵HA-R-Spondin1-Fc 293T(Trevigen,3710-001-01)
3、实验药物和实验试剂
⑴AdvancedDMEM/F12(Gibco,12634-010);
⑵基质胶(R&D,3533-010-02);
⑶肝脏组织消化液(Gibco,17703034);
⑷分散酶DispaseⅡ(Gibco,17105041);
⑸青链霉素(penicillin/streptomycin,Gibco,15140-122);
⑹谷氨酰胺(GlutaMAX,Gibco,35050-061);
⑺HEPES(MERCK,H4034);
⑻B27(Gibco,12587010);
⑼N2添加剂(R&D,AR009);
⑽N-乙酰半胱氨酸(MERCK,A9165);
⑾烟酰胺(Nicotinamide,MERCK,N0636);
⑿Gastrin I(R&D,3006/1);
⒀人细胞因子EGF(R&D,236-EG-01M),FGF10(R&D,345-FG-250),HGF(R&D,294-HG-250),Noggin(R&D,6057-NG-025);
⒁Forskolin(R&D,1099/10);
⒂A83-01(R&D,2939/10);
⒃抗肿瘤药物由美国Selleck生物科技有限公司提供;
⒄Anti-AFP抗体(Abcam,ab46799),Anti-EpCAM抗体(Abcam,ab223582);
⒅CellTiter-Glo 3D细胞活力检测系统(Promega,G9683);
⒆D-Luciferin(Merck,L6152);
⒇消化酶TrypLE Express(Gibco,12605028)。
4.重组慢病毒
⑴重组慢病毒CMV-GFP-Luc-Puro-Lentivirus购自吉满生物科技(上海)有限公司。
5、实验耗材
⑴24孔低吸附培养板(Corning,3473);
⑵96孔低吸附培养板(Corning,3474);
6、实验用设备
⑴生物安全柜:美国Baker公司;
⑵CO2培养箱;美国Thermo公司;
⑶水平离心机;德国Eppendorf公司
⑷多功能酶标仪:美国Bio Tek公司。
⑸全自动免疫组化仪:德国Leica公司。
实施例1肝胆系统肿瘤类器官培养基及其制备
一种肝胆系统肿瘤类器官培养基,由如下成分组成:基础培养基(Advanced DMEM/F12)、条件培养基(Wnt-3A条件培养基和Rspo-1条件培养基)、青链霉素、谷氨酰胺、HEPES、B27、N2添加剂、N-乙酰半胱氨酸、烟酰胺、Gastrin I、EGF、FGF10、HGF、重组人Noggin蛋白、Forskolin、A83-01和Y-27632二盐酸盐;
所述基础培养基与条件培养基的体积比为3:2,所述Wnt-3A条件培养基和Rspo-1条件培养基的体积比为3:1;所述肝胆系统肿瘤类器官培养基中,青链霉素的浓度为100U/mL,谷氨酰胺的浓度为2mM,HEPES的浓度为10mM,B27的体积浓度为2%,N2添加剂的体积浓度为1%,N-乙酰半胱氨酸的浓度为1.25mM,烟酰胺的浓度10mM,Gastrin I的浓度为10nM,EGF的浓度为50ng/mL,FGF10的浓度为100ng/mL,HGF的浓度为25ng/mL,重组人Noggin蛋白的浓度为50ng/mL,Forskolin的浓度为10μM、A83-01的浓度为2.0μM,Y-27632二盐酸盐的浓度为10μM。
肝胆系统肿瘤类器官培养基的制备方法:
(1)参照ATCC细胞系LWnt-3A(CRL-2647)说明书制备Wnt-3A条件培养基;
(2)参照Trevigen细胞系HA-R-Spondin1-Fc 293T(3710-001-01)说明书制备Rspo-1条件培养基;
(3)按上述计量比和浓度,在无菌条件下向Advanced DMEM/F12中依次加入青链霉素、谷氨酰胺和HEPES,混合均匀后,再加入Wnt-3A条件培养基、Rspo-1条件培养基、B27、N2添加剂、N-乙酰半胱氨酸、烟酰胺、Gastrin I、EGF、FGF10、HGF、重组人Noggin蛋白、Y-27632二盐酸盐、A83-01和Forskolin,搅拌混合均匀;
(4)培养基配好后于2-8℃保存,使用时间不超过4周。
实施例2HCC类器官的培养
收集2019年9月至2021年3月在南京医科大学第一附属医院肝胆中心接受手术的肝癌患者肿瘤切除标本,分别将每个患者的肝癌和癌旁正常肝组织分成4份,1份液氮长期保存,1份经甲醛固定后石蜡包埋,1份-80℃保存,1份用于类器官培养。
HCC类器官的培养方法:
(1)组织消化:用剪刀将HCC肝癌组织剪碎后转移至15mL离心管,肝脏组织消化液(Gibco,17703034)37℃消化60-90min后,300g离心3min,弃上清,AdvancedDMEM/F12洗2遍,转移细胞至1.5mL EP管;
(2)细胞接种:在细胞沉淀中加入基质胶BME2(R&D,3533-010-02),混匀,吸取30μL接种到低吸附24孔板,37℃静置15min待BME2凝固后,加入600μL实施例1制备的肝胆系统肿瘤类器官培养基,于37℃、5%CO
(3)类器官传代培养:10-14d后,转移类器官至EP管,DispaseⅡ(Gibco,17105041)消化15min以去除BME2,离心,TrypLE Express(Gibco,12605028)加入细胞沉淀继续消化5min,1:3-1:5传代,每隔6-8d传代。
将能够连续传代5代以上,且液氮冻存后复苏能够继续保持良好生长状态的类器官判定为构建成功。采用实施例2的培养方法,我们成功构建了18例HCC类器官(构建成功率为40.6%,高于文献报道的26%和29%),图1中的T12_ORG、T13_ORG、T36_ORG、T55_ORG、T60_ORG、T69_ORG、T70_ORG、T72_ORG、T77_ORG、T113_ORG、T118_ORG、T124_ORG、T127_ORG、T128_ORG、T133_ORG、T141_ORG、T143_ORG、T150_ORG对应的就是培养的18例不同患者来源的HCC类器官的显微镜图(×200),可以看出,不同患者来源的HCC类器官形态差异很大。T12_ORG、T36_ORG、T60_ORG、T113_ORG、T127_ORG、T143_ORG可见厚壁的腺腔样结构形成;T13_ORG、T70_ORG、T72_ORG、T124_ORG、T128_ORG及T150_ORG中间亦有管腔样结构形成,但管腔直径较小,在T70_ORG的空腔中间可见胆汁样物质分泌;T55_ORG、T69_ORG及T77_ORG表现为致密的实心型球体结构;T118_ORG表现为表面带有毛刺的中空腺腔样结构;T133_ORG表现为松散的不规则形态;T141_ORG形态不规则,但结构致密,部分类器官中间亦可形成腺腔样结构。
对比例1正常胆管类器官的培养
由于目前培养正常肝脏细胞(Hepatocyte)类器官难度较大,现有条件利用癌旁肝组织培养的类器官均来源于胆管细胞,因此,特利用部分患者的癌旁正常肝组织用同样方法培养正常胆管类器官作为实施例2培养的HCC类器官的对照。
正常胆管类器官的培养方法:
(1)组织消化:用剪刀将癌旁正常肝组织剪碎后转移至15mL离心管,肝脏组织消化液(Gibco,17703034)37℃消化60-90min后,300g离心3min,弃上清,AdvancedDMEM/F12洗2遍,转移细胞至1.5mL EP管;
(2)细胞接种:在细胞沉淀中加入基质胶BME2(R&D,3533-010-02),混匀,吸取30μL接种到低吸附24孔板,37℃静置15min待BME2凝固后,加入600μL实施例1制备的肝胆系统肿瘤类器官培养基,于37℃、5%CO
(3)类器官传代培养:7-10d后,转移类器官至EP管,DispaseⅡ(Gibco,17105041)消化15min以去除BME2,离心,TrypLE Express(Gibco,12605028)加入细胞沉淀继续消化5min,1:3-1:5传代,每隔6-8d传代。
将能够连续传代5代以上,且液氮冻存后复苏能够继续保持良好生长状态的类器官判定为构建成功。
采用对比例1的方法,构建了两例正常胆管类器官,图1中的Chol_12_ORG和Chol_118_ORG对应的就是两例不同患者来源的正常胆管类器官的显微镜图(×200),可以看出,显微镜下观察到正常胆管类器官均为空泡样囊状结构,形态规则,薄壁,透光性强。
1.指纹分析鉴定
实验方法:提取实施例2中每一例构建成功的HCC类器官及相应肝癌组织的基因组DNA,送广州赛库生物技术有限公司进行指纹鉴定,对HCC肝癌类器官与相应肝癌组织的21个STR位点及AMLEO位点进行比对,并计算两者之间的匹配率(match rate,MR),MR>80%视为肝癌类器官和肝癌组织来源于同一个患者;同时,计算不同的HCC类器官之间的MR,证实有无交叉污染。
实验结果:DNA指纹分析结果显示,HCC类器官与来源肝癌组织的STR匹配率均为85%以上,而HCC类器官与其他肝癌组织的STR匹配率均低于46%。DNA指纹分析结果证明我们构建的HCC类器官与相应肝癌组织为同一生物学来源,且不同患者来源的HCC类器官细胞系无交叉污染。
2.全外显子组测序(WES)分析实施例2构建成功的HCC肝癌类器官与相应肝癌组织基因组DNA,研究肝癌类器官能否保留相应肝癌组织的遗传特性,WES由广州基迪奥生物技术有限公司完成。
图2为实施例2培养的HCC肝癌类器官与相应肝癌组织基因组DNA的SNP相关性分析结果。结果显示,HCC类器官与来源肝癌组织中单核苷酸变异(Single nucleotidevariants,SNVs)具有有高度一致性,两者之间的一致率为87.1%-94.4%。进一步深度分析显示,一些肝癌中常见的突变基因,如TP53,TP53,AXIN1,KEAP1,ATM,JAK1,TSC2及ARID1B等,同时出现在HCC类器官及来源肝癌组织中。这些结果表明,利用本发明的肝胆系统肿瘤类器官培养基构建的HCC类器官能够很好地保留肝癌组织的遗传学变异。
3.对肝癌类器官与相应肝癌组织进行RNA测序,相关性分析研究HCC类器官与相应肝癌组织的表达一致性,RNA测序由广州基迪奥生物技术有限公司完成。
图3为实施例2培养的HCC类器官与相应肝癌组织及癌旁组织的RNA表达谱相关性分析结果,结果显示,不同患者来源的癌旁组织RNA表达谱有较高的均一性,而不同患者来源的肝癌组织RNA表达谱差异很大;HCC类器官与来源肝癌组织RNA表达谱有较高的相关性,而与其他患者的肝癌组织RNA表达谱相关性较低。RNA测序结果表明,利用本发明的肝胆系统肿瘤类器官培养基构建的HCC类器官能够很好的保留肝癌组织的RNA表达谱。
4.组织病理学分析
实验方法:
收集6-8孔构建成功的HCC类器官(T36_ORG、T55_ORG、T72_ORG、T124_ORG),Dispase消化10min后离心,PBS清洗;细胞沉淀用10%福尔马林固定4h后,PBS洗2次;在细胞沉淀中加入50μl预热的低熔点琼脂糖(48℃),混匀后,用移液器慢慢加到预冷的玻片上,使之成为一个球体;70%乙醇固定过夜后,常规石蜡包埋和切片;HE染色HCC类器官和相应肝癌组织切片,观察HCC类器官是否保留相应肝癌组织的组织学特征;免疫组化分析HCC标志物AFP及肝癌干细胞相关分子EpCAM在HCC类器官及相应肝癌组织中的表达情况,研究HCC类器官能否保留这些基因在相应肝癌组织中的特征性表达。
实验结果:
图4为实施例2培养的4例HCC类器官及相应肝癌组织的HE染色图,可以看出,HCC类器官细胞核大、深染、形态不规则,符合恶性细胞的核型;HCC肝癌组织典型的“玫瑰花结”样假腺腔结构可在相应的类器官中找到。
图5为实施例2培养的4例HCC类器官及相应肝癌组织的的免疫组化分析结果,可以看出,AFP和EpCAM等肝癌标志物在HCC类器官与来源肝癌组织中的表达一致。
上述结果表明我们构建的HCC类器官能够很好地保留来源肝癌组织的组织学结构及病理学特征。
5.构建HCC类器官小鼠肝癌原位移植瘤模型(PDO-PDXs)
(1)取5例实施例2培养的HCC类器官(T12_ORG、T13_ORG、T77_ORG、T118_ORG、T133_ORG),Dispase消化去除BME2后,TrypLE Express将HCC类器官消化成单个细胞并计数,用实施例1制备的肝胆系统肿瘤类器官培养基重悬细胞,调整细胞密度为2×10
(2)收集GFP-Luc基因转染的T12_ORG、T13_ORG、T77_ORG、T118_ORG、T133_ORG 5例HCC类器官及1例正常胆类器官Chol_118_ORG,分别接种2×10
图6为实施例2培养HCC类器官及对比例1培养的正常胆管类器官经重组慢病毒CMV-GFP-Luc-Lentivirus感染后的荧光显微镜图,图6中,“Bright field”表示的是在白光下的图像,“Fluorescence field”表示的是在荧光显微镜下的图像,可以看到,含有GFP和Luciferases双重标记基因的重组慢病毒感染类器官72h后,显微镜下观察到几乎所有细胞都发出绿色荧光,说明实施例2培养的类器官慢病毒感染效率高,基因可操作性强。
图7为实施例2培养HCC类器官及对比例1培养的正常胆管类器官接种小鼠皮下后形成的移植瘤图片,可以看出,报告基因转染的HCC类器官接种NCG小鼠皮下6-10周后,小鼠皮下肿瘤长至直径1cm左右,而正常胆管类器官Chol_118_ORG皮下接种后未见肿瘤生长。
将皮下肿瘤切成小块瘤组织接种肝脏28天后,小动物成像系统可观察到小鼠肝脏部位发出强烈信号,HCC类器官肝脏原位移植瘤模型构建成功率为100%。取肝脏肿瘤组织包埋后切片并对切片进行HE染色和免疫组化分析。
图8为HCC类器官、肝脏原位移植瘤PDO-PDXs及来源肝癌组织HE染色图(×200),可以看出,肝脏原位移植瘤PDO-PDXs与HCC类器官及来源肝癌组织(HCC Tissues)具有相似的组织学结构;图9为IHC分析AFP在HCC类器官、肝脏原位移植瘤PDO-PDXs及肝癌组织中的表达(×200),结果显示,HCC肝癌标志物AFP在PDO-PDXs的表达形式和强度与HCC类器官及来源肝癌组织一致。
这些结果表明,实施例2培养的HCC类器官具有高度的致瘤性,且移植瘤模型能够保留来源肝癌组织的组织学结构和病理学特征,为下一步利用HCC类器官皮下移植瘤及肝脏原位移植瘤模型进行体内实验打下了基础。
6.利用HCC类器官建立抗肝癌靶向药物高通量测试平台
(1)收集5例实施例2培养的不同患者来源的HCC类器官(T36_ORG、T55_ORG、T69_ORG、T72_ORG、T124_ORG),消化离心后,加入0.8mL BME2至细胞沉淀中(4×10
(2)3d后换液,每孔加入10μM的药物,以0.1%DMSO作为阴性对照,10%Triton X-100作为阳性对照,不含细胞的BME2孔为空白对照孔,每个药物设3个复孔;
(3)继续培养5d后,加入100μL CellTiter-Glo化学发光细胞活性检测试剂,震荡30min后,多功能酶标仪测定化学发光信号,计算靶向药物对HCC类器官的抑制率;
(4)选取对HCC类器官抑制率大于80%的药物进行倍比稀释,测定不同浓度的靶向药物对HCC类器官的抑制率,计算半抑制浓度(halfmaximal inhibitory concentration,IC50),研究利用HCC类器官作为分子靶向药物测试平台的可行性。
我们选取5例实施例2培养的不同患者来源的HCC类器官(T36_ORG、T55_ORG、T69_ORG、T72_ORG、T124_ORG)对24种抗肿瘤靶向药物进行了初筛,初筛浓度为10μM。初筛结果显示,舒尼替尼(Sunitinb)、瑞戈非尼(Regorafenib)、索拉非尼(Sorafenib)、恩曲替尼(Entrectinib)对5例HCC类器官抑制率均大于80%,替万替尼(Tivantinib)对3例HCC类器官抑制率大于80%,SF2523、瑞伐替尼(Refametinib)对2例HCC类器官抑制率大于80%,而卡博替尼(Cabozantinib)只对其中1例HCC类器官抑制率大于80%,其他药物对HCC类器官的抑制作用较低或完全没有抑制作用。选取对3例及3例以上HCC类器官抑制率大于80%的药物进行倍比稀释后,测定不同浓度的药物对HCC类器官的抑制率并计算IC50。结果见表1:
表1靶向药物对不同患者来源HCC类器官抑制作用的IC50值(μM)
表1显示,恩曲替尼对HCC类器官的IC50值普遍低于肝癌一线靶向药物索拉非尼和二线靶向药物瑞戈非尼,舒尼替尼与瑞戈非尼的抑制作用接近,而替万替尼对不同患者源HCC类器官的IC50值差异较大。
图10为实施例2培养的HCC类器官经靶向药物(10μM)处理5天后的光学显微镜图(×200),结果显示,10μM浓度的恩曲替尼对5例HCC类器官的抑制率达到100%,而相同浓度的舒尼替尼、瑞戈非尼、索拉非尼及替万替尼并不能达到完全抑制,尽管替万替尼对3例HCC类器官的半抑制浓度很低。这些研究表明,利用实施例2培养的HCC类器官作为高通量药物测试平台,再结合我们构建的HCC类器官移植瘤模型进行体内验证,有可能发现新的抗肝癌靶向药物和新的治疗靶点。
实施例3ICC类器官的培养
ICC类器官的培养方法:
(1)组织消化:用剪刀将胆管癌组织剪碎后转移至15mL离心管,肝脏组织消化液(Gibco,17703034)37℃消化60-90min后,300g离心3min,弃上清,Advanced DMEM/F12洗2遍,转移细胞至1.5mL EP管;
(2)细胞接种:在细胞沉淀中加入基质胶BME2(R&D,3533-010-02),混匀,吸取30μL接种到低吸附24孔板,37℃静置15min待BME2凝固后,加入600μL实施例1制备的肝胆系统肿瘤类器官培养基,于37℃、5%CO
(3)类器官传代培养:10-14d后,转移类器官至EP管,DispaseⅡ(Gibco,17105041)消化15min以去除BME2,离心,TrypLE Express(Gibco,12605028)加入细胞沉淀继续消化5min,1:3-1:5传代,每隔6-8d传代。
采用本实施例方法,我们从20例ICC手术切除样本中成功培养出12例ICC类器官,构建成功率为60%,高于文献报道的50%。
实施例3培养的12例ICC类器官的光学显微镜图(×200)见图11,可以看出,不同患者来源的的ICC类器官光学显微镜下形态差异也较大,T59_ORG、T73_ORG、T79_ORG、T92_ORG、T109_ORG、T152_ORG显示为空泡样囊状结构,但又不同于正常胆管类器官,这些ICC类器官形态不规则,囊壁较厚;T78_ORG、T83_ORG、T86_ORG、T125_ORG也显示为空泡样囊状结构,但在空泡中间有筛网状结构形成;而T42_ORG和T61_ORG则表现为致密的不规则形态,结构较小,有的可形成管道样结构。
实施例4复合型肝癌(combined hepatocellular-cholangiocarcinoma,CHC)类器官的培养
CHC类器官的培养方法:
(1)组织消化:用剪刀将CHC肝癌组织剪碎后转移至15mL离心管,肝脏组织消化液(Gibco,17703034)37℃消化60-90min后,300g离心3min,弃上清,AdvancedDMEM/F12洗2遍,转移细胞至1.5mL EP管;
(2)细胞接种:在细胞沉淀中加入基质胶BME2(R&D,3533-010-02),混匀,吸取30μL接种到低吸附24孔板,37℃静置15min待BME2凝固后,加入600μL实施例1制备的肝胆系统肿瘤类器官培养基,于37℃、5%CO
(3)类器官传代培养:10-14d后,转移类器官至EP管,DispaseⅡ(Gibco,17105041)消化15min以去除BME2,离心,TrypLE Express(Gibco,12605028)加入细胞沉淀继续消化5min,1:3-1:5传代,每隔6-8d传代。
采用本实施例方法,我们从6例CHC手术切除样本中构建了3例复合型肝癌(combined hepatocellular-cholangiocarcinoma,CHC)类器官。
实施例4培养的3例CHC类器官的光学显微镜图(×200)见图12,光学显微镜下观察这3例CHC类器官均表现为致密的球体结构,球体中间可见假腺体样结构形成。
实施例5胆囊癌(gallbladder cancer,GBC)类器官的培养
GBC类器官的培养方法:
(1)组织消化:用剪刀将胆囊癌组织剪碎后转移至15mL离心管,肝脏组织消化液(Gibco,17703034)37℃消化60-90min后,300g离心3min,弃上清,Advanced DMEM/F12洗2遍,转移细胞至1.5mL EP管;
(2)细胞接种:在细胞沉淀中加入基质胶BME2(R&D,3533-010-02),混匀,吸取30μL接种到低吸附24孔板,37℃静置15min待BME2凝固后,加入600μL实施例1制备的肝胆系统肿瘤类器官培养基,于37℃、5%CO
(3)类器官传代培养:10-14d后,转移类器官至EP管,DispaseⅡ(Gibco,17105041)消化15min以去除BME2,离心,TrypLE Express(Gibco,12605028)加入细胞沉淀继续消化5min,1:3-1:5传代,每隔6-8d传代。
采用本实施例方法,我们利用2例GBC手术切除样本中构建了2例胆囊癌(gallbladder cancer,GBC)类器官。
实施例5培养的2例GBC类器官的光学显微镜图(×200)见图13,光学显微镜下GBC类器官表现为厚壁的腺腔样管道结构。
- 一种用于肝脏类器官培养的全小分子培养基及其用途
- 一种活检肠道肿瘤类器官的培养、传代、冻存和复苏方法及其应用
- 一种肿瘤干细胞培养基、分选方法和抑制其分化为肿瘤源性免疫细胞的方法
- 一种用于培养腹水来源肿瘤类器官的添加剂、培养基及培养方法
- 一种食管癌肿瘤类器官培养用的培养基及培养方法
