基于CMK-3@AuNPs及ATRP信号放大策略的新型DR1电化学检测试剂盒
文献发布时间:2024-04-18 20:00:25
技术领域
本发明涉及一种基于纳米复合材料CMK-3@AuNPs及原子转移自由基聚(ATRP)信号放大策略的新型桥本甲状腺炎标志物DR1电化学检测试剂盒及使用方法和应用,属于生物分析技术领域。
背景技术
桥本甲状腺炎(Hashimoto’s Thyroiditis,HT),也称慢性淋巴细胞性或自身免疫性甲状腺炎,是目前最常见的自身免疫性甲状腺疾病。HT合并甲状腺癌的发病率呈逐年上升趋势,HT患者的癌变率是非桥本氏甲状腺炎患者的1.68倍。转录下调因子1(Down-regulator of transcription 1,DR1)是与HT密切相关的疾病标志物。因此,DR1的高灵敏检测对于HT的早期筛查、监测疾病进展以及提高治疗效果等方面具有重要意义。
目前,常见疾病标志物的检测方法有:免疫细胞化学法、酶联免疫吸附法、电化学传感法等。在这些方法中,电化学传感法因其特异性强、响应速度快、成本相对较低、便携性好等的优点,已广泛应用于靶分子的快速检测、临床诊断和分子医学等领域。但是基于1:1靶信号识别的电化学方法限制了传感器的广泛适用性,因此为了弥补缺陷,进一步提高电化学传感器的灵敏度和准确性,各种信号放大策略被用来提高电化学传感器的检测灵敏度。
发明内容
针对现有技术的不足,本发明的目的是提供一种基于纳米复合材料CMK-3@AuNPs及原子转移自由基聚(ATRP)信号放大策略的新型桥本甲状腺炎标志物DR1电化学检测试剂盒及使用方法和应用。
为了实现上述目的,本发明的技术方案之一是提供基于CMK-3@AuNPs及ATRP信号放大策略的新型桥本甲状腺炎标志物DR1电化学检测试剂盒,包括以下原料:GCE电极、CMK-3@AuNPs纳米复合材料、Ab1、BSA、Ab2、BMP、EDC、NHS、CuBr
进一步,所述的桥本甲状腺炎标志物DR1电化学检测试剂盒还包括PBS缓冲液、LiClO
进一步,使用时需将部分原料调配成不同浓度的溶液,其中,Ab1、Ab2溶液的浓度为1μg/mL,BSA溶液的质量浓度为1%,EDC/NHS混合溶液中EDC的浓度为20mM,NHS的浓度为5mM,BMP溶液的浓度为1mM,CuBr
进一步,CMK-3@AuNPs纳米复合材料的制备方法为:
(1)将50mL1mM HAuCl
(2)在步骤(1)所得溶液中加入10mL 38.8mM柠檬酸三钠溶液,继续保持沸腾状态直至溶液颜色不再变化;
(3)冷却至室温,得到AuNPs混悬液;
(4)将4.8mg CMK-3加入到4mL质量分数2%醋酸溶液中,并在冰水浴中超声处理2h,直至获得均匀分散的混悬液;
(5)将步骤(3)混悬液和步骤(4)混悬液等体积混合,并将混合体系继续超声处理1h,获得均匀分散的CMK-3@AuNPs纳米复合材料混悬液。
本发明的技术方案之一是提供一种所述桥本甲状腺炎标志物DR1检测试剂盒的使用方法,包括以下步骤:
(1)将CMK-3@AuNPs纳米复合材料混悬液滴加于GCE电极表面,孵育反应;
(2)将Ab1溶液滴加在步骤(1)所得电极表面,孵育反应;
(3)将步骤(2)所得电极浸泡在BSA溶液中,孵育反应;
(4)将待检测样品溶液滴加于步骤(3)所得电极表面,孵育反应;
(5)将Ab2溶液滴加于步骤(4)所得电极表面,孵育反应;
(6)将步骤(5)所得电极浸泡在活化后的BMP溶液中,孵育反应;
(7)将步骤(6)所得电极浸泡在由CuBr
(8)电化学检测
①将步骤(7)所得电极以超纯水洗涤,而后用氮气吹干;
②将步骤①的电极浸入LiClO
进一步,GCE电极先进行预处理:以0.3μm的氧化铝粉末对GCE电极进行机械抛光,得到光滑平整的电极表面;然后,依次用超纯水、无水乙醇、超纯水进行超声清洗,并在氮气流中干燥。
进一步,步骤(6)中BMP溶液的活化方法为:将BMP溶液和EDC/NHS混合溶液等体积混合,在37℃摇床中活化过夜。
进一步,步骤(1)中的反应温度为36-38℃,反应时间为10-30min;步骤(2)中反应条件为:36-38℃反应过夜;步骤(3)-(7)中的反应温度为36-38℃,反应时间为0.5 -1h。
本发明的技术方案之一是提供一种所述桥本甲状腺炎标志物DR1检测试剂盒在检测桥本甲状腺炎标志物DR1中的应用。
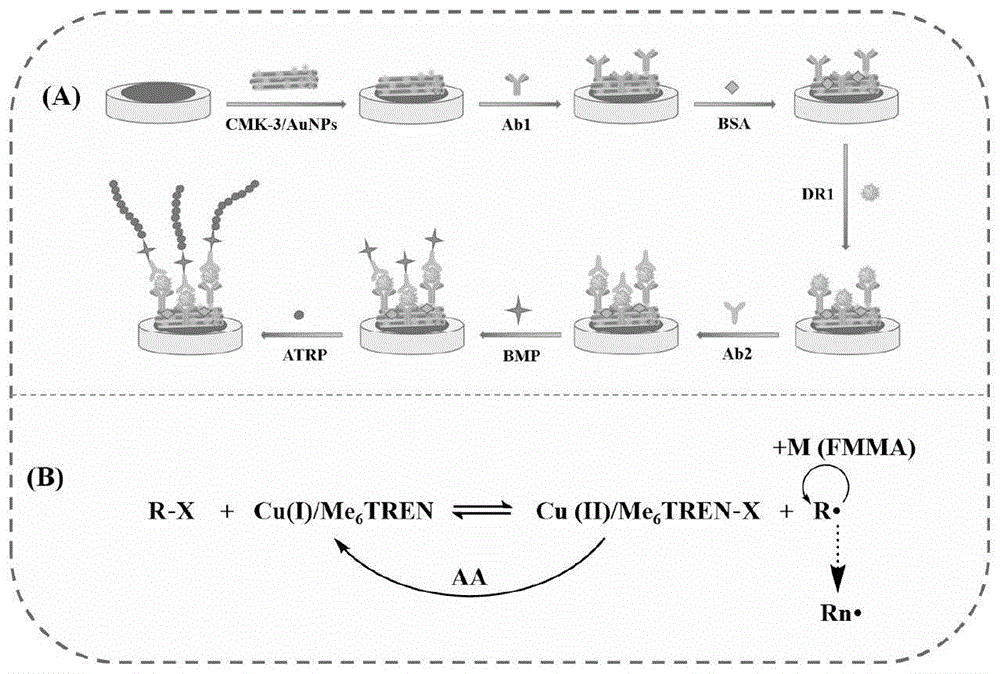
基于CMK-3@AuNPs及ATRP信号放大策略的新型DR1电化学检测试剂盒构建流程如图1A所示。首先CMK-3@AuNPs纳米复合材料在GCE表面形成稳定而致密的电子传导活性层。然后,Ab1通过金氨键连接在电极表面,随后BSA封闭电极表面未结合的非特异性位点。Ab1和Ab2通过抗原-抗体特异性识别捕获DR1,在电极表面形成一个三明治夹心结构。接着,引发剂BMP的羧基被EDC/NHS活化为琥珀酰亚胺酯结构(aBMP)。随后aBMP通过酰胺键修饰在电极表面引发ATRP反应,使大量FMMA单体在电极表面聚合接枝,从而显著增强电化学信号的输出。
ATRP的反应机理如图1B所示。以有机卤代物R-X作为引发剂,活性种Cu(I)/Me
本发明的有益效果:
1、该试剂盒基于CMK-3@AuNPs及ATRP聚合信号放大策略显著提高了检测灵敏度,同时具有良好的抗干扰性、选择性、稳定性和重现性。
2、该试剂盒具有高效、操作方便、灵敏度高的优点,且在正常人血清中的检测性能良好,有可靠的实际应用价值。
3、在最佳实验条件下,研究了该试剂盒在一定的DR1浓度范围内的分析性能。用不同浓度的DR1检测传感体系的电化学信号强度,发现在5×10
附图说明
图1为本发明检测试剂盒的构建流程图(A),ATRP的反应原理(B)。
图2为可行性分析图。
图3(A)为AuNPs表征的TEM图,(B)为AuNPs表征的UV-Vis图,
(C)为CMK-3@AuNPs纳米复合材料的SEM表征图,(D)为CMK-3@AuNPs纳米复合材料的TEM表征图。
图4为修饰电极的SEM表征图,(A)为裸电极表面图像,(B)为在电极表面修饰CMK-3@AuNPs纳米复合材料后的图像,(C)为ATRP反应后电极表面的SEM图像。
图5为电极逐步修饰的EIS(A)及CV表征图(B)。
图6为电极构建的关键条件优化:CMK-3@AuNPs纳米复合材料的修饰量优化(A)、引发剂BMP的反应时间优化(B)和ATRP聚合的反应时间优化(C)。
图7为不同浓度DR1的电化学信号强度(A)和电化学信号强度与DR1浓度对数的线性关系(B)。
图8为该试剂盒抗干扰能力分析。
图9为该试剂盒选择性(A)和稳定性(B)分析。
具体实施方式
以下结合实施例对本发明的具体实施方式作进一步详细说明。
Ab1为兔抗DR1多克隆抗体,Ab2为鼠抗DR1多克隆抗体,购自生工生物技术有限公司(中国上海)。
实施例1:基于CMK-3@AuNPs及ATRP信号放大策略的新型桥本甲状腺炎标志物DR1电化学检测试剂盒
本发明试剂盒包括以下原料:GCE电极(玻碳电极)、CMK-3@AuNPs纳米复合材料、Ab1、牛血清白蛋白(BSA)、Ab2、2-溴-2-甲基丙酸(BMP)、N-(3-二甲基氨基丙基)-N'-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、CuBr
CMK-3@AuNPs纳米复合材料的制备方法为:
(1)将50mLHAuCl
(2)在步骤(1)所得溶液中加入10mL柠檬酸三钠溶液(38.8mM),继续保持沸腾状态直至溶液颜色不再变化;
(3)冷却至室温,得到AuNPs混悬液并于4℃下避光保存;
(4)将4.8mg有序介孔碳(CMK-3)加入到4mL质量分数2%醋酸溶液中,并在冰水浴中超声处理2h,直至获得均匀分散的混悬液;
(5)将步骤(3)混悬液和步骤(4)混悬液等体积混合,并将混合体系继续超声处理1h,获得均匀分散的CMK-3@AuNPs纳米复合材料混悬液。
使用时需将部分原料调配成不同浓度的溶液,其中,Ab1、Ab2溶液的浓度为1μg/mL,BSA溶液的质量浓度为1%,EDC/NHS混合溶液中EDC的浓度为20mM,NHS的浓度为5mM,BMP溶液的浓度为1mM,CuBr
实施例2:试剂盒的使用方法
(1)电极预处理
以0.3μm的氧化铝粉末对GCE电极进行机械抛光,得到光滑平整的电极表面;然后,依次用超纯水、无水乙醇、超纯水进行超声清洗(每次1min),并在氮气流中干燥;
(2)电极修饰
①将2.5μL CMK-3@AuNPs纳米复合材料混悬液滴加在GCE电极表面,于37℃恒温箱中孵育反应20min后取出,超纯水冲洗电极表面,氮气吹干;
②将5μLAb1溶液(1μg/mL)滴加在步骤①所得电极表面,在37℃恒温箱中孵育反应过夜后取出,随后超纯水冲洗电极表面,氮气吹干;
③将步骤②所得电极浸泡在1% BSA溶液中,在37℃恒温箱中孵育反应30min后取出,超纯水冲洗电极表面,氮气吹干;
④将5μL待检测样品溶液(含DR1 5ng/mL)滴加在步骤③所得的电极表面,在37℃恒温箱中孵育反应1h后取出,超纯水冲洗电极表面,氮气吹干;
⑤将5μLAb2溶液(1μg/mL)滴加在步骤④所得的电极表面,在37℃恒温箱中孵育反应1h后取出,超纯水冲洗电极表面,氮气吹干;
⑥将步骤⑤修饰后的电极浸泡在活化后的BMP(aBMP)溶液中,在37℃恒温箱中孵育反应40min后取出,超纯水冲洗电极表面,氮气吹干;
⑦将步骤⑥修饰后的电极浸泡在由20μL CuBr
其中,步骤⑥中BMP溶液的活化方法为:将BMP溶液(1mM)和EDC/NHS混合溶液(EDC的浓度为20mM,NHS的浓度为5mM)等体积混合,在37℃摇床中活化过夜;
(3)电化学检测
①将步骤(2)所得电极以超纯水洗涤,而后用氮气吹干;
②将步骤①的电极浸入LiClO
实施例3:可行性分析
为了验证该电化学检测试剂盒的可行性,本研究记录了不同修饰电极的电化学信号响应。结果如图2所示,只有完整修饰所有组成部分时,才能在~0.42V电位处观察到明显的电流信号(曲线a),然而当不添加CMK-3@AuNPs(曲线b)、Ab1(曲线c)、DR1(曲线d)、Ab2(曲线e)、BMP(曲线f)以及未进行ATRP聚合(曲线g)时则没有明显的电流响应。这些结果说明每个修饰步骤在实验中都是必不可少的,且该试剂盒用于DR1的检测是可行性的。
实施例4:表征分析
为验证AuNPs是否制备成功,本研究使用透射电子显微镜(TEM)及紫外可见光光谱法(UV-Vis)对AuNPs的表面形貌进行了表征。TEM结果如图3A所示,AuNPs呈现出单分散且分布均匀的球形。UV-Vis结果如图3B所示,在520nm处可观察到AuNPs的紫外特征吸收峰,证明AuNPs制备成功。
为验证CMK-3@AuNPs纳米复合材料是否制备成功,在扫描电子显微镜(SEM)和TEM下观察了CMK-3@AuNPs纳米复合材料的表面结构与形貌。SEM结果如图3C所示,AuNPs均匀吸附在CMK-3表面,形成CMK-3@AuNPs纳米复合材料。TEM结果如图3D所示,可以看出CMK-3具有高度有序的多孔纤维状结构,在碳纳米棒之间产生了大量的空隙,从而为AuNPs提供大量的结合位点,这些结果表明CMK-3@AuNPs纳米复合材料已制备成功。
为验证试剂盒的构建是否成功,用SEM对修饰电极的表面形貌进行表征。结果如图4所示,未修饰的裸电极呈现平坦光滑的表面(图4A);在进一步修饰后,可明显看出CMK-3@AuNPs纳米复合材料吸附在电极表面(图4B);在ATRP聚合反应后,电极表面显示出大量聚合物聚集(图4C)。
为验证试剂盒是否逐步构建成功,使用电化学阻抗谱(EIS)法(图5A)和循环伏安法(CV)(图5B)来敏锐检测固液界面的变化。EIS结果如图5A所示,与裸GCE(~182.89Ω,曲线a)相比,CMK-3@AuNPs修饰到电极上后,R
实施例5:条件优化
对试剂盒检测中涉及的几个重要条件进行了优化,以实现DR1电化学检测试剂盒的最佳检测性能。研究了CMK-3@AuNPs纳米复合材料的修饰量、引发剂BMP的反应时间和ATRP聚合的反应时间对检测信号的影响。
(1)纳米材料的修饰量优化
纳米复合材料在电极表面形成导电薄膜层的性能与该试剂盒检测信号放大的性能有很大关系。因此,本部分研究了CMK-3@AuNPs纳米复合材料修饰量与试剂盒电流响应强度之间的相关性。从图6A中可以看出,电流强度随着纳米复合材料混悬液体积的增加而增加,并在2.5μL时达到最大值。然而,当修饰体积大于2.5μL时,电流强度略微下降。这是由于纳米复合材料薄膜过厚,不能在GCE表面形成完全均匀且紧凑的导电层,降低了电子传导速率。因此,CMK-3@AuNPs纳米复合材料混悬液最佳修饰体积为2.5μL。
(2)引发剂BMP的反应时间优化
BMP作为引发剂是ATRP反应发生的关键之一,以BMP为起点在电极表面接枝大量的电活性聚合物可以有效地增加信号输出,提高检测灵敏度。因此,BMP的反应时间将直接影响到电极表面修饰聚合物链的数量。在本研究中用SWV记录了不同的BMP反应时间对应试剂盒的氧化电流强度变化的影响。如图6B所示,随着BMP反应时间的增加,氧化电流强度逐渐增加而后趋于平稳。这是因为引发剂可以触发ATRP反应的发生,在电极表面逐渐接枝电活性聚合物链,然而,随着BMP反应时间的增加,空间位阻逐渐增加,聚合速率受限。因此,在接下来的研究中,BMP的最佳反应时间设定为40min。
(3)ATRP聚合反应时间优化
电极表面上的二茂铁电活性分子的修饰量直接决定了电化学信号的强度。理论上来说,较长的聚合时间会导致更多的二茂铁电活性分子的富集,但同时也会降低其在实际应用中的效率。因此,研究了聚合反应时间为15~90min内的电化学信号响应的变化。如图6C所示,在前60min内,氧化电流强度随着聚合反应时间的延长而迅速增加。此后,电流强度趋于平衡没有明显变化。这是由于随着ATRP反应的进行,含二茂铁电活性分子的单体FMMA逐渐接枝在电极表面,电化学信号随之增加。但随着聚合物链的动态增长,电极表面空间位阻大大增加,使得聚合反应难以继续进行。因此,在本发明中,60min被选定为ATRP的最佳反应时间。
实施例6:分析性能
在最佳条件下,研究了不同DR1浓度下该试剂盒的电化学响应能力,以评估该试剂盒检测灵敏度。如图7A所示,当DR1浓度从5×10
实施例7:抗干扰能力分析
抗干扰能力也是评估分析方法临床应用潜力的重要参数。因此,为了评估该试剂盒的抗干扰能力,本研究分别用含有5%、10%(v/v)人血清的PBS缓冲液将DR1样品稀释至不同浓度,并将其氧化电流信号与同浓度DR1样品在PBS缓冲液中的信号进行比较。结果如图8所示,对于50pg/mL的DR1样品,分别以5%、10%(v/v)的人血清干扰,其电化学信号分别为DR1样品在PBS缓冲液中所测信号的100.8%、101.6%;对于5ng/mL的DR1样品,分别以5%、10%(v/v)的人血清干扰,其电化学信号分别为DR1样品在PBS缓冲液中所测信号的100.9%、100.4%;对于500ng/mL的DR1样品,分别以5%、10%(v/v)的人血清干扰,其电化学信号分别为DR1样品在PBS缓冲液中所测信号的96.4%、98.5%。上述结果表明,所制备的试剂盒在检测过程中具有较高的抗干扰能力,因此在临床应用中具有很大的潜力。
实施例8:选择性、稳定性和重现性
为了评估该方法对DR1检测的特异性,本研究用该试剂盒对细胞角蛋白片段抗原21-1(CY 21-1)、癌胚抗原(CEA)和肌钙蛋白1(CTnl)进行电化学检测,并将所得结果与DR1检测结果进行对比。从图9A中可以看出,CY 21-1、CEA和CTnl的电化学响应值远低于DR1,其峰值电流分别为DR1峰值电流的18.14%、18.40%、18.31%。由于该试剂盒能够准确区分DR1和其他干扰物,因此这种方法具有良好的选择性,可在复杂环境中对DR1进行检测。
此外,为了研究该传感方法的稳定性,将制作好的电极放置在4℃的冰箱中,14天后取出再次进行电化学检测。SWV检测结果如图9B所示,放置两周后电极的电流强度仍能维持在初始值的95.54%,这表明该试剂盒具有良好的稳定性。
使用组内和组间实验(n=5)研究了该试剂盒的重现性。结果显示组内和组间的RSD分别为4.38%和3.39%,证明所制备的试剂盒具有良好的重现性。
实施例9:实际样品检测
为了探索该试剂盒在临床样本检测中的可靠性,本研究将用该试剂盒与ELISA试剂盒对DR1的检测数据进行了比较。结果如表1所示,该试剂盒测得的结果与ELISA试剂盒检测结果高度吻合,相对误差(RE)小于±5%,表明该策略在临床样本检测中具有良好的可靠性。此外,本研究中7份人血清样品由河南中医药大学第三附属医院提供,已得到河南省中医院伦理委员会的批准。
表1
- 一种基于氧化铜-氧化锡核壳纳米线结构的气敏纳米材料、制备工艺及其应用
- 一种氧化铜掺杂五氧化二钒的纳米纤维的制备方法及其应用
- 一种负载钆和硫化铜的聚乙烯亚胺纳米凝胶及其制备和应用
- 一种检测对乙酰氨基酚的氧化铜/碳纳米管/氮化碳电化学传感器及其制备方法与应用
- 一种纳米化铜粒子抗菌材料的应用
- 黑磷纳米片/硫化铜纳米粒子的纳米复合物及其制备方法和应用
