一种用HPLC分离测定非奈利酮对映异构体的方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及一种用HPLC分离测定非奈利酮对映异构体的方法,属于分析化学技术领域。
背景技术
非奈利酮(Finerenone,BAY94-8862),是由拜耳公司研发的一种非甾体选择性盐皮质激素受体拮抗剂,在临床前研究中显示可阻断盐皮质激素受体过度激活导致的有害影响。在糖尿病患者中,盐皮质激素受体过度激活被认为会导致慢性肾病进展和心血管受损,这可能由代谢、血流动力学或者炎症和纤维化等因素驱动。
非奈利酮的分子式:C
非奈利酮存在一个手性中心,在化学合成中,由非奈利酮消旋体经拆分得到。
故易产生一个对映异构体杂质。该杂质分子式:C
上述对映异构体杂质在样品中普遍存在,被列为非奈利酮的工艺杂质,影响非奈利酮原料药和其制剂产品的品质;因此,该杂质的分析检测对终产品非奈利酮的质量控制有着重要作用。
目前,该产品在现阶段没有可参考的异构体分析方法,阻碍了该产品的应用与推广。因此,建立一种操作简单、稳定有效的分析检测方法用于非奈利酮对映异构体的分析检测是非常必要的。
发明内容
为了准确反映非奈利酮原料药或制剂中对映异构体的含量,可以为质量标准的制定提供合理的依据,以便能够更好的控制和掌握产品质量,从而提高临床用药的安全性,本发明提供了一种用HPLC分离测定非奈利酮对映异构体的方法。该检测方法具有快速简便、分离度好、灵敏度高的优点,适合医药工业上非奈利酮对映异构体的检查及质量控制。
本发明采用的技术方案是:
一种用HPLC分离测定非奈利酮对映异构体的方法,包括如下步骤:色谱柱采用多糖衍生物涂敷型手性色谱柱,低级烷烃与低级醇混合液为流动相,通过高效液相色谱法,紫外检测器对非奈利酮对映异构体进行分离测定。
以硅胶表面涂敷有直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)为填充剂;以低级烷烃与低级醇与碱性添加剂混合比为流动相,等度洗脱;流速为0.6~0.8ml/min,柱温为30~40℃,采用紫外检测器进行检测,所述紫外检测器的检测波长为245~255nm。
所述的填充剂为硅胶表面涂敷有直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)。
所述的手性色谱柱选自大赛璐AD-H柱(
所述的低级烷烃为正己烷。
所述的低级醇为异丙醇、无水乙醇;异丙醇和无水乙醇均能使两种物质达到基线分离,选择异丙醇时,主峰保留时间靠后,拖尾因子增大,理论板数降低,故优选无水乙醇。
所述的流动相为低级烷烃、低级醇、碱性添加剂的混合,正己烷-无水乙醇按照体积比88:12~65:35,碱性添加剂的添加量占流动相总体积的0%~0.1%,非奈利酮与异构体的分离度随无水乙醇比例增加而减小,无水乙醇比例是12%时,此时非奈利酮与异构体的分离度大,但主峰保留时间较晚,无水乙醇比例是35%时,异构体与溶剂峰的分离度为1.5,流动相中加不加碱性添加剂以及碱性添加剂的种类对非奈利酮及异构体的保留时间、分离度、理论板数和拖尾因子等并无明显影响;故优选正己烷-无水乙醇(80:20)。
所述的流速为0.6~0.8ml/min,优选0.7ml/min。
所述的柱温为30~40℃,优选35℃。
所述的紫外检测器的检测波长为245~255nm,本品经紫外扫描,最大吸收在250nm,故优选250℃。
与现有技术相比,本发明的有益效果如下:
本发明通过综合考虑分析柱、流动相、洗脱程序以及流速、柱温对分离检测的综合影响,使得检测结果达到了最优化,可以将非奈利酮中的对映异构体在同一色谱条件进行快速高效的分离,并且该检测方法灵敏度高、专属性强、快速简便、操作方便,可有效控制药品的质量,适用于分离检测非奈利酮的对映异构体。
附图说明
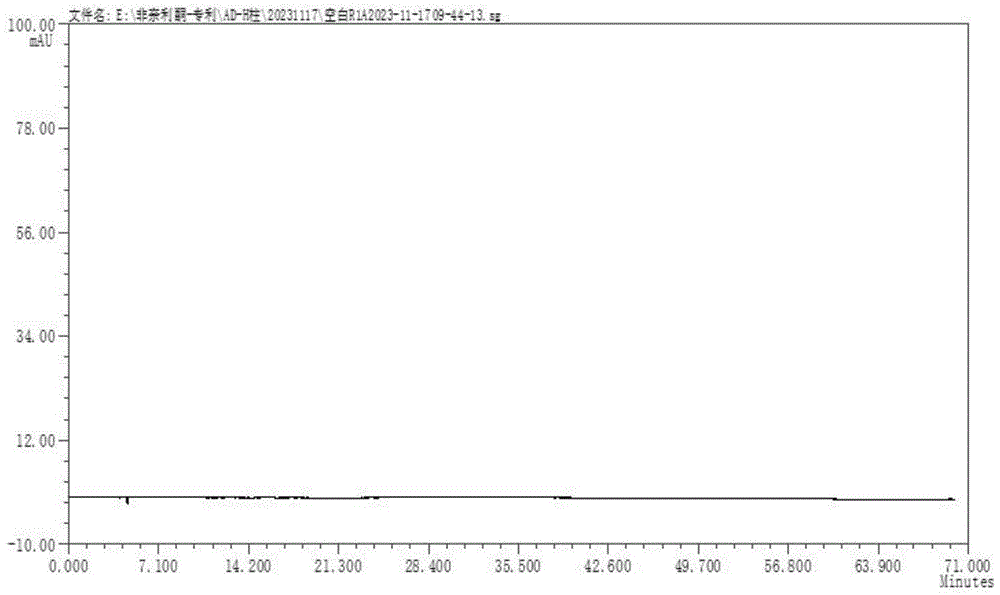
图1为按实施例1条件检测的空白溶液的色谱图;
图2为按实施例1条件检测的系统适用性溶液的色谱图;
图3为按实施例1条件检测的供试品溶液的色谱图;
图4为按实施例1条件检测的定量限溶液的色谱图;
图5为按实施例1条件检测的检测限溶液的色谱图;
图6为按实施例2条件检测的系统适用性溶液的色谱图【流动相比例-正己烷-无水乙醇(88:12)】;
图7为按实施例2条件检测的系统适用性溶液的色谱图【流动相比例-正己烷-无水乙醇(65:35)】;
图8为按实施例3条件检测的系统适用性溶液的色谱图(柱温-30℃);
图9为按实施例3条件检测的系统适用性溶液的色谱图(柱温-40℃);
图10为按实施例4条件检测的系统适用性溶液的色谱图(流速-0.6ml/min);
图11为按实施例4条件检测的系统适用性溶液的色谱图(流速-0.8ml/min);
图12为按实施例5条件检测的系统适用性溶液的色谱图(低级醇的选择-无水乙醇);
图13为按实施例5条件检测的系统适用性溶液的色谱图(低级醇的选择-异丙醇);
图14为按实施例6条件检测的系统适用性溶液的色谱图(碱性添加剂的选择-正己烷-无水乙醇-二乙胺(80:20:0.1));
图15为本发明中按实施例6条件检测的系统适用性溶液的色谱图(碱性添加剂的选择-正己烷-无水乙醇-乙醇胺(80:20:0.1));
图16为按实施例7条件检测的系统适用性溶液的色谱图(色谱柱的选择-CHIRALPAKAY-H,250×4.6mm,5μm);
图17为按实施例7条件检测的系统适用性溶液的色谱图(色谱柱的选择-CHIRALCELOD-H,250×4.6mm,5μm)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
色谱条件如下:
色谱柱:CHIRALPAKAD-H4.6mm×250mm5μm;
流动相:己烷-无水乙醇(80:20),V/V;
柱温:35℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品(非奈利酮对应异构体对照品)25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述的稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮工作对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂溶解并稀释至刻度,摇匀,即得。
供试品溶液:取非奈利酮25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀。
非奈利酮对照品贮备液:取非奈利酮对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得。
定量限溶液:精密量取所述异构体对照品贮备液及所述非奈利酮对照品贮备液各1ml至100ml量瓶中,加稀释剂稀释至刻度,摇匀,精密量取1ml至25ml,加稀释剂稀释至刻度,摇匀,即得。
检测限溶液:精密量取所述定量限溶液5ml置10ml量瓶中,加稀释剂稀释至刻度,摇匀,即得。
测定:分别将空白溶液(即稀释剂)、系统适用性溶液、供试品溶液、定量限溶液和检测限溶液注入高效液相色谱仪进行检测,记录色谱图。
空白溶液、系统适用性溶液、供试品溶液、定量限溶液和检测限溶液的色谱图分别如图1、2、3、4和5所示,可知,图1表明空白不干扰异构体检查;图2表明异构体和非奈利酮之间分离度良好,具体非奈利酮系统适用性图谱数据见表1;图3表明自制的非奈利酮样品中未检出异构体;图4表明异构体的定量限为0.04wt%;图5表明异构体的检测限为0.02wt%,低于异构体的限度0.15wt%;本法的检测灵敏度高。
表1实施例1中非奈利酮系统适用性图谱数据表
实施例2
采用实施例1相同的色谱柱,柱温、流速、流动相,仅变化流动相的比例,分别在流动相正己烷-无水乙醇(88:12~65:35)件下分离检测非奈利酮及异构体。
色谱条件如下:
色谱柱:CHIRALPAKAD-H 4.6mm×250mm 5μm;
流动相:正己烷-无水乙醇(88:12~65:35);
柱温:35℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图6、7。
结果表明,在上述色谱条件下,基线平稳,非奈利酮与异构体的分离度随无水乙醇比例增加而减小,无水乙醇比例是12%时,此时非奈利酮与异构体的分离度大,但主峰保留时间较晚,无水乙醇比例是35%时,异构体与溶剂峰的分离度为1.5,本发明在流动相正己烷-无水乙醇(88:12~65:35)内均可实现二种物质的基线分离。综合分离度、拖尾因子和分析时间等因素,本发明最优选流动相为正己烷-无水乙醇(80:20)条件下进行色谱分离。
表2实施例2中非奈利酮系统适用性图谱(不同流动相比例)数据表
实施例3
采用实施例1相同的色谱柱,柱温、流速、流动相,仅柱温不同,分别在30℃、40℃条件下分离检测非奈利酮及异构体。
色谱条件如下:
色谱柱:CHIRALPAK AD-H 4.6mm×250mm 5μm;
流动相:正己烷-无水乙醇(80:20);
柱温:30℃~40℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述的稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮工作对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂溶解并稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图8、9。
结果表明,在上述色谱条件下,基线平稳,非奈利酮和异构体之间的分离度与实例1无明显差异,本发明在30~40℃内均可实现二种物质的基线分离。综合分析时间及色谱柱使用温度范围(30~40℃)等因素,本发明最优选在35℃柱温下进行色谱分离。
表3实施例3中非奈利酮系统适用性图谱(不同柱温)数据表
实施例4
采用实施例1相同的色谱柱,柱温、流动相比例,仅变化流速,分别在流速0.6ml/min、0.8ml/min条件下分离检测非奈利酮及异构体。
色谱条件如下:
色谱柱:CHIRALPAK AD-H 4.6mm×250mm 5μm;
流动相:正己烷-无水乙醇(80:20);
柱温:35℃;
流速:0.6ml/min~0.8ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述的稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮工作对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂溶解并稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图10、11。
结果表明,在上述色谱条件下,基线平稳,随着流速的降低,各峰的保留时间均略有增加,柱压降低,非奈利酮和异构体之间的分离度与实例1无明显差异,本发明在流速(0.6ml/min~0.8ml/min)内均可实现二种物质的基线分离。综合分离度、分析时间及色谱柱耐压等因素,本发明最优选流速0.7ml/min。
表4实施例4中非奈利酮系统适用性图谱(不同流速)数据表
实施例5
采用实施例1相同的色谱柱,柱温、流动相比例、流速,仅变化流动相中低级醇的种类,分别在流动相正己烷-无水乙醇(80:20)、正己烷-异丙醇(80:20)条件下分离检测非奈利酮及异构体。
色谱条件如下:
色谱柱:CHIRALPAKAD-H4.6mm×250mm5μm;
流动相:正己烷-无水乙醇(80:20)、正己烷-异丙醇(80:20);
柱温:35℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图12、13。
结果表明,在上述色谱条件下,基线平稳,流动相中低级醇的种类不同,非奈利酮及异构体的保留时间和分离度不同,使用异丙醇虽分离度增加但主峰保留时间很晚,拖尾因子增大,理论板数降低;本发明流动相中不同种类低级醇均可实现二种物质的基线分离;综合保留时间、拖尾因子、理论板数等因素,本发明最优选流动相中低级醇为无水乙醇。
表5实施例5中非奈利酮系统适用性图谱(低级醇的选择)数据表
实施例6
采用实施例1相同的色谱柱,柱温、流动相比例、流速,仅变化流动相中碱性添加剂的种类,分别在流动相正己烷-无水乙醇-二乙胺(80:20:0.1)、正己烷-无水乙醇-乙醇胺(80:20:0.1)条件下分离检测非奈利酮及异构体。
色谱条件如下:
色谱柱:CHIRALPAK AD-H 4.6mm×250mm 5μm;
流动相:正己烷-无水乙醇-二乙胺(80:20:0.1)、正己烷-异丙醇-二乙胺(80:20:0.1);
柱温:35℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图14、15。
结果表明,在上述色谱条件下,基线平稳,流动相中加不加碱性添加剂以及碱性添加剂的种类,异构体与非奈利酮的分离度以及峰型并无明显改善,本发明在流动相中加不加碱性添加剂均可实现二种物质的基线分离。考虑到流动相的配置操作简单,本发明最优选流动相中不添加碱性添加剂。
表6实施例6中非奈利酮系统适用性图谱(碱性添加剂的选择)数据表
实施例7
采用实施例1相同的柱温、流动相比例、流速,仅变化色谱柱类型,分离检测非奈利酮及杂异构体。
色谱条件如下:
色谱柱:CHIRALPAK AY-H 4.6mm×250mm 5μm/CHIRALCEL OD-H 250×4.6mm5μm;
流动相:正己烷-无水乙醇(80:20);
柱温:35℃;
流速:0.7ml/min;
检测波长:250nm;
进样量:20μl;
溶液配制:
异构体对照品贮备液:取异构体对照品25mg,精密称定,置50ml量瓶中,加稀释剂溶解并稀释至刻度,摇匀,即得;所述稀释剂为:正己烷-无水乙醇(80:20)(V/V)。
系统适用性溶液:取非奈利酮对照品50mg,精密称定,置100ml量瓶中,精密加入上述异构体对照品贮备液1ml置上述100ml量瓶中,再加稀释剂稀释至刻度,摇匀,即得。
测定:取系统适用性溶液注入高效液相色谱仪,记录色谱图。见图16、17。
结果表明,在上述色谱条件下,基线平稳,不同类型色谱柱,色谱峰分离度有明显差异,OD-H柱非奈利酮与异构体分不开;AY-H柱能分开,但分离度不好且理论板数很低;考虑二种物质的分离度、响应值、理论板数等因素,本发明最优选AD-H柱。
表7实施例7中非奈利酮系统适用性图谱(不同类型色谱柱)数据表
在上述实施例中,异构体是指非奈利酮对映异构体。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种光学测定实验装置及其使用方法
- 光学对点棱镜基座校正装置及其使用方法
- 安装在可佩戴头盔的光学装置和使用方法
- 头盔佩戴检测方法、装置、电子设备及头盔
