细胞治疗产品中复制型逆转录病毒RCR-GALV的检测组合物、方法及试剂盒
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及分子生物检测领域,特别涉及一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测组合物、方法及试剂盒。
背景技术
逆转录病毒(Retrovirus),又称反转录病毒,属于RNA病毒中的一类,它们的遗传信息不是储存在脱氧核糖核酸(DNA),而是储存在核糖核酸(RNA)上。逆转录病毒基因组为二倍体,两条相同的单股正链RNA,其两端为长末端重复序列(LTR),内含有较强启动子和增强子,对病毒DNA的转录调控具有重要作用。病毒核心包含逆转录酶和整合酶。与其他RNA病毒不同之处在于,逆转录病毒的RNA不进行自我复制,进入宿主细胞后,RNA经逆转录酶合成双链DNA,双链DNA被整合酶整合至宿主细胞染色体DNA上形成前病毒,建立终生感染并可随宿主细胞分裂传递给子代细胞。
目前应用于细胞治疗的逆转录病毒均被设计为复制缺陷型病毒载体,缺陷型病毒载体的基因组RNA缺少逆转录病毒复制所需的gag、pol和env序列,理论上大大降低了产生复制型病毒的风险,但是在逆转录病毒载体的生产过程中这些包装元件是必不可少的,因此就有同源重组产生可复制性逆转录病毒的可能性。因为复制型逆转录病毒(RCR)存在的潜在致病性,所以更需要严格的检测以排除基于逆转录病毒载体的人类细胞治疗产品中RCR的存在。
对于逆转录病毒中的长臂猿白血病病毒(GALV)的滴度确定,常规方法是用空斑法测定,空斑法的目的是测定病毒空斑形成单位(PFU,plaque forming unit),用于病毒滴度测定及标定病毒的感染能力。空斑法的操作相对复杂,对实验员的要求也更高,因此实验结果的稳定性会相对较差。
复制型逆转录病毒(RCR)检测:根据目前的研究技术水平,一般采用敏感的指示细胞培养法对γ-逆转录病毒载体进行RCR检测。RCR扩增细胞与待测样本进行共培养以最大程度扩增RCR,在一定传代次数和时间的传代培养后取适量上清接种RCR指示细胞培养,以观察、计数细胞病变集落或者进行RCR标志物的检测,常规方法仅依靠细胞病变效应判断结果,会存在假阳的可能性。
发明内容
本发明的目的在于提供一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测组合物,该检测组合物具有高灵敏度、高特异性的优点。
本发明还提供了一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测试剂盒,利用本试剂盒能够准确、快速的检测样品中GALV的含量。目前所用的γ-逆转录病毒载体很多都是人工改造的逆转录病毒载体,一般在检测时依据所选用的包膜基因来确定对应的阳性对照病毒,因此本发明中所提的阳性对照病毒均为GALV。
本发明解决其技术问题所采用的技术方案是:
一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测组合物,所述检测组合物包括如下检测GALV的引物和探针:
Forwardprimer:AGCAGCAGCTGTTTTACTGGGGTTGGGA,SEQ ID NO:1,
Reverse primer:GCGCTGACTGAGTCTTGGAGGGC,SEQ ID NO:2,探针:5’-FAM-TCGCCATAGATGCTGACCTCCG-BHQ1-3’,SEQ ID NO:3,
一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测试剂盒,该试剂盒包含本发明所述的检测组合物。
作为优选,该试剂盒还包含:GALV阳性对照病毒;GALV敏感细胞,如HEK293细胞;GALV阳性RNA参考品。
作为优选,该试剂盒主要由试剂A和试剂B组成:
试剂A为qPCR反应预混液,包括探针法qPCR专用试剂2×One Step RT-PCR BufferⅢ,TaKaRa Ex Taq HS(5U/μL),PrimeScript RT Enzyme MixⅡ,ROX Reference Dye内参染料,无核酶水,所述的检测GALV的引物和探针;
试剂B为阳性对照,包含GALV阳性RNA参考品,浓度为2E9 copies/μL。
一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测方法,该方法包括以下步骤:
S1、待测样品的扩增及指示培养,提取待测样品的RNA;
S2、采用本发明所述的检测组合物建立荧光定量PCR反应体系;
S3、进行荧光定量PCR检测;
S4、待测样品的结果分析及判断。
作为优选,荧光定量PCR反应体系为20μL,包含15μL的试剂A和5μL的模板;所述模板为待测样品的RNA、阳性对照参考品或阴性对照参考品。
作为优选,所述反应体系的反应条件为:42℃反转录5m,95℃预变性3m;95℃变性5s,55℃退火34s,5个循环;95℃变性5s,60℃退火34s,40个循环。
作为优选,S4中检测结果同时满足以下条件,判定检测结果有效:
阴性对照组没有CPE,且GALV qPCR检测结果为未检出;
阳性对照组有CPE,且GALV qPCR检测结果Ct值<35。
作为优选,S4中,结果判断标准是:
若待测样品的检测结果为未检出且没有CPE,则判定该批次样品未检出复制型逆转录病毒GALV;
若待测样品有Ct值,且Ct值<35且有明显CPE,则判定该批次样品中检出复制型逆转录病毒GALV。
与现有技术相比,本发明的有益效果是:
1、本发明所述的GALV滴度测定方法选用了TCID
相比于TCID
2、本发明所述的长臂猿白血病病毒GALV的检测组合物,其中探针5’端选用FAM荧光报告基团,3’端选用BHQ1荧光淬灭基团;
其中引物探针设计的靶点位于ENV上,因此可以特异性的检出所感染的病毒是否是GALV病毒;
3、本发明所述的长臂猿白血病病毒GALV的检测试剂盒,含有用于检测GALV的阳性对照病毒试剂,通过将受检样品与HEK293细胞共同培养的方式进行扩增,再在PG-4细胞上指示培养后细提取RNA作为样品,并进行荧光定量PCR检测以确定GALV是否检出,检测限为1TCID
本发明所述的长臂猿白血病病毒GALV的检测方法在HEK293细胞上培养21天,期间传代次数不少于5次,然后对培养物进行三冻三融后再在PG-4细胞上指示培养7天,能够有最大程度扩增出其中可能存在的RCR,同时通过收集细胞裂解物上清,传代至PG-4细胞上,通过观察细胞病变CPE来初步判断,并进一步通过实时荧光定量PCR检测,进而提高该检测方法的灵敏度,并特异性地检出GALV。
附图说明
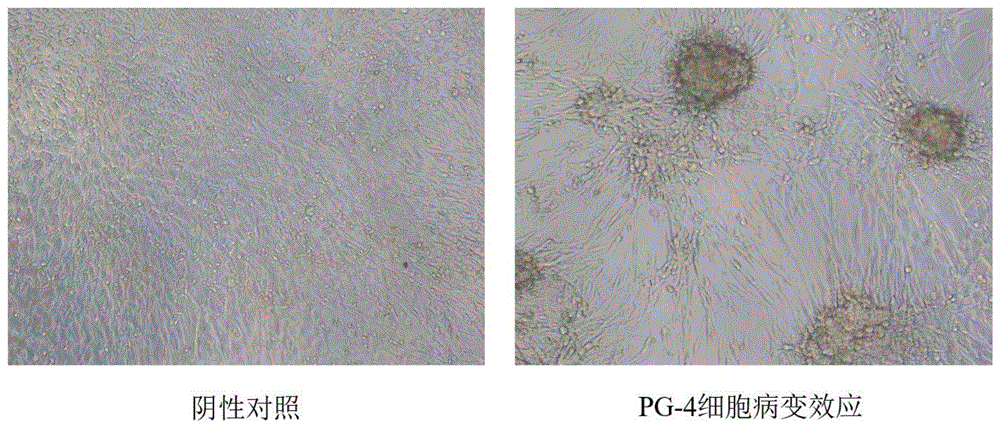
图1为PG-4细胞CPE结果图;
图2为qPCR扩增曲线;
图3为qPCR标准曲线;
图4为RCR检测实验流程图;
图5为1TCID
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
现结合具体实例对本发明作进一步的说明,以下实施例仅是为了解释本发明,但不构成对本发明的限制。在以下实施例中所用到的试验样本及试验过程包括以下内容(如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到)。
本发明实施例中所用的实验材料:
One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)和ROX生产厂家为TAKARA,无核酶水生产厂家为Invitrogen;
HEK293细胞和PG-4细胞来自ATCC细胞库;
DMEM培养基:购自Gibco,货号:11995065;
McCoy’s 5A培养基:购自Gibco,货号:16600-082
胎牛血清:购自ExCell Bio依科赛生物,货号:FND500;
RNA提取试剂盒:购自碧云天,货号:R0035M;
One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)购自TaKaRa(内含ROXReference Dye内参染料),货号:RR390A;
无核酶水购自Invitrogen,货号:10977-015。
实施例1GALV滴度检测
一种GALV病毒感染滴度确定的方法,具体包括如下步骤:
取PG-4细胞悬液进行计数,然后根据计数结果,用含10%胎牛血清的完全培养基将细胞悬液调整到合适的浓度,使细胞量达到2×10
取96孔细胞培养板一块或多块,于孔内滴加稀释好的细胞悬液,每孔50μL,将细胞培养板置37℃,含5%CO2培养箱孵育过夜。
取出所需GALV病毒/供试品,置于室温(10~30℃)进行复融,备用。
按照梯度稀释法,使用无血清的病毒稀释液将病毒/供试品稀释至10
先全部吸去96孔板中培养基。再将稀释好的不同梯度的病毒/供试品稀释液加入96孔板中,50μL/孔,每个稀释度6个重复孔。阴性对照组(Negative Control)加入50μL的无血清稀释液。孵育24h后,然后再补充100μL含有10%血清的完全培养基。将加好的6孔细胞培养板于37±1℃、5%CO
在实验终点通过细胞病变(CPE)判断阴阳性孔并计数,细胞病变效应如图1所示。
根据Reed–Muench公式计算半数感染量(TCID50):
根据Reed–Muench公式,为计算病毒的感染率,引入累积阳性值、累积阴性值和感染率概念,即在稀释度10-7时被感染的单位(阳性)在稀释度10-6时也会被感染。累积值的计算是由最小值向最大值的方向相加得到。通过计算各稀释度的感染率界定50%感染率的稀释点。感染率的计算公式为:
通过确认50%感染率位于的稀释度区间,计算50%感染率稀释点与上下稀释度的比例距离(PD):
计算得
logTCID
最终根据下面公式确定病毒/供试品的感染滴度:
其中A为接种量,单位mL。
实施例2GALV引物探针设计
本发明引物设计靶位点选择理由:复制型逆转录病毒的主要元件有gag、pol、env(编码VSV-G、GALV等)。目前的研究表明env基因相较于gag、pol基因变异较小,而且env基因表达的包膜蛋白决定易感细胞的种类。因此,我们选取GALV的env序列作为检测靶点。再加上GALV是ssRNA病毒,我们将上下游引物囊括的序列合成RNA参考品,更真实的模拟病毒的RNA核酸序列,得到一个更为准确的扩增结果。引物探针序列如下所示:
Forwardprimer:AGCAGCTGTTTTACTGGGGTTGGGA,SEQ ID NO:1,
Reverse primer:GCTGACTGAGTCTTGGAGGGC,SEQ ID NO:2,
探针:5’-FAM-TCGCCATAGATGCTGACCTCCG-BHQ1-3’,SEQ ID NO:3。
选用RNA参考品对引物进行筛选测试,对RNA参考品进行从2.000×10
表1 qPCR反应体系
使用ABI7500PCR仪,根据表2设置qPCR反应程序,在60℃时采集信号。
表2qPCR反应程序
结果如表3所示,引物探针获得的标准曲线R
表3GALV引物探针线性范围检测
UD:undetermined;NA:Notapplicable
该引物探针获得的扩增曲线如图2所示,标准曲线如图3所示。
实施例3精密度检测
精密度是指在规定条件下同一份样品经多次取样测定结果之间的接近程度,一般用相对标准差(变异系数CV%)来表示。进一步评估该检测方法的精密度,选取2×10
表4 GALV qPCR检测精密度
计算所有结果CV%值,均满足CV%<25%,说明该方法精密度良好。
实施例4检测限检测
检测限系指能被检测出的最低量。根据实施例2结果,确定本方法的检测限为STD8(100.000copies/reaction)。选取2×10
表5 GALV qPCR检测检测限
实施例5RCR-GALV检测方法
一种细胞治疗产品中复制型逆转录病毒之一GALV的检测方法,具体检测实验流程图如图4所示,具体包括如下步骤:
S1、待测样品的扩增及指示培养,抽提待测样品的RNA
(1)提前一天准备实验所需的HEK293细胞,接种5×10
阴性对照组:仅加DMEM基础培养基感染细胞样;
供试品组:仅加供试品感染细胞样,供试品体积不得超过30mL;
阳性对照组:加入1TCID
抑制对照组:加入供试品和1TCID
将上述接种物加入后将细胞至于37℃培养箱中培养2~4小时,然后将所有培养瓶中的培养液更换成新鲜的完全培养基。
(2)将接种好的培养瓶放入37℃,5%CO
(3)培养到14~15天时,开始准备指示阶段的PG-4细胞,在第20天铺板对应的六孔板。
(4)培养到第21天时,收集各实验组的细胞悬液,进行三冻(-80℃冻1h或液氮15min)三融(37℃水浴或者金属浴直至溶液彻底融化),使细胞中的病毒完全释放出来,离心(4000rpm,10min)后将收集的上清液接种于PG-4细胞上,孵育2~4小时,然后更换PG-4细胞培养基,继续培养7天,期间可进行一次换液,如出现细胞病变,可提前中止培养,将样本冻存于-80℃,待实验结束一起处理。
(5)对终点产物进行细胞病变效应(CPE)观察,并抽提其RNA用于后续测试。
S2、采用本发明所述的检测组合物建立荧光定量PCR反应体系
将上述提取的RNA作为检测模板,选用实施例2中筛选的引物探针,进行qPCR检测。
所述检测GALV的引物和探针是:
Forwardprimer:AGCAGCTGTTTTACTGGGGTTGGGA,SEQ ID NO:1,
Reverse primer:GCTGACTGAGTCTTGGAGGGC,SEQ ID NO:2,探针:5’-FAM-TCGCCATAGATGCTGACCTCCG-BHQ1-3’,SEQ ID NO:3。
S3、进行荧光定量PCR检测
qPCR反应预混液配置如表1所示,根据表2设置qPCR反应程序,具体方法参见实施例2。
检测可接受标准判定
该检测方法每次实验的标准曲线相关系数(R
该检测方法每次实验的NTC应为阴性,无明显扩增曲线。
反复重复该实验,结果无明显差异,说明不同实验批次之间的结果具有可比性,具有良好的重复性。
S4、待测样品的结果分析及判断
阴性对照组没有CPE,且GALV qPCR检测结果为未检出;
阳性对照组有CPE,且GALV qPCR检测结果Ct值<35。
其中,供试品类型有多种,如EOPC(终末细胞)、UPB(细胞收获液)和CAR-T细胞等。测试EOPC时,在HEK293细胞中加入新鲜培养基,随后加入供试品。检测UPB供试品时,HEK293细胞与样本直接共培养,以避免稀释。根据不同类型的供试品,按照如下公式计算感染细胞使用的供试品量:
UPB检测体积=-初始转导细胞数*MOI/(病毒收获液滴度)*ln(1-0.95)
EOPC/CAR-T细胞检测体积=(1E8 or 1%cell)/(细胞浓度)
阳性病毒GALV加入量为1TCID
如果供试品组qPCR检测为未检出且没有CPE,则供试品中未检出复制型逆转录病毒(GALV),检测结果为阴性。
如果供试品组qPCR检测Ct值<35且有明显CPE,则供试品中检出复制型逆转录病毒(GALV),检测结果为阳性。
如果供试品适用性组qPCR检测Ct值<35且有明显CPE,则供试品对复制型逆转录病毒(GALV)检测无干扰。
如果供试品适用性组qPCR检测为未检出和/或没有CPE,则供试品对复制型慢病毒检测存在干扰,则需通过一些方法,如调整供试品的接种比例消除供试品的影响作用后重新确认供试品的适用性。
RCR-GALV检测结果见表7。
表7RCR-GALV检测结果
本发明所述的细胞治疗产品中复制型逆转录病毒RCR-GALV的检测方法实施了21天至少传代5次的扩增培养阶段,尽可能的让存在的复制型逆转录病毒实现扩增,提高方法的灵敏度;其中,起始的阳性病毒控制在1TCID
实施例6一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测试剂盒
该试剂盒由15μL试剂A和5μL试剂B组成:
试剂A为qPCR反应预混液,具体是:探针法qPCR专用试剂2×One Step RT-PCRBufferⅢ,TaKaRa Ex Taq HS(5U/μL),PrimeScript RT Enzyme MixⅡ,ROX ReferenceDye内参染料,无核酶水,所述的检测GALV的引物和探针;
检测GALV的上下游引物和探针是:
Forwardprimer:CCAACTCCATCACTAGGGGTTC,SEQ ID NO:1,
Reverse primer:TGCTCGTCAAGGTCGCTG,SEQ ID NO:2,
探针:5’-FAM-ACCTTAATCACAATCTCGTAA-BHQ1-3’,SEQ ID NO:3;
试剂B为阳性对照,包含rcAAV8阳性质粒标准品,浓度为4×10
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其它实施例的不同之处,各个实施例之间相同或相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
以上对本发明所提供的一种细胞治疗产品中复制型逆转录病毒RCR-GALV的检测组合物、方法及试剂盒进行了详细介绍。本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 一种区块链交易方法、装置、管理系统、设备及存储介质
- 一种第三方支付方法、装置、设备及介质
- 交易系统的交易验证方法、装置和存储介质
- 一种风险交易识别方法、装置、设备及介质
- 应用于请求方客户端资源流交易方法、装置、设备及介质
- 面向第三方支付的交易方法、系统、装置、设备及介质
- 交易请求处理方法、装置、交易系统、设备及存储介质
