一种鸽圆环病毒亚单位疫苗(大肠杆菌源)抗原制备方法与应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物技术基因工程领域,主要涉及一种重组鸽圆环病毒亚单位疫苗(大肠杆菌源)疫苗抗原的制备与应用。具体地,利用基因重组技术,将鸽圆环病毒流行毒株Cap蛋白的共有序列与通用Thelper 表位串联,并克隆入载体,转化宿主菌,经过发酵、灭活、纯化、乳化工艺制备,得到一种鸽圆环病毒亚单位疫苗(大肠杆菌源)以及该疫苗在预防鸽圆环病毒病中的应用。
背景技术
鸽圆环病毒(Pigeon circovirus,PiCV)是一种主要影响青年鸽的传染性病原,可引起免疫抑制,使病鸽易继发感染其他疾病甚至死亡,严重影响赛鸽的竞翔能力,给养鸽行业造成了巨大的经济损失。PiCV属于圆环病毒科的圆环病毒属,是已知最小的致病性病毒,呈二十面体对称球形,无囊膜,直径为 17~22 nm,基因组由大约1.7~2.3 kb的单链环状DNA组成。PiCV于1993年在美国发现,随后报道于澳大利亚和欧洲的一些国家,加拿大、英国、德国、比利时、意大利、法国等。近年来日本等国家也有PiCV感染的报道。2009年,余旭平等报道了浙江地区的鸽圆环病毒感染病例,2011年,万春和等报道了福建地区的鸽圆环病毒病例,2015年,张志成等报道了中国东部6个省份的鸽圆环病毒流行情况。虽然,病例报道不断增多,但是对该病毒感染的发病机制知之甚少。据报道,PiCV对雏鸽的免疫产生复杂影响,引起雏鸽疾病综合征(YPDS)。2017年,中国台湾学者对淘汰赛鸽中164羽死亡鸽子进行PiCV检测,有96. 95%(159/164)呈PiCV阳性。同年,有学者对收集于安徽、广东、上海及江苏的78份鸽粪便、162份咽拭子及4份饮水样品进行了PiCV检测,其中 57. 69%的粪便、1. 23%咽的拭子及 25%的饮水中检测到PiCV。
圆环病毒侵染生长快速的淋巴细胞等宿主细胞,往往导致机体免疫混乱、免疫力下降,进而引起多种条件性病原的继发感染。在鸽圆环病毒阳性群,通常可见 2~12月龄青年鸽患病,但病死率差异很大,推测受多种因素的影响,包括病毒毒力、感染年龄和继发感染等,继发感染通常是造成死亡的直接原因。病鸽通常表现为嗜眠、厌食、生长发育不良、呼吸窘迫、水样腹泻、飞行能力下降等。组织学表现为淋巴器官(法氏囊和胸腺)萎缩,骨髓再生不良,并可观察到呈球状或粗糙颗粒的嗜碱性包涵体。在一些病例中出现整个囊结构的破坏,其它的病理学变化包括轻度的气囊浑浊,肺、肝、心肌散在的炎性细胞浸润等。由于并发细菌、真菌或病毒感染而出现不同的临床症状。PiCV 既可通过污染的粪便、饲料及饮水等方式水平传播,又可经鸽胚胎垂直传播。目前尚无安全有效的疫苗预防鸽圆环病毒病。
发明内容
本发明以鸽圆环病毒流行毒株Cap蛋白的共有序列与通用Thelper 表位串联融合蛋白作为疫苗框架结构,同时引入6his标签,在大肠杆菌中表达后,经过灭活、蛋白纯化、乳化等工艺,获得具有理想免疫原性的鸽圆环病毒亚单位疫苗(大肠杆菌源)。本疫苗免疫靶动物后可诱导有效的体液免疫和细胞免疫反应。
本发明的目的之一在于提供了一种新的能用于预防鸽圆环病毒病的亚单位疫苗多肽及其疫苗组合物;本发明的目的之二在于提供了所述鸽圆环病毒的构建及获得方法;本发明的目的之三在于提供了能够表达所述鸽圆环病毒亚单位疫苗的基因工程菌株;本发明的目的之四在于提供了所述亚单位疫苗的制备方法;本发明的目的之五在于提供了所述鸽圆环病毒亚单位疫苗(大肠杆菌源)在预防鸽圆环病毒病中的用途。
在第一方面,本发明提供了一种用于预防的鸽圆环病毒亚单位疫苗(大肠杆菌源)的多肽及其组合物。其含有鸽圆环病毒流行毒株Cap蛋白的共有序列与通用Thelper 表位。所述的鸽圆环病毒亚单位疫苗(大肠杆菌源)蛋白或多肽或药学上可接受的盐以及表达抗原表位蛋白所需要的载体。载体也可以包括单独编码各抗原表位的序列,串联可以通过遗传工程方法进行。所述疫苗也包括非免疫活性物质,即为各多肽的连接部分,不具有抗原表位的免疫原性,也不具有任何佐剂活性,主要有纯化标签、接头肽、化学修饰部分、N端信号肽和C端多聚腺苷酸等。所述药学上可接受的盐是指无毒性、刺激和变态反应,适用于人或动物组织的盐。非活性物质和药学上可接受的盐为本领域技术人员所熟知。鸽圆环病毒亚单位疫苗(大肠杆菌源)多肽氨基酸序列如下:
MRGSHHHHHHGMASMTGGQQMGRDLYDDDDKDRWGSMRKKRRQRRRGGVKRGLKLRHVRPRVTRMDVGSGAKFVAAWTLKAAAGDIPGCRRRRIRRRRTRLRRRGHRGSGRIYYFRLRRKDKITLPNDFKFGSGIFTFKLADVLTVGLNAPTLKVPFEDYQIPLVKVDMRPIGKGFGHTVPIYDARLKTFQQQVDLGDDPLMDFDGAKKWELRKGFKRLIRPRPQLTITDLATANQVAATWFSGRNQWIPLQTSGSSLDPTKVVYYGMWFPQKVNHYGLAFSYLHPAPDPMYYECEVTYYVKFRQFAWTALNVPPTPNVQGMELMHICNGDCPQCFADALDPDSAVDSE
在第二方面,本发明提供了一种核苷酸分子,其编码本发明第一方面所述的鸽圆环病毒亚单位疫苗(大肠杆菌源)多肽。本发明中核苷酸可以是RNA形式,DNA 形式,通过人工合成方式合成多抗原表位串联序列,然后经过基因工程操作连接后克隆入载体,转化入大肠杆菌,筛选、发酵、灭活、纯化后获得鸽圆环病毒亚单位疫苗多肽。在本发明中可以对该核酸进行常规的分子生物学操作,如:PCR、限制性内切酶酶切、连接等,核酸设计5’端和3’端均加入酶切位点。优选本发明中的核苷酸序列如下:
ATG CGG GGT TCT CAT CAT CAT CAT CAT CAT GGT ATG GCT AGC ATG ACT GGTGGA CAG CAA ATG GGT CGG GAT CTG TAC GAC GAT GAC GAT AAG GAT CGA TGG GGA TCCAtg cgc aaa aaa cgc cgc cag cgc cgc cgc ggc ggc gtg aaa cgc ggc ctg aaa ctgcgc cat gtg cgc ccg cgc gtg acc cgc atg gat gtg ggc agc ggc gcg aaa ttt gtggcg gcg tgg acc ctg aaa gcg gcg gcg ggc gat att ccg ggc tgc cgc cgc cgc cgcatt cgc cgc cgc cgc acc cgc ctg cgc cgc cgc ggc cat cgc ggc agc ggc cgc atttat tat ttt cgc ctg cgc cgc aaa gat aaa att acc ctg ccg aac gat ttt aaa tttggc agc ggc att ttt acc ttt aaa ctg gcg gat gtg ctg acc gtg ggc ctg aac gcgccg acc ctg aaa gtg ccg ttt gaa gat tat cag att ccg ctg gtg aaa gtg gat atgcgc ccg att ggc aaa ggc ttt ggc cat acc gtg ccg att tat gat gcg cgc ctg aaaacc ttt cag cag cag gtg gat ctg ggc gat gat ccg ctg atg gat ttt gat ggc gcgaaa aaa tgg gaa ctg cgc aaa ggc ttt aaa cgc ctg att cgc ccg cgc ccg cag ctgacc att acc gat ctg gcg acc gcg aac cag gtg gcg gcg acc tgg ttt agc ggc cgcaac cag tgg att ccg ctg cag acc agc ggc agc agc ctt gat ccg acc aaa gtg gtgtat tat ggc atg tgg ttt ccg cag aaa gtg aac cat tat ggc ctg gcg ttt agc tatctg cat ccg gcg cca gat ccg atg tat tat gaa tgc gaa gtg acc tat tat gtg aaattt cgc cag ttt gcg tgg acc gcg ctg aac gtg ccg ccg acc ccg aac gtg cag ggcatg gaa ctg atg cat att tgc aac ggc gat tgc ccg cag tgc ttt gcg gat gcg cttgat ccg gat agc gcg gtg gat agc gaa
在第三方面,本发明提供了一种载体,其除了含有本发明第二方面所述的编码基因鸽圆环病毒亚单位疫苗(大肠杆菌源)核苷酸分子,还含有与该核苷酸序列可操作的连接,在原核细胞表达(转录和翻译)所需的表达控制元件。最基本的表达控制元件包括启动子、转录终止子、增强子,选择性标记等,这些调控元件为本领域所熟知。
在第四方面,本发明提供了一种宿主细胞,其含有本发明第三方面所述的载体。宿主细胞经转化或转染含有本发明所述编码蛋白的基因序列,而后经检测具有良好的的遗传和表达稳定性后,可用于发酵表达生产所需的鸽圆环病毒亚单位疫苗(大肠杆菌源)多肽。
在第五方面,本发明提供了一种鸽圆环病毒亚单位疫苗(大肠杆菌源)的制备方法,其包括以下步骤:工程菌发酵诱导表达鸽圆环病毒亚单位疫苗(大肠杆菌源)多肽,经过灭活、粗纯化与精细纯化工艺以及后续乳化工艺,获得所需要的亚单位疫苗。其中涉及的方法包括但不限制于菌体破碎、包涵体分离、溶解、亲和层析、疏水层析、阴离子交换色谱、反相色谱、乳化等。本发明中涉及的制备方法为本领域技术人员所熟知。
在第六方面,本发明提供了一种用于预防鸽圆环病毒病的鸽圆环病毒亚单位疫苗(大肠杆菌源),其包括本发明第一方面所述的多肽以及药学上可接受的载体。所述亚单位疫苗能够预防鸽圆环病毒病的爆发。本发明所述的药学上可接受的载体为免疫增强剂或免疫佐剂,优选免疫佐剂为进口或国产水佐剂。
在第七方面,本发明提供了第六方面所述的鸽圆环病毒亚单位疫苗(大肠杆菌源)的应用。疫苗可以一定有效剂量肌肉注射,皮内或皮下注射接种动物,能够产生足够有效的体液免疫和细胞免疫反应(见实施例五、六、七)。此外,在本发明的实施方案中,通过对疫苗进行实验室安全性试验,结果表明本发明所述的鸽圆环病毒亚单位疫苗(大肠杆菌源)是安全的(见实施例四)。
另外,需要指出的是,在本申请的上下文的公开内容的基础上,本发明的其他具有实质性特点的方面对本领域的普通技术人来说是显而易见的。此外,本发明亦使用了公开文献,他们的全文内容均纳入本文进行参考。
附图说明
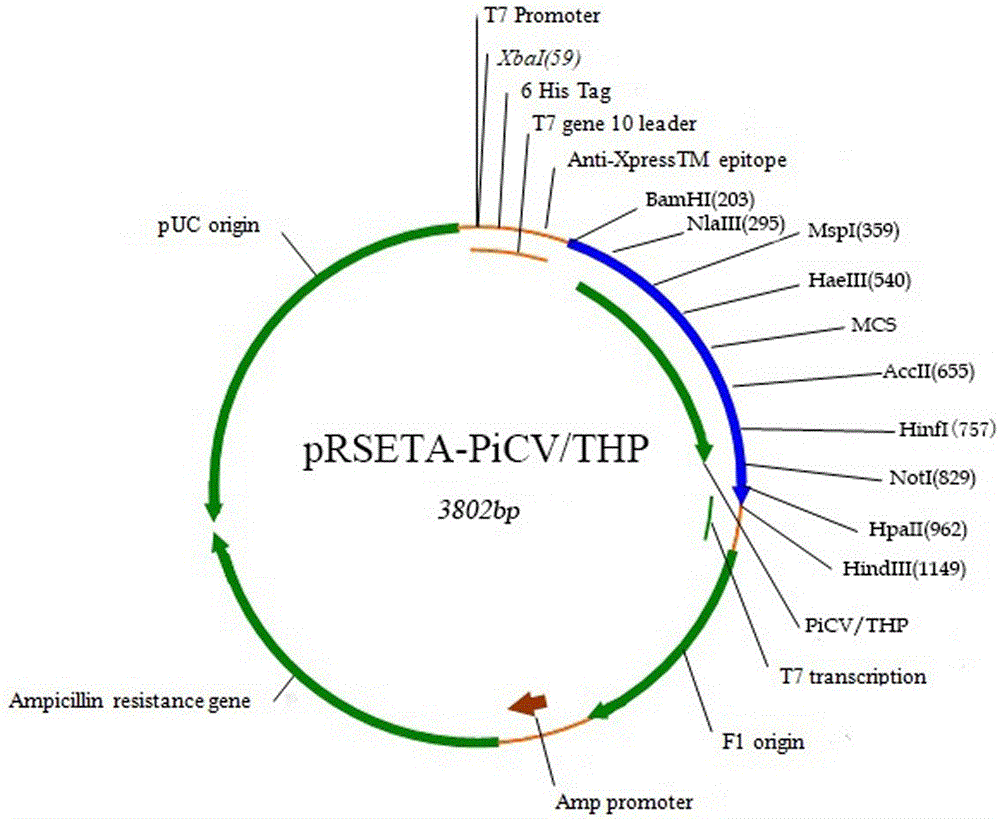
下列附图用于说明本发明的具体实施方案,而不用于限定由权利要求书所界定的本发明范围。图1 鸽圆环病毒亚单位疫苗表达质粒pRSETA-PiCV/THP构建图;图2 pRSETA-PiCV/THP载体质粒酶切图,其中泳道1为DNAmarker,从上至下分子量依次为2000bp、1000bp、750bp、500bp、250bp、100bp,泳道2为空白对照,泳道3为酶切质粒;图3 SDS-PAGE检测图,其中泳道1为蛋白Marker,从上至下依次为97.4KDa、66.2KDa、43KDa、31KDa、20.1KDa、14.4KDa,泳道2为未诱导对照,泳道3为诱导样品,箭头所指为表达的目的蛋白;图4 Westernblot 检测图,其中泳道1为预染marker,从上至下依次为180 KDa、135 KDa、100KDa、75 KDa、63 KDa、48 KDa、35 KDa、25 KDa、17 KDa、11 KDa,泳道2为空白对照,泳道3为目的蛋白;图5为发酵样品SDSPAGE检测图:其中泳道1为蛋白Marker,从上至下依次为97.4KDa、66.2KDa、43KDa、31KDa、20.1KDa、14.4KDa,泳道2为未诱导对照,泳道3为诱导对照,泳道4、泳道5均为发酵诱导样品;图6为发酵纯化样品SDSPAGE检测结果,其中泳道1为预染marker,从上至下依次为180 KDa、135 KDa、100 KDa、75 KDa、63 KDa、48 KDa、35 KDa、25KDa、17 KDa、11 KDa,泳道2为纯化样品。图7 为发酵纯化样品Westernblot 检测图,其中泳道1为纯化阳性对照,泳道2为预染marker,从上至下依次为180 KDa、135 KDa、100 KDa、75KDa、63 KDa、48 KDa、35 KDa、25 KDa、17 KDa、11 KDa,泳道3为发酵纯化样品,泳道4为空白对照。图8为ELISA 方法检测疫苗免疫原性结果;图9为亚单位疫苗免疫鸽血清抗体滴度检测结果;图10为脾脏淋巴细胞转化试验刺激指数。
具体实施方式
实施例中所述的具体试验方法描述仅是示例性描述,用于详细阐述本发明,但并不构成对本发明范围的限制,依据本发明的许多变化为本领域的技术人员所熟知。
实施例一 设计思路
综合分析国内鸽圆环病毒流行株基因组Cap序列及抗原结构,对鸽圆环病毒亚单位疫苗(大肠杆菌源)进行了优化设计。参考GenBank中的序列信息,根据氨基酸序列的相似性,分析各流行毒株TS-YZ2株、JZ7/SN株、HD1/SN株等共有抗原表位,进一步分析抗原表位在不同病毒株中的保守性,设计出符合表达特征的Cap蛋白基因序列,形成疫苗的主要结构。同时为了提高疫苗在实际使用中的免疫效率和抗变异能力,引入了通用Thelper表位,将Cap蛋白的共有序列与通用Thelper 表位串联构建出理想免疫效果的鸽圆环病毒亚单位疫苗(大肠杆菌源)。
实施例二 大肠杆菌表达载体与表达菌株的构建
1 将设计好的多肽编码核苷酸送北京鼎国生物技术公司合成,核苷酸片段两端分别设计了
2 转化:将pRSETA-PiCV/THP置冰上融化,加入2μl连接反应液,再次混匀,冰水浴30分钟,42℃ 30秒,然后迅速放回冰浴1.5分钟,加入1mL LB 培养液,37℃,静置培养1小时,4000g 低温离心10秒钟弃上清,用200μl LB 培养基重悬菌体;将菌液均匀涂布于含有100μg/mL氨苄青霉素的LB 琼脂培养板上,倒置于37℃恒温箱中培养12~16小时,直至克隆形成。
3 鉴定:挑取平板上的单克隆至LB培养基中,37℃,200 rpm震荡培养12小时,提取质粒,分别使用内切酶
4 诱导表达。即将阳性克隆过夜培养,次日早上按1:100转接,培养3小时后,加入0.2mM IPTG,继续培养4小时,制备样品;常规SDS-PAGE 检测目的蛋白表达情况,在40KDa,见到特异性条带为正确克隆(见图3);取正确克隆,放大培养,SDS-PAGE证实表达正确后,使用常规Western-blot 进一步证实其表达准确性(见图4);经过上述构建及鉴定程序后,可将挑选的阳性克隆作为工程菌进行原始种子库、基础种子库和生产种子库的建立,菌种命名pRSETA- PiCV/THP/ BL21(DE3,Plys)。
实施例三 工程菌的发酵、灭活、纯化与乳化
1 发酵 取生产菌种pRSETA- PiCV/THP/ BL21(DE3,Plys),接种于5 mL LB液体培养基中(含100μg/mL氨苄青霉素), 37℃,200 rpm振荡培养10小时活化菌种。再以1:100的接种+量接入摇瓶,37℃振荡培养至OD600=3.5,可按5%比例接种入发酵罐。发酵用培养基为改良LB培养基,用蒸馏水配制。校正溶氧和pH值电极,开启罐体搅拌,转数为350rpm,罐体在线灭菌,待罐内培养液温度降至37.0℃时,标定pH及溶氧(OD)零点。发酵温度为37.0±0.1℃,溶氧控制在35%左右,pH控制在7.0,发酵4小时后加入IPTG (终浓度为0.2mM)诱导表达,连续诱导4个小时后发酵结束,取样做SDS-PAGE检定表达情况(见图5)。
2 灭活 将发酵液排放至灭活罐,按0.3%的终浓度加入甲醛溶液,无菌倒罐后,37℃灭活24小时,灭活结束后取样进行灭活检验,检验合格后收集灭活菌液。
3 纯化 将收集到的菌体,用稀释液混悬后进行高压匀浆破碎。4℃,12000 rpm离心收集包涵体,并用包涵体洗液混悬二次超声洗涤包涵体,二次低温离心收集包涵体。包涵体沉淀用 8M尿素,0.3%β-ME,20mM Tris-cl (pH=8.00)混匀,室温搅拌4小时,8000rpm低温离心30min,弃去沉淀。用pH=8.0的20mM 磷酸缓冲液,0.5M氯化钠,20mM咪唑,平衡上亲和层析柱,用pH=8.0的20mM 磷酸缓冲液,0.5M氯化钠,0.5M咪唑洗脱;即得融合蛋白纯化液。此融合蛋白纯化液就是鸽圆环病毒亚单位疫苗(大肠杆菌源)半成品原液。取半成品原液做SDS-PAGE及Westernblot 检定(见图6、图7)。
4 乳化 将纯化的半成品原液用灭菌的PBS稀释成含有15μg /mL融合蛋白的疫苗水相。按水佐剂1:水佐剂2:疫苗水相 =2:5:93 的比例配制,300转搅拌10min,分装备用。
实施例四 鸽圆环病毒亚单位疫苗(大肠杆菌源)安全性试验
1 试验动物4周龄养殖肉鸽,购自郑州某规模饲养场。试验前对近1~2年周边地区流行的疾病进行调查,对正在发生疾病的区域不能进行试验。不能免疫同类其他疫苗,抗原、抗体检测阴性的鸽子用于免疫试验。
2 疫苗由北京高鸽生物技术有限公司研发中心提供,批号为190113A、190213A、190313A。
试验采用单因子完全随机化的试验设计,随机将40只检验合格的试验动物随机分为4组,3个批号组和对照组,每组10只,组间无体重差异。免疫组于每只鸽腿部肌肉注射疫苗1ml/只,观察至14日,对照组肌肉注射PBS, 1ml/只。免疫后,观察各实验动物的采饲、饮水、精神是否正常、是否有中毒症状、是否产生过敏反应、是否死亡或出现其他异常情况。免疫前及试验结束后,全部动物称重。对称重结果进行统计学分析。
3 结果
3.1 临床观察
3个免疫组动物免疫后均未观察到任何过敏反应或中毒症状,未出现精神委靡、羽毛凌乱无光泽及缩头等反应,采饲、饮水、活动、粪便等一切正常,未出现明显局部炎症等损伤性临床副反应,试验过程中,未发生鸽子死亡现象。
3.2 体重变化
结果见表1,与对照相比,三个免疫组动物体重增长与对照组差异不显著(P>0.05),表明鸽圆环病毒亚单位疫苗(大肠杆菌源)免疫对动物的体重无不良影响。
表1鸽圆环病毒亚单位疫苗(大肠杆菌源)对免疫动物体重变化的影响
实施例五 动物试验分组及免疫
1 疫苗
鸽圆环病毒亚单位疫苗(大肠杆菌源)由北京高鸽生物技术有限公司研发中心提供,批号为190113A、190213A、190313A。
2 试验动物
4周龄养殖肉鸽,购自郑州某规模饲养场。试验前对近1~2年周边地区流行的疾病进行调查,对正在发生疾病的区域不能进行试验。不能免疫同类其他疫苗,抗原、抗体检测阴性的鸽子用于免疫试验。
3 分组与免疫
将4周龄检验合格的肉鸽随机分为4组,3组为免疫组,1组为对照组,5只 /组。免疫组分别肌肉注射疫苗0.5mL/只,对照组免疫PBS,0.5mL/只。分别于免疫后7天、14天、21天、28天翅静脉采血并用于疫苗免疫原性及抗体滴度检测。
另免疫20只肉鸽用于脾脏淋巴细胞转化试验。
实施例六 重组蛋白免疫原性及抗体滴度检测
1 方法 采集首次免疫后的1、2、3、4 周的血清,用终点稀释ELISA 检测特异性IgG抗体。微孔板用纯化的疫苗蛋白包被,2~8℃过夜;5%脱脂牛奶于37℃封闭1h,将采集的抗血清作1:100倍稀释同时用免疫PBS的血清作为阴性对照,加入微孔板,100μL/孔,于37℃孵育1h,然后用兔抗鸽IgG-HRP的酶标二抗(1:10000),加入微孔板,100μL /孔,于37℃孵育1h。TAB 底物避光显色10min,2M H
结果
2.1 免疫原性检测
免疫后第1周,免疫动物与对照动物的抗体水平无差异。免疫后第2周,部分免疫组动物就发生了抗体阳转, 免疫后3 周平均抗体水平达到最高,免疫后4周平均抗体水平有所下降,均明显高于对照组,并呈现显著差异。对照组的鸽血清 OD450值始终在 0.07~0.18 之间波动。首免后3、4周,三个亚单位疫苗免疫组血清OD450值在0.4~0.9 之间波动。(如表2及图8)。
表2 疫苗免疫原性平均抗体检测结果
2.2 抗体滴度检测
由于首免后1周抗体水平较低,未进行抗体滴度检测。首免后2、3、4周,抗体水平上升明显。第3周、4周三个免疫组最终平均抗体水平均达到了1:10
1经鸽脾脏淋巴细胞浓度、ConA浓度筛选试验筛选出的鸽脾脏淋巴细胞转化试验的最佳条件为鸽脾脏淋巴细胞浓度为5×10
2 结果
各组试验鸽在免疫后的不同时间点采集脾脏,检测淋巴细胞刺激指数(SI),结果显示,各免疫组鸽的脾脏淋巴细胞在免疫后,SI逐渐升高,且3、5、7、10 d时免疫均明显高于对照组,在第7天时差异最显著(图10)。以上结果表明,本发明所设计的鸽圆环病毒亚单位疫苗(大肠杆菌源)能够刺激较强的细胞免疫反应。
- 一种焊接夹具和焊接工装
- 一种可调式焊接工装夹具
- 一种焊接工装夹具
- 一种前桥焊接用工装夹具
- 一种用于换热板焊接的工装夹具及用工装夹具的焊接方法
