猪RIG-I样受体LGP2特异性单克隆抗体和应用
文献发布时间:2024-04-18 20:00:50
本发明专利申请是分案申请,原案的申请号为202210680936.8,申请日为2022-06-15,发明名称为猪RIG-I样受体特异性单克隆抗体及其制备方法和应用。
技术领域
本发明属于医学和生物学技术领域,具体涉及猪RIG-I样受体LGP2特异性单克隆抗体和应用。
背景技术
据了解,单克隆抗体技术是现代生命科学研究的重要技术,其在蛋白质的结构与功能研究方面、在人类和动植物的免疫学诊断方面都发挥着无可代替的重要作用。单克隆抗体在疾病预防、临床治疗、疾病诊断及检测中均有众多应用,同时单克隆抗体在生物学研究领域作为研究工具也得到广泛使用。天然免疫是机体防御感染的第一道防线,天然免疫通过一系列模式识别受体(PRR)家族识别来自病原体的各种保守分子从而启动细胞信号和免疫应答。天然免疫RIG-I样受体(RLR)家族是胞浆内的双链RNA(dsRNA)识别受体,在识别和防御病毒尤其是RNA病毒感染中发挥关键作用。RLR家族包括RIG-I、MDA5和LGP2三个成员。
RIG-I是最早发现的RLR原型受体,包括N端的两个半胱天冬酶活化募集结构域(CARDs);中间的RNA解旋酶结构域,能够和C端结构域一起结合RNA;C端的编码自身活化抑制域(RD)或被称为调节结构域(RD),负责识别并结合病毒RNA。没有病毒感染时,RIG-I呈静息状态,活性区CARDs与CTD和RNA解旋酶结构域结合,后者阻止CARDs与修饰蛋白接触活化。RIG-I能够识别5'-三磷酸dsRNA(5'-ppp-dsRNA)和短链dsRNA(<300bp)。RIG-I在抗病毒免疫中发挥重要作用,这些病毒包括大多数单负链RNA病毒,如副粘病毒家族的新城疫病毒(Newcastledisease virus,NDV)、正粘病毒科的流感病毒、弹状病毒科的水疱性口炎病毒(Vesicular stomatitis virus,VSV)和狂犬病病毒(Rabies virus,RV),单正链RNA病毒如日本脑炎病毒(Japanese encephalitis virus,JEV),以及一些DNA病毒如腺病毒和痘苗病毒等。
MDA5与RIG-I具有相似的分子结构,包括N端的两个半胱天冬酶活化募集结构域(CARDs);中间的RNA解旋酶结构域,能够和C端结构域一起结合RNA;C端的编码自身活化抑制域(RD)或被称为调节结构域(RD),负责识别并结合病毒RNA。没有病毒感染时,MDA5呈静息状态,活性区CARDs与CTD和RNA解旋酶结构域结合,后者阻止CARDs发生活化。MDA5优先识别长的双链RNA(dsRNA)(>1000bp)。MDA5同样在抗病毒免疫中发挥重要作用,这些病毒主要为小核糖核酸病毒科的病毒如脑心肌炎病毒(EMCV),还有呼肠孤病毒科病毒如轮状病毒(Rotavirus)等。
LGP2缺少N端的信号活性区域(CARDs),但其能够与配体dsRNA高亲和力结合,发挥重要的调控功能。在RIG-I和MDA5信号介导的抗病毒免疫中,LGP2发挥的确切调控功能和作用机制尚未明晰,另外LGP2在细胞免疫应答中的作用及机制研究更需要进一步深入。
猪是非常重要的经济动物,但由于缺乏商业化的猪RLR蛋白RIG-I、MDA5和LGP2抗体工具,也没有猪RLR单克隆抗体的文献报道(现有RLR蛋白抗体都是人和鼠RLR的抗体,与猪RLR蛋白的交叉反应性没有测试数据,并不能与猪RLR蛋白进行反应),猪RLR蛋白功能相关研究非常缺乏。此外,猪还是包括传染病在内的多种人类疾病非常有前途的动物模型,因此研制出能区分猪和人RLR的特异抗体来研究其种属差异显得非常必要。
发明内容
本发明针对所要解决的技术问题,克服现有技术的不足而提供一种猪RIG-I样受体LGP2特异性单克隆抗体和应用。
本发明鉴于RLR包括猪RLR在抗病毒中的关键作用,为了弥补猪RLR商业化抗体的空白,使用细胞融合杂交瘤技术制备猪RLR所有三种蛋白的特异性单克隆抗体,将获得的猪RLR单克隆抗体成功用于各种免疫学试验,并可以用于猪和人RLR的比较免疫学研究。
本发明提供了猪RIG-I样受体特异性单克隆抗体,所述猪RIG-I样受体特异性单克隆抗体为猪LGP2蛋白特异性单克隆抗体,所述猪LGP2蛋白特异性单克隆抗体由杂交瘤细胞株pLGP2 mAb A1-3或杂交瘤细胞株pLGP2 mAb B9-2产生,所述杂交瘤细胞株pLGP2 mAbA1-3的保藏编号为CCTCC NO:C2022135,所述杂交瘤细胞株pLGP2 mAb B9-2的保藏编号为CCTCC NO:C2022136。
本发明提供了猪RLR家族三种蛋白的特异性单克隆抗体,与人RLR无交叉反应,只与猪RLR发生反应。本发明针对猪RIG-I样受体(RLR)家族成员RIG-I、MDA5和LGP2的特异单克隆抗体为猪RLR研究提供特定有用工具。已经成功地应用于各种免疫学试验,包括酶联免疫吸附试验(ELISA)、蛋白质印迹(WB)、免疫荧光(IFA)和免疫组织化学(IHC)实验,可以应用于猪RLR蛋白的检测和RLR蛋白抗病毒功能研究。此外,猪特异性RLR蛋白单克隆抗体还可以用于猪和人RLR的种属特异性比较免疫学研究。
本发明进一步的技术方案如下:
优选地,所述猪RIG-I蛋白特异性单克隆抗体能够识别RIG-I蛋白的C端Δ2CARDs片段(201-943aa),所述猪MDA5蛋白特异性单克隆抗体能够识别MDA5蛋白的C端Δ2CARDs片段(201-1023aa),所述猪LGP2蛋白特异性单克隆抗体能够识别LGP2蛋白的N端L1(1-200aa)片段。
优选地,所述猪RIG-I蛋白特异性单克隆抗体、猪MDA5蛋白特异性单克隆抗体、猪LGP2蛋白特异性单克隆抗体均为IgG2b的同型免疫球蛋白。
本发明还提供一种猪RIG-I样受体特异性单克隆抗体的制备方法,包括以下步骤:
步骤1、从猪肺泡巨噬细胞中提取总RNA,经反转录扩增得到猪RIG-I、猪MDA5、猪LGP2的编码基因,猪RIG-I、猪MDA5、猪LGP2的编码基因分别经过原核表达、纯化后获得猪pRIG-I蛋白、猪pMDA5蛋白、猪LGP2蛋白;
步骤2、利用猪pRIG-I蛋白、猪pMDA5蛋白、猪LGP2蛋白分别对动物进行免疫,分离出脾细胞与骨髓瘤细胞进行细胞融合,筛选出阳性的杂交瘤细胞株pRIG-I mAb、pMDA5mAb、pLGP2 mAb A1-3、pLGP2 mAb B9-2;
步骤3、在动物腹腔内分别接种杂交瘤细胞株pRIG-I mAb、pMDA5 mAb、pLGP2 mAbA1-3、pLGP2 mAb B9-2,将动物腹水液分离、纯化制备猪RIG-I蛋白、猪MDA5蛋白、猪LGP2蛋白特异性单克隆抗体。
本发明利用细胞融合杂交瘤技术制备猪RLR家族RIG-I、MDA5和LGP2蛋白的单克隆抗体,用来研究猪RLR在免疫信号中的作用和功能。
本发明进一步提供了一种猪RIG-I样受体特异性单克隆抗体在免疫学检测中的应用。
上述猪RIG-I样受体特异性单克隆抗体在免疫学检测中的应用,具体包括酶联免疫吸附试验(ELISA)、蛋白质印迹(WB)、免疫荧光(IFA)和免疫组织化学(IHC)。
本发明的有益效果如下:本发明提供四株猪RLR蛋白单克隆抗体,其中三株特异性单克隆抗体只与猪RLR(RIG-I、MDA5和LGP2)反应,与人RLR无交叉反应,用于特异性检测猪RLR,可用于猪RLR蛋白的检测和RLR蛋白抗病毒功能研究以及猪和人RLR的种属特异性比较免疫学研究。
保藏证明和存活证明说明
(1)保藏菌株:杂交瘤细胞株pRIG-I mAb,保藏编号:CCTCC NO:C2022133,保藏日期:2022-5-12收到,2022-5-18检测完毕,保藏单位:中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学;
(2)保藏菌株:杂交瘤细胞株pMDA5 mAb,保藏编号:CCTCC NO:C2022134,保藏日期:2022-5-12,保藏单位:中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学;
(3)保藏菌株:杂交瘤细胞株pLGP2 mAb A1-3,保藏编号:CCTCC NO:C2022135,保藏日期:2022-5-1,保藏单位:中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学;
(4)保藏菌株:杂交瘤细胞株pLGP2 mAb B9-2,保藏编号:CCTCC NO:C2022136,保藏日期:2022-5-12,保藏单位:中国典型培养物保藏中心,保藏地址:湖北省武汉市武昌区八一路299号武汉大学。
附图说明
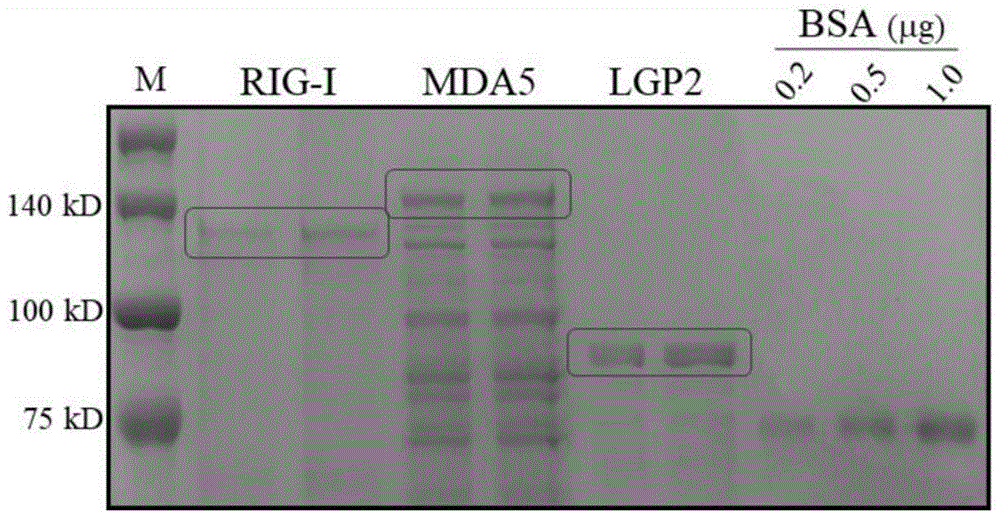
图1为本发明中重组猪RLR纯化蛋白的SDS-PAGE考马染色鉴定示意图。
图2为本发明中Western-blot分析纯化猪RLR蛋白与标签HA抗体的反应性的示意图。
图3为本发明中猪RLR三种蛋白4株单抗的亚类鉴定示意图。
图4为本发明中Western-blot分析猪RLR单克隆抗体与外源和内源猪RLR蛋白的反应性的示意图。
图5为本发明中Western-blot分析猪RLR单克隆抗体识别抗原区域的示意图。
图6为本发明中Western-blot分析猪RLR单克隆抗体种属反应特异性的示意图。
图7为本发明中猪RLR单抗间接免疫荧光检测猪RLR蛋白在细胞中的表达和定位的示意图。
图8为本发明中猪RLR单抗免疫组化检测PRRSV感染猪组织中的RLR蛋白分布与表达的示意图。
图中:将呼吸繁殖综合征病毒(PRRSV)感染猪的心,肝,脾,肺,肾,淋巴结组织切片进行免疫组化染色分析,在放大200X显微镜下观察染色结果。局部方框内组织染色放大结果图附于对应图片右侧。
具体实施方式
下面结合实施例对本发明的技术方案做进一步的详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护权限不限于下述的实施例。
实施例所涉及试剂及材料的来源如下:猪肺泡巨噬细胞(PAM,3D4/21,购自美国菌种保存中心,ATCC Cat#CRL-2843),中间载体pENTR4-MCS-2HA(扬州大学兽医学院实验室构建保存,构建方法见论文Front Immunol.2020Aug 14;11:1669.doi:10.3389/fimmu.2020.01669),真核目的表达载体pcDNA-DEST47(购自Addgene),原核目的表达载体pDSET-527(购自Addgene),IPTG诱导剂(购自TransGen生物技术公司),
除了上述特殊说明的生物材料及试剂外,本发明中所提及的其余材料及试剂为市购,公众能从国内外商业渠道购买到,此处不再一一说明。
本发明中的“%”为体积百分比。
实施例1猪RIG-I、MDA5和LGP2基因序列、单克隆抗体制备工艺
(1)猪RIG-I基因克隆表达、蛋白纯化和单克隆抗体的制备
从猪肺泡巨噬细胞(PAM,3D4/21)中提取总RNA,设计克隆和检测PCR引物(见表1),反转录PCR(RT-PCR)扩增出猪RIG-I(pRIG-I的编码基因(pRIG-I编码基因序列的GenBank登录号为MF358966,其核苷酸序列如SEQ ID NO.1所示;pRIG-I蛋白的氨基酸序列如SEQ IDNO.2所示)。将pRIG-I基因与中间载体pENTR4-MCS-2HA连接获得重组中间质粒pENTR4-pRIG-I-2HA。将上述重组中间质粒分别与真核目的表达载体pcDNA-DEST47和原核目的表达载体pDSET-527进行特异位点性重组(LR),获得重组真核表达质粒pcDNA-pRIG-I-2HA和重组原核表达质粒pDEST527-pRIG-I-2HA。将上述重组原核表达质粒转化到DE3/BL21感受态大肠杆菌(E.coli)进行原核蛋白诱导表达,原核蛋白表达的最佳诱导条件为:IPTG诱导剂浓度1mM、37℃条件下培养12h。对原核诱导表达的大肠杆菌菌体进行超声充分破碎后,于4℃离心30min,将目的蛋白所在的细菌裂解上清通过0.45μM的滤器过滤。过滤后上清使用
用纯化pRIG-I蛋白皮下免疫6-8周龄BALB/c小鼠,第二次与第一次免疫时间间隔14天,第三和第二次免疫时间间隔7天,三免后5天内小鼠尾静脉采血分离血清,对血清中抗体ELISA效价最高的小鼠进行腹腔注射加强免疫。加强免疫后72小时内取小鼠脾细胞与小鼠骨髓瘤细胞SP2/0进行融合(细胞融合的具体操作步骤见后面详细介绍),获得杂交瘤细胞克隆。其中,有1株ELISA阳性的细胞克隆,进一步Western-blot检测发现有杂交瘤细胞克隆能与真核pRIG-I蛋白能产生特异性反应。由此,获得了1株能够分泌pRIG-I单克隆抗体的杂交瘤细胞株pRIG-I mAb(中国菌种中心细胞收藏号为CCTCC NO:C2022133)。选取8-12周龄的BALB/c小鼠经腹腔注射0.2-0.3mL/只的福氏不完全佐剂。在3天后腹腔注射小鼠杂交瘤细胞株(1-3×10
(2)猪MDA5基因克隆表达、蛋白纯化和单克隆抗体的制备
从猪肺泡巨噬细胞(PAM,3D4/21)中提取总RNA,设计克隆和检测PCR引物(见表1),反转录PCR(RT-PCR)扩增出猪MDA5(pMDA5)的编码基因(pMDA5编码基因序列的GenBank登录号为MF358967,其核苷酸序列如SEQ ID NO.3所示;pMDA5蛋白的氨基酸序列如SEQ ID NO.4所示)。将pMDA5基因与中间载体pENTR4-MCS-2HA连接获得重组中间质粒pENTR4-pMDA5-2HA。将上述重组中间质粒分别与真核目的表达载体pcDNA-DEST47和原核目的表达载体pDSET-527进行特异位点性重组(LR),获得重组真核表达质粒pcDNA-pMDA5-2HA和重组原核表达质粒pDEST527-pMDA5-2HA。将上述重组原核表达质粒转化到DE3/BL21感受态大肠杆菌(E.coli)进行原核蛋白诱导表达,原核蛋白表达的最佳诱导条件为:IPTG诱导剂浓度1mM、37℃条件下培养12h。对原核诱导表达的菌体超声充分破碎后,于4℃离心30min,将目的蛋白所在的上清通过0.45μM的滤器过滤。过滤后上清使用
利用纯化pMDA5蛋白皮下免疫6-8周龄BALB/c小鼠,第二次与第一次免疫时间间隔14天,第三和第二次免疫时间间隔7天,三免后5天内小鼠尾静脉采血分离血清,对血清中抗体ELISA效价最高的小鼠进行腹腔注射加强免疫。加强免疫后72小时内取小鼠脾细胞与小鼠骨髓瘤SP2/0细胞进行融合(细胞融合的具体操作步骤见后面详细介绍),获得杂交瘤细胞克隆。其中有1株ELISA阳性的细胞克隆,进一步Western-blot检测发现有杂交瘤细胞克隆能与真核pMDA5蛋白能产生特异性反应。由此,获得了1株能够分泌pMDA5单克隆抗体的杂交瘤细胞株pMDA5 mAb(中国菌种中心细胞收藏号为CCTCC NO:C2022134)。选取8-12周龄的BALB/c小鼠经腹腔注射0.2-0.3mL/只的福氏不完全佐剂。在3天后腹腔注射小鼠杂交瘤细胞(1-3×10
(3)猪LGP2基因克隆表达、蛋白纯化和单克隆抗体的制备
从猪肺泡巨噬细胞(PAM,3D4/21)中提取总RNA,设计克隆和检测PCR引物(见表1),反转录PCR(RT-PCR)扩增出猪LGP2(pLGP2)的编码基因(pLGP2编码基因序列的GenBank登录号为MF358968,其核苷酸序列如SEQ ID NO.5所示;pLGP2蛋白的氨基酸序列如SEQ ID NO.6所示)。将pLGP2基因与中间载体pENTR4-MCS-2HA连接获得重组中间质粒pENTR4-pLGP2-2HA。将上述重组中间质粒分别与真核目的表达载体pcDNA-DEST47和原核目的表达载体pDSET-527进行特异位点性重组(LR),获得重组真核表达质粒pcDNA-pLGP2-2HA和重组原核表达质粒pDEST527-pLGP2-2HA。将上述重组原核表达质粒转化到DE3/BL21感受态大肠杆菌(E.coli)进行原核蛋白诱导表达,原核蛋白表达的最佳诱导条件为:IPTG诱导剂浓度1mM、37℃条件下培养6-9h。利用尿素溶解和浓度梯度透析方法从细菌包涵体中纯化出具有较好免疫原性的猪LGP2蛋白(猪LGP2蛋白SDS-PAGE考马染色鉴定结果见图1)。纯化猪LGP2在Western blot中可以被HA标签抗体所识别(见图2)。
利用纯化pLGP2蛋白皮下免疫6-8周龄BALB/c小鼠,第二次与第一次免疫时间间隔14天,第三次和第二次免疫时间间隔7天,三免后5天内小鼠尾静脉采血分离血清,对血清中抗体ELISA效价最高的小鼠进行腹腔注射加强免疫。加强免疫后72小时内取小鼠脾细胞与小鼠骨髓瘤SP2/0细胞进行融合(细胞融合的具体操作步骤见后面详细介绍),获得杂交瘤细胞克隆。其中有7株ELISA阳性的细胞克隆,进一步Western-blot检测发现有2株杂交瘤细胞克隆(A1-3和B9-2)能与真核pLGP2蛋白能产生特异性反应。由此,获得了2株能够分泌pLGP2单克隆抗体的杂交瘤细胞株pLGP2 mAb A1-3和pLGP2 mAb B9-2(中国菌种中心细胞收藏号为CCTCC NO:C2022135和CCTCC NO:C2022136)。选取8-12周龄的BALB/c小鼠经腹腔注射0.2-0.3mL/只的福氏不完全佐剂。在3天后腹腔注射小鼠杂交瘤细胞(1-3×10
表1猪RLR基因克隆和检测PCR引物序列
注:F/R为克隆PCR引物;f/r为检测PCR引物。大写字母标识处为限制性酶切位点。
细胞融合的具体操作步骤如下:
①将1×108脾细胞与1-2×107骨髓瘤细胞SP2/0在50mL融合管中混合,补加无血清DMEM培养基(购自Hyclone公司)至30mL,充分混匀。
②1000rpm离心5-10min,去除离心上清(此时管底沉淀为下层红色的脾细胞和上层白色的SP2/0细胞,两者压积大致相当)。
③握于手掌旋转轻击融合管底,使细胞团块呈松散均质的状态。
④用1mL移液枪在60s内缓缓滴加37℃预热1mL PEG1500,边加边旋转离心管,使PEG1500和细胞充分混匀。
⑤用移液枪在90s内先慢后快方式加入10-20mL预热至37℃的无血清DMEM培养基,稀释并同时终止PEG1500的作用。37℃静置10min。
⑥1000rpm,离心5-10min弃去上清。
⑦加入40mL HAT培养基(含1×的次黄嘌呤(H)、氨基喋呤(A)、胸腺嘧啶(T)和10%胎牛血清(FBS)的DMEM培养液))将沉淀细胞轻轻吹打混匀。
⑧用排枪分装至含腹腔饲养细胞的96孔细胞培养板,每孔100μL;然后将培养板置37℃,5% CO2培养箱内培养。
⑨融合后7-10d(杂交瘤细胞克隆非常明显),可以用新鲜HAT培养基换出1/2培养基。
⑩观察杂交瘤细胞生长情况,超过孔底面积1/10以上且上清变黄时吸出上清供ELISA抗体检测。
实施例2猪RIG-I、MDA5和LGP2单克隆抗体鉴定
(1)猪RLR单抗亚类鉴定
按照赛尔维(CELLWAY-LAB洛阳佰奥通实验材料中心)小鼠单抗Ig类/亚类/亚型鉴定试剂盒使用说明书中的操作方法,检测猪RLR三种蛋白4株腹水单抗的亚类,结果见图3。结果显示,pRIG-I、pMDA5和pLGP2(A1-3和B9-2)4株单抗的亚类均为IgG2b。
(2)猪RLR单抗识别内源性和外源性真核表达蛋白的鉴定
将猪肺泡巨噬细胞系(PAM,3D4/21)和PK15细胞分别铺于24孔细胞培养板(2×10
(3)猪RLR单抗识别蛋白结构域的鉴定
将猪RIG-I蛋白的N端CARDs结构域(1-200aa)编码DNA序列合成到pENTR4-MCS-2HA质粒的SalI/EcoRV位点,构建pENTR4-pRIG-I-CARDs-2HA。再将合成的pENTR4 pRIG-I-CARDs-2HA与目的表达载体pcDNA-DEST47进行位点特异性LR同源重组,获得pcDNA-pRIG-I-CARDs-2HA真核表达质粒。猪RIG-I蛋白的C端CARDs外区域(Δ2CARDs,201-943aa)用表2中的克隆引物从模板质粒PCR扩增,PCR产物酶切后经T4连接酶克隆到pCAGGS-2HA的EcoRI/EcoRV位点,构建pCAGGS-pRIG-I-Δ2CARDs-2HA表达质粒。
将猪MDA5蛋白的N端CARDs结构域(1-200aa)编码DNA序列合成到pENTR4-MCS-2HA质粒的SalI/EcoRV位点,构建pENTR4-pMDA5-CARDs-2HA。再将合成的pENTR4-pMDA5-CARDs-2HA与目的表达载体pcDNA-DEST47进行位点特异性LR同源重组,获得pcDNA-pMDA5-CARDs-2HA真核表达质粒。猪MDA5蛋白的C端CARDs外区域(Δ2CARDs,201-1023aa)用表2中的克隆引物从模板质粒PCR扩增,PCR产物酶切后经T4连接酶克隆到pCAGGS-2HA的EcoRI/EcoRV位点,构建pCAGGS-pMDA5-Δ2CARDs-2HA表达质粒。
使用prosite网站(https://prosite.expasy.org/)预测猪pLGP2的功能结构域,分别为猪pLGP2蛋白的N端解旋酶ATP结合域(L1,1-200aa)、中间解旋酶CTER域(L2,340-530aa)和C端CTR域(L3,531-685aa)。分别设计L1、L2和L3片段的克隆PCR引物(见表2),将相应PCR扩增片段克隆到载体pcDNA-2HA的NheI/EcoRV位点,分别构建pcDNA-pLGP2-L1-2HA、pcDNA-pLGP2-L2-2HA和pcDNA-pLGP2-L3-2HA表达质粒。
将序列正确pcDNA-pRIG-I-CARDs-2HA和pCAGGS-pRIG-I-Δ2CARDs-2HA表达质粒分别转染293T细胞。细胞裂解液样品用pRIG-I腹水单抗(体积比1∶1000稀释)进行Western-blot分析,根据Western-blot结果鉴定pRIG-I单克隆抗体所识别蛋白的功能结构区域。结果如图5所示,pRIG-I单抗识别位点位于RIG-I蛋白C端Δ2CARDs片段。
将序列正确pcDNA-pMDA5-CARDs-2HA和pCAGGS-pMDA5-Δ2CARDs-2HA表达质粒分别转染293T细胞。细胞裂解液样品用pMDA5腹水单抗(体积比1:1000稀释)进行Western-blot分析,根据Western-blot结果鉴定pMDA5单克隆抗体所识别蛋白的功能结构区域。结果如图5所示,pMDA5单抗识别位点位于MDA5蛋白C端Δ2CARDs片段。
将序列正确的pLGP2截短体(L1,L2,L3)pcDNA质粒分别转染293T细胞,细胞裂解液样品用2株pLGP2腹水单抗(体积比1∶1000稀释)进行Western-blot分析,根据Western-blot结果鉴定2株pLGP2单克隆抗体所识别蛋白的功能结构区域。结果如图5所示,pLGP2的2株单抗识别位点位于LGP2蛋白N端L1(1-200aa)片段。
表2猪RLR截短体克隆引物序列
注:大写字母标识处为限制性酶切位点。
(4)猪RLR单抗识别种属特异性的鉴定
将猪pcDNA pRIG-I-2HA质粒和人pcDNA hRIG-I-3FLAG质粒各1μg分别转染293T细胞,24h后收集细胞。细胞裂解液用pRIG-I腹水型单抗(体积比1:1000稀释)作为一抗进行Western-blot分析,检测pRIG-I单抗的种属识别/反应特异性。同时将HA和FLAG标签鼠单抗作为对照抗体使用,结果见图6。结果显示,猪RIG-I和人RIG-I蛋白均可以被各自的蛋白标签抗体HA和FLAG所特异识别,获得预期表达。猪RIG-I单抗只与猪RIG-I发生反应,与人RIG-I无交叉反应。因此,获得了1株具有种属特异性的pRIG-I单克隆抗体。
将猪pcDNA-pMDA5-2HA质粒和人pcDNA-hMDA5-3FLAG质粒各1μg分别转染293T细胞,24h后收集细胞。细胞裂解液用pMDA5腹水型单抗(体积比1:1000稀释)作为一抗进行Western-blot分析,检测pMDA5单抗的种属识别/反应特异性。同时将HA和FLAG标签鼠单抗作为对照抗体使用,结果见图6。结果显示,猪MDA5和人MDA5蛋白均可以被各自的蛋白标签抗体HA和FLAG所特异识别,获得预期表达。猪MDA5单抗只与猪MDA5发生反应,与人MDA5无交叉反应。因此,获得了1株具有种属特异性的pMDA5单克隆抗体。
将猪pcDNA pLGP2-2HA质粒和人pcDNA hLGP2-3FLAG质粒各1μg分别转染293T细胞,24h后收集细胞。细胞裂解液用2株pLGP2腹水型单抗(体积比1:1000稀释)作为一抗进行Western-blot分析,检测2株pLGP2单抗的种属识别/反应特异性。同时将HA和FLAG标签鼠单抗作为对照抗体使用,结果见图6。结果显示,猪LGP2和人LGP2蛋白均可以被各自的蛋白标签抗体HA和FLAG所特异识别,获得预期表达。猪LGP2的2株单抗情况有所不同,其中pLGP2(B9-2)单抗只与猪LGP2发生反应,与人LGP2无交叉反应;而pLGP2(A1-3)单抗既能识别猪LGP2,也可以识别人LGP2,与人LGP2存在交叉反应。因此,获得了1株具有种属特异性的pLGP2单克隆抗体(B9-2)。
实施例3猪RLR单抗间接免疫荧光鉴定RLR蛋白细胞内表达和定位
将消化好的PAM细胞按照3×10
实施例4猪RLR单抗免疫组化检测RLR蛋白在PRRSV感染猪组织中的分布与表达
取感染高致病性猪呼吸繁殖综合征病毒(HP-PRRSV)感染猪的组织,包括心脏、肝脏、脾脏、肺脏、肾脏和淋巴结,用于组织切片。固定、脱水后,将组织包埋在融化石蜡中进行切片。组织切片的厚度为5μm,组织切片用双蒸水铺展,平铺在聚赖氨酸涂层的载玻片上,在37℃下干燥过夜,并在4℃下保存。染色前,石蜡切片依次再水化,用3%过氧化氢(H
以上所述,仅为本发明中的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉该技术的人在本发明所揭露的技术范围内,可理解想到的变换或替换,都应涵盖在本发明的包含范围之内,因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 夜景图像处理方法、装置、电子设备及存储介质
- 人脸图像的处理方法及装置、电子设备和存储介质
- 图像处理方法和装置、电子设备、计算机可读存储介质
- 图像处理方法、装置、电子设备及计算机可读存储介质
- 图像处理方法、装置、存储介质及电子设备
- 图像处理方法、图像处理装置、电子设备和存储介质
- 图像处理方法、图像处理装置、电子设备和可读存储介质
