TMEM43蛋白作为纤维化疾病治疗靶标的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及生物医药技术领域,尤其涉及TMEM43蛋白作为纤维化疾病治疗靶标的应用,所述纤维化疾病包括肺纤维化、肝纤维化、肾纤维化和皮肤纤维化疾病或由纤维化诱发的疾病。
背景技术
天然产物(Natural products,NPs)发挥作用的本质是分子与靶点(Target)结合,药物靶点是指存在于生物体内的与外源性分子结合的位点,包括基因位点、蛋白质、核酸等生物大分子,它能与药物分子相互作用,促使药物发挥疗效。其中,蛋白质是生命的物质基础,目前对于药物靶点的研究的重点集中于蛋白质类,如酶类蛋白、受体类蛋白和离子通道类的蛋白等。因此鉴定生物活性小分子的靶标蛋白(Target protein)是了解药物作用方式和解决特定表型的潜在机制的关键步骤。随着基因组学、转录组学和蛋白质组学等技术的蓬勃发展,多种学科相互渗透,药物靶标发现的方法也在不断更新。化学蛋白质组学(Chemical proteomics)是化学生物学(Chemical biology)的一个不断发展的领域,旨在利用化学合成的方法设计小分子探针(Probe)以了解分子与蛋白质的相互作用。与传统的蛋白质组学不同,化学蛋白质组学是一个在蛋白质组学的基础上集合生物化学、合成化学、质谱学等多学科于一体的研究领域,利用合成化学的方法合成化学小分子探针直接从功能角度切入蛋白质组学,同时揭示化学分子与靶蛋白的相互作用。近年,林彩圣教授团队利用二甲双胍探针,证明二甲双胍结合PEN2并激活AMPK信号传导途径;王继刚教授团队利用化学蛋白质组学使用雷公藤红素探针证明了雷公藤红素可以通过诱导肝细胞中的铁死亡进而改善肝纤维化。
基于活性的蛋白质分析(Activiyty-based Protein Profiling,ABPP)是一种新兴的化学蛋白质组学技术技术,是蛋白质组学与化学分析和合成工具相关联,主要用于分析细胞环境中分子-蛋白质的相互作用。ABPP方法主要是基于活性的探针(Activity-BasedProbe,ABP)与活细胞、动物组织、细胞裂解液孵育,使探针标记靶标蛋白。随后,对标记的蛋白质靶标进行分离或亲和纯化,并通过小分子探针的报告标签,使用荧光SDS-PAGE、蛋白质印迹或LC-MS平台进行鉴定。其中主要包括两个步骤(1)、利用合成化学的方法合成小分子探针;(2)、利用探针对靶标蛋白的捕获。其中ABP的基本要求是,探针必须与活性位点的氨基酸残基共价连接,通常是与靶蛋白共价结合的反应基团(Reactive group);用于识别、检测、富集的报告标签(Reporter tag)和将这两部分稳定连接在一起的链接部位(Linker),延长两者间的距离避免空间位阻,并诱导探针对靶蛋白的选择性。
目前,利用生物正交反应(Click reaction)的两步标记法是ABPP中应用的最为广泛的方法,与原有的带有生物素标签(Biotin tag)或固定化合物与生物相容性的惰性树脂方法相比,排除了因为引入标签位阻较大的缘故而导致化合物的活性降低甚至丧失的可能。其主要原理是在天然产物(NPs)的结构的游离基团上引入一个非常小的Linker如末端炔烃、环丙烯得到探针,应用最广泛的生物正交反应是铜催化叠氮化物-炔烃环加成反应(The copper-catalyzed azide/alkyne cycloaddition reaction,CuAAC),将叠氮化物和炔烃加入生物探针的合成较为简单,引起空间位阻改变也是最小的,并且由于叠氮化物对水、氧气和多种合成转化环境具有高稳定性,因此该反应是生物应用的理想选择。在确认探针依然保留原有天然产物(NPs)的活性后,将探针与活细胞、细胞裂解液或动物组织匀浆孵育,使探针与靶蛋白结合,形成“蛋白-探针”复合体,随后利用Click反应,将Linker与报告标签反应得到“蛋白-探针-报告标签”复合体,常用的报告标签有生物素标签(Biotintag)、Cyanine3标签或Cyanine5标签等。在与生物素标签(Biotin tag)Click反应后,Linker上的生物素可以与链霉亲和素磁珠(Streptavidin Magnetic Beads)反应,形成“蛋白-探针-生物素-磁珠”复合体,随后经过洗脱,富集可以得到与探针共价结合的蛋白,通过LC-MS/MS分析便可以鉴定蛋白混合物。
然而,ABPP技术的前提是在保障活性的前提下,对原型化合物结构进行改造,合成具有活性的探针(ABP),并通过探针进行靶标蛋白的钓取。
跨膜蛋白43(TMEM43)也被称为LUMA,是一个发现较晚的功能蛋白,它是由TMEM43基因编码的,大小为45kDa的唯一完整的核膜蛋白,在物种之间高度保守。目前对该蛋白的功能及相关特性的研究报道还很缺乏,现已知该基因的突变能导致人的心律失常性右心室心肌病(Arrhythmogenic right ventricular cardiomyopathy,ARVC)、金刚砂-德雷福斯肌营养不良疾病(Emery dreifuss muscular dystrophy,EDMD等。
发明内容
本发明所要解决的技术问题是提供了TMEM43蛋白作为纤维化疾病的治疗靶标的应用。
为了解决上述问题,本发明提出以下技术方案:
本发明提供TMEM43蛋白作为纤维化疾病治疗靶标的应用。
进一步地,所述纤维化疾病包括肺纤维化、肝纤维化、肾纤维化和皮肤纤维化疾病或由纤维化诱发的疾病。
通过多因素分析和验证,TMEM43蛋白可作为肺、肝、肾、皮肤等器官及组织纤维化疾病的治疗靶标。
本发明还提供TMEM43蛋白的调节剂在制备治疗肺、肝、肾、皮肤等器官及组织纤维化疾病药物中的应用。
进一步地,所述调节剂抑制TMEM43蛋白表达。
肺、肝、肾、皮肤细胞纤维化模型的实验数据表明TMEM43蛋白表达水平下调后,纤连蛋白、I型胶原蛋白和α-平滑肌动蛋白均降低,这表明下调TMEM43蛋白会抑制纤维化的进程,抑制TMEM43蛋白表达的药物可用于治疗纤维化疾病。
本发明还提供TMEM43蛋白作为纤维化疾病治疗靶标的筛选方法,包括以下步骤:
S1、以具有抗纤维化活性的化合物进行探针设计;
S2、基于ABPP技术,利用探针进行靶标蛋白的钓取,得到共价结合的蛋白混合物;
S3、使用高分辨蛋白质谱对所述蛋白混合物鉴定,挑选出靶标的候选蛋白;
S4、对候选蛋白进行验证,最终筛选得到肾纤维化疾病治疗靶标TMEM43蛋白。
进一步地,所述筛选方法还包括步骤S5、对TMEM43蛋白在器官纤维化中的功能进行验证。
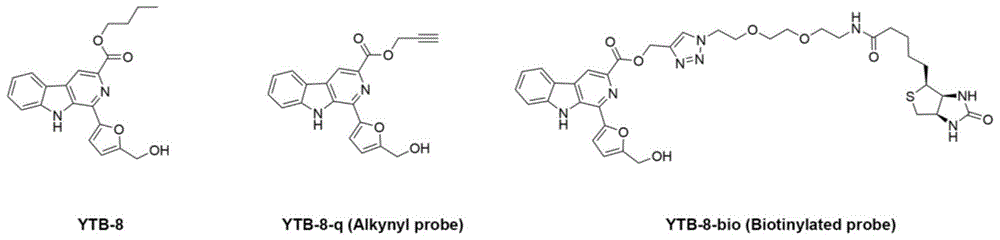
所述具有抗纤维化活性的化合物为YTB-8,结构式如下:
本发明中,化合物YTB-8具有抗纤维活性已被同日递交的专利《β-咔伯啉生物碱类化合物在制备预防和治疗纤维化疾病药物的应用》验证。本发明对此不再赘述。
进一步地,所述探针为YTB-8-q或YTB-8-bio,结构式如下:
本发明中,化合物TB-68d和化合物YTB-8均为文献已有报道的化合物,其制备方法也是本领域技术人员所熟知的。例如,专利CN 115872991 A中给出了TB-68d及化合物YTB-8的具体制备方法。
进一步地,所述探针YTB-8-q的制备方法如下:
将化合物TB-68d在溶剂DMF中加入K
化合物TB-68d和化合物A的用量比m/v:2-4/1;
化合物TB-68d和化合物A的结构式如下:
进一步地,所述探针YTB-8-bio的制备方法如下:
向YTB-8-q和化合物B按重量比0.5-1.5:1在DMF溶剂中,在环境温度下加入CuSO
化合物B的结构式如下:
另一方面,本发明提供一种β-咔伯啉分子探针,所述β-咔伯啉分子探针为YTB-8-q或YTB-8-bio,结构式如下:
进一步地,所述探针YTB-8-q的制备方法如下:
将化合物TB-68d在溶剂DMF中加入K
化合物TB-68d和化合物A的用量比m/v:2-4/1;
化合物TB-68d和化合物A的结构式如下:
所述探针YTB-8-bio的制备方法如下:
向YTB-8-q和化合物B按重量比0.5-1.5:1在DMF溶剂中,在环境温度下加入CuSO
化合物B的结构式如下:
本发明还提供所述的β-咔伯啉分子探针,或根据所述制备方法制得的β-咔伯啉分子探针在鉴定调控纤维化的蛋白质靶标的应用。
与现有技术相比,本发明所能达到的技术效果包括:
本发明利用具有抗纤维化活性的化合物YTB-8设计出的探针,进行调控纤维化的蛋白质靶标筛选,经最终的鉴定和验证,得到TMEM43蛋白可作为器官及组织纤维化疾病的治疗靶标的结果。器官纤维化模型的实验数据表明TMEM43蛋白表达水平下调后,纤连蛋白、I型胶原蛋白和α-平滑肌动蛋白均降低,这表明下调TMEM43蛋白会抑制纤维化的进程,抑制TMEM43蛋白表达的药物可用于治疗纤维化疾病。本发明为器官纤维化疾病的治疗提供了新思路。
附图说明
图1为本发明实施例提供的β-咔伯啉分子探针的结构图。
图2为本发明实施例提供的探针与原型化合物在TGF-β1诱导的NRK-52E细胞上的抗肾纤维化活性对比结果。
图3为本发明使用ABPP技术进行下拉实验(Pull down)的流程示意图。
图4为使用ABPP策略结合鸟枪蛋白质组学鉴定YTB-8靶蛋白的实验结果。其中,(A)为通过SDS/PAGE,然后通过考马斯蓝染色来分辨珠上的下拉样品。(B)为NRK-52E细胞裂解1小时后荧光YTB-8-q的蛋白质组学图谱显示主要区域的标记。凝胶的考马斯染色显示负载相等。(C)为YTB-8-q与YTB-8蛋白质组反应性的竞争性分析结果。凝胶的考马斯染色显示组间蛋白量相等。(D)为Venn图显示了ABPP实验每次重复中的蛋白质数量。
图5为利用蛋白质印迹分析检测YTB-8的潜在结合靶标的结果。
图6为YTB-8对NRK-52E细胞中TMEM43蛋白敲低诱导的纤维化的作用活性。
图7为YTB-8对NRK-52E细胞中TXNDC5敲低诱导的纤维化的作用活性。条形图表示免疫印迹分析的定量。数据代表三个独立实验的平均值±SEM*p<0.05、**p<0.01。
图8为以剂量依赖的方式对TMEM43蛋白进行YTB-8标记,以及在存在或不存在不同浓度的YTB-8的情况下对TMEM43蛋白进行YTB-8-q标记的结果。
图9为TMEM43蛋白(绿色)和YTB-8-q的免疫荧光染色与红色荧光染料TAMRA-N3(比例尺=6μM)反应结果。
图10为YTB-8对HDF、HPF、HSC细胞中TMEM43蛋白敲低诱导的纤维化的作用活性结果。
具体实施方式
下面将结合本发明实施例中的附图,对实施例中的技术方案进行清楚、完整地描述。显然,以下将描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例中使用的各种仪器、设备、原料或试剂,并没有来源上的特殊限制,均为可以通过正规商业途径购买获得的常规产品,也可以按照本领域技术人员熟知的常规方法进行制备。
参见图1,本发明以无论体外还是在体内的抗肾纤维化活性都较好的化合物YTB-8作为原型化合物进行改造,合成具有活性的探针YTB-8-q或YTB-8-bio,并通过探针进行靶标蛋白的钓取,最终筛选并验证得到TMEM43蛋白可作为纤维化疾病的治疗靶标的结果。
实施例1探针及制备
本实施例提供β-咔伯啉分子探针,所述β-咔伯啉分子探针为YTB-8-q或YTB-8-bio,结构式如下:
合成过程如下所示:
具体地,所述探针YTB-8-q的制备方法如下:
在90℃下,将150mg的化合物TB-68d在5mL溶剂DMF中加入K
YTB-8-q的鉴定结果:ESIMS m/z 347[M+H]
所述探针YTB-8-bio的制备方法如下:
向23.5mg的化合物YTB-8-q和26mg的化合物B在2mL DMF溶剂中,在环境温度下加入CuSO
YTB-8-bio鉴定结果:ESIMS m/z 747[M+H]
实施例2测定探针的抗纤维化活性
本实施例通过体外模型对化合物YTB-8、探针YTB-8-q和YTB-8-bio的抗肾纤维化活性进行检测。
蛋白质免疫印迹(Western Blot)是以抗体-抗原相互作用为基础,采用聚丙烯酰胺蛋白凝胶电泳,将不同蛋白依据分子量分离,再将蛋白质转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,然后选择合适的抗体对其进行检测。本发明中,肾纤维化模型选用TGF-β1/Smad通路诱导的模型,通过检测纤连蛋白(Fibronectin)、I型胶原蛋白(Collagen I)、α-平滑肌动蛋白(α-Smooth Muscle Actin,α-SMA),来评价药物抗肾纤维化的活性。
按常规操作方法,取对数生长的NRK-52E细胞,经消化、计数改变细胞的密度为每孔1X10
实验结果见图2,显示化合物YTB-8、探针YTB-8-q和YTB-8-bio在TGF-β1诱导的NRK-52E细胞上具有良好的体外抗肾纤维化活性,探针YTB-8-q和YTB-8-bio保留了原化合物YTB-8的抗肾纤维化活性。
实施例3利用探针进行调控肾纤维化的蛋白质靶标的筛选及鉴定
3.1Pull down实验
参见图3,其为Pull down的流程示意图,本实施例利用ABPP技术进行调控肾纤维化的蛋白质靶标的筛选,具体是将探针与活细胞、细胞裂解液或动物组织匀浆孵育,使探针与靶蛋白结合,形成“蛋白-探针”复合体,随后利用Click反应,将Linker与生物素报告标签反应得到“蛋白-探针-报告标签”复合体,在与生物素标签(Biotin tag)Click反应后,Linker上的生物素可以与链霉亲和素磁珠反应,形成“蛋白-探针-生物素-磁珠”复合体,随后经过洗脱,富集可以得到与探针共价结合的蛋白,通过LC-MS/MS分析便可以鉴定蛋白混合物。
本实施例按照上述条件使用探针进行体外Pull down实验,并通过亲和层析和蛋白免疫印迹实验对探针与蛋白裂解液的结合情况进行研究。实验方法按照常规操作,根据预设的浓度,先加入原型化合物孵育再加入探针进行Pull down实验。使用链霉亲和素磁珠(Streptavidin Magnetic Beads)富集被探针标记的蛋白,将富集到的蛋白与Pull down前后的蛋白使用WB、考马斯亮蓝染色进行检测。实验结果如图4,On beads的样品中,在40-55kDa区间有明显的差异条带,Probe蛋白信号较强,DMSO组蛋白信号几乎没有,加入原型化合物的竞争性抑制组蛋白信号强度介于两者之间,这充分证明了探针的可行性,同时也为接下来的蛋白质谱数据分析提供了证据。
3.2基于高分辨的亲和性蛋白质组学分析
经小分子探针Pull down垂钓到的蛋白,接下来需借助高分辨蛋白质谱进行分析,以确定蛋白的详细信息。本发明将Pull down的到的On beads样品经SDS-PAGE分离,随后进行考马斯亮蓝染色,分别将全蛋白凝胶和40-55kDa特异条带区间的凝胶进行高分辨蛋白质谱分析鉴定,实验重复两次。
将得到的DMSO组,Probe组,Mix组数据,制作韦恩图,排除DMSO组的非特异性吸附蛋白,得到只存在于Probe组和Mix组交集的蛋白。结果如图4(D),两次全蛋白凝胶样品高分辨质谱定性蛋白质组学结果共得到70个蛋白;两次特异条带区间蛋白凝胶样品高分辨质谱定性蛋白质组学结果共得到12个蛋白,随后将两部分取数据重叠部分,依据蛋白丰度值进行排序,得到排名靠前,且分子量在55kDa-40kDa特异区间的蛋白TMEM 43,TXNDC 5。
3.3蛋白筛选、验证
将选取的蛋白TMEM 43、TXNDC 5进行下一步筛选和验证。
首先,通过蛋白质印迹分析,将NRK-52E裂解物与DMSO、YTB-8-bio或YTB-8与YTB-8-bio一起孵育。拉下后,通过SDS-PAGE解析珠上样品,检测YTB-8的潜在结合靶标TMEM 43,TXNDC 5,结果如图5。结果显示,两种蛋白Probe组蛋白信号较强,DMSO组信号几乎没有,竞争性抑制组蛋白信号强度介于两者之间,因此两种蛋白都有可能是靶标蛋白。
接着,进行si RNA干扰实验。
将选取的蛋白TMEM 43、TXNDC 5进行靶蛋白验证。
按表1设计的si RNA序列对si RNA序列进行筛选。挑选可以使蛋白表达下调70%-80%的序列用于后续实验。取对数生长期的细胞,消化、计数后按照密度为每孔1×10
表1TMEM43、TXNDC 5蛋白的siRNA序列
结果显示TMEM43-homo1134-siRNA和Txndc5-Rat-586-siRNA具有最好的下调效果。
检测下调TMEM43、TXNDC 5蛋白对YTB-8活性的影响。
在确定si RNA序列有效后,以空白阴性si RNA作为对照,再对YTB-8的抗纤维化活性进行验证。
按常规操作进行转染,转染10-12小时后,更换培养基,加入不同浓度的YTB-8孵育。1小时后加入TGF-β1至终浓度10ng/mL诱导形成纤维化模型,48小时后通过WesternBlot检测纤连蛋白(Fibronectin)、I型胶原蛋白(Collagen I)、α-平滑肌动蛋白(α-SmoothMuscle Actin,α-SMA)三个蛋白表达情况。
结果见图6-7。我们发现,TMEM43蛋白下调后,三种目的蛋白表达降低,由此可见TMEM43蛋白表达下调也会抑制纤维化的进程。为了确定TMEM43蛋白下调后对于YTB-8活性的影响,我们将Western Blot蛋白条带进行量化,对TMEM43蛋白下调前后模型组与给药组之间进行了统计学差异分析,发现与TMEM43蛋白下调前相比,给药组与模型组之间的统计学差异均减小,其中α-SMA蛋白最为明显,即TMEM43蛋白下调后,YTB-8活性相应的减弱。而从图7我们看到siRNA干扰TXNDC5表达后并没有使得YTB-8抗纤维化效果减弱。由此我们得出结论TMEM43蛋白可能是YTB-8的靶标蛋白之一。
验证YTB-8与TMEM43蛋白直接相互作用并且在细胞内直接靶向TMEM43蛋白。
为了验证本发明设计的小分子探针与TMEM43蛋白体外和活细胞内的结合。我们购买了TMEM43纯化蛋白,对该蛋白进行探针体外直接结合、竞争性抑制验证实验,向等量的蛋白溶液中加入不同浓度的探针(10μM-40μM),经过孵育、Click反应、SDS-PAGE电泳检测荧光信号,结果如图8,显示探针浓度越高,TMEM43蛋白的荧光信号越强。再挑选结合信号较强的探针浓度40μM,蛋白在与探针孵育前分别加入探针浓度1、10、100倍浓度的YTB-8孵育后再加入等量的探针,经孵育、Click反应、SDS-PAGE电泳检测荧光信号,发现加入YTB-8一定程度上抑制探针的结合,10倍探针浓度的抑制结合作用较为明显,由此确定探针与TMEM43蛋白存在直接结合。
通过胞内荧光共定位我们发现探针荧光信号主要分布区域与TMEM43蛋白的胞内定位相似,因此选择TMEM43蛋白继续接下来的验证。随后我们又利用探针与TMEM43纯蛋白标记,竞争性抑制实验发现与全蛋白的标记一样,呈剂量依赖性,证明YTB-8与TMEM43蛋白的结合。通过细胞内共定位成像技术,如(图9)使用激光共聚焦显微镜观察到TMEM43蛋白与探针的荧光信号都分布在细胞核和细胞质中,并可大部分重叠,证明YTB-8可以直接靶向TMEM43蛋白。
因为不同器官的纤维化具有相同的机制,为了进一步验证TMEM43蛋白在器官纤维化中的角色,我们在HDF,HPF,HSC三种细胞中对TMEM43蛋白进行了si RNA干扰验证。
按上述操作,验证结果见图10。我们发现,TMEM 43蛋白下调后,细胞中的三种目的蛋白表达降低,由此可见TMEM 43蛋白表达下调也会抑制纤维化的进程。为了确定TMEM43蛋白下调后对于YTB-8活性的影响,我们将Western Blot蛋白条带进行量化,对TMEM 43蛋白下调前后模型组与给药组之间进行了统计学差异分析,发现与TMEM 43蛋白下调前相比,给药组与模型组之间的统计学差异均减小,其中α-SMA蛋白最为明显,即TMEM 43蛋白下调后,YTB-8活性相应的减弱。
上述实验证明了TMEM43蛋白为YTB-8的靶标,为制备抗器官纤维化疾病药物提供了新思路。
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详细描述的部分,可以参见其他实施例的相关描述。
以上所述,为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 文本中的实体关系抽取方法及系统、存储介质、电子设备
- 一种基于实体关系联合抽取模型的多三元组抽取方法
- 一种基于邻接矩阵的文档级别关系抽取方法和存储设备
- 一种文档级别关系抽取方法、装置、电子设备及存储介质
