噻唑并内酰胺并螺杂环类化合物及其应用
文献发布时间:2024-04-18 20:01:23
本申请主张如下优先权:
CN202110722003.6,申请日:2021年06月28日;
CN202111673614.2,申请日:2021年12月31日;
CN202210693548.3,申请日:2022年06月17日。
本发明涉及一类噻唑并内酰胺并螺杂环类化合物,及其在制备治疗相关疾病的药物中的应用。具体涉及式(I)所示化合物及其药学上可接受的盐。
Ras/Raf/MEK/ERK通路是一条经典的有丝分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号级联通路,参与各种生长因子、细胞因子、丝裂原以及激素受体活化后的信号传导,是控制细胞生长、分化和存活最重要的信号传导途径之一。
研究表明,突变或扩增引起的Ras/Raf/MEK/ERK通路异常活化是多种癌症发生的决定因素。在人类肿瘤中,RAS突变发生率约为22%,BRAF突变发生率约为7%,MEK突变发生率约为1%,因此,该通路上的关键节点蛋白已成为癌症治疗的重要靶点(Cancer Discov.2019,9,329-341)。目前,已有多个BRAF抑制剂和MEK1/2抑制剂,以及它们的联用方案,被美国FDA批准用于黑色素瘤、BRAFV600E突变型非小细胞肺癌等癌症的治疗。然而,使用这些上游节点的BRAF和MEK抑制剂后,由于突变或通路重新激活,会快速导致耐药性问题,极大地限制了它们的临床应用。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK),特别是ERK1和ERK2激酶,是Ras/Raf/MEK/ERK通路的主要参与者和下游关键节点,在许多人类的癌症中都可发现它们的过度激活。ERK作为该通路的末端信号激酶,目前尚未发现有耐药突变,因此,靶向ERK激酶的药物有望克服上游靶点抑制剂治疗后产生的耐药性问题,成为更具潜力的治疗策略。但迄今为止,关于ERK抑制剂的研究仍处于临床阶段,还没有ERK抑制剂作为药物批准上市。
综上所述,迫切需要研发出安全、有效的ERK抑制剂药物满足肿瘤治疗的需要。
发明内容
本发明提供了式(I)所示化合物或其药学上可接受的盐,
其中,
R
R
n为0或1;
m为1或2;
环A选自吡唑基和四氢吡喃基,所述吡唑基和四氢吡喃基任选被1、2或3个R
R
R
R选自F、Cl、Br和I。
本发明提供了式(I)所示化合物或其药学上可接受的盐,
其中,
R
R
n为0或1;
m为1或2;
环A选自吡唑基和四氢吡喃基,所述吡唑基和四氢吡喃基任选被1、2或3个R
R
R
R选自F、Cl和Br。
本发明的一些方案中,上述R
本发明的一些方案中,上述R
本发明的一些方案中,上述R
本发明的一些方案中,上述R
本发明的一些方案中,上述R
本发明的一些方案中,上述R
本发明的一些方案中,上述环A选自
本发明的一些方案中,上述环A选自
本发明的一些方案中,上述结构单元
本发明还有一些方案由上述变量任意组合而来。
本发明的一些方案中,上述化合物或其药学上可接受的盐,其选自:
其中,
R
本发明还提供了下式所示化合物或其药学上可接受的盐,
本发明还提供了述化合物或其药学上可接受的盐在制备治疗实体瘤的药物中的应用。
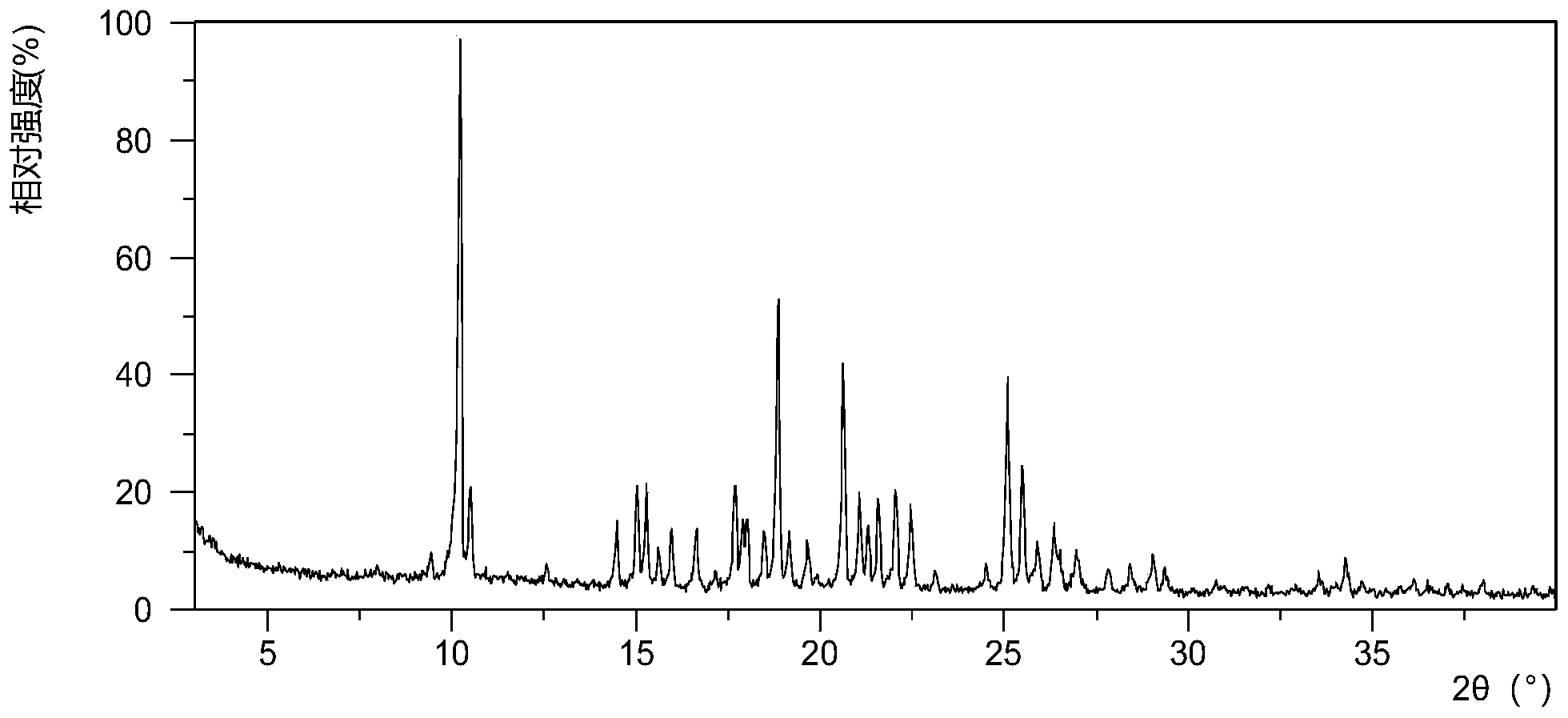
本发明提供了WX001的晶型A,其特征在于其X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080±0.2000°,18.8429±0.2000°,20.6217±0.2000°;
本发明的一些实施方案中,上述晶型A,其X射线粉末衍射图谱中,用2θ角表示,至少包含选自下述中的4或5个衍射峰:10.2080±0.2000°,18.8429±0.2000°,20.6217±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
在本发明的一些方案中,上述晶型A的X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080±0.2000°,18.8429±0.2000°,20.6217±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
本发明的一些实施方案中,上述晶型A,其X射线粉末衍射图谱中,用2θ角表示,至少包含选自下述中的6、7或8个衍射峰:10.2080±0.2000°,15.2687±0.2000°,17.6747±0.2000°,18.8429±0.2000°,20.6217±0.2000°,21.0531±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
在本发明的一些方案中,上述晶型A的X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080±0.2000°,15.2687±0.2000°,17.6747±0.2000°,18.8429±0.2000°,20.6217±0.2000°,21.0531±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
本发明的一些实施方案中,上述晶型A,其X射线粉末衍射图谱中,用2θ角表示,至少包含选自下述中的9、10、11或12个衍射峰:10.2080±0.2000°,14.4684±0.2000°,15.2687±0.2000°,17.6747±0.2000°,18.8429±0.2000°,20.6217±0.2000°,21.0531±0.2000°,21.5713±0.2000°,22.0420±0.2000°,22.4540±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
在本发明的一些方案中,上述晶型A的X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080±0.2000°,14.4684±0.2000°,15.2687±0.2000°,17.6747±0.2000°,18.8429±0.2000°,20.6217±0.2000°,21.0531±0.2000°,21.5713±0.2000°,22.0420±0.2000°,22.4540±0.2000°,25.0767±0.2000°,25.4797±0.2000°。
本发明的一些方案中,上述晶型A的X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080±0.2000°,18.8429±0.2000°,和/或20.6217±0.2000°,和/或9.4003±0.2000°,和/或10.4856±0.2000°,和/或14.4684±0.2000°,和/或15.0133±0.2000°,和/或15.2687±0.2000°,和/或15.6003±0.2000°,和/或15.9518±0.2000°,和/或16.6214±0.2000°,和/或17.6747±0.2000°,和/或17.9514±0.2000°,和/或18.4703±0.2000°,和/或19.1531±0.2000°,和/或19.6571±0.2000°,和/或21.0531±0.2000°,和/或21.2894±0.2000°,和/或21.5713±0.2000°,和/或22.0420±0.2000°,和/或22.4540±0.2000°,和/或23.1098±0.2000°,和/或24.5027±0.2000°,和/或25.0767±0.2000°,和/或25.4797±0.2000°,和/或25.8919±0.2000°,和/或26.3255±0.2000°,和/或26.9544±0.2000°,和/或28.3997±0.2000°,和/或29.0345±0.2000°,和/或29.3507±0.2000°,和/或33.5390±0.2000°,和/或34.2457±0.2000°,和/或37.9776±0.2000°。
在本发明的一些方案中,上述晶型A的X射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.2080°,10.4856°,14.4684°,15.0133°,15.2687°,15.9518°,16.6214°,17.6747°,17.9514°,18.4703°,18.8429°,19.1531°,20.6217°,21.0531°,21.2894°,21.5713°,22.0420°,22.4540°,25.0767°,25.4797°,26.3255°,26.9544°。
在本发明的一些方案中,上述晶型A,其XRPD图谱基本上如图1所示。
在本发明的一些方案中,上述晶型A的XRPD图谱解析数据如表1所示:
表1 WX001晶型A的XRPD图谱解析数据
在本发明的一些方案中,上述晶型A的差示扫描量热曲线在241.0±3.0℃处有一个吸热峰的起始点。
在本发明的一些方案中,上述晶型A的DSC图谱如图2所示。
在本发明的一些方案中,上述晶型A的热重分析曲线在150.0±3.0℃时失重达0.83%。
在本发明的一些方案中,上述晶型A的TGA图谱如图3所示。
本发明还提供了上述晶型A在制备治疗实体瘤的药物中的应用。
技术效果
本发明化合物表现出较优的对ERK1和ERK2酶抑制活性;本发明化合物表现出较优的对HT29细胞增殖抑制活性;本发明化合物在不同pH条件下具有较好的溶解度;本发明化合物具有优异的药代动力学性质和抑瘤效果。
定义和说明
除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
这里所采用的术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
术语“药学上可接受的盐”是指本发明化合物的盐,由本发明发现的具有特定取代基的化合物与相对无毒的酸或碱制备。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的碱与这类化合物接触的方式获得碱加成盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的酸与这类化合物接触的方式获得酸加成盐。本发明的某些特定的化合物含有碱性和酸性的官能团,从而可以被转换成任一碱或酸加成盐。
本发明的药学上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
除非另有说明,术语“异构体”意在包括几何异构体、顺反异构体、立体异构体、对映异构体、旋光异构体、非对映异构体和互变异构体。
本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(R)-和(S)-对映体、非对映异构体、(D)-异构体、(L)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围 之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本发明的范围之内。
除非另有说明,术语“对映异构体”或者“旋光异构体”是指互为镜像关系的立体异构体。
除非另有说明,术语“顺反异构体”或者“几何异构体”系由因双键或者成环碳原子单键不能自由旋转而引起。
除非另有说明,术语“非对映异构体”是指分子具有两个或多个手性中心,并且分子间为非镜像的关系的立体异构体。
除非另有说明,“(+)”表示右旋,“(-)”表示左旋,“(±)”表示外消旋。
除非另有说明,用楔形实线键
除非另有说明,术语“互变异构体”或“互变异构体形式”是指在室温下,不同官能团异构体处于动态平衡,并能很快的相互转化。若互变异构体是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(proton tautomer)(也称质子转移互变异构体(prototropic tautomer))包括通过质子迁移来进行的互相转化,如酮-烯醇异构化和亚胺-烯胺异构化。价键异构体(valence tautomer)包括一些成键电子的重组来进行的相互转化。其中酮-烯醇互变异构化的具体实例是戊烷-2,4-二酮与4-羟基戊-3-烯-2-酮两个互变异构体之间的互变。
除非另有说明,术语“富含一种异构体”、“异构体富集”、“富含一种对映体”或者“对映体富集”指其中一种异构体或对映体的含量小于100%,并且,该异构体或对映体的含量大于等于60%,或者大于等于70%,或者大于等于80%,或者大于等于90%,或者大于等于95%,或者大于等于96%,或者大于等于97%,或者大于等于98%,或者大于等于99%,或者大于等于99.5%,或者大于等于99.6%,或者大于等于99.7%,或者大于等于99.8%,或者大于等于99.9%。
除非另有说明,术语“异构体过量”或“对映体过量”指两种异构体或两种对映体相对百分数之间的差值。例如,其中一种异构体或对映体的含量为90%,另一种异构体或对映体的含量为10%,则异构体或对映体过量(ee值)为80%。
可以通过的手性合成或手性试剂或者其他常规技术制备光学活性的(R)-和(S)-异构体以及D和L异构体。如果想得到本发明某化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如氨基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和 非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成氨基甲酸盐)。
本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(
术语“任选”或“任选地”指的是随后描述的事件或状况可能但不是必需出现的,并且该描述包括其中所述事件或状况发生的情况以及所述事件或状况不发生的情况。
术语“被取代的”是指特定原子上的任意一个或多个氢原子被取代基取代,取代基可以包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。当取代基为氧(即=O)时,意味着两个氢原子被取代。氧取代不会发生在芳香基上。术语“任选被取代的”是指可以被取代,也可以不被取代,除非另有规定,取代基的种类和数目在化学上可以实现的基础上可以是任意的。
当任何变量(例如R)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被0-2个R所取代,则所述基团可以任选地至多被两个R所取代,并且每种情况下的R都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
当一个连接基团的数量为0时,比如-(CRR)
当一个取代基数量为0时,表示该取代基是不存在的,比如-A-(R)
当一个取代基为空缺时,表示该取代基是不存在的,比如A-X中X为空缺时表示该结构实际上是A。
当其中一个变量选自单键时,表示其连接的两个基团直接相连,比如A-L-Z中L代表单键时表示该结构实际上是A-Z。
当一个取代基的键可以交叉连接到一个环上的两一个以上原子时,这种取代基可以与这个环上的任意原子相键合,例如,结构单元
当所列举的连接基团没有指明其连接方向,其连接方向是任意的,例如,
除非另有规定,当某一基团具有一个或多个可连接位点时,该基团的任意一个或多个位点可以通过化学键与其他基团相连。当该化学键的连接方式是不定位的,且可连接位点存在H原子时,则连接化学键时,该位点的H原子的个数会随所连接化学键的个数而对应减少变成相应价数的基团。所述位点与其他基团连接的化学键可以用直形实线键
除非另有规定,环上原子的数目通常被定义为环的元数,例如,“5-7元环”是指环绕排列5-7个原子的“环”。
除非另有规定,术语“C
除非另有规定,术语“C
本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方 式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
在整个本说明书中提到的“一实施方案”或“实施方案”或“在另一实施方案中”或“在某些实施方案中”意指在至少一实施方案中包括与该实施方案所述的相关的具体参考要素、结构或特征。因此,在整个说明书中不同位置出现的短语“在一实施方案中”或“在实施方案中”或“在另一实施方案中”或“在某些实施方案中”不必全部指同一实施方案。此外,具体要素、结构或特征可以任何适当的方式在一个或多个实施方案中结合。
本发明中DSC图谱的Exo Up表示向上放热。
本发明的化合物可以通过本领域技术人员所熟知的常规方法来确认结构,如果本发明涉及化合物的绝对构型,则该绝对构型可以通过本领域常规技术手段予以确证。例如单晶X射线衍射法(SXRD),把培养出的单晶用Bruker D8 venture衍射仪收集衍射强度数据,光源为CuKα辐射,扫描方式:
下面会通过实施例具体描述本发明,这些实施例并不意味着对本发明的任何限制。
本发明所使用的所有溶剂是市售的,无需进一步纯化即可使用。
本发明所使用的溶剂可经市售获得。
本发明采用下述缩略词:aq代表水;eq代表当量、等量;DCM代表二氯甲烷;PE代表石油醚;DMSO代表二甲亚砜;EtOAc代表乙酸乙酯;EtOH代表乙醇;MeOH代表甲醇;BOC代表叔丁氧羰基是一种胺保护基团;r.t.代表室温;O/N代表过夜;THF代表四氢呋喃;Boc
化合物依据本领域常规命名原则或者使用
本发明粉末X-射线衍射(X-ray powder diffractometer,XRPD)方法
仪器型号:PANalytical(帕纳科)公司的X’Pert
测试方法:大约10mg样品用于XRPD检测。
表1 XRPD测试参数
本发明差热分析(Differential Scanning Calorimeter,DSC)方法
仪器型号:TA 2500差示扫描量热仪
表3 DSC仪器参数和测试方法
本发明热重分析(Thermal Gravimetric Analyzer,TGA)方法
仪器型号:TA 5500热重分析仪
表4 TGA仪器参数和测试方法
本发明动态蒸汽吸附分析(Dynamic Vapor Sorption,DVS)方法
动态水分吸附(DVS)曲线在SMS(Surface Measurement Systems)公司的DVS Intrinsic plus上采集。在25℃时的相对湿度用LiCl,Mg(NO
表5 DVS测试参数
表6 引湿性评价分类
注:ΔW%表示受试品在25±1℃和80±2%RH下的吸湿增重。
说明书附图
图1:WX001晶型A的Cu-Kα辐射的XRPD谱图;
图2:WX001晶型A的DSC谱图;
图3:WX001晶型A的TGA谱图;
图4:WX001晶型A的DVS谱图;
图5:人黑色素瘤A375模型动物在分别给予溶剂和WX001后的肿瘤生长曲线;
图6:人黑色素瘤A375模型动物在给药过程中的体重变化率。
下面通过实施例对本发明进行详细描述,但并不意味着对本发明任何不利限制。本文已经详细地描述了本发明,其中也公开了其具体实施例方式,对本领域的技术人员而言,在不脱离本发明精神和范围的情况下针对本发明具体实施方式进行各种变化和改进将是显而易见的。
参考例1
步骤1:化合物A-1-2的合成。
向反应瓶中加入A-1-1(150g,635.36mmol,1eq)、氯化钙(70.51g,635.36mmol,1eq)、四氢呋喃(500mL)和乙醇(1000mL)。氮气保护下,加入硼氢化钠(48.07g,1.27mol,2eq),20℃下混合液反应15小时。反应完毕后,反应液减压浓缩,浓缩物用15%柠檬酸水溶液(4000mL)稀释,乙酸乙酯(4000mL x 3)萃取。合并有机相,用饱和食盐水(2000mL)洗涤、无水硫酸钠干燥。过滤,滤液减压浓缩干得粗品。粗品用柱层析分离纯化得到A-1-2。
步骤2:化合物A-1-4的合成。
向反应瓶中加入A-1-2(102g,525.64mmol,1eq)和2-甲基四氢呋喃(1000mL)。抽换氮气后降温至-70℃,缓慢滴入二异丙基胺基锂(2M,525.64mL,2.0eq)。在-70℃下搅拌30分钟,随后缓慢滴入A-1-3(138.18g,788.46mmol,1.5eq)的2-甲基四氢呋喃(400mL)溶液,在-70℃下继续反应1小时。反应完毕后,反应液用饱和氯化铵水溶液(2000mL)淬灭,乙酸乙酯(2000mL x 4)萃取,分液合并得有机相。有机相用饱和食盐水(1000mL)洗涤、无水硫酸钠干燥。过滤,滤液减压浓缩干得粗品。粗品先用柱分离纯化,再经甲基叔丁基醚打浆纯化得到A-1-4。
步骤3:化合物A-1-5的合成。
向反应瓶中加入A-1-4(50g,135.39mmol,1eq)、偶氮二甲酰二哌啶(40.99g,162.47mmol,1.2eq)和四氢呋喃(500mL)。抽换氮气后降温至0℃,缓慢滴入三丁基膦(32.87g,162.47mmol,40.09mL,1.2eq)的四氢呋喃(100mL)溶液,0℃下混合液反应1小时。反应完毕后,反应液中依次加入水(500mL)和饱和食盐水(500mL),然后乙酸乙酯(500mL x 2)萃取,分液合并得有机相。有机相用饱和食盐水(300mL)洗涤、无水硫酸钠干燥。过滤,滤液减压浓缩干得粗品。向粗品中加入500mL甲基叔丁基醚打浆,过滤,收集滤液, 滤液浓缩得到粗品。粗品再加入50mL正己烷打浆,过滤,收集滤饼干燥得到A-1-5。
步骤4:化合物A-1-6的合成。
向反应瓶中加入A-1-5(29g,82.55mmol,1eq)、四氢呋喃(250mL)和水(50mL)。抽换氮气后加入碘(2.10g,8.26mmol,1.66mL,0.1eq),在50℃下混合液反应18小时。然后再补加碘(2.10g,8.26mmol,1.66mL,0.1eq),50℃下继续反应6小时。反应完毕后,得到A-1-6的粗品溶液直接用于下一步。
步骤5:化合物A-1-7的合成。
向装有A-1-6的粗品溶液中,加入碳酸钠(17.50g,165.11mmol,2eq),抽换氮气后加入碳酸二叔丁酯(27.03g,123.83mmol,28.45mL,1.5eq)。在20℃下混合液反应12小时。反应完毕,反应液倒入水(200mL)中,用乙酸乙酯(300mL x 3)萃取,分液合并得有机相。有机相用饱和食盐水(300mL x 3)洗涤、无水硫酸钠干燥。过滤,滤液减压浓缩得粗品。粗品通过柱层析分离纯化得到A-1-7。
步骤6:化合A-1-8的合成。
向反应瓶中加入A-1-7(26.5g,76.32mmol,1eq)、冰乙酸(1.37g,22.90mmol,1.31mL,0.3eq)和乙腈(260mL),抽换氮气后加热至50℃,滴入亚氯酸钠(32.48g,305.28mmol,85%纯度,4eq)的水(70mL)溶液,滴加完毕后,在50℃下继续反应12小时。然后再补加亚氯酸钠(8.97g,99.21mmol,1.3eq)、冰乙酸(458.31mg,7.63mmol,436.49μL,0.1eq),在50℃下继续反应6小时。反应完毕后,反应液用饱和亚硫酸钠水溶液(150mL)淬灭,再加入水(90mL),静置分出有机相,水相用乙酸乙酯(90mL)萃取。合并有机相用饱和食盐水(90mL)洗涤、无水硫酸钠干燥。过滤,滤液浓缩得粗品。粗品用乙酸乙酯∶正己烷(1∶5,120mL)搅拌匀浆,过滤,收集滤饼干燥得到A-1-8。
步骤7:化合物A-1的合成。
在干燥的反应瓶中加入A-1-8(10g,27.68mmol,1eq)和二氯甲烷(100mL),0℃下加入三氟乙酸(41.04g,359.90mmol,26.65mL,13eq),随后在0℃下反应0.5小时。反应完毕,将反应液缓慢倒入饱和碳酸氢钠水溶液(1000mL)中,调节pH至7~8。用二氯甲烷(1000mL x 3)萃取,分液合并得有机相。有机相用无水硫酸钠干燥,过滤,滤液减压浓缩得到A-1。
参考例2
步骤1:化合物B-1-2的合成。
向反应瓶中加入氢氧化钠(590.8g,14.8mol,1.05eq)和冰水(20L)、B-1-1(2000.00g,14.07mol,1eq),然后加入碘甲烷(2495.80g,17.59mol,1.25eq),在25℃下反应2小时。反应完毕后,将6N的冰盐酸水溶液缓慢加入反应瓶中,调节pH至6~7,搅拌0.5小时。过滤,收集滤饼。向滤饼中加入乙腈(500mL),搅拌0.5小时,过滤,收集滤饼,烘干得到B-1-2。
步骤2:化合物B-1-3的合成。
25℃下向反应瓶中加入乙腈(15L)、B-1-2(1500.00g,9.60mol,1eq),然后再加入三氯氧磷(1840.00g,12.0mol,1.25eq),缓慢升温至62℃,在62℃下反应12小时。将反应液倒入水(10.5L)中,加入固体碳酸氢钠调节pH至6-7。用乙酸乙酯(10.5L)萃取,分液得有机相。有机相用饱和食盐水(7.5L)洗涤、无水硫酸钠干燥。过滤,滤液减压浓缩得到B-1-3。
步骤3:化合物B-1的合成。
向反应瓶中加入B-1-3(100g,572.57mmol,1eq)、水(24.76g,1.37mol,24.76mL,2.4eq)和乙腈(1000mL)。抽换氮气后依次加入碘化钠(571.59g,3.81mol,6.66eq)、三甲基氯硅烷(186.61g,1.72mol,218.00mL,3eq),20℃下混合液反应14小时。反应完毕后,反应液中依次加入二氯甲烷(800mL)和用水(1200mL)。然后加碳酸氢钠固体调pH至6-7,分液,水相用二氯甲烷(500mL)萃取一次,合并有机相,有机相依次用饱和亚硫酸钠水溶液(500mL)和饱和食盐水(500mL)洗涤,无水硫酸钠干燥。过滤,滤液减压浓缩得粗品。粗品中加入正庚烷(0.5L),搅拌1小时,过滤,收集滤饼得到B-1。
实施例1
合成路线:
步骤1:WX001-2的合成
向反应瓶中加入A-1(500mg,1.92mmol,1eq)、WX001-1(427.54mg,2.30mmol,1.2eq)和N’N-二甲基甲酰胺(3mL)。抽换氮气后加入碳酸铯(935.92mg,2.87mmol,1.5eq),25℃反应16小时。反应完毕后,将反应液倒入水(20mL)中,用乙酸乙酯(30mL x 3)萃取,分液合并得有机相。有机相用饱和食盐水(30mL x 3)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩得粗品。粗品通过薄层层析硅胶板纯化得到WX001-2。LCMS(m/z):366,368[M+H]
步骤2:WX001-3的合成
在预先干燥的反应瓶中置换氩气加入湿钯碳(0.1g,819.15μmol,10%纯度,1eq)、乙醇(20mL),然后加入WX001-2(300mg,819.15μmol,1eq),置换氢气三次,在50℃,50Psi下搅拌反应24小时。反应完毕后,将反应液过滤,滤液减压浓缩得粗品。粗品通过薄层层析硅胶板纯化得到WX001-3。
步骤3:WX001-4的合成
向干燥的反应瓶中加入WX001-3(60mg,208.81μmol,1eq)、四氢呋喃(1mL)、氯化锌溶液(0.7M,298.31μL,1eq)。降温至-78℃加入六甲基二硅基胺基锂(1M,417.63μL,2eq),20℃反应1小时,得到反应液1。
氮气保护下,将B-1(55.57mg,208.81μmol,1eq)、四三苯基膦钯(7.24mg,6.26μmol,0.03eq)的N’N-二甲基乙酰胺(1mL)的混合液升温至50℃,随后滴加反应液1,滴加完毕后在50℃下混合液继续反应1小 时。反应完毕,将反应液倒入水(5mL)中,用二氯甲烷(30mL x 3)萃取,分液合并得有机相。有机相用饱和食盐水(30mL x 3)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩得粗品。粗品通过薄层层析硅胶板纯化得到WX001-4。LCMS(m/z):426.0[M+H]
步骤4:WX001-5的合成
向反应瓶中加入WX001-4(100mg,235.00μmol,1eq)、乙腈(1mL)和水(0.5mL),抽换氮气三次,然后加入单过硫酸氢钾(288.95mg,470.01μmol,2eq),在20℃混合液反应14小时。反应完毕,将反应液倒入饱和硫代硫酸钠水溶液中(5mL),用二氯甲烷(30mL x 3)萃取,分液合并得有机相。有机相分别用饱和碳酸氢钠水溶液(20mL)和饱和食盐水(30mL x 3)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩得粗品。粗品通过薄层层析硅胶板纯化得到WX001-5。LCMS(m/z):458.0[M+H]
步骤5:WX001的合成
向干燥的反应瓶中加入WX001-5(40mg,87.43μmol,1eq)、C-1(16.98mg,174.85μmol,2eq)和四氢呋喃(0.5mL)。置换氮气,降温至0℃滴加六甲基二硅基胺基锂(1M,166.11μL,1.9eq),0℃反应1小时。反应完毕,将反应液倒入水中(5mL),用二氯甲烷(30mL x 3)萃取,分液合并得有机相。有机相用饱和食盐水(30mL x 3)洗涤、无水硫酸钠干燥,过滤,滤液减压浓缩得粗品。粗品通过高效液相制备色谱(色谱柱:Waters Xbridge BEH C18 100*25mm*5μm;流动相:[水(10mM碳酸氢铵)-乙腈];B(乙腈)%:20%-50%,10分钟)纯化得WX001。
实施例2:WX001晶型A的制备
步骤1:化合物I-1-3的合成。
将四氢呋喃(12L)、I-1-1(1200g,5.69mol)加入到反应釜中。将四甲基乙二胺(661.59g,5.69mol)缓慢加入到反应釜中,抽换氮气后降温至-70℃(内温)。缓慢滴入二异丙基胺基锂(2M,6.83L),-70℃搅拌0.5小时。缓慢滴入I-1-2(1.76kg,9.39mol)的四氢呋喃(4.8L)溶液(滴加1.5小时),混合液在-70℃下反应1小时。反应完毕后,向反应液中滴加水(6L)淬灭反应,用水(2.4L)清洗反应瓶,合并混合液,搅拌。待温度升至10℃后,先分液,水相用乙酸乙酯(6L)萃取。剩余水相用硫酸氢钾水溶液(15.6L)调节pH至3~4后,用乙酸乙酯(6L)萃取三次。合并有机相,用饱和食盐水(6L)洗涤。有机相用无水硫酸钠1200g(m/m=1∶1)干燥,有机相在45℃下经减压浓缩得粗品。粗品加入二氯甲烷(2.4L)和异丙醚(7.2L)室温搅拌半小时。过滤,收集滤饼得I-1-3。
步骤2:化合物I-1-4的合成。
向反应釜中依次加入二氯甲烷(1330mL)、I-1-3(1330g,1.99mol,粗品)、4-二甲氨基吡啶(41.37g,338.61mmol)。分批加入N,N’-羰基二咪唑(419.86g,2.59mol),50℃下混合液反应36小时。反应完毕后,反应液加入2N盐酸水溶液(5.32L)调节pH至3-4,搅拌0.5小时,随后加入水(5.32L)浓缩除去有机溶剂,残余物经过滤得滤饼。滤饼经碳酸氢钠水溶液(5.32L)搅拌0.5小时,过滤,用水(2.66L)洗涤滤饼,收集滤饼。粗品中加入无水乙醇(10.64L),搅拌2小时,过滤,用无水乙醇(1.3L)洗涤滤饼,收集滤饼,干燥后得到I-1-4。
步骤3:化合物I-1-6的合成。
向反应瓶中加入I-1-4(283g,1.03mol)、碳酸铯(505.36g,1.55mol)和N,N’-二甲基甲酰胺(2800mL),抽换氮气后加入I-1-5(221.24g,1.19mol),20℃混合液反应12小时。反应完毕后,反应液缓慢倒入冰水(14L)中,搅拌1小时,过滤收集滤饼。粗产物中加入甲基叔丁基醚(5L)搅拌2小时,过滤,收集滤饼,干燥得到I-1-6。
步骤4:化合物I-1的合成。
平行三个反应,向反应瓶中加入I-1-6(183g,468.60mmol)和四氢呋喃(2745mL),抽换氮气后,20℃缓慢滴入二异丙基乙胺(181.69g,1.41mol)和亚磷酸二乙酯(194.14g,1.41mol),40℃下混合液反应16小时。反应完毕后,反应液用水(915mL)稀释,二氯甲烷(1830mL*3)萃取,有机相用饱和食盐水(915mL)洗涤,无水硫酸钠干燥,过滤,滤液在45℃经浓缩干燥得粗品。粗品加入甲叔醚和正己烷混合溶剂(总1098mL,二者体积比1∶5),搅拌1小时,过滤,收集滤饼,干燥。滤饼加入水(5400mL),搅拌1小时,过滤,收集滤饼,干燥得I-1。
步骤5:化合物I-3的合成。
向两个反应瓶中分别加入I-1(120g,403.05mmol)、氯化锌(0.7M,575.79mL)的四氢呋喃溶液(1200mL),抽换氮气后降温至0℃,缓慢滴入六甲基二硅基胺基锂(1M,806.11mL),自然升温至20℃,搅拌1小时,此为反应液1。向另一反应瓶中加入B-1(107.25g,403.05mmol、四三苯基膦钯(13.97g,12.09mmol)和N,N’-二甲基甲酰胺(600mL)反应液升温至50℃,为反应液2。向反应液2中缓慢滴入反应液1,50℃下混合液反应1小时。反应完毕后,用0.1M的乙二胺四乙酸二钠盐(10800mL)淬灭反应,搅拌30min。加入正庚烷(4800mL),搅拌0.5小时。过滤,收集滤饼,干燥得到粗品。粗品用乙醇(7200mL)在20℃打浆2小时,过滤,收集滤饼,滤饼晾干得到I-3。
步骤6:化合物I-4的合成。
向反应瓶中加入I-3(120g,282.00mmol)、乙腈(110mL)和水(550mL)。抽换氮气后加入单过硫酸氢钾(329.40g,535.81mmol),30℃下混合液反应12小时。反应完毕后,向反应液中加入200mL冰水混合物,随后加入饱和碳酸氢钠水溶液和饱和硫代硫酸钠水溶液各600mL,随后加入600mL水。过滤,收集滤饼,干燥,得到粗品。粗品加入600mL无水乙醇,搅拌1小时,过滤,收集滤饼得到I-4。
步骤7:WX001晶型A的合成。
向反应瓶中加入I-4(47g,102.73mmol)、C-1(25.94g,267.09mmol)、二氯甲烷(470mL)和四氢呋喃(470mL)。抽换氮气后-5℃(控制内温在-5-3℃)滴加六甲基二硅基胺基锂(1M,246.54mL,2.4eq),0℃下混合液反应0.5小时。反应完毕后,加入去离子水(470mL)淬灭。浓缩除去有机溶剂。过滤收集滤饼。滤饼用去离子水(1000mL)室温搅拌30分钟。过滤收集滤饼。滤饼用乙腈(1000mL)室温搅拌30min, 过滤收集滤饼得到WX001晶型A。
实施例3:WX001的多晶型筛选
1.气固渗透
称取约20mg每份的WX001晶型A于3mL小瓶中,另在20mL小瓶中加入约4mL溶剂,将3mL小瓶敞口置于20mL小瓶中后,将20mL小瓶密封。样品吸附溶剂部分溶解或者室温下静置7天后收集固体并进行XRPD测试。试验结果如表7所示。
表7 气固渗透试验小结
2.气液扩散
称取约20mg每份的WX001晶型A至3mL小瓶中,加入1.2~1.8mL溶剂溶解,另取20mL的小瓶向其中加入约4mL的反溶剂,将装有清液的3mL小瓶敞口置于20mL小瓶后,密封20mL的小瓶并于室温下静置。收集得到的固体并进行XRPD测试。试验结果如表8所示。
表8 气液渗透试验小结
*表示固体在室温挥发得到。
3.缓慢挥发
称取15~20mg的WX001晶型A至3mL小瓶中,加入1.0~3.0mL的溶剂溶解,用封口膜封住小瓶, 并在上面扎4个针孔,放置在室温下缓慢挥发。收集所得固体并进行XRPD测试。试验结果如表9所示。
表9 缓慢挥发试验小结
4.缓慢降温
称取15~35mg每份的WX001晶型A于3mL小瓶中,加入1.0~3.0mL的溶剂,在50℃下搅拌平衡约3.5小时后过滤取上清液。将所得上清液放置在生化培养箱中,以0.1℃/分钟从50℃降温至5℃后并在5℃保持恒温。收集析出的固体并进行XRPD测试。试验结果见表10。
表10 缓慢降温试验小结
*表示样品在5℃和-20℃下澄清,固体在室温挥发得到。
5.温度循环搅拌
称量约25mg每份的WX001晶型A至HPLC小瓶中,分别加入0.5mL的溶剂,得到的悬浮液在温度循环下(将样品加热至50℃后以0.1℃/分钟的速率降温至5℃,然后重复这一循环,最后样品保持在5℃)磁力搅拌(1000rpm),离心收集固体并进行XRPD测试。试验结果见表11。
表11 温度循环搅拌试验小结
6.室温悬浮搅拌
称量约25mg每份的WX001晶型A至HPLC小瓶中,分别加入0.5mL的溶剂,得到的浑浊液置于室温下磁力搅拌(1000rpm)3天后,离心收集固体并进行XRPD测试。试验结果见表12。
表12 室温悬浮搅拌试验小结
7. 50℃悬浮搅拌
称量约25mg每份的WX001晶型A至HPLC小瓶中,分别加入0.5mL的溶剂,得到的悬浮液在50℃下磁力搅拌(1000rpm)3天后,离心收集固体并进行XRPD测试。试验结果见表13。
表13 50℃悬浮搅拌试验小结
8.反溶剂添加法
分别称取约15mg的WX001晶型A加至20mL的小瓶内,用0.7~1.0mL的溶剂将固体完全溶解。向该澄清溶液中边搅拌(1000rpm)边滴加中的反溶剂,直至有固体析出,或当反溶剂总体积加至10mL后,无固体析出的样品在5℃下悬浮搅拌,澄清样品转移至-20℃下悬浮搅拌,仍澄清的样品转至室温挥发。分离析出的固体并进行XRPD测试,结果如表14所示。
表14 反溶剂添加试验小结
*表示样品在室温下澄清,固体在5℃搅拌得到。
实施例4:WX001晶型A的吸湿性研究
实验材料:
SMS DVS Advantage动态蒸汽吸附仪
实验方法:
取WX001晶型A 10~30mg置于DVS样品盘内进行测试。
实验结果:
WX001晶型A的DVS谱图如图4所示,ΔW=0.1134%。
实验结论:
WX001晶型A在25℃和80%RH下的吸湿增重为0.1134%,几乎无引湿性。
实施例5:WX001晶型A的稳定性试验
平行称取WX001晶型A样品12份,每份大约5mg,置于HPLC小瓶的底部,摊成薄薄一层。将放置在60℃/75%湿度条件恒温恒湿箱以及92.5%RH干燥器中的样品用封口膜封住瓶口,并扎些小孔,保证样品能与环境空气充分接触。将放置在60℃、光照及遮光条件下的样品盖紧瓶盖(其中遮光条件下的样品用锡箔纸包裹)。试验结果见下表15所示:
表15 WX001晶型A的固体稳定性试验结果
#:ICH条件
结论:WX001晶型A具有良好的稳定性。
实验例一、体外酶活性测试
1.实验目的:
测量化合物抑制ERK1和ERK2激酶活性的能力。
2.实验缓冲液:
20mM Hepes(pH 7.5),10mM MgCl
3.化合物处理:
将测试化合物溶于100%DMSO中,配制成特定浓度的母液。利用Integra Viaflo Assist智能移液器将化合物连续稀释在DMSO溶液中。
4.实验方法:
1)在新制备的反应缓冲液中配置底物MBP;
2)将ERK1(或ERK2)激酶加入到上述MBP溶液中并轻轻混合;
3)运用超声技术(Echo550;纳升范围)将溶于100%DMSO中的化合物加入到激酶反应体系中,在室温下孵育20分钟;
4)将
5)在室温下孵育2小时;
6)通过过滤--结合方法检测放射性的量;
7)ERK1(或ERK2)激酶活性计算方式为测试样品中剩余激酶活性占对照组(二甲基亚砜处理)激酶活性的比值。使用Prism(GraphPad软件)进行曲线拟合并计算IC
5.实验结果见表16和表17:
表16 ERK1酶活性测试结果
结论:本发明化合物表现出较优的对ERK1酶抑制活性。
表17 ERK2酶活性测试结果
结论:本发明化合物表现出较优的对ERK2酶抑制活性。
实验例二、体外细胞增殖抑制实验
1.实验目的:
测量化合物抑制HT29肿瘤细胞增值的能力。
2.化合物处理:
将测试化合物溶于100%DMSO中,配制成10mM的母液。
3.实验步骤与方法:
1)开启生物安全柜紫外灯,倒计时30分钟;
2)37℃水浴锅中,预热RPMI1640培养基和胰酶;
3)紫外照射完毕,开启生物安全柜,将预热培养基,胰酶,磷酸缓冲盐溶液(PBS)等用酒精擦拭并放入生物安全柜中;
4)将HT29细胞从培养箱中取出,在生物安全柜中去除旧培养基,加入10毫升PBS,轻轻摇晃,并去除PBS;
5)加入预热0.25%胰酶1.5毫升,水平晃动培养瓶,使其均匀覆盖到底部的细胞,置培养箱中2分钟;
6)用完全培养基终止细胞消化,并吹打至均匀的细胞悬液计数;
7)根据细胞计数结果,调整细胞悬液密度为1500细胞每孔,50微升每孔进行种板;
8)将化合物母液连续稀释在DMSO溶液中,并使用Tecan将化合物加入细胞板中;
9)将加过化合物的细胞板和CellTiterGlo放到室温平衡,后加CellTiterGlo 25微升至每孔,震荡1-2分钟,静置10分钟后检测信号值,并用XL-Fit分析数据,计算各化合物的IC
4.实验结果见表18:
表18 体外细胞活性测试结果
结论:本发明化合物表现出较优的对HT29细胞增殖抑制活性。
实验例三、小鼠体内PK研究
1.实验目的:
以雌性BALB/c小鼠为受试动物,单次给药后测定化合物血药浓度并评估药代动力学行为。
2.实验操作:
选择健康成年雌性BALB/c小鼠4只,2只为静注组,2只为口服组。静注组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与适量静注溶媒混合,涡旋并超声,制备得到0.5mg/mL澄清溶液,微孔滤膜过滤后备用;口服组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与溶媒混合后,涡旋并超声,制备得到0.3mg/mL溶液。小鼠1mg/kg静脉给药或3mg/kg口服给药后,收集一定时间的全血,制备得到血浆,以LC-MS/MS方法分析药物浓度,并用Phoenix WinNonlin软件(美国Pharsight公司)计算药代参数。注DMSO:二甲基亚砜;HP-β-CD:羟丙基-β-环糊精。
3.实验结果见表19:
表19 化合物PK测试结果
备注:C
结论:本发明化合物展现了优良的口服暴露量和生物利用度。
实验例四、溶解度研究
1.实验目的:
测定化合物的溶解度,评估化合物的溶解性。
2.测试溶液:
1)缓冲液A(pH 2.0):50mM磷酸盐缓冲液,pH 2.0;缓冲液B(pH 6.5):50mM磷酸盐缓冲液,pH 6.5;缓冲液C液(pH 7.4):50mM磷酸盐缓冲液,pH 7.4;
2)标准溶液的制备:
a)将50%的乙腈溶液和50%的缓冲溶液混合,得到稀释液;
b)10mM(10μL/化合物)化合物储备液加入稀释液(490μL/化合物)混合为200μM的检测标准溶液;
c)以10倍和200倍量的稀释液稀释200μM的紫外检测标准液,得到20μM,1μM的紫外标准溶液;
d)1μM、20μM、200μM的紫外标准溶液作为溶解性实验的标准溶液。
3.实验方法:
1)DMSO溶解化合物配制成10mM的储配液。盐酸胺碘酮,卡马西平,氯霉素作为溶解度实验的对照;
2)被测试化合物和对照的储备液(各10μL)放入96孔板中,分别加入三种不同的溶解介质(缓冲液A,B,C)490uL,对应溶解度溶液的pH分别为2.0,6.5和7.4。实验化合物的理论最大浓度为200μM,含DMSO 2%;
3)在室温(25±2℃)下以每分钟600转的转速,在摇床中振荡24小时;
4)吸取200μL的溶液于96孔板真空抽滤装置中抽滤后取至新96孔板中作为测试样品;
5)用HPLC-UV测试化合物浓度,HLPC条件如表20。
表20 HPLC条件
6)从低浓度到高浓度(1μM,20μM,200μM)注入3个紫外标准液至HPLC中,然后注入待测化合物的测试样品;
7)对紫外色谱峰进行积分,计算样品的溶解度。
4.实验结果见表21:
表21 化合物溶解度测试结果
结论:本发明化合物在不同pH条件下具有较好的溶解度。
实验例五、人黑色素瘤A375小鼠模型体内药效研究
1.实验目的:
使用人黑色素瘤A375细胞皮下异种移植肿瘤裸小鼠模型,评价WX001的抗肿瘤作用。
2.实验动物:
种属:小鼠
品系:BALB/c裸小鼠
周龄:6-8周龄
性别:雌性
体重:18-22克
供应商:维通利华实验动物技术有限公司
3.饲养环境:
动物在SPF级动物房以IVC(独立送风系统,恒温恒湿)笼具饲养(每笼3只),温度:20-26℃,湿度:40-70%;
笼具:以聚碳酸酯制成,体积375mm x 215mm x 180mm,垫料为玉米芯,每周更换一次;
食物:实验动物在整个实验阶段中可自由进食(照射灭菌,干颗粒状食物);
饮水:实验动物可自由饮用灭菌水;
笼具标识:每笼动物信息卡应注明笼内动物数目,性别,品系,接收日期,给药方案实验编号,组别以及实验开始日期;
动物标识:实验动物以耳标进行标识。
4.实验内容:
1)实验细胞及培养:人黑色素瘤A375细胞体外单层培养,培养条件为DMEM培养基中加10%胎牛血清,37℃ 5%CO
2)肿瘤组织接种及分组:0.1mL(5×10
表22 实验动物分组及给药方案
3)实验动物日常观察:本实验方案的拟定及任何修改均通过了实验动物管理与使用委员会(IACUC)的评估核准。实验动物的使用及福利遵照国际实验动物评估和认可委员会(AAALAC)的规定执行。每天监测动物的健康状况及死亡情况,例行检查包括观察肿瘤生长和药物治疗对动物日常行为表现的影响如行为活动,摄食摄水量(仅目测),体重变化(每周测量两次体重),外观体征或其它不正常情况。基于各组动物数量记录了组内动物死亡数和副作用。
4)受试物的配制
a)溶媒组:5%DMSO+95%(20%HP-β-CD)。
b)待测化合物组:称量定量的受试化合物于配药瓶内,加入相应体积的DMSO后涡旋,得到澄清溶液,在加入相应体积的20%HP-β-CD后涡旋,得到均一混悬液。
5)肿瘤测量和实验指标:
a)每周两次用游标卡尺测量肿瘤直径。肿瘤体积的计算公式为:TV=1/2×a×b
b)化合物的抑瘤疗效用TGI(%)评价。TGI(%),反映肿瘤生长抑制率。TGI(%)的计算:TGI(%)={[1-(某处理组给药结束时平均瘤体积-该处理组开始给药时平均瘤体积)]/(溶剂对照组治疗结束时平均瘤体积-溶剂对照组开始治疗时平均瘤体积)}×100%。
5.实验结果:
1)如表23和图5所示,在人黑色素瘤A375细胞皮下异种移植肿瘤裸小鼠模型上,口服给药至第21天,WX001能够剂量依赖性地抑制肿瘤生长,在12.5mg/kg、25mg/kg和50mg/kg三个剂量下,TGI分别为 45%、58%和102%。
2)实验动物的体重作为间接测定药物毒性的参考指标。如图6所示,给药至第21天时,溶剂对照组和WX001组所有动物的体重均未有明显下降,耐受性良好。
表23 小鼠A375模型体内药效实验结果
实验结论:WX001在12.5mg/kg、25mg/kg和50mg/kg三个给药剂量下,能够剂量依赖性地抑制肿瘤生长;给药过程中动物的体重未见明显下降,耐受性好。
实验例六、SD大鼠体内PK研究
1.实验目的:
以雄性SD大鼠为受试动物,单次给药后测定化合物血药浓度并评估药代动力学行为。
2.实验操作:
选择健康成年雄性SD大鼠6只,3只为静注组,3只为口服组。静注组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与适量静注溶媒混合,涡旋并超声,制备得到0.2mg/mL澄清溶液,微孔滤膜过滤后备用;口服组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与溶媒混合后,涡旋并超声,制备得到1mg/mL溶液。SD大鼠1mg/kg静脉给药或10mg/kg口服给药后,收集一定时间的全血,制备得到血浆,以LC-MS/MS方法分析药物浓度,并用Phoenix WinNonlin软件(美国Pharsight公司)计算药代参数。
注DMSO:二甲基亚砜;HP-β-CD:羟丙基-β-环糊精。
3.实验结果见表24:
表24 化合物PK测试结果
注:C
结论:本发明化合物展现了优良的口服暴露量和生物利用度。
实验例七、食蟹猴体内PK研究
1.实验目的:
以雄性食蟹猴为受试动物,单次给药后测定化合物血药浓度并评估药代动力学行为。
2.实验操作:
选择健康成年雄性食蟹猴5只,2只为静注组,3只为口服组。静注组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与适量静注溶媒混合,搅拌溶解,制备得到0.4mg/mL澄清溶液,微孔滤膜过滤后备用;口服组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与溶媒混合后,搅拌溶解,制备得到0.3mg/mL溶液。食蟹猴1mg/kg静脉给药或3mg/kg口服给药后,收集一定时间的全血,制备得到血浆,以LC-MS/MS方法分析药物浓度,并用Phoenix WinNonlin软件(美国Pharsight公司)计算药代参数。
注DMSO:二甲基亚砜;HP-β-CD:羟丙基-β-环糊精。
3.实验结果见表25:
表25 化合物PK测试结果
注:C
结论:本发明化合物展现了优良的口服暴露量和生物利用度。
实验例八、比格犬体内PK研究
1.实验目的:
以雄性比格犬为受试动物,单次给药后测定化合物血药浓度并评估药代动力学行为。
2.实验操作:
选择健康成年雄性比格犬5只,2只为静注组,3只为口服组。静注组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与适量静注溶媒混合,搅拌溶解,制备得到0.4mg/mL澄清溶液,微孔滤膜过滤后备用;口服组溶媒为5%DMSO+95%(20%HP-β-CD),待测化合物与溶媒混合后,搅拌溶解,制备得到0.3mg/mL溶液。食蟹猴1mg/kg静脉给药或3mg/kg口服给药后,收集一定时间的全血,制备得到血浆,以LC-MS/MS方法分析药物浓度,并用Phoenix WinNonlin软件(美国Pharsight公司)计算药代参数。
注DMSO:二甲基亚砜;HP-β-CD:羟丙基-β-环糊精。
3.实验结果见表26:
表26 化合物PK测试结果
注:C
结论:本发明化合物展现了优良的口服暴露量和生物利用度。
实验例九、hERG测试
1.试验目的:
使用全自动膜片钳方法测试化合物对hERG钾通道(human Ether-a-go-go Related Gene potassium channel)电流的影响。
2.实验方法:
2.1细胞准备
CHO-hERG细胞培养于175cm
2.2溶液配制
细胞外液配方(mM):140 NaCl,5 KCl,1 CaCl
细胞内液配方(mM):140 KCl,1 MgCl
2.3电生理记录过程
单细胞高阻抗封接和全细胞模式形成过程全部由Qpatch仪器自动完成,在获得全细胞记录模式后,细胞钳制在-80毫伏,在给予一个5秒的+40毫伏去极化刺激前,先给予一个50毫秒的-50毫伏前置电压,然后复极化到-50毫伏维持5秒,再回到-80毫伏。每15秒施加此电压刺激,记录2分钟后给予细胞外液记录5分钟,然后开始给药过程,化合物浓度从最低测试浓度开始,每个测试浓度给予2.5分钟,连续给完所有浓度后,给予阳性对照化合物3 M Cisapride。每个浓度至少测试3个细胞(n≥3)。
2.4化合物准备
将化合物20.00mM母液用DMSO进行稀释,取10μL化合物母液加入至20μL DMSO溶液中,3倍连续稀释至6个DMSO浓度。分别取4μL 6个DMSO浓度的化合物,加入至396μL的细胞外液中,100倍稀释至6个中间浓度,再分别取80μL的6个中间浓度化合物,加入至320μL的细胞外液中,5倍稀释至需要测试的最终浓度。最高测试浓度为40μM,依次分别为40,13.3,4.4,1.48,0.494,0.165μM共6 个浓度。最终测试浓度中的DMSO含量不超过0.2%,此浓度的DMSO对hERG钾通道没有影响。化合物准备由Bravo仪器完成整个稀释过程。
2.5数据分析
实验数据由GraphPad Prism 5.0软件进行分析。
2.6质量控制
环境:湿度20~50%,温度22~25℃
试剂:所用实验试剂购买于Sigma公司,纯度>98%
报告中的实验数据必须满足以下标准:
全细胞封接阻抗>100MΩ
尾电流幅度>300pA
药理学参数:
多浓度Cisapride对hERG通道的抑制效应设为阳性对照。
3.实验结果见表27:
表27 化合物hERG测试结果
结论:本发明化合物对hERG钾通道电流抑制作用弱,心脏毒性风险更低,安全性更高。
实验例十、血浆蛋白结合度测试(PPB)
1.实验目的:
研究受试化合物与人/小鼠/大鼠/犬/猴血浆白蛋白的结合度。
2.实验操作:
1)基质准备:实验当天,将血浆在冷水中解冻,并以3220rpm的速度离心5min,以去除所有血块。测量得到的血浆的pH值,并根据需要使用1%的磷酸或1N的氢氧化钠将其pH调整到7.4±0.1。
2)测试化合物的稀释步骤:测试化合物溶解在二甲基亚砜(DMSO)中,以制备浓度分别为10mM和2mM的原液。用98μL DMSO稀释2μL原液(2mM),制得40μM的工作溶液。用240μL DMSO稀释10μL原液,制得400μM对照化合物的工作溶液。将化合物的工作溶液(5μL)与空白基质(995μL)按1∶200的比例混合均匀以制备负载基质。
3)分析步骤:
a)将等量的30μL负载基质(n=2)转移至样品采集板,制备待测时间0(T0)样品用于残留测定。样品立即与相应的空白缓冲液进行匹配,最终体积为60μL,每孔中血浆与缓冲液的体积比为1∶1。然后,测试化合物的T0样品分别加入60μL的4%H
b)将剩余的血浆样品放在37±1℃的二氧化碳培养箱预培养30min。准备无蛋白样品(F样品),负载基质的样品(230μL)都被转移到聚碳酸酯管(n=2)中,并在37℃和155000×g(35000rpm)条件下超速离心4h。
c)为了制备T样品(测试样品),额外一份含基质样品转移到单独的96孔板(样品培育板)上,并在37℃下培育4h。
d)离心结束后,从上清液第二层(上层以下)取30μL的无蛋白样品和30μL的T样品转移到新的样品收集板中。每个样品与相应的空白缓冲液或基质混合,最终体积为60μL,基质∶缓冲液体积比1∶1。在所有样品加入60μL4%的H
3.实验结果见表28:
表28 化合物血浆蛋白结合度测试结果
结论:本发明化合物具有中等血浆蛋白结合度。
- 一种油浸式变压器油监测引出装置的改进结构
- 一种油浸变压器和电抗器运行状态的声纹数据采集装置
- 一种变压器和电抗器运行状态的声纹数据边缘处理系统
