原位形成神经帽的方法和装置
文献发布时间:2024-04-18 20:01:23
本申请是国际申请日为2019年7月2日,中国国家申请号为201980057395.X,发明名称为“原位形成神经帽的方法和装置”的发明专利申请的分案申请。
通过参考并入任意优先权申请
根据35U.S.C.§119(e),本申请要求作为2018年7月2日提交的美国临时申请No.62/692,858和2019年3月24日提交的美国临时申请No.62/822,881的非临时申请的权益,所述两篇美国临时申请的全部内容通过引用并入本文。
背景技术
神经瘤是良性肿瘤,起源于神经组织,由异常萌芽的轴突、许旺细胞和结缔组织组成。尽管神经瘤可能在各种类型的损伤后出现,但最常见和最具治疗挑战性的一些来自创伤或神经组织受损或横断的外科手术。截肢手术需要切断一条或多条感觉神经或混合神经。由神经瘤形成引起的慢性神经性疼痛,在高达30%的患者术后发生,并导致佩戴假体的下游挑战。除了创伤性和截肢相关的神经瘤之外,神经瘤形成还发生于多种临床适应症中,如普通外科手术(疝修补术、乳房切除术、腹腔镜胆囊切除术)、妇科手术(剖腹产、子宫切除术)和骨科手术(关节镜检查、截肢、膝关节置换)。
神经瘤是周围神经损伤后正常修复过程的一部分。当向神经远端或目标器官的神经恢复失败,并且神经纤维不正确和不规则地再生到周围的疤痕组织中时,形成它们。神经瘤包括缠结轴突、许旺细胞、神经内膜细胞和神经束膜细胞在致密胶原基质中的紊乱结构,周围有成纤维细胞(Mackinnon S E et al.1985.Alteration of neuroma formation bymanipulation of its microenvironment.Plast Reconstr Surg.76:345-53)。神经瘤发展过程中某些通道和受体的上调也可引起损伤轴突的异常敏感性和自发活动(Curtin Cand Carroll I.2009.Cutaneous neuroma physiology and its relationship tochronic pain.J.Hand Surg Am.34:1334-6)。已知随意排列的神经纤维会产生刺激中枢神经元的异常活动(Wall P D and Gutnick M.1974.Ongoing activity in peripheralnerves;physiology and pharmacology of impulses originating from neuroma.ExpNeurol.43:580-593)。这种正在进行的异常活动可以通过机械刺激(例如,在损伤部位不断重建的疤痕)来增强(Nordin M etal.1984.Ectopic sensory discharges andparesthesia in patients with disorders of peripheral nerves,dorsal roots anddorsal columns.Pain.20:231-245;Scadding J W.1981.Development of ongoingactivity,mechanosensitivity,and adrenaline sensitivity in severed peripheralnerve axons.Exp Neurol.73:345-364)。
神经残端的神经瘤或连续性神经瘤是神经损伤的不可避免的后果(当神经没有或不能修复时),会导致衰弱性疼痛。据估计,大约30%的神经瘤变得疼痛和有问题。如果神经瘤存在于皮肤表面或其附近,则特别有可能,因为物理刺激会在神经中引起信号传导,从而引起疼痛感。
近年来,世界上被截肢者的人数显著增加,战争伤害和血管障碍疾病(dysvascular disease)(如糖尿病)约占所有被截肢者病例的90%。仅在美国,目前就有大约170万截肢者,每年有超过23万新的截肢患者从医院出院。此外,据估计,到2050年,每年新增截肢人数将增加20%。
不幸的是,由于残肢持续疼痛,约25%的截肢者无法开始康复,更不用说恢复日常活动了。这种疼痛的原因可能是神经瘤。最近的一项研究报告称,在25年的研究期间,78%的截肢者因神经瘤的形成而遭受轻度至重度疼痛,其中63%的人将疼痛描述为持续酸痛。这种疼痛也经常被描述为手术截肢后持续多年的尖锐的、射击或电击样幻觉。此外,患者对覆盖于神经瘤上的皮肤触诊有压痛、自发灼痛、异常性疼痛(allodynia)和痛觉过敏。
虽然已经使用了各种方法来预防、最小化或防御神经瘤,以试图最小化神经性疼痛,但目前治疗神经瘤的临床“金标准”是牵引神经切除术,其中在牵引下向前拉动神经,并尽可能向后横切神经,希望如果形成神经瘤,它将位于组织深处。另一种公认的方法是将近端神经末端(其将形成神经瘤)埋在肌肉或骨头上的钻孔中。然后将神经缝合到肌肉或骨的骨膜上,以保持其位置。其基本原理是周围的组织缓冲和隔离神经瘤,以抑制刺激和由此产生的疼痛感觉。然而,该程序会使手术变得非常复杂,因为需要对其他健康组织进行大量的额外解剖来放置神经残端。这一点,再加上疗效差且多变,缺乏合适/可用的组织,以及需要额外的手术时间,导致很少进行该程序来防止神经瘤的形成。
另一种方法是将神经残端切回,留下一段或一套悬垂的神经外膜。这个突出部分可以被结扎以覆盖神经残端的表面。或者,可以从其他神经组织获得一段神经外膜,或者可以切回相应的神经残端,以形成可用于连接和覆盖其他神经残端的神经外膜套。
另一种常用的方法是缝合结扎,其中将一圈缝合线绕在神经末端并拉紧。这种压力被认为是机械地阻断了轴突的出口,并导致末端最终在该部位形成疤痕组织。然而,临床和临床前证据表明,该程序会导致结扎后形成疼痛的神经瘤。此外,结扎的神经通常不被定位成最小化对神经瘤的机械刺激,因为预期疤痕组织将对神经末端提供足够的保护。
临床上使用的其他方法包括将神经残端放置在具有开放的或更新近地具有密封端的固态可植入硅树脂或可生物降解聚合物管中(例如Polyganics NEUROCAP);再用收获的静脉或脂肪移植物包裹神经近端,目的是为神经异常再生提供物理屏障。生物材料植入装置和方法的使用需要在装置的开口中用缝线插入和固定神经,这可能是困难的,并进一步损伤神经末端。例如,目前用于固定NEUROCAP的程序需要将缝合线放置在神经的神经外膜中并穿过管壁,然后使用缝合线将神经拉入并填充到管腔中,并放置多条缝合线以将神经保持在装置中。这些方法和装置还可导致对神经瘤组织的机械刺激,这是由于1)组织顺应性和导管刚性之间的不匹配,以及2)帽不能防止帽内神经瘤的形成,从而导致疼痛的感觉。虽然这些神经帽在3个月至18个月的时间内降解,但在最初的3至6个月内会发生大量降解介导的质量损失,导致暂时受保护的神经瘤暴露于周围环境中。因此,这些固体可植入帽的功效受限于帽适形神经近端和防止神经瘤形成的能力,其次是它们随后的降解以使神经瘤暴露于周围环境。最后,由于这些方法需要使用细缝线(9-0尼龙)进行缝合,因此在手术放大(小型放大镜(loupes))下固定这些植入物或收集组织所需的程序时间和技能限制了外科医生更广泛地采用这些程序。
不幸的是,目前用于解决神经瘤的形成和由神经瘤引起的疼痛的方法还没有被广泛采用。因此,除了减少疤痕形成和神经周围粘连之外,还需要一种有效的技术或疗法来控制或抑制无意或计划的手术或创伤性神经损伤后的神经瘤形成。
已经在临床前探索了多种生物材料导管,以试图防止神经瘤的形成,包括基于聚丙交酯/聚己内酯的其他固体可植入生物可降解聚合物导管(Onode et al(2019)Nervecapping with a nerve conduit for the treatment of painful neuroma in the ratsciatic nerve,J Neurosurg.p.1-9;Yan et al(2014)Mechanisms of Nerve CappingTechnique in Prevention of Painful Neuroma Formation,PLOS One,9(4)p.1-11;Yiet al(2018)Painful Terminal Neuroma Prevention by Capping PGRD/PDLLA Conduitin Rat Sciatic Nerves Adv.Sci,1-11),atelocollagen(Sakai et al(2005)Preventionand Treatment of Amputation Neuroma by an Atelocollagen Tube in Rat SciaticNerves.J Biomed Mater Res Part B:Appl Biomater 73B:355-360)或猪小肠粘膜下层(Tork et al(2018),ePoster:Prevention of Neuromas with a Porcine SIS NerveCap:Histopathologic Evaluation,http://meeting.handsurgery.org/files/2018/ePosters/HSEP106.pdf)或微晶壳聚糖(Marcol et al(2011)Reduction of Post-Traumatic Neuroma and Epineural Scar Formation in Rat Sciatic Nerve byApplication of Microcrystallic Chitosan.Microsurgery,31:642-649)。到目前为止,这些方法在预防神经瘤的形成方面还不成功,或者还是因为固体植入物不能原位形成,并且产生潜在的空间以允许神经生长(outgrowth)和不同程度的神经瘤形成,或者,极为重要地,是因为这些材料在体内的持久性不足以预防神经瘤的形成。
本文公开的一些实施方案已经被证明在临床前防止神经瘤的形成,并且1)消除了在导管内缝合、牵引或填塞神经的需要,2)适形神经残端,为神经再生提供物理屏障,以及3)在神经损伤后的生长再生阶段,提供机械强度以防止神经再生,持续两个月,优选三个月或更长时间,以防止神经生长。本文所述的原位形成植入物可与周围组织相适应,粘附于但不压缩下面的神经组织,是柔性的,使得它们可在涉及关节的组织区域或神经相对于其他组织滑动的区域上移动,并防止在神经周围形成疤痕组织和粘连。最后,这些原位形成植入物中的一些可以在没有高级外科手术训练的情况下递送。在其他情况下,仍然需要一种技术来防止神经生长到周围组织中,并将横切或压缩的神经的生长引导到远端神经残端或同种异体移植物/自体移植物中。由此,在一些方面,描述了可以直接(通过与远端神经残端的直接接合/吻合)或间接(通过神经导管、引导通道、同种异体移植物、自体移植物)或通过生长许可基质引导神经从近端神经残端再生进入远端神经残端的无缝线技术。另外,在一些方面,描述了允许压制吻合位点以促进更好的神经再生的技术。最后,在一些方面,希望有一种技术能够快速和广泛地应用于神经,以防止在各种外科手术过程中对邻近神经的无意损伤。
发明内容
根据本发明的一个方面,提供了一种原位形成适形的(conforming)、保护性神经帽的方法,以抑制在切断的神经末端形成神经瘤。所述方法包括以下步骤:识别神经的切断端;将所述切断端定位在由结构(a form)限定的空腔中;将介质引入所述结构以包围所述切断端;并且允许介质经历从第一相对可流动状态到第二相对不可流动状态的转变,以形成围绕切断端的保护性适形屏障。所述方法可以进一步包括移除所述结构的步骤,以留下形成的生物相容性原位保护性神经帽。
所述识别神经的切断端的步骤可以包括识别诸如通过切割或消融或通过创伤方式切断的神经。所述结构可以包括神经引导件(a nerve guide),并且定位步骤可以包括定位神经,使得所述神经引导件将所述切断端保持在与所述结构的侧壁间隔开的空腔内。所述切断端可以定位在距离所述侧壁至少约0.1mm或2mm处,或者更优选地,距离所述侧壁约1mm处。优选地,所述结构或者是生物可吸收的,或者由柔性的不可降解的材料组成,所述材料在原位神经帽形成之后可以容易地从手术部位移除。
从可流动状态到不可流动状态的转变可在引入步骤的约1分钟内,或约30秒内,或约10秒内发生。所述方法还可以包括在引入步骤之前从切断的神经上吸去一定量的轴浆的步骤。
在本发明的一个实施方式中,所述结构可以包括其中空腔被暴露的第一构型和其中空腔被部分或完全覆盖的第二构型;并且还包括在引入神经步骤之后将所述结构从第一构型推进到第二构型的步骤。可选地,将所述结构从第一构型推进到第二构型的步骤可以在引入神经或介质步骤之前发生。所述结构可替代地可包括开孔泡沫,并且所述空腔包括泡沫内曲折的、互连的间隙体积。在后一个实施方案中,在与神经帽整合和形成神经帽后,所述结构将保持原位。
所述识别切断的神经的步骤可以包括切断目标神经的步骤。所述步骤可以另外包括在将神经放置在所述结构中之前,以斜角干净地横切神经。所述转变步骤可以包括交联反应或聚合以及使用原位形成的水凝胶,所述水凝胶可以插入宿主组织以在水凝胶和组织之间形成粘附。在优选实施方案中,所述水凝胶是中性或带负电荷的材料,具有亚微米或更小的孔,允许营养物和蛋白质交换,但不允许细胞渗透。在一种实施方式中,所述转变产生了合成的交联水凝胶保护屏障,通过所述屏障,神经不能在横切的神经残端周围再生。
使用PEG作为递送至神经的生物材料在本领域是众所周知的。越来越多的人认识到,生物材料(包括PEG水凝胶)需要针对特定的应用进行调整。性质,包括分子量、降解动力学、PEG形状(线性vs多臂vs树枝状)、交联度、取代度、交联类型(亲电-亲核或自由基)、胶凝时间、臂长(在多臂PEG的情况下)、官能团、水解键和其他因素(如pH值和缓冲液选择)是为针对神经的特定应用而定制的,以防止神经瘤的形成。
在一些实施方案中,本文公开了双组分原位形成生物材料组合物,其包含神经生长许可组分和神经生长抑制组分。
在一些实施方案中,首先递送神经生长许可组分,然后递送神经生长抑制组分。
在一些实施方案中,所述神经生长许可组分适形神经并促进神经向内生长进入、通过并穿过生物材料进入远端残端。
在一些实施方案中,所述神经生长抑制组分防止神经生长进入材料。
在一些实施方案中,所述神经生长抑制组分充当可以在其上发生神经再生的引导件。
在一些实施方案中,所述生物材料组分包括原位形成凝胶。
在一些实施方案中,所述生物材料组分包括原位形成的交联凝胶、微粒、纳米颗粒、浆液或胶束。
在一些实施方案中,所述生长许可组分和生长抑制组分都含有聚乙二醇(PEG)。
在一些实施方案中,所述PEG是多臂PEG。
在一些实施方案中,所述PEG由氨基甲酸乙酯或酰胺键组成。
在一些实施方案中,所述PEG由酯键组成。
在一些实施方案中,所述PEG另外包含5,000道尔顿或更小的线性封端的PEG。
在一些实施方案中,所述交联在PEG-NHS酯和PEG-胺或三赖氨酸之间进行。
在一些实施方案中,所述原位形成凝胶包含尺寸为1μm或更大的孔。
在一些实施方案中,所述原位形成凝胶包含棒或细丝。
在一些实施方案中,所述生长许可组分包含壳聚糖。
在一些实施方案中,所述生长许可组分包含聚赖氨酸,优选在0.001wt%和10wt%之间,更优选在0.01wt%和0.1wt%之间。
在一些实施方案中,所述神经生长许可组分包含0.001-20%之间的胶原,优选3-6wt%之间。
在一些实施方案中,所述神经生长许可组分之间包含纤维连接蛋白。
在一些实施方案中,所述生长许可组分包含聚左旋鸟氨酸。
在一些实施方案中,所述生长许可组分包括层粘连蛋白,优选0-5wt%,更优选0-0.5%。
在一些实施方案中,所述生长许可组分的溶胀小于20%,优选在5-20%之间。
在一些实施方案中,所述生长抑制组分的溶胀小于30%,优选在0-10%之间。
在一些实施方案中,所述生长许可组分的溶胀小于或等于生长抑制组分的溶胀。
在一些实施方案中,所述生长抑制组分的抗压强度大于10kPa,优选>30kPa。
在一些实施方案中,所述生长许可和生长抑制组分是不同的颜色。
在一些实施方案中,所述生长许可区包含支持神经存活、生长和再生的剂。
在一些实施方案中,所述生长许可区允许许旺细胞或神经胶质细胞的浸润。
在一些实施方案中,组合物包括可包含一种或多种生长因子、抗抑制肽或抗体和/或轴突导向线索的剂。
在一些实施方案中,所述系统包含支持细胞,如神经胶质细胞,包括许旺细胞、少突胶质细胞或祖细胞(如干细胞)。
在一些实施方案中,所述系统被递送到外周神经或脊髓。
在一些实施方案中,所述生长许可和生长抑制区域包括P2XR受体拮抗剂。
在一些实施方案中,所述P2XR受体拮抗剂是P2X7受体拮抗剂,包括亮蓝FCF(BBFCF)或亮蓝G(BBG)。
在一些实施方案中,所述P2XR拮抗剂是P2X3受体拮抗剂,例如。
在一些实施方案中,所述P2XR拮抗剂的浓度为水凝胶的0.001-0.55%。
在一些实施方案中,公开了包括两种或更多种原位形成水凝胶的试剂盒。所述试剂盒包括清楚地标记为生长许可施用器的双施用器系统和清楚地标记为生长抑制施用器的双施用器系统。每个组件都可以清晰地进行颜色编码,并包括粉末小瓶、重构/稀释溶液和促进剂(accelerator)溶液,用于双施用器系统。所述试剂盒还可包括两种或更多种结构——一种结构用于接受生长抑制水凝胶,另一种结构用于接受生长许可水凝胶。
在一些实施方案中,本文公开了一种递送双重原位形成水凝胶以治疗涉及神经的病况的方法。所述神经可能需要修复,例如端对端吻合、接合、用同种异体移植物或自体移植物或导管或包裹物修复、或间隙修复。
在一些实施方案中,生长许可区域被递送到近端神经残端和远端神经残端之间、端对端吻合部位之间、近端残端和同种异体移植物/自体移植物之间。
在一些实施方案中,在近端残端和移植物之间和/或移植物和远端残端之间递送生长许可区域。
在一些实施方案中,生长许可区域被递送到导管或包裹物内部。
在一些实施方案中,生长许可区域被递送至结构,其允许生长许可凝胶粘附于神经但不粘附于所述结构。
在一些实施方案中,生长抑制区域在生长许可区域之后递送。
在一些实施方案中,生长抑制区域覆盖近端和远端神经以及生长许可区域。
在一些实施方案中,试剂盒可以包括原位形成的水凝胶。所述试剂盒包括双施用器系统和粉末小瓶、重构/稀释溶液和促进剂溶液,用于双施用器系统。所述试剂盒还可以包括用于接收水凝胶的尺寸和长度范围内的结构的选择。
在一些实施方案中,生长抑制区域覆盖所述吻合连接处。
在一些实施方案中,生长抑制区域覆盖神经和导管或包裹物之间的连接处。
在一些实施方案中,生长抑制区域覆盖健康、受压或挫伤的神经。
在一些实施方案中,本文公开了一种原位形成的神经再生构建体,其包括:生长许可水凝胶桥,其具有第一和第二末端,并被配置为跨越两个神经末端之间的空间并促进神经跨桥再生;以及生长抑制水凝胶护套,其包封生长许可水凝胶桥,并被配置为延伸超过第一和第二末端以直接接触两个神经末端。
在一些实施方案中,本文公开了一种促进第一神经末端和第二神经末端之间的神经生长的方法,所述方法包括:将第一神经末端和第二神经末端放置在结构空腔中;将生长许可介质引入所述空腔中,并与所述第一神经末端和所述第二神经末端接触以形成连接;将所述连接放置在第二结构空腔中;以及将生长抑制介质引入第二结构空腔,以封装所述连接。
在一些实施方案中,本文公开了一种用于产生原位神经帽以抑制神经瘤形成的结构,所述结构包括:限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口,所述顶部开口位于第一平面上,并且具有小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并平行于第一平面;和凹形神经引导件,所述神经引导件由所述壁承载,并提供通向所述空腔的侧面入口。
在一些实施方案中,本文公开了一种用于在神经至神经连接处周围形成原位包裹物的结构,所述结构包括:限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口,所述顶部开口位于第一平面上,并且具有小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并平行于第一平面;第一凹形神经引导件,其由所述壁承载,并提供用于将第一神经末端定位在所述空腔中的第一侧入口;和第二凹形神经引导件,其由所述壁承载,并提供用于将第二神经末端定位在所述空腔中的第二侧入口。
在一些实施方案中,本文公开了用于原位形成生长抑制水凝胶的组合物,其具有:超过3个月的大于10kDa的抗压强度,至少3个月的体内持久性(包括少于15%的质量损失),和/或超过3个月的小于30%的溶胀。
在一些实施方案中,所述组合物包括以下中的一种或多种:聚(乙二醇)琥珀酰亚胺碳酸酯、P2XR受体拮抗剂和/或P2X7受体拮抗剂。
在一些实施方案中,P2X7受体拮抗剂是亮蓝FCF(BB FCF)或亮蓝G(BBG)。
在一些实施方案中,一种原位形成神经包裹物的方法,其包括识别神经的一部分;将神经定位在由结构限定的空腔中;将介质引入所述结构的空腔以包裹神经;并且允许介质经历从第一相对可流动状态到第二相对不可流动状态的转变,以在神经周围形成保护屏障。
在一些实施方案中,神经是健康的、受压的或挫伤的。
在一些实施方案中,神经通过直接吻合修复、同种异体移植物或自体移植物修复或导管修复。
在一些实施方案中,所述方法包括移除所述结构。
在一些实施方案中,所述结构包括神经引导件,并且定位包括定位神经,使得所述神经引导件维持神经与所述结构的侧壁间隔开。
在一些实施方案中,原位形成神经包裹物的方法包括在神经周围覆盖至少0.5mm的保护屏障。
在一些实施方案中,所述转变发生在引入步骤的大约10秒内。
在一些实施方案中,所述转变包括交联或聚合。
在一些实施方案中,所述转变产生了合成的交联水凝胶保护屏障。
在一些实施方案中,所述保护屏障具有至少约两个月的体内持久性。
在一些实施方案中,所述保护屏障具有至少约三个月的体内持久性。
在一些实施方案中,所述转变导致介质体积溶胀在约2%至约60%的范围内。
在一些实施方案中,所述转变导致介质体积溶胀在约20%至60%的范围内。
在一些实施方案中,所述方法包括在定位切断端之前原位形成结构;和/或在两个连续的步骤中围绕神经递送介质。
在一些实施方案中,切断目标神经的步骤和将结构定位在治疗部位的步骤由单个器械完成。
在一些实施方案中,可流动介质的粘度小于70,000cps。
在一些实施方案中,可流动介质的密度小于1g/cm
在一些实施方案中,所述结构由硅树脂组成。
在一些实施方案中,所述结构包含用于安置更长长度的神经的整体柱(integralpost)。
在一些实施方案中,所述包裹物由PEG组成。
在一些实施方案中,所述结构具有蛤壳式盖子。
在一些实施方案中,所述生长许可和生长抑制区域包含P2XR受体拮抗剂。
在一些实施方案中,所述P2XR受体拮抗剂是P2X7受体拮抗剂,包括亮蓝FCF或亮蓝G(BBG)。
在一些实施方案中,P2XR拮抗剂在水凝胶中的浓度在0.001-0.55%之间。
在一些实施方案中,本文公开了作为帽的原位形成水凝胶。在一些实施方案中,神经帽不是预先形成的。
本文公开的一些实施方案包括原位形成水凝胶支架或可原位形成/包裹在神经周围的水凝胶支架。在一些实施方案中,系统和方法不包括神经引导导管(具有两个开口端的管)而不是帽。在一些实施方案中,本文公开了用于以适当设计的结构围绕神经周向递送水凝胶的系统和方法。在一些实施方案中,系统和方法可以包括使用PEG水凝胶的结构或特定设计来防止神经瘤形成,例如周向递送、体内持久性、最小溶胀等。并将其转换成可移除的形式。
本文涉及如下项目:
1.一种原位形成神经帽的方法,其包括以下步骤:
识别神经的切断末端;
将所述切断末端定位在由结构限定的空腔中;
将介质引入所述结构的所述空腔中以包围所述切断末端;和
允许所述介质经历从第一相对可流动状态到第二相对不可流动状态的转变,以在切断的神经末端周围形成保护屏障。
2.根据项目1所述的原位形成神经帽的方法,其进一步包括移除所述结构的步骤。
3.根据项目1所述的原位形成神经帽的方法,其包括识别外科手术切断的神经。
4.根据项目1所述的原位形成神经帽的方法,其中所述结构包括神经引导件,并且所述定位步骤包括定位所述神经,使得所述神经引导件将所述切断末端保持在与所述结构的侧壁间隔开的空腔内。
5.根据项目4所述的原位形成神经帽的方法,其包括将所述切断末端定位在距离侧壁至少约1mm处。
6.根据项目1所述的原位形成神经帽的方法,其中所述转变发生在所述引入步骤的约30秒内。
7.根据项目1所述的原位形成神经帽的方法,其中所述转变发生在所述引入步骤的约10秒内。
8.根据项目1所述的原位形成神经帽的方法,其还包括在引入步骤之前从切断的神经吸去一定量的外胞浆的步骤。
9.根据项目1所述的原位形成神经帽的方法,其中所述结构包括第一构型和第二构型,在所述第一构型中所述空腔是暴露的,在所述第二构型中所述空腔被覆盖;并且所述方法还包括在引入介质步骤之前将所述结构从所述第一构型推进到所述第二构型的步骤。
10.根据项目1所述的原位形成神经帽的方法,其中所述结构包括第一构型和第二构型,在所述第一构型中所述空腔是暴露的,在所述第二构型中所述空腔被覆盖;并且所述方法还包括在引入神经步骤之前将所述结构从所述第一构型推进到所述第二构型的步骤。
11.根据项目1所述的原位形成神经帽的方法,其中所述结构包括开孔泡沫,并且所述空腔包括泡沫内的间隙体积。
12.根据项目1所述的原位形成神经帽的方法,其中所述识别切断的神经的步骤包括切断目标神经的步骤。
13.根据项目1所述的原位形成神经帽的方法,其中所述转变包括交联或聚合。
14.根据项目1所述的原位形成神经帽的方法,其中所述转变产生合成的交联水凝胶保护屏障。
15.根据项目1所述的原位形成神经帽的方法,其中所述保护屏障具有至少约两个月的体内持久性。
16.根据项目1所述的原位形成神经帽的方法,其中所述保护屏障具有至少约三个月的体内持久性。
17.根据项目1所述的原位形成神经帽的方法,其中所述转变导致介质的溶胀体积在约2%至约30%的范围内。
18.根据项目17所述的原位形成神经帽的方法,其中所述转变导致介质的溶胀体积在约5%至约20%的范围内。
19.根据项目1所述的原位形成神经帽的方法,其还包括在所述定位切断末端步骤之前,将结构定位在治疗部位的步骤。
20.根据项目1所述的原位形成神经帽的方法,其还包括在所述定位切断末端步骤之前,原位形成结构的步骤。
21.根据项目1所述的原位形成神经帽的方法,其进一步包括以两个连续步骤,围绕神经递送介质。
22.根据项目12所述的原位形成神经帽的方法,其中所述切断目标神经的步骤和将结构定位在治疗部位的步骤由单个器械完成。
23.根据项目1所述的原位形成神经帽的方法,其中所述可流动介质的粘度小于70,000cps。
24.根据项目1所述的原位形成神经帽的方法,其中所述可流动介质的密度小于1g/cm
25.根据项目1所述的原位形成神经帽的方法,其中所述结构由硅树脂组成。
26.根据项目1所述的原位形成神经帽的方法,其中所述结构包含用于安置神经的整体柱。
27.根据项目1所述的原位形成神经帽的方法,其中所述帽由PEG组成。
28.根据项目1所述的原位形成神经帽的方法,其中所述结构具有蛤壳盖。
29.一种双组分原位形成生物材料组合物,其包含神经生长许可组分和神经生长抑制组分。
30.根据项目29所述的组合物,其中首先递送神经生长许可组分,然后递送神经生长抑制组分。
31.根据项目29所述的组合物,其中所述神经生长许可组分适形于神经并促进神经向内生长进入、通过和穿过生物材料进入远端残端。
32.根据项目29所述的组合物,其中所述神经生长抑制组分防止神经生长进入材料。
33.根据项目29所述的组合物,其中所述神经生长抑制组分充当可以在其上发生神经再生的引导件。
34.根据项目29所述的组合物,其中所述生物材料组分包括原位形成凝胶。
35.根据项目29所述的组合物,其中所述生物材料组分包括原位形成交联凝胶、微粒、纳米颗粒、浆液或胶束。
36.根据项目29所述的组合物,其中所述生长许可组分和生长抑制组分都含有聚乙二醇(PEG)。
37.根据项目34所述的组合物,其中所述PEG是多臂PEG。
38.根据项目32所述的组合物,其中所述PEG由氨基甲酸乙酯或酰胺键组成。
39.根据项目31所述的组合物,其中所述PEG由酯键组成。
40.根据项目31所述的组合物,其中所述PEG另外包含5,000道尔顿或更小的线性封端的PEG。
41.根据项目36所述的组合物,其中所述交联在PEG-NHS酯和PEG-胺或三赖氨酸之间进行。
42.根据项目31所述的组合物,其中所述原位形成凝胶包含尺寸为1μm或更大的孔。
43.根据项目31所述的组合物,其中所述原位形成凝胶包含棒或细丝。
44.根据项目31所述的组合物,其中所述生长许可组分包含壳聚糖。
45.根据项目31所述的组合物,其中所述生长许可组分包含聚赖氨酸,优选在0.001和10wt%之间,更优选在0.01和0.1wt%之间。
46.根据项目31所述的组合物,其中所述神经生长许可组分包含0.001-20%,优选3-6wt%的胶原。
47.根据项目31所述的组合物,其中所述神经生长许可组分包含在纤连蛋白之间。
48.根据项目31所述的组合物,其中所述生长许可组分包含包含聚左旋鸟氨酸。
49.根据项目31所述的组合物,其中所述生长许可组分包括层粘连蛋白,优选在0-5wt%,更优选在0-0.5%。
50.根据项目31所述的组合物,其中所述生长许可组分的溶胀小于20%,优选在5-20%之间。
51.根据项目30所述的组合物,其中所述生长抑制组分的溶胀小于30%,优选在0-10%之间。
52.根据项目30所述的组合物,其中所述生长许可组分的溶胀小于或等于生长抑制组分的溶胀。
53.根据项目32所述的组合物,其中所述生长抑制组分的抗压强度大于10kPa,优选>30kPa。
54.根据项目30所述的组合物,其中所述生长许可组分和生长抑制组分是不同的颜色。
55.根据项目29所述的组合物,其中所述生长许可区包含支持神经存活、生长和再生的试剂。
56.根据项目29所述的组合物,其中所述生长许可区允许许旺细胞或神经胶质细胞的浸润。
57.根据项目29所述的组合物,其包括可包含一种或多种生长因子、抗抑制肽或抗体和/或轴突导向线索的试剂。
58.根据项目29所述的组合物,其中系统包含支持细胞如神经胶质细胞,包括许旺细胞、少突胶质细胞或祖细胞如干细胞。
59.根据项目29所述的组合物,其中系统被递送至外周神经或脊髓。
60.根据项目29所述的组合物,其中,所述。
61.根据项目30所述的组合物,其中所述生长许可区和生长抑制区含有P2XR受体拮抗剂。
62.根据项目61所述的组合物,其中所述P2XR受体拮抗剂是P2X7受体拮抗剂,包括亮蓝FCF(BB FCF)或亮蓝G(BBG)。
63.根据项目62所述的组合物,其中所述P2XR拮抗剂是P2X3受体拮抗剂,例如。
64.根据项目63所述的组合物,其中所述P2XR拮抗剂的浓度为水凝胶的0.001-0.55%。
65.一种包含两种原位形成水凝胶的试剂盒,所述试剂盒包括清楚地标记为生长许可施用器的双施用器系统和清楚地标记为生长抑制施用器的双施用器系统,每个组件都清楚地进行颜色编码,并包括粉末瓶、重构/稀释溶液和促进剂溶液,用于双施用器系统,所述试剂盒还可包括两种或更多种结构——一种结构用于接收生长抑制水凝胶,另一种结构用于接收生长许可水凝胶。
66.一种递送双原位形成水凝胶以治疗涉及神经的病况的方法。
67.根据项目66所述的方法,其中所述神经需要修复。
68.根据项目66所述的方法,其中所述修复是端对端吻合、接合、用同种异体移植物或自体移植物或导管或包裹物修复、或间隙修复。
69.根据项目66所述的方法,其中生长许可区域被递送到近端神经残端和远端神经残端之间、端对端吻合部位之间、近端残端和同种异体移植物/自体移植物之间。
70.根据项目66所述的方法,其中在近端残端和移植物之间和/或移植物和远端残端之间递送生长许可区域。
71.根据项目66所述的方法,其中生长许可区域被递送到导管或包裹物内部。
72.根据项目66所述的方法,其中生长许可区域被递送到结构中,允许生长许可凝胶粘附于神经但不粘附于所述结构。
73.根据项目66所述的方法,其中生长抑制区域在生长许可区域之后递送。
74.根据项目66所述的方法,其中生长抑制区域覆盖近端神经和远端神经以及生长许可区域。
75.一种包含原位形成水凝胶的试剂盒,所述试剂盒包括双施用器系统和粉末小瓶、重构/稀释溶液和促进剂溶液,用于双施用器系统,所述试剂盒还可以包括用于接收水凝胶的尺寸和长度范围内的结构的选择。
76.根据项目75所述的方法,其中生长抑制区覆盖吻合连接。
77.根据项目76所述的方法,其中生长抑制区覆盖神经和导管或包裹物之间的连接。
78.根据项目77所述的方法,其中生长抑制区覆盖健康、受压或挫伤的神经。
79.一种原位形成的神经再生构建体,其包括:
生长许可水凝胶桥,其具有第一末端和第二末端,并被配置为跨越两个神经末端之间的空间,并促进神经跨桥再生;和
生长抑制水凝胶护套,其包封所述生长许可水凝胶桥,并被配置为延伸超过第一末端和第二末端以直接接触所述两个神经末端。
80.一种促进第一神经末端和第二神经末端之间神经生长的方法,其包括以下步骤:
将所述第一神经末端和所述第二神经末端放置在结构空腔中;
将生长许可介质引入所述空腔中,并与所述第一神经末端和所述第二神经末端接触以形成连接;
将所述连接放入第二结构空腔中;和
将生长抑制介质引入所述第二结构空腔以封装所述连接。
81.一种用于产生原位神经帽以抑制神经瘤形成的结构,其包括:
限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口,所述顶部开口位于第一平面上,并且其面积小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并且平行于第一平面;和
凹形神经引导件,其由所述壁承载,并提供通向所述空腔的侧面入口。
82.一种用于在神经至神经连接处周围形成原位包裹物的结构,其包括:
限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口,所述顶部开口位于第一平面上,并且其面积小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并且平行于第一平面;
第一凹形神经引导件,其由所述壁承载,并提供用于将第一神经末端定位在所述空腔中的第一侧入口;和
第二凹形神经引导件,其由所述壁承载,并提供用于将第二神经末端定位在所述空腔中的第二侧入口。
83.一种用于原位形成生长抑制水凝胶的组合物,其具有:
超过3个月的大于10kDa的抗压强度
至少3个月的体内持久性,包括小于15%的质量损失,
和超过3个月的小于30%的溶胀。
84.根据项目83所述的组合物,其包含聚(乙二醇)琥珀酰亚胺基碳酸酯。
85.根据项目83所述的组合物,其中所述水凝胶包含P2XR受体拮抗剂。
86.据项目85所述的组合物,其中所述水凝胶包含P2X7受体拮抗剂。
87.根据项目86所述的组合物,其中所述P2X7受体拮抗剂是亮蓝FCF(BB FCF)或亮蓝G(BBG)。
88.一种原位形成神经包裹物的方法,其包括以下步骤:
识别神经的截面;
将所述神经定位在由结构限定的空腔中;
将介质引入所述结构的所述空腔中以包围所述神经;和
允许所述介质经历从第一相对可流动状态到第二相对不可流动状态的转变,以在所述神经周围形成保护屏障。
89.根据项目88所述的原位形成神经包裹物的方法,其中所述神经是健康的、受压的或挫伤的。
90.根据项目88所述的方法,其中所述神经通过直接吻合修复、用同种异体移植物或自体移植物修复或用导管修复。
91.根据项目88所述的方法,其进一步包括移除所述结构的步骤。
92.根据项目88所述的原位形成神经包裹物的方法,其中所述结构包括神经引导件,并且所述定位步骤包括定位所述神经,使得所述神经引导件保持所述神经与所述结构的侧壁间隔开。
93.一种原位形成神经包裹物的方法,其中所述神经被至少0.5mm的保护屏障周向覆盖。
94.根据项目93所述的原位形成神经帽的方法,其中所述转变发生在引入步骤的约10秒内。
95.根据项目93所述的原位形成神经帽的方法,其中所述转变包括交联或聚合。
96.根据项目93所述的原位形成神经帽的方法,其中所述转变产生合成的交联水凝胶保护屏障。
97.根据项目93所述的原位形成神经帽的方法,其中所述保护屏障具有至少约两个月的体内持久性。
98.根据项目93所述的原位形成神经帽的方法,其中所述保护屏障具有至少约三个月的体内持久性。
99.根据项目93所述的原位形成神经帽的方法,其中所述转变导致介质的溶胀体积在约2%至约60%的范围内。
100.根据项目93所述的原位形成神经帽的方法,其中所述转变导致介质的溶胀体积在约20%至60%的范围内。
101.根据项目93所述的原位形成神经帽的方法,其还包括在所述定位切断末端步骤之前原位形成结构的步骤。
102.根据项目93所述的原位形成神经帽的方法,其进一步包括以两个连续步骤,围绕神经递送介质。
103.根据项目93所述的原位形成神经帽的方法,其中所述切断目标神经的步骤和将结构定位在治疗部位的步骤由单个器械完成。
104.根据项目93所述的原位形成神经帽的方法,其中所述可流动介质的粘度小于70,000cps。
105.根据项目93所述的原位形成神经帽的方法,其中所述可流动介质的密度小于1g/cm
106.根据项目93所述的原位形成神经帽的方法,其中所述结构由硅树脂组成。107.根据项目93所述的原位形成神经包裹物的方法,其中所述结构包含用于安置较长长度神经的整体柱。
108.根据项目93所述的原位形成神经包裹物的方法,其中所述包裹物由PEG组成。
109.根据项目93所述的原位形成神经包裹物的方法,其中所述结构具有蛤壳盖。
110.根据项目93所述的组合物,其中所述生长许可区和生长抑制区含有P2XR受体拮抗剂。
111.根据项目110所述的组合物,其中所述P2XR受体拮抗剂是P2X7受体拮抗剂,包括亮蓝FCF或亮蓝G(BBG)。
112.根据项目111所述的组合物,其中所述P2XR拮抗剂的浓度为水凝胶的0.001-0.55%。
附图说明
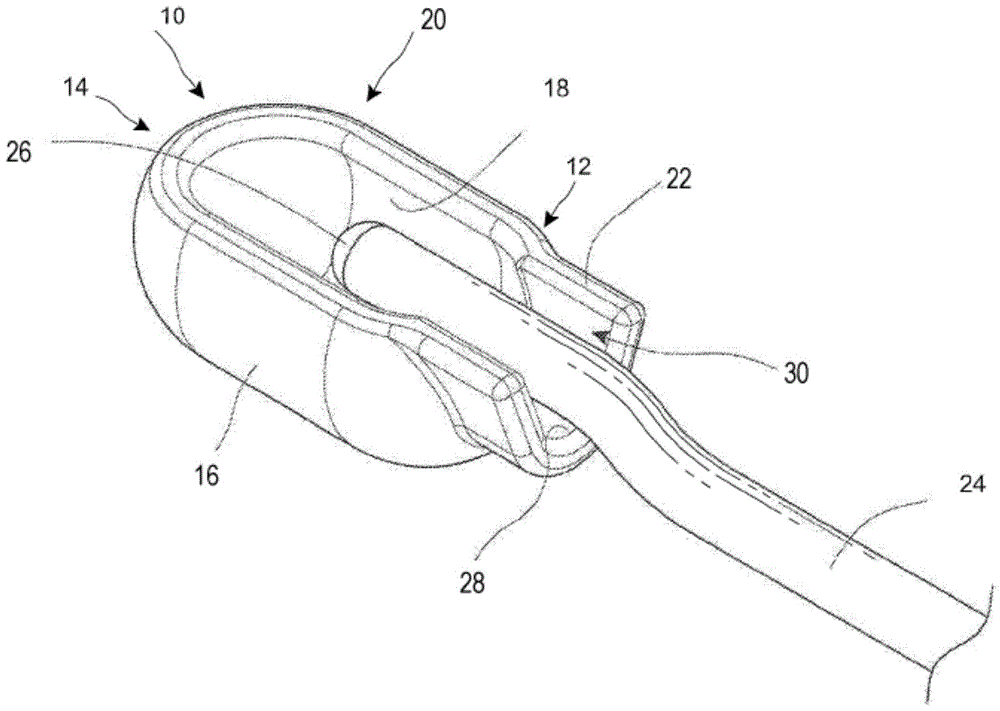
图1A是位于结构空腔内的神经末端的透视示意图。允许神经引导进入所述结构的入口区域。提供所述结构的长度以提供足够的表面积,水凝胶在所述表面积上形成并粘附到神经组织。
图1B是通过图1A结构的截面的侧向立视图。
图1C是图1A结构的顶视图。
图1D是图1A结构的端视图。
图1E是沿图1B中的1E-1E线截取的截面视图。
图2是根据本发明的一些实施方案形成的成形屏障的示意图。
图3是具有稳定特征的结构的透视图。
图4是用于在神经周围产生包裹物或在神经之间产生生长许可区域的结构的透视图。因此,根据应用,所述包裹物形式可以包含生长许可或生长抑制水凝胶。
图5A-5E显示了一系列步骤,用于产生由生长抑制水凝胶屏障包封的生长许可水凝胶连接。
图6是蛤壳结构的透视图。
图7-10C示出了用于横切神经和/或产生水凝胶连接的工具的实施方案。
图11A-11E示出了一种结构和使用方法的视图。
图12是带有稳定棒的结构的透视图。
图13A-13D是带有部分盖子和内部棒以支撑神经的帽结构的透视图。
图14A-14C是具有部分蛤壳的帽结构的透视图。
图15A-15C是可撕开的神经帽结构的透视图。
图16A-16E显示了在神经周围原位形成的水凝胶(生长抑制和生长允许)的透视图和照片,包括帽式和包裹式。
图17A-17B示出了临床前数据,其展示了在递送具有足够初始机械强度但不足够的体内持久性(相对于具有更长持续时间机械强度和持久性的水凝胶而言)的水凝胶后,神经瘤的形成。
图18A-18B示出了用于在递送低体积的前体溶液时提高水凝胶稠度(consistence)的混合元件设计。
具体实施方式
本发明的一些方面涉及使用可注射或可手术引入的介质在神经末端周围原位形成保护屏障,所述介质可以是凝胶/水凝胶或凝胶前体,以阻断在神经周围/与神经接触的神经再生和/或神经瘤形成以及炎症和粘连等。可通过开放手术或经皮(针、血管内/经血管)进入。所述神经末端或残端可以通过横切(切割)、创伤性损伤或通过包括RF、冷冻、超声、化学、热、微波或本领域已知的其他方式的消融来形成。
水凝胶可以“粘附”到神经的末端,在神经的末端周围提供紧贴的(snug)、适形的(conforming)、缓冲的(cushioning)屏障,而不是带有空隙(存在引起神经瘤形成的炎性细胞/液体囊肿)的帽。水凝胶是透明的(用于可视化)、低溶胀的、顺应的,并且被递送至结构,以产生体积为0.1至0.5ml的水凝胶帽。所述屏障可以完全通过机械阻断神经再生长来抑制神经瘤的形成。所述介质可以另外包含多种药物中的任何一种,例如用于抑制神经再生长的药物,如本文进一步详细讨论的。
目标神经的直径或非圆形外部构型可以变化很大,切割或切断角度和精度也可以变化。根据本发明的一些实施方案,加帽最好通过原位形成柔软、缓冲和适形的保护屏障来完成。可流动介质或介质前体可被引入,以包围并适形于神经末端的构型,然后被转变成不可流动的状态以形成与神经末端紧密贴合并与其结合的保护塞。为了在转变(例如,交联)之前和转变期间容纳介质,所述介质可以被引入到神经末端已经或将要被放置的结构中。将所述介质填充到结构中可允许介质围绕神经末端并转变成固态,同时以预定的体积和构型被包含,以始终产生保护性的、适形的神经帽,而不管神经残端的直径和构型如何。
参考图1A至1D,其示出了神经帽结构10。所述结构10在近端12和远端14之间延伸,并包括在其间延伸的侧壁16。侧壁16是凹面的,以在其中产生结构空腔18。所述结构空腔18通过窗口20暴露于所述结构的外部。
结构10的近端12设有神经引导件22,以便于神经24通过,从而将神经末端26定位在结构空腔18内。所述神经引导件22可以包括在结构10的近端壁12中的窗口或开口,并且被配置为在将神经末端26定位在结构空腔18内的水平处支撑神经。在图示的实施方案中,神经引导件22包括在向上凹陷的外壳上的支撑表面28,以产生神经引导件通道30。见图1D。图1E是沿图1B中的1E-1E线截取的截面视图。
参考图1B和1C,神经末端26被定位成使得在任何方向上将神经末端26与结构10的侧壁的内表面分开至少1mm,优选2mm或更大。这允许介质27流入所述结构空腔并围绕所述神经末端26,以在所有方向上提供保护屏障。
在介质从相对可流动状态转变为相对不可流动状态之后,所述结构10可以留在原位,或者可以被剥离以留下形成的栓塞(plug)形式的屏障60,如图2示意性所示。
为了在放置之后以及填充和转变阶段期间稳定结构10,可以添加至少一个稳定构件(feature)32。参见图3。所述稳定构件32可以是至少一个或两个或四个或更多的脊、凸缘或脚,其提供横向支撑表面34,用于接触相邻组织并稳定所述结构以防止其移动。所述横向支撑表面34可以沿着或平行于结构10的侧壁的切线延伸。
在本发明的一个实施方式中,提供了一种双水凝胶构建体,所述构建体在两个神经末端之间的连接处具有连接性,这是通过在两个相对的神经末端之间产生生长许可水凝胶连接,然后用生长抑制水凝胶胶囊包封所述连接而实现的。使用原位交联水凝胶作为生长许可介质产生了具有足够机械完整性和粘附性的连接,使得它可以作为一个单元被拾取,就像它是完整的神经一样,然后其被放置在第二结构中,以形成外部生长抑制水凝胶胶囊。
参考图4,结构10包括限定结构空腔68的弯曲侧壁66。第一神经引导件70和第二神经引导件72与空腔68连通,并且其尺寸和方向允许将第一和第二神经末端定位在空腔68中的某一位置,在所述位置上它们将彼此面对并且被引入空腔68中的可流动介质包围。
参照图5A-5E,示出了在两个神经末端之间形成双水凝胶传导性神经连接的一系列步骤。第一结构50包括细长的侧壁,所述侧壁弯曲形成凹面,例如呈半圆柱体的形式,其内径大于目标神经的直径。所述结构50具有第一末端52、第二末端54和在其间延伸的细长通道56。第一神经末端58从第一末端52定位在通道56内。第二神经末端60从第二末端54延伸到通道56中。结果是,在第一和第二神经末端与结构50的侧壁之间形成结构空腔62。
将可转变的生长许可水凝胶前体引入结构空腔62,以粘附到神经末端并原位聚合,以在第一神经末端58和第二神经末端60之间形成传导桥64,如图5B所示。在凝胶转变成流动性较低的状态后,如图所示移除所述结构50,留下包括由聚合的生长许可凝胶62的传导桥64连接的神经末端的连接。参见图5C。
此后,将聚合的连接置于第二结构66内,第二结构66具有将第一和第二神经支持物70、72分开的中心腔室68,例如,图4所示的。将第二生长抑制水凝胶前体引入中心腔室68中,以包围并覆盖传导桥64和神经末端,从而产生最终构建体,其中第一生长许可聚合物桥62被第二生长抑制聚合物胶囊70包封。参见图5E。
本发明一些实施方案的神经加帽或神经再生形式可以以蛤壳构型提供,如图6所示。第一壳体80限定了第一空腔82,第二壳体84限定了第二互补空腔86。所述第一和第二壳体通过铰链88(例如由薄聚合物膜制成的柔性活动铰链)连接。所述第一和第二壳体80、84可以围绕铰链88朝向彼此旋转,以形成封闭的腔室结构。
图7示出了夹持工具700的透视图,所述夹持工具700被配置成切割神经组织,以及容纳用于例如在横切神经后形成水凝胶神经连接的结构(如本文别处所公开的)。所述工具700可包括多个近端可移动把手702,每个把手连接到在枢轴704处连接的轴706,并且可具有如图所示的解锁构造,可利用锁定机构705(例如一系列互锁齿)移动到锁定构造。轴706的远端707可以包括末端效应器708,末端效应器708可以包括侧壁710,侧壁710可以具有如图所示的弯曲几何形状,以及可操作地连接到弯曲侧壁的互补切割元件712。在一些实施方案中,结构10可以在切割神经后连接到侧壁710。在其他实施方案中,结构可以包括整体形成的切割元件。在一些实施方案中,所述切割元件可以在切割后被拆卸或以其他方式移除,而将结构留在原位。
图8是图7的末端效应器708的特写视图,还示出了末端效应器708也可以承载结构10。图9是所述工具的一个实施方案的远端的侧视特写图,其示出了每个末端效应器可以包括切割元件和/或结构。
图10A-10C示出了在从神经末梢去除轴浆的同时横切神经的方法的各个阶段,以改善神经末端和水凝胶之间的紧密贴合(apposition)。在一些实施方案中,相对的末端效应器708可以包括刀片712,刀片712可以具有相等或不等的长度。如一些实施方案所示,每个末端效应器708上的刀片712通常可以是相对的,但是彼此偏移。启动末端效应器708可导致刀片横切神经24,产生神经末端26。所述刀片可以处于如前所述的结构内。吸收材料780(例如拭子)可以连接到一个或多个末端效应器708(例如,在结构内),并且靠近(例如直接邻近)一个或多个刀片712,以便在神经横断后吸收任何轴浆。拭子的尖端可以例如小于5mm,更优选小于2mm,以便它可以合适地配合在所述结构内,并在水凝胶递送时保持所述神经。
参考图11A-11E,在一些实施方案中,递送针1102推进到帽结构1100的开口1104中,以将水凝胶前体递送到神经1124中和周围。还示出了神经引导件1122,其可以如本文别处所述。参见图11A。水凝胶可以被递送到连续的应用中,以半填充所述结构并形成如图11B所示的水凝胶1150,然后完全填充所述结构,如图11C所示,并形成水凝胶帽,之后所述结构被移除。如图11D所示,水凝胶以小丸剂1152的形式被递送到神经末梢周围,然后帽的剩余部分随后被填充以形成水凝胶帽,之后移除所述结构,如图11E所示。
参考图12,在一些实施方案中,可生物降解的棒1215被放置为邻近神经1224并与其长度连续。所述棒1215为神经1224提供额外的强度,并且自然地粘附到神经1224,使得无论棒的位置如何,神经1224都粘附到棒1215。然后水凝胶溶液被递送到神经1224和可生物降解的棒1215上或周围,以形成神经帽。
参照图13A-13D,在一些实施方案中,在帽或包裹物结构1300的侧面提供一个、两个或多个孔1310,以引导针将前体溶液递送到正确的位置。根据递送前体溶液13A的需要,孔1310可以位于所述结构周围的许多位置之一。在帽或包裹物结构的底部可以包括柱1330,以向神经提供额外的支撑。将神经长度放置在柱1330的顶部,同时注意神经末梢不与柱1330接触。柱1330可以与帽或包裹物结构成一体,并且随后在移除所述结构时被移除。可选地,柱1330可以包括保持与水凝胶帽保持一体的可生物降解的柱。参见图13B和13C。在一些实施方案中,帽结构可以包括部分盖1320,如图13A所示。将所述结构倾斜,使得前体材料将首先流到并填充远端帽,围绕近端神经残端,然后填充神经帽的其余部分。如图13D所示,所述帽或包裹物结构还可以包括凸起的拉片(tabs)1333。
图14A-14C示出了类似于图13A-13D所示的神经帽结构1400的实施方案的多种视图,其中部分盖1420通过铰链1428与插入物1440连接,以帮助盖1420在帽结构1400上居中。还示出了神经引导件,其可以如本文别处所述。
图15A-15C示出了可撕开的帽结构1500的多种视图,所述帽结构1500可以包括可剥离的护套1560,所述护套1560包括侧壁1561,其中放置有神经(神经通道1562)。将前体溶液递送到第一神经通道1562中并围绕第一神经通道1562,随后将可剥离的护套1560从神经1524上撕下,例如使用如图15A所示的可撕开的拉片1564。然后将神经水凝胶1570旋转大约90度,并放置在第二个较大直径的可剥离帽结构1501中。然后将前体溶液施加到神经通道中以包围神经和第一帽结构。然后,可剥离的护套从第二可撕开的帽结构1501上撕下。最终的圆柱形帽结构包含居中的神经。所述神经1524然后可以旋转回到正常生理位置,如图15B所示。图15C示出了一种替代的可撕开的帽结构设计,其可以包括多个拉片。
图16A-16E显示了水凝胶填充帽结构并包围帽结构中的神经。图16B示出了在帽结构内部形成的水凝胶的照片。图16C示出了帽结构的高分辨率图像。图16D示出了围绕猪坐骨神经的帽结构和包裹物结构的例子。生长许可水凝胶(粉红色)的实例,其在包裹物结构中围绕神经,然后嵌入第二(蓝色)生长抑制水凝胶包裹物中。水凝胶被切成横截面,以便看到嵌入生长抑制(蓝色)水凝胶中的生长许可(粉色)水凝胶,如图16E所示。
图17A显示了在将DuraSeal以帽结构递送到横断的大鼠坐骨神经周围后的神经瘤形成。图17B显示在横切的大鼠坐骨神经周围递送先导制剂(lead formulation)后没有形成神经瘤。帽结构保持机械强度和3个月的体内持久性。
图18A-18B示意性示出了混合两部分水凝胶系统的混合元件的实施方案。在一些实施方案中,一个静态混合器1800将水凝胶前体溶液输送到中心腔室中,允许从混合器出来的初始材料回流和再循环。第二个静态混合器捕获充分混合的溶液,并通过针尖输送。还示出了流体入口1802(来自双腔施用器)和流体出口1804(通向钝针)。
下表涉及用于递送原位形成水凝胶的特定非限制性实施方案和装置。
/>
/>
外周神经刺激(PNS)。随着神经刺激器从脊椎向外周发展,并且硬件已经小型化,特制的外周神经刺激器正在开发和发展,用于阻断疼痛、刺激肌肉收缩、刺激或阻断神经以调节疾病和/或症状以及刺激神经再生。随着新的应用和新的神经刺激器的开发,对能够保持刺激电极和导管与目标神经直接或紧密贴合的需求的认识也有所提高,因为1)在程序上,将电极放置在神经附近可能是具有挑战性的,并且即使在理想地将其放置在神经附近之后,在程序上,电极也可能移动;以及2)在放置之后,随着肌肉收缩或植入物更好地位于组织内,电极可能通过患者的运动或操作而漂移。这可能导致到达目标神经的治疗的损失,并因此失去效力。
经皮递送。随着更高分辨率手持超声的出现和介入性疼痛医生的更好培训,经皮递送的植入式神经刺激器正越来越多地被用作治疗慢性疼痛的替代方法。在一个实施方案中,一旦使用经皮递送系统将电极放置在神经附近,就可以通过递送大约0.1-3cc的导电水凝胶以在电极周围形成并保持与神经紧密贴合,从而可以保持电极靠近神经的位置。水凝胶介质可以通过导管递送系统的内腔或电极的内腔递送,并将在原位形成。在一些实施方案中,电极的表面可以被设计成使得其界面更粗糙,从而允许水凝胶和电极之间更强的嵌入以防止导线(lead)迁移。在其他实施方案中,线圈或其他类似螺钉的设计被放置在电极的端部,以在电极、水凝胶和周围组织之间提供更好的牢固接触(purchase)。对于经皮施用,递送生长抑制水凝胶或具有中等至长期机械强度的水凝胶是理想的。同样,长期保持机械强度以保持电极在水凝胶内的位置是理想的,直到慢性异物反应足以将电极保持在适当位置。例如,为了保持较长时间的导线放置,选择含有更稳定的酯、氨基甲酸乙酯或酰胺键的交联PEG水凝胶(例如PEG-SG、PEG-SC或PEG-SGA)是可取的。
在另外的实施方案中,神经刺激器是可注射的无线植入物,并且采用小球、棒、珠、包裹物、薄片或封套(cuff)的形式,其通过邻近神经、神经节或丛的水凝胶保持在适当的位置。在一个实施方案中,首先将水凝胶递送到目标部位,并将神经刺激器递送到水凝胶中。在另一个实施方案中,首先递送神经刺激器植入物,将其调节至所需位置,然后将水凝胶递送至其周围以将其固定在所需位置。类似地,可以使用外部磁体来调整神经刺激器植入物的位置,以将植入物定向为邻近或接触神经或神经组织。在该实施方案中,可以调节胶凝时间以提供足够的时间用于神经刺激器的适当对准。在一些实施方案中,将多个可注射微刺激器植入物注射到可降解或不可降解的原位形成水凝胶中。在又一个实施方案中,微米棒或纳米棒形式的微刺激器被植入两个神经残端之间的生长许可水凝胶中,以促进神经突起延伸和加速再生。这些微刺激器可以通过凝胶并可能沿着微刺激器植入物传递磁场、化学场或电场来刺激神经再生。在一个实施方案中,所述微刺激器是纳米纤维,并且可以通过低规格针或导管注射到神经。在另一个实施方案中,短效或长效微刺激器可以与可注射的生物相容性生物材料(如水凝胶)一起递送,以形成神经刺激器anisogel。所述微刺激器是磁性的,允许所述微刺激器植入物的方向控制,并且例如,在凝胶从前体溶液转变成凝胶之前,允许微植入物在水凝胶内的平行排列。这些水凝胶将被注射到神经束或卷须的周围或附近,然后微刺激器可以在物理上提供它们可以生长和取向的区域,以及提供化学、电或磁场刺激以支持神经突起生长。
开放式手术。对于开放式手术应用,所述水凝胶也可以以类似的方式沉积在电极周围,在直接观察下,所述电极直接接触和/或邻近神经。同样,大约0.5至1cc水凝胶的沉积足以保持电极相对于神经的位置。在递送水凝胶之前,可以将电极插入邻近神经并与神经相连的硅树脂形式的凹槽中。可以设想具有用于电极的第二入口区域的形式。以这种方式,例如,当应用凝胶时,电极可以平行于神经排列或直接与神经贴合。对于神经刺激治疗只需要一天到几周的应用,拉动电极将使其相对容易地从水凝胶中取出。可以根据应用选择使用上述生长抑制水凝胶和生长许可水凝胶的组合。例如,放置在神经附近的电极只需要在适当的位置停留几天或几周的情况,可以使用短期的可降解水凝胶。这为水凝胶提供了足够的时间来保持原位,同时所述疗法被递送,然后迅速从组织中清除。这方面的一个例子是选择含有更多反应性酯键的交联PEG水凝胶,如PEG-SS或PEG-SAZ。这些水凝胶是导电的,因此适用于涉及神经刺激器的应用。
一般来说,选择低溶胀制剂对保持与电极的贴合至关重要;在一个实施方案中,所述水凝胶溶胀小于30%,更优选小于20%,以保持与神经和电极的贴合。
在又一个实施方案中,原位形成的水凝胶可用于将对流增强的递送系统固定到该部位。像植入式神经刺激器一样,药物递送导管可以固定在损伤神经部位附近约10mm处,尖端距离神经损伤约5mm。与可植入的神经刺激器一样,硅树脂结构可以设计成包括入口区或从硅树脂结构的顶部边缘切掉,以允许导管或刺激器导线停留在所述结构中,为加入水凝胶做准备。在递送治疗(神经刺激、对流增强的药物递送)后,可以从水凝胶中移除导管或神经刺激器,而不破坏水凝胶周围的保护屏障。例如美国专利No.9,386,990教导使用DuraSeal在体内持续2到4周来修复神经,水凝胶不能提供防止再生过程中(如在手术修复后3个月和4个月内)神经瘤形成或松弛(detension)神经所必需的持续机械强度。例如,含有快速降解酯键的交联多臂PEG(如PEG-SS或PEG-SG)非常适用于防止急性和亚急性粘连形成的应用。另一个例子是,低分子量的线性PEG在注射到损伤的神经周围时,已被证明起着融合剂(fusogen)的作用,并促进神经修复和再生(但不能提供机械强度或持久性来防止神经瘤的形成)。例如,PEG水凝胶(如PEG四丙烯酸酯水凝胶)已经在临床前模型中用于重新连接神经(Hubbell 2004/0195710)。
前面的例子中没有一个包含支持所需机械强度或体内持久性所必需的可降解键,所述机械强度或体内持久性是防止异常神经生长和神经瘤形成的应用所必需的。市售的PEG水凝胶,特别是具有水解酯键的常规PEG,不具有合适的机械强度或体内持久性来防止神经瘤的形成或松弛神经持续三至四个月,直到神经被修复。这些PEG和PEG凝胶最初可以具有足够的机械强度,以暂时帮助修复吻合处的神经和/或防止粘连形成,但是水凝胶在施用后两个月、或更优选三个月,没有足够的机械强度来防止异常的神经瘤形成(帽),并继续提供机械卸载(offloading)以支持再生神经(包裹物)。图16提供了一个在大鼠坐骨神经横断模型中,DuraSeal水凝胶在防止神经瘤形成方面缺乏耐久性的例子。含有酯键的水凝胶要么已经降解到足以不再为神经再生提供屏障,要么已经从神经上脱落,要么已经完全清除。因此,初始的机械屏障不足以作为防止神经生长和神经瘤形成的长期屏障。
此外,其他方法教导了直接在神经周围递送原位形成的水凝胶,而不保护下面的肌肉免受粘连,或者提供了用水凝胶系统地周向覆盖近端神经末梢的方法。原位形成的聚合物系统粘附到它们在交联或聚合过程中接触的周围组织上,尽管程度不同。如果非目标组织(例如肌肉或筋膜)没有受到保护或屏蔽,则水凝胶也粘附在该组织上。由于神经在筋膜平面内(通常是在肌肉之间)自由滑动,因此,限制它们的运动是不可取的,并可能导致疼痛和/或丧失疗效。这里描述的一些实施方案提供了将原位形成的水凝胶与周围环境分开的形式,以防止神经和周围组织之间的束缚,并允许神经在筋膜通道内滑动。
神经阻断。为了阻断神经再生,原位形成的生物材料需要具有防止神经迁移到所述生物材料中的物理性质,包括负电荷或中性电荷、较小的孔径、亲水性和/或较高的交联密度。虽然大多数研究集中在神经再生的材料上,但也有一些研究记录了神经不能生长的生物材料(包括基于聚(乙二醇)的水凝胶、基于琼脂糖和藻酸盐的水凝胶),特别是在聚合物浓度较高时。较高的浓度通常具有较高的交联密度,因此孔径较小。这些水凝胶由于其电荷、惰性表面、亲水性和孔径大小,能够在体外和体内防止神经突起生长。这种琼脂糖的一个例子是,当浓度超过1.25%重量/体积时,神经不会延伸穿过生物材料。在另一个例子中,PEG水凝胶可以在4%w/v或更高的浓度下防止神经瘤的形成。在其他实施方案中,如果固体含量和交联密度使得孔对于细胞向内生长来说太小,即使带正电荷或天然原位形成的生物材料也可以为神经再生提供屏障。
为了防止神经瘤的形成,原位形成的生物材料需要提供必要的机械强度,以作为两个月,更优选三个月或更长时间内神经再生的屏障。许多原位形成的凝胶(包括商业上的具有可生物降解酯键的原位形成的PEG水凝胶)最初可能具有足够的机械强度,但是水解的速度使得它们的交联已经断裂到足以使它们在1-2个月时的机械强度不足以阻止神经瘤的形成(见表1)。在大鼠坐骨神经模型中的体内实验证明,在横切的神经残端周围递送这些水凝胶后1-3个月形成球根状神经瘤。临床前测试表明,至少10千帕,更优选20千帕或更高的机械强度是防止神经瘤形成所必需的。在三个月时,体内研究表明,这些水凝胶已经完全降解并从该部位清除,或者已经失去足够的机械完整性,以至于神经已经生长至柔软、塌陷和/或断裂的凝胶,并形成神经瘤。因此,尽管现有技术教导了将PEG水凝胶用于神经修复的目的,但并非所有水凝胶都适合于支持防止神经瘤形成和异常神经生长所必需的长期机械强度和持久性要求。优选地,所述屏障具有至少约两个月或至少约三个月,优选四个月或更长时间的体内持久性,这取决于减少手术后慢性神经性疼痛所需的临床反应。水凝胶在体外和体内不同点的机械完整性可以通过压缩测试来评估,下面将进一步描述。
持久性生物可降解水凝胶的体内持久性与交联密度有关,因此与水凝胶的机械完整性有关。对于防止神经瘤形成的应用,水凝胶降解必须足够慢,以使水凝胶在神经试图再生的几周至几个月期间(其在人类中在大约3个月内发生并且可能是6个月或更长时间)不会失去显著的结构完整性。以这种方式,水凝胶的持久性和水凝胶的机械完整性的持久性对于提供持续保护并防止神经瘤和异常神经生长(优选持续3个月或更长时间,优选4个月或更长时间)至关重要。在使用可降解水凝胶的实施方案中,机械强度必须保持超过2个月,优选3个月,因此在这段时间内(优选3个月或更长时间内),水凝胶必须没有大量降解。类似地,机械完整性以及水凝胶的持久性对于由水凝胶在神经-神经或神经-移植物界面周围提供的持续负荷来说是至关重要的,持续时间优选为2个月,更优选为3个月,因为即使是已经通过直接接合而彼此直接缝合的神经也仍未恢复其原始强度(神经在横断后3个月具有大约60%的原始强度)。
开发原位形成的聚合物,特别是原位形成的合成水凝胶,包括具有更长的体内机械强度和超过2.5个月但少于12个月的更长持久性的基于PEG的水凝胶是具有挑战性的。例如,具有生物可降解酯的PEG水凝胶在神经的手术环境中和手术环境周围的体内持久性(数周至少于3个月)与含有生物可降解氨基甲酸乙酯或酰胺键的PEG水凝胶(在该皮下肌外位置的降解特性为近似9个月至18个月或更长)之间存在显著差异。一些实施方案关注具有防止神经瘤形成所需的机械强度和持久性的原位形成聚合物(优选多臂PEG)。特别地,描述了PEG水凝胶的溶胀、机械强度和体内持久性,以在需要长期预防异常神经生长以及在外科手术修复后的几个月内需要具有松弛神经和卸载神经的能力的应用中,具有长期安全性和有效性。
为了获得合适的体内机械强度和持久性,含有可降解酯键的常规PEG水凝胶(其可作为硬脑膜和肺密封剂在商业上广泛获得)不适用于神经周围的应用,因为它们在几个月内会丧失机械强度和/或被清除。简而言之,降解发生的速度足够快,以至于机械完整性不能保持足够长的时间,使得这些水凝胶适用于防粘连,但不适用于防止神经生长。在使用不可降解PEG水凝胶的实施方案中,水凝胶的机械强度基于水凝胶的初始机械强度,因为交联不会随时间降解。对一系列具有不同分子量、可降解键、交联密度的水凝胶进行的体外和体内测试表明,只有在3个月时具有足够机械强度(并具有体内持久性)的水凝胶才能防止神经瘤的形成。下表提供了水凝胶、降解时间和神经瘤形成的例子。图16A显示了DuraSeal递送后神经瘤的形成。
具有各种水解不稳定键的多臂PEG水凝胶的例子
体内持久性是指生物材料没有显著吸收,例如在给定时间点再吸收小于25%,优选小于15%。根据生物材料,这可以通过质量损失、交联密度损失或生物材料形式的变化来评估。在体内具有更长降解时间的活性键,例如PEG脲(例如PEG异氰酸酯、PEG-NCO)、PEG氨基甲酸乙酯(PEG-琥珀酰亚胺碳酸酯)(PEG-SC)和PEG氨基甲酸酯。水凝胶由聚乙二醇琥珀酰亚胺碳酸酯(PEG-SC)组成,其具有2个以上的臂,例如分子量为1K至50K,优选10K至20K,如10K、15K或20kDa的4臂、6臂或8臂PEG。在一些实施方案中,选择4臂10K PEG-SC、4臂20KPEG-SC、8臂10K PEG-SC、8臂15K PEG-SC或8臂20K PEG-SC,更优选4臂10K PEG-SC或8臂20KPEG-SC。以下专利被并入作为参考20160331738A1。
抗压强度。
期望的水凝胶抗压强度(弹性模量、杨氏模量)大于10kPa,优选大于20kPa,优选大于30kPa。在优选实施方案中,水凝胶的抗压强度在体内3个月后大于10kPa,更优选在施用后3个月时为40kPa。
在体外平衡后以及从大鼠皮下空间采集植入样品后,在台式计算机上测量抗压强度,其中水凝胶柱(d=6mm)被切割成100mm长,预平衡(在37℃下12小时),并评估抗压强度。用Instron以1mm/分钟的速度测量水凝胶制剂的抗压性能。模量计算为应力-应变曲线的0.05和0.17之间的线性区域的切线斜率。
各种制剂的抗压强度
虽然水凝胶(37℃,PBS)的体外机械强度和持久性通常与体内持久性不太相关,但水凝胶在体外3个月的机械强度维持是水凝胶为体内神经再生提供持续机械屏障能力的强有力指标。
在一些实施方案中,可生物降解水凝胶中可裂解的氨基甲酸酯、碳酸酯或酰胺接头允许更稳定的缓慢降解键,以保持必需的机械强度,从而在三个月或更长时间内防止神经生长,并因此,保持体内持久性,从而为神经再生提供持久的机械屏障。
通常,多臂PEG的结构是
C-[(PEG)
其中
C=多臂PEG的核心结构
n=每个臂上的PEG重复单元(25至60个单元)
M=调节剂
L=可裂解或不可裂解的接头(酯、氨基甲酸乙酯、酰胺、脲、氨基甲酸酯、碳酸酯、硫脲、硫酯、二硫化物、腙、肟、亚胺、脒、三唑和硫醇/马来酰亚胺)。
F=用于共价交联的反应性官能团,例如马来酰亚胺、硫醇或受保护的硫醇、醇、丙烯酸酯、丙烯酰胺、胺、受保护的胺、羧酸或受保护的羧酸、叠氮化物、炔烃、1,3-二烯、呋喃、α-卤代羰基和N-羟基琥珀酰亚胺、N-羟基磺基琥珀酰亚胺或硝基苯酯或碳酸酯
m=PEG臂的数量(例如2、3、4、6、8、10)
在一些实施方案中,水解调节剂(M)可以掺入水凝胶的主链中,以减缓水凝胶中酯键(L)的水解性降解。这可以通过与反应有关的给电子基团或通过增加与酯键邻近的碳链长度来实现,以增加疏水性并保护所述键免受水解。例如,PEG-SAP、PEG-SAZ是具有比PEG-SG更长的碳链的PEG-酯键的例子。在另一个实施方案中,在酯基旁边放置芳族基团,以提供酯键抗水解的额外稳定性,例如PEG-芳族羧基酯,包括苯甲酸酯或取代的苯甲酸酯。
在一些实施方案中,可以选择更稳定或缓慢降解的键,例如氨基甲酸乙酯键或酰胺键,以提供必要的机械强度和体内持久性,从而防止神经瘤的形成。
在其他实施方案中,水解调节剂(M)可以设计在水凝胶的主链中,以增加水凝胶中氨基甲酸乙酯的水解性降解。这可以通过加入加速反应的吸电子基团来实现。
在一个实施方案中,氨基甲酸酯键的水解速率可由相邻基团调节,从而调节水凝胶在体内的持久性。R1和R3可以是任何排列形式的任何脂肪族烃基(-CH
在另一个实施方案中,氨基甲酸酯键的水解速率可以由β位置的调节剂调节。所述调节剂可以是CF
或者,官能化PEG氨基甲酸乙酯和酯可以与另一种含有胺或受保护的胺、马来酰亚胺、硫醇或受保护的硫醇、丙烯酸酯、丙烯酰胺、羧酸或受保护的羧酸、叠氮化物、炔烃(包括环炔)、1-3二烯和呋喃、α-羟基羰基和N-羟基琥珀酰亚胺基、N-羟基磺基琥珀酰亚胺基或硝基苯酯或碳酸酯的反应性聚合物或小分子(例如三赖氨酸)共价交联。
在其他实施方案中,较快降解的PEG酯和较慢降解的PEG-SGA或PEG-SC按10∶1或5∶1的比例的共混物可以允许体内降解曲线的减慢。类似地,交联形成氨基甲酸酯键和PEG-碳酸酯键的多臂PEG-SC和PEG-胺的共混物(PEG-SC和羟基官能团的延迟反应),形成混合的60:40水凝胶(Kelmansky et al(2017)In Situ Dual Cross-Linking of Neat BiogelWith Controlled Mechancal and Delivery Properties.Molecular Pharmaceutics,14(10)3609-3616)。
在其它实施方案中,多臂PEG可与其它可水解性降解的聚合物的嵌段组合,所述可水解性降解的聚合物可用于定制所述PEG水凝胶的降解时间。例如,具有聚酯二嵌段或三嵌段的软链段可以用低分子量聚酯区域合成,以允许水凝胶在水性环境中形成(聚己内酯、聚乳酸、聚乙醇酸、聚氨酯、聚羟基链烷酸酯(PHA)、聚(己二酸乙二醇酯)(PEA)、脂肪族二异氰酸酯(例如异佛尔酮二异氰酸酯(IPDI)或L-赖氨酸乙酯二异氰酸酯(LDI))。这些嵌段可以由丙交酯、乙交酯或己内酯区域组成,根据结晶度(D,L或L,L),这些区域可以用于为水凝胶提供额外的机械强度,从而允许调节降解曲线。例如,可以将己内酯嵌段加入到多臂PEG中,每个臂包含PEG-PCL-NHS酯。在该实施方案中,所述PCL结构域可以延长先前具有水解酯键的体内持久性较差的多臂PEG的降解。在优选的实施方案中,在PEG臂上添加1-5kDa,优选1-2kDa的PCL嵌段。例如,4臂28KPEG-PCL-NHS酯可以与4臂10K PEG-胺反应以原位形成交联水凝胶,其中所述PEG是2K嵌段。嵌段的加入使得水凝胶通过化学和物理交联原位形成。氨基酸也可以作为增链剂掺入PEG-SC中,以改善PEG氨基甲酸乙酯的降解。在一些实施方案中,选择低分子量三官能聚酯多元醇进行掺入。请参考图1-用于合成生物稳定和可生物降解的聚氨酯的常见单体,其并入本文作为参考(章节:用于心血管应用的聚氨酯的降解,书:生物材料科学和生物医学应用的进展)。
在一些实施方案中,异双官能交联剂用于使聚酯能够与一些臂和NHS酯或具有其它臂的其它官能团共轭。
在其他实施方案中,可以将赋形剂掺入水凝胶中以改变水凝胶的机械强度、密度、表面张力、流动性和体内持久性。当水凝胶形成时,这些调节剂被包封在水凝胶中。调节剂可以包括两亲性赋形剂(如维生素E TPGS),低分子量聚酯(如己内酯)或溶剂(如乙醇)。在一个实施方案中,将乙醇掺入稀释剂或促进剂溶液中,以产生5%至70%v/v的乙醇负载水凝胶。所述乙醇提高了水凝胶的弹性,并降低了相对于神经密度的水凝胶前体溶液的密度。此外,可以在水凝胶中掺入低浓度的乙醇,以提高PEG粉末悬浮后PEG/稀释剂溶液的使用寿命或功能寿命。在另一个实施方案中,普朗尼克(Pluronic)可以掺入稀释剂或促进剂溶液中以得到5-15%w/v,从而产生具有改善的弹性和体内持久性的PEG-SG水凝胶。在另一个实施方案中,将低分子己内酯掺入稀释剂溶液中,得到1-5%w/v的PEG/己内酯共混水凝胶。在另一个实施方案中,可以将维生素TPGS掺入稀释剂溶液中,得到5-20%w/v的PEG/维生素ETPGS共混物。
溶胀这些水凝胶的另一个关键要素是应用于神经周围的水凝胶的溶胀。当水凝胶围绕物体(例如神经)周向递送时,在向外的径向方向上经历正向溶胀。最初,水凝胶在与周围环境中的流体平衡时经历平衡介导的溶胀,随后,当临界数量的水解键断裂时,水凝胶由于机械强度的损失而溶胀。后一阶段的降解介导的溶胀导致机械强度的逐渐丧失和水凝胶软化,水凝胶塌陷并最终从该部位被清除。其中横切的大鼠坐骨神经被溶胀了5%、10%、20%、30%和60%的水凝胶包围的体内实验表明,溶胀超过30%的水凝胶由于在神经和水凝胶之间产生间隙而更有可能从神经上脱落。值得注意的是,当在体外或体内平衡时,溶胀度等于或小于0%的PEG水凝胶会收缩,由此产生的压缩可能会导致持续的水凝胶介导的局部神经疼痛。例如,所述DuraSeal水凝胶在原位递送时会显著溶胀,并有从近端神经残端脱落的趋势。
平衡溶胀。对于将水凝胶递送至神经以防止神经再生的应用,保持神经与适形性水凝胶之间的紧密粘附和贴合是理想的。因此,使水凝胶递送后的平衡溶胀最小化是合乎需要的。当水凝胶在原位环境中与流体平衡时,平衡溶胀在几分钟到几天内发生。在一个实施方案中,水凝胶溶胀大于0%但小于40%,优选大于5%且小于30%,更优选大于5%且小于25%。
此外,在一些实施方案中,希望避免水凝胶收缩,因为这些水凝胶可能压迫神经并导致异常的神经放电,因此优选使用溶胀大于0%的水凝胶。此外,神经在受伤后可能会溶胀,因此需要一些溶胀度来给神经留出一些溶胀的空间。
平衡溶胀最好在体外在体温条件下进行评估(37℃在PBS中)。水凝胶样品在圆柱形硅树脂管(6mm)中制备,并切割成6mm直径×12mm长度的尺寸。样品称重并在37℃下合并到PBS中。在37℃的PBS中溶胀12-24小时后,取出样品并再次称重。通过质量增加的百分比来计算溶胀。
降解溶胀。在最初的平衡溶胀后,生物可降解或生物溶蚀性水凝胶的第二个特征是对由于水凝胶降解而发生的第二个仍在进行的溶胀阶段的认识。溶胀可能通过水凝胶中的水解、酶促或氧化敏感键发生。这是一个同样重要的特征,因为水凝胶需要在神经上保留一个月或更长时间,更优选两个月或更长时间,更优选三个月。在动物模型中,该时间段较短,而在临床环境中,该时间段较长。在某些情况下,如果降解速度过快,水凝胶可能断裂并从神经上脱落,或者在水凝胶能够起到防止神经生长和/或预防神经瘤的作用之前被清除。在其他情况下,如果水凝胶在神经上看起来完好无损,但由于降解,水凝胶内的机械完整性可能会显著丧失,神经可能会延伸到软化或断裂的水凝胶中并形成神经瘤。因此,优选生物可降解系统在3个月时具有不超过50%的水解不稳定键断裂,更优选不超过30%的键断裂,甚至更优选不超过20%的键断裂。在水凝胶为神经再生提供机械屏障的一段时间后,交联密度会下降,降解会继续,直到水凝胶被完全清除。键的损失可以部分通过水凝胶的机械完整性的降低来评估。键的损失可以部分通过水凝胶的机械完整性的降低来评估。因此,希望水凝胶在递送后3个月保持40kPa的抗压模量,这种水凝胶足够硬,以至于神经不会生长通过它。
压力。除了确保溶胀不会大到使水凝胶从神经上脱落,还需要确认溶胀(或低溶胀、收缩)不会导致神经压迫。在一个实验中,将压力传感器导管放置在神经旁边,并将原位形成水凝胶递送到神经/压力传感器(Millar Mikro-Tip压力导管,3.5F,单直,AD仪器)周围来形成。然后将水凝胶置于37℃的PBS中,测量压力随时间的变化。具有大约0%或负溶胀的水凝胶导致施加在嵌入神经上的压力高且持续增加(>80mmHg),而溶胀10%或更多的水凝胶不会导致压力显著增加(~20mmHg)。在优选实施方案中,平衡溶胀后的压力读数约为5mmHg。在临床前和临床模型中,神经损伤部位的压力可在5至15mmHg之间(Khaing等人,2015年-Injectable Hydrogels for Spinal Cord Repair)。例如,尽管在脊髓模型中评估了多种调节神经再生的材料,但大多数材料不具有防止神经瘤形成所需的线性抗压模量(G)(表1,Khaing等人,2015年)。
硬度。水凝胶的硬度可以通过流变学(G’=储能模量,G
压缩和回弹。除了具有最小溶胀的可注射凝胶之外,可压缩的凝胶也是理想的。在这种方式中,即使水凝胶植入物被挤压,它也不会断裂。压缩和回弹测试在圆柱形样品(直径6mm,长10mm)上进行,这些样品在37℃下孵育至少1小时,直到达到平衡。将样品装入Instron,并以1mm/分钟的十字头速度施加垂直于圆柱体纵轴的位移,以使最终位移为导管直径的60%。验证水凝胶可以承受大于0.25N的压缩力,并且在去除压缩力后形状和直径没有发生变化。
柔韧性。这些原位形成聚合物的另一个关键参数是水凝胶在体内以生理相关角度弯曲(bend)和挠曲(flex)的能力。为了评估水凝胶的柔韧性,水凝胶在内径为0.1至0.25”的硅树脂管中形成,以形成12至24”长的圆柱形水凝胶绳索。优选地,所述水凝胶具有足够的柔韧性以弯曲大于90°,更优选地,圆柱形水凝胶束可以容易地打结。由于柔韧性和弹性部分地由多臂PEG的核与其相邻多臂PEG的核之间的距离决定,因此PEG水凝胶的核-核距离为3kDa,更优选5kDa或更大。柔韧结实的水凝胶,在身体高度活动和受压的环境中不会断裂。因此,需要更柔韧的水凝胶,例如4臂10K或20K PEG与4臂或8臂20K PEG-胺的组合可能是理想的。
粘度。可以选择低粘度和中粘度的前体溶液来包封通常在低粘度溶液中具有更好的粘附性并在中粘度前体溶液中具有改善的神经处理能力的水凝胶。在本发明的一个实施方案中,可流动介质是低粘度水凝胶前体溶液,其粘度不超过约100cP,在一些实施方案中不超过约20cP或不超过约5cP。在又一个实施方案中,可流动介质是中粘度的水凝胶前体溶液,其粘度优选为300至1000cP,更优选为300至900cP。在一个实施方案中,可以向凝胶前体中加入粘度增强剂/调节剂或增稠剂,以改变流体性质,并有助于在凝胶化之前将神经定位在帽中。所述粘度调节剂可以是天然水胶体、半合成水胶体、合成水胶体和粘土。天然水胶体包括但不限于阿拉伯胶、胶黄芪、海藻酸、海藻酸盐、梧桐树胶、瓜尔豆胶、槐树豆胶、角叉菜胶、明胶、胶原蛋白、透明质酸、葡聚糖、淀粉、黄原胶、半乳甘露聚糖、魔芋甘露聚糖、黄蓍胶、壳聚糖、结冷胶、甲氧基果胶、琼脂、阿拉伯树胶、达马胶。半合成水胶体包括但不限于甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素(HPMC,0.3%)、改性淀粉、藻酸丙二醇酯。合成水胶体包括但不限于PEG、聚丙烯酸、聚乙烯醇、聚乙烯吡咯烷酮、聚甘油、聚甘油聚蓖麻醇酸酯。粘土包括但不限于硅酸镁铝(Veegum)、膨润土、凹凸棒石。在另一个实施方案中,粘度可以通过预交联PEG-胺和PEG-氨基甲酸乙酯来调节。PEG-胺和PEG-氨基甲酸乙酯可以以10000∶1至1∶10000的比例预交联,其中PEG的总浓度为0.01%至100%。所述预交联可以进一步通过自身交联,或与PEG-胺交联,或与PEG-氨基甲酸乙酯交联,或与PEG-胺和PEG-氨基甲酸乙酯交联,以形成更高粘度的前体溶液。
前体溶液的密度。由髓鞘质和脂肪组织形成的神经组织是疏水性的,因此倾向于漂浮在密度接近水的溶液中(~1g/cm
开放式外科神经瘤手术。在公开暴露手术部位并隔离目标神经后,需要对神经进行新的横断以清理神经末端。在一些实施方案中,临床医生可以选择以90度或者45度的角度横切神经。在一些实施方案中,临床医生可以选择使用其他方法,例如电烙神经末端、结扎神经残端、应用低分子量末端封闭的PEG(例如1-5kDa,50w/v%低渗溶液)或他们开发的用于封闭或消融神经末端的其他方法。
轴浆。由于轴浆是一种粘稠物质,在切断后从切断的神经末端渗出,可能会减少神经末端和水凝胶之间的紧密贴合,因此可能需要将其从神经末梢移除。这可以通过神经和吸收材料(如拭子)之间的接触来实现。可以提供可吸收的拭子以吸收神经横断后的任何轴浆。所述拭子的尖端优选小于5mm,更优选小于2mm,以便它可以合适地配合在所述结构内,并在递送水凝胶时保持神经。所述拭子可以作为试剂盒的一部分提供。或者,这可以通过使神经末梢与周围组织接触来实现,这导致在神经和组织之间迅速形成粘连,然后必须再次切断该粘连。
覆盖近端神经残端。水凝胶本身优选延伸超过近端神经残端至少0.5mm,优选1mm至20mm,优选2mm至10mm。
长度覆盖。尽管在一些情况下,5mm可能就足够了,但是优选地,至少10mm的神经被嵌入/包封在水凝胶中。较长的神经嵌入水凝胶中实现了几件事:a)增加了神经和水凝胶之间贴合的表面积,和b)由于这些近端节点嵌入在水凝胶中,因此降低了从靠近横切的Ranvier节点近端出芽的可能性。再次,被包封的神经的长度越长,甚至通过镊子处理、先前的创伤等受损的区域还被包埋在水凝胶中的可能性越高,从而防止了神经纤维萌芽。
一旦分离出大约10mm的神经部分,无论神经是附着在拭子、镊子或棒的侧面,还是被一对镊子轻轻夹住,所述神经都被稍微抬高,以允许在神经下面放置结构。在一个实施方案中,所述神经然后被轻轻地降低到通道或进入区中,以将神经对准所述结构的中心。参见,例如图1A和1B。一旦到达理想的位置,所述结构就留在此处。
当一只手将神经末梢保持在所述结构的中心时,临床医生然后用另一只手递送原位形成水凝胶以填充所述结构并将神经保持在所述结构的中心。所述硅树脂结构的顶部作为何时停止填充所述结构的指导。当水凝胶填充超过神经顶部时,所述拭子/镊子被移除,使得神经保留在水凝胶内而不是工具内。以这种方式,神经没有通过周围组织再生的直接路径,并且神经完全被水凝胶包围。
凝胶厚度。防止神经再生需要在横断神经的近端提供适形的屏障。所述水凝胶还优选以100μm至5mm的厚度径向包围神经。在一个实施方案中,将水凝胶前体溶液滴在神经上,以在近端神经残端周围形成周向厚度约为100μm至2mm的薄保护涂层,并保留在此处以阻止神经突起生长。薄涂层足以为神经再生提供屏障,因此在一些实施方案中,将神经浸涂在可流动介质中,水凝胶随后在神经周围形成薄层。在该实施方案中,所述水凝胶胶凝时间被调节至10至20秒,以允许在转变为不可流动形式并形成凝胶之前除去被涂覆的神经。薄涂层提供对神经残端的周向和尖端的粘附和覆盖(其数量级为50微米至500微米),以覆盖神经的末端是理想的。
在又一个实施方案中,理想的是,以植入物或丸剂形式,在神经周围形成水凝胶,从而在神经周围提供坚实的水凝胶粘合层,其在神经圆周周围的厚度约为0.5-5mm,更优选1-2mm,距神经残端尖端1-5mm。
孔径。为了防止神经再生进入生物材料,水凝胶的孔径需要足够小,以防止神经和其他支持细胞渗入生物材料。神经轴突的直径大约在0.5-30μm之间。优选地,所述生长抑制水凝胶是微孔的或中孔的,其孔直径小于1μm,优选小于0.5微米,更优选小于500nm。
荷电带中性或负电的生物材料优选作为生长抑制凝胶,因为神经突优选生长成带正电荷的生物材料。类似地,亲水性材料或两亲性优于疏水性材料。
不可降解水凝胶。如果使用不可降解的水凝胶系统,同样的平衡溶胀特性适用,但由于水凝胶是不可降解的或生物稳定的,降解溶胀是不相关的。例如,不可降解的、原位形成、热响应性共聚物,普朗尼克(PEO-PPO-PEO)、聚乙烯醇或PEO可用于形成水凝胶。
清晰。在优选实施方案中,水凝胶是清澈、透明的,以在水凝胶形成后确认神经的位置。可以在水凝胶中掺入可视化剂,以有助于相对于背景组织的对比。着色剂或着色剂混合物可以包含在聚合物粉末溶液中。在使用多种水凝胶(如下所述)的情况下,需要使用一种或多种不同的可视化剂来提供视觉确认,例如,生长许可水凝胶被正确地递送到神经之间,以及生长抑制水凝胶被递送到生长许可水凝胶周围。弹性。在一些实施方案中,水凝胶的弹性可以通过将疏水结构域掺入水凝胶中来调节。所述疏水结构域可以通过交联或混合分子、颗粒、纤维和胶束来掺入。掺入的分子可以是两亲性分子,包括普朗尼克、聚山梨醇酯和生育酚聚乙二醇琥珀酸酯。所述颗粒、纤维和胶束可以由上述两亲性分子制成。此外,掺入水凝胶中的许多低分子量疏水性药物(如下所述)可改善水凝胶的弹性。
试剂盒。原位形成水凝胶通过双施用器系统递送,该系统包括双通道施用器、双适配器、一个或多个混合器以及一个或多个钝针。所述试剂盒中还包括粉末小瓶,其配有相关的小瓶适配器、稀释剂溶液和促进剂溶液,用于双施用器系统。所述试剂盒可包括水凝胶被递送到其中的一种或多种结构。所述试剂盒还可以包括一个或多个混合器-钝头注射器。所述混合器注射器可以是具有静态混合元件的常规单腔混合器,或者所述混合器可以是其中存在内容物的再循环和湍流以改善前体溶液混合的混合器。
化学和物理。优选地,水凝胶网络主要是亲水性的,具有高含水量,并且通过物理或化学交联或合成或天然聚合物、共聚物、嵌段共聚物或低聚物形成。非生长许可的合成水凝胶的例子包括琼脂糖、PEG或藻酸盐、PVA水凝胶,其具有2%w/v或更高的固体含量、优选6%w/v的固体含量、更优选8%w/v或更高的固体含量。PEGs。多臂PEG如上所述,但是可以根据所需的性质从PEG-胺、PEGarboxyl、PEG-SCM、PEG-SGA、PEG-硝基苯碳酸酯(碳酸酯接头)、PEG-马来酰亚胺、PEG-丙烯酸酯、PEG-硫醇、PEG-乙烯砜、PEG-琥珀酰亚胺琥珀酸酯(SS)、PEG-琥珀酰亚胺戊二酸酯(SG)、PEG-异氰脲酸酯(Isocianate)、PEG-降冰片烯或PEG-叠氮化物中选择。藻酸盐。粘性可注射藻酸盐溶胶(1-5%)可被递送到神经周围。同样,浓度为1%重量/体积或更高的琼脂糖凝胶可防止神经延伸。
低渗溶液。在一个实施方案中,将低渗溶液(不含Ca2+的、稍微低渗的、含1-2mMEGTA的盐溶液)递送到切割的神经,以在用原位形成生物材料修复之前帮助封闭受压迫的或横断的轴突末端。
PEG融合结合原位神经帽或包裹物。正如许多概述神经PEG融合方法的出版物(3.35-5kDa,30-50%w/v溶液)所述,PEG溶液可以单独或与亚甲蓝联合递送到神经,以首先融合神经。在密封膜后,将生长许可水凝胶递送到被压缩或切断的神经之间和周围。
交联的颗粒。在一些实施方案中,所述水凝胶可以由可交联的颗粒、纤维或胶束制成。这些颗粒、纤维或胶束用反应性基团官能化,所述反应性基团包括但不限于活性酯、胺、羧基、醛、异氰酸酯、异硫氰酸酯、硫醇、叠氮化物和炔烃,它们可以与具有反应性基团的小分子、聚合物、颗粒、纤维或胶束交联形成键,包括酰胺、氨基甲酸酯、碳酸酯、脲、硫脲、硫酯、二硫化物、腙、肟、亚胺、脒和三唑。在一些实施方案中,所述胶束、纤维和颗粒可以由具有亲水和疏水链段的两亲性大分子形成。亲水链段可以是天然或合成的聚合物,包括聚乙二醇、多元酸、聚乙烯醇、聚氨基酸、聚乙烯吡咯烷酮、聚甘油、聚噁唑啉和多糖。疏水链段可以是脂肪酸、脂类、PLA、PGA、PLGA、PCL和不同比例的聚合物酯共聚物。在另一个实施方案中,官能化微粒在pH变化后彼此形成物理交联,然后,当原位放置时,官能化微粒交联形成微粒的互连网络。
密封剂。一些为防止粘连而开发的原位形成凝胶和密封剂也可适用于该应用,以防止神经瘤和异常神经生长进入疤痕组织,例如像癸二酸这样的酸的低分子量聚酸酐,包括基于聚(甘油-共-癸二酸酯)(PGSA)的密封剂(9,724,447,US20190071537,Pellenc etal(2019)Preclinical and clinical evaluation of a novel syntheticbioresorbable,on demand light activated sealant in vascular reconstruction,并入本文并适合在神经周围使用,以供参考)。可以适于在外周神经周围递送的另一种密封剂是Adherus Dural密封剂,其包含原位形成的PEG-聚乙烯亚胺(PEI)共聚物,因为它表现出低溶胀并在约90天内降解(9,878,066,并入本文)。其他密封剂包括由牛血清白蛋白和戊二醛组成的BioGlue外科粘合剂(Cryolife)、Omnex(Eticon)、ArterX(Baxter)、Coseal(Baxter)和由赖氨酸基氨基甲酸乙酯组成的TissuGlu(Cothera Medical)。
光响应。在一些实施方案中,设想了光响应、光聚合或光交联的生物材料,其可以以液体(低至中等粘度)状态递送到神经周围的结构(帽或包裹物结构)中,然后,当在该结构中获得神经的正确定位时,用紫外光或可见光引发光聚合。在一个实施方案中,光源可以直接或通过光纤电缆连接,所述光纤电缆直接与帽或包裹物结构中的开口接合。帽结构使光发生衍射,从而确保整个结构被充分照亮,从而在整个凝胶上实现一致的均匀交联。在优选实施方案中,光源壳体在面向神经残端面的帽的远端直接与所述结构耦合,以确保光直接穿透。可选地,所述结构可以设计有嵌入式发光元件,所述发光元件允许光围绕神经周向传递。水凝胶包括用发色团(如叶绿素的三钠盐)改性的PNIPAAM水凝胶。
其他形式。除了交联网络,水凝胶还可以由树枝状聚合物、自组装水凝胶或低分子量合成聚合物液体组成。
在一个实施方案中,低分子量水凝胶(2kDa,液体)可以在没有水作为溶剂的情况下原位形成,如Kelmansky等人(2017)In Situ Dual Cross-Linking of Neat Biogelwith Controlled Mechanical and Delivery Properties),Molecular Pharmaceutics,14(10)3609-3616中所述,该文献并入本文。在其他实施方案中,水凝胶可以被光交联以形成水凝胶,如文献中广泛描述的。交联剂包括伊红。在其他实施方案中,使用导电水凝胶,包括聚(3,4-亚乙基二氧噻吩)(PEDOT)、聚(吡咯)、聚苯胺、聚乙炔、聚噻吩、酯衍生物、3,4-亚丙基二氧噻吩(ProDOT)、天然或合成黑色素、衍生物及其组合。
硫酸化蛋白聚糖的添加。在一些实施方案中,除了由水凝胶提供的机械屏障之外,可能还需要向神经传递抑制性环境线索。这可以通过物理混合或化学交联向水凝胶中加入抑制分子和/或细胞外基质来实现。硫酸化蛋白聚糖,如带有负电荷的侧链,如糖胺聚糖,是让人感兴趣的。特别感兴趣的是硫酸皮肤素(DS)。
混合。在一些实施方案中,可能希望产生两种PEG的混合物以提高系统的降解性。在一个实施方案中,在与三赖氨酸胺交联之前,将PEG-SC与PEG-SG组合,以产生水凝胶,该水凝胶具有足够的机械支撑以防止神经生长,但随后降解比PEG-SC更快。凝胶在体内的持续时间由PEG-SG和PEG-SC的比例微调。随着PEG-SC含量的增加,凝胶在体内的持续时间增加。在另一个实施方案中,PEG-氨基甲酸酯与PEG-碳酸酯混合。其他水凝胶包括由氨基甲酸酯衍生物组成的PEG水凝胶(7,060,259)。
试剂的掺入。在一些实施方案中,试剂可以溶解或悬浮在稀释剂或促进剂溶液中,并且可以加入表面活性剂或乙醇来稳定悬浮液。药物也可以被包裹在微粒、纳米颗粒或胶束中,然后悬浮在稀释剂或促进剂中。在一些实施方案中,水凝胶可以由可交联的颗粒和胶束制成。这些颗粒或胶束具有反应性基团,例如活性酯、胺、羧基、硫醇和专利US 7,347,850B2中描述的那些,并且可以与具有反应性基团的小分子、聚合物、颗粒或胶束交联,后者的反应性基团与前述颗粒或胶束反应并形成键,包括酰胺、氨基甲酸酯、碳酸酯、脲、硫脲、硫酯、二硫化物、腙、肟、亚胺、脒和三唑。在其他实施方案中,凝胶可以通过颗粒的溶胀来形成。大体积的溶胀可以增加颗粒接触,并将它们锁定在它们形成凝胶的位置。
固体含量。可以调节固体含量以微调水凝胶的溶胀和拉伸性能。例如,可以将固体含量调节到临界凝胶化浓度以上,例如6-15%的负载量,更优选7-9%的负载量,更优选8-8.5%的固体含量。
交联。水凝胶可以通过亲电-亲核、自由基或光聚合原位形成。
体内持久性。在一些实施方案中,可能优选更长的体内持久性,其中水凝胶在原位保持3个月至3年,更优选6个月至18个月,更优选6个月至12个月。
粘附。粘附强度是保持水凝胶与神经紧密贴合的重要标准。粘附可以通过水凝胶和组织表面上的伯胺和仲胺之间的交联反应发生,例如神经外膜或在神经、神经胶质和相关细胞表面发现的胺基。粘附强度应该大于10kPa,优选大于50kPa,更优选大于100kPa。神经上的粘附强度可以通过将坐骨神经嵌入水凝胶中来估计。神经的末端嵌入砂纸之间的强力胶中,并放置在Bose Electronic Force3200-ES中的钛夹中。神经以0.08mm/s的速度脉动,直到衰竭。注意确保神经在收获后不久使用,并且在测试前使水凝胶和神经在37℃的PBS中平衡。
其他水凝胶。原位形成聚酸酐也有利于开发针对神经的应用。在一个实施方案中,聚酸酐类聚合物可以被丙烯酸化,使得它们可以通过自由基聚合原位形成。或者,它们可以通过光交联形成。在较低浓度下,聚合物是水溶性的,例如10%。防止神经再生的部分原因是其疏水性。US20180177913A1、US62/181,270和US201562181270P通过引用并入本文。
施用器。用于递送原位形成水凝胶的双通道施用器可从市场上买到(NordsonMedical Fibrijet Biomateral Applicators,Medmix Double Syringe BiomaterialDelivery System,K-System)。然而,递送2.75ml至多达10ml水凝胶的这些混合器包括带有静态混合元件的单个内腔,并且被设计用于大体积水凝胶溶液的充分混合和递送,并且对于将小体积(<1ml)水凝胶溶液递送至一个部位并不理想。因此,需要一种混合器来提供小体积的两种组分系统的混合,因为不可避免地,两种溶液中的一种通常略微领先于另一种溶液,这首先导致针头存在小体积的部分或不充分混合的凝胶。在一个实施方案中,定制的混合器被设计成通过鲁尔接头或卡扣配合安装到Nordson Medical或K-System施用器上,如双腔施用器系统所必需的,以再循环进入混合器的一些初始溶液,从而确保水凝胶(包括初始组分)的更好混合。图18示出了所述混合器的中心部分的设计(透明的),其包含具有至少一个静态混合器的入口,通过其递送和再循环内容物的较大容器,以及捕获混合的再循环流体并将其递送到混合器出口的第二端口。所述第二端口可以包含或不包含额外的静态混合器。
实施例1
在一些实施方案中,4臂PEG 10K-SC与8臂PEG 20K胺交联。将PEG-SC和PEG-胺以1:1的比例溶解在酸性稀释剂中。将悬浮液与促进剂缓冲液混合,并通过静态混合器递送以形成水凝胶。这种配方在4秒钟内胶凝。
实施例2
在另一个实施例中,8臂15K PEG-SC与三赖氨酸交联。将PEG-SC悬浮在缓冲的三赖氨酸溶液中,然后通过静态混合器与促进剂缓冲液混合。该配方在2秒钟内凝胶化,凝胶的压缩强度高达200kPa。
实施例3
在另一个实施例中,8臂20K PEG-硫代异氰酸酯与三赖氨酸以1∶1的比例交联。该配方在3秒钟内凝胶化,压缩强度为120kPa,溶胀率为5%。
帽结构。所述方法可以包括在定位切断端步骤之前,将结构定位在治疗部位的步骤。所述结构作为包含递送系统的试剂盒的一部分提供,并且由惰性的、生物相容的、柔性的且非粘性的材料组成,以给原位形成的材料提供所需的形状。所述结构被设计成填充有可流动介质,使得它在近端神经残端周围流动,在那里它转变成不可流动的组合物,适形神经残端并防止神经瘤的形成。在优选实施方案中,所述结构产生了低轮廓的神经帽,其在神经和帽之间具有平滑的过渡,并且在神经周围呈近似圆柱形的形状。
形状。结构是理想的,不仅因为它减少了原位形成材料的偏离目标的扩散,而且因为它提供了一种低轮廓的周向光滑形状,这是单独应用水凝胶所不能实现的。所述结构设计的轮廓和过渡减少了与周围组织的摩擦和干扰,允许水凝胶相对于周围组织滑动和旋转。所述帽被设计成能够覆盖至少5mm,优选10mm或更长的神经。
根据本发明的另一方面,提供了一种产生原位形成的神经帽以抑制神经瘤形成的结构。所述结构包括限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口。所述顶部开口位于第一平面上,并且其面积小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并平行于第一平面。凹形神经引导件由所述壁承载,并提供通向所述空腔的侧面入口,用于接收神经末端。所述壁是柔性的,因此它可以从空腔内形成的交联神经帽上移除,并且其可以包括硅树脂,并优选具有30-50的硬度,最优选40的硬度。所述结构的壁设计具有轻微的底切(undercut),使得当将所述结构填充到所述结构的顶部边缘时,部分由于介质的表面张力,材料形成凸面,从而完成水凝胶的圆柱形状。
硅树脂。在一个实施方案中,所述结构由不可粘附的不可降解的材料组成。在优选实施方案中,所述材料是医用级硅树脂,其具有足够的柔性以从原位形成的材料上剥离或弹出(例如硬度40)。在介质转变成基本上不可流动的状态后,将所述硅树脂形式结构除去并丢弃。在一个实施方案中,所述硅树脂结构被着色以提供与周围组织的对比,使得不可降解聚合物不会意外留在原位。较暗的颜色更有利于增强进入帽子并照亮神经的光线,如深蓝色、深紫色或深绿色。
可生物降解。所述方法可替代地包括在定位切断端步骤之前,放置可生物降解的结构的步骤。所述可生物降解的结构可以由非交联的冻干(或干燥)合成生物材料组成,其在原位形成水凝胶被递送期间保持在原位约5至10分钟,然后在不到例如一天或两天的时间内快速溶解并从位点清除。在一个实施方案中,生物溶蚀性结构由冻干的、多臂、封端或非交联PEG,冻干的、线性PEG(3.35kDa),或交联的多臂PEG(例如8臂15kDa)组成。所述方法可替代地包括在定位切断端步骤之前,原位形成生物可降解结构的步骤。在替代实施方案中,所述结构由通常用于神经导管和包裹物的材料组成,例如聚乙烯醇、壳聚糖、聚乳酸、聚乙醇酸、聚己内酯。
在又一个实施方案中,离体可植入结构由与递送到所述结构中的原位形成材料相同的材料组成。以这种方式,经平衡的结构的性质是类似的,并且与经平衡的原位形成的水凝胶匹配良好。在这些实施方案中,可生物降解的结构在递送水凝胶后保持在原位,并且不被移除,而是以与原位形成的材料大致相同的速率从植入部位清除。在又一个实施方案中,所述结构由冻干的、非交联PEG组成,原位形成的水凝胶介质被递送到其中。所述非交联PEG容易溶解并从所述位点清除,使所述结构成为快速生物溶蚀性结构。在另一个实施方案中,所述结构由交联的PEG基质组成,所述基质将由于快速断裂的水解键(例如可以通过PEG琥珀酰亚胺基琥珀酸酯(PEG-SS)中的酯键获得)而从位点快速清除。
结构可以通过注射成型、在空腔中交联或聚合、溶剂浇铸或3D打印来合成。可选择一系列合成材料和天然材料用于可植入结构,所述材料包括胶原、PEG-PEI、藻酸盐、壳聚糖或琼脂糖。
形式可以是快速溶解性结构,其在润湿时溶解并在手术后一小时内清除,同时将原位形成的生物材料留在原位。或者,结构可以是更缓慢降解的结构,其溶胀到与递送到其内部的原位形成的材料相似或更大的程度。所述溶胀可防止水凝胶在平衡溶胀过程中溶胀并压迫神经(如果将其递送到的结构是收缩性的或具有最小的顺应性)的情况。
在一些实施方案中,一只手用镊子将定位的神经保持在期望的位置或方向,另一只手将介质输送到所述结构中。当介质填充所述结构时,所述神经被释放,随后介质变为不可流动状态。或者,辅助医生或护士可以协助该程序。在另一个实施方案中,生长抑制水凝胶在神经周围分两步形成。在第一步中,水凝胶被递送到神经末梢以包封神经末端。在第二步中,施加所述水凝胶以填充整个结构,包括神经末梢。在另一个实施方案中,生长抑制水凝胶在第一层中围绕神经形成,然后在两步过程中施加第二层水凝胶。
适形性。与包裹物不同(在包裹物和神经之间仍然有间隙),水凝胶直接适形于神经本身,为炎症和促疤痕形成细胞进入该部位提供了屏障,同时允许营养物质通过。因为水凝胶附着在神经上,所以不需要将神经缝合到水凝胶上。水凝胶靠近神经也有助于在最初的愈合阶段防止神经周围形成疤痕和粘连。
居中。神经,由于其低密度、高脂肪含量和柔韧性,特别是较小的神经,在低粘度溶液中有可能向上流动。以下实施方案被设计成确保在将介质递送到该表面的顶部之后神经不会上浮。
粘度。如上所述,可流动溶液的粘度可以增加,以最小化溶液中的神经上浮。
流动。在另一种方法中,递送可流动介质的针以这样的方式被引导,即介质的流动允许溶液在凝胶形成之前围绕神经周向扩散。所述帽结构也可以设计成改善介质的流动动力学和改善神经排列。在本发明的一个实施方式中,切断目标神经步骤和将结构定位在治疗部位步骤由单个器械完成。在本发明的另一实施方式中,所述神经帽结构被设计成使得所述递送系统和所述结构是一体的。在优选实施方案中,所述递送系统通过导管连接到所述结构。帽中的导管入口位于神经进入该结构的同一入口。所述导管允许材料沿着轴并在神经周围周向流动,使得介质起到使神经在所述结构内自我居中的作用。
稳定器。在另一个实施方案中,稳定棒或片直接在神经下方或靠着神经排列,使得它提供足够的粘合力,使得水凝胶可以围绕中心神经递送到所述结构中。
可剥离导管在又一个实施方案中,通过连续放置在两个可剥离导管内,将神经定位在原位生物材料的中心。简而言之,将神经置于第一可剥离导管内,并将原位形成材料递送至神经的顶端和远端周围。所述可剥离导管可以是末端开放或末端封闭的导管。水凝胶形成后,护套沿着材料中较弱的剥离线被拉开并被丢弃。然后将所得的神经-水凝胶置于第二个更大的可剥离导管中。通过轻微旋转神经,所述水凝胶表面可以放置在第二护套的底部,使得神经大约位于第二护套的中间。原位形成水凝胶的第二次应用导致在神经周围累积形成环状水凝胶,其保护神经并使其在神经帽内居中。在一个实施方案中,所述护套由挤出的可拆分的PTFE管组成,所述管具有垂直的拉片,以有助于在手术环境中撕开该件(piece),类似于血管导引器。
在另一个实施方案中,神经被放置成使得近端残端以90度角向下搁置在杯形结构中,并且所述水凝胶被递送至所述杯形结构中以在神经周围成形。所述杯形结构随后被移除和丢弃,并且近端残端被调整回到其在组织中的静止位置。
在又一个实施方案中,神经可以在两亲性或疏水性溶液中递送,以防止神经漂浮到介质的表面。在又一个实施方案中,原位形成材料可以更粘,以防止神经在所述结构内迁移。
倾斜。或者,所述结构在形式上可具有倾斜,以将神经填充从远端偏压至近端。以这种方式,神经可以以这样的方式定位,即水凝胶首先围绕近端神经末梢周向形成,然后通过第二次施加或第一次施加的继续,填充所述结构的剩余部分。
入口居中。在一个实施方案中,所述结构以这样的方式设计,使得神经在相对于所述结构顶部的较低水平处进入,以允许所述材料围绕神经周向递送。在另一个实施方案中,所述结构的入口区域是倾斜的,使得神经以向下的角度进入所述结构,将近端神经末梢位置向下偏置。
肋片(rib)。在不可降解的临时结构(例如硅树脂结构)的外表面上设置有拉片或肋片,以帮助在凝胶形成后移除所述结构。这些拉片被放置在这样的位置,以为不规则表面上的帽结构提供额外的稳定性,或者提供用镊子或其他外科器械抓握的表面。在又一个实施方案中,所述结构被设计成自动居中的(self centering)。换句话说,所述结构可以自然就位,使得所述结构的顶面处于水平状态,从而为原位形成水凝胶的递送做准备。
孔。在一些实施方案中,提供孔或引导护套来引导针以特定方向将介质递送到所述结构中。所述介质流的方向可以设计成更好地将神经定位在通道中。在一个实施方案中,孔设置在神经进入所述结构的位置附近或顶部,以将溶液从导管中的近端引导至远端,并促进所述结构内的层流。
盖子。在一些实施方案中,所述结构包含部分或完全铰接的盖子,以允许根据所述结构内的流动方向将神经居中。
递送的体积。与盖结构一样,递送的介质体积可以在0.1cc至10cc的范围内,典型地为0.2cc至5cc,更典型地为0.3cc至1cc。
针头大小。所述试剂盒包含21号(gauge)或23号针,用于将较小的体积递送到较小的包裹物(或帽)结构,以及18号针,用于填充较大的结构。这些针对原位形成材料的递送速度提供了额外的控制,允许水凝胶珠的沉积快速填充较大的导管。
胶凝时间。类似地,胶凝时间可以根据包裹物或帽结构的填充体积来调节,对于较大的包裹物提供10至20秒的较长胶凝时间,对于较小的包裹物或帽提供约5秒的较短胶凝时间。
结构尺寸和水凝胶厚度。结构尺寸的范围被设计成具有入口区域,以适应神经直径±1至3mm,或更优选±1mm。所述结构的直径决定了神经周围形成的凝胶的厚度。根据神经的大小,在神经周围形成的水凝胶的厚度可以是0.05mm至10mm,更优选1mm至5mm,更优选1mm至3mm。
试剂盒设计。不同于每个试剂盒包含仅用于一种尺寸的神经的一种结构,如可植入的神经导管和包裹物的情况,试剂盒将包含一至十种,更典型地一至种帽结构(或包裹物结构,或其组合),允许医生为所述程序选择合适的尺寸,以及能够在不需要额外试剂盒的情况下切换结构。试剂盒可根据选择的结构进行标记,例如适用于一定神经大小范围的结构、适用于某种外科手术类型的结构(用于腹股沟修复的神经保护物)或适合特定位置的手术的结构(用于手部手术的神经帽、用于上肢的神经保护物、用于臂丛的神经结构)。
薄片。在一些实施方案中,原位形成材料可以被递送到神经,所述神经被放置在临时的非粘连的生物相容性薄片上,例如通常用于将神经与周围组织隔离的Esmarch绷带或其他生物相容性薄片或背景(Mercian Surgical Visibility Background Material)。可以缩短胶凝时间以限制水凝胶在神经周围的扩散,例如缩短至10秒或更短,优选5秒或更短。然后可以从手术部位移除任何多余的水凝胶并丢弃。
液体帽结构。在另一个实施方案中,所述结构不是物理结构,而是通过注射可溶性疏水溶液产生的,优选粘性溶液,如甘油。例如,在确保神经不受干扰的同时,可以将粘性油递送到周围的组织中,以覆盖它并防止水凝胶粘附到所述周围的组织上。如果所述溶液足够粘稠,则可以形成快速生物溶蚀性结构,用于递送原位形成水凝胶。在优选实施方案中,首先递送溶液A以阻断胺和组织结合位点,并产生溶液B可以递送到其中的空间或区域。在下一步中,溶液B被递送到由溶液A创建的空间中,或者其被递送到溶液B的中心,并将溶液B从该位点移走。
无结构。在一些实施方案中,空间或入口不允许使用结构。在某些情况下,例如在臂丛神经损伤时,手术窗口很小或者对损伤邻近组织的担心很小,以至于不可能在递送水凝胶的部位放置结构。在这些情况下,水凝胶可以直接递送到神经内或神经周围的手术袋或区域中。如果神经周围的区域被用作天然结构,则帽具有由神经底部和侧面的组织边界限定的不规则形状。在一个实施方案中,由于水凝胶既粘附于神经又粘附于组织,所以原位形成的材料应该小心地从肌肉和筋膜上剥离,以使其形成与神经接触的自由浮动团。这将允许神经在该区域内继续移动,而不被周围组织束缚。
在另外的实施方案中,希望水凝胶采取神经周围的周围组织的形状。例如,在要消融神经并且水凝胶需要填充神经所在/曾经所在的潜在空间和周围区域以防止再生的实施方案中。或者,当水凝胶被递送到内脏神经周围时,所述内脏神经周围通常有一个由微小神经纤维组成的松散而精细的网络,这些神经纤维周围的空间需要填充。在另一个实施方案中,水凝胶填充在不规则形状的神经或神经纤维束/簇和/或细胞体的周围。这样,水凝胶可以最有效地将治疗剂递送到所述区域。
在神经周围以可控方式原位放置的水凝胶。然而,在另一个实施方案中,特别是在神经在肌肉、关节、骨骼或腱之间(例如在周围的肌肉之间)运动期间滑动的动态环境中,不希望神经通过水凝胶被束缚到周围组织。相反,希望开发出神经可以在通道内自由滑动的解决方案。在这些实施方案中,水凝胶可以在原位交联或原位聚合过程中与周围组织物理分离。这可以通过像非粘性无菌片一样简单的方法来实现,所述无菌片可以放置在该部位,然后在凝胶形成后移除。这也可以通过在神经内/周围放置结构来实现。根据神经的大小和位置、护套的存在与否、传递到所述部位的治疗目标(神经刺激、神经阻滞、神经消融或神经再生障碍),所述结构可以采取多种形式。在一个实施方案中,所述结构是帽,其可以被轻轻地放置在神经的末端周围,并且原位形成凝胶被注射到所述结构中,以便它呈现所述结构的形状。然后可以将帽中的材料推出,并移除和丢弃所述帽结构。在其他实施方案中,所述帽是生物相容的,并因此不被移除。在另一个实施方案中,半圆柱体(纵向对半)可以放置在神经下方,并且原位形成材料被递送到所述半圆柱体中。以同样的方式,可以在神经周围周向递送凝胶,而凝胶不会附着到周围组织。
可选的帽结构。为了减少粘连形成的机会,可将3至10mm的神经段放入注射器筒内(移除鲁尔锁末端部分),并将柱塞拉回至神经末端上所需的适当凝胶距离。所述水凝胶被递送到凝胶所在的柱塞内的神经中及周围。凝胶形成后,轻轻按压柱塞,挤出水凝胶中包裹的神经。再次使用这种方法,需要最少的缝合或不需要缝合,以避免神经的额外损伤或过度处理。优选地,注射器筒具有光滑涂层。
腹腔镜或内窥镜手术。在腹腔镜或内窥镜手术过程中,所述结构可以沿着通道前进,并放置在神经下,类似于开放手术中的方法。所述结构可以被折叠以允许通过较小的导管,然后在手术现场释放。或者,器械可以设计成将神经结构(帽或包裹物)构建到一个器械的尖端,通过另一个器械的内腔递送原位形成生物材料。所述原位形成生物材料的胶凝时间需要调整到20至30秒或更长,以允许水凝胶沿器械内腔行进的时间。
在所述程序的针镜学方法中,可以注射第一材料,所述第一材料覆盖外部组织以防止凝胶和周围组织之间的直接粘附。此后,水凝胶可以被递送到相同的部位,在神经周围形成储库,并将第一材料转移到注射部位的外围。这可以通过疏水物质如油或粘性物质如甘油来实现。这也可以用低分子量PEG溶液来实现,所述溶液具有在水凝胶形成神经周围的神经阻滞/帽之前帮助密封神经膜的额外益处。
在另一个实施方案中,在神经交联以在水凝胶上形成薄的保护表面之前,将神经浸入可流动材料溶液中。在一些实施方案中,在神经周围仅需要生物可降解聚合物的薄涂层。所述涂层的厚度可能只有100微米到500微米。在其他实施方案中,涂层不足以防止炎性浸润和/或防止早期降解——在这些情况下,希望使用0.5mm至10mm厚的涂层。
迄今为止,开发神经帽的尝试一直集中在围绕横断神经末端缝合的固体物理帽上。这些帽必然在近端残端的神经末端周围以及周向上具有间隙。结果,神经瘤形成发生在帽的末端。实例包括可再吸收的聚(D,L-丙交酯-共-己内酯)植入物、与聚(L-乳酸-共-e-己内酯)共混的定向丝纤蛋白(SF)(SF/P(LLA-CL))纳米纤维支架、聚(乳酸)-共-(乙醇酸)/精氨酰甘氨酸颗粒酸)改性的聚(乳酸-共-乙醇酸-alt-L-赖氨酸)(PRGD-PDLLA)植入物,其具有直径约10微米的孔(Yi et al 2018,Adv Sci)。PRGD/PDLLA导管长10mm,内径2mm,管壁厚200微米,SF/P(LLA-CL)导管长1.5cm,内径1.5mm。这些帽需要缝合放置。另一种称为
神经保护物/包裹物。根据本发明的另一方面,提供了保护完整或受压神经的方法和装置。在一些情况下,可能需要保护由于程序而手术暴露的神经或邻近的神经或组织,例如在这些神经否则会变干的情况下。在一些情况下,可能希望保护和标记作为另一手术的一部分而暴露的神经,从而可以减少或避免额外的处理、拉伸、挫伤和/或压迫。在一个实施方案中,在神经周围递送原位形成材料,以提供保护层并防止在所述区域中由镊子和其他手术设备对神经的损伤。此外,水凝胶中的染料可以提供与周围组织足够的对比度,使得医生在程序过程中也可以在视觉上远离神经。这可以显著降低手术过程中医源性神经损伤的发生率。
根据本发明的另一方面,提供了一种用于在神经至神经连接处周围创建原位形成的胶囊的结构。所述结构包括限定空腔的凹壁,所述壁具有用于进入空腔的顶部开口。所述顶部开口位于第一平面上,并且具有小于第二平面的面积,所述第二平面适形于空腔的内部尺寸,并且与空腔间隔开,并平行于第一平面。第一凹形神经引导件,其由所述壁承载,并提供用于将第一神经末端定位在所述空腔中的第一侧入口;和第二凹形神经引导件,其由所述壁承载,并提供用于将第二神经末端定位在所述空腔中的第二侧入口。
这方面的一个例子是在疝修补,特别是腹股沟疝修补过程中,对髂腹股沟和髂腹下神经的预防性治疗。在疝修复过程中,这些神经可能部分或完全暴露,导致压迫、挫伤和部分或完全横断。手术后,受损的神经可能会将异常的神经芽送出到手术后的疤痕组织中,这可能会导致神经瘤的形成和神经卡压,从而导致高比例的手术后慢性疼痛。此外,这些神经可以被偶然地或有目的地通过外科手术切断,以试图防止神经被外科手术截留或缠结在用于修补疝的网状物中。在一个实施方案中,包含原位形成生长抑制水凝胶和合适结构的试剂盒允许外科医生选择一种结构,来提供“帽”或“包裹物”形状的结构腔。根据手术情况,如果神经没有被切断,则医生可以选择包裹物,如果神经被切断,则医生希望保护神经免受进一步损伤,或者如果神经被切断,医生希望防止在切断的神经末端形成远端神经瘤,则医生可以选择帽。
另一个例子是在髋关节手术中暴露坐骨神经。尽管神经不是这些手术的目标,但神经经常暴露并处于牵引状态,因此在手术过程中有被损伤和/或变干的危险。在一个实施方案中,提供了包裹物形状的结构,以在坐骨神经的危险区域周围递送水凝胶。对于较大的神经,这些区域可以是5至50cm或更大。可以提供包裹物形状的结构来跨越整个长度,或者可以沿着神经串联放置多个帽结构来提供保护。在另一个实施方案中,抗炎剂被递送到水凝胶中,以减少手术期间由于定位或移动神经而可能导致的神经周围的炎症。在另一个实施方案中,局部麻醉剂被递送到放置在神经周围的水凝胶中。
在另一个实施方案中,水凝胶被递送到神经周围以减少手术后可能导致的炎性神经病,特别是外周神经病,其可能导致受影响肢体中缓慢发展的严重疼痛和/或虚弱。原位形成水凝胶可以在开放手术后或通过经皮图像引导程序递送。对于经皮超声引导或荧光透视递送,回声针不仅需要确认深度,还需要确认针相对于相关结构的位置。
在另一个实施方案中,原位形成水凝胶在“包裹物”结构的空腔中被递送到神经周围,以在神经周围形成保护性顺应性包裹。将包裹物结构的空腔留在原位,其在手术过程中提供额外的支撑和保护,然后在手术完成后,在封闭所述部位之前,将包裹物结构移除并丢弃。水凝胶保留在原位是为了保护神经,防止异常的神经生长,以及任何疤痕组织渗透到神经中。
接合助剂。在一些实施方案中,已经与缝线直接接合的神经可以被放置在包裹形式的空腔中。直接接合部位可以填充有注射的生长许可水凝胶或临时间隔材料(例如纤维蛋白胶),其可以扩散到所述部位的间隙中,并且生长抑制水凝胶使用包裹形式的空腔直接递送到吻合部位周围。
包裹物或保护物结构。所述包裹物结构的空腔包括具有两个神经入口区的结构,在需要保护的神经区域周围具有可变的空腔长度。在较短的包裹结构中,空腔被设计成使得神经停留在入口区域上,并且神经在所述区域之间“浮动”,并且不与所述结构的壁接触。递送原位形成水凝胶的针将可流动的水凝胶溶液递送到围绕神经的结构中,在那里它在神经周围形成保护性水凝胶。所述结构防止水凝胶向邻近组织的非目标扩散,并在神经周围保持一致的水凝胶厚度。
较长的长度。在需要保护的神经长度较长的情况下,可以使用较长的包裹物结构的空腔,并在所述结构的底部设计小的支柱,以在较长的距离上支撑和提供神经的稳定性。当所述结构被移除时,这些支柱被移除,仅在远离近端神经残端尖的非关键位置(如果存在)的神经和周围环境之间留下小的暴露。在另一个实施方案中,其中希望保护更长的神经,原位形成水凝胶溶液可以在多个层或区域中递送。在一个实施方案中,所述结构在多个部分被填充,以便将神经保持在所述结构的中心。在另一个实施方案中,将原位形成水凝胶的第一层递送至所述结构的底部,完全或部分包埋神经或不包埋神经,然后将第二层水凝胶递送至第一层的顶部,以完全覆盖和保护神经。
在一个实施方案中,提供了试剂盒,其包含适当体积的原位形成水凝胶以填充包裹物结构,以及多个混合器和针组件,以允许医生根据需要切换混合器-针尖,并根据需要在第二或第三应用中继续递送更多的介质。
保护吻合部位。随着同种异体移植物和自体移植物在较大神经间隙修复中使用的增加,人们越来越认识到,异常神经从周围神经残端生长到神经-同种异体移植物、神经-自体移植物或神经-导管连接处的周围组织中会导致局部疼痛并降低神经修复的效果。此外,用于固定两个神经残端的固体可植入导管和神经本身之间的顺应性不匹配可能在神经和导管之间的界面处引起摩擦,导致额外的异常神经束缚到周围组织中。在一个实施方案中,预期在近端神经和同种异体移植物或自体移植物吻合之间的界面处递送原位形成的水凝胶,或者在同种异体移植物或自体移植物和远端神经残端之间递送水凝胶,或者类似地在神经残端进入和出现在导管的地方之间的连接处递送水凝胶。直接或以较短的包裹结构段递送的较小体积的水凝胶提供了对神经突起生长的保护,并减少了疤痕形成和免疫细胞向移植物和导管的浸润。或者,包裹物结构可以跨越吻合的整个长度,以覆盖除神经之外的同种异体移植物/自体移植物/导管。
神经滑动。一些外周神经在其所在的筋膜平面内经历相当大的运动,因此这些神经的结疤和束缚特别痛苦。例如,腕管中的正中神经或相对于肘部的尺神经位置是提供滑动很重要的位置。对于可植入的导管、包裹物和保护物,植入物的形式使得神经的滑动不会被生物材料增强,并且可能被进一步抑制。在一个实施方案中,原位形成水凝胶被递送作为这些神经周围的保护物,以允许神经继续在其筋膜平面内滑动。实现这一点的一种方式是通过递送较高溶胀原位形成材料,所述材料在递送到神经周围后显著溶胀,例如径向向外大于30%,优选大于60%,使得神经可以在水凝胶达到平衡后产生的通道内滑动。以这种方式,即使水凝胶最终变得镶嵌在薄的囊层中,水凝胶内的神经本身在通道内自由滑动,并且没有明显的疤痕组织、神经生长到周围组织中,并且在这些关键位置也没有被压缩。
适应症。还可以在手术中引入原位形成水凝胶,以帮助使用包裹物结构维持供体和受体神经的成功显微外科手术吻合。水凝胶可以以包裹物形式注射到吻合的连接处,以保护异常炎症反应、疤痕组织的形成,并有助于供体和受体神经的适应。转移非关键神经以重新激活更重要的感觉神经或运动神经被称为神经化(neurotization)。在一个例子中,乳房切除术后进行乳房重建的患者可以选择自体皮瓣重建来连接神经和胸壁。包裹物结构可以放置在近端神经残端和远端神经组织之间的连接处并被缝合到其上,并且水凝胶被递送以保护吻合部位。这种修复可能导致感觉功能的恢复,并提高妇女的身体和生活质量。
压迫修复。在另一个实施方案中,原位形成水凝胶可以以包裹物形式递送到神经周围,作为神经修复时周围组织附着的屏障。这种方法允许水凝胶渗透并适形于神经,并作为静脉包裹的替代物,其中自体静脉以螺旋包裹技术包裹在神经周围,为周围组织的附着提供屏障。这也为AxoGuard神经保护物提供了一种替代方案,所述AxoGuard神经保护物必须缠绕在神经上,这可能会拉伸并进一步损坏神经。固体神经保护物需要用镊子对神经进行大量处理,将固态包裹物拉开以使其保持打开状态,然后将神经缝合到包裹物上。使用柔软的、适形的、基于水凝胶的方法,液体或粘性液体可以以最少神经处理的形式直接递送到神经周围。软组织附着最小化,溶胀最小化,凝胶提供的机械支撑减少了接合部位的张力和应力。营养物质可以通过水凝胶网络扩散。此外,水凝胶可以减少医生的手术时间。
在一个实施方案中,所述溶液基于透明质酸。在另一个实施方案中,所述溶液基于水凝胶浆料(TraceIT,波士顿科学)。
应用的距离。水凝胶可以用注射器或施用器尖端在神经周围周向递送,以这种方式,神经在损伤的长度上具有保护。理想地,水凝胶将被施加在受损或横断神经的每个部位上例如5-15mm。给药体积可以在100微升至10ml之间,更优选0.2至3ml。包含水凝胶(或水凝胶的两种前体组分)的注射器可以被设计成具有要递送的精确体积,以允许原位形成水凝胶的受控自动递送。或者,可以提供额外的量,以允许个人使用他/她的判断来决定在位点周围递送多少。水凝胶至少应在神经外侧周围形成约200微米厚的细胞屏障,尽管水凝胶也可以被递送以填充部位,从而在水凝胶部位周围形成半径为2cm的周向团。
端到侧(end-to-side)修复。在外神经鞘中形成一个窗口,并将神经转移连接到神经的一侧。缝合后,原位形成水凝胶被递送到周围,以保持它们彼此紧密贴合。
内部神经松解术。在神经被拉伸或长期压迫后,会出现内部疤痕和肿胀。这些神经的外鞘可以打开以减轻压力并帮助血液流动。
外部神经松解术。如果神经已经结疤或发展神经瘤,拉伸或移动可能会导致额外的神经损伤、疼痛和额外的神经结疤。神经松解术可用于去除神经周围的疤痕组织,而不进入神经本身。原位形成水凝胶可以在外部神经松解后在神经周围递送,以防止额外的神经疤痕并减少疼痛。
神经化。在一个实施方案中,经皮神经保护物围绕受损或受压迫的神经递送。在所述实施方案中,如果在损伤后的一天至几天内施用,则可以减少局部炎症反应。原位形成水凝胶,其1)是生物相容的,2)是可生物降解的或可生物溶蚀的,3)允许营养物和氧气扩散到组织中和组织外,同时防止炎症,4)柔韧和适形的,因此轴突被保护而不被压迫,5)不溶胀或最小溶胀,以及6)防止纤维向内生长到损伤部位。
位置。可注射的适形水凝胶还允许将相同的产品递送到多个神经直径和多个位置(在骨骼、筋膜、韧带、肌肉之间),因为材料将在神经周围区域流动。
递送位置。在一些实施方案中,针的位置影响水凝胶的递送。在一些实施方案中,针将水凝胶直接递送到目标神经或区域的顶部。在另一个实施方案中,针由远侧至近侧行进,以首先填充所述结构的末端和远侧神经残端,然后填充导管的其余部分。
TMR。在另一个实施方案中,水凝胶可以递送至作为目标肌肉神经再支配(TMR)程序的一部分而重新连接的神经周围。由于切断的供体神经和通常较小的去神经支配的受体神经之间的尺寸经常不匹配,可能需要在连接处应用水凝胶来帮助将再生纤维导入目标受体运动神经。对于这些适应症,所述水凝胶可以直接施用或在结构中施用。典型地,这是在混合的运动和感觉神经之间进行的。
抑制药物到帽和包裹物中。根据所需的临床表现,机械屏障可以由抑制或防止神经再生的多种化学试剂(有时称为“抗再生剂”)中的任何一种来辅助或增强。这些试剂包括无机和有机化学试剂,包括小分子有机化学试剂、生物化学试剂和基于细胞的疗法,所述生物化学试剂可以来自患者和/或外部来源,例如动物来源和/或合成生物化学来源。抗再生剂可以在形成神经末端之前或之后直接应用于目标组织。或者,抗再生剂可以携带在介质中,在那里它们被捕获在介质中,然后随着时间的推移在神经末端附近释放。
可与本发明的一些实施方案结合使用的抗再生剂的一些具体例子尤其包括:(a)辣椒素、树脂毒素和其他辣椒素类(参见,例如J.Szolcsanyi et al.,"Resiniferatoxin:an ultrapotent selective modulator of capsaicin-sensitive primary afferentneurons",J Pharmacol Exp Ther.1990November;255(2):923-8);(b)紫杉醇类(taxol),包括紫杉醇(paclitaxel)和多西紫杉醇(即,因为较低浓度的紫杉醇可以促进神经再生,所以其浓度升高到足以减缓或停止神经再生;参见,例如,W.B.Derry,et al.,"Substoichiometric binding of taxol suppresses microtubule dynamics,"Biochemistry 1995February 21;34(7):2203-11)、肉毒杆菌、嘌呤类似物(参见,例如,L AGreene et al.,"Purine analogs inhibit nerve growth factor-promoted neuriteoutgrowth by sympathetic and sensory neurons,"The Journal of Neuroscience,1May 1990,10(5):1479-1485);(c)有机溶剂(例如,丙酮、苯胺、环己烷、乙二醇、乙醇等);(d)长春花生物碱,包括长春新碱、长春地辛和长春瑞滨,以及其它抗微管剂,如诺考达唑和秋水仙碱;(e)铂类抗肿瘤药物(铂类),如顺铂、卡铂、奥沙利铂、satraplatin、吡铂、奈达铂和三铂;(f)ZnSO.sub.4(即,神经退行性因子);(g)latarcins(短线性抗菌和细胞溶解肽,可能来自蜘蛛Lachesana tarabaevi的毒液);(h)硫酸软骨素蛋白聚糖(CSPGs),如聚集蛋白聚糖(CSPG1)、多能蛋白聚糖(CSPG2)、神经蛋白聚糖(CSPG3)、黑色素瘤相关硫酸软骨素蛋白聚糖或NG2(CSPG4)、CSPGS、SMC3(CSPG6)、短蛋白聚糖(CSPG7)、CD44(CSPG8)和磷蛋白聚糖(参见,例如,Shen Y et al."PTPsigma is a receptor for chondroitin sulfateproteoglycan,an inhibitor of neural regeneration",Science,2009October 23;326(5952):592-6);(i)髓鞘相关糖蛋白(MAG);(j)少突胶质细胞;(k)少突胶质细胞-髓鞘糖蛋白;和(I)网状蛋白-4,也称为神经突起生长抑制因子或Nogo,它是一种在人类中由RTN4基因编码的蛋白质(参见,例如,Lynda J.-S.Yang et al.,"Axon regenerationinhibitors,Neurological Research,1Dec.2008,Volume 30,Issue10,pp.1047-1052);(m)乙醇或甘油。
抗再生剂的进一步例子包括诱导抑制性疤痕组织形成的试剂,其尤其可以选自以下:(a)层粘连蛋白、纤连蛋白、腱生蛋白C和蛋白聚糖,其已显示抑制轴突再生(参见,例如,Stephen J.A.Davies et al.,"Regeneration of adult axons in white matter tractsof the central nervous system,"Nature 390,680-683(18Dec.1997);(b)反应性星形胶质细胞,其是胶质疤痕的主要细胞成分,形成致密的质膜延伸网,并通过分泌包括层粘连蛋白、纤连蛋白、腱生蛋白C和蛋白聚糖在内的许多分子来修饰细胞外基质;(c)已知诱导胶质疤痕形成的分子介质,包括转化生长因子β(TGFβ),如TGFβ-1和TGFβ-2,白细胞介素,细胞因子,如干扰素γ(IFNγ),成纤维细胞生长因子2(FGF2)和睫状神经营养因子;(d)促进基底膜生长的糖蛋白和蛋白聚糖(参见,例如,CC Stichel et al.,"The CNS lesion scar:newvistas on an old regeneration barrier",Cell Tissue Res.(October 1998)294(1):1-9);和(e)使许旺细胞失活的物质。抗再生剂的其他例子包括Semaphorin-3A蛋白(SEMA3A)(其可用于诱导神经元生长锥的塌陷和麻痹)以阻断再生,其被掺入水凝胶中以每天释放约1μg,两周内总共释放2μg,钙(其可导致由细胞内钙离子的局部增加诱导的神经生长锥的转动),f)抑制性染料如亚甲蓝,和g)放射性颗粒。其他抑制性药物包括西加毒素(ciguatoxin)、大麻素、HA-1004、phenamil、MnTBAB、AM580、PGD2、拓扑异构酶I抑制剂(10-HCT)、抗NGF和抗BDNF。
疼痛和炎症。介质可另外包括一种或多种用于在手术后短期时间范围内缓解疼痛的药剂,在所述时间范围内,由于取决于消融程序的局部组织反应,可能会经历超过基线的疼痛增加。为此目的可掺入水凝胶中的合适麻醉剂的例子包括,例如,布比卡因、罗哌卡因、利多卡因等,其可被释放以在治疗区域周围提供手术后短期局部疼痛缓解。通过在水凝胶中掺入甲泼尼龙,周围组织中的炎症和疤痕组织也可以最小化。
生长许可形式。关于图5A-5E的例子,在一些情况下,希望在神经的近端和远端残端之间提供生长许可物质,以促进神经再生而不是抑制生长。在一些实施方案中,生长许可物质只是为生长抑制凝胶泄漏到吻合部位或受损神经组织中并抑制再生提供了临时屏障。在其他实施方案中,生长许可物质提供了一种介质,通过所述介质神经可以再生,而不需要自体移植物/同种异体移植物或导管/包裹物。
根据本发明的另一方面,提供了促进引导神经生长的方法和装置,例如跨越两个相对的神经残端之间的间隙并恢复神经功能或填充已经用缝线直接接合的神经之间的小间隙。所述方法可以包括以下步骤:将第一神经末端和第二神经末端放置在第一结构空腔中;将原位形成生长许可介质引入所述空腔,并与第一神经末端和第二神经末端接触以形成连接;所述介质从可流动状态转变为不可流动状态。然后将通过原位形成的介质耦合在一起的神经从第一结构空腔中移除,并放入第二个更大的结构空腔中;以及将生长抑制介质引入第二结构空腔中以封装所述连接。生长抑制介质从可流动状态转变为不可流动状态,覆盖神经和生长许可介质;所述第二结构然后被移除和丢弃。在另一个实施方案中,所述第一和/或第二结构保留在原位。
还提供了一种原位形成的神经再生构建体,其包括生长许可水凝胶桥,其具有第一和第二末端,并被配置为跨越两个神经末端之间的空间并促进神经跨桥再生;以及生长抑制水凝胶护套,其包封生长许可水凝胶桥,并被配置为延伸超过所述生长许可区域的所述第一和第二末端,以分别直接接触近端和远端神经。在又一个实施方案中,生长许可介质被递送到抑制性结构空腔中,在那里它经历从基本可流动状态到不可流动状态的变化。所述结构保留在原位,并作为神经不能通过其再生的生长抑制基质。
优选地,所述生长许可介质由原位形成凝胶如水凝胶组成,生长抑制介质由原位形成凝胶如水凝胶组成。然而,生长许可介质可以由原位形成凝胶组成,并且其被递送到的结构由离体交联的凝胶组成。
在一些实施方案中,期望所述生长许可水凝胶粘附到神经组织,提供一种无需缝合就能使组织吻合的方法。这样,神经生长许可凝胶-神经单元可以作为一个连续的神经单元被拾取和处理,允许它们稍后将所述单元放置在生长抑制水凝胶中。在其他实施方案中,所述生长许可水凝胶可以提供持续大约半小时的临时胶粘。所述胶粘的强度足够强,使得不费力地粘住两条神经,但机械强度却可以与例如纤维蛋白胶相当。
无张力修复。原位形成水凝胶的另一个优点是,它们可以被设计成提供神经的无张力修复。在一个实施方案中,导管的包裹物结构足够深,使得直接修复的/吻合的神经末端被放置在所述结构中,同时修复区域在所述结构内部去紧张。当水凝胶在被去紧张的神经周围形成时,神经-神经修复不受张力;任何张力都是由它周围的水凝胶承载的。以这种方式,神经不受张力,水凝胶以比缝合修复更均匀分布的方式承载负荷。
在另一个实施方案中,所述生长抑制水凝胶另外提供无张力修复。在所述实施方案中,近端和远端神经被放置在导管中,并且生长抑制水凝胶在神经-导管界面处被递送,以防止神经从导管中逸出并与周围的疤痕组织束缚在一起。在另一个实施方案中,通过在结构内的神经中产生松弛,在生长许可水凝胶内有目的地使神经去紧张。在神经直接重新吻合的情况下,在将生长许可水凝胶前体溶液应用于包裹物中之前,要小心确保张力(如果有的话)位于神经和包裹物结构两侧的结构入口之间的界面处,并且包裹物内部的神经是松弛的或者没有张力。以这种方式,神经吻合、神经-凝胶-神经或神经-神经界面没有张力。在优选实施方案中,所述神经生长许可水凝胶-神经单元完全位于第二神经结构的空腔内。抑制性水凝胶的递送提供了额外的保护和去紧张,在损伤的两侧神经周围提供了大约3至10mm的周向覆盖。
覆盖。在一个实施方案中,所述生长许可介质基本上位于两个神经末端之间,并且没有明显地覆盖神经的外表面。因此,生长许可介质的直径非常接近神经的直径。由于生长许可介质的位置,生长抑制介质被递送到近端神经和远端神经的外表面或神经外膜表面以及生长许可介质周围,优选在两侧覆盖10mm或5mm以上的健康神经。这允许引导神经从近端神经残端直接到远端神经残端。额外的覆盖提供了粘附强度和保护,以防止近端神经-凝胶连接处的异常神经生长。
颜色。在一个实施方案中,生长许可水凝胶是一种颜色,例如蓝色,而生长抑制水凝胶没有颜色。在另一个实施方案中,生长许可水凝胶是蓝色的,而生长抑制水凝胶是绿色或蓝绿色的。
优选地,所述生长许可物质是原位形成水凝胶。优选地,所述生长许可物质包含生长抑制性和生长许可性微区。神经将自然地沿着生长抑制区域和在生长许可区域内寻路。利用原位形成PEG平台的生长许可水凝胶是理想的。这些水凝胶可以是化学交联的,或者使用光交联方法进行交联,如上述非生长许可水凝胶。所述原位生长许可水凝胶优选比生长抑制水凝胶更快降解,促进细胞向内生长并用天然细胞外基质替代合成基质。因此,用于这些应用的优选的PEG水凝胶是通过PEG-NHS酯与水解不稳定的酯键(PEG-SS、PEG-SG、PEG-SAZ、PEG-SAP,优选PEG-SS)的交联形成的。例如,这些PEG可以和PEG-胺或三赖氨酸交联。
可以选择其它水凝胶来提供生长许可水凝胶的非生长许可区,包括PEG-PPO-PEG、PEG-聚酯(三嵌段、二嵌段)、藻酸盐、琼脂和琼脂糖。其他合成水凝胶包括PEG-聚(酰胺基胺)水凝胶、PEO、PVA、PPF、PNIPAAm、PEG-PPO-PEO、PLGA-PEG-PLGA、聚(醛古洛糖醛酸)(poly(aldehyde guluronate))或聚酸酐。Hoffman(2012)Hydrogels for biomedicalapplications.Advanced Drug Delivery Reviews,64:18-24中列出了一系列适用于原位形成的水凝胶基质,其在此引入作为参考。另一种可能适用的软水凝胶包括InnoCore液体聚合物(LQP)(PCLA-PEG-PCLA),它是一种液体聚合物,其在体内递送后形成软的宏观贮库,并在两到三个月的时间内缓慢降解。另一种潜在合适的水凝胶包括六臂星形的聚(环氧乙烷-stat-环氧丙烷),带有丙烯酸酯端基(star-PEG-A),可以光固化。其他星形的PEG包括6臂或8臂NHS酯PEG,包括mPEG-SCM(PEG-NHS:琥珀酰亚胺羧基甲基酯)和mPEG-SG(PEG-NHS:琥珀酰亚胺戊二酸酯)、PEG-共-聚(乳酸)/聚(三亚甲基碳酸酯)、PEG-NHS和三赖氨酸、PEG-NHS和PEG-硫醇、PEG-NHS和PEG-胺、PEG-NHS和白蛋白、葡聚糖醛和用三(2-氨基乙基)胺官能化的PEG-胺。PEG浓度。如果在生长许可基质中使用PEG,对于支持神经延伸的应用,这些水凝胶中PEG的浓度优选为3-8wt%,更优选为3-5wt%。
在一些实施方案中,所述生长许可区域直接共轭或化学连接到非生长许可水凝胶区域。例如,壳聚糖可以偶联到抑制区。所述壳聚糖的分子量可以是100kDa至350kDa,更优选130kDa至160kDa,脱乙酰度为0.85。在另一个实施方案中,明胶甲基丙烯酰胺的互穿网络与PEG框架聚合。
可选的生长许可基质。除了包含促进神经胶质细胞侵袭、细胞分裂和三维细胞组织化的带正电荷的基质成分外,生长许可成分还可以在有或没有支持细胞的情况下支持神经向内生长。这些生长促进物质以足以支持生长的浓度施用,但浓度不能高到影响水凝胶的机械性能。生长许可水凝胶包含天然生长促进生物材料的组合,例如天然聚合物I型胶原(0.01-5wt%,优选0.3-0.5wt%,1.28mg/ml)、层粘连蛋白(4mg/ml)、透明质酸、纤维蛋白(9-50mg/ml,强度2.1kPa)或合成/半合成聚合物如聚左旋精氨酸或聚左旋赖氨酸(0.001-10wt%)。通过将上述生长抑制区域与生长许可基质结合,可以形成生长支持基质。这些混合物支持1)建立再生神经可以通过其寻路的路径,2)提供神经突可以粘附和许旺细胞可以迁移的基质。在一个实施方案中,水凝胶是用三赖氨酸交联的8臂15K PEG-琥珀酰亚胺琥珀酸酯(PEG-SS),其含有5wt%的胶原。在另一个实施方案中,水凝胶包含含有0.01%聚左旋赖氨酸的4%PEG(用4-臂20K PEG-胺交联的4-臂10K PEG-SG)。通过相对于用于神经瘤阻断应用的生长抑制性PEG,降低交联PEG溶液的浓度,并增加带正电荷的生长许可生物材料的浓度,可以产生具有抑制性和许可性区域的原位形成水凝胶,以促进神经生长。
在另一个例子中,非生长许可水凝胶(例如交联的PEG水凝胶、藻酸盐、甲基丙烯酰基取代的原弹性蛋白MeTro水凝胶)可以与生长许可水凝胶(例如纤维蛋白明胶-甲基丙烯酰基GelM、GelM/PEG或GelMA/MeTro复合材料)混合,Soucy et al(2018)Photocrosslinable Gelatin-Tropoelastin Hydrogel Adhesives for PeripheralNerve Repair,Tissue Engineering,PMID:29580168。聚赖氨酸的加入。聚赖氨酸——无论是D、L还是L形式,都可以掺入所述生长许可水凝胶区域。例如,Epsiliseen(Siveele,ε-聚-L-赖氨酸)。所述生长许可水凝胶可以是包含壳聚糖和聚赖氨酸的原位形成水凝胶(https://pubs.acs.org/doi/10.1021/acs.biomac.5b01550)。所述生长许可水凝胶可以是包含PEG和聚赖氨酸的原位形成水凝胶(https://pubs.acs.org/doi/abs/10.1021/bm201763n)。
主链中的PEG+胶原。或者,天然聚合物,例如I型胶原,可以与PEG水凝胶(例如8臂15K SG)交联,胶原浓度范围为30至60mg/ml,PEG浓度为50或100mg/ml(Sargeant et al2012.An in situ forming collagen-PEG hydrogel for tissue regeneration.ActaBiomaterialia 8,124-132和Chan et al(2012)Robust and semi-interpenetratinghydrogels from PEG and Collagen for Elastomeric Tissue Scaffolds.12(11)1490-1501)。
其他凝胶。在又一个实施方案中,第一生长许可材料可以包括粘性溶液、基于纳米颗粒或微粒的凝胶、浆料或大粒凝胶。在一个实施方案中,纤维蛋白胶可以递送在神经周围。在另一个实施方案中,所述溶液是生物相容性纳米颗粒或微粒的浆液,神经可以通过所述浆液再生。在另一个实施方案中,将微凝胶或模块凝胶(modugel)递送至所述部位。微凝胶是通过沉淀聚合产生的尺寸均匀、表面积大的稳定分散体。模块凝胶是由微凝胶形成的支架,其性质可以通过交联度和支架刚度来改变(所述凝胶的制备,包括基于PEG的水凝胶,可以参考Scott et al(2011)Modular Poly(ethylene glycol)scaffolds provide theability to decouple the effects of stiffness and protein concentration onPC12 cells.Acta Biomater 7(11)3841-3849,其在此引入作为参考)。此外,使用导电水凝胶,如在机械应变下产生瞬时表面电荷的压电聚合物如聚偏二氟乙烯(PVDF),可能有利于支持神经通过水凝胶的生长。例如,由代谢物(如琥珀酸、甘油和β-丙氨酸)组成的树枝状聚合物可以掺入水凝胶中以促进细胞外基质渗透(Degoricija et al(2008)Hydrogels forOsteochondral Repair Based on Photocrosslinkable Carbamate Dendrimers,Biomacromolecules,9(10)2863)。
普通天然水凝胶。在另一个实施方案中,提供完全生长许可水凝胶,而没有生长抑制微区。在一个实施方案中,选择具有较低线性压缩模量的纤维蛋白水凝胶(例如用凝血酶交联的那些)。许多其他生物材料也已被证明支持2D和3D支架中的神经再生,包括壳聚糖、壳聚糖偶联的藻酸盐水凝胶、粘性纤连蛋白、I型胶原(~1.2mg/ml)、辅助再生、纤维蛋白(9至50mg/ml)、纤连蛋白、层粘连蛋白(https://www.ncbi.nlm.nih.gov/pubmed/15978668)、Puramatrix、硫酸肝素蛋白聚糖、透明质酸(1%透明质酸钠粘性溶液)、聚赖氨酸(聚(D,或L,或D,L)赖氨酸)、木葡聚糖、聚鸟氨酸、琼脂糖(0.5%至1%w/v)和这些材料的混合物。其他生长许可水凝胶包括热敏水凝胶,如壳聚糖-β-甘油磷酸盐水凝胶(C/GP)混合物。其他热敏水凝胶包括聚(N-异丙基丙烯酰胺)(PNIPAAM)。在一个实施方案中,聚富马酸丙烯酯(PPF)可以作为液体注射,并且被化学、热或光原位交联以形成凝胶,从而提供支持生长的水凝胶。在另一个实施方案中,HA和可光交联的甲基丙烯酸缩水甘油酯透明质酸(GMHA)的互穿网络提供了生长许可基质。其他生长许可水凝胶包括:交联透明质酸凝胶(Hyaloglide凝胶)或ADCON-T/N凝胶(Gliatech)。这些材料可以是物理交联或共价交联的。其他支架材料可预期用于生长许可区域(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5899851/)。
带电。本领域众所周知,神经更喜欢在带正电的表面上或穿过带正电的表面生长。在一些实施方案中,将正电荷掺入聚合物主链中。在其他实施方案中,这些电荷被掺入其他成分中,例如当水凝胶原位形成时被捕获在水凝胶中的细胞外基质蛋白。
佐剂的掺入。在一些实施方案中,可以将抗抑制分子掺入水凝胶中以改善生长许可环境,例如软骨素酶,其分解硫酸软骨素蛋白聚糖(CSPG)。https://www.ncbi.nlm.nih.gov/pubmed/20620201。根据佐剂的稳定性要求,这些可以与聚合物粉末、稀释剂或促进剂一起掺入。
脂质结构域的掺入。脂质结构域可以添加到主链或侧链或这些聚合物中,以促进神经生长。疏水域也可以掺入水凝胶的主链中,以支持神经通过水凝胶的软区和硬区向内生长。在一个实施方案中,添加脂质以在聚合物链之间扩散,并作为聚合物材料的增塑剂,促进链移动并提高弹性。
粘附强度。生长许可介质和生长抑制介质可以转化成水凝胶,并具有足够的粘附性,其一旦形成,神经末端就可以容易地被拾取和处理。然而,随后形成的不可流动的生长许可介质的粘合强度允许用镊子拾取神经-凝胶-神经单元。所述单元可以轻轻放置在第二结构中,以允许抑制性水凝胶的周向递送。粘附强度还允许神经末端和水凝胶之间的良好耦合。
刚度。由于水凝胶的基质刚度和抗压强度在促进或抑制神经再生中起着重要作用,生长抑制水凝胶和生长许可水凝胶的机械性能有很大不同。所述生长许可水凝胶明显更软,刚度更低,以支持和促进神经生长锥在介质中的再生。生长许可水凝胶的凝胶刚度(G*,dynes/sq cm)优选更软且更具弹性,其特征在于G*小于800dynes/sqcm,更优选小于200dynes/sqcm。在一些实施方案中,软基质区域(100-500Pa)被放置在较硬基质区域(1000-10000Pa)附近。所述生长许可基质的弹性应优选小于0.1-0.2MPa,优选小于1.5KPa。另一方面,生长抑制水凝胶提供了必要的机械强度,以保持近端和远端神经残端之间的耦合和关系,减少或消除缝合的需要,并潜在地允许无张力修复。神经向生长许可基质中的延伸强烈依赖于基质刚度和孔的孔隙互连性、电荷。随着凝胶降解,神经延伸也可能受到基质水解、氧化或酶降解的影响。对于生长许可水凝胶,凝胶的刚度应更接近神经组织的弹性模量,等于或低于1kPa,优选200-300Pa。溶胀。基于生长抑制水凝胶在生长许可水凝胶周围的放置,生长许可水凝胶的溶胀必须小于或等于生长抑制水凝胶的溶胀。或者,生长许可水凝胶必须足够柔软,以至于它不具有推动生长抑制水凝胶的强度。孔隙率。在一些实施方案中,所述生长许可介质包括生长抑制水凝胶,其填充有高度互连的宏观的生长许可孔,这些孔提供了再生神经可以通过其寻路的通道。通过成孔剂淋溶(固体、液体)、气体发泡、乳液模板以产生大孔隙率,可以在水凝胶中产生孔。所述孔可以由生长许可成孔剂产生和/或包含治疗剂或简单地用盐水填充。所述孔可以通过水凝胶形成过程中的相分离产生。平均孔径、孔径分布和孔隙互连很难量化,因此包含在一个称为迂曲度(tortuosity)的术语中。优选地,所述水凝胶是大孔水凝胶,其孔大于1μm,更优选大于10μm,优选在>100μm之间,更优选>150μm,平均孔半径为0.5至5%。所述孔的密度应大于60%,或优选大于90%的孔体积,其密度足以使孔相互连接。以这种方式,剩余的PEG水凝胶提供了一个非生长许可的支架,神经元可以通过所述支架生长。在一个实施方案中,通过摇动在水凝胶中产生空气或氮气泡,来回推动施用器中的柱塞,或者通过施用器中的另一个端口引入空气,来产生孔隙率。在另一个实施方案中,表面活性剂(例如十二烷基硫酸钠(SDS))被用作空气潴留剂以在水凝胶中产生孔隙率。原位气体发泡具有高达60%的孔隙率和50至500微米的孔以及20-40Mpa的压缩模量,如https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3842433/中所述。在另一个实施方案中,创建一种发泡剂,该发泡剂产生宏观尺寸的孔,以允许细胞迁移和增殖。在一些实施方案中,成孔剂是降解增强剂。优选地,孔的浓度足以使孔相互连接。优选地,>70%的孔是相互连接的,更优选80%或更多。这些孔形成并限定了生长许可区,并且优选地,互连性足够高,使得迂曲度低,神经将延伸到其中。此外,如果孔的壁由PEG形成,则神经可以沿着水凝胶的壁寻路。可以通过低分子量封端的PEG(例如PEG 3350)产生孔,这些PEG可以以高达50wt%的溶液形式递送。所述生长许可区或孔可包含天然生物材料,如胶原/明胶、壳聚糖、透明质酸、层粘连蛋白(基质凝胶)、纤维蛋白,它们为神经生长提供生长许可基质。
通道。在另一个实施方案中,在水凝胶中原位产生通道以允许神经引导。在一个实施方案中,通道直径约为150μm、300μm,更优选直径为500μm至1mm。优选地,通道原位充满盐水。
纤维和其他结构元素。期望添加纤维或结构元素(例如珠、巨球、凝胶颗粒浆、微球、棒、纳米颗粒、脂质体、棒、细丝、海绵)来增强水凝胶的结构完整性、改善水凝胶在体内的持久性和/或提供神经突可沿其延伸和生长以进行引导的基质。纳米纤维可以是柔性的或刚性的,尺寸范围可从纳米到微米,并且可以是线性的或不规则形状的。在优选实施方案中,纤维通过包含介质的针沉积到结构中允许导管内的纤维大致纵向平行排列。通过首先填充远端并以平滑连续的运动将针推进到结构的近端(同时沉积水凝胶),将负载纤维的介质放置在导管中。快速凝胶化(少于20秒,优选少于10秒,更优选少于7秒)允许纤维在介质变为不可流动形式时以所需的方向被捕获。在另一个实施方案中,介质溶液更粘,在10和20cP之间,允许这些纤维悬浮在生长许可介质中。在另一个实施方案中,纤维被提供在试剂盒中,并且被用镊子放置在内腔中。
纤维、棒、细丝、海绵。在另一个实施方案中,在递送包裹物结构中的生长许可水凝胶溶液之前或之后立即将纤维加入到所述结构中,以提供一个表面,神经可以沿着所述表面生长到远端残端。可以使用镊子、另一个注射器或在导管内喷洒来添加纤维。水凝胶介质的胶凝时间被充分延迟,使得纤维可以在介质变成基本上不可流动的形式之前嵌入介质中。
注射纳米棒类似地,较短的纳米棒可以掺入到聚合物溶液、聚合物粉末、稀释剂或促进剂中,然后原位注射。通过平滑地沿一个方向注射并利用快速凝胶化水凝胶,可以改善这些纤维的排列。纤维可以由不可降解或可生物降解的材料制成。在一些实施方案中,纤维由壳聚糖、聚己内酯、聚乳酸或乙醇酸或其组合制成。所述纤维可以是惰性的,用正电荷官能化或添加涂层(如层粘连蛋白)。https://www.ncbi.nlm.nih.gov/pubmed/24083073.在另一个实施方案中,所述纤维经历分子自组装以形成纤维或缆绳。
在一个实施方案中,纤维将随机或以对齐的方式加入,以便为穿过凝胶的神经再生提供支持。细丝和海绵可以由胶原形成。棒可以由胶原-糖胺聚糖、纤维蛋白、透明质酸、聚酰胺、聚丙烯腈-共-甲基丙烯酸酯、PAN-MA、PGA、PHBV/PLGA共混物、PLLA、PLGA或PP形成。细丝的直径可以在0.5至500μm之间,更优选直径为15至250μm。在一个实施方案中,棒、纤维和细丝可以用层粘连蛋白涂覆。
纳米纤维可以掺入水凝胶中以提供结构支撑。纤维可以由PEG、PGA、PLA、PCL、与明胶混合的PCL、具有层粘连蛋白涂层的PCL、壳聚糖、透明质酸、凝胶、玻尿酸、纤维蛋白或纤维蛋白原(10mg/ml)组成。在一个实施方案中,通过静电纺丝制造的纤维状纤维蛋白水凝胶(AFG),或P(D,L,LA)纤维被掺入到原位形成凝胶中。(McMurtrey(2014)Patterned andfunctionalized nanofiber scaffolds in three-dimensional hydrogel constructsenhance neurite outgrowth and functional control.J.Neural Eng 11,1-15中描述了静电纺丝方法,其被并入本文)。在另一个实施方案中,聚乙二醇作为成孔剂掺入,纳米纤维(如纤维素纳米纤维)用于为软多孔水凝胶提供结构完整性(Naseri et al(2016)3-Dimensional Porous Nanocomposite Scaffolds Based on Cellulose Nanofibers forCartilage Tissue Engineering:Tailoring of Porosity and MechanicalPerformance.RSC Advances,6,5999-6007,在此引入作为参考)。
微粒。在又一个实施方案中,可以将微粒、纳米颗粒或胶束引入生长许可介质中,以将药物递送至神经组织。在一个实施方案中,微粒由PEG水凝胶(例如8臂15K SG,10%),聚(D,赖氨酸)微粒组成。例如,离体形成的交联PEG颗粒可以配制成由低分子量PEG(1-6%,12kDa)润滑的浆液。或者,颗粒可以悬浮在胶原蛋白或透明质酸溶液中,以提供生长许可基质,神经可以通过所述基质再生。类似地,可以掺入疏水颗粒和油,以在水凝胶中产生允许生长的空隙,以促进神经生长。
生长促进水凝胶的压缩模量。将神经组织的压缩模量与生长许可水凝胶相匹配也可能是有利的——约2.6至高达9.2kPa(Seidlits et al(2010)The effects ofhyaluronic acid hydrogels with tunable mechanical properties on neuralprogenitor cell differentiation are promising(Biomaterials 31,3930-3940)。类似地,线性压缩模量小于20kPa,优选小于10kPa,更优选小于1kPa,以促进神经和许旺细胞向内生长到凝胶中。
理想的是原位形成生长许可水凝胶,其能够以包裹物结构或薄层围绕部分横断的、被压迫的或完全横断的神经末端递送。原位形成凝胶的使用消除了横切原本大体上完整的神经的需要,并提供了一种支持神经再生通过基质并进入远端组织的机制。将生长许可水凝胶与生长抑制水凝胶偶联有助于在生长许可区域内引导和指导这些神经突。在一个实施方案中,原位形成水凝胶具有足够的粘合强度和刚度,使得它可以在神经残端之间递送,至合适的结构中,然后从第一包裹物结构中拾取和移出,并放置在更大的第二包裹物结构中,生长抑制性原位形成水凝胶被递送到所述更大的第二包裹物结构中。
水凝胶厚度。生长许可凝胶。生长许可凝胶的厚度或直径应大致接近其递送到的神经的直径。在神经中只存在小缺陷的情况下,生长许可凝胶可以直接滴在受伤组织上形成薄层。生长抑制凝胶。鉴于神经所处的通常严格的环境(通常在肌肉之间或沿着肌肉的筋膜平面中),在一些实施方案中,期望在神经周围保持最小厚度的生长抑制水凝胶,优选在圆周方向上1mm,更优选2-3mm。例如,对于放置在普通指神经(直径约为2-2.5mm)周围的结构,使用直径约为3-4mm的导管,在神经周围提供0.5-2mm的水凝胶层。对于约1至1.5mm的指神经,选择直径约2至2.5mm的导管。对于嵌入在手臂或大腿中的较大神经(在2至10mm之间),优选地,在神经周围周向的凝胶厚度为2至6mm,优选地为2至3mm。
胶凝时间。在30秒或更短,优选20秒或更短,更优选10秒或更短,更优选3至7秒后,水凝胶在神经周围形成。水凝胶是透明的,因此神经的位置可以在水凝胶中被视觉确认。临床医生通过视觉或机械方式确认水凝胶的形成,并将硅树脂结构从水凝胶帽上滑下并丢弃。参见图2。周围的组织(肌肉、皮肤)然后按照标准的外科技术再次缝合。
生长许可凝胶或浆液的体内持久性。生长许可水凝胶的体内持久性可能比生长抑制凝胶低得多,从而允许许旺细胞的进行性侵袭和再生神经纤维。对于生长许可水凝胶,需要更快速降解的水凝胶网络,以允许细胞浸润和随后的神经再生。优选地,水凝胶应在2个月至6个月之间降解,更优选3个月。抑制区的降解。抑制性引导件优选保持在原位1个月或更长时间,更优选3个月或更长时间,以向再生神经提供支持。在一些实施方案中,生长许可水凝胶的降解是几天至几个月,优选几天至几周,从而允许随着细胞组织的替换和再生而清除材料。
电荷。优选地,生长许可水凝胶是带正电荷的或包含带正电荷的区域。添加PEG融合剂。在一些实施方案中,可能需要向水凝胶制剂中加入非反应性融合剂。因此,除了水凝胶的机械阻断特性之外,受损的近端存活神经可以被保护免受兴奋毒性损伤,并且它们的膜被重新密封。此外,细胞体如背根神经节的过度兴奋性降低,减少伴随神经损伤的神经性感觉异常和不适感。在一个实施方案中,低分子量封端或非反应性PEG(甲氧基-PEG)加入到制剂中。例如,三赖氨酸缓冲液可以包含非反应性低分子量线性PEG(0.2kDa、2kDa、3.35kDa、4kDa或5kDa)。当与8臂15K星形PEG混合时,所得水凝胶将具有低分子量PEG(2kDa,10-50%w/v),这可能有助于密封受损的神经末梢,从而进一步减少离子的流入和流出。以这种方式,可以防止溶酶体形成、脱髓鞘和其他膜碎片在所述部位积累。在另一个实施方案中,环孢菌素A可以与溶液一起应用,以提高消融轴突的存活率。
在另一个实施方案中,可以加入六臂星形封端PEG(聚环氧乙烷-stat-环氧丙烷)或星形PEG-OH作为融合剂。混合在聚合物混合物中的线性PEG可以从交联网络中扩散出来,产生直径高达1微米的微孔,促进营养物质的扩散,但不促进神经突的延伸。所述线性PEG基水凝胶比星形PEG基融合剂添加物更硬。线性PEG的添加是基于已证明2kDa PEG有利于快速恢复轴突完整性的发现,称为切割轴突和受压迫轴突的神经之间的“PEG融合”(Britt etal 2010,J.Neurophysiol,104:695-703)。理论认为,这部分是由于质膜和轴膜在病变部位的封闭。
重新应用或重新定位。如果临床医生对神经的位置不满意,则可以用镊子取下水凝胶“帽”,重复所述程序。神经备用。在又一个实施方案中,可能希望在神经周围递送原位形成水凝胶,以减少手术过程中对神经的处理。通过将其递送到神经束内和周围,水凝胶可以在手术过程中固定并防止镊子或任何其他显微操作器挤压它。除了保护神经免受机械损伤之外,水凝胶还可以防止热损伤,例如通过烧灼或RF消融、冷冻消融。
存在几个实施方案,其中现有的神经包裹物(例如导管顶部开有缝隙,可将神经推入半刚性包裹物中)和/或导管仍然是期望的,但是医生希望以应用生长许可水凝胶、生长抑制水凝胶或其组合的结构为再生提供额外的支持。
生长许可水凝胶的结构被设计成基本上与它们所放置的神经的尺寸相同。在一个实施方案中,选择硅管结构,其是半管,其内径近似等于神经的外径。神经被放置在所述结构中,或者是直接贴合,或者是紧密接近,或者是有一个间隙以防止张力,这样它们就可以毫无张力地放置在所述结构中。神经直接位于所述结构本身的表面,用于递送生长许可水凝胶。
促进神经再生的药物。药物可以在放置所述结构前直接被递送到神经。例如,局部麻醉剂、抗炎剂、生长因子剂可以在用水凝胶包裹之前直接递送到神经。或者,可以将药物直接掺入水凝胶中,或者通过包封掺入载药微球、胶束、脂质体或游离碱中,以获得改善的持续释放曲线。
止痛药。在一些实施方案中,用于治疗慢性神经性疼痛的药物可以在水凝胶中递送,包括三环抗抑郁药、选择性血清素和去甲肾上腺素再摄取抑制剂、抗癫痫药和阿片类药物。例如,普瑞巴林和加巴喷丁可根据其镇痛特性进行选择。类似地,度洛西汀、文拉法辛、SNRI抑制剂及其组合可提供更全面的疼痛缓解。抗炎剂如双氯芬酸可能也有望使用。其他潜在的靶标包括FK506结合蛋白家族的配体、神经免疫亲和素配体,它们是神经营养剂、神经保护剂和神经再生剂。
紫杉醇和西妥昔单抗的局部给药也显示出改善神经元存活和再生的前景,并且当在原位形成的水凝胶中局部递送时,可能适合于刺激神经再生。在另一个实施方案中,环腺苷酸(cAMP)或cAMP类似物二丁酰cAMP促进神经再生,并可掺入原位形成水凝胶中以促进损伤后的神经再生。在另一个实施方案中,Kindlin-1和Kindlin-2(Fermitin家族)以及结合到细胞表面受体的整合素超家族的药物允许神经延伸穿过抑制性基质,并且可以被掺入水凝胶中以增强穿过抑制性细胞外基质的再生。
在另一个实施方案中,可以将免疫抑制剂他克莫司(FK506)掺入水凝胶中,以增强轴突生成和速度。形成的水凝胶中FK506的最终浓度为100ug/ml至10mg/ml,更优选0.1mg/ml。所述药物释放数周至数月,优选至少一个月,更优选至少3个月,以帮助免疫抑制和增强神经生长。药物包括FK506,为FKBP12或FKBP51的选择性抑制而选择的药物。
与内脏和神经性疼痛(以及偏头痛和癌症疼痛)有关的P2X受体拮抗剂(P2XR)、P2X3受体拮抗剂(例如AF-219Gefapivant、AF-130)、P2X4和P2X7受体拮抗剂药物是感兴趣的。P2X7受体拮抗剂。嘌呤能受体拮抗剂亮蓝G(BBG)和结构相似的类似物亮蓝FCF(BBFCF),由于其调节损伤后神经环境的能力而特别受关注(Wang et al.2013.The food dyeFD&C Blue No.1is a selective inhibitor of the ATP release channelPanx1.J.Gen.Physiol.141(5)649-656))。其他感兴趣的染料包括FD&C Green No.3染料,它像BBG和BB FCF一样,抑制ATP释放Pannexin1通道,其IC50在0.2和3uM之间。一种结构相似的类似物,亮蓝FCF(BB FCF),也称为FD&C#1(https://pubchem.ncbi.nlm.nih.gov/compound/Acid_Blue_9),当与低分子量封端的PEG 3350Da(https://www.ncbi.nlm.nih.gov/pubmed/23731685)结合使用时,也已被证明能改善损伤后的神经存活和再生。在大鼠坐骨神经挤压伤模型(Ribeiro等人,2017年)和肌间神经丛缺血模型(Palombit等人,2019年)中使用BBG证明了类似的功效。此外,通过减少神经损伤后细胞外高ATP浓度和高钙流入,BBG被认为具有抗炎和抗伤害感受性作用。在一个实施方案中,亮蓝FCF被掺入原位形成水凝胶中。染料可以掺入聚合物小瓶、稀释剂或促进剂溶液中,以在凝胶中产生0.0001至5%,优选0.001至0.25%,更优选0.01至0.02%wt%或约1至1000ppm,优选10至100ppm的最终浓度。在每个部位的解剖学基础上,5μg至高达25mg的染料的局部剂量可以在水凝胶中局部递送。例如,FD&C#1染料可在水凝胶中以0.01%的浓度递送,以减少中风后的神经元损伤(Arbeloa等人,2012年——参考Palmobit等人,2019年)。通过将染料掺入水凝胶中,染料可以帮助提高横断轴突的存活率,减少局部炎症,同时水凝胶提供再生屏障。
在另一个实施方案中,TRPV1激动剂,例如辣椒素,被递送至神经以对神经进行预处理损伤,从而导致下游的神经再生反应以增强神经再生(PMID:29854941)。在一个实施方案中,负载辣椒素的水凝胶(1至8wt%的药物载量)经皮递送至完整神经,以减轻糖尿病性神经痛。在另一个实施方案中,在水凝胶中递送菲丝菌素-u(pifithrin-u)或乙酰-L-肉碱,以通过减少神经元线粒体损伤来减少和治疗化疗诱导的外周神经病(CIPN)。
在另一个实施方案中,阻断去调节的长的非编码RNA的药物也可以掺入水凝胶中,例如内源性Kcna2反义RNA的靶标。在一个实施方案中,丝裂霉素C被掺入原位形成水凝胶中,以抑制许旺细胞增殖并刺激成纤维细胞凋亡。在一个实施方案中,将0.1至5mg丝裂霉素C装载入聚合物粉末中,并用于形成原位形成的凝胶,其中0.01-0.5wt%的丝裂霉素C每天的释放量在0.1至0.5mg/ml之间,优选释放7天或更长时间。在又一个实施方案中,可以掺入Rho激酶(ROCK)抑制剂或ROK拮抗剂或Rac1拮抗剂,例如盐酸利舒地尔。
其他药物包括抗炎的姜黄素、雷帕霉素、紫杉醇、环孢菌素A、刺激髓鞘再生的嘧啶衍生物(RG2和RG5)、轴突导向分子Slit 3、雷公藤内酯醇、KMUP-1。钙调节剂包括降钙素、钙拮抗剂硝苯地平、尼莫地平、神经生长因子(NGF,500ng)、胰岛素样生长因子(IGF-1)、百里醌、度洛西汀(10-30mg)、褪黑激素、c-Jun或mTORC1激动剂可帮助支持许旺细胞分化和神经髓鞘再生、尼古丁和肾上腺髓质素-用作神经保护和神经营养药物。
实施例1。生长抑制水凝胶。向含有80mg具有NHS酯反应性基团的PEG的小瓶中加入80μg BB FCF,以在PEG水凝胶中产生0.1%的染料浓度。
实施例2。生长抑制剂水凝胶与融合剂。向含有具有NHS酯反应性基团的80PEG的小瓶中加入80μg BB FCF和500mg PEG 3350。
实施例3。磷脂(如脑磷脂)被掺入PEG水凝胶中,以改善融合。磷脂是表面活性的两亲性分子,可以作为乳化剂、润湿剂、增溶剂和膜融合剂掺入。这些可以包括磷脂酰胆碱、磷脂酰乙醇胺或磷脂酰甘油(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4207189/,在此引入作为参考)。
实施例4。在一些实施方案中,水凝胶负载有胺碘酮,添加或不添加乙醇。例如,可以达到负载0.1-5wt%的胺碘酮或更多。这也可以通过在溶液中掺入乙醇来实现和改善。例如,可以将50至75%的乙醇与0.25wt%的胺碘酮一起掺入,以在3至5天之间实现胺碘酮的爆发释放。同样,1%胺碘酮可以从水凝胶中递送30-60天。
根据上述教导,多种其他修改、改编和替代设计当然是可能的。因此,此时应该理解,在所附权利要求的范围内,本发明可以以不同于本文具体描述的方式实施。预期可以进行上面公开的实施方案的特定特征和方面的各种组合或子组合,并且仍然落入本发明中的一个或多个中。此外,本文中与实施方案相关的任意特定特征、方面、方法、特性、特征、质量、属性、元件等的公开内容可以用于本文阐述的所有其他实施方案中。因此,应该理解的是,所公开的实施方案的多种特征和方面可以彼此组合或替换,以便形成所公开的发明的变化模式。因此,意图是本文公开的本发明的范围不应受上述具体公开的实施方案的限制。此外,尽管本发明易于进行多种修改和替换形式,但是其具体示例已在附图中示出并在本文中详细描述。然而,应该理解,本发明不限于所公开的具体形式或方法,相反,本发明将覆盖落入所述多个实施方案和所附权利要求的精神和范围内的所有修改、等同内容和替代内容。本文公开的任何方法均不需要按照所述顺序进行。本文公开的方法包括从业者采取的某些动作;但是,它们也可以明确地或暗示地包括这些动作的任意第三方指示。例如,诸如“进入脾肾韧带”的动作包括“指导进入脾肾韧带”。本文公开的范围还包括任意和所有重叠、子范围及其组合。诸如“至多”、“至少”、“大于”、“小于”、“在......之间”等语言包括所列的数字。如本文所用,用术语例如“大约”、“约”和“基本上”修饰的数字包括所列的数字(例如,大约10%=10%),并且还表示接近所述量的仍然执行所需功能或达到所需结果的量。例如,术语“大约”、“约”和“基本上”可以指所述量的小于10%内、小于5%内、小于1%内、小于0.1%内、小于0.01%内的量。此外,本文讨论了多种理论和可能的动作机制,但并不意图限制。
- 一种扫码方法、系统和一种用于扫码的装置
- 一种问卷调查对象确定方法、装置、电子设备和存储介质
- 一种车位确定方法、装置、电子设备、车辆及存储介质
- 配送参数的确定方法、确定装置、存储介质和电子设备
- 生成、验证二维码的方法和装置,存储介质和电子设备
- 一种扫码识别率确定方法、装置、电子设备和介质
- 一种健康码快速扫码方法、装置、电子设备及存储介质
