基于葡萄糖数据的对患者健康状况变化的检测
文献发布时间:2024-04-18 20:01:30
技术领域
本公开整体涉及医疗系统,并且更具体地,涉及被配置为监测患者心脏健康风险的患者数据的医疗系统。
背景技术
一些类型的医疗系统可监测患者或一组患者的各种数据(例如,心电图(EGM)和活动)以检测健康状况变化。在一些示例中,医疗系统可监测心脏EGM以检测一种或多种类型的心律失常,诸如心动过缓、心动过速、纤颤或心搏停止(例如,由窦性暂停或AV阻滞引起)。在一些示例中,医疗系统可包括可植入医疗装置或可穿戴装置中的一者或多者以收集用于检测患者健康状况变化的各种测量。
发明内容
本文所述的医疗系统和技术基于来自葡萄糖传感器的患者数据来检测患者的心血管事件风险。通常,在患者的葡萄糖水平和患者的心脏健康之间存在明确定义的关系。如本文所示,各种医疗装置(例如,可植入装置、可穿戴装置等)可被配置为监测患者葡萄糖传感器测量结果,并且一个或多个计算装置可检测与葡萄糖传感器测量结果相关的患者健康状况变化。已经发现,患者的葡萄糖传感器测量结果提供了对患者心脏健康的准确评估,并且监测这些葡萄糖水平提供了对患者健康状况变化的改进指示。
通过利用葡萄糖传感器来检测心血管事件的风险,本公开的系统、装置和技术可受益于改进的心血管事件风险检测,例如,相对于使用一个或多个其他患者参数而不考虑葡萄糖数据的检测。相对于基于单独参数的单独风险评估,使用集成诊断方法检测心血管事件的风险可降低系统复杂性并提供改进的检测。鉴于上文,本公开描述了一种整合到实际应用中的技术改进或技术解决方案。
在另一种可植入的监测变型中,该装置以皮下方式植入到颅骨上,以便于监测附加的生理信号(例如,心电图(EGM)、脑电图(EEG)和活动/加速度测量),如图1B和图1C所示。已经发现,患者的葡萄糖传感器测量结果提供了对患者心脏健康和中风风险的准确评估,因此监测这些葡萄糖水平提供了对患者健康状况变化的改进指示,并降低了中风风险。
在一个示例中,医疗系统包括处理电路,该处理电路能够通信地耦合到葡萄糖传感器并且被配置为生成患者的连续葡萄糖传感器测量结果。该处理电路还被配置为:在至少一个时间段内从这些连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于这些连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件的风险的数据;并且基于该心血管事件的该风险生成输出数据。
在另一示例中,方法包括:在至少一个时间段内从患者的连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于该连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件的风险的数据;和基于该心血管事件的该风险生成输出。
在另一示例中,非暂时性计算机可读存储介质包括程序指令,当由医疗系统的处理电路执行时,该程序指令使医疗系统:在至少一个时间段内从患者的连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于这些连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件的风险的数据;以及基于该心血管事件的该风险生成输出。
本发明内容旨在提供对本公开中所描述的主题的概述。本发明内容并不旨在提供对以下附图和说明书内详细描述的系统、装置和方法的排他性或详尽解释。在附图和以下具体实施方式中阐述了本公开的一个或多个示例的进一步细节。根据说明书和附图以及权利要求,其他特征、目标和优点将是显而易见的。
附图说明
图1A示出根据本公开的一个或多个示例的结合患者的示例性医疗系统的示例性环境。
图1B示出了根据本公开的一个或多个示例的由图1A的示例性医疗系统使用的示例性医疗装置。
图1C示出根据本公开的一个或多个示例的结合患者的示例性医疗系统的另一示例性环境。
图1D示出了根据本公开的一个或多个示例,具有结合患者的电极延伸部的示例性医疗系统的另一示例性环境。
图2是示出根据本公开的一个或多个示例的图1的外部装置的示例性配置的功能框图。
图3是示出根据本公开的一个或多个示例的示例性系统的框图,该示例性系统包括接入点、网络、外部计算装置(诸如服务器)和一个或多个其他计算装置,该一个或多个其他计算装置可耦合到图1至图2的医疗装置和外部装置。
图4是示出包括光学传感器的示例性医疗装置的透视图的概念图。
图5是示出包括光学传感器的示例性医疗装置的局部横截面侧视图的概念图。
图6是示出根据本公开的一个或多个示例,使用葡萄糖传感器数据以使得能够准确检测患者健康状况变化的示例性操作的流程图。
图7是示出根据本公开的一个或多个示例,通过分析葡萄糖传感器测量结果来检测患者健康状况变化的示例性操作的流程图。
在说明书和附图中各处,类似参考字符代表类似元件。
具体实施方式
通常,根据本公开的医疗系统实现了用于基于包括患者葡萄糖水平的患者数据来检测患者患心血管事件的风险的技术。可收集患者数据的示例性医疗装置可包括可植入或可穿戴监测装置、起搏器/除颤器或心室辅助装置(VAD)。一种示例性技术包括预测特定心血管事件的风险水平以及该风险水平是否进一步指示住院治疗的风险。
该系统可包括一个或多个医疗装置,该一个或多个医疗装置可将患者数据传送到其他装置,诸如心脏监测服务的计算装置,并且那些装置可进一步分析患者数据,然后提供关于患者的活动和健康状况的报告。该报告可比较本文所述的技术的各种具体实施,例如,针对同一患者,比较由医疗装置或具有葡萄糖传感器的另一装置提供的相应的葡萄糖传感器测量值。
以这种方式,本公开的技术可有利地实现患者健康状况变化的检测的改进的准确度,并且因此实现对患者的状况的更好评估。
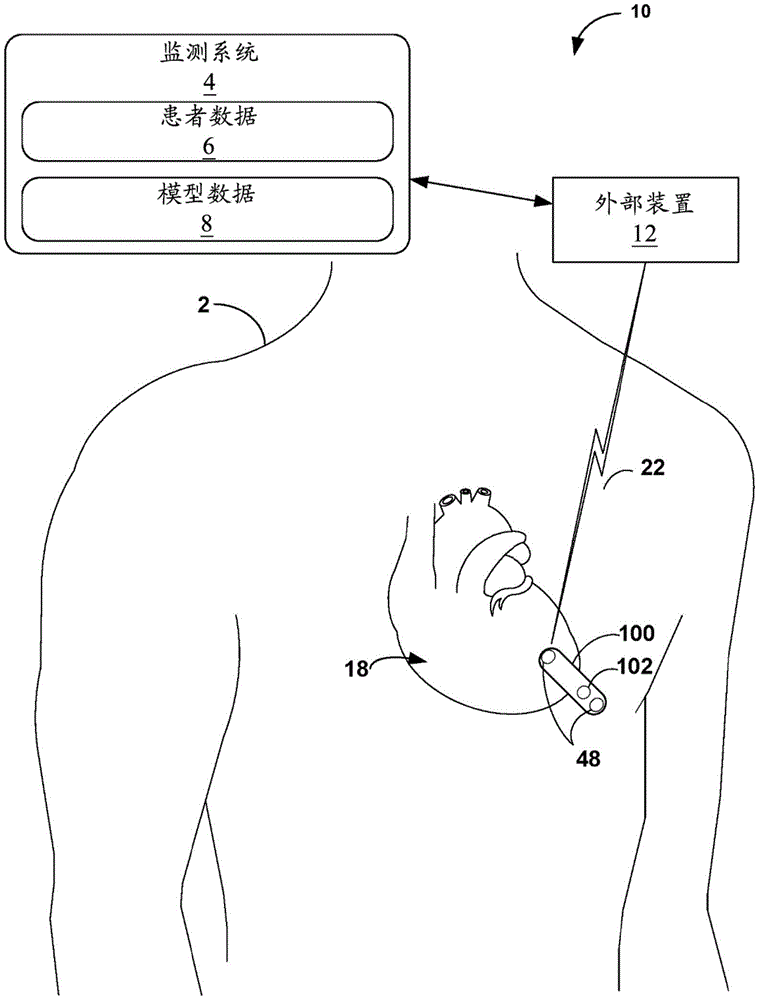
图1A是示出根据本公开中所描述的各种示例的与患者2结合的示例性医疗系统10的概念图。出于本描述的目的,假定对心血管解剖和功能的了解,并且省略细节,除非达到解释本公开的技术的上下文所必需或期望的程度。系统10包括医疗装置100,该医疗装置具有被植入在患者2的心脏18的部位处或其附近的光学传感器102和可选的外部计算装置12。
医疗装置100可与外部装置12和图1中未示出的其他装置中的至少一者进行无线通信。在一些示例中,医疗装置100被植入在患者2的胸腔的外部(例如,以皮下方式植入图1A所示的胸肌位置中)。在其他示例中,医疗装置100以皮下方式植入患者2的颅骨外部(例如,分别皮下植入用于医疗装置100A和100B的图1C和图1D所示的颅骨位置中)。医疗装置100可定位在靠近或刚好低于患者2的心脏水平的胸骨附近,例如至少部分地在心脏轮廓内。在一些示例中,医疗装置100包括多个电极48,并且被配置为经由多个电极48感测患者2的心脏的电活动。所感测的电活动在本文可被称为心电图(ECG)或心电图(EGM)。在一些示例中,医疗装置100采用LINQ
外部装置12可为具有用户界面的计算装置,诸如能够由用户查看的显示器和用于向外部装置12提供输入的界面(即,用户输入机构)。在一些示例中,外部装置12可为笔记本电脑、平板电脑、工作站、一个或多个服务器、智能电话、智能手表、智能注射笔(诸如例如,可从康盼宁医疗公司(Companion Medical,Inc.)和美敦力泌力美公司(MedtronicMiniMed,Inc.)获得的InPen
外部装置12可用于配置医疗装置100的操作参数。外部装置12可用于从医疗装置100检索数据。检索到的数据可以包括由医疗装置100测量的生理参数的值、由医疗装置100检测到的心律失常或其他疾病发作的迹象以及由医疗装置100记录的生理信号。例如,外部装置12可检索由医疗装置100记录的分析物浓度,例如,由于医疗装置100确定在该片段期间分析物浓度的变化超过预先确定的幅度或者超过预先确定的最大或最小分析物浓度阈值,或者响应于来自患者2或另一用户的记录该片段的请求。另外地或另选地,外部装置12可检索由医疗装置100记录的分析物浓度和心脏EGM片段,例如,由于医疗装置100确定在该片段期间发生心律失常或另一疾病的发作,或者响应于来自患者2或另一用户的记录该片段的请求。在一些示例中,一个或多个远程计算装置可以类似于外部装置12的方式与医疗装置100交互,例如以经由网络对医疗装置100进行编程和/或从医疗装置100检索数据,该网络诸如是可用于存储和处理数据以有益于患者和/或保健提供者的云计算网络,诸如例如,可从美敦力泌力美公司获得的CareLink
在各种示例中,医疗装置100可包括被配置为感测与患者2相关联的特定生理或神经参数的一个或多个附加传感器电路,或者可包括可相对于患者2和/或相对于彼此位于各种和/或不同位置处的多个传感器电路,并且可被配置为感测与患者2相关联的一个或多个生理参数。
例如,医疗装置100可包括能够操作以在医疗装置100的位置中或通过引线耦合到医疗装置100的温度传感器所定位的患者的位置处感测患者2的体温的传感器。在另一示例中,医疗装置100可包括被配置为感测诸如患者2所走的步数等运动和/或患者2的位置或姿势变化的传感器。在各种示例中,医疗装置100可包括被配置为检测患者2进行的呼吸的传感器。在各种示例中,医疗装置100可包括被配置为检测患者2的心跳的传感器。在各种示例中,医疗装置100可包括被配置为测量患者2的全身血压的传感器。
在一些示例中,医疗装置100的传感器中的一者或多者可植入患者2体内,即,植入在患者的至少皮肤水平以下。在一些示例中,医疗装置100的传感器中的一者或多者可位于患者2的体外,例如作为袖带的一部分或作为可穿戴装置,诸如嵌入患者2所穿戴的衣服中的装置。在各种示例中,医疗装置100可被配置为感测与患者2相关联的一个或多个生理参数,并且将对应于所感测的一个或多个生理参数的数据传输到外部装置12,如将医疗装置100耦合到外部装置12的闪电螺栓22所表示的。
在各种示例中,从医疗装置100到外部装置12的数据传输可经由无线传输来执行,例如使用上述用于无线通信的格式中的任一者。在各种示例中,医疗装置100可与非外部装置12或者除了其之外的外部装置(例如,一个或多个仪器)无线通信,诸如提供医疗装置100和网络之间的无线通信链路的收发器或接入点。由上文所述的装置中的任一者所使用的通信技术的示例可以包括射频(RF)遥测,该RF遥测可以是经由
在一些示例中,系统10可以包括比图1所示更多或更少的组件。例如,在一些示例中,系统10可包括植入患者2体内的多个附加可植入医疗装置(IMD),诸如可植入起搏器装置或其他IMD。在这些示例中,医疗装置100可以用作其他IMD的集线器装置。例如,附加IMD可被配置为与医疗装置100通信,该医疗装置然后将经由低能量遥测协议与外部装置12(诸如用户的智能电话)通信。
在系统10中,监测系统4是被配置为用机器学习计算服务来增强医疗装置100的功能的医疗系统的示例。在一些示例中,监测系统4利用医疗装置100的(连续)葡萄糖感测能力来生成患者2的葡萄糖传感器测量结果,然后使用机器学习模型来确定这些测量结果(以及在一些示例中的其他患者参数值)是否指示患者2的心血管事件的风险(例如,风险水平)。监测系统4可将这些(例如,连续)葡萄糖传感器测量结果与其他数据组合成患者数据6。作为替代方案,监测系统4可从另一个葡萄糖传感器接收葡萄糖传感器测量结果,诸如可穿戴心脏监测器中的葡萄糖传感器或独立于医疗装置100中的葡萄糖传感器的连续葡萄糖传感器(例如,连续葡萄糖监测(CGM)传感器)。
在一些示例中,患者数据6可包括由模型数据8中定义的机器学习模型使用的输入特征的数据集。监测系统4可存储模型的表示(例如,神经网络),使得逻辑可识别模型部件,包括预测算法、馈入预测算法的输入特征、以及由预测算法生成的输出类别。监测服务4在设计预测算法时可考虑许多可应用的机器学习概念;通常,预测算法执行将输入特征(X)映射到由一个或多个数学函数(例如,线性或非线性方程)和/或一个或多个统计(例如,先验概率或条件概率)定义的标签分布的标签的技术。
监测系统4可利用处理电路来执行上述逻辑并实例化机器学习计算服务。在一些示例中,监测服务4可在与医疗装置100通信的计算装置上运行机器学习计算服务,该计算装置诸如外部装置12或另一外部装置,诸如通过有线/无线连接耦合到医疗装置100的本地计算机或通过网络连接耦合到医疗装置100的远程服务器。应当注意,本公开可将葡萄糖监测器描述为包括葡萄糖传感器、心脏监测器或与葡萄糖监测器或心脏监测器中的至少一者通信的计算装置,并且葡萄糖监测器可参考医疗装置100、外部装置12、上述的其他外部装置或包括上述处理电路的任何其他计算装置。具体地,图1A、图1C和图1D示出了作为示例性心脏监测器的医疗装置100,其包括葡萄糖传感器(例如,功能部件)。应当注意,存在许多其他方式来组合葡萄糖感测和心脏监测。
响应于包括患者2的葡萄糖传感器测量结果的患者数据6,上述处理电路被配置为提取对应于至少一个时间段的至少一个特征。本公开设想了许多可能的特征,其中一些示例包括预定葡萄糖水平范围内的时间量(例如,范围时间)、低血糖事件的数量(例如,低血糖事件计数)、或高血糖事件的数量(例如,高血糖事件计数)中的一者或多者。预定葡萄糖水平范围内的时间量包括第一(例如,健康)葡萄糖范围或第二(例如,不健康)葡萄糖范围内的时间量。
其他可能的特征包括对应于连续葡萄糖传感器测量结果的各种统计度量中的一者或多者,诸如连续葡萄糖传感器测量结果的至少一个数据集的标准差、变异系数、平均值、中值、四分位距或最大变化率等。该至少一个数据集包括连续葡萄糖传感器测量结果的不同时间间隔。应当注意,存在许多其他可能的特征可输入到机器学习模型。举例来说,上述处理电路可被配置为提取至少一个葡萄糖传感器测量特征和至少一个心脏特征,以产生指示心血管事件风险的数据。心脏特征的示例对应于阻抗和/或心电图(EGM)度量,包括阻抗、恢复速率、夜间心率、心率变异性、活动或心房纤颤(AF)参数。
在一些示例中,模型数据8将机器学习模型定义为单变量回归分析的数学函数或贝叶斯信念网络的概率分布。在大多数(如果不是全部)示例中,模型数据8还使用不同的特征组合(例如,最多6个特征至8个特征)和不同的输出类别(例如,心血管事件的低、中、高证据状态/风险水平)来定义机器学习模型。在一个示例中,模型数据8使用以下特征来定义模型:过去7天内和过去30天内以及过去90天内在第一葡萄糖范围(例如,90-140,其可被称为“正常”或健康)中的时间量;过去7天内和过去30天内以及过去90天内的低血糖事件数量;过去7天内和过去30天内以及过去90天内处于低范围(<90)的时间;过去7天内和过去30天内以及过去90天内处于第二葡萄糖范围(大于或等于140,可被称为不健康)的时间量;过去7天内和过去30天内以及过去90天内的葡萄糖传感器测量结果的标准差;过去7天内和过去30天内以及过去90天内葡萄糖传感器测量结果的变异系数;过去7天内和过去30天内以及过去90天内的平均葡萄糖传感器测量结果;过去7天内和过去30天内以及过去90天内的中值葡萄糖传感器测量结果;过去7天内和过去30天内以及过去90天内的葡萄糖传感器测量结果的四分位距;以及过去7天内和过去30天内以及过去90天内葡萄糖传感器测量结果的平均和/或最大变化率。
通过训练机器学习模型,可确定用于评估上述特征的标准(例如,阈值)。根据经训练的机器学习模型的一个示例性具体实施,模型数据8可组合上述特征中的至少两者,使得如果过去30天内第一葡萄糖范围内的时间量的范围时间特征(例如,正常范围(90-140))小于40%,或者过去7天内的低血糖事件特征的数量小于1,或者过去30天内的第二葡萄糖范围(例如,高或不健康范围)中的时间量的范围时间特征大于80%,则该模型预测心血管事件的高风险水平。此外,如果不满足上述标准(例如,不是高风险),则模型数据8进一步定义以下标准:如果过去30天内测量结果的标准差大于阈值,或者过去30天内低血糖事件特征的数量大于1,或者过去30天内第二葡萄糖范围内的时间量的范围时间特征(例如,高或不健康范围)大于30%,或者过去30天内第一葡萄糖范围(例如,正常范围(90-140))内的时间量的范围时间特征小于60%,则患者2存在中等风险的心血管事件。如果上述标准都不满足,则模型预测患者2的低风险水平。
在一些示例中,模型数据8可指定用于预测心血管事件风险的上述特征的子集。基于各种度量,可就特征与患者2的心血管健康的相关性进行相互比较。响应于该比较,例如,如果特征未能提供足够的正交信息,则可从机器学习模型中移除一个或多个特征。例如,机器学习模型可配置有限制于以下6个参数的特征:过去30天内正常范围(90-140)内的时间、过去30天内低血糖事件的数量、过去7天内低血糖事件的数量、过去30天内高范围内的时间、过去30天内BG测量结果的标准差、过去7天内BG测量结果的最大变化率。这些特征的不同组合可定义患者2的血糖水平的低、中和高证据状态。
上述处理电路被配置为将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件风险的数据,并基于心血管事件的风险生成输出。如果应用基于分类器的模型,则模型数据8为每个输入特征存储一个或多个先验概率和一个或多个后验概率。先验概率可基于知识,诸如大数据语料库,然后进行近似或假设。后验概率可基于输入特征本身的一个或多个条件或观察。监测服务的上述处理电路计算测量基于分类器的模型与所提取的至少一个特征值的拟合优度的可能性。在一些示例中,上述处理电路生成具有未知值的多个特征的联合概率分布,并提出用于预测心血管事件风险的一个或多个标准。给定患者2的一组已知输入特征值,上述处理电路计算联合概率作为患者2的心血管事件风险的可能性,然后基于上述标准确定该联合概率是否满足。基于该确定,上述处理电路生成对应于患者2的心血管事件风险的输出数据—诸如风险水平和/或该风险水平是否进一步指示由于心血管事件引起的一些方面(例如,住院治疗的风险)—并且通过有线或无线连接将该输出数据传送到计算装置。
本公开可引用特定示例,但是这些示例不限制本文所述的机器学习模型或机器学习计算服务。本公开也不将心血管事件限于任何特定的示例,并且可包括影响在人体周围泵送和移动血液的人类心脏或血管(例如,患者2的循环系统)的任何状况;因此,如本文所定义的,心血管事件可为代表此类状况的通用术语。为了确定患者2的心血管事件风险而不依赖(例如,专门依赖)心脏生理信号(例如,心电图(EGM)、脑电图(EEG)和活动/加速度测量),本公开中描述的技术利用患者2的葡萄糖传感器测量结果。
如上所述,机器学习模型被配置为确定(例如,预测)患者2的心血管事件的风险水平。在一些示例中,上述处理电路生成指示患者2由于一些心血管事件(例如,包括任何心脏神经性事件,诸如缺血性或出血性中风)而住院治疗的风险的输出数据。当在外部装置12中实现时,上述处理电路可通过网络连接或直接连接向医疗装置100或另一医疗装置(例如,心脏监测器或葡萄糖监测器)传送指示上述住院治疗风险的输出数据。上述处理电路还可通过无线网络连接将输出数据传送到心脏监测服务,诸如监测服务4。在一些示例中,外部装置12生成指示患者2的心脏炎症、心力衰竭、心律失常或中风中的至少一者的风险的输出数据,并将其传送给医疗装置100或其他医疗装置。在其他示例中,外部装置12计算患者2的葡萄糖水平(例如,最近/当前测量结果或历史读数)引起上述心血管事件中的任何上述心血管事件的似然概率(例如,联合概率)。
在其中医疗装置100(或具有心脏监测器的另一装置)接收上述输出数据的一些示例中,该装置基于所接收的输出数据并进一步基于与阻抗或心脏EGM度量中的至少一者相对应的数据,生成指示心血管事件风险的第二输出数据。如本文所述,这些度量指定了阻抗、恢复速率、夜间心率、心率变异性、心脏活动或心房纤颤(AF)参数的标准(例如,阈值),并且指定标准的满足指示心血管事件的特定风险水平。
在一些示例中,外部装置12、医疗装置100(或上述心脏监测器)将第二机器学习模型应用于至少一个第二特征,以产生指示心血管事件风险的第二数据。第二特征的示例可包括心脏特征的上述示例中的任何上述示例。类似于监测服务4采用的机器学习模型,第二机器学习模型计算患者2的葡萄糖水平(例如,最近/当前测量结果或历史读数)是心血管事件风险背后的原因的似然概率。
如本文所述,监测服务4配置诸如外部装置12的计算装置来运行机器学习计算服务,以向患者2提供远程心脏监测,并且在一些示例中,为患者2定制计算服务(例如,患者2的心脏生理学或通常的生理学)。除了将机器学习模型应用于患者2的特征数据之外,监测服务4还配置定制计算服务以更新机器学习模型,使模型的预测算法个性化以适应患者的心脏活动和/或葡萄糖代谢。在一个示例中,当上述计算装置的处理电路应用(例如,当前版本的)机器学习模型时,处理电路计算患者的葡萄糖水平引起心血管事件的似然概率,然后使该似然概率包含在机器学习模型中,更新所述模型的当前版本。处理电路可以多种方式使该似然概率包含在模型中,诸如通过将似然概率包括在至少一个特征中,将似然概率包括为独立先验概率,或者调整心血管事件的至少一个先验概率中的至少一者。
图1B是示出包括光学传感器102的医疗装置100的示意性概念图的概念图。除了上述功能之外,医疗装置100被配置为光学地测量生物系统的样品流体101中的一种或多种分析物的浓度,诸如人类患者的葡萄糖的浓度。尽管描述为检测葡萄糖的浓度,但在其他示例中,医疗装置100可以被配置为测量其他分析物(诸如例如,钠、氯化物、钾、碳酸氢盐/二氧化碳、血尿素氮、肌酸酐、葡萄糖、脑钠肽、C-反应蛋白、肌钙蛋白I、乳酸盐、pH或左旋多巴中的一者或多者)的浓度。样品流体101可以包括但不限于血液、间质液、唾液、尿液、脊髓液、腹膜液或其他体液中的一者或多者。
医疗装置100包括光学传感器组件102(例如,光学传感器102)、处理电路104、天线106和外壳110。医疗装置100可以能够插入到生物系统中。例如,医疗装置100可能够经皮插入或植入人类患者的间质液或体腔中,或者以皮下方式插入或植入人类患者的头皮下或头盖骨上。在其他示例中,医疗装置100的第一部分可以插入到皮肤中,例如,暴露于或以其他方式流体耦合到患者的间质液,并且医疗装置的第二部分可以固定到患者或由患者佩戴,例如,作为皮肤佩戴贴片。以此方式,医疗装置100可以使得能够连续或接近连续监测生物系统中的一种或多种分析物浓度。
光学传感器102包括光源112、参考光学信标114和测试光学信标116。光学传感器102被配置为检测由荧光团响应于暴露于分析物而发射的荧光,并且产生指示分析物的浓度的信号。以皮下方式在头皮下或头盖骨上采集的光学信号在一段时间内提供了分析物浓度信息的稳定传输。
光源112包括被配置为发射具有选定的波长范围的辐射的一个或多个辐射源。例如,光源112可以包括一个或多个发光二极管(LED)或激光器。在一些示例中,光源112可以包括布置在LED芯片上的两个、三个、四个、五个或更多个LED。由光源112发射的辐射可以包括任何合适的波长或波长范围的辐射。在一些示例中,辐射可以包括在可见光范围内的波长,例如在从约380纳米(nm)至约740nm的范围内。
在一些示例中,光源112可以发射具有基于参考光学信标114和/或测试光学信标116的荧光团的吸光度而选择的波长范围的辐射。例如,荧光团的吸光度可以基本上在约480nm至约700nm的范围内。如本文所用,基本上在特定波长范围内的吸光度可以包括在该范围内相对于总吸收光谱的大于90%(诸如大于95%或大于约99%)的吸收百分比。在此类示例中,光源112可以具有基本上在从约480nm至约700nm范围内的发射光谱。如本文所用,基本上在特定波长范围内的发射光谱可以包括该范围内相对于总发射光谱的大于90%(诸如大于95%或大于约99%)的发射百分比。作为另一示例,荧光团可以具有小于约600nm(诸如约590nm)的最大吸收峰。在此类示例中,光源112可以具有约590nm的峰值发射波长。
在光源112包括具有大于约580nm的发射波长的一个或多个LED的示例中,光源112可以包括由小于约100毫安和/或在从约1.5伏特(V)至约2.5V(诸如从约1.9V至约2.2V)范围内的电压驱动的一个或多个LED。通过利用小于约2.5V和/或大于约580nm的发射波长在毫安范围内驱动光源112,光源112可以包括与被配置为发射具有小于约580nm的波长的光的LED相比不太复杂的电路。
辐射可以入射到参考光学信标114和测试光学信标116的相应荧光团上。响应于入射辐射,参考光学信标114和测试光学信标116的相应荧光团可以发荧光。相应荧光团可以包括任何合适的荧光团。荧光团的示例包括但不限于三(4,7-二苯基-1,10-菲咯啉)二氯化钌(Ru(dpp))、八乙基卟啉铂(II)(PtOEP)、八乙基卟啉钯(II)(PdOEP)、5,10,15,20-四-(2,3,4,5,6-五氟苯基)卟啉铂(II)(PtTFPP)、5,10,15,20-四-(2,3,4,5,6-五氟苯基)卟啉钯(II)(PdTFPP)、八乙基卟啉酮铂(II)(PtOEPK)、八乙基卟啉酮钯(II)(PdOEPK)、四苯基四苯并卟啉铂(II)(PtTPTBP)、四苯基四苯并卟啉钯(II)(PtTPTBP)、四苯基四萘卟啉铂(II)(PtPTPNP)或四苯基四萘卟啉钯(II)(PdPTPNP)。
在一些示例中,与被配置为与氧相互作用的其他荧光团相比,可以选择荧光团为具有相对更高的光发射效率、相对更高的亮度以及相对更长的发射时间常数。在一些示例中,可以选择荧光团为在约580nm或更长的波长处发荧光。在一些示例中,可以选择荧光团为在约600nm至约1100nm范围内具有发射波长和/或匹配硅光电检测器的峰值灵敏度范围。在一些示例中,可以选择荧光团为对于在体内长期使用而言是生物相容的和/或固有稳定的。参考光学信标114和测试光学信标116的相应荧光团可以具有相同的化学组成或不同的化学组成。
荧光团可以被配置为与存在于医疗装置100周围的样品流体101中的物质相互作用。在一些示例中,参考光学信标114和测试光学信标116的相应荧光团可以定位在医疗装置100的外壳110的外表面上。在其他示例中,外壳110可以包括一个或多个孔,该一个或多个孔将参考光学信标114和测试光学信标116的至少相应荧光团流体地耦合到样品流体101。以这些方式,参考光学信标114和测试光学信标116的相应荧光团可以与样品流体101接触。
在一些示例中,荧光团可以与存在于样品流体101中的氧相互作用。例如,相应荧光团的荧光可以被氧淬灭。换句话说,与接近相对较低氧浓度的参考光学信标114的荧光团的荧光相比,接近测试光学信标116的更高氧浓度可以使得测试光学信标116的荧光团发射更小强度的荧光。以此方式,参考光学信标114和测试光学信标116的荧光团的荧光可以用于确定接近每个相应荧光团的物质的浓度的变化。
例如,参考光学信标114可以用于调节样品流体101中的物质(诸如氧)的环境浓度,而测试光学信标116可以包括被配置为与选定的分析物反应以改变接近测试光学信标116的物质的浓度的附加化学物质。在一些示例中,除了荧光团之外,测试光学信标116包括试剂底物,该试剂底物被配置为与选定的分析物反应以改变接近测试光学信标116的物质的浓度。试剂底物可以包括一种或多种酶、催化剂、抗体、分子印迹聚合物、适配体或被配置为与分析物反应以调节选定的物质的浓度的其他材料。
在分析物包括葡萄糖的示例中,试剂底物可以包括葡萄糖氧化酶和过氧化氢酶。例如,葡萄糖氧化酶消耗氧(例如,该物质)以氧化存在于样品流体101中的葡萄糖,从而产生葡糖酸和过氧化氢(例如,副产物)。过氧化氢酶还原过氧化氢以产生水和氧(例如,该物质)。通过消耗过氧化氢,过氧化氢酶可以减少或防止过氧化氢对葡萄糖氧化酶的抑制。通过经由葡萄糖氧化酶消耗氧并经由过氧化氢酶产生氧,试剂底物被配置为调节指示葡萄糖的浓度的局部氧浓度。
在一些示例中,参考光学信标114和/或测试光学信标116可以包括设置在荧光团和/或试剂底物上的限制膜和/或选择性离子转移膜。膜可以能够选择性地透过分析物。例如,膜可以控制分析物从样品流体101到测试光学信标116的试剂底物的扩散速率。以此方式,膜可以例如通过控制试剂底物对分析物的暴露速率来控制分析物在试剂底物表面处的反应程度或反应速率。另外地或另选地,膜可以通过限制葡萄糖的渗透性来例如相对于样品流体101中的葡萄糖浓度扩展相应光学信标的线性范围。换句话说,相对于没有试剂底物的光学信标,膜可以防止试剂底物(例如,试剂底物的酶)在更大范围的葡萄糖浓度内饱和。以此方式,可以选择荧光团、试剂底物和/或膜的化学物质为特定于分析物,扩展相应光学信标的线性范围,和/或增加相应光学信标的可用寿命。
参考光学信标114和测试光学信标116各自包括在具有相应荧光团的视线中的相应感光器。参考光学信标114和测试光学信标116的相应光电检测器被配置为检测参考光学信标114和测试光学信标116中的每一者的荧光团的相应荧光的相应强度。尽管被描述为包括两个光电检测器,但是在一些示例中,光学传感器102可以包括单个光电检测器,参考光学信标114和测试光学信标116中的每一者被设置在单个光电检测器的一部分上。相应光电检测器可以包括任何合适的光电检测器。在一些示例中,光电检测器可以包括倒装芯片光电检测器。可以选择相应光电检测器来检测由参考光学信标114和测试光学信标116的相应荧光团发射的辐射的波长或波长范围。例如,响应于从光源112发射的入射在荧光团上的辐射,荧光团可以具有基本上在约700nm至约820nm范围内的发射光谱,和/或约760nm的最大发射峰。在此类示例中,光电检测器可以被配置为检测在从约380nm至约1100nm范围内(诸如在从约700nm至约820nm范围内)和/或具有在从约700nm至约820nm范围内的峰值检测灵敏度的辐射。在一些示例中,峰值检测灵敏度可以是光电检测器的固有性能,例如基于构造材料和/或物理配置。在一些示例中,光电检测器的检测范围或峰值检测灵敏度可以通过例如一个或多个滤波器(诸如带通滤波器、光吸收凝胶或膜或荧光团与相应光电检测器之间的其他离散滤波器)来调节。过滤可以例如使得光电检测器能够检测荧光团的荧光,同时基本上不检测由光源发射的光。
相应光电检测器可以将指示相应强度的信号传输到处理电路104。处理电路104可以包括各种类型的硬件,包括但不限于微处理器、控制器、数字信号处理器(DSP)、专用集成电路(ASIC)、现场可编程门阵列(FPGA)或等效分立或集成逻辑电路以及此类部件的组合。术语“处理电路”通常可以指代前述逻辑电路单独或与其它逻辑电路的组合或任何其它等效电路中的任何电路。在一些示例中,处理电路104可以表示和/或包括附加部件。处理电路104表示可以被配置为实施阐述本文所述的算法中的一者或多者的固件和/或软件的硬件。例如,处理电路104可以被配置为实施用于执行存储在一个或多个存储部件188(诸如信号识别模块196和/或信号分析模块198)内的处理指令的功能、处理指令或两者。
一个或多个存储部件188可以被配置为将信息存储在医疗装置100内。在一些示例中,一个或多个存储部件188包括计算机可读存储介质或计算机可读存储装置。在一些示例中,一个或多个存储部件188包括临时存储器,这意味着一个或多个存储部件188的主要目的不是长期存储。在一些示例中,一个或多个存储部件188包括易失性存储器,这意味着一个或多个存储部件188在不向一个或多个存储部件188提供电力时不维护存储内容。易失性存储器的示例包括随机存取存储器(RAM)、动态随机存取存储器(DRAM)、铁电随机存取存储器(FRAM)、静态随机存取存储器(SRAM)和本领域中已知的其他形式的易失性存储器。在一些示例中,一个或多个存储部件188用于存储供处理电路104执行的程序指令。在一些示例中,在处理电路104上运行的软件或应用程序使用一个或多个存储部件188,以在程序执行期间临时存储信息。
在一些示例中,一个或多个存储部件188可以被配置用于信息的长期存储。在一些示例中,一个或多个存储部件188可以包括非易失性存储元件。此类非易失性存储元件的示例包括闪存存储器或电可编程存储器(EPROM)或电可擦除可编程存储器(EEPROM)的形式。
处理电路104(例如,信号识别模块196)可以被配置为识别对应于相应光学信标的相应信号。例如,信号识别模块196可以包括多路复用器,该多路复用器被配置为在来自参考光学信标114和测试光学信标116的输入之间进行选择。在一些示例中,输入选择可以基于由光源112发射的光的定时。例如,响应于从光源112发射的第一光脉冲,处理电路104(例如,信号识别模块196)可以选择来自参考光学信标114的输入,该输入然后被输出到处理电路104和/或信号分析模块198以用于处理。响应于从光源112发射的在时间上与第一光脉冲分离的第二光脉冲,处理电路104(例如,信号识别模块196)可以选择来自测试光学信标116的输入,该输入然后被输出到处理电路104和/或信号分析模块198以用于处理。在一些示例中,第一光脉冲和第二光脉冲之间的持续时间可以大于1毫秒、大于10毫秒、大于100毫秒、大于一秒或更多。例如,第一光脉冲和第二光脉冲之间的持续时间可以是基于响应于第一光脉冲的相应荧光团的荧光持续时间的。
处理电路104(例如,经由信号分析模块198)可以被配置为处理所识别的信号以确定分析物的浓度。在一些示例中,信号分析模块198可以被耦合到一个或多个电容器,该一个或多个电容器被配置为从参考光学信标114或测试光学信标116的相应光电检测器来接收指示来自相应荧光团的荧光发射的相应数量的电能。处理电路104(例如,信号分析模块198)可以确定与参考光学信标114的荧光团的荧光衰减相关联的第一数量的电能和与测试光学信标116的荧光团的荧光衰减相关联的第二数量的电能之间的差。相应荧光团的荧光衰减可以包括响应于由光源112发射的入射光而由相应荧光团发射的基本上所有荧光,诸如相应荧光团的总荧光衰减的至少80%、至少90%、至少95%或至少99%。通过使用电容器来响应于相应荧光团的荧光衰减而存储来自相应光电检测器的电能,与其他方法(诸如相应荧光团的荧光的时间相关采样)相比,电能的数量可以更准确地表示荧光衰减。另外地或另选地,使用电容器来存储指示荧光衰减的电能可以相对于其他方法(诸如相应荧光团的荧光的时间相关采样)来简化电路设计。
信号识别模块196和信号分析模块198中的每一个可以以各种方式实施。例如,信号识别模块196和信号分析模块198中的一者或多者可以被实施为由处理电路104执行的应用程序或应用程序的一部分。在一些示例中,信号识别模块196和信号分析模块198中的一者或多者可以被实施为医疗装置100的硬件单元的一部分(例如,实施为电路)。在一些示例中,信号识别模块196和信号分析模块198中的一者或多者可在外部装置12上被远程实施为例如由外部装置12的一个或多个处理器执行的应用程序的一部分或被远程实施为外部装置12的硬件单元。由信号识别模块196和信号分析模块198中的一者或多者执行的功能在下文参考图8示出的示例性流程图进行解释。
处理电路104可以被配置为经由天线106与一个或多个外部装置24通信。例如,医疗装置100可以包括操作地耦合到处理电路104的通信电路190。通信电路可以被配置为发送和接收信号以使得能够经由天线106与外部装置12通信。通信电路190可以包括通信接口,诸如射频发射器和/或接收器、蜂窝发射器和/或接收器、
医疗装置100包括操作地耦合到处理电路104的天线106,以使得医疗装置100能够与外部装置12(图1A)通信,例如当完全在生物系统内操作时。在一些示例中,处理电路104可以使得通信电路190经由天线106传输指示分析物的所确定的浓度的数据,诸如经处理的数据、来自光学传感器184的未经处理的信号或两者。在一些示例中,外部装置12可以经由天线106连续地或周期性地询问或轮询通信电路190,以使得处理电路104接收、识别或处理来自光学传感器184的信号。通过仅当由外部装置12询问或轮询时接收、识别或处理来自光学传感器184的信号,处理电路可以节省电力或处理资源。在一些示例中,医疗装置100可被配置为使得能够长期、连续和/或基本上连续地监测生物系统中的分析物浓度。
医疗装置100包括外壳110,该外壳被配置为保护医疗装置100的部件免受生物系统的环境的影响。外壳110可被形成为将光学传感器102、处理电路104和/或天线106中的一者或多者的至少一部分与医疗装置100周围的环境分开。在一些示例中,外壳110可以包含涂覆或封装医疗装置100的部件的一种或多种生物相容性材料。医疗装置100的一个或多个部件(诸如光学传感器102的部分)可设置在外壳110外部,诸如例如,固定到外壳110的外表面或限定医疗装置100的外表面。作为一个示例,天线106可以固定到外壳110的外表面,以改善天线106的传输性能。外壳110可以包括任何合适的形状,诸如直线的或曲线的。在一些示例中,外壳110可以被成形成促进将医疗装置100插入到人类患者的体腔中。例如,外壳110可以包括待加载到插入工具中的圆柱形形状或包括圆角和边缘以减少对患者的刺激。
外壳110可以是任何合适的尺寸。在一些示例中,外壳110的高度可以介于大约1毫米(mm)与大约8mm之间,诸如大约4mm。在一些示例中,外壳110的宽度可以介于大约5mm与大约15mm之间,诸如大约7mm。在一些示例中,外壳182的长度可以介于大约20mm与大约60mm之间,诸如大约45mm。在一些示例中,医疗装置100的部件可以在外壳110内分层或堆叠,以与部件未分层或堆叠的装置相比减小医疗装置100的尺寸。
医疗装置100包括感测电路130,例如,根据从对患者生理参数进行编码的传感器接收的传感器信号来生成传感器数据。感测电路130和处理电路104可将传感器数据作为患者数据的一部分存储在存储部件188中。感测电路130可以经由切换电路选择性地耦合到电极,例如,以例如通过选择用于感测心脏EGM的电极和被称为感测向量的极性来感测患者的心脏的电信号,如由处理电路104所控制的。感测电路130可以感测来自电极16的信号,例如以产生内心电图(EGM),以便于监测心脏的电活动。感测电路130可监测来自传感器的信号,诸如运动传感器120,其可包括一个或多个加速度计;作为示例,其他传感器包括压力传感器和/或光学传感器。在一些示例中,感测电路130可包括一个或多个滤波器和放大器以用于对从电极和/或传感器接收到的信号进行滤波和放大。感测电路130可捕获来自传感器中的任何一个传感器的信号,例如以产生患者数据,以便于监测心脏的电活动和检测患者健康状况变化。
图1C是根据本公开的一种或多种技术的与患者2结合的示例性医疗系统10A的概念图。医疗系统10A的医疗装置100A可以皮下方式植入或插入人类患者的头皮下或头盖骨上。医疗系统10A可与图1A的医疗系统10基本上相似,其中医疗装置100可被植入或插入胸部区域。然而,医疗系统10A的医疗装置100A可被配置为植入在目标区域17中,该目标区域位于患者2的颈部的后部部分或颅底处。
在所展示的示例中,医疗系统10A的医疗装置100A包括承载三个电极16(在图1D中对该三个电极之一进行了标记)的外壳。尽管对于医疗系统10A的医疗装置100A示出了三个电极,但在其他示例中,医疗系统10A的医疗装置100A的外壳可承载两个或四个或更多个电极。如所展示的,医疗装置100A的外壳可限定其中心部分包含顶点的回旋镖或人字形形状,其侧向部分侧向向外并从中心部分延伸并且还相对于医疗装置100A的纵轴以向下角度延伸。在其他示例中,医疗装置100A的外壳可以其他形状形成,这些其他形状可通过由该外壳承载的不同电极之间的所期望的距离或角度确定。该外壳的构型可促进以可穿戴或绷带状形式或针对皮下植入放置在患者2的皮肤之上。因此,相对薄的壳体可以是有利的。另外地,在一些实施方案中,医疗装置100A的外壳可为柔性的,使得该外壳可至少部分地弯曲以与患者2的颈部的解剖学相对应(例如,其中医疗装置100A的外壳的左侧侧向部分和右侧侧向部分相对于医疗装置100A的外壳的中心部分向前弯曲)。
植入在患者2的上臂上的医疗装置102A可被配置为(例如,作为葡萄糖传感器)感测检测此区域中的血糖浓度或血糖浓度的变化以及本文所述的其他传感器信号。例如,医疗装置102A可包括一个或多个光学血细胞比容传感器并且可被配置为检测循环血量的变化。在其他示例中,医疗装置102A可被配置为感测来自患者2的其他区域的如本文所述的信号,这些其他区域可位于患者2的上臂之外。
图1D是根据本公开的一种或多种技术的与患者2结合的示例性医疗系统10B的概念图。医疗系统10B可与图1C的医疗系统10A基本上相似。然而,作为位于该医疗系统的外壳上的电极16的替代方案或除了这些电极之外,医疗系统10B的医疗装置100B还包括电极延伸部19(在图1D中对这些电极延伸部之一进行了标记),这些电极延伸部包括电极16。如图1D所展示的,医疗装置100B的电极延伸部19包括桨叶,使得一个或多个电极16分布在这些桨叶上。在一些示例中,医疗装置100B的电极延伸部19包括一个或多个环形电极。在一些示例中,医疗装置100B的电极延伸部19可经由接头引脚连接到医疗装置100C的外壳。在一些示例中,医疗装置100B的电极延伸部19可永久地附接到医疗装置100B的外壳。
在图1D的示例中,医疗装置102B植入在患者2的腹部上并且可被配置为感测检测此区域中的血糖浓度或血糖浓度的变化以及本文所述的其他传感器信号。例如,医疗装置102B可包括一个或多个光学血细胞比容传感器并且可被配置为检测循环血量的变化。在其他示例中,医疗装置102B可被配置为感测来自患者2的其他区域的如本文所述的信号,这些其他区域可位于患者2的腹部之外。
图2是示出外部装置12的部件的示例性配置的框图。在图2的示例中,外部装置12包括处理电路80、通信电路82、存储装置84和用户界面86。
处理电路80可包括一个或多个处理器,该一个或多个处理器被配置为实现用于在外部装置12内执行的功能和/或处理指令。例如,处理电路80可能够处理存储在存储装置84中的指令。处理电路80可包括例如微处理器、DSP、ASIC、FPGA或等效离散或集成逻辑电路或前述装置或电路中的任一个装置或电路的组合。因此,处理电路80可包括任何合适的结构,无论是硬件、软件、固件还是它们的任何组合,以执行本文中归于处理电路80的功能。
通信电路82可包括用于与诸如IMD 10的另一装置通信的任何合适的硬件、固件、软件或它们的任何组合。在处理电路80的控制下,通信电路82可从心脏监测器和/或葡萄糖监测器(诸如医疗装置100或另一装置)接收下行链路遥测,以及向该心脏监测器和/或葡萄糖监测器发送上行链路遥测。通信电路82可被配置为经由感应耦合、电磁耦合、NFC、RF通信、蓝牙、WiFi或其他专有或非专有无线通信方案来传输和/或接收信号。通信电路82还可被配置为经由多种形式的有线和/或无线通信和/或网络协议中的任一种与除医疗装置100之外的装置通信。
存储装置84可被配置为在操作期间将信息存储在外部装置12内。存储装置84可包括计算机可读存储介质或计算机可读存储装置。在一些示例中,存储装置84包括短期存储器或长期存储器中的一个或多个存储器。存储装置84可包括例如RAM、DRAM、SRAM、磁盘、光盘、闪存存储器或各种形式的EPROM或EEPROM。在一些示例中,存储装置84用于存储指示用于由处理电路80执行的指令的数据。存储装置84可由在外部装置12上运行的软件或应用程序用以在程序执行期间暂时存储信息。
在外部装置12和医疗装置100之间交换的数据可包括操作参数。外部装置12可传输包括计算机可读指令的数据,这些计算机可读指令在由医疗装置100实施时可控制医疗装置100改变一个或多个操作参数和/或导出收集到的数据。例如,处理电路80可向医疗装置100传输指令,该指令请求医疗装置100将收集到的数据导出到外部装置12。进而,外部装置12可从医疗装置100接收收集到的数据,并且将收集到的数据存储在存储装置84中。外部装置12从医疗装置100接收的数据可包括元数据(例如,时间戳、消息报头属性等)、控制数据(例如,操作参数)、包括生理参数的患者数据(例如,图1的患者数据6)、事件数据(例如,心脏EGM)、患者活动数据和其他患者信息。处理电路80可实现本文所述的技术中的任何技术来分析来自医疗装置100的数据,以确定本文所述的机器学习模型的输入特征值。输入特征值可基于原始数据(例如,诸如连续葡萄糖测量结果的传感器数据和诸如高血糖事件和低血糖事件的计数的事件数据)、经处理的数据(例如,诸如健康和不健康葡萄糖范围时间的度量值和诸如标准差的原始数据的统计数据)和任何其他基于一个或多个标准有助于确定患者是否正在经历健康状况变化(例如,心血管事件)的数据。
诸如临床医生或患者2等用户可通过用户界面86与外部装置12交互。用户界面86包括显示器(未示出),诸如液晶显示器(LCD)或发光二极管(LED)显示器或其他类型的屏幕,利用该显示器,处理电路80可呈现与医疗装置100相关的信息,例如机器学习模型的预测和与机器学习模型的预测相关的患者健康状况变化的指示,以及心脏事件和其他事件数据的检测(例如,初始检测),诸如心脏EGM(例如,心电图(ECG))波形。另外,用户界面86可包括被配置为接收来自用户的输入的输入机构。输入机构可包括例如按钮、小键盘(例如,字母数字小键盘)、外围定点装置、触摸屏或允许用户导航通过由外部装置12的处理电路80呈现的用户界面并且提供输入的另一输入机构中的任一者或多者。在其他示例中,用户界面86还包括用于向用户提供听觉通知、指令或其他声音,接收来自用户的语音命令或两者的音频电路。
图3是展示了根据本文所述的一种或多种技术的示例性系统的框图,该示例性系统包括接入点90、网络92、外部计算装置(诸如服务器94)以及一个或多个其他计算装置99A–99N(统称为“计算装置99”),该一个或多个其他计算装置可经由网络92与医疗装置100和外部装置12耦合。在该示例中,医疗装置100可使用通信电路54以经由第一无线连接与外部装置12进行通信,并且经由第二无线连接与接入点90进行通信。在图5的示例中,接入点90、外部装置12、服务器94和计算装置99相互连接,并且可通过网络92彼此通信。
接入点90可包括经由多种连接(诸如电话拨号、数字用户线(DSL)或电缆调制解调器连接)中的任何连接而连接到网络92的装置。在其他示例中,接入点90可通过不同形式的连接(包括有线连接或无线连接)耦合到网络92。在一些示例中,接入点90可为可与患者位于一处的用户装置,诸如平板电脑或智能电话。医疗装置100可被配置为向接入点90传输数据,诸如患者的原始或经处理的收集到的数据,以存储在存储装置96中(例如,作为图1A的患者数据6)。接入点90随后可经由网络92将检索到的数据传送到服务器94。如本文所述,此类患者数据的示例包括传感器测量结果(例如,葡萄糖传感器测量结果)、事件(例如,低血糖事件或高血糖事件)、度量值(例如,生理参数)、事件数据、心电图和/或患者2的健康状况变化的指示。
在一些情况下,服务器94可被配置为提供用于已经从医疗装置100和/或外部装置12收集到的数据的安全存储站点。在一些情况下,服务器94可经由计算装置99将数据汇编在网页或其他文档中以供诸如临床医生的受过训练的专业人员观看。图5的所示出的系统的一个或多个方面可用可与由美敦力
在一些示例中,计算装置99中的一个或多个计算装置可为与临床医生一起定位的平板电脑或其他智能装置,临床医生可通过该平板计算机或其他智能装置进行编程,从中接收警报和/或询问医疗装置100。例如,临床医生可通过计算装置99访问由医疗装置100收集到的数据,诸如上述患者数据和/或患者健康状况指示,诸如当患者2在临床医生访视之间时,以检查医疗状况的状态。在一些示例中,临床医生可诸如基于由IMD 10、外部装置12、服务器94或它们的任何组合而确定的患者状况的状态或基于临床医生已知的其他患者数据,将针对患者2的医疗干预的指令输入到由计算装置99执行的应用程序中。随后,装置99可向与患者2或患者2的看护者一起定位的计算装置99中的另一计算装置传输用于医疗干预的指令。例如,此类用于医疗干预的指令可以包括改变药物剂量、时序或选择的指令、安排临床医生访视的指令或寻求医疗关注的指令。在另外的示例中,计算装置99可基于患者2的医疗状况的状态而向患者2生成警告,这可使患者2能够在接收用于医疗干预的指令之前主动寻求医疗关注。以这种方式,患者2可根据需要自主采取行动来解决他或她的医疗状态,这可帮助改善患者2的临床结果。
在由图3示出的示例中,服务器94包括例如用于存储从IMD 10检索到的数据的存储装置96和处理电路98。尽管图5未示出,但是计算装置99可类似地包括存储装置和处理电路。处理电路98可包括一个或多个处理器,该一个或多个处理器被配置为实现用于在服务器94内执行的功能和/或处理指令。例如,处理电路98可能够处理存储在存储装置96中的指令。处理电路98可包括例如微处理器、DSP、ASIC、FPGA或等效离散或集成逻辑电路或前述装置或电路中的任一个装置或电路的组合。因此,处理电路98可包括任何合适的结构,无论是硬件、软件、固件还是它们的任何组合,以执行本文中归于处理电路98的功能。服务器94的处理电路98和/或计算装置99的处理电路可实现本文所述的技术中的任何技术,以分析从医疗装置100接收到的信息,例如,基于患者发生心血管事件的风险水平,确定患者的健康状态是否已经改变。
存储装置96可包括计算机可读存储介质或计算机可读存储装置。在一些示例中,存储装置96包括短期存储器或长期存储器中的一个或多个存储器。存储装置96可包括例如RAM、DRAM、SRAM、磁盘、光盘、闪存存储器或各种形式的EPROM或EEPROM。在一些示例中,存储装置96用于存储指示用于由处理电路98执行的指令的数据。
在一些示例中,医疗装置100的部件可以被布置为促进部件的操作。图4是示出包括光学传感器202的示例性医疗装置200的透视图的概念图。医疗装置200可以与上文参考图1所讨论的医疗装置100相同或基本上相似。例如,医疗装置200可包括光学传感器202(包括光源212、参考光学信标214和测试光学信标216、处理电路204、天线206、电源208和外壳210,其可与上文参考图1A和图1B中所示的医疗装置100所讨论的类似编号的特征部相同或基本上相似。尽管在图4中未示出,但是医疗装置200可包括电极,例如用于感测患者2的心脏EGM、阻抗和/或其他参数,如上文关于图1A和图1B所描述的。
如图4中所示,天线206设置在外壳210的外表面211上。在一些示例中,天线206可以包括衬底层和形成于衬底层上的金属化层。衬底层可以包括例如生物相容聚合物,诸如聚酰胺或聚酰亚胺、石英玻璃、硅、蓝宝石等。金属化层可以包括例如铝、铜、银或其它导电金属。天线206可以包含其他材料,诸如例如,陶瓷或其他介电材料(例如,如在介质谐振器天线中)。在一些示例中,天线206(例如,金属化层等)可直接形成在外壳210的外表面211上。
不管材料如何,天线206可以包含不透明材料或基本上不透明材料。例如,不透明(例如,或基本上不透明)材料可以阻挡选定波长的辐射的至少一部分(诸如,介于可见光的约75%与约100%之间)的透射。
在天线206包含不透明材料的示例中,光学传感器202的部件可以相对于天线206的部分布置,以减少或防止部件之间的光学干扰。例如,如图2中所示,光源212定位于天线206的外周上,而参考光学信标214和测试光学信标216定位于由天线206限定的孔内。以此方式,天线206可以限定不透明材料的光学边界,该光学边界减少或防止光从光源直接透射到参考光学信标214和测试光学信标216的相应光电检测器。相反,从光源212发射的光必须穿过医疗装置200外部的环境。以此方式,所发射的光可以仅入射在参考光学信标214的荧光团和测试光学信标216的荧光团和/或反应底物上。因此,由参考光学信标214和测试光学信标216的相应光电检测器产生的光学信号基本上仅由相应荧光团的荧光产生。基本上仅由相应荧光团的荧光产生可以排除环境辐射、由相邻荧光团发射的荧光或从光源212通过医疗装置200的部件(例如,基底)传输到相应光电检测器的光。
虽然在图2中未示出,但是在一些示例中,参考光学信标214和测试光学信标216可以设置在天线206的相对部分上。将参考光学信标214和测试光学信标216设置在天线206的相对部分上可以减少或防止参考光学信标214和测试光学信标216的相应荧光团发射的荧光被参考光学信标214和测试光学信标216中的另一者的相应光电检测器检测到。
另外地或另选地,医疗装置200可以包括可选的光学掩模218A和218B(统称为光学掩模218)。光学掩模218可以被配置为减少或防止辐射透射出医疗装置200的衬底或透射到医疗装置的衬底中。例如,如上文参考图1所讨论的,医疗装置200的衬底可以包含一种或多种透明(例如,或半透明)材料,诸如玻璃或蓝宝石。光学传感器202的部分(诸如光源212和/或参考光学信标214和测试光学信标216的相应光电检测器)可以相对于医疗装置200周围的环境设置在透明材料内(例如,下方)。
从光源112发射的光可以穿过透明材料行进到医疗装置200周围的环境中。在一些示例中,至少一部分光可以以引起该部分光的反射或全内反射的角度入射到透明材料上。另外地或另选地,在医疗装置200被植入患者体内的示例中,在医疗装置200周围的组织或生物材料可以引起光的漫散射。散射光的至少一部分可以以引起散射光的部分的全内反射的角度入射到透明材料上。光学掩模218可以设置在透明材料的内表面和/或外表面上,以减少或防止光的反射和/或全内反射。以此方式,光学掩模218可以减少或防止杂散光透射穿过透明衬底到达参考光学信标114和测试光学信标116的相应光电检测器。
可选的光学掩模218可以包含被配置为基本上吸收由光源212发射的辐射的材料。在一些示例中,光学掩模218可以包含氮化钛、柱状氮化钛、钛或适于吸收可由光源212发射的选定的波长的辐射的另一材料。
图5是示出包括光学传感器302的示例性医疗装置300的局部横截面侧视图的概念图。医疗装置300可以与上文参考图1至图2所讨论的医疗装置100或医疗装置200相同或基本上相似。例如,光学传感器302可以包括光源312A和312B(统称为光源312)、参考光学信标314、测试光学信标316和天线306,并且可以操作地耦合到处理电路和电源(未示出),并且可以封装在外壳310中,其可以与上文参考图1A、图1B和图2中所示的医疗装置100和/或医疗装置200所讨论的类似编号的特征部相同或基本上相似。
光学传感器302可以包括光源312、参考光学信标314和测试光学信标316的任何合适的布置。如图3中所示,医疗装置300包括限定表面321和322的衬底层320。在一些示例中,衬底层320可以包含蓝宝石、蓝宝石晶片、石英玻璃、玻璃晶片、硅、生物相容聚合物、聚酰胺、聚酰亚胺、液晶聚合物或介电材料。在一些示例中,表面321和/或322基本上是平面的。在其他示例中,表面321和/或322可以限定与特征部(诸如光源312、参考光学信标314和测试光学信标316的至少一部分、电迹线、通孔、光阻挡区域等)相对应的表面特征部(诸如脊部、凹处或孔)。表面321和/或322上或该表面中的表面特征部可以通过任何合适的方式形成,诸如例如,机械加工、激光蚀刻、化学蚀刻或半导体制造技术,诸如前段制程(FEOL)工艺。以此方式,可以形成衬底层320以支撑另外的层、促进医疗装置300的制造或两者。
光学掩模318可以设置在表面322的至少一部分上,或在一些示例中设置在表面321的一部分上。如上文参考图2所讨论的,光学掩模318被配置为减少或防止辐射透射出医疗装置200的衬底层320或透射到医疗装置的衬底层中。例如,光学掩模318可以吸收入射到光学掩模318上的辐射,诸如光线319。
互连层324可以设置在光学掩模318的表面326上。互连层324被配置为将光源312、参考光学信标314和测试光学信标316电耦合到医疗装置300的处理电路和/或电源。例如,光源312、参考光学信标314和测试光学信标316可以通过相应电迹线313A、313B、315和317电耦合到互连层324。
互连层324可以包含导电材料,诸如例如,铝、镉、铬、铜、金、镍、铂、钛、氮化铟、磷化铟、氧化锌、它们的合金等。在一些示例中,表面322可以通过例如化学气相沉积、物理气相沉积、热喷涂、冷喷涂等来金属化以形成互连层324。在一些示例中,互连层324可以形成多个电迹线,例如使用半导体制造技术(诸如后段制程(BEOL)工艺)形成的多个电迹线。相应电迹线或多个电迹线可以电耦合医疗装置300的一个或多个部件。
尽管示出为嵌入或部分嵌入在光学掩模318和互连层324中,但是在一些示例中,光源312、参考光学信标314和测试光学信标316的一个或多个部分可以形成在光学掩模318和/或互连层324的一部分上。例如,光源312可以定位在光学掩模318和/或互连层324的表面上并且电耦合到该表面,其中光学掩模318和互连层324可以限定将光源312光学耦合到衬底320的孔径。参考光学信标314和测试光学信标316中的每一者可以类似地定位在光学掩模318和/或互连层324的表面上。
在一些示例中,医疗装置300可以包括至少部分地延伸穿过衬底层320的一个或多个光学屏障330。例如,光学屏障330可以延伸穿过衬底层320的至少一部分。光学屏障330可以延伸仅穿过衬底层320的一部分,以使得衬底层320能够限定医疗装置300的内部和外部之间的气密密封。除了光学屏障330可以延伸到衬底层320中之外,光学屏障330可以与光学掩模318基本上相同或相似。例如,光学屏障330可以包含被配置为吸收透射通过衬底层320的辐射的至少一部分的材料。在一些示例中,辐射(诸如光线331)可以以导致辐射的全内反射的角度入射在荧光团324和衬底层320之间的界面上。通过在光学传感器302的部件之间定向光学屏障330,光学屏障可以显著减少或防止光线331到达测试光学信标316的光电检测器364。以此方式,可以在参考光学信标314和测试光学信标316之间设置一个或多个光屏障330,以减少或防止从参考光学信标314和测试光学信标316中的任一者发射的荧光到达参考光学信标314和测试光学信标316中的另一者。
在操作中,当例如通过LED 311A从光源312A发射光时,光(例如光线332)可以行进通过衬底层320的一部分并且可以入射在测试光学信标316上。当光例如由LED 311B从光源312B发射时,光可以行进通过衬底层320的一部分并且可以入射在测试光学信标314上。
参考光学信标314包括荧光团342和光电检测器344。由光源312B发射的辐射的至少一部分入射到荧光团342上。荧光团342吸收辐射的至少一部分,并且发射入射到光电检测器344上的荧光343。荧光团342暴露于医疗装置300周围的环境。在一些示例中,如上文所讨论的,响应于入射辐射的荧光团342的荧光343与存在于医疗装置300周围的环境中的物质的浓度相关联。例如,荧光343可以被猝灭(例如被减少),与接近荧光团342的氧浓度成比例。
测试光学信标316包括试剂底物360、荧光团362和光电检测器364。由光源312A发射的辐射(例如光线332)的至少一部分入射到荧光团362上。荧光团362吸收入射辐射的至少一部分,并且发射入射到光电检测器364上的荧光363。荧光团362暴露于试剂底物360。试剂底物360以及在一些示例中荧光团362的至少一部分暴露于医疗装置300周围的环境。尽管示出为不同的层,但是在一些示例中,试剂底物360和荧光团362可以限定单层,诸如由试剂底物360和荧光团362的均匀混合物、非均匀混合物或复合物组成的层。
如上文参考图1所讨论的,试剂底物360可以被配置为与存在于邻近环境中的分析物反应以调节与荧光团362相互作用的物质的浓度。在一些示例中,试剂底物360包括被配置为固定试剂的固定化底物。如上文所讨论的,试剂可以包含至少一种酶、催化剂或被配置为与分析物反应以产生物质的其他材料。在其中分析物包括葡萄糖并且物质包括氧的示例中,试剂可包括氧化酶,诸如葡萄糖氧化酶。在一些示例中,试剂可以通过例如物理截留(例如,相应试剂在物理上不能穿过固定化底物的孔)、化学键合(例如,离子键合、共价键合、范德华力(van der Waals forces)等)或它们的组合而固定在固定化底物上。在一些示例中,固定化底物可以包含聚合物,诸如聚赖氨酸、氨基硅烷、环氧硅烷或硝酸纤维素或具有三维晶格结构的底物,诸如水凝胶、有机凝胶或干凝胶。在一些示例中,固定化底物可以包含被配置成与相应试剂的至少一部分化学键合的配体。例如,包括戊二醛的固定化底物可以使葡萄糖氧化酶固定。包含伯胺缀合恩镰孢菌素的相应固定化底物可以固定(用于钠Na+检测)可以通过其固定到工作电极。在一些示例中,固定化底物可以包含但不限于戊二醛、基于硫醇的缀合化合物(例如,16-巯基十六烷酸(MHDA)、二乙基二硫代氨基甲酸(DSH)、二硫代双琥珀酰亚胺基十一烷酸酯(DSU)、嘌呤缀合化合物、链霉亲和素-生物素缀合化合物、伯胺和乙烯基吡啶聚合物、赖氨酸、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)偶联、基于琼脂糖的凝胶和聚合物混合物、硅烷交联剂、(羟乙基)甲基丙烯酸酯和聚(乙二醇)二丙烯酸酯聚合物。在一些示例中,固定化底物可以是透明的或半透明的以使得辐射(例如,光线332B)能够到达荧光团362。通过使试剂固定,固定化底物可以减少试剂对样品流体的损失。
在试剂底物360包括至少一种酶的示例中,可以基于待检测的分析物来选择至少一种酶。例如,该至少一种酶可以选自由葡萄糖氧化酶、乳酸氧化酶、过氧化氢酶或它们的混合物组成的组。在一些示例中,可以选择该至少一种酶以与所选分析物反应并且提供反应途径以使得能够检测所选分析物的浓度。例如,荧光343可以被猝灭(例如被减少),与接近荧光团342的氧浓度成比例。在试剂底物360包括葡萄糖氧化酶(例如,葡糖氧化酶(notatin))的示例中,葡萄糖氧化酶可以氧化样品流体中的葡萄糖以产生D-葡萄糖酸-δ-内酯和过氧化氢。过氧化氢可以被过氧化氢酶还原以产生氧。氧浓度的该调节可以指示样品流体中的葡萄糖浓度。在试剂底物360包括乳酸氧化酶的示例中,乳酸氧化酶可以氧化样品流体中的乳酸以产生丙酮酸盐和过氧化氢。过氧化氢可以被过氧化氢酶还原以产生氧。氧浓度的该调节可以指示样品流体中的乳酸浓度。
在一些示例中,参考光学信标314和/或测试光学信标316可以包括一个或多个可渗透膜370。膜370可以能够渗透至少分析物,并且在一些示例中,被配置为阻断干扰细胞体或分子结合或粘附到参考光学信标314和/或测试光学信标316的相应成分。例如,葡萄糖膜可以阻断大细胞体或分子,诸如红细胞、白细胞、醋氨酚、抗坏血酸等。膜370可以包括例如,一个或多个限制膜、一个或多个选择性离子转移膜、一个或多个离子载体膜或它们的组合。限制膜可以包含但不限于聚氨酯聚脲嵌段共聚物,包含材料混合物,例如六亚甲基、二异氰酸酯、氨基丙基封端的硅氧烷聚合物和聚乙二醇或与环氧基混合并涂覆有聚乙二醇的乙烯基吡啶-苯乙烯共聚物。选择性离子转移膜可以包括具有净正(或负)电荷的多孔材料,以使得具有相同电荷的离子能够渗透通过选择性离子转移膜,同时减少具有相反电荷的离子的渗透。选择性离子转移膜可以包括但不限于氨基甲基化聚苯乙烯水杨醛、二苯并-18-冠醚-6、色唑霉素、恩镰孢菌素、短杆菌肽A、拉沙里菌素、大环内酯类、莫能菌素、甲基盐霉素、尼日利亚菌素、尼日利亚菌素钠盐、无活菌素、聚酰亚胺/莱卡共混物、盐霉素、缬氨霉素或它们的混合物。离子载体膜可以包括分散在离子载体基质材料中的多个离子载体,其中多个离子载体可以被选择为能够优选渗透选定的离子或离子组。离子载体可以包括但不限于冠醚、穴状配体、杯芳烃(calixarenesm)、苯酚、氨基甲基化聚苯乙烯水杨醛、白僵菌素、卡西霉素(calcimycine)、色唑霉素、羰基氰化物间氯苯腙、二苯并-18-冠醚-6、恩镰孢菌素、短杆菌肽A、离子霉素、拉沙里菌素、大环内酯类、莫能菌素、尼日利亚菌素、尼日利亚菌素钠盐、甲基盐霉素、无活菌素、聚酰亚胺/莱卡共混物、盐霉素、替曲那新(tetronasin)、缬氨霉素、钾离子载体III(BME 44)或它们的混合物。离子载体基质材料可以包括但不限于聚氯乙烯、硅酮、氟硅酮、聚氨酯、戊二醛、UV可固化聚合物,如PVA-SbQ、PVA水凝胶、pHEMA-HAA交联和琼脂糖凝胶。以此方式,光学信标可以被配置为与选定的分析物或其衍生物反应,以产生对选定的分析物的存在的响应信号。
在一些示例中,膜370的一个或多个区域可以包含光吸收材料。例如,除了一个或多个上文所述的限制膜之外,膜370还可以包含被配置为至少部分地吸收入射在膜370上的辐射的光吸收材料、颜料或染料。在一些示例中,膜370的光吸收区域可以包括设置在光学信标314和316之间的膜370的一部分。以此方式,膜370可被配置为减少荧光团342和362之间的辐射的透射。另外地或可选地,膜370的光吸收区域可以包括膜370的整个体积或至少总表面面积。以此方式,膜370可以基本上阻挡入射在光学信标314和316上的环境光。
天线306可以设置在衬底层320的表面321上。在一些示例中,天线306可以限定不透明材料的光学边界,该光学边界减少或防止光在荧光团342和362之间和/或在荧光团342和光电检测器364之间和/或在荧光团362和光电检测器344之间透射。天线可以包含任何合适的材料,诸如例如,钛或钛箔。
电极层307可以设置在天线306上。电极层307可限定医疗装置300的导电表面,该导电表面被配置为检测人类患者体内的电信号,诸如例如,心脏EGM信号,以及进行阻抗测量,例如用于感测患者的灌注或呼吸。电极层307可以包含任何合适的材料,诸如例如,氮化钛。
图6是示出了根据本公开的一个或多个示例,用于确定患者健康状况变化或能够准确检测患者健康状况变化的示例性操作的流程图。在一些示例中,可实施示例性操作来确定患者是否最有可能已经或正在发生某种类型的心血管事件。如本文所述,机器学习模型被配置为基于特定输入特征是否满足一个或多个预测标准来呈现预测/检测,并且在一些情况下,确定医疗装置的初始检测是否为假。
下文参考图1A至图1B的系统10描述图6的步骤。根据图6的所展示的示例,外部装置12的处理电路80监测由具有葡萄糖传感器的心脏监测器或具有葡萄糖传感器的葡萄糖监测器提供的患者数据,并从存储连续葡萄糖传感器测量结果的此类患者数据中提取一个或多个特征(402)。如关于图1至图2更详细讨论的,处理电路80可从心脏监测器或葡萄糖监测器接收包括连续葡萄糖传感器测量结果的原始传感器消息和包括事件和度量值的经处理的数据。
如本文进一步讨论的,患者2的葡萄糖传感器测量结果提供了对患者2的心脏健康和他/她的心律失常和/或中风风险(例如,因其住院治疗)的准确评估;因此,监测该患者的葡萄糖水平提供了对患者健康状况变化的改进的指示,以及降低的中风风险。心脏监测器或葡萄糖监测器可经皮植入患者2的间质液或体腔中(如图1A所示),或以皮下方式植入患者2的头皮下或头盖骨上(如图1C和图1D所示)。如图1C和图1D所示,心脏监测器还可用作神经监测器,以便于监测附加生理信号(例如,心电图(EGM)、脑电图(EEG)和活动/加速度测量)。
在所展示的示例中,外部装置12的处理电路80将机器学习模型应用于特征值,并产生指示心血管事件风险的数据(404)。在图6的示例性操作中,注意到存在许多特征可作为输入(例如,变量)被编程到模型数据8中定义的机器学习模型的示例中:预定葡萄糖水平范围内的时间量(例如,范围时间)、低血糖事件的数量(例如,低血糖事件计数)、或高血糖事件的数量(例如,高血糖事件计数)、对应于连续葡萄糖传感器测量结果的统计度量、心脏特征等中的一者或多者。预定葡萄糖水平范围内的时间量包括第一(例如,健康)葡萄糖范围或第二(例如,不健康)葡萄糖范围内的时间量。上述统计度量的示例包括连续葡萄糖传感器测量结果的至少一个数据集的标准差、变异系数、平均值、中值、四分位距、最大变化率等。该至少一个数据集包括连续葡萄糖传感器测量结果的不同时间间隔。应当注意,存在许多其他可能的特征可输入到机器学习模型,诸如至少一个葡萄糖传感器测量特征和/或至少一个心脏特征,以产生指示心血管事件风险的数据。心脏特征的示例对应于阻抗和/或心脏EGM度量,包括阻抗、恢复速率、夜间心率、心率变异性、活动或心房纤颤(AF)参数。
外部装置12的处理电路80基于心血管事件的风险生成输出数据(406)。基于模型的预测,处理电路80生成对应于患者2的心血管风险水平和/或该风险水平是否进一步指示由心血管事件(例如,心脏炎症、心力衰竭或心律失常)和/或心脏神经性事件(例如,缺血性和/或出血性中风)引起的一些方面(例如,住院治疗的风险)的输出数据。外部装置12可包括电子显示器,用于可视地呈现输出数据(例如,在用户界面(UI)中)。在一些示例中,外部装置12生成指示患者2患心脏炎症、心力衰竭或心律失常中的至少一者的风险的输出数据,并将其传送给医疗装置100、另一医疗装置或另一个装置。接收输出数据的装置可呈现此类数据和/或使用输出数据来执行一些操作;例如,医疗装置100可使用心血管事件的风险水平来修改同一心血管事件或另一疾病的检测逻辑。如本文所述,医疗装置100可实现第二机器学习模型来预测心血管事件或糖尿病相关状况的发生。在另一示例中,医疗装置100可接收对医疗装置100的心血管事件的初始检测的确认或拒绝,并且使用所述确认或拒绝来改进当前检测逻辑。
在其他示例中,外部装置12计算患者2的葡萄糖水平(例如,最近/当前测量结果或历史读数)引起上述心血管事件中的任何上述心血管事件的似然概率(例如,联合概率)。外部装置12的处理电路80通过网络连接将所述输出数据传送到计算装置和/或将该输出数据返回给患者2的医疗装置。如本文所述,计算装置由诸如图1A的监测服务4的心脏监测服务和/或由患者2或患者2的临床医生操作。
外部装置12的处理电路80更新机器学习模型(408)。在一些示例中,外部装置12的处理电路80包含患者2的葡萄糖水平引起上述心血管事件中的任何上述心血管事件的上述联合概率。可假设联合概率是一个或多个心血管事件的先验。本文针对图7提供了关于基于输入特征预测一个或多个心血管事件的进一步细节,其包括在图6所示的示例性操作中。
图7是示出根据本公开的一个或多个示例,基于机器学习模型的评估来检测患者健康状况变化的示例性操作的流程图。根据图1至图6,监测服务4在外部装置12的处理电路80上运行计算服务,以确定给定患者当前是否处于心血管事件的风险中。
根据图7所展示的示例,外部装置12的处理电路80代表监测服务4操作用于患者2的计算服务,并基于从医疗装置100提供的各种数据中提取的输入特征值来检测患者2的心脏健康状况变化(500)。具体地,患者2的一些(如果不是全部)特征值对应于由医疗装置100或具有葡萄糖监测器和/或心脏监测器的另一装置生成的葡萄糖传感器测量结果。多个特征可被配置为由模型数据8定义的机器学习模型的输入特征:预定葡萄糖水平范围内的时间量(例如,范围时间)、低血糖事件的数量(例如,低血糖事件计数)、或高血糖事件的数量(例如,高血糖事件计数)、对应于连续葡萄糖传感器测量结果的统计度量、心脏特征等中的一者或多者。预定葡萄糖水平范围内的时间量包括第一(例如,健康)葡萄糖范围或第二(例如,不健康)葡萄糖范围内的时间量。上述统计度量的示例包括连续葡萄糖传感器测量结果的至少一个数据集的标准差、变异系数、平均值、中值、四分位距、最大变化率等。
在图7所展示的示例中,在计算作为预定葡萄糖水平范围内的时间量的范围时间和基于时间段内的此类事件的数量的高血糖事件计数之后,外部装置12的处理电路80将范围时间和高血糖事件计数与第一阈值和第二阈值进行比较(502)。第一阈值和第二阈值可通过训练机器学习模型来确定,以预测(一般地)患者和/或(具体地)患者2相对于本文所识别的心血管事件中的任何心血管事件所具有的风险水平。在一些示例中,在将上述特征值与第一阈值和第二阈值进行比较之后,外部装置12的处理电路80确定该比较是否满足任一阈值。基于满足第一阈值和第二阈值中的一者或两者的确定(502的是),外部装置12的处理电路80生成指示心血管事件的高风险的输出数据(504)。基于既不满足第一阈值也不满足第二阈值的确定(502的否),外部装置12的处理电路80计算在该时间段内生成的葡萄糖传感器测量结果的数据集的标准差。
在图7所展示的示例中,在计算该时间段内的标准差之后,外部装置12的处理电路80将该标准差与第三阈值进行比较(506)。类似于第一阈值和第二阈值,使用任何已知的学习算法训练机器学习模型可将第三阈值设置为患者2的葡萄糖传感器测量结果的标准差的最小或最大值。在一些示例中,在将上述特征值与第三阈值进行比较之后,外部装置12的处理电路80确定该比较是否满足该阈值。基于满足第三阈值的确定(506的是),外部装置12的处理电路80生成指示心血管事件的中等风险的输出数据(514)。基于不满足第三阈值的确定(506的否),外部装置12的处理电路80继续使用附加标准来评估患者2的输入特征值。
在图7所展示的示例中,外部装置12的处理电路80将高血糖事件计数与第四阈值进行比较(508)。在一些示例中,在将上述特征值与第四阈值进行比较之后,外部装置12的处理电路80确定该比较是否满足该阈值。基于满足第四阈值的确定(508的是),外部装置12的处理电路80生成指示心血管事件的中等风险的输出数据(514)。基于不满足第四阈值的确定(508的否),外部装置12的处理电路80继续使用附加标准来评估患者2的输入特征值。
在图7所展示的示例中,外部装置12的处理电路80将范围时间与第五阈值进行比较(510)。在一些示例中,在将上述范围时间与第五阈值进行比较之后,外部装置12的处理电路80确定该比较是否满足该阈值。基于满足第五阈值的确定(510的是),外部装置12的处理电路80生成指示心血管事件的中等风险的输出数据(514)。基于不满足第五阈值的确定(510的否),外部装置12的处理电路80继续计算一个或多个概率,每个概率指示患者2的葡萄糖水平测量结果具有心血管事件风险的可能性。
在图7所展示的示例中,在基于该时间段内的测量结果计算似然概率之后,外部装置12的处理电路80将似然概率与各种标准进行比较(512)。在一些示例中,在将似然概率与阈值概率和其他统计度量进行比较之后,外部装置12的处理电路80确定该比较是否满足各种标准。基于满足各种标准的确定(510的是),外部装置12的处理电路80生成指示心血管事件的中等风险的输出数据(514)。基于不满足各种标准的确定(508的否),外部装置12的处理电路80生成指示患者2的心血管事件的低风险的输出数据(516)。
图6和图7中所示出的操作顺序和流程是示例。在根据本公开的其它示例中,可考虑更多或更少阈值。进一步,在一些示例中,如由用户引导的,处理电路可例如经由外部装置12或计算装置99执行或不执行图6和图7的方法或本文所述的技术中的任何技术。例如,患者、临床医生或其他用户可打开或关闭用于(例如,使用Wi-Fi或蜂窝服务)或本地(例如,使用患者蜂窝电话上提供的应用程序或使用医疗装置编程器)识别患者健康状况变化的功能。
本公开中描述的技术可至少部分地以硬件、软件、固件或其任何组合的形式实现。例如,这些技术的各个方面可在一个或多个微处理器、DSP、ASIC、FPGA或任何其它等效的集成或离散逻辑QRS电路以及此类部件的任何组合中实现,此类组件体现在外部装置(诸如医师或患者编程器、模拟器或其它装置)中。术语“处理器”和“处理电路”通常可为指单独的或与其它逻辑电路组合的前述逻辑电路中的任何逻辑电路或单独的或与其它数字或模拟电路组合的任何其它等效电路。
对于以软件实现的各个方面,归因于本公开中描述的系统和装置的功能中的至少一些可体现为计算机可读存储介质上的指令,诸如RAM、FRAM、DRAM、SRAM、磁盘、光盘、闪存存储器或各种形式的EPROM或EEPROM。可以执行指令以支持本公开中所述的功能的一个或多个方面。
除此之外,在一些方面,本文所述的功能可以设置在专用硬件和/或软件模块内。将不同特征描述为模块或单元旨在突出不同的功能方面,并且不一定暗示此类模块或单元必须由单独的硬件或软件部件来实现。相反,与一个或多个模块或单元相关联的功能可由单独的硬件或软件部件执行,或者集成在公共或单独的硬件或软件部件内。另外,本技术可在一个或多个电路或逻辑元件中完全实施。本公开的技术可在各种装置或设备中实现,包括IMD、外部编程器、IMD和外部编程器的组合、集成电路(IC)或一组IC和/或驻留在IMD和/或外部编程器中的离散电路。
实施例1:一种方法,包括:在至少一个时间段内从患者的连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于这些连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件的风险的数据;以及基于该心血管事件的该风险生成输出。
实施例2:根据实施例1所述的方法,其中将该机器学习模型应用于所提取的至少一个特征以产生指示心血管事件的风险的数据包括:将该机器学习模型应用于所提取的至少一个特征,以产生指示心脏炎症、心力衰竭、心律失常或中风中的至少一者的风险的数据。
实施例3:根据实施例1或2所述的方法,其中将该机器学习模型应用于所提取的至少一个特征以产生指示心血管事件的风险的数据包括:将该机器学习模型应用于所提取的至少一个特征,以产生指示由该心血管事件导致的住院治疗的风险的数据。
实施例4:根据实施例1至3中任一项所述的方法,其中预定葡萄糖水平范围内的时间量包括对应于第一葡萄糖范围或第二葡萄糖范围内的连续葡萄糖传感器测量结果的一部分的时间量。
实施例5:根据实施例1至4中任一项所述的方法,其中该一个或多个统计度量包括这些连续葡萄糖传感器测量结果的至少一个数据集的标准差、变异系数、平均值、中值、四分位距或最大变化率中的至少一者,其中该至少一个数据集包括这些连续葡萄糖传感器测量结果的不同时间间隔。
实施例6:根据实施例1至5中任一项所述的方法,其中该应用机器学习模型包括确定该预定葡萄糖水平范围内的该时间量小于第一阈值或者该高血糖事件的数量大于第二阈值。
实施例7:根据实施例1至6中任一项所述的方法,其中应用该机器学习模型包括:确定该预定葡萄糖水平范围内的该时间量大于或等于第一阈值,这些高血糖事件的数量小于或等于第二阈值,以及这些连续葡萄糖传感器测量结果的数据集的标准差大于第三阈值、这些低血糖事件的数量大于第四阈值、或该预定葡萄糖水平范围内的该时间量大于第五阈值中的至少一者。
实施例8:根据实施例1至7中任一项所述的方法,其中应用该机器学习模型包括:计算该患者的葡萄糖水平引起该心血管事件的似然概率,其中通过将该似然概率包括在该至少一个特征中、将该似然概率包括为独立先验概率、或者调整该心血管事件的至少一个先验概率中的至少一者,使该似然概率包含在该机器学习模型中。
实施例9:根据实施例1至8中任一项所述的方法,其中该输出包括第一输出,并且其中生成该输出还包括基于该第一输出和对应于阻抗或心电图度量中的至少一者的数据生成指示该心血管事件的该风险的第二输出。
实施例10:根据实施例1至9中任一项所述的方法,其中提取至少一个特征还包括:从对应于阻抗或心电图度量中的至少一者的数据提取至少一个第二特征,其中该至少一个第二特征包括阻抗、恢复速率、夜间心率、心率变异性、活动或心房纤颤(AF)参数中的至少一者。
实施例11:一种方法,该方法包括在至少一个时间段内从患者的连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于这些连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心脏神经性事件的风险的数据;以及基于该心脏神经性事件的该风险生成输出。
实施例12:根据实施例11所述的方法,其中该心脏神经性事件包括缺血性中风或出血性中风中的至少一者。
实施例13:根据实施例11或12所述的方法,其中将该机器学习模型应用于所提取的至少一个特征以产生指示心血管事件的风险的数据包括:将该机器学习模型应用于所提取的至少一个特征,以产生指示由该心血管事件导致的住院治疗的风险的数据。
实施例14:一种医疗系统,该医疗系统包括:处理电路,该处理电路可通信地耦合到葡萄糖传感器,并且被配置为生成患者的连续葡萄糖传感器测量结果,其中该处理电路还被配置为:在至少一个时间段内从这些连续葡萄糖传感器测量结果提取至少一个特征,其中该至少一个特征包括以下中的一者或多者:预定葡萄糖水平范围内的时间量、低血糖事件的数量、高血糖事件的数量、或者对应于这些连续葡萄糖传感器测量结果的一个或多个统计度量;将机器学习模型应用于所提取的至少一个特征,以产生指示心血管事件的风险的数据;以及基于该心血管事件的该风险生成输出数据。
实施例15:根据实施例14所述的医疗系统,其中葡萄糖监测器、心脏监测器、神经监测器或计算装置中的一者或多者与包括该处理电路的该葡萄糖监测器或该心脏监测器中的至少一者通信。
实施例16:根据实施例14或15中任一项所述的医疗系统,其中该心脏监测器或该葡萄糖监测器包括该葡萄糖传感器,其中该心脏监测器或该神经监测器是可穿戴设备或植入物。
实施例17:根据实施例14至16中任一项所述的医疗系统,其中为了应用该机器学习模型,该处理电路被进一步配置为将该机器学习模型应用于所提取的至少一个特征,以产生指示心脏炎症、心力衰竭、心律失常或中风中的至少一者的风险的数据。
实施例18:根据实施例14至17中任一项所述的医疗系统,其中为了应用该机器学习模型,该处理电路被配置为:计算该患者的葡萄糖水平引起该心血管事件的似然概率;以及通过将该似然概率包括在该至少一个特征中、将该似然概率包括为独立先验概率、或者调整该心血管事件的至少一个先验概率中的至少一者,使该似然概率包含在该机器学习模型中。
实施例19:根据实施例14至18中任一项所述的医疗系统,其中为了应用该机器学习模型,该处理电路被配置为将该机器学习模型应用于所提取的至少一个特征,以产生指示由该心血管事件导致的住院治疗的风险的数据。
实施例20:根据实施例14至19中任一项所述的医疗系统,其中预定葡萄糖水平范围内的时间量包括对应于第一葡萄糖范围或第二葡萄糖范围内的连续葡萄糖传感器测量结果的一部分的时间量,其中该一个或多个统计度量包括该连续葡萄糖传感器测量结果的至少一个数据集的标准差、变异系数、平均值、中值、四分位距或最大变化率中的至少一者,其中该至少一个数据集包括该连续葡萄糖传感器测量结果的不同时间间隔。
实施例21:根据实施例14至20中任一项所述的医疗系统,其中为了应用该机器学习模型,该处理电路被配置为确定该预定葡萄糖水平范围内的该时间量小于第一阈值或者该高血糖事件的数量大于第二阈值。
实施例22:根据实施例14至21中任一项所述的医疗系统,其中为了应用该机器学习模型,该处理电路被配置为:确定该预定葡萄糖水平范围内的该时间量大于或等于第一阈值,该高血糖事件的数量小于或等于第二阈值,以及该连续葡萄糖传感器测量结果的数据集的标准差大于第三阈值、该低血糖事件的数量大于第四阈值、或该预定葡萄糖水平范围内的该时间量大于第五阈值中的至少一者。
实施例23:根据实施例14至22中任一项所述的医疗系统,其中该输出数据包括第一输出数据,并且其中为了生成该输出数据,该处理电路被配置为:基于该第一输出数据和对应于阻抗或心电图度量中的至少一者的数据生成指示该心血管事件的该风险的第二输出数据。
实施例24:根据实施例14至23中任一项所述的医疗系统,其中该至少一个特征包括至少一个第一特征,并且其中为了提取该至少一个特征,该处理电路被配置为:从对应于阻抗或心电图度量中的至少一者的数据提取至少一个第二特征,其中该至少一个第二特征包括阻抗、恢复速率、夜间心率、心率变异性、活动或心房纤颤(AF)参数中的至少一者。
- 用于生产由注射模制的塑料材料制成的中空物品的方法和装置
- 生产模制件的方法和模制件
- 由玻璃纤维材料和/或矿物纤维材料制造模制件的方法,可由此获得的模制件和用于此的生产单元
- 适于在注射模制期间对泄漏进行检测的方法和注射模制歧管
- 从可用于模制金属合金的注射模制系统的热流道的歧管向板转移力
