一种产乳酰-N-二岩藻六糖II的工程大肠杆菌的构建方法及应用
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及一种产乳酰-N-二岩藻六糖II的工程大肠杆菌的构建方法及应用,属于微生物代谢工程技术领域。
背景技术
母乳低聚糖(Human Milk Oligosaccharides,HMOs)作为母乳中除了乳糖和脂质外的第三大固体营养成分,它们为婴幼儿健康成长提供了不可替代的益处。相关研究表明母乳低聚糖在肠道健康如抗菌作用、肠道屏障等方面发挥了独特作用。乳糖-N-二岩藻六糖II(Lacto-N-difucohexaose II,LNDFH II)是岩藻糖基化的人乳寡糖之一,可以通过各种纯化步骤直接从母乳中分离出来,但产量相对较低;也可以通过化学酶和细胞工厂合成,但需要添加昂贵的GDP-岩藻糖和酶,从而增加生产成本。
微生物合成复杂和支链HMO报道较少。2015年,
但是,现有的LNDFH II产量仍有待进一步提升以满足工业化生产需求。
发明内容
为了解决现有技术存在的不足,本发明提供了一株重组菌株,该菌株以甘油为碳源,以乳糖为底物,高效合成乳糖-N-二岩藻六糖II(LNDFH II)。
本发明提供的第一个目的是提供一株基因工程菌,所述基因工程菌以大肠杆菌ENP4L2为出发菌株,表达了α1,3/4-岩藻糖基转移酶fucT14,甘露糖1-鸟苷酸转移酶manC,磷酸甘露糖酶manB,GDP-D-甘露糖-4,6-脱水酶gmd,GDP-岩藻糖合成酶wcaG,β-1,3-半乳糖基转移酶wbgO和α1,3-岩藻糖转移酶;
所述大肠杆菌ENP4L2公开于文献Engineering Escherichia coli for high-level production of lacto-N-fucopentaose I by stepwise de novo pathwayconstruction中。所述大肠杆菌ENP4L2以大肠杆菌BL21(DE3)为出发菌株,敲除了β-半乳糖苷酶基因lacZ、二磷酸尿核苷葡萄糖脱氢酶基因ugD、UDP-N-乙酰葡萄糖胺-2-差向异构酶基因wecB以及葡萄糖胺-6磷酸脱氨酶基因nagB;并在大肠杆菌的基因组上的recA位点整合了来源于大肠杆菌K-12衍生菌MG1655的UDP-葡萄糖4差向异构酶基因galE,同时在大肠杆菌的基因组上的IS186-1、IS186-2、IS186-4、IS186-5位点分别整合了来源于脑膜炎奈瑟菌的编码β-1,3-乙酰葡萄糖胺转移酶的基因lgtA。
在一种实施方式中,编码所述甘露糖1-鸟苷酸转移酶manC,磷酸甘露糖酶manB,GDP-D-甘露糖-4,6-脱水酶gmd,GDP-岩藻糖合成酶wcaG的基因的序列公开于专利CN112342176A中。
在一种实施方式中,所述α1,3/4-岩藻糖基转移酶fucT14的氨基酸序列如SEQ IDNo.1所示。
在一种实施方式中,所述β-1,3-半乳糖基转移酶wbgO的氨基酸序列如SEQ IDNo.2所示。
在一种实施方式中,所述α1,3-岩藻糖转移酶选自以下一种或多种:FucT3、Bf13FT、FutA、FutB、FucU、FutM1、FutM2、HpFucT、M32;
所述α1,3-岩藻糖转移酶FucT3来源于幽门螺杆菌(Helicobacter pylori)NCTC11637,其氨基酸序列的NCBI登录号为AAB93985.1,编码所述α1,3-岩藻糖转移酶FucT3的基因的核苷酸序列如SEQ ID No.3所示;
所述α1,3-岩藻糖转移酶Bf13FT来源于脆弱类杆菌(Bacteroides fragilis)NCTC9343,其氨基酸序列的NCBI登录号为CAH09151.1,编码所述α1,3-岩藻糖转移酶Bf13FT的基因的核苷酸序列如SEQ ID No.4所示;
所述α1,3-岩藻糖转移酶FutA、FutB来源于幽门螺杆菌(Helicobacter pylori)26695,其氨基酸序列的NCBI登录号分别为AAD07447.1、AAD07710.1,编码所述α1,3-岩藻糖转移酶FutA、FutB的基因的核苷酸序列分别如SEQ ID No.5、SEQ ID No.6所示;
所述α1,3-岩藻糖转移酶FucU来源于幽门螺杆菌(Helicobacter pylori)J99,其氨基酸序列的NCBI登录号为AAD06573.1,编码所述α1,3-岩藻糖转移酶FucU的基因的核苷酸序列如SEQ ID No.7所示;
所述α1,3-岩藻糖转移酶FutM1来源于拟杆菌科细菌(Bacteroidaceaebacterium),其氨基酸序列的NCBI登录号为MBO5664686.1,编码所述α1,3-岩藻糖转移酶FutM1的基因的核苷酸序列如SEQ ID No.8所示;
所述α1,3-岩藻糖转移酶FutM2来源于鸡拟杆菌(Bacteroides gallinaceum),其氨基酸序列的NCBI登录号为WP_204430034.1,编码所述α1,3-岩藻糖转移酶FutM2的基因的核苷酸序列如SEQ ID No.9所示;
所述α1,3-岩藻糖转移酶HpFucT来源于幽门螺杆菌(Helicobacter pylori)NCTC11639,其氨基酸序列的NCBI登录号为AAB81031.1,编码所述α1,3-岩藻糖转移酶HpFucT的基因的核苷酸序列如SEQ ID No.10所示;
所述α1,3-岩藻糖转移酶M32为:以所述α1,3-岩藻糖转移酶HpFucT为亲本,将亲本的第45位丝氨酸突变为苯丙氨酸,第127位天冬氨酸突变为天冬酰胺,第128位精氨酸突变为谷氨酸,第131位组氨酸突变为异亮氨酸,第199位酪氨酸突变为天冬酰胺,第340位天冬酰胺突变为天冬氨酸,第368位缬氨酸突变为丙氨酸,其氨基酸序列如SEQ ID No.12所示,编码所述α1,3-岩藻糖转移酶M32的基因的核苷酸序列如SEQ ID No.11所示。
在一种实施方式中,以质粒pRSFDuet-1为载体表达所述甘露糖1-鸟苷酸转移酶manC,磷酸甘露糖酶manB、GDP-D-甘露糖-4,6-脱水酶gmd和GDP-岩藻糖合成酶wcaG;以质粒pCDFDuet 1为载体表达所述β-1,3-半乳糖基转移酶wbgO和α1,3-岩藻糖转移酶;以质粒pETDuet-1为载体表达所述α1,3/4-岩藻糖基转移酶fucT14。
本发明还提供了一种生产乳糖-N-二岩藻六糖II(LNDFH II)的方法,所述方法包括以所述基因工程菌发酵生产LNDFH II。
在一种实施方式中,所述方法包括:将所述基因工程菌接种至发酵培养基,待菌株生长至OD
在一种实施方式中,所述方法包括:将所述的基因工程菌接种至发酵培养基,待菌株生长至OD
在一种实施方式中,所述发酵培养基中含有甘油,所述甘油的含量为20-30g/L。
在一种实施方式中,所述IPTG的浓度为0.1-1mM。
在一种实施方式中,所述底物中乳糖的含量为3-10g/L。
在一种实施方式中,所述生产的温度为25℃。
在一种实施方式中,所述生产的时间为不低于60h,或不低于72h。
本发明还提供了上述基因工程菌或上述方法在食品领域中的应用。
在一种实施方式中,所述应用为将所述基因工程菌或所述方法用于生产LNDFH II或含有LNDFH II的产品。
本发明的有益效果:
本发明构建得到的生产LNDFH II的基因工程菌EWL01,其摇瓶LNDFH II产量可达到2.441g/L。通过进一步筛选不同来源的α1,3-岩藻糖基转移酶,成功构建了多株高效生产LNDFH II的工程大肠杆菌,其中,α1,3-岩藻糖基转移酶FutM1的共表达菌株EWL07的摇瓶LNDFH II产量可达到3.011g/L,进一步通过罐上发酵,控制甘油和乳糖含量为5g/L,在发酵时间为60h时,最高LNDFH II产量达到了18.062g/L。本发明所述菌株为进一步合成其他复杂母乳低聚糖奠定了基础,具有良好的工业前景。
附图说明
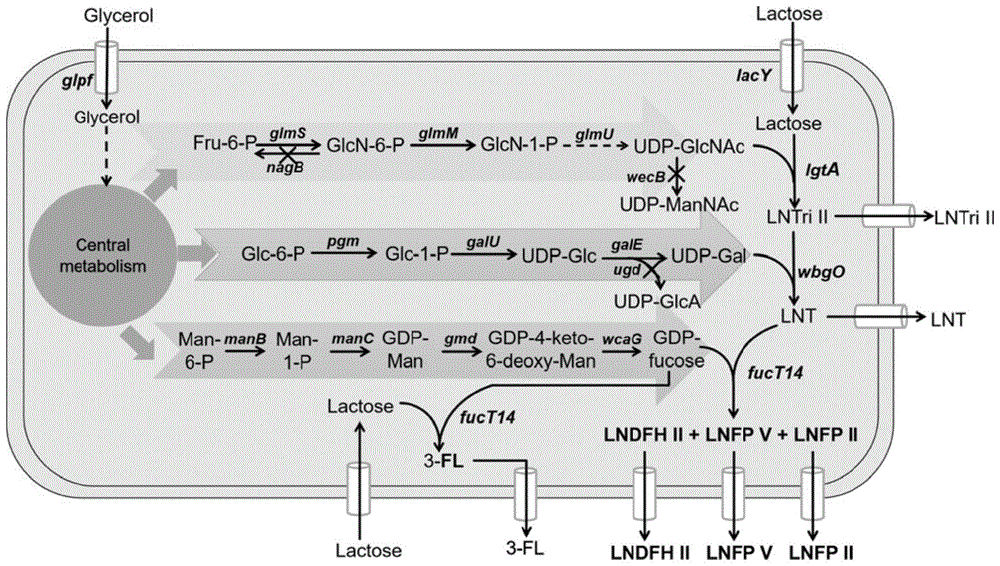
图1为工程大肠杆菌生物合成LNDFH II代谢通路图。
图2发酵优化图,其中(A)为诱导剂浓度优化,(B)为诱导温度优化。
具体实施方式
下面通过具体实施例子对本发明进一步阐述。
本发明所有使用的PCR扩增酶、质粒、DNA凝胶回收试剂盒和柱式质粒抽提盒等商业化产品,具体操作均按照试剂盒说明书进行。大肠杆菌感受态制备:TAKARA试剂盒;核酸琼脂糖凝胶电泳、水浴热激转化、感受态细胞制备、菌落PCR和细菌基因组抽提等常规分子生物学实验操作根据Molecular Cloing:A Laboratory Manua(Fourth Edition)进行。
下述构建质粒和PCR扩增产物的测序工作均由苏州安升达公司完成。
下述实施例中所涉及的培养基如下:
LB固体培养基:10g/L蛋白胨,10g/L氯化钠,5g/L酵母提取物,15g/L琼脂粉。
LB液体培养基:10g/L氯化钠,5g/L酵母提取物,10g/L蛋白胨。
发酵培养基(Defined medium,DM):20g/L甘油,1.7g/L柠檬酸,13.5g/L磷酸二氢钾,1.4g/L七水硫酸镁,4.0g/L磷酸氢二氨和10ml/L微量金属元素,再用氢氧化钠调节pH至6.8。
微量金属元素:2.25g/L七水硫酸锌,10g/L硫酸亚铁,0.35g/L一水硫酸锰,1.0g/L无水硫酸铜,0.23g/L十水硼酸钠,2.0g/L二水氯化钙,0.11g/L钼酸铵,溶于5M盐酸。
抗生素的工作浓度:卡那霉素(50mg/L),链霉素(50mg/L),氨苄青霉素(200mg/L,固体培养基),氨苄青霉素(100mg/L,液体培养基)。
下述实施例中所涉及的检测方法如下:
LNDFH II的产量检测
将所取发酵液,以12000g的离心速度离心10分钟,再将上清液稀释一定倍数,后通过0.22μm水系针筒式过滤器,将样品用高压离子色谱进行检测,采用CarboPac PA10色谱柱(4mm×250mm)测定LNDFH II、LNFP II、LNFP V、3-FL、LNT、LNTri II和乳糖的浓度。梯度洗脱采用三种溶液:洗脱液A:超纯水;洗脱液B:1M醋酸钠;洗脱液C:250mmol/L NaOH;以1.0mL/min的流速线性梯度洗脱。
下述实施例中所涉及的引物序列如表1所示。
表1:引物序列信息
下述实施例中所涉及的PCR反应体系如表2所示。
表2:PCR体系
PCR反应体系条件:95℃预变性3min;95℃变性30s,56℃退火30s,72℃延伸2kb/min;32个循环,4℃保存,PCR产物进行胶回收。
下述实施例中所涉及的吉布森组装反应体系如表3所示。
表3:吉布森组装反应体系
吉布森组装反应条件:50℃,30min。
X/Y根据公式计算可得到线性化载体用量和插入片段的用量:
X=(0.02×克隆载体碱基对数/胶回收对应DNA片段浓度)ng;
Y=(0.02×插入片段碱基对数/胶回收对应DNA片段浓度)ng;
实施例1:重组菌EWL01的构建及发酵生产LNDFH II
具体步骤如下:
1、pET-FucT14质粒构建:
以SEQ ID No.1所示的氨基酸序列出发,通过Azenta GENEWIZ(Suzhou,China)公司密码子优化并合成编码α1,3/4-岩藻糖基转移酶fucT14的基因,并将其插入至质粒pETDuet-1第2克隆位点NdeI处,得到pET-FucT14质粒。
2、重组菌EWL01构建
将pCD-wbgO(公开于专利CN116355819A)、pRSF-CBGW(公开于专利CN112342176A,公开专利中名称为pRSF-BCGW)和pET-FucT14质粒导入菌株ENP4L2(公开于文献Engineering Escherichia coli for high-level production of lacto-N-fucopentaose I by stepwise de novo pathway construction),经测序验证后,得到菌株EWL01。
3、发酵生产LNDFH II
将菌株EWL01挑取至含有4mL LB的试管中,在37℃和200rpm摇床条件下,进行培养10-12h,制备得到种子液;
将上述种子液以2%(v/v)的接种量接种至含有20mL DM培养基的250mL三角瓶中,在37℃和200rpm摇床条件下进行培养,当菌体密度OD
结果显示,菌株EWL01的72h LNDFH II的产量为2.411g/L。
实施例2:基因工程菌EWL02、EWL03、EWL04、EWL05、EWL06、EWL07、EWL08、EWL09和EWL10的构建及发酵生产LNDFH II
具体步骤如下:
1、基因工程菌EWL02、EWL03、EWL04、EWL05、EWL06、EWL07、EWL08、EWL09和EWL10的构建
(1)重组质粒的构建
利用引物pCD-wbgO-F/R,对模板质粒pCD-wbgO进行PCR扩增后;以SEQ ID No.3所示的编码α1,3-岩藻糖基转移酶Fut3的基因的核苷酸片段为模板,以表1所示引物,对α1,3-岩藻糖基转移酶基因fucT3进行PCR扩增,对上述PCR片段回收、纯化,以上述按表3组装体系进行吉布森组装反应,涂布至对应抗性的LB平板37℃过夜培养,后挑取单菌落并抽质粒进行Sanger测序,测序验证正确,即得到重组质粒pCD-wbgO-fucT3。
质粒pCD-wbgO-Bf13FT,pCD-wbgO-futA,pCD-wbgO-futB,pCD-wbgO-fucU,pCD-wbgO-futM1,pCD-wbgO-futM2,pCD-wbgO-HpfucT和pCD-wbgO-M32的构建方法同上,区别在于,将模板替换为SEQ ID No.3-SEQ ID No.11相应的编码α1,3-的岩藻糖基转移酶的基因序列,引物替换为表1中对应引物。
(2)基因工程菌EWL02、EWL03、EWL04、EWL05、EWL06、EWL07、EWL08、EWL09和EWL10的构建
将质粒PRSF-CBGW、pET-FucT14和导入pCD-wbgO-fucT3基因工程菌ENP4L2,通过菌落PCR及测序,验证正确后即得基因工程菌EWL02。
基因工程菌EWL03、EWL04、EWL05、EWL06、EWL07、EWL08、EWL09和EWL10的构建与基因工程菌EWL02相同。区别在于,将质粒pCD-wbgO-fucT3替换为步骤(1)相应质粒。构建得到的基因工程菌及其所导入的质粒信息如下表4所示。
表4:不同菌株的构建
2、发酵生产LNDFH II
发酵方法如上述实施例1,区别在于,当菌体密度OD
表5:不同工程大肠杆菌摇瓶发酵详细信息
实施例3:LNDFH II发酵条件优化
对菌株EWL01和菌株EWL07发酵生产LNDFH II的温度进行条件优化,具体步骤同实施例1,区别在于,当菌体密度OD
对菌株EWL01和菌株EWL07发酵生产LNDFH II的诱导剂浓度进行条件优化,具体步骤同实施例1,区别在于,当菌体密度OD
结果显示(图2),在诱导剂浓度为0.5mM,诱导温度为25℃条件下发酵72h,LNDFHII的产量最高,在此条件下菌株EWL01的产量为2.636g/L,菌株EWL07的产量为3.011g/L。
实施例4:5L发酵罐生产LNDFH II
为进一步验证菌株EWL01以及菌株EWL07在5L发酵罐中的生产效果,将菌株EWL01以及菌株EWL07种子液分别以10%(v/v)的接种比例接种到含1.5LDM培养基(甘油浓度为30g/L)的5L发酵罐中,设定溶氧为30%,生长温度37℃,搅拌速度800rpm,通气量2vvm,pH6.6±0.05。生长过程中的pH用氨水调控以维持全程发酵的pH稳定;待罐体菌株的OD
结果显示,菌株EWL01以及菌株EWL07的LNDFH II产量在60h时达到最高,分别为16.245g/L和18.062g/L。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种高产乳酰-N-岩藻糖基五糖Ⅰ的重组大肠杆菌的构建方法及应用
- 一种宽波段吸光材料及其制备方法
