基于PCR/RAA-CRISPR-Cas13a检测NDM型碳青霉烯酶基因试剂盒
文献发布时间:2024-05-31 01:29:11
技术领域
本发明属于生物技术领域,具体涉及基于PCR/RAA-CRISPR-Cas13a检测NDM型碳青霉烯酶基因试剂盒及其检测方法与应用。
背景技术
碳青霉烯类抗菌药物是临床中常用的一类广谱β-内酰胺类抗菌药物,因其抗菌谱广、抗菌作用强,曾被认为是20世纪80年代以来治疗耐多药革兰阴性杆菌严重感染的最后一道防线。近年来,随着临床上对这类药物的不当使用,耐药率逐年上升。目前对碳青霉烯类抗菌药物产生耐药的主要菌群是肠杆菌科细菌,其耐药产生的主要机制为产生了一种可水解碳青霉烯类抗菌药物的水解酶,即碳青霉烯酶(Carbapenemase)。碳青霉烯酶基因可以通过质粒和转座子在细菌之间进行水平传播,造成碳青霉烯酶的流行。根据Ambler分类方法可以将碳青霉烯酶分为三类(A、B和D类),A类酶主要包括KPC、GES、SME等,B类酶主要包括NDM、IMP、VIM等,D类酶包括OXA-48等。虽然种类繁多,但在全球范围内主要流行以下5种碳青霉烯酶:KPC(Klebsiella Pneumoniae Carbapenemase,KPC)、NDM(New Delhi Metallo-β-Lactamases,NDM)、VIM(Verona integron-encoded Metallo-β-Lactamases,VIM)、IMP(Imipenem-resistant Pseudomonas)、OXA-48(Oxacillin-hydrolysing carbapenemase)。产生碳青霉烯酶基因的细菌(如耐碳青霉烯类抗生素肠杆菌科细菌,CRE)极易以克隆播撒的方式快速传播,临床上对于产碳青霉烯酶菌株的鉴定和分型将有助于合理制定治疗方案、缩短治疗周期。因此,对这些细菌检测仍需进一步研究和开发具有更高特异性和灵敏度的检测方法。
目前实验室常用的碳青霉烯酶检测方法主要为表型检测和基因型检测。常用的表型检测方法有:改良Hodge试验、Carba-NP确证试验、EDTA双纸片协同试验、Carba-NP确证试验以及碳青霉烯失活法(CIM)试验,但是以上检测方法存在耗时较长的缺点,通常需要24-96小时,并且无法得知具体的碳青霉烯酶基因型。基于抗原抗体反应的商用试纸条虽有便捷的优势,但其达不到理想的灵敏度。常用的碳青霉烯酶基因型检测方法包括作为金标准的传统PCR技术、荧光定量PCR技术、全基因组测序技术等,但这些检测方法需要依赖实验室环境、昂贵的仪器设备,并且成本较高。
近年来,基因编辑技术发展迅速,不同亚型的CRISPR-Cas的基因编辑系统拓展了临床检测、基础研究和生物医学领域方面的应用。其中CRISPR-Cas13属于2类CRISPR系统中的Ⅵ型,与Cas9特异性切割DNA不同,该系统在gRNA引导下可特异性结合并切割RNA,并可对其进行编辑。Cas13a效应蛋白是一个RNA引导的CRISPR效应蛋白,它具有“附带切割”特性,不仅能够特异性靶向切割单链RNA,而且在切割目标序列后仍保持活性,继续切割其他非目标RNA。利用Cas13a的这种附带切割活性,将其运用于分子诊断检测中,通过在检测体系内加入含有报告基团的单链RNA探针,当Cas13a识别到靶序列的存在时,就会转入一种酶促“激活”状态,进而切割单链RNA探针释放荧光报告基团,发出荧光信号,实现检测靶标序列的目的。
发明内容
本发明所要解决的技术问题是如何精准、灵敏、简便、快速地检测NDM型碳青霉烯酶基因和/或如何鉴定产碳青霉烯酶菌株(如产NDM型碳青霉烯酶菌株)。所要解决的技术问题不限于如所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
为解决上述技术问题,本发明首先提供了用于检测NDM型碳青霉烯酶基因的试剂盒,所述试剂盒可包括特异性扩增NDM型碳青霉烯酶基因的引物对和crRNA,所述crRNA的序列可由用于与Cas13a蛋白结合的锚定序列和靶向NDM型碳青霉烯酶基因靶点序列的向导序列组成,所述向导序列可为SEQ ID No.14的第39-65位(5’-gcugguucgacaacgcauuggcuaagu-3’)。
所述NDM型碳青霉烯酶基因靶点的核苷酸序列为SEQ ID No.13,位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第515-542位。
进一步地,上述试剂盒中,所述crRNA的核苷酸序列可为SEQ ID No.14。
核苷酸序列为SEQ ID No.14的crRNA名称可为NDM-crRNA-5。
其中,SEQ ID No.14的第1-38位为用于与Cas13a蛋白结合的锚定序列;SEQ IDNo.14的第39-65位为靶向NDM型碳青霉烯酶基因靶点序列(SEQ ID No.13)的向导序列。
进一步地,上述试剂盒中,所述引物对可为下述任一种:
A1)PCR引物对,所述PCR引物对可由引物NDM-PCR-F2和引物NDM-PCR-R2组成,所述引物NDM-PCR-F2可为SEQ ID No.4所示的单链DNA分子;所述引物NDM-PCR-R2可为SEQ IDNo.7所示的单链DNA分子;
A2)RAA引物对,所述RAA引物对可由引物NDM-RAA-F2和引物NDM-RAA-R2组成,所述引物NDM-RAA-F2可为SEQ ID No.10所示的单链DNA分子;所述引物NDM-RAA-R2可为SEQ IDNo.12所示的单链DNA分子。
进一步地,所述试剂盒还可包括Cas13a蛋白。
上述试剂盒中,所述Cas13a蛋白可独立存在或与本发明所述的crRNA以复合物的形式存在。
进一步地,所述Cas13a蛋白可为LwCas13a蛋白。
进一步地,所述试剂盒还可包括报告RNA。
所述报告RNA可为具有信号报告功能的RNA分子,当所述RNA分子被降解时,能够报告阳性信号并被检测到。
在本发明的一个实施例中,所述报告RNA为RNaseAlert
进一步地,所述试剂盒还可包括T7 RNA聚合酶、NTP(如NTP Mix)、RNA酶抑制剂、缓冲液(如HEPES Buffer Solution)、MgCl
进一步地,所述试剂盒还可包括记载有本文中所述检测NDM型碳青霉烯酶基因的方法的可读性载体。所述可读性载体可为关于实践本发明方法的试剂盒说明书(例如印刷形式的说明书)或在其上已记录了信息的计算机可读的介质(例如软盘、CD等)。
所述试剂盒的各种试剂组分可以存在于分开的容器中,或者可以全部或部分预组合成试剂混合物。
所述crRNA,和/或,所述引物对也在本发明的保护范围内。
本发明还提供了用于检测NDM型碳青霉烯酶基因的组合物,所述组合物可由所述引物对(PCR引物对或RAA引物对)和所述crRNA组成。
进一步地,所述组合物可由所述PCR引物对和所述crRNA组成。
进一步地,所述组合物可由所述RAA引物对和所述crRNA组成。
本发明还提供了一种检测NDM型碳青霉烯酶基因的方法,所述方法可包括如下步骤:
B1)提取待测样本DNA;
B2)以所述DNA为模板,利用所述引物NDM-PCR-F2和引物NDM-PCR-R2进行PCR扩增,得到PCR扩增产物;或以所述DNA为模板,利用所述引物NDM-RAA-F2和引物NDM-RAA-R2进行RAA扩增,得到RAA扩增产物;
B3)利用CRISPR-Cas13a检测体系进行检测;
所述CRISPR-Cas13a检测体系包括所述crRNA(如NDM-crRNA-5,SEQ ID No.14)。
上述方法中,所述CRISPR-Cas13a检测体系还可包括Cas13a蛋白和/或T7 RNA聚合酶。
进一步地,所述CRISPR-Cas13a检测体系还可包括报告RNA、NTP(如NTP Mix)、RNA酶抑制剂、无RNA酶水。
进一步地,步骤B2)中,进行所述PCR扩增的反应条件可为:95℃预变性5min,95℃30s,55℃30s,72℃45s,循环35次,72℃延伸10min。
进一步地,步骤B2)中,进行所述PCR扩增的反应体系(25μL)可为:待测样本DNA 1μL、引物NDM-PCR-F2 10μM 2μL、引物NDM-PCR-R2 10μM 2μL、2×Taq mix 14.5μL、ddH
其中2×Taq mix为博迈德公司产品,货号MT211-02。
进一步地,步骤B2)中,进行所述RAA扩增的反应条件可为:39℃条件下反应20-40分钟(如30分钟)。
进一步地,步骤B2)中,进行所述RAA扩增的反应体系(47.5μL)可为:待测样本DNA5μL、引物NDM-RAA-F2 10μM 2μL、引物NDM-RAA-R2 10μM 2μL、A Buffer 38.5μL。
其中A Buffer为RAA核酸扩增试剂盒(江苏奇天基因生物科技有限公司,货号B00000A)内组分。
进一步地,步骤B3)所述利用CRISPR-Cas13a检测体系进行检测的方法如下:
①配制含有如下组分的CRISPR-Cas13a检测体系:步骤B2)所得RAA扩增产物或PCR扩增产物、Cas13a蛋白、crRNA、报告RNA、NTP、T7 RNA聚合酶、RNA酶抑制剂、无RNA酶水、CRISPR-Cas13a检测反应缓冲液;②进行反应;③检测阳性信号。
进一步地,在本发明的一个实施方案中,所述CRISPR-Cas13a检测体系(25μL)可为:模板5μL、LwCas13a蛋白(1X)1μL、NTP Mix(10mM)2μL、T7 RNA聚合酶(50000U/ml)0.5μL、RNA酶抑制剂(Murine RNase inhibitor)(40U/ml)1μL、NDM-crRNA-5(100ng/μL)1.5μL、HEPES Buffer Solution(1M)0.5μL、MgCl
进一步地,步骤②中,所述反应的条件可为:37℃,步骤③中所述检测阳性信号可为:每2min检测一次所述阳性信号,共检测30次。
进一步地,所述方法还包括根据阳性信号的有无判定所述待测样本中是否含有NDM型碳青霉烯酶基因,和/或,根据阳性信号的强弱判定所述待测样本中NDM型碳青霉烯酶基因的浓度。
所述根据阳性信号的有无判定所述待测样本中是否含有NDM型碳青霉烯酶基因为:如果有阳性信号,则判定所述待测样本中含有或者候选含有NDM型碳青霉烯酶基因;如果无阳性信号,则判定所述待测样本中不含有或者候选不含有NDM型碳青霉烯酶基因。
所述根据阳性信号的强弱判定所述待测样本中NDM型碳青霉烯酶基因的浓度为:阳性信号越强,表示所述待测样本中含有的NDM型碳青霉烯酶基因含量越高;阳性信号越弱,表示所述待测样本中含有的NDM型碳青霉烯酶基因含量越低。
本文中,所述阳性信号可为荧光信号。在同一检测时间内,实验组荧光强度值比阴性对照(ddH
进一步地,所述待测样本可为纯化菌落、血清、血浆或环境样本等。
本发明还提供了所述crRNA,和/或,所述引物对,和/或,所述组合物的下述任一种应用:
C1)在检测NDM型碳青霉烯酶基因中的应用;
C2)在制备用于检测NDM型碳青霉烯酶基因的产品中的应用;
C3)在鉴定产碳青霉烯酶菌株中的应用;
C4)在制备用于鉴定产碳青霉烯酶菌株的产品中的应用;
C5)在检测微生物耐药性中的应用;
C6)在制备用于检测微生物耐药性的产品中的应用。
进一步地,所述C3)可为在鉴定产NDM型碳青霉烯酶菌株中的应用。
进一步地,所述C4)可为在制备用于鉴定产NDM型碳青霉烯酶菌株的产品中的应用。
所述产品可为试剂、试剂盒、芯片或试纸。
C5)所述检测微生物耐药性可通过检测待测微生物样品中是否含有碳青霉烯酶基因进行,如果含有碳青霉烯酶基因表明待测微生物大概率存在对碳青霉烯类抗生素的耐药性。进一步可用于诊断具有碳青霉烯抗性的受试者,以及开发对于具有细菌感染的受试者合适的治疗方案,其中所述治疗基于碳青霉烯抗性的存在或不存在来确定。
所述微生物可为肠杆菌科细菌,包括但不限于铜绿假单胞菌、鲍氏不动杆菌、肺炎克雷伯氏菌、产酸克雷伯氏菌(Klebsiellaoxytoca)、肠杆菌属物种(Enterobactersp.)、肠沙门氏菌(Salmonellaenterica)、大肠杆菌等。
上述应用和方法的目的可以是疾病诊断目的、疾病预后目的和/或疾病治疗目的,它们的目的也可以是非疾病诊断目的、非疾病预后目的和非疾病治疗目的;它们的直接目的可以是获取疾病诊断结果、疾病预后结果和/或疾病治疗结果的中间结果的信息,它们的直接目的可以是非疾病诊断目的、非疾病预后目的和/或非疾病治疗目的。
本发明涉及细菌检测领域,具体涉及基于PCR/RAA-CRISPR-Cas13a(PCR-CRIS PR-Cas13a和RAA-CRISPR-Cas13a)检测NDM型碳青霉烯酶基因的试剂盒、组合物及其应用。本发明公开了一种基于CRIPSR-Cas13a的核酸检测技术,其最主要的机制是Cas13a蛋白可以在向导RNA的帮助下识别具有靶向序列的RNA片段,随后被激活的不受序列限制的RNA酶活性,通过在反应体系中加入RNA链降解导致的信号报告分子,最终实现具有靶向序列的RNA片段的信号识别。
本发明采用PCR技术或RAA技术联合CRISPR-Cas13a技术检测NDM型碳青霉烯酶基因的方法,通过设计、构建、筛选,最终提供一段用于检测NDM型碳青霉烯酶基因的靶向该序列的特异性crRNA和引物对,本发明提供的方法简便、快速、具有较高的灵敏度和特异性,灵敏度可达到单个拷贝级别,有效杜绝了上一步核酸扩增反应中非目的扩增片段的假阳性事件发生,可用于临床快速鉴定产碳青霉烯酶菌株(如产NDM型碳青霉烯酶菌株),从而对患者进行合理的抗生素治疗,以缩短治疗周期,另一方面其便捷的检测特点可有助于在偏远地区开展POCT检测,从而有效监测和控制耐药菌株的扩散,有着非常重要的临床应用前景和开发价值。
附图说明
图1为实施例1中步骤六的PCR扩增产物的琼脂糖电泳检测结果图。
图2为实施例1中步骤七的RAA扩增产物的琼脂糖电泳检测结果图。
图3为实施例2中crRNA转录模板电泳图。
图4为实施例2中使用10
图5为实施例4中PCR-CRISPR-Cas13a方法的灵敏度检测结果。
图6为实施例4中RAA-CRISPR-Cas13a方法的灵敏度检测结果。
图7为实施例4中PCR-CRISPR-Cas13a方法的稳定性实验(临床样本实验)结果。
图8为实施例4中RAA-CRISPR-Cas13a方法的稳定性实验(临床样本实验)结果。
图9为实施例4中PCR-CRISPR-Cas13a方法的特异性实验结果。
图10为实施例4中RAA-CRISPR-Cas13a方法的特异性实验结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、基于PCR/RAA-CRISPR-cas13a检测NDM型碳青霉烯酶基因
本发明所提供的基于PCR/RAA-CRISPR-cas13a检测NDM型碳青霉烯酶基因的方法的基本原理是:首先NDM型碳青霉烯酶基因进行转录转变成单链RNA,再通过CRISPR的crRNA特异性结合目的片段,最后利用Cas13a酶切活性带有荧光信号的报告RNA,通过荧光信号来检测NDM型碳青霉烯酶基因。
一、质粒标准品的制备
NDM型碳青霉烯酶质粒pUC57-NDM由博迈德生物公司合成,质粒浓度为:200ng/μL。质粒长度为3523bp。
拷贝数计算公式:6.02×10
稀释:取4μL质粒到18μL水中,得到浓度为1×10
重组载体pUC57-NDM的核苷酸序列为:5’-tcgcgcgtttcggtgatgacggtgaaaacctctgacacatgcagctcccggagacggtcacagcttgtctgtaagcggatgccgggagcagacaagcccgtcagggcgcgtcagcgggtgttggcgggtgtcggggctggcttaactatgcggcatcagagcagattgtactgagagtgcaccatatgcggtgtgaaataccgcacagatgcgtaaggagaaaataccgcatcaggcgccattcgccattcaggctgcgcaactgttgggaagggcgatcggtgcgggcctcttcgctattacgccagctggcgaaagggggatgtgctgcaaggcgattaagttgggtaacgccagggttttcccagtcacgacgttgtaaaacgacggccagtgaattcgagctcggtacctcgcgaatgcatctagatatggaattgcccaatattatgcacccggtcgcgaagctgagcaccgcattagccgctgcattgatgctgagcgggtgcatgcccggtgaaatccgcccgacgattggccagcaaatggaaactggcgaccaacggtttggcgatctggttttccgccagctcgcaccgaatgtctggcagcacacttcctatctcgacatgccgggtttcggggcagtcgcttccaacggtttgatcgtcagggatggcggccgcgtgctggtggtcgataccgcctggaccgatgaccagaccgcccagatcctcaactggatcaagcaggagatcaacctgccggtcgcgctggcggtggtgactcacgcgcatcaggacaagatgggcggtatggacgcgctgcatgcggcggggattgcgacttatgccaatgcgttgtcgaaccagcttgccccgcaagaggggatggttgcggcgcaacacagcctgactttcgccgccaatggctgggtcgaaccagcaaccgcgcccaactttggcccgctcaaggtattttaccccggccccggccacaccagtgacaatatcaccgttgggatcgacggcaccgacatcgcttttggtggctgcctgatcaaggacagcaaggccaagtcgctcggcaatctcggtgatgccgacactgagcactacgccgcgtcagcgcgcgcgtttggtgcggcgttccccaaggccagcatgatcgtgatgagccattccgcccccgatagccgcgccgcaatcactcatacggcccgcatggccgacaagctgcgctgaatcggatcccgggcccgtcgactgcagaggcctgcatgcaagcttggcgtaatcatggtcatagctgtttcctgtgtgaaattgttatccgctcacaattccacacaacatacgagccggaagcataaagtgtaaagcctggggtgcctaatgagtgagctaactcacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtgccagctgcattaatgaatcggccaacgcgcggggagaggcggtttgcgtattgggcgctcttccgcttcctcgctcactgactcgctgcgctcggtcgttcggctgcggcgagcggtatcagctcactcaaaggcggtaatacggttatccacagaatcaggggataacgcaggaaagaacatgtgagcaaaaggccagcaaaaggccaggaaccgtaaaaaggccgcgttgctggcgtttttccataggctccgcccccctgacgagcatcacaaaaatcgacgctcaagtcagaggtggcgaaacccgacaggactataaagataccaggcgtttccccctggaagctccctcgtgcgctctcctgttccgaccctgccgcttaccggatacctgtccgcctttctcccttcgggaagcgtggcgctttctcatagctcacgctgtaggtatctcagttcggtgtaggtcgttcgctccaagctgggctgtgtgcacgaaccccccgttcagcccgaccgctgcgccttatccggtaactatcgtcttgagtccaacccggtaagacacgacttatcgccactggcagcagccactggtaacaggattagcagagcgaggtatgtaggcggtgctacagagttcttgaagtggtggcctaactacggctacactagaagaacagtatttggtatctgcgctctgctgaagccagttaccttcggaaaaagagttggtagctcttgatccggcaaacaaaccaccgctggtagcggtggtttttttgtttgcaagcagcagattacgcgcagaaaaaaaggatctcaagaagatcctttgatcttttctacggggtctgacgctcagtggaacgaaaactcacgttaagggattttggtcatgagattatcaaaaaggatcttcacctagatccttttaaattaaaaatgaagttttaaatcaatctaaagtatatatgagtaaacttggtctgacagttaccaatgcttaatcagtgaggcacctatctcagcgatctgtctatttcgttcatccatagttgcctgactccccgtcgtgtagataactacgatacgggagggcttaccatctggccccagtgctgcaatgataccgcgagacccacgctcaccggctccagatttatcagcaataaaccagccagccggaagggccgagcgcagaagtggtcctgcaactttatccgcctccatccagtctattaattgttgccgggaagctagagtaagtagttcgccagttaatagtttgcgcaacgttgttgccattgctacaggcatcgtggtgtcacgctcgtcgtttggtatggcttcattcagctccggttcccaacgatcaaggcgagttacatgatcccccatgttgtgcaaaaaagcggttagctccttcggtcctccgatcgttgtcagaagtaagttggccgcagtgttatcactcatggttatggcagcactgcataattctcttactgtcatgccatccgtaagatgcttttctgtgactggtgagtactcaaccaagtcattctgagaatagtgtatgcggcgaccgagttgctcttgcccggcgtcaatacgggataataccgcgccacatagcagaactttaaaagtgctcatcattggaaaacgttcttcggggcgaaaactctcaaggatcttaccgctgttgagatccagttcgatgtaacccactcgtgcacccaactgatcttcagcatcttttactttcaccagcgtttctgggtgagcaaaaacaggaaggcaaaatgccgcaaaaaagggaataagggcgacacggaaatgttgaatactcatactcttcctttttcaatattattgaagcatttatcagggttattgtctcatgagcggatacatatttgaatgtatttagaaaaataaacaaataggggttccgcgcacatttccccgaaaagtgccacctgacgtctaagaaaccattattatcatgacattaacctataaaaataggcgtatcacgaggccctttcgtc-3’(SEQID No.1)。
二、PCR和RAA引物的设计
首先对NDM型碳青霉烯酶基因序列进行保守性分析,在NCBI(https://www.ncbi.nlm.nih.gov/)下载31株NDM型碳青霉烯酶基因序列信息,应用MEGA7软件对序列进行生物信息学分析,分析得保守序列为:5’-atggaattgcccaatattatgcacccggtcgcgaagctgagcaccgcattagccgctgcattgatgctgagcgggtgcatgcccggtgaaatccgcccgacgattggccagcaaatggaaactggcgaccaacggtttggcgatctggttttccgccagctcgcaccgaatgtctggcagcacacttcctatctcgacatgccgggtttcggggcagtcgcttccaacggtttgatcgtcagggatggcggccgcgtgctggtggtcgataccgcctggaccgatgaccagaccgcccagatcctcaactggatcaagcaggagatcaacctgccggtcgcgctggcggtggtgactcacgcgcatcaggacaagatgggcggtatggacgcgctgcatgcggcggggattgcgacttatgccaatgcgttgtcgaaccagcttgccccgcaagaggggatggttgcggcgcaacacagcctgactttcgccgccaatggctgggtcgaaccagcaaccgcgcccaactttggcccgctcaaggtattttaccccggccccggccacaccagtgacaatatcaccgttgggatcgacggcaccgacatcgcttttggtggctgcctgatcaaggacagcaaggccaagtcgctcggcaatctcggtgatgccgacactgagcactacgccgcgtcagcgcgcgcgtttggtgcggcgttccccaaggccagcatgatcgtgatgagccattccgcccccgatagccgcgccgcaatcactcatacggcccgcatggccgacaagctgcgctga-3’(SEQ ID No.2)。
在所述引物的5’端具有一段T7转录序列,使得PCR和RAA扩增得到的双链DNA(dsDNA)可以被T7 RNA聚合酶识别并且进行转录。PCR引物和RAA引物序列分别如表1和表2所示,由生工生物工程(上海)有限公司合成。
表1、NDM型碳青霉烯酶基因PCR扩增引物
注:表中下划线部分为T7序列。
表2、NDM型碳青霉烯酶基因RAA扩增引物
注:表中下划线部分为T7序列。
三、相关试剂
本研究中基因组提取试剂盒为天根公司产品,DNA纯化回收试剂盒(货号DP315)、2×Taq mix(货号MT211-02)、RAA核酸扩增试剂盒(货号B00000A)和ddH
四、PCR扩增产物的获得
以步骤一所得的质粒标准品作为模板,采用表1设计的引物进行PCR扩增,得到PCR扩增产物。PCR扩增体系如表3所示。
表3、PCR扩增体系
其中,NDM-PCR-F为NDM型碳青霉烯酶基因PCR扩增正向引物,NDM-PCR-R为NDM型碳青霉烯酶基因PCR扩增反向引物。
PCR反应条件:95℃预变性5min,95℃30s,55℃30s,72℃45s,循环35次,72℃延伸10min。得到PCR扩增产物。
五、RAA扩增产物的获得
以步骤一所得的质粒标准品作为模板,采用表2设计的引物进行RAA扩增,得到RAA扩增产物。RAA扩增体系如表4所示。
表4、RAA扩增体系
其中,NDM-RAA-F为NDM型碳青霉烯酶基因RAA扩增正向引物,NDM-RAA-R为NDM型碳青霉烯酶基因RAA扩增反向引物。
具体扩增操作步骤如下:将混合好的47.5μL溶液加入到RAA扩增试剂盒自带的反应单元,使冻干粉充分重溶均匀。向每个反应管管盖上加入2.5μL B Buffer溶液,合上管盖,上下颠倒5-6次混匀,快速离心10秒钟。将上述反应管放置在39℃条件下反应30分钟,得到RAA扩增产物。
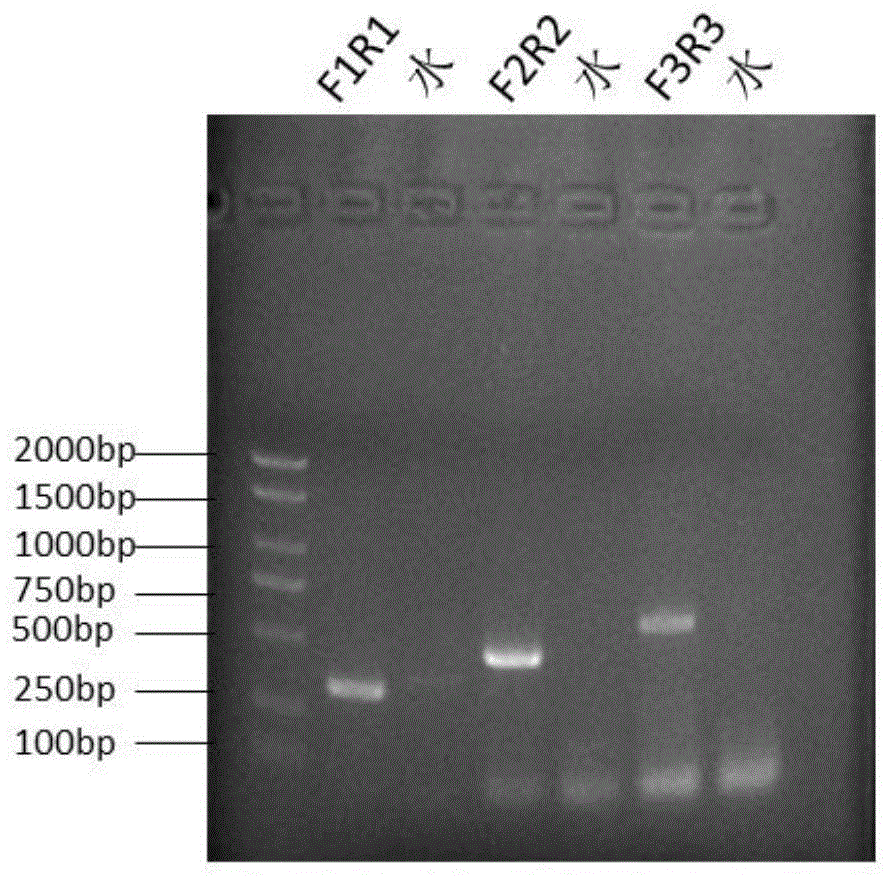
六、PCR引物的筛选
以10
PCR结束后取5μL PCR扩增产物,加入1μL 6×Loading Buffer,混匀后进行琼脂糖凝胶电泳检测。
检测结果如图1所示,结果显示,引物NDM-PCR-F2和引物NDM-PCR-R2(即SEQ IDNo.4和SEQ ID No.7)的组合扩增效率较高。因此引物NDM-PCR-F2和引物NDM-PCR-R2组合作为最佳PCR扩增引物对用于针对NDM碳青霉烯酶耐药基因的扩增。
筛选得到的用于特异性扩增NDM型碳青霉烯酶基因的PCR引物对由引物NDM-PCR-F2和引物NDM-PCR-R2组成,所述引物NDM-PCR-F2为SEQ ID No.4所示的单链DNA分子;所述引物NDM-PCR-R2为SEQ ID No.7所示的单链DNA分子。
七、RAA引物的筛选
以10
将三氯甲烷和Tris平衡酚等体积混匀、振荡后离心10min,弃去上清,得到酚与三氯甲烷混合物,以备后续使用。取RAA扩增产物与酚与三氯甲烷混合物等体积混合,振荡混匀,10000rpm离心10min,吸取上清5μL,加入1μL 6×Loading Buffer,混匀后琼脂糖凝胶电泳。检测结果如图2所示,结果显示,引物NDM-RAA-F2和引物NDM-RAA-R2(即SEQ ID No.10和SEQ ID No.12)的组合扩增效率较高。因此NDM-RAA-F2和NDM-RAA-R2组合(F2R2组合)作为最佳RAA扩增引物用于针对NDM碳青霉烯酶耐药基因的扩增。
筛选得到的用于特异性扩增NDM型碳青霉烯酶基因的RAA引物对由引物NDM-RAA-F2和引物NDM-RAA-R2组成,所述引物NDM-RAA-F2为SEQ ID No.10所示的单链DNA分子;所述引物NDM-RAA-R2为SEQ ID No.12所示的单链DNA分子。
实施例2、用于本发明的crRNA的设计和筛选
一、crRNA的设计
根据实施例1中筛选出的PCR引物(表1中的引物NDM-PCR-F2和引物NDM-PCR-R2)和序列比对分析结果,在NDM型碳青霉烯酶基因保守序列(SEQ ID No.2)中设计5条crRNA:NDM-crRNA-1、NDM-crRNA-2、NDM-crRNA-3、NDM-crRNA-4、NDM-crRNA-5。其中NDM-crRNA-1靶点序列如下:5’-gcgcaacacagcctgactttcgccgcca-3’,位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第569-596位;NDM-crRNA-2靶点序列如下:5’-aacacagcctgactttcgccgccaatgg-3’,位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第573-600位;NDM-crRNA-3靶点序列如下:5’-cgcaacacagcctgactttcgccgccaa-3’,位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第570-595位;NDM-crRNA-4靶点序列如下:5’-ttatgccaatgcgttgtcgaaccagctt-3’,位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第517-544位;NDM-crRNA-5靶点序列如下:5’-acttatgccaatgcgttgtcgaaccagc-3’(SEQ ID No.13),位于NDM型碳青霉烯酶基因组(GenBank ID:NG049326.1)第515-542位。
crRNA制备所需引物为如下表5所示。
表5、制备crRNA所需模板与引物序列
二、crRNA的制备
1、PCR扩增
将上述合成的序列用ddH
表6、PCR扩增体系
PCR反应条件:95℃5min热变性;95℃30s,55℃30s,72℃45s,共35个循环;72℃自动延伸10min;4℃保存PCR产物。
PCR结束后可取5μL PCR产物,加入1μL 6×Loading Buffer,混匀后琼脂糖凝胶电泳结果如图3。
2、PCR产物的纯化
使用Tris平衡酚对步骤1获得的PCR产物进行纯化,具体步骤如下:Tris平衡酚(灏样生物)取500μL,加入等体积的三氯甲烷,振荡混匀后短暂离心,弃上清;取130μL酚氯仿混合液加入PCR产物中,混匀后12,000rpm离心1min;取上清液到一个新的1.5mL离心管,加入无水乙醇使上清与乙醇比例为3:7(体积比)混合,震荡,12,000rpm离心10min,弃上清;加入200μL 75%的乙醇,12,000rpm离心10min,弃上清(该步骤共进行三次)。得到的沉淀室温晾干(约10min),加入40μL无RNA酶的水,ND5000超微量分光光度计检测浓度,-20℃保存。
3、转录
取1μg步骤2获得的纯化PCR产物,使用T7转录试剂盒(NEB)转录crRNA。crRNA转录体系如表7所示。
表7、crRNA转录体系
上述crRNA转录体系混匀后,37℃转录过夜,使用DNaseⅠ去除多余的DNA:上一步得到的转录产物加入20μL无RNase的水,加入2μL DNaseⅠ,混匀,37℃孵育15min,得到crRNA。
4、crRNA的纯化
按照Agencourt RNA Clean XP说明书(Beckman Coulter)纯化步骤3转录获得的crRNA,具体步骤如下:磁珠振荡混匀,向转录产物中加入1.8倍体积的磁珠,吹打10次或涡旋30s以混匀磁珠和转录体系,室温静置5min。将反应体系放到磁力架,静置5-10min以分离磁珠。轻轻吸出体系中的液体,避免磁珠被吸出,向磁珠中加入200μL 70%的乙醇(无RNase水配制),室温孵育30s,吸出乙醇;重复此过程清洗磁珠,共3次。室温晾干体系,去除体系中的乙醇,约10min。加入50μL RNase-free水,涡旋30s或用移液器吹打10次,吸出上清液,放入无RNase的1.5mL离心管中,ND5000分光光度计测定纯化得到的crRNA浓度,-80℃分装备用。
最终所得五条crRNA的序列如下:
crRNA1(NDM-crRNA-1):5’-GGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACuggcggcgaaagucaggcuguguugcgc-3’,
crRNA2(NDM-crRNA-2):5’-GGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACccauuggcggcgaaagucaggcuguguu-3’,
crRNA3(NDM-crRNA-3):5’-GGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACuuggcggcgaaagucaggcuguguugcg-3’,
crRNA4(NDM-crRNA-4):5’-GGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACaagcugguucgacaacgcauuggcauaa-3’,
crRNA5(NDM-crRNA-5):5’-GGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACgcugguucgacaacgcauuggcuaagu-3’(SEQ ID No.14)。
三、crRNA的筛选
1、以10
2、经PCR扩增后,取5μL扩增产物按照实施例3中的方法利用不同crRNA检测NDM型碳青霉烯酶基因,同时设置水为模板的扩增产物作为阴性对照。
检测结果显示,当使用10
实施例3、基于CRISPR-Cas13a检测NDM型碳青霉烯酶基因方法的建立
本实施例建立了两种基于CRISPR-Cas13a检测NDM型碳青霉烯酶基因的方法。一种是基于PCR-CRISPR-Cas13a的检测NDM型碳青霉烯酶基因的方法(简称PCR-CRISPR-Cas13a方法),一种是基于RAA-CRISPR-Cas13a的检测NDM型碳青霉烯酶基因的方法(简称RAA-CRISPR-Cas13a方法)。其中:
PCR-CRISPR-Cas13a方法包括如下步骤:
(1)提取待测样本DNA;
(2)以所述DNA为模板,利用引物NDM-PCR-F2(SEQ ID No.4)和引物NDM-PCR-R2(SEQ ID No.7)进行PCR扩增,得到PCR扩增产物;
(3)利用CRISPR-Cas13a检测体系进行检测。
上述步骤(2)PCR扩增体系和PCR反应条件同实施例1中的步骤四。
RAA-CRISPR-Cas13a方法包括如下步骤:
(1)提取待测样本DNA;
(2)以所述DNA为模板,利用引物NDM-RAA-F2(SEQ ID No.10)和引物NDM-RAA-R2(SEQ ID No.12)进行RAA扩增,得到RAA扩增产物;
(3)利用CRISPR-Cas13a检测体系进行检测。
上述步骤(2)RAA扩增体系和RAA扩增方法同实施例1中的步骤五。
PCR-CRISPR-Cas13a方法和RAA-CRISPR-Cas13a方法的CRISPR-Cas13a检测体系除了模板不同,其余组分及其用量均相同。
PCR-CRISPR-Cas13a方法的CRISPR-Cas13a检测体系中模板为以引物NDM-PCR-F2(SEQ ID No.4)和引物NDM-PCR-R2(SEQ ID No.7)进行PCR扩增,得到的PCR扩增产物。
RAA-CRISPR-Cas13a方法的CRISPR-Cas13a检测体系中模板为以引物NDM-RAA-F2(SEQ ID No.10)和引物NDM-RAA-R2(SEQ ID No.12)进行RAA扩增,得到的RAA扩增产物。
CRISPR-Cas13a检测体系的配制和检测方法如下所示:
一、CRISPR-Cas13a检测体系的配制
以实施例1的步骤四中获得的NDM扩增产物(PCR扩增产物)为模板,按表8配制CRISPR-Cas13a检测体系,其中crRNA为NDM-crRNA-5(SEQ ID No.14)。
以实施例1的步骤五中获得的NDM扩增产物(RAA扩增产物)为模板,按表8配制CRISPR-Cas13a检测体系,其中crRNA为NDM-crRNA-5(SEQ ID No.14)。
将表8中的扩增产物替换为ddH
表8、CRISPR-Cas13a检测体系
相关试剂:LwCas13a蛋白为杭州众测生物科技有限公司产品。报告RNA为RNaseAlert
二、荧光强度检测
将上述配制的反应体系的PCR管放入荧光定量PCR仪中,FAM通道检测荧光信号变化。设置37℃,每2min读取一次荧光强度值,读取30次。
结果判定:在同一检测时间内,实验组荧光强度值比阴性对照(ddH
进一步地,根据阳性信号的有无判定所述待测样本中是否含有NDM型碳青霉烯酶基因,和/或,根据阳性信号的强弱判定所述待测样本中NDM型碳青霉烯酶基因的浓度:
(1)如果有阳性信号,则判定所述待测样本中含有或者候选含有NDM型碳青霉烯酶基因;如果无阳性信号,则判定所述待测样本中不含有或者候选不含有NDM型碳青霉烯酶基因;
(2)阳性信号越强,表示所述待测样本中含有的NDM型碳青霉烯酶基因含量越高;阳性信号越弱,表示所述待测样本中含有的NDM型碳青霉烯酶基因含量越低。
实施例4、基于CRISPR-Cas13a系统的NDM型碳青霉烯酶基因检测方法的灵敏度特异性和稳定性实验
一、灵敏度实验
以实施例1中梯度稀释后的质粒标准品作为模板,按照实施例3中的两种方法检测含有不同浓度的NDM型碳青霉烯酶质粒,以检测本发明方法的灵敏度。具体步骤如下:
1、按照实施例1的步骤四和五中的方法分别对不同浓度的NDM型碳青霉烯酶质粒进行PCR和RAA扩增,得到PCR扩增产物和RAA扩增产物。
2、经PCR和RAA扩增后,取5μL扩增产物按照实施例3中的方法检测NDM型碳青霉烯酶质粒。将10
二、稳定性实验
采用本发明的两种方法(PCR-CRISPR-Cas13a方法和RAA-CRISPR-Cas13a方法),以梯度稀释的标准品(即实施例1步骤一制备的标准品)为样本,每个样本分别进行3次重复实验(参照实施例1进行),组间组内无显著性差异(p<0.05)。对临床来源的3份样本进行3次重复检测(参照实施例1进行),组间组内无显著性差异(p<0.05),表明本发明方法稳定性及可重复性较好。3份样本为3株携带NDM型碳青霉烯酶基因菌株样本,均来自于首都医科大学附属北京佑安医院。PCR-CRISPR-Cas13a方法的临床样本检测结果如图7所示,RAA-CRISPR-Cas13a方法的临床样本检测结果如图8所示。
三、特异性实验
从北京市佑安医院检验科获得三株CRKP菌株,使用PCR方法检测显示分别为携带NDM型碳青霉烯酶基因菌株和携带非NDM型碳青霉烯酶基因菌株。
以3株菌株所提DNA为模板,按照实施例3中的两种方法(PCR-CRISPR-Cas13a方法和RAA-CRISPR-Cas13a方法)进行检测,以验证本发明方法的特异性。具体步骤如下:
(1)分别以2株携带NDM型碳青霉烯酶基因菌株DNA和一株携带非NDM型碳青霉烯酶基因菌株DNA为检测模板,分别按照实施例1的步骤四和五中的方法进行PCR扩增和RAA扩增,得到PCR扩增产物和RAA扩增产物。
(2)取5μL上述扩增产物按照实施例3中的方法检测,同时设置水为模板的扩增产物作为阴性对照。
检测结果显示,携带NDM型碳青霉烯酶基因菌株的实验组的荧光信号在反应开始后逐渐升高,而阴性对照组(ddH
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 基于RAA-CRISPR-Cas13a检测KPC型碳青霉烯酶基因试剂盒
- 包含产碳青霉烯酶基因的耐药菌的PCR检测试剂盒及其应用
