一种非变性Ι型胶原蛋白的快速制备方法
文献发布时间:2023-06-19 11:59:12
技术领域
本发明属于动物胶原提取技术领域,具体涉及非变性Ι型胶原蛋白的制备方法。
背景技术
胶原蛋白是一类蛋白家族,主要存在于动物的皮、骨、韧带和肌腱中,常见类型为Ⅰ型、Ⅱ型、Ⅲ型、Ⅴ型和Ⅺ型,其中Ι型胶原蛋白在动物体内的含量最高,分布最广,应用也最为广泛。Ⅰ型胶原分子长度约300nm,由三条肽链组成,三条肽链相互缠绕形成三股螺旋结构。具有完整的三股螺旋结构的胶原能最大程度发挥其生物活性修复、止血、提高免疫力、抗衰老等功效。
现有的胶原蛋白提取方法多为酸法提取和酶法。其中酸法提取胶原蛋白更常用法,但是该法浸提过程中存在过热或酸性浸提液的低离子强度会破坏胶原分子间氢键、盐键和Schiff碱结构,引起胶原分子膨胀,分子内作用降低,有可能破坏三螺旋结构。现有技术采用低温长时间酸法浸提克服该问题,但仅可在有限程度上保持胶原的三螺旋结构,且溶出率低、生产周期冗长。另外,现有酸法提取胶原蛋白的方法较为繁琐,时间冗长(7~14天),一方面长时间酸作用加剧了对胶原三螺旋结构的破坏,另一方面也更加延长了制备周期。
酶法提取是利用特定的蛋白酶(如胃蛋白酶、胰蛋白酶和碱性磷酸酶等)限制性降解胶原,即剪切掉胶原的非螺旋末端肽,主要目的是去除胶原蛋白的免疫原性;同时也可破坏分子间的交联作用,从而提高含三螺旋结构的主体部分在酸溶液中的溶出率,使胶原蛋白从原料中的溶出速度加快、溶出量增加。酶法提取引入了酶制剂,既增加了食用风险(微生物来源的酶制剂可能带有毒素),也使提取工艺更加复杂,因此,在酶解的过程中必须严格控制酶解条件(pH、温度、时间),酶解后需要对酶进行灭活或者分离除去。此外,酶法提取成本较高,在实际操作中通常与酸结合使用,进一步提高胶原蛋白的提取效率。
发明内容
本发明要解决的技术问题是现有提取技术无法实现低成本、短时间制备三螺旋活性胶原,本发明提供一种可以在常温条件下进行的快速制备Ι型胶原蛋白的方法,不仅可缩短制备周期,制备条件也更简便,同时无需添加酶制剂,成本更低,而且能够保持胶原的三螺旋结构。
本发明的目的是一种非变性Ι型胶原蛋白的快速制备方法。
本发明的另一目的是提供一种非变性Ι型胶原蛋白。
为实现上述目的,本发明提供如下技术方案:
一种非变性Ι型胶原蛋白的快速制备方法,包括如下步骤:
(1)原料预处理;
(2)酸泡胀处理:将预处理后的原料加入酸溶液中,室温泡胀3~48h后过滤除去酸溶液;
(3)步骤(2)处理后的原料加入水中,匀浆;
(4)匀浆悬液过滤除杂,即得到非变性Ι型胶原蛋白。
其中,优选地,步骤(2)所述的酸为柠檬酸、乳酸、乙酸或苹果酸等可以用于本领域加工的酸中的一种或几种。
优选地,步骤(2)所述的酸溶液的质量浓度为0.1%~5%,原料与酸溶液的质量比为1:2~20。
优选地,步骤(2)中过滤所用的是50~100目过滤网。
优选地,所述原料和水的质量比为1:10~100,匀浆时间为10秒~120秒,匀浆功率为200W~800W。
优选地,步骤(3)所述水为纯化水、
优选地,所述匀浆悬液过滤除杂,过滤所用的是100~200目过滤网。
本发明上述方法适用的原料可以为牛筋腱、牛皮、猪筋腱、猪皮等可以用于本领域加工的原材料。
预处理方法:预料去脂,冷冻粉碎,消毒洗净。
所述室温是指在温度10~30℃。
另外,上述方法制备的非变性Ι型胶原蛋白,及其在用于制备食品、保健品、化妆品、药品或医疗器械中的应用,也均应在本发明保护范围之内。
本发明具有以下有益效果:
(1)本发明的方法将牛筋腱等原料经过较短时间的酸泡胀后,经过滤去除酸溶液后加入水中直接匀浆,即可得到具有三螺旋结构的I型胶原蛋白含量较高的原液,节省了提取时间,提高了生产效率。
(2)该方法在室温条件下进行,无需低温处理,降低能源成本。
(3)该方法相对于常用的酸酶提取法,省略了酶解步骤,以及后续可能的盐析、透析等步骤,同时降低了制备成本。
附图说明
图1是本发明实施例1得到的非变性Ι型胶原蛋白的紫外光谱图。
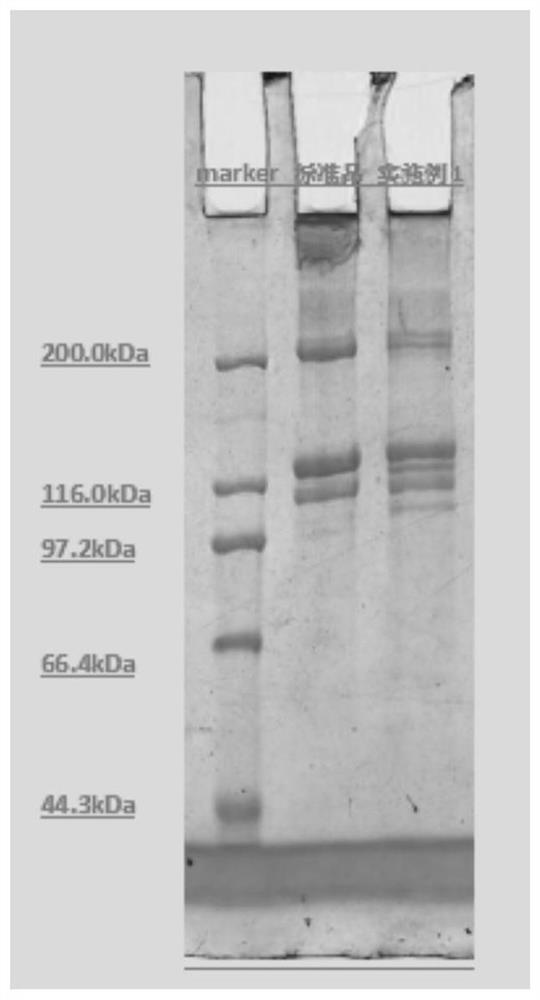
图2是本发明实施例1得到的非变性Ι型胶原蛋白的SDS-PAGE电泳图。图中:Marker,SDS-PAGE蛋白质高分子量标准蛋白;标准品:牛Ι型胶原蛋白标准品(经过胃蛋白酶酶切);实施例1:本发明实施例1得到的非变性Ι型胶原蛋白。
图3是本发明实施例1得到的非变性Ι型胶原蛋白的圆二色光谱图。
图4是本发明实施例2得到的非变性Ι型胶原蛋白的紫外光谱图。
图5是本发明实施例2得到的非变性Ι型胶原蛋白的SDS-PAGE电泳图。图中:Marker,SDS-PAGE蛋白质高分子量标准蛋白;标准品:牛Ι型胶原蛋白标准品(经过胃蛋白酶酶切);实施例2:本发明实施例2得到的非变性Ι型胶原蛋白。
图6是本发明实施例2得到的非变性Ι型胶原蛋白的圆二色光谱图。
图7是本发明实施例3得到的非变性Ι型胶原蛋白的紫外光谱图。
图8是本发明实施例3得到的非变性Ι型胶原蛋白的SDS-PAGE电泳图。图中:Marker,SDS-PAGE蛋白质高分子量标准蛋白;标准品:牛Ι型胶原蛋白标准品(经过胃蛋白酶酶切);实施例3:本发明实施例3得到的非变性Ι型胶原蛋白。
图9是本发明实施例3得到的非变性Ι型胶原蛋白的圆二色光谱图。
图10是采用不同的酸泡胀原料,非变性Ι型胶原蛋白的得率图。
图11是采用不同的酸泡胀原料,非变性Ι型胶原蛋白的圆二色光谱图。
图12是采用柠檬酸泡胀牛筋腱,牛筋腱和3%柠檬酸在不同的质量比例下泡胀,非变性Ι型胶原蛋白的得率图。
图13是采用3%柠檬酸泡胀牛筋腱,在不同的温度下泡胀,非变性Ι型胶原蛋白的得率图。
图14是采用3%柠檬酸泡胀牛筋腱,在不同的温度下泡胀,非变性Ι型胶原蛋白的圆二色光谱图。
图15是采取不同的匀浆功率,非变性Ι型胶原蛋白的得率图。
图16是采取不同的匀浆时间,非变性Ι型胶原蛋白的得率图。
图17是采取不同的匀浆时间,非变性Ι型胶原蛋白的圆二色光谱图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1
1、非变性Ι型胶原蛋白的快速制备方法,包括如下步骤:
(1)预处理:选取牛筋腱10kg,解冻后去除牛筋腱上的筋膜和脂肪,用切片机切成2mm的片状,清洗干净,液氮冷冻粉碎。
(2)消毒:取步骤(1)的牛筋腱5kg,加入浓度为100ppm的双氧水溶液10L,消毒3次,每次3h,然后用纯化水清洗3~4次,直至洗净。
(3)泡胀:取步骤(2)的牛筋腱5kg,加入5%柠檬酸溶液50L,室温浸泡3h。
(4)过滤1:用100目的不锈钢滤网过滤除去柠檬酸溶液,得到泡胀牛筋腱。
(5)匀浆:向步骤(4)处理的泡胀牛筋腱中加入100L纯化水,用搅拌机匀浆120s,重复2次。
(6)过滤2:用200目的不锈钢滤网进行过滤,除去溶液中的大颗粒物质,收集滤液。
2、非变性Ι型胶原蛋白的测定与表征
(1)双缩脲法检测滤液中的胶原蛋白含量
a.双缩脲试液配制:取硫酸铜1.5g,酒石酸钾钠6.0g,碘化钾5.0g,加水500mL溶解,边搅拌边加入10%氢氧化钠溶液300mL,用水稀释至1000mL,混匀,即得。
b.BSA对照品溶液配制:精密称取血清白蛋白(牛)(BSA)对照品,加水溶解并制成10mg/mL的BSA溶液。
c.标准曲线的制作:精密量取对照品溶液0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置具塞试管中,加水至1.0mL,再分别加入双缩脲试液4.0mL,立即混匀,室温放置30min,采用紫外-可见光分光光度法,在540nm的波长处测定吸光度,以对照品溶液0.0mL的管为空白。根据对照品溶液浓度与其相对应的吸光度制作得到标准曲线:
A=0.0489C-0.0003,
其中,A为吸光度,C为溶液浓度。
d.样品中胶原蛋白含量的测定:精密量取滤液适量,以3%的柠檬酸溶液为空白,方法同标准曲线操作方法相同,做3个平行,求出平均吸光度,代入标准曲线计算滤液中的蛋白质浓度,得率计算公式如下:
其中,Y为得率,C为滤液浓度,V为滤液体积,M为牛筋腱质量。
实验结果:样品的平均吸光度为0.293,代入标准曲线得到蛋白质浓度为6.0mg/mL,计算得率为28.2%。
(2)紫外光谱图
用3%的柠檬酸溶液将滤液稀释成1.0mg/mL。以3%的柠檬酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行波长扫描,波长范围为200~300nm,具体见图1。
(3)SDS-PAGE电泳
取实施例1的滤液和标准品,采用SDS-PAGE浓缩胶浓度为5%,分离胶浓度为6%的凝胶系统,进行恒压电泳(浓缩胶90V,分离胶110V),具体见图2。
(4)圆二色光谱图
用0.5%柠檬酸溶液将滤液稀释至0.2mg/mL。以0.5%柠檬酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行圆二色光谱扫描,波长范围为190~250nm,Rpn为0.13,具体见图3。
实施例2
1、非变性Ι型胶原蛋白的快速制备方法,包括如下步骤:
(1)预处理:选取猪筋腱10kg,解冻后去除牛筋腱上的筋膜和脂肪,用切片机切成5mm的片状,清洗干净,液氮冷冻粉碎。
(2)消毒:取步骤(1)的猪筋腱10kg,加入浓度为1000ppm的次氯酸钠溶液50L,消毒2次,每次3h,然后用纯化水清洗至无余氯检出。
(3)泡胀:取步骤(2)的猪筋腱5kg,加入0.1%乳酸溶液100L,室温浸泡24h。
(4)过滤1:用50目的不锈钢滤网过滤除去乳酸溶液,得到泡胀猪筋腱。
(5)匀浆:向步骤(4)处理的泡胀猪筋腱中加入500L纯化水,用搅拌机匀浆60s,重复3次。
(6)过滤2:用150目的不锈钢滤网进行过滤,除去溶液中的大颗粒物质,收集滤液。
2、非变性Ι型胶原蛋白的测定与表征
(1)双缩脲法检测滤液中的胶原蛋白含量
a.双缩脲试液配制:取硫酸铜1.5g,酒石酸钾钠6.0g,碘化钾5.0g,加水500mL溶解,边搅拌边加入10%氢氧化钠溶液300mL,用水稀释至1000mL,混匀,即得。
b.BSA对照溶液配制:精密称取血清白蛋白(牛)(BSA)对照品,加水溶解并制成每1mL含10mg的溶液。
c.标准曲线的制作:精密量取对照品溶液0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置具塞试管中,加水至1.0mL,再分别加入双缩脲试液4.0mL,立即混匀,室温放置30min,采用紫外-可见光分光光度法,在540nm的波长处测定吸光度,以对照品溶液0.0mL的管为空白。根据对照品溶液浓度与其相对应的吸光度制作得到标准曲线:
A=0.0490C-0.0006,
其中,A为吸光度,C为溶液浓度。
d.样品中胶原蛋白含量的测定:精密量取滤液适量,以0.1%的乳酸溶液为空白,方法同标准曲线操作方法相同,做3个平行,求出平均吸光度,代入标准曲线计算滤液中的蛋白质浓度,得率计算公式如下:
其中,Y为得率,C为滤液浓度,V为滤液体积,M为猪筋腱质量。
实验结果:样品的平均吸光度为0.249,代入标准曲线得到蛋白质浓度为5.1mg/mL,计算得率为23.4%。
(2)紫外光谱图
用0.1%乳酸溶液将样品稀释成1.0mg/mL。以0.1%乳酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行波长扫描,波长范围为200~300nm,具体见图4。
(3)SDS-PAGE电泳图
取实施例2的滤液和标准品,采用SDS-PAGE浓缩胶浓度为5%,分离胶浓度为6%的凝胶系统,进行恒压电泳(浓缩胶90V,分离胶110V),具体见图5。
(4)圆二色光谱图
用0.5%乳酸溶液将滤液稀释至0.2mg/mL。以0.5%乳酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行圆二色光谱扫描,波长范围为190~250nm,Rpn为0.11,具体见图6。
实施例3
1、非变性Ι型胶原蛋白的快速制备方法,包括如下步骤:
(1)预处理:选取牛筋腱20kg,解冻后去除牛筋腱上的筋膜和脂肪,用切片机切成3mm的片状,清洗干净,液氮冷冻粉碎。
(2)消毒:取步骤(1)的牛筋腱10kg,加入浓度为2000ppm的过氧乙酸溶液300L,消毒2次,每次0.5h,然后用纯化水清洗3~4次,直至洗净。
(3)泡胀:取步骤(2)的牛筋腱10kg,加入1%乙酸溶液200L,室温浸泡48h。
(4)过滤1:用100目的不锈钢滤网过滤除去乙酸溶液,得到泡胀牛筋腱。
(5)匀浆:向步骤(4)处理的泡胀牛筋腱中加入600L纯化水,用搅拌机匀浆30s,重复3次。
(6)过滤2:用200目的不锈钢滤网进行过滤,除去溶液中的大颗粒物质,收集滤液。
2、非变性Ι型胶原蛋白的测定与表征
(1)双缩脲法检测滤液中的胶原蛋白含量
a.双缩脲试液配制:取硫酸铜1.5g,酒石酸钾钠6.0g,碘化钾5.0g,加水500mL溶解,边搅拌边加入10%氢氧化钠溶液300mL,用水稀释至1000mL,混匀,即得。
b.BSA对照溶液配制:精密称取血清白蛋白(牛)(BSA)对照品,加水溶解并制成每1mL含10mg的溶液。
c.标准曲线的制作:精密量取对照品溶液0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置具塞试管中,加水至1.0mL,再分别加入双缩脲试液4.0mL,立即混匀,室温放置30min,采用紫外-可见光分光光度法,在540nm的波长处测定吸光度,以对照品溶液0.0mL的管为空白。根据对照品溶液浓度与其相对应的吸光度制作得到标准曲线:
A=0.0482C-0.0042,
其中,A为吸光度,C为溶液浓度。
d.样品中胶原蛋白含量的测定:精密量取滤液适量,以1%的乙酸溶液为空白,方法同标准曲线操作方法相同,做3个平行,求出平均吸光度,代入标准曲线计算滤液中的蛋白质浓度,得率计算公式如下:
其中,Y为得率,C为滤液浓度,V为滤液体积,M为牛筋腱质量。
实验结果:样品的平均吸光度为0.280,代入标准曲线得到蛋白质浓度为5.9mg/mL,计算得率为27.6%。
(2)紫外光谱图
用1%乙酸溶液将样品稀释成1.0mg/mL。以1%乙酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行波长扫描,波长范围为200~300nm,具体见图7。
(3)SDS-PAGE电泳图
取实施例1的滤液和标准品,采用SDS-PAGE浓缩胶浓度为5%,分离胶浓度为6%的凝胶系统,进行恒压电泳(浓缩胶90V,分离胶110V),具体见图8。
(4)圆二色光谱图
用0.5%乙酸溶液将滤液稀释至0.2mg/mL。以0.5%乙酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行圆二色光谱扫描,波长范围为190~250nm,Rpn为0.13,具体见图9。
实施例4方法步骤(3)中泡胀条件的优化与选择
以同一批预处理后的牛筋腱为原料,初始条件为:以柠檬酸为泡胀用的酸,浓度3%,泡胀时牛筋腱:酸=1:5,泡胀时间为10h,温度为20℃;匀浆时牛筋腱:水=1:50,匀浆功率200W,匀浆时间60s。
采用单因素方差分析,改变初始条件中的其中一个条件,根据双缩脲法计算的得率和/或圆二色光谱法测得的活性,筛选该条件的最优参数范围。
1、酸的种类
分别用柠檬酸、乳酸、乙酸、苹果酸和盐酸泡胀牛筋腱,结果表明,柠檬酸得率最高(图10),随后是盐酸、乙酸、乳酸和苹果酸。
圆二色光谱结果(图11)显示,柠檬酸、乳酸、乙酸和苹果酸提取得到的胶原蛋白Rpn为0.13、0.12、0.13、0.13,说明三螺旋结构保持完好,盐酸提取的胶原蛋白Rpn为0.10,三螺旋结构已被破坏。
综上,优选酸的种类为柠檬酸、乙酸、乳酸和苹果酸。
2、酸的比例
改变泡胀时使用的柠檬酸的比例,结果显示,牛筋腱:酸=1:1时得率较低,从1:2增加到1:10得率都明显升高,继续增加到1:15得率没有明显变化(图12)。
故优选牛筋腱:酸=1:2~10。
3、泡胀温度
泡胀温度范围选取10~50℃,在这个温度范围内得率没有明显差异(图13)。
圆二色光谱(图14)结果显示,10~40℃提取得到的胶原蛋白Rpn为0.12、0.13、0.12、0.12,说明三螺旋结构保持完好,50℃提取的胶原蛋白Rpn为0.10,三螺旋结构已被破坏。
40℃需要加热,10~30℃为室温条件。
综上,优选泡胀温度为10~30℃。
实施例5方法步骤(5)中匀浆条件的优化与选择
以同一批预处理后的牛筋腱为原料,初始条件为:以柠檬酸为泡胀用的酸,浓度3%,泡胀时牛筋腱:酸=1:5,泡胀时间为10h,温度为20℃;匀浆时牛筋腱:水=1:50,匀浆功率200W,匀浆时间60s。
采用单因素方差分析,改变初始条件中的其中一个条件,根据双缩脲法计算的得率和/或圆二色光谱法测得的活性,筛选该条件的最优参数范围。
1、匀浆功率
采用不同的匀浆功率进行匀浆,发现100W得率最低,200~800W得率没有明显差异(图15)。
故优选匀浆功率为200~800W。
2、匀浆时间
改变匀浆时间,结果显示,10~180s得率没有明显差异,5s得率低于10~180s(图16)。
圆二色光谱(图17)结果显示,10~120s提取得到的胶原蛋白Rpn为0.12、0.12、0.13、0.11,说明三螺旋结构保持完好,180s提取的胶原蛋白Rpn为0.10,三螺旋结构已被破坏。
综上,优选匀浆时间为10~120s。
3、匀浆介质
根据实施例2和对照例2的实验结果,采用水作为匀浆溶剂,制得的胶原蛋白,其Rpn为0.11,明显优于乳酸(Rpn为0.10)。故选水作为匀浆介质。
对比例1
1、按照如下步骤提取胶原:
(1)预处理:选取牛筋腱20kg,解冻后去除牛筋腱上的筋膜和脂肪,用切片机切成2mm的片状,清洗干净,液氮冷冻粉碎。
(2)消毒:取步骤(1)的牛筋腱10kg,加入浓度为1500ppm的过氧乙酸溶液200L,消毒3次,每次0.5h,然后用纯化水清洗3~4次,直至洗净。
(3)浸提:取步骤(2)的牛筋腱10kg,加入1%乙酸溶液200L,室温下30rpm搅拌72h,用100目的不锈钢滤网过滤,收集滤液;往滤渣中加入1%乙酸溶液200L,室温下30rpm继续搅拌72h,收集滤液,重复4次,共搅拌360h;合并收集到的滤液。
2、胶原蛋白的测定与表征
(1)双缩脲法检测滤液中的胶原蛋白含量
a.双缩脲试液配制:取硫酸铜1.5g,酒石酸钾钠6.0g,碘化钾5.0g,加水500mL溶解,边搅拌边加入10%氢氧化钠溶液300mL,用水稀释至1000mL,混匀,即得。
b.BSA对照溶液配制:精密称取血清白蛋白(牛)(BSA)对照品,加水溶解并制成每1mL含10mg的溶液。
c.标准曲线的制作:精密量取对照品溶液0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置具塞试管中,加水至1.0mL,再分别加入双缩脲试液4.0mL,立即混匀,室温放置30min,采用紫外-可见光分光光度法,在540nm的波长处测定吸光度,以对照品溶液0.0mL的管为空白。根据对照品溶液浓度与其相对应的吸光度制作得到标准曲线:
A=0.0489C-0.0006,
其中,A为吸光度,C为溶液浓度。
d.样品中胶原蛋白含量的测定:精密量取滤液适量,以1%的乙酸溶液为空白,方法同标准曲线操作方法相同,做3个平行,求出平均吸光度,代入标准曲线计算滤液中的蛋白质浓度,得率计算公式如下:
其中,Y为得率,C为滤液浓度,V为滤液体积,M为牛筋腱质量。
实验结果:样品的平均吸光度为0.043,代入标准曲线得到蛋白质浓度为0.9mg/mL,计算得率为8.6%。
(2)圆二色光谱图
用0.5%乙酸溶液将滤液稀释至0.2mg/mL。以0.5%乙酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行圆二色光谱扫描,波长范围为190~250nm。结果显示,胶原蛋白Rpn为0.10,三螺旋结构被破坏。
对比例2
1、按照如下步骤提取胶原:
(1)预处理:选取猪筋腱10kg,解冻后去除牛筋腱上的筋膜和脂肪,用切片机切成5mm的片状,清洗干净,液氮冷冻粉碎。
(2)消毒:取步骤(1)的猪筋腱10kg,加入浓度为1000ppm的次氯酸钠溶液50L,消毒2次,每次3h,然后用纯化水清洗至无余氯检出。
(3)泡胀:取步骤(2)的猪筋腱5kg,加入0.1%乳酸溶液100L,室温浸泡24h。
(4)过滤1:用50目的不锈钢滤网过滤除去乳酸溶液,得到泡胀猪筋腱。
(5)匀浆:向步骤(4)处理的泡胀猪筋腱中加入500L 0.1%乳酸溶液,用搅拌机匀浆60s,重复3次。
(6)过滤2:用150目的不锈钢滤网进行过滤,除去溶液中的大颗粒物质,收集滤液。
2、胶原蛋白的测定与表征
(1)双缩脲法检测滤液中的胶原蛋白含量
a.双缩脲试液配制:取硫酸铜1.5g,酒石酸钾钠6.0g,碘化钾5.0g,加水500mL溶解,边搅拌边加入10%氢氧化钠溶液300mL,用水稀释至1000mL,混匀,即得。
b.BSA对照溶液配制:精密称取血清白蛋白(牛)(BSA)对照品,加水溶解并制成每1mL含10mg的溶液。
c.标准曲线的制作:精密量取对照品溶液0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置具塞试管中,加水至1.0mL,再分别加入双缩脲试液4.0mL,立即混匀,室温放置30min,采用紫外-可见光分光光度法,在540nm的波长处测定吸光度,以对照品溶液0.0mL的管为空白。根据对照品溶液浓度与其相对应的吸光度制作得到标准曲线:
A=0.0468C-0.0084,
其中,A为吸光度,C为溶液浓度。
d.样品中胶原蛋白含量的测定:精密量取滤液适量,以0.1%的乳酸溶液为空白,方法同标准曲线操作方法相同,做3个平行,求出平均吸光度,代入标准曲线计算滤液中的蛋白质浓度,得率计算公式如下:
其中,Y为得率,C为滤液浓度,V为滤液体积,M为猪筋腱质量。
实验结果:样品的平均吸光度为0.235,代入标准曲线得到蛋白质浓度为5.2mg/mL,计算得率为24.1%。
(2)圆二色光谱图
用0.5%乳酸溶液将滤液稀释至0.2mg/mL。以0.5%乳酸溶液为溶剂空白,扣除背景后,对稀释后的样品进行圆二色光谱扫描,波长范围为190~250nm。结果显示,胶原蛋白Rpn为0.10,三螺旋结构被破坏。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种非变性Ι型胶原蛋白的快速制备方法
- 一种非变性Ⅱ型胶原蛋白的制备方法
