一种肺鳞癌免疫疗效预测的方法、系统及试剂盒
文献发布时间:2023-06-19 19:18:24
技术领域
本发明涉及医疗技术领域,具体涉及一种基于NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合应用于肺鳞癌免疫疗效预测的方法、系统及试剂盒。
背景技术
在我国,肺鳞癌总体发病人数相当多,在肺癌中处于第二的位置,约占肺癌患者的30%左右,仅次于肺腺癌。相较于肺腺癌,由于肺鳞癌病人很少有敏感基因突变,所以无法使用针对EGFR、ALK等基因的靶向药。但肺鳞癌通常肿瘤突变负荷较大,免疫治疗效果较好,所以免疫治疗早已被指南推荐作为晚期肺鳞癌一线治疗,譬如:PD-L1高表达者,采用免疫单药治疗,而PD-L1低表达或无表达者考虑采用化疗联合免疫治疗。此外,PD1/PD-L1免疫检查点抑制剂在其他肺鳞癌患者中适应症正在逐渐扩大,术前新辅助免疫治疗和术后辅助免疫治疗正在考虑纳入指南推荐使用。
现在肺鳞癌免疫疗法的主要判断指标是基于肿瘤突变负荷(TMB)方法。但是面对当前许多肺鳞癌患者免疫治疗用药无效的窘境, TMB方法预测免疫疗效的有效性有待进一步提高。所以,非常有必要开发出对肺鳞癌免疫疗效预测具有高有效性的预测方法,切实提高肺鳞癌患者的免疫治疗疗效,降低患者疾病痛苦和经济负担的关键。
发明内容
针对现有技术中存在的缺陷,本发明提供了一种肺鳞癌免疫治疗疗效预测性比较理想的基于NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合应用的肺鳞癌免疫治疗疗效的评估方法、系统及试剂盒。本发明首次将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合作为标志物组用于肺鳞癌免疫疗效的预测,提高了肺鳞癌免疫疗效预测的有效性。
本发明是这样实现的。
第一方面,本发明提供了一种将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合作为标志物组预测肺鳞癌免疫疗效的方法。
NLRC4主要感受细菌的鞭毛蛋白和III型分泌系统等成分,在正常情况下, NLRC4通过自抑制作用处于静息状态。只有当病原菌成分进入细胞内时,NLRC4才会被活化,从而产生免疫应答反应。当前,医学界已明确病原体与癌症发生、发展及抗癌治疗的疗效密切相关。有研究表明呼吸道微生物组群在肺鳞癌发生发展中可能存在动态变化,并可能通过炎症机制,免疫反应,代谢产物调节作用等多条途径参与肺鳞癌的发生与进展。与此同时,NOD1是一种胞浆内模式识别受体,在免疫反应中起关键作用,是介导机体识别胞内感染过程中发挥重要作用的固有免疫反应生物标记物之一。近年来,NOD1 已被证明可以调节癌症的进展,包括乳腺癌、肝细胞癌和结肠癌。ICOS是一种在激活的T细胞上表达的免疫检查点蛋白,是共刺激受体的一种,是潜在的免疫疗法生物标志物之一。NRP1是一种神经纤毛蛋白,在参与关键免疫功能的多种免疫细胞类型中表达,控制T细胞如何发育和免疫记忆的建立,阻断NRP1可能会让癌症患者获得持久的全身抗肿瘤免疫和长期缓解。VTCN1是一种T细胞激活抑制因子,在肺癌中存在VTCN1蛋白的表达,且不依赖肿瘤的分级和分期, VTCN1高表达往往意味着较差的预后。
但目前尚未有NLRC4,NOD1,ICOS,NRP1和 VTCN1基因编码的蛋白用于肺鳞癌免疫疗效预测的生物医学实践相关方面的报道。
一般来说,目前临床上想要采取免疫治疗策略时,都会先进行目前免疫治疗最为确定的 3 个标志物-TMB,MSI 和 PD-L1检测。但同时具备3 个标志物的患者比例仅为0.6%。此外,MSI 和 TMB似乎具有一定的相关性,83%的 MSI高的患者同时具有高 TMB,但是仅有16% 的高TMB患者具有高MSI。而高TMB的患者往往被认为可以从免疫治疗中获益,可尝试进行免疫疗法。2018 年,NCCN 指南(2019.v1)首次将 TMB 列入 NSCLC 患者的免疫治疗疗效预测标志物。但由于TMB 可被很多因素影响,包括不同瘤种,内在遗传/分子因素,肿瘤微环境改变,外界致癌原,不同检测方法和不同界值都可能造成 TMB 缺乏异质性,而使之不能作为准确的免疫疗效预测因子。换句话说,虽然TMB获批作为免疫疗效生物标志物,但由于Panel设计、算法、评判TMB高低的cut-off值都缺乏标准,不同临床试验采取不同检测机构提供的TMB检测结果不具有可比性,临床应用必须基于临床性能验证和前瞻性研究结果数据。
与此同时,围绕单一生物标志物做测序研究并试图预测免疫治疗效果,是当前主流免疫疗效预测生物标志物产品普遍采用的设计思路。虽然经过持续迭代的单一生物标志物测序产品能够在一定程度上区分获益人群,但是无论是使用哪个生物标志物都存在较高假阳性率和假阴性率的缺陷。换言之,现有免疫治疗预测方式存在挑选出的高水平患者对免疫治疗不响应,而有些低水平的患者反而对免疫治疗有响应的困境。本发明创造性地将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合作为标志物组,用于到肺鳞癌免疫疗效预测,大大提高了肺鳞癌免疫疗效预测的有效性。在本发明中,所述NLRC4,NOD1,ICOS,NRP1和VTCN1标志物的检测指标为血浆,血清,血浆囊泡,组织或组织细胞的表达量。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型1为:R1=A1×R(NLRC4)+B1×R(NOD1)+C1×R(ICOS)+D1×R(NRP1) +E1×R(VTCN1)-F1×R(TMB);其中,A1取值为0.9-0.8,B1取值为0.8-0.7,C1取值为0.7-0.6,D1取值为0.6-0.5,E1取值为0.5-0.4,F1取值为0.6-0.5,R1为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A1的取值可以是0.8和0.81之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.81、0. 82、0.83、0.8 4、0.85、0.86、0.87、0.88和0.89中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.89和0.9之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.59和0.6之间的范围。
进一步地,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断: 5.3<R1<15.2,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型2为: R2=A2×R(NLRC4)+C2×R(ICOS)+ E2×R(VTCN1)-B2×R(NOD1)-D2×R(NRP1)-F2×R(TMB);其中,A2取值为0.8-0.7,B2取值为0.7-0.6,C2取值为0.6-0.5,D2取值为0.5-0.4,E2取值为0.4-0.3,F2取值为0.5-0.4,R2为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A2的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.49和0.5之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -16.7<R2<0.85,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型3为:R3= F3×R(TMB)-A3×R(NLRC4)-B3×R(NOD1)-C3×R(ICOS)-D3×R(NRP1)-E3×R(VTCN1);其中,A3取值为0.7-0.6,B3取值为0.6-0.5,C3取值为0.5-0.4,D3取值为0.4-0.3,E3取值为0.3-0.2,F3取值为0.2-0.3,R3为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A3的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.29和0.3之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.29和0.3之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -10.7<R3<2.53,则判断所述肺鳞癌患者可以进行免疫治疗。
在上述三个模型中, R(NLRC4)代表受试者NLRC4的表达量相对于人体正常表达量的比值,R(NOD1)代表受试者NOD1的表达量相对于人体正常表达量的比值,R(ICOS)代表受试者ICOS的表达量相对于人体正常表达量的比值,R(NRP1)代表受试者NRP1的表达量相对于人体正常表达量的比值,R(VTCN1)代表受试者VTCN1的表达量相对于人体正常表达量的比值,R(TMB)代表受试者TMB值相对于10Mut/Mb的比值。
可选地,在一些实施方案中,所述检测试剂包括但不限于适用于如下任意一种方法以实现所述标志物组的检测:全外显子测序、靶向测序 panel、单分子阵列法、酶联免疫、胶体金、实时荧光定量聚合酶链式反应(PCR)、Western blotting、电化学发光和量子点技术方法。
进一步地,以实时荧光定量PCR法对NLRC4表达量进行检测的步骤如下:首先设计NLRC4的上游引物: 5´-TGCCGTAGTAGACTGTGTTGGCA-3´(Seq_1); 下游引物: 5´-CTACAATCGGCGTCCTTGAAGTT-3´(Seq_2)。所采用的PCR反应体系为: 10微升由1微克 RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM) ,1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为: 第一步,在95摄氏度预变性30秒,再于95摄氏度变性5秒,循环40次;第二步,在 60摄氏度退火30秒;第三步,在95摄氏度延伸5秒,循环40次;第四步,在60摄氏度再延伸1分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用t 检验。以P小于0.05 为差异有统计学意义。
进一步地,NLRC4表达量的Western blotting法进行检测的步骤如下:准备样品,加入 5微升 4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。95摄氏度煮沸 10分钟,使蛋白样品变性。电转移结束后,剪膜、封闭 60 分钟。1×TBST 洗膜 5分钟;用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3次×10分钟;将 PVDF 膜与 HRP 偶联的二抗,室温下孵育 60 分钟,TBST 洗膜 3 次×10分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测NLRC4的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
进一步地,以实时荧光定量PCR法对NOD1表达量进行检测的步骤如下:首先设计NOD1的上游引物: 5´- GATCTGGTCTTAACCGCTCTC -3´(Seq_3); 下游引物: 5´-GGGAGTAGGATGGCTTGAGGG -3´(Seq_4)。所采用的PCR反应体系为: 12微升经变性处理的RNA溶液,2微升dNTP混合物,1微升RNA酶抑制剂 (10 U/微升),4微升5×RT Buffer,1微升Rever Tra Ace,总体积为20微升。PCR反应程序为: 第一步,在100摄氏度预变性1分钟,再于90摄氏度变性120秒;第二步,在 75摄氏度退火30秒;第三步,在75摄氏度延伸30秒,循环40次;第四步,在90摄氏度再延伸2分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NOD1相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义。
进一步地,NOD1表达量的Western blotting法进行检测的步骤如下:制备十二烷基硫酸钠-聚丙烯酰胺凝胶,样本上样后进行电泳分离,转膜、封闭后,先后加入一抗、二抗进行孵育,增强化学发光法 ( ECL) 检测 NOD1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
进一步地,以实时荧光定量PCR法对ICOS表达量进行检测的步骤如下:首先设计ICOS的上游引物: 5´- ATCTAATCGGTATGCCAGAAAAGTCAAA -3´(Seq_5); 下游引物: 5´-ACTACGCTAGCAGCTCTCACAATCAGTC -3´(Seq_6)。所采用的PCR反应体系为: 10微升由1微克RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM),1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为: 第一步,在94摄氏度预变性120秒,再于94摄氏度变性30秒;第二步,在 60摄氏度退火30秒;第三步,在72摄氏度延伸30秒,循环35次;第四步,在72摄氏度再延伸7分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS 19.0统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义。
进一步地,ICOS表达量的Western blotting法进行检测的步骤如下:准备样品,加入 5微升 4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。90摄氏度煮沸8分钟,使蛋白样品变性。电转移结束后,剪膜、封闭 90 分钟。1×TBST 洗膜 10分钟; 用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3 次×10分钟;将 PVDF 膜与 HRP 偶联的二抗,室温下孵育 90 分钟,TBST 洗膜 3 次×10 分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测NLRC4的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
进一步地,以实时荧光定量PCR法对NRP1表达量进行检测的步骤如下:首先设计NRP1的上游引物: 5´-GCCGCTGTCTGGGTACCGATG-3´(Seq_7); 下游引物: 5´-AATGAGTGTGTGTGCAGAGCA-3´(Seq_8)。所采用的PCR反应体系为: 12微升经变性处理的RNA溶液,2微升dNTP混合物,1微升RNA酶抑制剂 (10 U/微升),4微升5×RT Buffer,1微升Rever Tra Ace,总体积为20微升。PCR反应程序为: 第一步,在95摄氏度预变性3分钟,再于95摄氏度变性20秒;第二步,在 60摄氏度退火30秒;第三步,在75摄氏度延伸35秒,循环40次;第四步,在75摄氏度再延伸10分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NRP1相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义。
进一步地,NRP1表达量的Western blotting法进行检测的步骤如下:制备十二烷基硫酸钠-聚丙烯酰胺凝胶,样本上样后进行电泳分离,转膜、封闭后,先后加入一抗、二抗进行孵育,增强化学发光法 ( ECL) 检测 NRP1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
进一步地,以实时荧光定量PCR法对VTCN1表达量进行检测的步骤如下:首先设计VTCN1的上游引物: 5´-AGGCGGTGACTTACAGAGCCCTT-3´(Seq_9); 下游引物: 5´-TCTGATGGGTCACTTCGCTTCCA-3´(Seq_10)。所采用的PCR反应体系为: 10微升由1微克 RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM) ,1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为:第一步,在95摄氏度预变性180秒,再于95摄氏度变性30秒;第二步,在 58摄氏度退火35秒;第三步,在72摄氏度延伸40秒,循环40次;第四步,在72摄氏度再延伸10分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义。
进一步地,VTCN1表达量的Western blotting法进行检测的步骤如下:准备样品,加入 5微升 4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。94摄氏度煮沸10分钟,使蛋白样品变性。电转移结束后,剪膜、封闭75 分钟。1×TBST 洗膜 5分钟; 用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3 次×10分钟;将 PVDF 膜与 HRP 偶联的二抗,室温下孵育 75 分钟,TBST 洗膜 3 次×10 分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测VTCN1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
第二方面,本发明提供了一种用于肺鳞癌患者免疫疗效预测的系统。
所述系统包括检测信息模块、预测模块和结果报告模块。
进一步地,所述检测信息模块用于执行获取受试者检测信息;所述检测信息包括NLRC4,NOD1,ICOS,NRP1及VTCN1的表达量和受试者TMB检测值。
进一步地,所述预测模块用于执行上述所述检测信息代入计算模型进行相关阈值的数据处理操作。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型1为:R1=A1×R(NLRC4)+B1×R(NOD1)+C1×R(ICOS)+D1×R(NRP1) +E1×R(VTCN1)-F1×R(TMB);其中,A取值为0.9-0.8,B取值为0.8-0.7,C取值为0.7-0.6,D取值为0.6-0.5,E取值为0.5-0.4,F取值为0.6-0.5,R1为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A1的取值可以是0.8和0.81之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.81、0. 82、0.83、0.8 4、0.85、0.86、0.87、0.88和0.89中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.89和0.9之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.59和0.6之间的范围。
进一步地,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断: 5.3<R1<15.2,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型2为: R2=A2×R(NLRC4)+C2×R(ICOS)+ E2×R(VTCN1)-B2×R(NOD1)-D2×R(NRP1)-F2×R(TMB);其中,A2取值为0.8-0.7,B2取值为0.7-0.6,C2取值为0.6-0.5,D2取值为0.5-0.4,E2取值为0.4-0.3,F2取值为0.5-0.4,R2为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A2的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.49和0.5之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -16.7<R2<0.85,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型3为:R3= F3×R(TMB)-A3×R(NLRC4)-B3×R(NOD1)-C3×R(ICOS)-D3×R(NRP1)-E3×R(VTCN1);其中,A3取值为0.7-0.6,B3取值为0.6-0.5,C3取值为0.5-0.4,D3取值为0.4-0.3,E3取值为0.3-0.2,F3取值为0.2-0.3,R3为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A3的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.29和0.3之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.29和0.3之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -10.7<R3<2.53,则判断所述肺鳞癌患者可以进行免疫治疗。
在上述三个模型中, R(NLRC4)代表受试者NLRC4的表达量相对于人体正常表达量的比值,R(NOD1)代表受试者NOD1的表达量相对于人体正常表达量的比值,R(ICOS)代表受试者ICOS的表达量相对于人体正常表达量的比值,R(NRP1)代表受试者NRP1的表达量相对于人体正常表达量的比值,R(VTCN1)代表受试者VTCN1的表达量相对于人体正常表达量的比值,R(TMB)代表受试者TMB值相对于10Mut/Mb的比值。
可选地,在一些实施方案中,所述结果报告模块可以通过屏幕显示、声音播报或打印的方式显示肺鳞癌患者免疫疗效预测的结果。
第三方面,本发明提供了一种肺鳞癌患者免疫疗效预测的试剂盒,所述试剂盒包括NLRC4,NOD1,ICOS,NRP1,VTCN1及TMB的检测试剂。
可选地,在一些实施方案中,所述试剂盒包括使用说明书,所述使用说明书记载有肺鳞癌患者免疫疗效预测的模型。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型1为:R1=A1×R(NLRC4)+B1×R(NOD1)+C1×R(ICOS)+D1×R(NRP1) +E1×R(VTCN1)-F1×R(TMB);其中,A取值为0.9-0.8,B取值为0.8-0.7,C取值为0.7-0.6,D取值为0.6-0.5,E取值为0.5-0.4,F取值为0.6-0.5,R1为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A1的取值可以是0.8和0.81之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.81、0. 82、0.83、0.8 4、0.85、0.86、0.87、0.88和0.89中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A1的取值可以是0.89和0.9之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B1的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C1的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D1的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E1的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F1的取值可以是0.59和0.6之间的范围。
进一步地,当所述肺鳞癌患者TMB指标小于5Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断: 5.3<R1<15.2,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型2为: R2=A2×R(NLRC4)+C2×R(ICOS)+ E2×R(VTCN1)-B2×R(NOD1)-D2×R(NRP1)-F2×R(TMB);其中,A2取值为0.8-0.7,B2取值为0.7-0.6,C2取值为0.6-0.5,D2取值为0.5-0.4,E2取值为0.4-0.3,F2取值为0.5-0.4,R2为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A2的取值可以是0.70和0.71之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78和0.79中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A2的取值可以是0.79和0.8之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B2的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C2的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D2的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E2的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F2的取值可以是0.49和0.5之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于等于5Mut/Mb,但小于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -16.7<R2<0.85,则判断所述肺鳞癌患者可以进行免疫治疗。
可选地,在一些实施方案中,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则所述方法中肺鳞癌免疫疗效预测的模型3为:R3= F3×R(TMB)-A3×R(NLRC4)-B3×R(NOD1)-C3×R(ICOS)-D3×R(NRP1)-E3×R(VTCN1);其中,A3取值为0.7-0.6,B3取值为0.6-0.5,C3取值为0.5-0.4,D3取值为0.4-0.3,E3取值为0.3-0.2,F3取值为0.2-0.3,R3为肺鳞癌患者免疫治疗阈值。
进一步地,在一些实施方案中,A3的取值可以是0.60和0.61之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68和0.69中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,A3的取值可以是0.69和0.7之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.50和0.51之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58和0.59中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,B3的取值可以是0.59和0.6之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.40和0.41之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48和0.49中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,C3的取值可以是0.49和0.5之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.30和0.31之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.31、0.32、0.33、0.34、0.35、0.36、0.37、0.38和0.39中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,D3的取值可以是0.39和0.4之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,E3的取值可以是0.29和0.3之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.20和0.21之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28和0.29中的任意一者或任意两者之间的范围。
进一步地,在一些实施方案中,F3的取值可以是0.29和0.3之间的范围。
进一步地,当所述肺鳞癌患者TMB指标大于20 Mut/Mb,则肺鳞癌患者免疫疗效预测按如下条件进行判断:若 -10.7<R3<2.53,则判断所述肺鳞癌患者可以进行免疫治疗。
在上述三个模型中,R(NLRC4)代表受试者NLRC4的表达量相对于人体正常表达量的比值,R(NOD1)代表受试者NOD1的表达量相对于人体正常表达量的比值,R(ICOS)代表受试者ICOS的表达量相对于人体正常表达量的比值,R(NRP1)代表受试者NRP1的表达量相对于人体正常表达量的比值,R(VTCN1)代表受试者VTCN1的表达量相对于人体正常表达量的比值,R(TMB)代表受试者TMB值相对于10Mut/Mb的比值。
附图说明
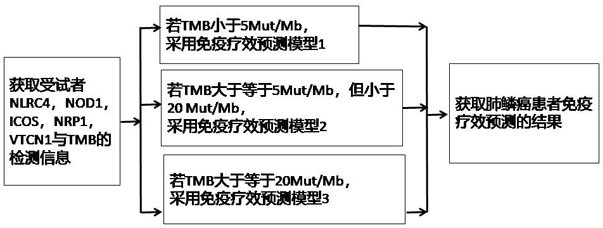
图1是本发明的肺鳞癌免疫疗效预测流程图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。图1是本发明的肺鳞癌免疫疗效预测流程图。
以下结合实施例对本发明的特征和性能作进一步的详细描述。本发明中所有用于研究分析的临床数据的获取征得受试者知情,同意和授权,符合伦理要求。
实施例1 NLRC4在肺鳞癌患者免疫疗治疗有效和无效个体之间的表达差异检测
NLRC4由不同的检测方法均可以检测肺鳞癌患者免疫疗治疗有效,无效个体及健康人之间的表达差异(各100位);通过实时荧光定量PCR法检测NLRC4表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是0.52±0.06,无效患者的平均值是1.14±0.19,两组统计学检验的p值小于0.0001。健康个体的平均值是1.31±0.24,肺鳞癌患者组和健康个体组统计学检验的p值小于0.0001;
通过Western blotting 法检测NLRC4表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是0.43±0.04,无效患者的平均值是1.05±0.11,两组统计学检验的p值小于0.0001。健康个体的平均值是1.33±0.28,肺鳞癌患者有效,无效个体和健康个体组统计学检验的p值小于0.0001;
不同的检测方法,均体现了NLRC4在肺鳞癌患者免疫疗治疗有效和无效个体间存在表达差异。
实施例2 NOD1在肺鳞癌患者免疫疗治疗有效和无效个体之间的表达差异检测
NOD1由不同的检测方法均可以检测肺鳞癌患者免疫疗治疗有效,无效个体及健康人之间的表达差异(各100位);通过实时荧光定量PCR法检测NOD1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是1.23±0.13,无效患者的平均值是0.29±0.05,两组统计学检验的p值小于0.0001。健康个体的平均值是0.23±0.04,肺鳞癌患者组和健康个体组统计学检验的p值小于0.0001;
通过Western blotting 法检测NOD1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是0.43±0.04,无效患者的平均值是1.05±0.11,两组统计学检验的p值小于0.0001。健康个体的平均值是1.33±0.28,肺鳞癌患者有效,无效个体和健康个体组统计学检验的p值小于0.0001;
不同的检测方法,均体现了NOD1在肺鳞癌患者免疫疗治疗有效和无效个体间存在表达差异。
实施例3 ICOS在肺鳞癌患者免疫疗治疗有效和无效个体之间的表达差异检测
ICOS由不同的检测方法均可以检测肺鳞癌患者免疫疗治疗有效,无效个体及健康人之间的表达差异(各100位);通过实时荧光定量PCR法检测ICOS表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是1.07±0.09,无效患者的平均值是2.45±0.13,两组统计学检验的p值小于0.0001。健康个体的平均值是2.51±0.19,肺鳞癌患者组和健康个体组统计学检验的p值小于0.0001;
通过Western blotting 法检测ICOS表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是0.98±0.06,无效患者的平均值是2.37±0.11,两组统计学检验的p值小于0.0001。健康个体的平均值是2.43±0.14,肺鳞癌患者有效,无效个体和健康个体组统计学检验的p值小于0.0001;
不同的检测方法,均体现了ICOS在肺鳞癌患者免疫疗治疗有效和无效个体间存在表达差异。
实施例4 NRP1在肺鳞癌患者免疫疗治疗有效和无效个体之间的表达差异检测
NRP1由不同的检测方法均可以检测肺鳞癌患者免疫疗治疗有效,无效个体及健康人之间的表达差异(各100位);通过实时荧光定量PCR法检测NRP1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是4.60±0.71,无效患者的平均值是1.21±0.12,两组统计学检验的p值小于0.0001。健康个体的平均值是1.03±0.10,肺鳞癌患者组和健康个体组统计学检验的p值小于0.0001;
通过Western blotting 法检测NRP1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是4.73±0.66,无效患者的平均值是1.37±0.25,两组统计学检验的p值小于0.0001。健康个体的平均值是1.12±0.10,肺鳞癌患者有效,无效个体和健康个体组统计学检验的p值小于0.0001;
不同的检测方法,均体现了NRP1在肺鳞癌患者免疫疗治疗有效和无效个体间存在表达差异。
实施例5 VTCN1在肺鳞癌患者免疫疗治疗有效和无效个体之间的表达差异检测
VTCN1由不同的检测方法均可以检测肺鳞癌患者免疫疗治疗有效,无效个体及健康人之间的表达差异(各100位);通过实时荧光定量PCR法检测VTCN1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是2.39±0.13,无效患者的平均值是1.17±0.09,两组统计学检验的p值小于0.0001。健康个体的平均值是1.07±0.05,肺鳞癌患者组和健康个体组统计学检验的p值小于0.0001;
通过Western blotting 法检测VTCN1表达量,结果表明:肺鳞癌患者免疫疗治疗有效的表达量平均值是4.73±0.66,无效患者的平均值是1.37±0.25,两组统计学检验的p值小于0.0001。健康个体的平均值是1.12±0.10,肺鳞癌患者有效,无效个体和健康个体组统计学检验的p值小于0.0001;
不同的检测方法,均体现了VTCN1在肺鳞癌患者免疫疗治疗有效和无效个体间存在表达差异。
实施例6 NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合用于肺鳞癌患者免疫疗效的预测
入组600名肺鳞癌患者。入组标准为TMB小于5Mut/Mb。用实时荧光定量PCR法对上述600名患者血浆中NLRC4,NOD1,ICOS,NRP1,VTCN1检测并结合TMB数值代入肺鳞癌患者免疫疗效预测的模型1为:R1=A1×R(NLRC4)+B1×R(NOD1)+C1×R(ICOS)+D1×R(NRP1) +E1×R(VTCN1)-F1×R(TMB);其中,A取值为0.9-0.8,B取值为0.8-0.7,C取值为0.7-0.6,D取值为0.6-0.5,E取值为0.5-0.4,F取值为0.6-0.5,R1为肺鳞癌患者免疫治疗阈值;预测方式:若5.3<R1<15.2,则判断所述肺鳞癌患者免疫治疗有效。
根据600个模型结果的R1是否在对应区间,给出符合入组标准的患者可以进行免疫治疗的结果。根据肺鳞癌诊疗指南,对600名患者进行随访至有明确的临床治疗结果。将临床治疗结果与肺鳞癌患者免疫疗效预测模型结果比较,结果表明:单独NLRC4对肺鳞癌患者免疫疗效预测的有效性为35.5%;单独NOD1对肺鳞癌患者免疫疗效预测的的有效性为36.3%;单独ICOS对肺鳞癌患者免疫疗效预测的有效性为42.9%;单独VTCN 1对肺鳞癌患者免疫疗效预测的有效性为35.6%;单独NRP1对肺鳞癌患者免疫疗效预测的有效性为43.0%;将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合,对肺鳞癌患者免疫疗效预测的有效性为93.3%。
实施例7 NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合用于肺鳞癌患者免疫疗效的预测
入组600名肺鳞癌患者。入组标准为TMB大于等于5Mut/Mb,但小于20 Mut/Mb。用实时荧光定量PCR法对上述600名患者血浆中NLRC4,NOD1,ICOS,NRP1,VTCN1检测并结合TMB数值代入肺鳞癌患者免疫疗效预测的模型2为: R2=A2×R(NLRC4)+C2×R(ICOS)+ E2×R(VTCN1)-B2×R(NOD1)-D2×R(NRP1)-F2×R(TMB);其中,A2取值为0.8-0.7,B2取值为0.7-0.6,C2取值为0.6-0.5,D2取值为0.5-0.4,E2取值为0.4-0.3,F2取值为0.5-0.4,R2为肺鳞癌患者免疫治疗阈值;预测方式:若 -16.7<R2<0.85,则判断所述肺鳞癌患者免疫治疗有效。
根据600个模型结果的R1是否在对应区间,给出符合入组标准的患者可以进行免疫治疗的结果。根据肺鳞癌诊疗指南,对600名患者进行随访至有明确的临床治疗结果。将临床治疗结果与肺鳞癌患者免疫疗效预测模型结果比较,结果表明:单独NLRC4对肺鳞癌患者免疫疗效预测的有效性为30.9%;单独NOD1对肺鳞癌患者免疫疗效预测的的有效性为40.1%;单独ICOS对肺鳞癌患者免疫疗效预测的有效性为35.2%;单独NRP1对肺鳞癌患者免疫疗效预测的有效性为31.7%;单独VTCN 1对肺鳞癌患者免疫疗效预测的有效性为38.5%;将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合,对肺鳞癌患者免疫疗效预测的有效性为90.7%。
实施例8 NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合用于肺鳞癌患者免疫疗效的预测
入组600名肺鳞癌患者。入组标准为TMB大于20 Mut/Mb。用实时荧光定量PCR法对上述600名患者血浆中NLRC4,NOD1,ICOS,NRP1,VTCN1检测并结合TMB数值代入肺鳞癌患者免疫疗效预测的模型3为: R3= F3×R(TMB)-A3×R(NLRC4)-B3×R(NOD1)-C3×R(ICOS)-D3×R(NRP1)-E3×R(VTCN1);其中,A3取值为0.7-0.6,B3取值为0.6-0.5,C3取值为0.5-0.4,D3取值为0.4-0.3,E3取值为0.3-0.2,F3取值为0.2-0.3,R3为肺鳞癌患者免疫治疗阈值;预测方式:若-10.7<R3<2.53,则判断所述肺鳞癌患者免疫治疗有效。
根据600个模型结果的R3是否在对应区间,给出符合入组标准的患者可以进行免疫治疗的结果。根据肺鳞癌诊疗指南,对600名患者进行随访至有明确的临床治疗结果。将临床治疗结果与肺鳞癌患者免疫疗效预测模型结果比较,结果表明:单独NLRC4对肺鳞癌患者免疫疗效预测的有效性为34.2%;单独NOD1对肺鳞癌患者免疫疗效预测的的有效性为30.8%;单独ICOS对肺鳞癌患者免疫疗效预测的有效性为43.1%;单独NRP1对肺鳞癌患者免疫疗效预测的有效性为38.1%;单独VTCN 1对肺鳞癌患者免疫疗效预测的有效性为42.6%;将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB 联合,对肺鳞癌患者免疫疗效预测的有效性为94.2%。
对比例1 用于预测肺鳞癌患者免疫疗效的标志物组
现有文献1(用于预测肺鳞癌患者免疫疗效的标志物组,专利申请号202210448091X,授权公告号:CN 114540504 B)通过长链非编码RNA RP5-1091N2.9、CD48、P2RY10、CD2、CTSS、GMFG和HLA-DMB组成的联合标志物,指导临床用药,建立合理的联合治疗方案。对30名患者的后期临床追踪反馈,通过模型推荐免疫治疗的两个患者的免疫治疗效果均好于其他28个患者。由于入组人数少,该文献未进行模型实践有效性检测。
对比例2 基于基因表达情况的肺鳞癌免疫治疗疗效预测模型及其构建方法和应用
现有文献2(基于基因表达情况的肺鳞癌免疫治疗疗效预测模型及其构建方法和应用;专利申请号 202210018337X,申请公布号:CN 114574578 A)采用括AKAP2、NANOG、TMEM236、NTSR1、LRRC38、GCGR、MARCO、PF4、RP1、ALOX5- 24、FCGR2A、KCNQ3、NLRP12、SCARF1、SIGLEC12、TGM2和VSTM1等17种基因,对肺鳞癌免疫治疗进行评价。但没有进行该方法实践有效性验证。
对比例3一种用于评估实体瘤临床预后或免疫特征的试剂盒
现有文献3(一种用于评估实体瘤临床预后或免疫特征 的试剂盒;专利申请号:201910036329.6;申请公布号:CN 109652546 B)根据基于ASMT/ CYP1B1的比值水平评估实体瘤(包括肺鳞癌)临床预后或免疫特征的试剂盒。但没有进行该方法实践有效性验证。
综上,无论是长链非编码RNA RP5-1091N2.9、CD48、P2RY10、CD2、CTSS、GMFG和HLA-DMB组成的联合标志物,还是17种基因联合,以及ASMT/ CYP1B1的比值水平都无法给出肺鳞癌免疫疗效预测的实践有效性。此外,现有技术方案中没有针对基因表达量和TMB联合预测肺鳞癌免疫疗效的方法、系统和试剂盒,从而影响肺鳞癌免疫疗效预测的完善性。
通过上述实施例和对比例,可以看出,本发明首次将NLRC4,NOD1,ICOS,NRP1,VTCN1与TMB联合,实现了肺鳞癌免疫疗效地有效预测,从而可以更好地实现临床上对肺鳞癌患者的用药,减少副作用,并确定免疫疗效,指导免疫治疗,避免不必要的免疫治疗,建立合理的联合治疗方案。由于预测模型的实践有效性大于90%,所以本发明大大地提高了肺鳞癌患者的免疫疗效有效性预测,具有比较理想的免疫治疗方案实施准确度。
本发明中的NLRC4,NOD1,ICOS,NRP1和VTCN1表达量检测可以通过实时荧光定量PCR法和Western blotting 法实现,确保临床有可选的方法对肺鳞癌患者个人进行免疫治疗方案实施的有效性结果进行验证。
上述实施例中NLRC4,NOD1,ICOS,NRP1和VTCN1表达量检测中的血浆样本处理可以参考如下步骤进行:
第一步,用抗凝真空采血管(10毫升)进行采血,每个样本采集1管,共10毫升。血样采集后立即将采血管轻轻颠倒混匀 8-10次,保证抗凝剂与血液充分混匀(拖延颠倒混匀时间可能会造成检测失败),混匀后将采血管直立放置于试管架。采集的全血样本存储于15-35摄氏度;
第二步,将样本在以3000×g,4摄氏度离心15分钟,使血浆和血细胞分离;
第三步,将血浆以12000×g,4摄氏度离心10分钟,从上层取约1.8毫升血浆;
第四步,将第三步中1.8毫升血浆加入2.2毫升磷酸缓冲液至4毫升,以100000×g,4摄氏度离心60分钟,去除上层约3.6毫升溶液,并加入1毫升磷酸缓冲液将离心管底部沉淀重悬;
第五步,将重悬后的溶液再次以100000×g,4摄氏度离心60分钟,去除上层溶液只保留沉淀,并加入200微升磷酸缓冲液将离心管底部沉淀重悬;
第六步,向第五步中获得的沉淀溶液中加入200微升的RIPA裂解液,并用移液器吹洗混匀溶液并将装有溶液的离心管放置于冰上15分钟进行TNFRSF13B的提取;
第七步,提取后的溶液以10000×g,4摄氏度离心15分钟后保留上层溶液。将上层溶液可以直接用于分析或长期保存于-80摄氏度冰箱;
第八步,以实时荧光定量PCR法和Western blotting法对NLRC4,NOD1,ICOS,NRP1和VTCN1表达量进行检测;
第九步,以实时荧光定量PCR法对NLRC4表达量进行检测的步骤如下:首先设计NLRC4的上游引物: 5´-TGCCGTAGTAGACTGTGTTGGCA-3´(Seq_1); 下游引物: 5´-CTACAATCGGCGTCCTTGAAGTT-3´(Seq_2)。所采用的PCR反应体系为: 10微升由1微克 RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM) ,1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为: 第一步,在95摄氏度预变性30秒,再于95摄氏度变性5秒,循环40次;第二步,在 60摄氏度退火30秒;第三步,在95摄氏度延伸5秒,循环40次;第四步,在60摄氏度再延伸1分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用t 检验。以P小于0.05 为差异有统计学意义;
第十步,以实时荧光定量PCR法对NOD1表达量进行检测的步骤如下:首先设计NOD1的上游引物: 5´- GATCTGGTCTTAACCGCTCTC -3´(Seq_3); 下游引物: 5´-GGGAGTAGGATGGCTTGAGGG -3´(Seq_4)。所采用的PCR反应体系为: 12微升经变性处理的RNA溶液,2微升dNTP混合物,1微升RNA酶抑制剂 (10 U/微升),4微升5×RT Buffer,1微升Rever Tra Ace,总体积为20微升。PCR反应程序为: 第一步,在100摄氏度预变性1分钟,再于90摄氏度变性120秒;第二步,在 75摄氏度退火30秒;第三步,在75摄氏度延伸30秒,循环40次;第四步,在90摄氏度再延伸2分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NOD1相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义;
第十一步,以实时荧光定量PCR法对ICOS表达量进行检测的步骤如下:首先设计ICOS的上游引物: 5´- ATCTAATCGGTATGCCAGAAAAGTCAAA -3´(Seq_5); 下游引物: 5´-ACTACGCTAGCAGCTCTCACAATCAGTC -3´(Seq_6)。所采用的PCR反应体系为: 10微升由1微克RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM),1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为: 第一步,在94摄氏度预变性120秒,再于94摄氏度变性30秒;第二步,在 60摄氏度退火30秒;第三步,在72摄氏度延伸30秒,循环35次;第四步,在72摄氏度再延伸7分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS 19.0统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义;
第十二步,以实时荧光定量PCR法对NRP1表达量进行检测的步骤如下:首先设计NRP1的上游引物: 5´-GCCGCTGTCTGGGTACCGATG-3´(Seq_7); 下游引物: 5´-AATGAGTGTGTGTGCAGAGCA-3´(Seq_8)。所采用的PCR反应体系为: 12微升经变性处理的RNA溶液,2微升dNTP混合物,1微升RNA酶抑制剂 (10 U/微升),4微升5×RT Buffer,1微升Rever Tra Ace,总体积为20微升。PCR反应程序为: 第一步,在95摄氏度预变性3分钟,再于95摄氏度变性20秒;第二步,在 60摄氏度退火30秒;第三步,在75摄氏度延伸35秒,循环40次;第四步,在75摄氏度再延伸10分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NRP1相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义;
第十三步,以实时荧光定量PCR法对VTCN1表达量进行检测的步骤如下:首先设计VTCN1的上游引物: 5´-AGGCGGTGACTTACAGAGCCCTT-3´(Seq_9); 下游引物: 5´-TCTGATGGGTCACTTCGCTTCCA-3´(Seq_10)。所采用的PCR反应体系为: 10微升由1微克 RNA和DEPC 水组成的RNA溶液,2微升10✕RT Buffer 2.0,0.8微升25✕dNTP Mix (100 mM) ,1微升MultiScribe™ Reverse Transcriptase,4.2微升Nuclease-free H2O。PCR反应程序为:第一步,在95摄氏度预变性180秒,再于95摄氏度变性30秒;第二步,在 58摄氏度退火35秒;第三步,在72摄氏度延伸40秒,循环40次;第四步,在72摄氏度再延伸10分钟;第五步,在4摄氏度保存。通过双ΔCt 法计算NLRC4相对表达量,实验重复5 次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以P小于0.05 为差异有统计学意义。
此外,NLRC4表达量的Western blotting法进行检测的步骤如下:准备样品,加入5微升 4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。95摄氏度煮沸 10分钟,使蛋白样品变性。电转移结束后,剪膜、封闭 60 分钟。1×TBST 洗膜 5分钟; 用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3 次×10分钟;将 PVDF 膜与 HRP 偶联的二抗,室温下孵育 60 分钟,TBST 洗膜 3 次×10 分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测NLRC4的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
另,NOD1表达量的Western blotting法进行检测的步骤如下:制备十二烷基硫酸钠-聚丙烯酰胺凝胶,样本上样后进行电泳分离,转膜、封闭后,先后加入一抗、二抗进行孵育,增强化学发光法 ( ECL) 检测 NOD1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
ICOS表达量的Western blotting法进行检测的步骤如下:准备样品,加入 5微升4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。90摄氏度煮沸8分钟,使蛋白样品变性。电转移结束后,剪膜、封闭 90 分钟。1×TBST 洗膜 10分钟; 用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3 次×10分钟;将PVDF 膜与 HRP 偶联的二抗,室温下孵育 90 分钟,TBST 洗膜 3 次×10 分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测NLRC4的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
NRP1表达量的Western blotting法进行检测的步骤如下:制备十二烷基硫酸钠-聚丙烯酰胺凝胶,样本上样后进行电泳分离,转膜、封闭后,先后加入一抗、二抗进行孵育,增强化学发光法 ( ECL) 检测 NRP1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
VTCN1表达量的Western blotting法进行检测的步骤如下:准备样品,加入 5微升4×上样缓冲液,剩余体积以 RIPA 补齐,构建 20 微升上样体系。94摄氏度煮沸10分钟,使蛋白样品变性。电转移结束后,剪膜、封闭75 分钟。1×TBST 洗膜 5分钟; 用特异性一抗孵育 PVDF 膜,4摄氏度过夜;PVDF 膜用 l×TBST 室温摇床上轻摇洗涤 3 次×10分钟;将PVDF 膜与 HRP 偶联的二抗,室温下孵育 75 分钟,TBST 洗膜 3 次×10 分钟;发光显影液覆盖于 PVDF 膜表面,然后使用 Tanon 化学发光显示系统对膜进行曝光显影。增强化学发光法 ( ECL) 检测VTCN1的表达,最后采用 Image J 软件扫描所得胶片的灰度值。实验重复5次。使用 SPSS 19.0 统计软件行统计学分析,相对表达量以(x±R)表示。样本组和参比组两组间比较采用 t 检验。以 P小于0.05 为差异有统计学意义。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种免疫层析用封闭剂组合物、用途、及免疫层析试剂盒的制备方法
- 用于预测肺鳞癌患者免疫疗效的标志物组及系统
- 用于预测肺鳞癌患者免疫疗效的标志物组及系统
