一种用于递送难溶性药物的载酶微针制剂及制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于透皮微针制剂技术领域,具体涉及一种用于递送难溶性药物的载酶微针制剂及所述载酶微针制剂的制备方法。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
相对于口服、注射等给药方式,透皮给药具有诸多优势,例如:避免首过效应、维持恒定的有效血药浓度,降低毒副反应、给药方便等诸多优势,然而皮肤组织中角质层由于其特殊的砖泥结构,阻碍了难溶性药物的经皮渗透,仅一些具有特殊性质的药物能够透过皮肤,这极大的限制了透皮领域的发展。可溶性微针给药系统是一种通过刺破角质层,制备微米级给药通道将药物输送至皮下的给药方式,是一种优良的经皮给药方式,具有多种优点:①绕过角质层,并在皮肤中产生微孔道,增强药物的皮肤渗透;②无痛,增强患者适应性;③具有生物相容性、优异的生物降解性和足够的载药能力。然而可溶性MNs药物递送系统仍然存在一些挑战:1)MNs的亲水材料严重限制了疏水药物的充分负载,仅通过搅拌将难溶性药物加入水溶性微针,会造成微针针体药物分布不均匀,释放曲线不理想;2)微针递送后,部分难溶性药物在皮肤中滞留,这对于全身给药是不利的,尤其是浓度依赖或者需要快速起效的药物。
文献({He,2021#316})使用可溶性微递送透明质酸酶修饰的半导体聚合物纳米粒,用于治疗黑色素瘤。该文献使用透明质酸酶降解浅表黑色素瘤中的细胞外基质,增强纳米颗粒的肿瘤渗透。然而,纳米颗粒缀合酶化学反应复杂、反应条件苛刻且不具有普适性,较难实现生产。
文献({Huang,2022#318})使用可溶性微针共同递送透明质酸酶、5-氨基乙酰丙酸(ALA)、二甲双胍用于治疗局部肥厚性瘢痕(HS)。然而,该文献中微针递送的均为水溶性药物。此外,透明质酸酶与药物共同分布在整个微针中,这对于酶不稳定的药物是不利的,药物对酶的影响也需要进一步考察。
综上,目前酶载微针可分成两类,一是酶缀合纳米颗粒,然后载入微针,这种方法操作繁琐,成本高;另外一种是将水溶性药物与透明质酸酶混合后制备微针,该方法针对水溶性药物,且需要针对性考虑药物与生物酶间的相互作用。此外,在上述研究中均为透明质酸酶用于局部的药物递送,未关注酶载微针用于全身药物的递送。
发明内容
为了解决上述两个问题,本发明开发了一种用于全身给药的、难溶性药物递送的微针,①将纳米晶与生物酶装载于微针中,通过透明质酸酶对皮肤的解聚作用,增加皮肤空隙,增强药物的皮肤渗透,提高药物的吸收率;②通过纳米晶体技术将难溶性药物制备成纳米混悬剂,使其均匀分散至可溶性的微针基材中,达到理想的释放效果;③将透明质酸酶载入微针针尖,药物载入针体,实现时空释放,先使用透明质酸酶降解皮肤后实现药物的释放。
本发明提供以下技术内容:
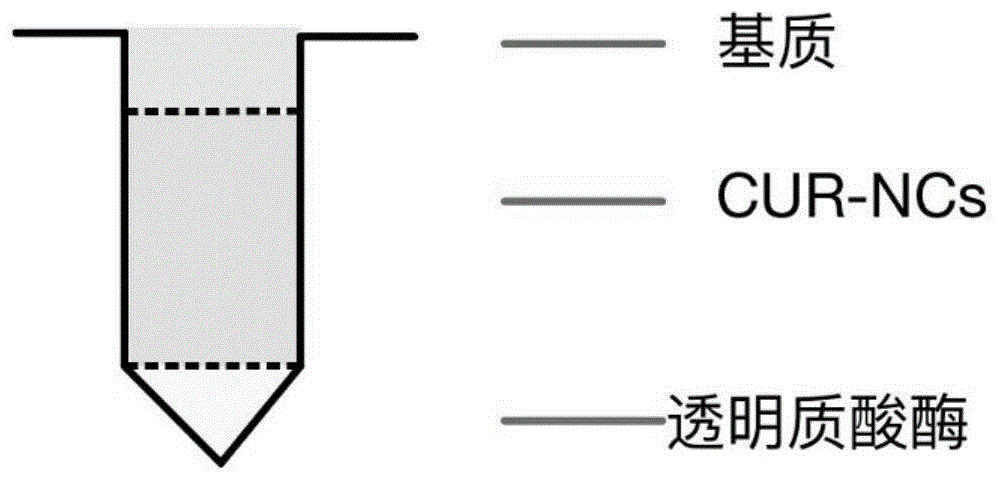
本发明第一方面,提供一种用于递送难溶性药物的载酶微针制剂,所述制剂中自微针顶部至针尖依次分布基质材料、药物纳米晶及透明质酸酶。
本发明第一方面目的在于提供一种适用于难溶性药物给药的通用型制剂,解决难溶性药物透皮吸收中出现的共性问题;发明人发现脂溶性药物在透皮时部分药物被滞留在皮肤,例如:伊维菌素微针24h皮肤滞留量34%;阿苯哒唑31%等等,然而药物在皮肤中的滞留对于全身给药是不利的,尤其是浓度依赖的药物,或者需要快速起效的药物。因此本发明设计通过透明质酸酶载入微针用于增强难溶性药物的皮肤微针递送;优选的方案中,所述难溶性药物为包括但不限于姜黄素、左炔诺孕酮、辛伐他汀、辅酶Q10、紫杉醇中的一种或几种的组合。
优选的,上述微针制剂中,所述基质材料、药物纳米晶及透明质酸酶的质量比为55~65:5~7:0.8~1.2;进一步的,为58~62:5~7:0.8~1.2;具体的,为60:6:1。
优选的,所述基质材料为包括但不限于聚乙烯吡咯烷酮、聚乙烯醇、壳聚糖及其衍生物、果胶、透明质酸及其钠盐、纤维素类衍生物、海藻糖中的一种。
优选的,所述药物纳米晶中具有非离子型聚合物作为骨架材料及分散基质,所述非离子型聚合物为包括但不限于聚乙烯吡咯烷酮、聚乙烯醇、壳聚糖及其衍生物、果胶、透明质酸及其钠盐、纤维素类衍生物、海藻糖中的一种或几种的混合,本发明优选的一种实施方式中,所述非离子型聚合物为聚乙烯吡咯烷酮,进一步的,为聚乙烯吡咯烷酮K30(PVPK30),采用PVPK30作为分散基质可以有效增加姜黄素在水中的溶解度,提高药物在水相中的稳定性,改善药物的溶出效果。
另外,所述药物纳米晶优选的粒径尺寸为60~80nm,更进一步的,为65~75nm。
优选的,所述药物纳米晶的制备方法如下:避光条件下将药物溶于乙醇中得到有机相;将PVPK30溶于水中使其充分混匀得到水相;向水相中加入有机相并超声混匀得到药物纳米晶。
进一步的,所述有机相的制备过程中,所述药物溶于乙醇后的浓度为4~6mg/mL,可通过水浴加热方式辅助溶解,加热温度为75~85℃。
进一步的,所述药物纳米晶中,药物与PVPK30的质量比为1:5~7;所述超声功率为380~420W,超声时间为4~6min,超声过程采用间断性超声方式,如3s开/2s关。
进一步的,所述超声后的反应体系可通过超滤进行浓缩,一种具体的实施方式中,采用超滤管进行浓缩,所述超滤管的截留分子量为30KDa,浓缩所述姜黄素纳米晶浓度至4mg/mL。
优选的,所述透明质酸酶中也具有聚合物作为骨架材料;进一步优选的,所述聚合物为聚乙烯吡咯烷酮K30(PVPK30);所述透明质酸酶与PVPK30的质量比为1:8~12,优选的,为1:9~11;具体的,为1:10。
本发明第二方面,提供第一方面所述载酶微针制剂的制备方法,包括如下步骤:
将透明质酸酶溶液加入微针腔体中,离心并干燥制备透明质酸酶部分;继续加入药物纳米晶混悬液,离心并干燥制备药物纳米晶层;加入基质材料再次离心并干燥。
上述制备方法中,所述透明质酸酶溶液优选为透明质酸酶的PVPK30溶液;其中,PVPK30溶液的浓度为25~35%。
所述离心的目的在于减少粘附在微针内壁的药物,辅助药物形成稳定的药物贮库层,优选的离心转速为3500~4500rpm,离心时间为15~25min。
另外,制备过程中所述干燥优选采用低温干燥的方式,本发明提供的一种实施方式中,所述干燥通过干燥箱实现,干燥温度为3~5℃,干燥时间为0.8~2h;其中,所述基质材料的干燥在室温条件下进行,干燥时间为12~16h。
以上一个或多个技术方案的有益效果在于:通过纳米晶体技术将难溶性药物制备成纳米混悬剂,使其均匀分散至可溶性的微针基材中,达到理想的可控释放效果。将透明质酸酶载入微针针尖,药物载入针体,实现时空释放,先使用透明质酸酶降解皮肤后实现药物的释放。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为实施例1制备的姜黄素载酶微针制剂构造示意图;
图2为ImageJ检测含不同浓度透明质酸酶皮肤扩散效果,(a)CUR-NCs的皮肤扩散情况(bar:100μm);CUR-MNs的(b)皮肤扩散面积和(c)荧光强度。
图3为实施例1中载酶微针的整体形貌和侧面、尖端载药情况;其中,A为CUR-NCs微针;B为CUR-NCs+HAse微针;C为CUR-NCs微针侧面;D为CUR-NCs+HAse微针侧面;E为CUR-NCs微针尖端;F为CUR-NCs+HAse微针尖端;
图4为含不同浓度HAase的CUR-MNs的力-位移曲线;
图5为左炔诺孕酮纳米颗粒表征;
其中,(a)为粒径图;(b)为DSC图;(c)为SEM图;
图6为左炔诺孕酮载酶微针形态图;
图7为辛伐他汀纳米晶的粒径图(左)及DSC图(右);
图8为辅酶Q10纳米晶的粒径图(左)及DSC图(右);
图9为紫杉醇纳米晶的粒度图;
图10为紫杉醇载酶微针的形态图;
图11为紫杉醇载酶微针放大后的形态图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1姜黄素(CUR)载酶微针的制备及制剂工艺考察
本实施例中,提供一种姜黄素(CUR)载酶微针,制备方法如下:
姜黄素纳米晶的制备:将10mg CUR溶解在2mL乙醇中形成有机相,将60mg PVP溶解在水中作为水相。有机溶液在连续超声下注入水溶液(JY92-IIDN,惠西,上海,中国)。~60nm配方的功率、超声时间、间隔时间、总超声时间分别为400w、3s、2s、5min;对于~120nm配方,400w、3s、10s、5min。通过搅拌沉淀制备480nm CUR-NCs。简而言之,将溶解在乙醇中的2mL 10mg/mL姜黄素在500rpm搅拌下注入水相(水相含有40mgPVP)。使用30KDa超滤管浓缩CUR-NCs。
姜黄素载酶微针的制备:含有HAase的30%的PVPK30溶液,4000rpm下离心20min后,置于干燥箱中在4℃下放置1h后。加入含有CUR-NCs的30%PVPK30混悬液,4000rpm下离心20min后,置于干燥箱中在4℃下放置1h后,重复上述操作。加入HA背衬层,离心后放置于干燥箱中在室温(25℃)下干燥14h。
黄素纳米晶微针的制剂工艺考察
1、不同粒径姜黄素纳米晶(CUR-NCs)的制备:
姜黄素纳米晶制备工艺如下:
(1)步骤1-有机相溶液的制备:在避光条件下精密称取一定量姜黄素原料药溶于无水乙醇中,配制成5mg/mL的姜黄素乙醇溶液,80℃水浴加热溶解,获得有机相溶液。
(2)步骤2-水相溶液的制备:精密称量适量的PVPK90溶于去离子水中,浓度为20mg/mL,室温下使其充分溶胀,并不断搅拌使其混匀,获得水相溶液。
(3)步骤3-姜黄素纳米晶的制备:
60nm粒径的纳米晶制备:取3mL水相溶液和10mL纯化水于烧杯中,在超声条件下向其注入2mL有机相,超声条件为3s开/2s关
/400w/5min(4℃),即可得到60nm的CUR-NCs。使用30KDa超滤管浓缩上述混悬液,直至浓度为4mg/mL。
120nm粒径的纳米晶制备:取3mL水相溶液和5mL纯化水于烧杯中,在超声条件下向其注入2mL有机相,超声条件为3s开/10s关
/400w/5min(4℃),即可得到120nm的CUR-NCs。使用30KDa超滤管浓缩上述混悬液,直至浓度为4mg/mL。
480nm粒径的纳米晶制备:取2mL水相溶液和6mL纯化水于烧杯中,在搅拌条件下向其注入2mL有机相,搅拌条件为500rpm(25℃),即可得到480nm的CUR-NCs混悬液。
实验结果表明:相较于120nm和480nm的CUR-NCs,60nmCUR-NCs在皮肤中扩散的更快,因此选择60nmCUR-NCs。
2、微针尖端HAase用量筛选
将含有0mg/mL、10mg/mL、50mg/mL的HAase的30%的PVPK30溶液作为针尖溶液,按上述方法制备微针,考察HAase用量对皮肤局部微环境中透明质酸降解情况,并增加CUR-NCs渗透性,增强进入体循环药量。
取猪皮,生理盐水浸泡4h后,刺入微针,37℃下孵育30min后,进行切片,倒置显微镜观察。
考察结果如图2所示,通过ImageJ对皮肤扩散面积进行测量,随着透明质酸含量的增加,CUR-NCs的皮肤扩散面积逐渐增加(50mg/mL>10mg/mL>0mg/mL),0mg/mL与10mg/mL组间无显著性差异,但50mg/mL平均皮肤扩散面积略大于10mg/mL组,最终选择50mg/mL的HAase浓度。
3、含有透明质酸酶(HAase)微针(MNs)的制备
按照上述实施例1中所述的方式,将HAase制剂及CUR-NCs依次灌入微针后离心、干燥,再加入HA背衬层,离心后干燥即得所述微针制剂。
本实施例中,所采用的微针模具参数如下:
载酶微针的表征:使用Nova Nano SEM(FEI,Hillsboro,USA)的扫描电子显微镜对微针形态进行表征,结果如图3所示;使用TMS-pilot纹理分析仪(FTC,Virginia,USA)在压缩模式下对载酶微针的硬度进行表征,结果如图4所示,从图4中可以看出,三种不同HAase浓度的CUR-MNs均可承受≥0.14N/needle的压缩力,可以刺入皮肤。
实施例2左炔诺孕酮载酶微针的制备
左炔诺孕酮纳米晶的制备:5mg/mL LNG乙醇溶液,取2mL在5s开/5s关/45%,5min的超声条件下加入18mL水中,制备650nmLNG-NCs。
左炔诺孕酮载酶微针的制备:将制备好的左炔诺孕酮纳米晶混悬液在12000rpm下离心,刮取沉淀0.1g加入1mL 30%PVPK30中,制备含药的微针针体溶液,其余步骤同实施例1。
纳米颗粒表征:如图5所示,(a)粒径图;(b)DSC图;(c)SEM图,纳米颗粒粒径约为580nm片状,呈无定形状态。
左炔诺孕酮载酶微针的表征:形态表征如图6所示,微针形态良好呈圆锥形。
实施例3辛伐他汀(SIM)载酶微针的制备
辛伐他汀纳米晶体的制备:将50mg辛伐他汀溶解在0.5mL甲醇中以获得有机相;将20mg F68溶解在20mL纯化水中,制备水相;在搅拌下将有机相注入水相,制备辛伐他汀纳米混悬液,使用30KDa超滤管浓缩SIM-NCs。
辛伐他汀载酶微针的制备:同实施例1。
纳米颗粒的表征:粒径及DSC如图7,SIM-NCs粒径约为360nm,形态为无定形状态。
实施例4辅酶Q10载酶微针的制备
辅酶Q10纳米晶的制备:辅酶Q10将10mg辅酶Q10溶解在1mL无水乙醇中以获得有机相;将10mg PVP(180nm:PVPK30;310nm:PVPK90)溶解在20mL纯化水中,制备水相;在1000rpm的搅拌下将有机相以6mL/min(5s)的速度注入水相,制备辅酶Q10纳米混悬液。
辅酶Q10载酶微针的制备:同实施例1。
纳米颗粒表征:粒径及DSC如图8所示。
实施例5紫杉醇载酶微针的制备
紫杉醇纳米晶的制备:将10mg的紫杉醇溶解在1mL无水乙醇中已获得有机相,将10mgTPGS溶解在9mL纯化水中,制备水相;在功率为45%,3s开/2s关/5min的超声条件下通过注射器将有机相下加入水相中。
紫杉醇载酶微针的制备:同实施例1。
纳米颗粒的表征:粒度如图9所示,微针形态如图10及图11所示。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
