一种快速从鼻咽拭子中提取核酸的试剂盒及提取方法
文献发布时间:2024-04-18 19:48:15
技术领域
本发明涉及一种核酸提取技术领域,具体涉及一种快速从鼻咽拭子中提取核酸的试剂盒及提取方法。
背景技术
随着分子生物学的快速发展,研究者们对核酸的关注日益增加。尤其是在分子诊断领域,进行病原体核酸检测或基因检测时,都对核酸的浓度、纯度有较高的要求,且涉及到人或动物基因组DNA、病原体DNA、病原体RNA等。但传统的采血获取核酸样本的方式会对被采样者造成伤害,因此,一些采样方式利用无创的鼻咽拭子代替传统的采血检验。例如呼吸道感染疾病,常见的人呼吸道感染病原体,包括甲型流感病毒、乙型流感病毒、呼吸道合胞体病毒、冠状病毒、腺病毒、支原体、衣原体等, 均可采用鼻咽拭子进行病原体检测。
目前对于鼻咽拭子常用提取核酸的方法主要有酚/氯仿法、柱提法、磁珠法等。酚/氯仿法毒性较大,且核酸的回收率较低,所需样本量大,不适合微量样本分析;柱提法需要较多的样本和耗材,且需要反复离心,不便于高通量、自动化操作;磁珠法更适用于高通量、自动化的快速核酸提取。但是现有的磁珠提取法往往只能针对病原体DNA、病原体RNA、基因组DNA或RNA中的部分核酸类型进行高效率提取,不能通用性的对样本中各类型总核酸进行无差别提取,且提取时间依然较长、提取效率有待提高。
发明内容
本发明的目的在于提供一种快速从鼻咽拭子中提取核酸的试剂盒及提取方法,其具有提取时间更短、操作更简便、提取效率更高的优点。
为解决上述技术问题,本发明所采用的技术方案是:
一种快速从鼻咽拭子中提取核酸的试剂盒,包括设置在盒体内的如下组分:保存液、裂解液、洗涤液、清洗液、洗脱液、蛋白酶K和磁珠;
保存液包含以下浓度的组分:1.8-2.2M 异硫氰酸胍,8-11mM EDTA,0.4-0.6%质量百分比的SDS,18-22mM Tris-HCl,所述EDTA的pH为7.0-8.0,Tris-HCl的pH为6.6-7;
裂解液包含以下浓度的组分:0.8-1.1M 异硫氰酸胍,9-11mM EDTA,0.4-0.6%体积百分比的Triton-X100,0.4-0.6%质量百分比的SDS,35-45%体积百分比的异丙醇,0.09-0.11%质量百分比的磁珠,18-22mM Tris-HCl,所述EDTA的pH为7.0-8.0,Tris-HCl的pH为6.6-6.9;
洗涤液包含以下浓度的组分:0.8-1.2M 异硫氰酸胍,8-12mM EDTA,45-55%体积百分比的无水乙醇,18-22mM Tris-HCl,所述EDTA的pH为7.0-8.0,Tris-HCl的pH为7.0-8.0;
清洗液包含以下浓度的组分:75-85%体积百分比的无水乙醇,8-12mM Tris-HCl,所述Tris-HCl的pH为7.0-8.0;
洗脱液包含以下浓度的组分:8-12mM Tris-HCl,所述Tris-HCl的pH为7.0-8.0。
其中,保存液组分浓度如下:2M 异硫氰酸胍,10mM EDTA,0.5%质量百分比的SDS,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8。
进一步限定,裂解液组分浓度如下:1M 异硫氰酸胍,10mM EDTA,0.5%体积百分比的Triton-X100,0.5%质量百分比的SDS,40%体积百分比的异丙醇,0.1%质量百分比的磁珠,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8。
进一步限定,洗涤液组分浓度如下:1M 异硫氰酸胍,10mM EDTA,50%体积百分比的无水乙醇,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为8.0。
进一步限定,清洗液组分浓度如下:80%体积百分比的无水乙醇,10mM Tris-HCl,所述Tris-HCl的pH为8.0。
进一步限定,洗脱液组分浓度如下:10mM Tris-HCl,所述Tris-HCl的pH为8.0;所述蛋白酶K浓度为20mg/mL。
进一步限定,磁珠为硅羟基磁珠。
本发明还公开了一种快速从鼻咽拭子中提取核酸的提取方法,包括使用上述的快速从鼻咽拭子中提取核酸的试剂盒,具体提取方法如下:
a.向提取容器中依次加入保存液、鼻咽拭子,涡旋混匀后,取液体部分;
b.在步骤a中得到的液体中依次加入蛋白酶K、裂解液、磁珠,涡旋混匀2min,分离磁珠后弃液体;
c.向步骤b中得到的磁珠中加入洗涤液,涡旋混匀后分离磁珠,弃液体;
d.向步骤c中得到的磁珠中加入清洗液,涡旋混匀后分离磁珠,弃液体;
e.向步骤d中得到的磁珠中加入洗脱液,涡旋混匀后弃磁珠,即得样本中总核酸溶液。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种提取时间更短、操作更简便、提取效率更高,并且广泛适用于提取鼻咽拭子中病原体DNA、病原体RNA、基因组DNA和基因组RNA的提取方法和试剂盒;
本发明可高效率提取鼻咽拭子中包括病原体DNA、病原体RNA、基因组DNA和基因组RNA在内的总核酸,适用于各种需要不同核酸类型的提取场景;同时,本发明通过配方优化,能够快速从鼻咽拭子中提取核酸,操作简便,最快5min内即可完成从采样到获取总核酸溶液的全流程提取,且提取效率有所提高;更重要的是,本发明所需样本体积小、试剂量少、步骤简单,且能够轻松提取微量核酸,节省提取试剂,成本低廉。
附图说明
为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
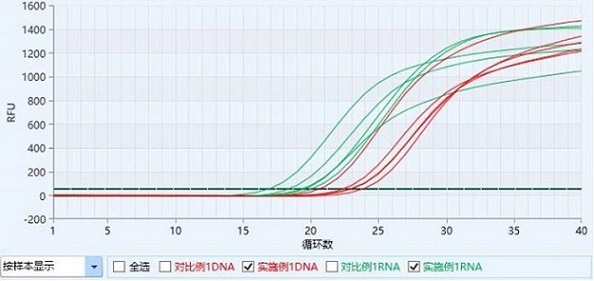
图1为本发明实施例1中提取得到的样本对猫GAPDH基因DNA和猫B2M基因RNA的扩增曲线图。
图2为本发明实施例2和对比例2中提取得到的样本对猫支原体基因组DNA的扩增曲线图。
图3为本发明实施例3和对比例3中提取得到的样本对猫杯状病毒基因组RNA的扩增曲线图。
图4为本发明实施例4和对比例4中提取得到的样本对人β-actin基因DNA的扩增曲线图。
图5为本发明实施例4和对比例4中提取得到的样本对人β-actin基因RNA的扩增曲线图。
图6为本发明对比例1中提取得到的样本对猫GAPDH基因DNA和猫B2M基因RNA的扩增曲线图。
具体实施方式
在下文中,仅简单地描述了某些示例性实施例。正如本领域技术人员可认识到的那样,在不脱离本发明实施例的精神或范围的情况下,可通过各种不同方式修改所描述的实施例。因此,附图和描述被认为本质上是示例性的而非限制性的。下面结合附图对本发明的实施例进行详细说明。
实施例1
本实施例公开了一种快速从鼻咽拭子中提取核酸的试剂盒,所述试剂盒包括保存液、裂解液、洗涤液、清洗液、洗脱液、蛋白酶K和磁珠,采用样本为健康猫咽拭子,编号为样本1~5,为与对比例进行对比,将拭子用200μL生理盐水涡旋混匀后,取100μL拭子样本液平均分成两份,一份用实施例方法进行提取,一份用对比例方法进行提取。
其中保存液包含以下浓度的组分:2M 异硫氰酸胍,10mM EDTA,0.5%质量百分比的SDS,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中裂解液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,0.5%体积百分比的Triton-X100,0.5%质量百分比的SDS,40%体积百分比的异丙醇,0.1%质量百分比的磁珠,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中洗涤液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,50%体积百分比的无水乙醇,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为8.0;
其中清洗液包含以下浓度的组分:80%体积百分比的无水乙醇,10mM Tris-HCl,所述Tris-HCl的pH为8.0;
其中洗脱液包含以下浓度的组分:10mM Tris-HCl,所述Tris-HCl的pH为8.0;
所述蛋白酶K浓度为20mg/mL;
所述磁珠为硅羟基磁珠。
提取步骤为:
(1)取50μL拭子样本液,加入150μL保存液,涡旋混匀,并依次加入20μL蛋白酶K、500μL裂解液、20μL磁珠,涡旋混匀2min,分离磁珠后弃液体;
(2)向步骤(1)中加入500μL洗涤液,涡旋混匀后分离磁珠,弃液体;
(3)向步骤(2)中加入500μL清洗液,涡旋混匀后分离磁珠,弃液体;
(4)向步骤(3)中得到的磁珠中加入100μL洗脱液,涡旋混匀后弃磁珠,即得样本中总核酸溶液。
以提取到的总核酸溶液为模板,以猫GAPDH基因DNA和猫B2M基因RNA的引物和探针进行实时荧光PCR。
实施例2
在本实施例中,所述试剂盒包括保存液、裂解液、洗涤液、清洗液、洗脱液、蛋白酶K和磁珠,采用样本为含有支原体的猫咽拭子,编号为样本6~10,为与对比例进行对比,将拭子用200μL生理盐水涡旋混匀后,取100μL拭子样本液平均分成两份,一份用实施例方法进行提取,一份用对比例方法进行提取。
其中保存液包含以下浓度的组分:2M 异硫氰酸胍,10mM EDTA,0.5%质量百分比的SDS,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中裂解液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,0.5%体积百分比的Triton-X100,0.5%质量百分比的SDS,40%体积百分比的异丙醇,0.1%质量百分比的磁珠,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中洗涤液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,50%体积百分比的无水乙醇,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为8.0;
其中清洗液包含以下浓度的组分:80%体积百分比的无水乙醇,10mM Tris-HCl,所述Tris-HCl的pH为8.0;
其中洗脱液包含以下浓度的组分:10mM Tris-HCl,所述Tris-HCl的pH为8.0;
所述蛋白酶K浓度为20mg/mL;
所述磁珠为硅羟基磁珠。
提取步骤为:
(1)取50μL拭子样本液,加入150μL保存液,涡旋混匀,并依次加入20μL蛋白酶K、500μL裂解液、20μL磁珠,涡旋混匀2min,分离磁珠后弃液体;
(2)向步骤(1)中加入500μL洗涤液,涡旋混匀后分离磁珠,弃液体;
(3)向步骤(2)中加入500μL清洗液,涡旋混匀后分离磁珠,弃液体;
(4)向步骤(3)中得到的磁珠中加入100μL洗脱液,涡旋混匀后弃磁珠,即得样本中总核酸溶液。
以提取到的总核酸溶液为模板,以猫支原体基因组DNA的引物和探针进行实时荧光PCR。
实施例3
本实施例所述试剂盒包括保存液、裂解液、洗涤液、清洗液、洗脱液、蛋白酶K和磁珠,采用样本为含有杯状病毒的猫咽拭子,编号为样本11~15,为与对比例进行对比,将拭子用200μL生理盐水涡旋混匀后,取100μL拭子样本液平均分成两份,一份用实施例方法进行提取,一份用对比例方法进行提取。
其中保存液包含以下浓度的组分:2M 异硫氰酸胍,10mM EDTA,0.5%质量百分比的SDS,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中裂解液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,0.5%体积百分比的Triton-X100,0.5%质量百分比的SDS,40%体积百分比的异丙醇,0.1%质量百分比的磁珠,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中洗涤液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,50%体积百分比的无水乙醇,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为8.0;
其中清洗液包含以下浓度的组分:80%体积百分比的无水乙醇,10mM Tris-HCl,所述Tris-HCl的pH为8.0;
其中洗脱液包含以下浓度的组分:10mM Tris-HCl,所述Tris-HCl的pH为8.0;
所述蛋白酶K浓度为20mg/mL;
所述磁珠为硅羟基磁珠。
提取步骤为:
(1)取50μL拭子样本液,加入150μL保存液,涡旋混匀,并依次加入20μL蛋白酶K、500μL裂解液、20μL磁珠,涡旋混匀2min,分离磁珠后弃液体;
(2)向步骤(1)中加入500μL洗涤液,涡旋混匀后分离磁珠,弃液体;
(3)向步骤(2)中加入500μL清洗液,涡旋混匀后分离磁珠,弃液体;
(4)向步骤(3)中得到的磁珠中加入100μL洗脱液,涡旋混匀后弃磁珠,即得样本中总核酸溶液。
以提取到的总核酸溶液为模板,以猫杯状病毒基因组RNA的引物和探针进行实时荧光PCR。
实施例4
本实施例所述试剂盒包括保存液、裂解液、洗涤液、清洗液、洗脱液、蛋白酶K和磁珠,采用样本为健康人咽拭子,编号为样本16,为与对比例进行对比低浓度样本提取效率,将拭子用200μL生理盐水涡旋混匀后,样本液稀释100倍,取20份50μL的拭子样本液,其中10份用实施例方法进行提取,另10份用对比例方法进行提取。
其中保存液包含以下浓度的组分:2M 异硫氰酸胍,10mM EDTA,0.5%质量百分比的SDS,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中裂解液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,0.5%体积百分比的Triton-X100,0.5%质量百分比的SDS,40%体积百分比的异丙醇,0.1%质量百分比的磁珠,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为6.8;
其中洗涤液包含以下浓度的组分:1M 异硫氰酸胍,10mM EDTA,50%体积百分比的无水乙醇,20mM Tris-HCl,所述EDTA的pH为8.0,Tris-HCl的pH为8.0;
其中清洗液包含以下浓度的组分:80%体积百分比的无水乙醇,10mM Tris-HCl,所述Tris-HCl的pH为8.0;
其中洗脱液包含以下浓度的组分:10mM Tris-HCl,所述Tris-HCl的pH为8.0;
所述蛋白酶K浓度为20mg/mL;
所述磁珠为硅羟基磁珠。
提取步骤为:
(1)取50μL拭子样本液,加入150μL保存液,涡旋混匀,并依次加入20μL蛋白酶K、500μL裂解液、20μL磁珠,涡旋混匀2min,分离磁珠后弃液体;
(2)向步骤(1)中加入500μL洗涤液,涡旋混匀后分离磁珠,弃液体;
(3)向步骤(2)中加入500μL清洗液,涡旋混匀后分离磁珠,弃液体;
(4)向步骤(3)中得到的磁珠中加入100μL洗脱液,涡旋混匀后弃磁珠,即得样本中总核酸溶液。
以提取到的总核酸溶液为模板,以人β-actin基因DNA和人β-actin基因RNA的引物和探针进行实时荧光PCR。
对比例1
以商业试剂盒对拭子样本提取核酸的一个对比例,所述商业试剂盒为拭子(诺唯赞VAMNE Magnetic Pathogen DNA/RNA Kit)专用的磁珠法DNA/RNA共提试剂盒,采用样本为实施例1中的样本,编号为样本1~5,提取前采样及样品处理方式参照实施例1,按照试剂盒说明书操作。
以提取到的核酸溶液为模板,以猫GAPDH基因DNA和猫B2M基因RNA的引物和探针进行实时荧光PCR。
对比例2
以商业试剂盒对拭子样本提取核酸的一个对比例,所述商业试剂盒(诺唯赞VAMNEMagnetic Pathogen DNA/RNA Kit)为拭子专用的磁珠法DNA/RNA共提试剂盒,采用样本为实施例2中的样本,编号为样本6~10,提取前采样及样品处理方式参照实施例2,按照试剂盒说明书操作。
以提取到的核酸溶液为模板,以猫支原体基因组DNA的引物和探针进行实时荧光PCR。
对比例3
以商业试剂盒(诺唯赞VAMNE Magnetic Pathogen DNA/RNA Kit)对拭子样本提取核酸的一个对比例,所述商业试剂盒为拭子专用的磁珠法DNA/RNA共提试剂盒,采用样本为实施例3中的样本,编号为样本11~15,提取前采样及样品处理方式参照实施例3,按照试剂盒说明书操作。
以提取到的核酸溶液为模板,以猫杯状病毒基因组RNA的引物和探针进行实时荧光PCR。
对比例4
以商业试剂盒(诺唯赞VAMNE Magnetic Pathogen DNA/RNA Kit)对拭子样本提取核酸的一个对比例,所述商业试剂盒为拭子专用的磁珠法DNA/RNA共提试剂盒,采用样本为实施例4中的样本,编号为样本16,提取前采样及样品处理方式参照实施例4,按照试剂盒说明书操作。
以提取到的核酸溶液为模板,以人β-actin基因DNA和人β-actin基因RNA的引物和探针进行实时荧光PCR。
为了便于本领域技术人员进一步理解本发明,下面结合具体的实验数据来进一步阐述本发明。
实施例1中提取得到的样本对猫GAPDH基因DNA和猫B2M基因RNA的扩增曲线如图1所示,对比例1中提取得到的样本对猫GAPDH基因DNA和猫B2M基因RNA的扩增曲线如图6所示;实施例1和对比例1检测猫GAPDH基因DNA和猫B2M基因RNA的Ct值结果如表1所示:
表1 实施例1和对比例1 Ct值
由图1、图6和表1可以看出,实施例1中本发明试剂盒提取猫咽拭子中基因组DNA及RNA的结果,除样本3 DNA组的Ct值比对比例大0.04,其他样本的DNA及RNA的Ct值均明显小于对比例1中的商业试剂盒,说明本发明试剂盒从咽拭子中提取基因组DNA和基因组RNA的效率均高于该商业试剂盒。
实施例2和对比例2中提取得到的样本对猫支原体基因组DNA的扩增曲线如图2所示,检测Ct值结果如表2所示:
表2 实施例2和对比例2 Ct值
由图2和表2可以看出,实施例2中本发明试剂盒提取猫鼻咽拭子中支原体DNA的结果, Ct均明显小于对比例1中的商业试剂盒,其中对比例2对样本8的检测Ct值大于40,因此用“-”代表未检出,以上结果说明本发明试剂盒从鼻咽拭子中提取病原体DNA的效率高于该商业试剂盒。
实施例3和对比例3中提取得到的样本对猫杯状病毒基因组RNA的扩增曲线如图3所示,检测Ct值结果如表3所示:
表3 实施例3和对比例3 Ct值
实施例4和对比例4中提取得到的样本对人β-actin基因DNA的扩增曲线如图4所示,检测Ct值结果如表4所示;实施例4和对比例4中提取得到的样本对人β-actin基因RNA的扩增曲线如图5所示,检测Ct值结果如表5所示:
表4 实施例4和对比例4 DNA检测 Ct值
表5 实施例4和对比例4 RNA检测 Ct值
由图4、图5和表4、表5可以看出,实施例4中本发明试剂盒提取低浓度人咽拭子中β-actin基因DNA和RNA的结果, Ct均明显小于对比例4中的商业试剂盒,由CV值评估说明重复性也好于对比例4中的商业试剂盒,以上结果说明本发明试剂盒对于低样本浓度的咽拭子中提取核酸效率和重复性都明显优于该商业试剂盒。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,应当指出的是,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
