用于治疗晚期实体瘤的FGFR酪氨酸激酶抑制剂
文献发布时间:2024-04-18 19:53:33
技术领域
本文公开了治疗癌症的方法,所述方法包括向已被诊断患有癌症并且具有至少一种成纤维细胞生长因子受体(FGFR)融合的患者施用治疗有效量的厄达替尼,该FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。本文还公开了治疗癌症的方法,所述方法包括向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的厄达替尼,其中该癌症是晚期实体瘤,任选地其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
背景技术
基因异常的鉴定可用于为癌症患者选择合适的治疗剂。基因异常的鉴定对于接受该癌症类型的主要治疗选择(一线治疗)失败的癌症患者也很有用,特别是在二线和后续治疗没有公认的护理标准的情况下。成纤维细胞生长因子受体(FGFR)是参与调节细胞存活、增殖、迁移和分化的受体酪氨酸激酶家族。FGFR改变可能作为与潜在肿瘤类型无关的疾病的致癌驱动因素起作用。关于临床环境中实体瘤的发病率、多样性或主要FGFR改变知之甚少。
发明内容
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的厄达替尼,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。
在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。
在某些实施方案中,FGFR融合是FGFR2-CCDC102A。在其他实施方案中,癌症是非鳞状NSCLC。
在某些实施方案中,FGFR融合是FGFR2-CCDC147。在其他实施方案中,FGFR融合是FGFR2-ENOX1。在更多其他实施方案中,FGFR融合是FGFR2-LCN10。在某些实施方案中,FGFR融合是FGFR2-PDE3A。在其他实施方案中,FGFR融合是FGFR2-RANBP2。在更多其他实施方案中,FGFR融合是RRM2B-FGFR2。在某些实施方案中,癌症是胆管癌。
在某些实施方案中,FGFR融合是FGFR2-GPHN。在其他实施方案中,癌症是胰腺癌。
在某些实施方案中,FGFR融合是FGFR3-ENOX1。在其他实施方案中,FGFR融合是FGFR3-TMEM247。在某些实施方案中,癌症是高级别神经胶质瘤。
在某些实施方案中,FGFR融合是IGSF3-FGFR1。在其他实施方案中,癌症是胸腺癌。
在某些实施方案中,FGFR融合是RHPN2-FGFR1。在其他实施方案中,癌症是卵巢癌。
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。
在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-PTEN、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在一些实施方案中,至少一种FGFR基因改变是FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-CTNND2、FGFR2-YPEL5、FGFR2-SENP6、FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、BAG4-FGFR1、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、RHPN2-FGFR1、FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247、WHSC1-FGFR3、CD44-FGFR2、FGFR2-CTNND2、FGFR2-FAM24B、FGFR2-GOLGA2、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-SENP6、FGFR2-YPEL5、FGFR3-JAKMIP1、WDR11-FGFR2、FGFR1-S125L、FGFR2-E565A、FGFR2-P253L、FGFR2-W72C、FGFR3-P250R或FGFR3-R399C。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、BAG4-FGFR1、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、RHPN2-FGFR1、FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247、WHSC1-FGFR3、CD44-FGFR2、FGFR2-CTNND2、FGFR2-FAM24B、FGFR2-GOLGA2、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-SENP6、FGFR2-YPEL5、FGFR3-JAKMIP1、WDR11-FGFR2、FGFR1-S125L、FGFR2-E565A、FGFR2-P253L、FGFR2-W72C或FGFR3-P250R。
在一些实施方案中,至少一种FGFR基因改变是FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-NOL4、FGFR2-PAWR、FGFR2-SENP6、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-TACC3、FGFR1-K656E、FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C、FGFR2-Y375C、FGFR3-R248C或FGFR3-S249C。
在某些实施方案中,受试者在所述施用厄达替尼之前接受过至少一个线数的系统治疗。
在某些实施方案中,本文所述的方法或用途还包括在所述施用厄达替尼之前,评估来自患者的生物样品中至少一种FGFR融合(特别是如本文所述的至少一种融合)或至少一种FGFR基因改变(特别是本文所述的至少一种基因改变)的存在。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。
在其他实施方案中,厄达替尼每天施用,特别是每天一次。在更多其他实施方案中,厄达替尼口服施用。在某些实施方案中,厄达替尼按连续每天(特别是每天一次)给药方案口服施用。
在一些实施方案中,患者在首次施用FGFR抑制剂(特别是厄达替尼)之日年龄为15岁或更大。在一些实施方案中,厄达替尼以每天(特别是每天一次)约8mg的剂量口服施用。在一些实施方案中,厄达替尼以每天(特别是每天一次)约9mg的剂量口服施用。
在一些实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在12岁至<15岁之间。在某些实施方案中,厄达替尼以每天(特别是每天一次)约5mg的剂量施用。在一些实施方案中,厄达替尼以每天(特别是每天一次)约6mg的剂量口服施用。在一些实施方案中,厄达替尼以每天(特别是每天一次)约8mg的剂量口服施用。
在一些实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在6岁至<12岁之间。在某些实施方案中,厄达替尼以每天(特别是每天一次)约3mg的剂量施用。在一些实施方案中,厄达替尼以每天(特别是每天一次)约4mg的剂量口服施用。在一些实施方案中,厄达替尼以每天(特别是每天一次)约5mg的剂量口服施用。
在某些实施方案中,厄达替尼以固体剂型施用。在其他实施方案中,固体剂型是片剂。
本文描述了治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者的癌症的方法,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合的存在;以及如果该样品中存在至少一种FGFR融合,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合;以及如果该患者具有这些FGFR融合中的至少一种,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。在一个实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者的癌症的方法,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌;这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者的癌症的方法,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文描述了一种在治疗具有至少一种FGFR融合的患者的癌症中使用的FGFR抑制剂,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文描述了一种在治疗具有至少一种FGFR融合的患者的癌症中使用的FGFR抑制剂,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。
本文描述了一种在治疗具有至少一种FGFR融合的患者的癌症中使用的FGFR抑制剂,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2,并且其中在评估来自患者的生物样品中选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合的存在之后以及如果该样品中存在选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文描述了一种在治疗具有至少一种FGFR融合的患者的癌症中使用的FGFR抑制剂,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1,并且其中在评估来自患者的生物样品中选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合的存在之后以及如果该样品中存在选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂,并且其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂,并且其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂,并且其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌,并且其中在评估来自患者的生物样品中至少一种FGFR基因改变的存在之后以及如果该样品中存在至少一种FGFR基因改变,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂,并且其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌,并且其中在评估来自患者的生物样品中至少一种FGFR基因改变的存在之后以及如果该样品中存在至少一种FGFR基因改变,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。
本文进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2,并且其中在评估来自患者的生物样品中选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合的存在之后以及如果该样品中存在选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1,并且其中在评估来自患者的生物样品中选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合的存在之后以及如果该样品中存在选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1和FGFR2-GPHN。
本文还进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌,并且其中在评估来自患者的生物样品中至少一种FGFR基因改变的存在之后以及如果该样品中存在至少一种FGFR基因改变,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还进一步描述了FGFR抑制剂用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌,并且其中在评估来自患者的生物样品中至少一种FGFR基因改变的存在之后以及如果该样品中存在至少一种FGFR基因改变,则施用或将施用该FGFR抑制剂。FGFR抑制剂将以治疗有效剂量施用。在一个实施方案中,FGFR抑制剂是厄达替尼。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
附图说明
当结合附图阅读时,进一步理解发明内容以及下文的具体实施方式。出于说明所公开的方法或用途的目的,附图示出了方法或用途的示例性实施方案;然而这些方法和用途不限于所公开的具体实施方案。在附图中:
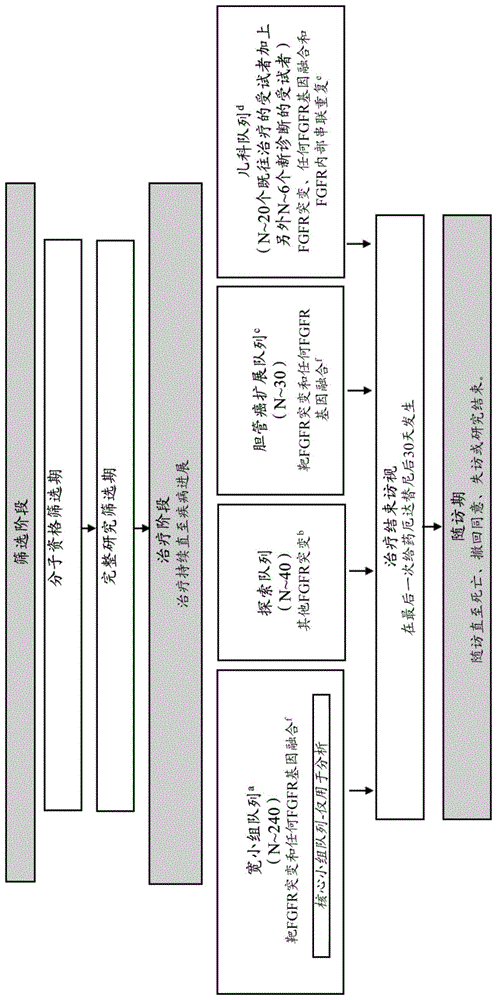
图1是本文示例的临床研究的示意性概述。
图2展示了基于血清磷酸盐水平上调厄达替尼剂量的说明。
图3A是示出根据实施例2中描述的临床研究对分子资格群体(N=191)进行原发性肿瘤诊断的饼图。
图3B是示出根据实施例2中描述的临床研究对入组群体(N=110)进行原发性肿瘤诊断的饼图。
图4是有效性分析组中目标病变的最大百分比减少的瀑布图。
图5是治疗持续时间和反应的泳道图;由研究人员确认反应者的CR/PR。
图6是治疗受试者的目标病变相对于基线(独立放射照相检查(宽小组队列))的最大百分比减少的瀑布图。CCA=胆管癌;HGG=高级别神经胶质瘤;BRST=乳腺癌;PANCR=胰腺癌;sqNSCLC=鳞状NSCLC;nonsqNSCLC=非鳞状NSCLC;CRC=结肠直肠癌;EDMTL=子宫内膜癌;ESOPH=食道癌;LGG=低级别神经胶质瘤;GSTRC=胃癌;HNSCC=鳞状细胞头颈癌;CRVX=宫颈癌;OVAR=卵巢癌;CR:完全反应;PR:部分反应;SD:稳定疾病;PD:疾病进展;NE:不可评估的。最佳总体反应是在PD和随后的抗癌治疗(随后的手术/程序、随后的放射疗法和随后的系统治疗)之前,考虑到确认的任何需要,从研究治疗开始到研究结束记录的最佳反应。对于基于RECIST 1.1的疾病评估,以目标病变直径的总和计算相对于基线的最大百分比减少;而对于基于RANO的疾病评估,以垂直维度的乘积之和计算相对于基线的最大百分比减少。将目标病变相对于基线大于100%的最大百分比增加设定为100%。在数据切割时,1名受试者具有“未知”FGFR突变/融合。此后,受试者FGFR状态被确认为FGFR融合。
图7是治疗持续时间和反应(独立放射照相检查(宽小组队列))的泳道图;由IRC确认反应者的CR/PR。CCA=胆管癌;HGG=高级别神经胶质瘤;BRST=乳腺癌;PANCR=胰腺癌;sqNSCLC=鳞状NSCLC;nonsqNSCLC=非鳞状NSCLC;EDMTL=子宫内膜癌;ESOPH=食道癌;LGG=低级别神经胶质瘤;HNSCC=鳞状细胞头颈癌;OVAR=卵巢癌。*表示患者仍在接受治疗。+表示患者的反应持续时间目前已被检查。
图8是按亚组(独立放射照相检查(宽小组队列))治疗受试者的客观反应率的森林图。CR:完全反应;PR:部分反应。
具体实施方式
应当理解,为了清楚起见,本发明的某些特征在单独实施方案的上下文中进行阐述,但也可以组合形式提供在单个实施方案中。也就是说,除非明显不相容或明确地被排除在外,否则每个单独实施方案被认为可与任何其他实施方案组合,并且这种组合被视为另一个实施方案。相反地,为简明起见,本发明的各种特征在单个实施方案的上下文中进行阐述,也可单独地或以任何子组合形式提供。最终,尽管实施方案可描述为一系列步骤的一部分或更普遍结构的一部分,但每个所述步骤本身也可被视为独立的实施方案,可与其他实施方案组合。
某些术语
过渡术语“包括”、“基本上由……组成”和“由……组成”旨在暗示它们在专利用语中的公认含义;即,(i)“包括”与“包含”、“含有”或“其特征在于”同义,并且是包括端值在内或末端开放的,并且不排除附加的、未列出的要素或方法步骤;(ii)“由...组成”排除权利要求书未指定的任何要素、步骤或成分;以及(iii)“基本上由...组成”将权利要求或实施方案的范围限制于指定的材料或步骤以及本质上不影响受权利要求书保护的发明或实施方案的基本及新颖特征的材料或步骤。更具体地,该基本及新颖特征涉及该方法或用途提供本文所述的益处中的至少一种益处的能力,这些益处包括但不限于相对于本文别处所述的对比人类群体的生存能力,提高人类群体的生存能力的能力。还提供了以短语“包括”(或其等同形式)描述的实施方案,如以“由...组成”和“基本上由...组成”独立描述的那些。
当使用描述符“约”将值表示为近似值时,应当理解,该具体值构成了另一个实施方案。如果没有另外说明,术语“约”表示相关值的±10%的变化,但是另外的实施方案包括其中变化可以是±5%、±15%、±20%、±25%或±50%的那些,具体地术语“约”表示相关值的±5%或±10%的变化,更具体地±5%。
当提供一个列表时,除非另行指出,否则应当理解,该列表中的每个单独元素和该列表的每种组合都是单独的实施方案。例如,以“A、B或C”提供的实施方案列表将被视为包括实施方案“A”、“B”、“C”、“A或B”、“A或C”、“B或C”或“A、B或C”。
如本文所用,单数形式“一个”、“一种”和“该”包括复数形式。
如本文所用,“患者”旨在表示任何动物,特别是哺乳动物。因此,该方法或用途适用于人和非人动物,但最优选地适用于人。术语“患者”和“受试者”和“人”可互换使用。
术语“治疗”是指对患有病理性病况的患者的治疗,并且指通过杀死癌细胞缓解该病况的效果,并且还指导致病况进展被抑制的效果,并且包括进展速率的减缓、进展速率的终止、病况的改善和病况的治愈。作为预防性措施的治疗(即预防)也包括在内。
“治疗有效量”是指在所需剂量和时间段有效实现期望的治疗结果的量。治疗有效量可根据以下因素变化:诸如个体的疾病状态、年龄、性别和体重,以及治疗剂或治疗剂组合在个体中引发期望的应答的能力。有效的治疗剂或治疗剂的组合的示例性指标包括例如改善患者的健康。
术语“给药方案”是指受试者要服用的治疗剂的量和受试者要服用的治疗剂的次数的频率的信息。
术语“剂量”是指每次要服用的治疗剂的量或用量。
如本文所用,术语“癌症”是指倾向于以不受控制的方式增殖的细胞异常生长,并且在一些情况下是指转移(扩散)。
术语“连续每天给药日程表”是指对于特定治疗剂没有任何药物假期的情况下施用该特定治疗剂。在一些实施方案中,特定治疗剂的连续每天给药日程表包括在每一天大致相同的时间每天施用特定治疗剂。
如本文所用,术语“共同施用”等涵盖向单个患者施用所选择的治疗剂,并且旨在包括将这些药剂通过相同或不同的施用途径或在相同或不同的时间施用的治疗方案。
术语“不良事件”是在施用药物(研究性或非研究性)产品的临床研究受试者中发生的任何不良医学事件。不良事件不一定与干预有因果关系。因此,不良事件可以是与使用药物(研究性或非研究性)产品暂时相关联的任何不利且非预期的体征(包括异常发现)、症状或疾病,无论是否与该药物(研究性或非研究性)产品相关。
如本文所用,术语“安慰剂”意指施用不包含FGFR抑制剂的药物组合物。
术语“随机化”当涉及临床试验时是指当患者被确认适合进行临床试验并且被分配给治疗组的时间。
术语“试剂盒”和“制造的制品”作为同义词使用。
术语“客观反应率”和“总体反应率”在本文中可互换使用。
“生物样品”是指来自患者的任何样品,其中可获得癌细胞并且可以检测FGFR基因改变。合适的生物样品包括但不限于血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。在一些实施方案中,生物样品可以是福尔马林固定的石蜡包埋组织(FFPET)。
在确定患者是否具有至少一种FGFR基因改变的情况下,术语“确定”包括医疗保健专业人员检查生物样品中一种或多种FGFR基因改变的存在的评估结果。例如,基于对此类结果(例如,通过下一代测序、直接测序等获得的患者测序结果)的检查,医疗保健专业人员可以确定(识别)患者具有至少一种FGFR基因改变,诸如如本文所述的融合。基于该确定,根据具体实施方案,施用厄达替尼成为患者治疗方案的一部分。
术语“完整FGFR激酶结构域”是指(a)与3-引物配偶体的FGFR融合(FGFR基因首先列出,例如FGFR-GENE或FGFR3-TACC3),其中融合的FGFR部分必须涉及外显子≥17;(b)与5-引物配偶体的FGFR融合(配偶体基因首先列出,FGFR基因其次,例如GENE-FGFR),其中融合的FGFR部分必须涉及外显子≤11,或(c)命名的FGFR融合配偶体基因(自融合或重排,例如FGFR-FGFR不合格)。
FGFR基因改变
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR基因改变选自FGFR1-PLAG1、FGFR2-C382R、BAG4-FGFR1、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、RHPN2-FGFR1、FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247、WHSC1-FGFR3、CD44-FGFR2、FGFR2-CTNND2、FGFR2-FAM24B、FGFR2-GOLGA2、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-SENP6、FGFR2-YPEL5、FGFR3-JAKMIP1、WDR11-FGFR2、FGFR1-S125L、FGFR2-E565A、FGFR2-P253L、FGFR2-W72C、FGFR3-P250R或FGFR3-R399C。
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-NOL4、FGFR2-PAWR、FGFR2-SENP6、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-TACC3、FGFR1-K656E、FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C、FGFR2-Y375C、FGFR3-R248C或FGFR3-S249C。
在某些实施方案中,患者不具有FGFR缬氨酸看守或耐药性改变,特别是选自以下的缬氨酸看守或耐药性改变:FGFR1 V561、FGFR2 V564、FGFR3 V555、FGFR4 V550、FGFR1N546、FGFR2 N549、FGFR3 N540和FGFR4 N535。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。在某些实施方案中,FGFR融合是FGFR1融合,特别是如本文所述的FGFR1融合。在某些实施方案中,FGFR融合是FGFR2融合,特别是如本文所述的FGFR2融合。在某些实施方案中,FGFR融合是FGFR3融合,特别是如本文所述的FGFR3融合。在某些实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合,特别是如本文所述的FGFR1融合、FGFR2融合或FGFR3融合。在某些实施方案中,FGFR融合是FGFR2融合或FGFR3融合,特别是如本文所述的FGFR2融合或FGFR3融合。在某些实施方案中,FGFR突变是FGFR2突变,特别是如本文所述的FGFR2突变。在某些实施方案中,FGFR突变是FGFR3突变,特别是如本文所述的FGFR3突变。在某些实施方案中,FGFR突变是FGFR2突变或FGFR3突变,特别是如本文所述的FGFR2突变或FGFR3突变。在某些实施方案中,适应症是具有FGFR1融合(特别是如本文所述的FGFR1融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2融合(特别是如本文所述的FGFR2融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR3融合(特别是如本文所述的FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR1融合、FGFR2融合或FGFR3融合(特别是如本文所述的FGFR1融合、FGFR2融合或FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2融合或FGFR3融合(特别是如本文所述的FGFR2融合或FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2突变(特别是如本文所述的FGFR2突变)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR3突变(特别是如本文所述的FGFR3突变)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2突变或FGFR3突变(特别是如本文所述的FGFR2突变或FGFR3突变)的晚期实体瘤。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的儿科患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),其中该癌症是多形性胶质母细胞瘤、低级别神经胶质瘤、毛细胞性星形细胞瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、尤文肉瘤或髓母细胞瘤。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的儿科患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),其中该癌症是胚胎发育不良性神经上皮肿瘤、胶质母细胞瘤、神经胶质瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、尤文肉瘤或髓母细胞瘤。在某些实施方案中,神经胶质瘤包括低级别神经胶质瘤和高级别神经胶质瘤。在某些实施方案中,低级别神经胶质瘤包括多毛细胞性星形细胞瘤、星形细胞瘤、毛细胞粘液性星形细胞瘤、少形性星形细胞瘤和多形性黄色星形细胞瘤。在某些实施方案中,高级别神经胶质瘤包括间变性星形细胞瘤。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了治疗多形性胶质母细胞瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有多形性胶质母细胞瘤并且具有至少一种FGFR基因改变的儿科患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼)。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。蛋白酪氨酸激酶(PTK)受体的成纤维细胞生长因子(FGF)家族调节多种生理功能,包括有丝分裂发生、伤口愈合、细胞分化和血管生成以及发育。正常和恶性细胞生长以及增殖都受到FGF局部浓度变化的影响,FGF是作为自分泌因子以及旁分泌因子的细胞外信号分子。自分泌FGF信号传导在类固醇激素依赖性癌症向激素非依赖性状态的进展中可能特别重要。
FGF和它们的受体在几种组织和细胞系中以增加的水平表达,并且认为过表达有助于恶性表型。此外,许多癌基因是编码生长因子受体的基因的同源物,并且在人胰腺癌中存在FGF依赖性信号传导的异常活化的潜力(Knights等人,Pharmacology andTherapeutics 2010 125:1(105-117);Korc M等人,Current Cancer Drug Targets 20099:5(639-651))。
两种原型成员是酸性成纤维细胞生长因子(aFGF或FGF1)和碱性成纤维细胞生长因子(bFGF或FGF2),并且迄今为止,已经鉴定了至少二十种不同的FGF家族成员。对FGF的细胞反应经由编号为1至4的四种类型的高亲和力跨膜蛋白酪氨酸激酶成纤维细胞生长因子受体(FGFR,FGFR1至FGFR4)传递。
在某些实施方案中,癌症易受FGFR基因改变的影响。
如本文所用,“FGFR基因改变”是指野生型FGFR基因的改变,包括但不限于FGFR融合基因、FGFR突变或它们的任何组合。术语“变体”和“改变”在本文中可互换使用。
在某些实施方案中,FGFR基因改变是FGFR基因融合。“FGFR融合”或“FGFR基因融合”是指编码FGFR的一部分(例如,FGRF2或FGFR3)和本文公开的融合配偶体之一或其一部分的基因,其通过两个基因之间的易位产生。术语“融合”和“易位”在本文中可互换使用。表9、表14和表19提供了FGFR融合基因以及FGFR和融合配偶体。
表1提供了示例性FGFR融合和基因断点的列表。
表1
在任何所描述的实施方案中,FGFR融合可以是任何FGFR融合,其中FGFR蛋白具有完整FGFR激酶结构域。在某些实施方案中,至少一种FGFR融合选自FGFR1-PLAG1、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-TACC3、FGFR3-TMEM247和FGFR3-WHSC1。
在某些实施方案中,至少一种FGFR融合选自FGFR1-BAG4、IGSF3-FGFR1、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-PTEN、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-WAC、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-TACC3、FGFR3-TMEM247和FGFR3-WHSC1。
在某些实施方案中,至少一种FGFR融合选自FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-CTNND2、FGFR2-YPEL5、FGFR2-SENP6、FGFR1-PLAG1、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-TACC3、FGFR3-TMEM247和FGFR3-WHSC1。
在某些实施方案中,至少一种FGFR融合选自BAG4-FGFR1、CD44-FGFR2、FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-CTNND2、FGFR2-ENOX1、FGFR2-FAM24B、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GOLGA2、FGFR2-GPHN、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-SENP6、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR2-YPEL5、FGFR3-ENOX1、FGFR3-JAKMIP1、FGFR3-MYH14、FGFR3-TACC3、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1、WDR11-FGFR2、WHSC1-FGFR3和WHSC1L1-FGFR1。
在某些实施方案中,至少一种FGFR融合选自FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-NOL4、FGFR2-PAWR、FGFR2-SENP6、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC和FGFR3-TACC3。
在某些实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。
在某些实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。
FGFR基因改变包括FGFR单核苷酸多态性(SNP)。“FGFR单核苷酸多态性”(SNP)是指个体中单个核苷酸不同的FGFR基因。在某些实施方案中,FGFR基因改变是FGFR3基因突变。具体地,“FGFR单核苷酸多态性”(SNP)是指个体中单个核苷酸不同的FGFR1、FGFR2或FGFR3基因。表9、表14或表19中的来自患者的生物样品中一种或多种FGFR SNP的存在可以通过本领域普通技术人员已知的方法或WO 2016/048833中公开的方法来确定。
在某些实施方案中,至少一种FGFR突变选自FGFR1-K656E、FGFR2-C382R、FGFR2-D101Y、FGFR2-F276C、FGFR2-K659M、FGFR2-L551F、FGFR2-L770V、FGFR2-S252L、FGFR2-S267P、FGFR2-V395D、FGFR2-Y375C、FGFR3-A500T、FGFR3-F384L、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F和FGFR3-S371G。
在某些实施方案中,至少一种FGFR突变选自FGFR1-K656E、FGFR2-C382R、FGFR2-D101Y、FGFR2-F276C、FGFR2-K659M、FGFR2-L551F、FGFR2-L770V、FGFR2-S252L、FGFR2-S267P、FGFR2-V395D、FGFR2-Y375C、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F和FGFR3-S371G。
在某些实施方案中,至少一种FGFR突变选自FGFR1-K656E、FGFR1-S125L、FGFR2-C382R、FGFR2-D101Y、FGFR2-E565A、FGFR2-F276C、FGFR2-K659M、FGFR2-L551F、FGFR2-L770V、FGFR2-P253L、FGFR2-S252L、FGFR2-S267P、FGFR2-V395D、FGFR2-W72C、FGFR2-Y375C、FGFR3-A500T、FGFR3-F384L、FGFR3-P250R、FGFR3-R248C、FGFR3-R399C、FGFR3-S249C、FGFR3-S249F和FGFR3-S371G。
在某些实施方案中,至少一种FGFR突变选自FGFR1-K656E、FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C、FGFR2-Y375C、FGFR3-R248C和FGFR3-S249C。
在某些实施方案中,至少一种FGFR突变不是FGFR缬氨酸看守或耐药性改变。在某些实施方案中,至少一种FGFR突变不是FGFR1 V561、FGFR2 V564、FGFR3 V555、FGFR4 V550、FGFR1 N546、FGFR2 N549、FGFR3 N540或FGFR4 N535。
如本文所用,“FGFR基因改变基因组”包括一种或多种上文列出的FGFR基因改变。在一些实施方案中,FGFR基因改变基因组依赖于患者的癌症类型。
在所公开的方法的评估步骤中使用的FGFR基因改变基因组部分地基于患者的癌症类型。对于患有癌症的患者,合适的FGFR基因改变基因小组可以包含表9、表14或表19中公开的任何FGFR基因改变。在一个实施方案中,对于患有癌症的患者,合适的FGFR基因改变基因小组可以包含实施例1A的靶FGFR突变中公开的任何FGFR基因改变。在一个实施方案中,对于患有癌症的患者,合适的FGFR基因改变基因小组可以包含实施例1B的靶FGFR突变中公开的任何FGFR基因改变。
在所公开的方法或用途中使用的FGFR抑制剂
本文提供了用于所公开的方法或用途的合适的FGFR抑制剂。FGFR抑制剂可单独或组合用于本文所述的治疗方法。
在一些实施方案中,如果样品中存在一种或多种FGFR基因改变,则可用美国公布2013/0072457A1(以引用方式并入本文)中公开的FGFR抑制剂(包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物)治疗癌症。
在一些方面,例如,可用N-(3,5-二甲氧基-苯基)-N'-(1-甲基乙基)-N-[3-(1-甲基-1H-吡唑-4-基)喹喔啉-6-基]乙烷-1,2-二胺(本文称为“JNJ-42756493”或“JNJ493”或厄达替尼),包括其任何互变异构形式、其N-氧化物、其药学上可接受的盐或其溶剂化物来治疗癌症。在一些实施方案中,FGFR抑制剂可以是式(I)的化合物,也称为厄达替尼:
或其药学上可接受的盐。在一些方面,药学上可接受的盐是HCl盐。在优选的方面,使用厄达替尼碱。
厄达替尼(也称为ERDA),一种口服泛FGFR激酶抑制剂,已经被美国食品药物管理局(FDA)批准用于治疗患有具有易感的FGFR3或FGFR2基因改变的局部晚期UC或mUC并且在至少一线先前含铂化学疗法期间或之后,包括在新辅助或辅助含铂化学疗法的12个月内已经进展的成年患者。Loriot Y等人,NEJM.2019;381:338-48。厄达替尼已经在患有mUC和具有FGFR表达改变的患者中显示临床益处和耐受性。Tabernero J等人,J Clin Oncol.2015;33:3401-3408;Soria J-C等人,Ann Oncol.2016;27(附刊6):vi266-vi295.摘要781PD;Siefker-Radtke AO等人,ASCO 2018。摘要4503;Siefker-Radtke A等人,ASCO-GU 2018.摘要450。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是N-[5-[2-(3,5-二甲氧基苯基)乙基]-2H-吡唑-3-基]-4-(3,5-二甲基哌嗪-1-基)苯甲酰胺(AZD4547),如Gavine,P.R.等人,AZD4547:An Orally Bioavailable,Potent,and SelectiveInhibitor of the Fibroblast Growth Factor Receptor Tyrosine Kinase Family,Cancer Res.2012年4月15日,72;2045中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是3-(2,6-二氯-3,5-二甲氧基-苯基)-l-{6-[4-(4-乙基-哌嗪-l-基)-苯基氨基]-嘧啶-4-基}-甲基-脲(也称为NVP-BGJ398或英菲格拉替尼(infigratinib)),如国际公布WO2006/000420中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是4-氨基-5-氟-3-[6-(4-甲基哌嗪-l-基)-lH-苯并咪唑-2-基]-lH-喹啉-2-酮(多韦替尼(dovitinib)),如国际公布号WO2006/127926中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是6-(7-((l-氨基环丙基)-甲氧基)-6-甲氧基喹啉-4-基氧基)-N-甲基-1-萘甲酰胺(AL3810)(卢西替尼(lucitanib);E-3810),如Bello,E.等人,E-3810Is a Potent Dual Inhibitor of VEGFRand FGFR that Exerts Antitumor Activity in Multiple Preclinical Models,CancerRes,2011年2月15日,71(A)1396-1405和国际公布号WO2008/112408中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是(4-{[4-氨基-6-(甲氧基甲基)-5-(7-甲氧基-5-甲基-1-苯并噻吩-2-基)吡咯并[2,1-f][1,2,4]三嗪-7-基]甲基}哌嗪-2-酮)(也称为BAY1163877或罗加替尼(rogaratinib)),如Grunewald等人,Rogaratinib:A potent and selective pan-FGFR inhibitor with broadantitumor activity in FGFR-overexpressing preclinical cancer models,IntJournal of Cancer 145(5),2019中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是(1-[(3S)-[4-氨基-3-[(3,5-二甲氧基苯基)乙炔基]-1H-吡唑并[3,4-d]嘧啶-1-基]-1-吡咯烷基]-2-丙烯-1-酮)(也称为TAS-120或福巴替尼(futibatinib)),如Sootome等人,FutibatinibIs a Novel Irreversible FGFR 1–4Inhibitor That Shows Selective AntitumorActivity against FGFR-Deregulated Tumors,Cancer Res;80(22)2020年11月15日中所述:
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一些实施方案中,可用FGFR抑制剂来治疗癌症,其中FGFR抑制剂是3-(2,6-二氟-3,5-二甲氧基苯基)1-乙基-8-(吗啉-4-基甲基)-1,3,4,7-四氢-2H-吡咯并[3',2':5,6]吡啶并[4,3d]嘧啶-2-酮(也称为佩米替尼(pemigatinib)或
当化学上可能时,包括其任何互变异构或立体化学异构形式,及其N-氧化物、其药学上可接受的盐或其溶剂化物。
另外合适的FGFR抑制剂包括BAY1179470(Bayer)、ARQ087(ArQule)、ASP5878(Astellas)、FF284(Chugai)、FP-1039(GSK/FivePrime)、Blueprint、LY-2874455(Lilly)、RG-7444(Roche)或它们的任何组合,当化学上可能时,包括其任何互变异构或立体化学异构形式、其N-氧化物、其药学上可接受的盐或其溶剂化物。
在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼作为药学上可接受的盐施用。在一个优选的实施方案中,通常FGFR抑制剂且更具体地厄达替尼以碱形式施用。在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼作为药学上可接受的盐以对应于5mg碱当量、6mg碱当量、8mg碱当量或9mg碱当量的量施用。在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼以5mg、6mg、8mg或9mg的量以碱形式施用。在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼作为药学上可接受的盐以对应于3mg碱当量或4mg碱当量的量施用。在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼以3mg或4mg的量以碱形式施用。
该盐可通过例如使通常FGFR抑制剂且更具体地厄达替尼在适当的溶剂中与适当的酸反应来制备。
酸加成盐可与无机酸和有机酸形成。酸加成盐的示例包括与选自由以下项组成的组的酸形成的盐:乙酸、盐酸、氢碘酸、磷酸、硝酸、硫酸、柠檬酸、乳酸、琥珀酸、马来酸、苹果酸、羟乙磺酸、富马酸、苯磺酸、甲苯磺酸、甲磺酸(甲磺酸盐)、乙磺酸、萘磺酸、戊酸、乙酸、丙酸、丁酸、丙二酸、葡糖醛酸和乳糖酸。另一组酸加成盐包括由乙酸、己二酸、抗坏血酸、天冬氨酸、柠檬酸、DL-乳酸、富马酸、葡糖酸、葡糖醛酸、马尿酸、盐酸、谷氨酸、DL-苹果酸、甲磺酸、癸二酸、硬脂酸、琥珀酸和酒石酸形成的盐。
在一个实施方案中,通常FGFR抑制剂且更具体地厄达替尼以溶剂化物的形式施用。如本文所用,术语“溶剂化物”意指厄达替尼与一种或多种溶剂分子的物理缔合。该物理缔合涉及不同程度的离子键合和共价键合,包括氢键合。在某些情况下,溶剂化物将能够在例如一个或多个溶剂分子掺入在结晶固体的晶格中时分离出来。术语“溶剂化物”旨在既涵盖溶液相溶剂化物又涵盖可分离的溶剂化物。可形成溶剂化物的溶剂的非限制性示例包括水、异丙醇、乙醇、甲醇、DMSO、乙酸乙酯、乙酸或乙醇胺等。
溶剂化物在药物化学中是众所周知的。它们对于用于制备物质的方法(例如,关于它们的纯化、物质的储存(例如,其稳定性)和物质的处理的容易性)可能是重要的,并且通常形成为化学合成的分离或纯化阶段的一部分。本领域技术人员可通过标准和长期使用的技术确定水合物或其他溶剂化物是否通过用于制备给定化合物的分离条件或纯化条件形成。此类技术的示例包括热重量分析(TGA)、差示扫描量热法(DSC)、X射线晶体学(例如,单晶X射线晶体学或X射线粉末衍射)和固态NMR(SS-NMR,也称为魔角旋转NMR或MAS-NMR)。此类技术是熟练化学家的标准分析工具包的一部分,如NMR、IR、HPLC和MS。另选地,技术人员可使用包括特定溶剂化物所需的溶剂的量的结晶条件有意地形成溶剂化物。此后,上述标准方法可用于确定是否已经形成溶剂化物。还涵盖任何络合物(例如,与化合物诸如环糊精的包合络合物或包合物,或与金属的络合物)。
此外,该化合物可具有一种或多种多晶型体(结晶)或无定形形式。
该化合物包括具有一个或多个同位素取代的化合物,并且对特定元素的提及在其范围内包括该元素的所有同位素。例如,对氢的提及在其范围内包括
治疗方法和用途
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。在某些实施方案中,癌症是NSCLC,特别是非鳞状NSCLC、胆管癌、胰腺癌、高级别神经胶质瘤、胸腺癌或卵巢癌。
本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。在某些实施方案中,癌症是非鳞状NSCLC、胆管癌、胰腺癌、高级别神经胶质瘤、胸腺癌或卵巢癌。
本文描述了治疗NSCLC的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有NSCLC(特别是非鳞状NSCLC)并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,至少一种FGFR融合是FGFR2-CCDC102A。
本文描述了治疗胆管癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胆管癌并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,至少一种FGFR融合是FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2或RRM2B-FGFR2。在某些实施方案中,至少一种FGFR融合是FGFR2-ENOX1或FGFR2-PDE3A。
本文描述了治疗胰腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胰腺癌并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,FGFR融合是FGFR2-GPHN。
本文描述了治疗高级别神经胶质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有高级别神经胶质瘤并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,FGFR融合是FGFR3-ENOX1。
本文描述了治疗胸腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胸腺癌并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,FGFR融合是IGSF3-FGFR1。
本文描述了治疗卵巢癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有卵巢癌并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,FGFR融合是RHPN2-FGFR1。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤、具有靶FGFR突变或融合、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。在一个实施方案中,靶FGFR突变或融合如本文的实施方案中所述。在一个实施方案中,靶FGFR突变或融合是选自实施例1A的靶FGFR突变或选自实施例1B的靶FGFR突变的FGFR突变。在一个实施方案中,靶FGFR突变或融合是具有完整FGFR激酶结构域的FGFR融合。在一个实施方案中,靶FGFR突变或融合是选自实施例1A的靶FGFR突变或选自实施例1B的靶FGFR突变的FGFR突变,或者是选自具有完整FGFR激酶结构域的FGFR融合的FGFR融合。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中所述癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合。在一个实施方案中,至少一种FGFR基因改变、至少一种FGFR突变或至少一种FGFR融合如本文的实施方案中所述。在一个实施方案中,至少一种FGFR基因改变选自实施例1A的靶FGFR突变或选自实施例1B的靶FGFR突变。在一个实施方案中,至少一种FGFR基因改变是与完整FGFR激酶结构域的FGFR融合。在一个实施方案中,至少一种FGFR基因改变选自实施例1A的靶FGFR突变或选自实施例1B的靶FGFR突变或选自与完整FGFR激酶结构域的FGFR融合。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗胆管癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胆管癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在某些实施方案中,至少一种FGFR融合选自FGFR2-AHCYL1、FGFR2-AMOT、FGFR2-BICC1、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-ENOX1、FGFR2-KIAA1598、FGFR2-LGSN、FGFR2-NOL4、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-WAC和FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合选自FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-ENOX1、FGFR2-KIAA1598、FGFR2-LGSN、FGFR2-NOL4、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-WAC和FGFR3-TACC3。在一个实施方案中,至少一种FGFR融合是FGFR2-AHCYL1。在一个实施方案中,至少一种FGFR融合是FGFR2-AMOT。在一个实施方案中,至少一种FGFR融合是FGFR2-BICC1。在一个实施方案中,至少一种FGFR融合是FGFR2-CD2AP。在一个实施方案中,至少一种FGFR融合是FGFR2-CFAP57。在一个实施方案中,至少一种FGFR融合是FGFR2-ENOX1。在一个实施方案中,至少一种FGFR融合是FGFR2-KIAA1598。在一个实施方案中,至少一种FGFR融合是FGFR2-LGSN。在一个实施方案中,至少一种FGFR融合是FGFR2-NOL4。在一个实施方案中,至少一种FGFR融合是FGFR2-PAWR。在一个实施方案中,至少一种FGFR融合是FGFR2-PDE3A。在一个实施方案中,至少一种FGFR融合是FGFR2-POC1B。在一个实施方案中,至少一种FGFR融合是FGFR2-SYNPO2。在一个实施方案中,至少一种FGFR融合是FGFR2-TACC2。在一个实施方案中,至少一种FGFR融合是FGFR2-TBC1D4。在一个实施方案中,至少一种FGFR融合是FGFR2-TRA2B。在一个实施方案中,至少一种FGFR融合是FGFR2-WAC。在一个实施方案中,至少一种FGFR融合是FGFR3-TACC3。
本文还描述了治疗胆管癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胆管癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2融合。在某些实施方案中,至少一种FGFR突变选自FGFR2-C382R和FGFR2-V395D。在一个实施方案中,至少一种FGFR突变是FGFR2-C382R。在一个实施方案中,至少一种FGFR突变是FGFR2-V395D。
本文还描述了治疗高级别神经胶质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有高级别神经胶质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1、FGFR2或FGFR3融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-TACC1、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-TACC3、FGFR3-TMEM247和FGFR2-IMPA1或选自FGFR1-TACC1、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-TACC3和FGFR3-TMEM247。在一个实施方案中,至少一种FGFR融合是FGFR1-TACC1。在一个实施方案中,至少一种FGFR融合是FGFR3-ENOX1。在一个实施方案中,至少一种FGFR融合是FGFR3-MYH14。在一个实施方案中,至少一种FGFR融合是FGFR3-TACC3。在一个实施方案中,至少一种FGFR融合是FGFR3-TMEM247。在一个实施方案中,FGFR融合是FGFR2-IMPA1。
本文还描述了治疗高级别神经胶质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有高级别神经胶质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变和FGFR2突变或FGFR3突变。
本文还描述了治疗胰腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胰腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-MTUS1、FGFR2-ATAD2、FGFR2-CIT、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIF6、FGFR2-NRBF2、FGFR2-ALDH1L1和FGFR2-KIAA1598。在某些实施方案中,至少一种FGFR融合选自FGFR1-MTUS1、FGFR2-ATAD2、FGFR2-CIT、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIF6、FGFR2-NRBF2、FGFR2-ALDH1L1、FGFR2-KIAA1598和FGFR2-PAWR。在一个实施方案中,至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-MTUS1、FGFR2-ATAD2、FGFR2-CIT、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIF6、FGFR2-NRBF2和FGFR2-PTEN。在一个实施方案中,至少一种FGFR融合是FGFR1-MTUS1。在一个实施方案中,至少一种FGFR融合是FGFR2-ATAD2。在一个实施方案中,至少一种FGFR融合是FGFR2-CIT。在一个实施方案中,至少一种FGFR融合是FGFR2-GKAP1。在一个实施方案中,至少一种FGFR融合是FGFR2-GPHN。在一个实施方案中,至少一种FGFR融合是FGFR2-KCTD1。在一个实施方案中,至少一种FGFR融合是FGFR2-KIF6。在一个实施方案中,至少一种FGFR融合是FGFR2-NRBF2。在一个实施方案中,至少一种FGFR融合是FGFR2-PTEN。在一个实施方案中,至少一种FGFR融合是FGFR2-ALDH1L1。在一个实施方案中,至少一种FGFR融合是FGFR2-KIAA1598。在一个实施方案中,至少一种FGFR融合是FGFR2-PAWR。
本文还描述了治疗胰腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胰腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1、FGFR2或FGFR3突变。
本文还描述了治疗鳞状NSCLC的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有鳞状NSCLC并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR3-TACC3、FGFR3-TACC2和WDR11-FGFR2。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR2-TACC2。在某些实施方案中,至少一种FGFR融合是WDR11-FGFR2。
本文还描述了治疗鳞状NSCLC的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有鳞状NSCLC并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR3-R248C和FGFR3-S249C。在某些实施方案中,至少一种FGFR突变是FGFR3-R248C。在某些实施方案中,至少一种FGFR突变是FGFR3-S249C。
本文还描述了治疗非鳞状NSCLC的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有非鳞状NSCLC并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合或FGFR3融合。在某些实施方案中,至少一种FGFR融合选自FGFR2-BICC1、FGFR3-TACC3和FGFR2-CCDC102A。在某些实施方案中,至少一种FGFR融合选自FGFR2-BICC1、FGFR3-TACC3、FGFR2-CCDC102A和FGFR2-TACC2。在一个实施方案中,至少一种FGFR融合是FGFR2-BICC1。在一个实施方案中,至少一种FGFR融合是FGFR3-TACC3。在一个实施方案中,至少一种FGFR融合是FGFR2-CCDC102A。在一个实施方案中,至少一种FGFR融合是FGFR2-TACC2。
本文还描述了治疗非鳞状NSCLC的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有非鳞状NSCLC并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变或FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-Y375C、FGFR3-R399C和FGFR3-S249C。在某些实施方案中,至少一种FGFR突变是FGFR2-Y375C。在某些实施方案中,至少一种FGFR突变是FGFR3-R399C。在某些实施方案中,至少一种FGFR突变是FGFR3-S249C。
本文还描述了治疗乳腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有乳腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-FKBP15、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TCERG1L、FGFR2-BICC1和FGFR2-KIAA1598或选自FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-FKBP15、FGFR2-TACC2、FGFR2-TBC1D4和FGFR2-TCERG1L。在某些实施方案中,至少一种FGFR融合选自FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-FKBP15、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TCERG1L、FGFR2-BICC1 FGFR2-KIAA1598、CD44-FGFR2 FGFR2-FAM24B。在一个实施方案中,至少一种FGFR融合是FGFR1-TACC1。在一个实施方案中,至少一种FGFR融合是FGFR1-WHSC1L1。在一个实施方案中,至少一种FGFR融合是WHSC1L1-FGFR1。在一个实施方案中,至少一种FGFR融合是FGFR2-FKBP15。在一个实施方案中,至少一种FGFR融合是FGFR2-TACC2。在一个实施方案中,至少一种FGFR融合是FGFR2-TBC1D4。在一个实施方案中,至少一种FGFR融合是FGFR2-TCERG1L。在一个实施方案中,至少一种FGFR融合是FGFR2-BICC1。在一个实施方案中,至少一种FGFR融合是FGFR2-KIAA1598。在一个实施方案中,至少一种FGFR融合是CD44-FGFR2。在一个实施方案中,至少一种FGFR融合是FGFR2-FAM24B。
本文还描述了治疗乳腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有乳腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变或FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-C382R、FGFR2-K659M、FGFR3-R248C和FGFR3-Y375C或选自FGFR2-C382R和FGFR2-K659M。在一个实施方案中,至少一种FGFR突变是FGFR2-C382R。在一个实施方案中,至少一种FGFR突变是FGFR2-K659M。在一个实施方案中,至少一种FGFR突变是FGFR3-R248C。在一个实施方案中,至少一种FGFR突变是FGFR3-Y375C。
本文还描述了治疗结肠直肠癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有结肠直肠癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合或FGFR3融合。在某些实施方案中,至少一种FGFR融合选自FGFR2-BICC1和FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR2-BICC1。
本文还描述了治疗结肠直肠癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有结肠直肠癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGR2突变或FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-L770V、FGFR3-A500T和FGFR3-F384L。在一个实施方案中,至少一种FGFR突变是FGFR2-L770V。在一个实施方案中,至少一种FGFR突变是FGFR3-A500T。在一个实施方案中,至少一种FGFR突变是FGFR3-F384L。
本文还描述了治疗子宫内膜癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有子宫内膜癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗子宫内膜癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有子宫内膜癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR1或FGFR2突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-C382R、FGFR2-D101Y、FGFR2-L551F和FGFR2-Y375C。在某些实施方案中,至少一种FGFR突变选自FGFR1-S125L、FGFR2-C382R、FGFR2-D101Y、FGFR2-L551F和FGFR2-Y375C。在一个实施方案中,至少一种FGFR突变是FGFR1-S125L。在一个实施方案中,至少一种FGFR突变是FGFR2-C382R。在一个实施方案中,至少一种FGFR突变是FGFR2-C382R。在一个实施方案中,至少一种FGFR突变是FGFR2-D101Y。在一个实施方案中,至少一种FGFR突变是FGFR2-L551F。在一个实施方案中,至少一种FGFR突变是FGFR2-Y375C。
本文还描述了治疗胃癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胃癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR3-TACC3和FGFR2-HTRA1。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。在某些实施方案中,FGFR融合是FGFR2-HTRA1。
本文还描述了治疗胃癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胃癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变或FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-Y375C、FGFR3-S249C和FGFR3-A500T。在一个实施方案中,至少一种FGFR突变是FGFR2-Y375C。在一个实施方案中,至少一种FGFR突变是FGFR3-S249C。在一个实施方案中,至少一种FGFR突变是FGFR3-A500T。
本文还描述了治疗卵巢癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有卵巢癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合或FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-RHPN2、FGFR2-AGAP1和FGFR2-CLOCK。在某些实施方案中,至少一种FGFR融合选自RHPN2-FGFR1、FGFR2-AGAP1和FGFR2-CLOCK。在一个实施方案中,至少一种FGFR融合是FGFR1-RHPN2。在一个实施方案中,至少一种FGFR融合是RHPN2-FGFR1。在一个实施方案中,至少一种FGFR融合是FGFR2-AGAP1。在一个实施方案中,至少一种FGFR融合是FGFR2-CLOCK。
本文还描述了治疗卵巢癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有卵巢癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-S249C。
本文还描述了治疗原发灶不明癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有原发灶不明癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合。在某些实施方案中,至少一种FGFR融合选自FGFR2-TBC1D5和FGFR2-BICC1。在某些实施方案中,至少一种FGFR融合选自FGFR2-TBC1D5、FGFR2-BICC1、FGFR2-CTNND2和FGFR2-YPEL5。在一个实施方案中,至少一种FGFR融合是FGFR2-TBC1D5。在一个实施方案中,至少一种FGFR融合是FGFR2-BICC1。在一个实施方案中,至少一种FGFR融合是FGFR2-CTNND2。在一个实施方案中,至少一种FGFR融合是FGFR2-YPEL5。
本文还描述了治疗原发灶不明癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有原发灶不明癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变或FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR3-S249C、FGFR2-S267P和FGFR2-Y375C。在一个实施方案中,至少一种FGFR突变是FGFR3-S249C。在一个实施方案中,至少一种FGFR突变是FGFR2-S267P。在一个实施方案中,至少一种FGFR突变是FGFR2-Y375C。
本文还描述了治疗宫颈癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有宫颈癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合和FGFR2融合或FGFR3融合。在一个实施方案中,FGFR融合是FGFR3融合。在一个实施方案中,至少一种FGFR突变是FGFR3-TACC3。
本文还描述了治疗宫颈癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有宫颈癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-S249C。
本文还描述了治疗鳞状细胞头颈癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有鳞状细胞头颈癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。
本文还描述了治疗鳞状细胞头颈癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有鳞状细胞头颈癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变选自FGFR3-S249C和FGFR3-S371G。在一个实施方案中,至少一种FGFR突变是FGFR3-S249C。在一个实施方案中,至少一种FGFR突变是FGFR3-S371G。
本文还描述了治疗食道癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有食道癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合。在某些实施方案中,至少一种FGFR融合选自FGFR3-JAKMIP1和FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR3-JAKMIP1。
本文还描述了治疗食道癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有食道癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-R248C。在某些实施方案中,至少一种FGFR突变是FGFR3-A500T。
本文还描述了治疗低级别神经胶质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有低级别神经胶质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合、FGFR2融合或FGFR1融合。在某些实施方案中,至少一种FGFR融合选自FGFR1-TACC1、FGFR2-VPS35和FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。在某些实施方案中,至少一种FGFR融合是FGFR2-VPS35。在某些实施方案中,至少一种FGFR融合是FGFR1-TACC1。
本文还描述了治疗低级别神经胶质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有低级别神经胶质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR1突变。在某些实施方案中,至少一种FGFR突变是FGFR1-K656E。
本文还描述了治疗前列腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有前列腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合。在某些实施方案中,至少一种FGFR融合是FGFR3-WHSC1。在某些实施方案中,至少一种FGFR融合是WHSC1-FGFR3。
本文还描述了治疗前列腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有前列腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-R248C。
本文还描述了治疗唾液腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有唾液腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合。在某些实施方案中,至少一种FGFR融合是FGFR1-PLAG1。在某些实施方案中,至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变。在某些实施方案中,至少一种FGFR突变是FGFR2-C382R。在某些实施方案中,至少一种FGFR基因改变是FGFR融合和FGFR突变。在某些实施方案中,FGFR融合和FGFR突变是FGFR1-PLAG1和FGFR2-C382R。本文还描述了治疗唾液腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有唾液腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变。在某些实施方案中,至少一种FGFR突变选自FGFR2-C382R、FGFR2-F276C和FGFR2-Y375C。在某些实施方案中,至少一种FGFR突变选自FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C和FGFR2-Y375C。在一个实施方案中,至少一种FGFR突变是FGFR2-C382R。在一个实施方案中,至少一种FGFR突变是FGFR2-F276C。在一个实施方案中,至少一种FGFR突变是FGFR2-Y375C。在一个实施方案中,至少一种FGFR突变是FGFR2-E565A。在一个实施方案中,至少一种FGFR突变是FGFR2-W72C。在一个实施方案中,至少一种FGFR突变是FGFR2-E565A和FGFR2-W72C。
本文还描述了治疗基底细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有基底细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗基底细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有基底细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变。在某些实施方案中,至少一种FGFR突变是FGFR2-S252L。
本文还描述了治疗胸腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胸腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合。在某些实施方案中,至少一种FGFR融合是IGSF3-FGFR1。
本文还描述了治疗胸腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胸腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗小肠腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有小肠腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗小肠腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有小肠腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗肝细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有肝细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗肝细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有肝细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗微囊肿性附属器癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有微囊肿性附属器癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗微囊肿性附属器癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有微囊肿性附属器癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗棘细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有棘细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗棘细胞癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有棘细胞癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗胃肠道间质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胃肠道间质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗胃肠道间质瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胃肠道间质瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制
剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-S249F。
本文还描述了治疗甲状旁腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有甲状旁腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR1融合。在某些实施方案中,至少一种FGFR融合是FGFR1-BAG4。在某些实施方案中,至少一种FGFR融合是BAG4-FGFR1。
本文还描述了治疗甲状旁腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有甲状旁腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗软组织肉瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有软组织肉瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合,特别是FGFR1融合。在某些实施方案中,至少一种FGFR融合是FGFR1-MTUS1。
本文还描述了治疗软组织肉瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有软组织肉瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR1突变。在某些实施方案中,至少一种FGFR突变是FGFR1-K656E。
本文还描述了治疗CUP综合征的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有CUP综合征并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合。在某些实施方案中,至少一种FGFR融合是FGFR2-BICC1。
本文还描述了治疗CUP综合征的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有CUP综合征并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗肛门腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有肛门腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗肛门腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有肛门腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-R428C。
本文还描述了治疗肛门腺样囊性癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有腺样囊性癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗腺样囊性癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有肛门腺样囊性癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变。在某些实施方案中,至少一种FGFR突变是FGFR2-P253L。
本文还描述了治疗结膜表皮样癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有结膜表皮样癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗结膜表皮样癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有结膜表皮样癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-S294C。
本文还描述了治疗十二指肠癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有十二指肠癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合。在某些实施方案中,至少一种FGFR融合是FGFR2-TACC2。
本文还描述了治疗十二指肠癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有十二指肠癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗胆囊癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胆囊癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗胆囊癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有胆囊癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR2突变。在某些实施方案中,至少一种FGFR突变是FGFR2-Y375C。
本文还描述了治疗生殖细胞肿瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有生殖细胞肿瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗生殖细胞肿瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有生殖细胞肿瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-P250R。
本文还描述了治疗间皮瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有间皮瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合。在某些实施方案中,至少一种FGFR融合是FGFR2-GOLGA2。
本文还描述了治疗间皮瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有间皮瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗恶性小圆细胞肿瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有恶性小圆细胞肿瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合。在一个实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合。
本文还描述了治疗恶性小圆细胞肿瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有恶性小圆细胞肿瘤并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变,特别是FGFR3突变。在某些实施方案中,至少一种FGFR突变是FGFR3-S249C。
本文还描述了治疗睾丸癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有睾丸癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR3融合。在某些实施方案中,至少一种FGFR融合是FGFR3-TACC3。
本文还描述了治疗睾丸癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有睾丸癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗甲状腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有甲状腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR融合,特别是FGFR2融合。在某些实施方案中,至少一种FGFR融合是FGFR3-SENP6。
本文还描述了治疗甲状腺癌的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有甲状腺癌并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,其中该至少一种FGFR基因改变是FGFR突变。在一个实施方案中,FGFR突变是FGFR1突变、FGFR2突变或FGFR3突变。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的儿科患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼),其中该癌症是多形性胶质母细胞瘤、低级别神经胶质瘤、毛细胞性星形细胞瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、尤文肉瘤或髓母细胞瘤。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了治疗多形性胶质母细胞瘤的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有多形性胶质母细胞瘤并且具有至少一种FGFR基因改变的儿科患者施用治疗有效量的FGFR抑制剂(特别是厄达替尼)。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了FGFR抑制剂(特别是厄达替尼)用于制造用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的儿科患者的药物的用途,其中该癌症是多形性胶质母细胞瘤、低级别神经胶质瘤、毛细胞性星形细胞瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、尤文肉瘤或髓母细胞瘤。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了FGFR抑制剂(特别是厄达替尼)用于制造用于治疗已被诊断患有多形性胶质母细胞瘤并且具有至少一种FGFR基因改变的儿科患者的药物的用途。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了一种在治疗具有至少一种FGFR基因改变的儿科患者的癌症中使用的FGFR抑制剂,特别是厄达替尼,其中该癌症是多形性胶质母细胞瘤、低级别神经胶质瘤、毛细胞性星形细胞瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、尤文肉瘤或髓母细胞瘤。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了一种在治疗具有至少一种FGFR基因改变的儿科患者的多形性胶质母细胞瘤中使用的FGFR抑制剂,特别是厄达替尼。在某些实施方案中,患者年龄为≥6岁至<18岁。在某些实施方案中,患者年龄为≥6岁至<12岁。在某些实施方案中,患者年龄为≥12岁至<15岁。在某些实施方案中,患者年龄为≥15岁至<18岁。在某些实施方案中,至少一种FGFR基因改变是FGFR突变或FGFR融合,特别是FGFR突变或与完整FGFR激酶结构域的FGFR融合。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的客观反应率的方法,所述方法包括向所述患者或所述患者群体提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,客观反应率由独立审查委员会评估。可以确定个体或患者群体的客观反应率。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约29%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约29.2%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约29%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约22%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%或36%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤、具有靶FGFR突变或融合、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,并且其中所述患者群体中的客观反应率如上所述。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善具有至少一种FGFR基因融合的癌症患者或患者群体的客观反应率的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,客观反应率由独立审查委员会评估。可以确定个体或患者群体的客观反应率。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约31.3%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约30%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约30%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约31%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约31%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约22%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%或36%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善具有至少一种FGFR基因突变的癌症患者或患者群体的客观反应率的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,客观反应率由独立审查委员会评估。可以确定个体或患者群体的客观反应率。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约25.7%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约26%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约25.7%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约26.8%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约27%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约22%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为至少约26%。在某些实施方案中,癌症患者群体的客观反应率(特别是由独立审查委员会评估的客观反应率)为约22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%或36%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善具有至少一种FGFR基因融合的癌症患者或患者群体的客观反应率的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,客观反应率由研究人员评估。可以确定个体或患者群体的客观反应率。在某些实施方案中,癌症患者群体的客观反应率(特别是研究人员评估的中值反应持续时间)为至少约26.4%。在某些实施方案中,癌症患者群体的客观反应率(特别是研究人员评估的客观反应率)为至少约26%。在某些实施方案中,癌症患者群体的客观反应率(特别是研究人员评估的客观反应率)为至少约22%。在某些实施方案中,癌症患者群体的客观反应率(特别是研究人员评估的客观反应率)为约22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%或36%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的中值反应持续时间的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,中值反应持续时间由独立审查委员会评估。可以确定个体或患者群体的中值反应持续时间。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为约6.90个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为约6.93个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为至少约6.93个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为约6.9个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为至少约6.9个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是由独立审查委员会评估的中值反应持续时间)为至少约5.0个月。在某些实施方案中,中值反应持续时间为约5.0个月、5.1个月、5.2个月、5.3个月、5.4个月、5.5个月、5.6个月、至少约5.7个月、5.8个月、5.9个月、6.0个月、6.1个月、6.2个月、6.3个月、6.4个月、6.5个月、6.6个月、6.7个月、6.8个月、6.9个月、7.0个月、7.1个月、7.2个月、7.3个月、7.4个月、7.5个月、7.6个月、7.8个月、7.9个月、8.0个月。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的中值反应持续时间的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,中值反应持续时间由研究人员评估。可以确定个体或患者群体的中值反应持续时间。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是研究人员评估的中值反应持续时间)为约7.1个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是研究人员评估的中值反应持续时间)为约7个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是研究人员评估的中值反应持续时间)为至少约7个月。在某些实施方案中,癌症患者群体的中值反应持续时间(特别是研究人员评估的中值反应持续时间)为至少约5.0个月。在某些实施方案中,中值反应持续时间为约5.0个月、5.1个月、5.2个月、5.3个月、5.4个月、5.5个月、5.6个月、至少约5.7个月、5.8个月、5.9个月、6.0个月、6.1个月、6.2个月、6.3个月、6.4个月、6.5个月、6.6个月、6.7个月、6.8个月、6.9个月、7.0个月、7.1个月、7.2个月、7.3个月、7.4个月、7.5个月、7.6个月、7.8个月、7.9个月、8.0个月。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤、具有靶FGFR突变或融合、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,并且其中所述患者群体中的中值反应持续时间如上所述。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的疾病控制率的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,疾病控制率由独立审查委员会评估。可以确定个体或患者群体的疾病控制率。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为约72.5%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为至少约72%或至少约72.5%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为约77.4%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为至少约77.4%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为至少约75%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为72.0%、72.5%、73%、73.5%、74%、74.5%、75%、75.5%、76%、76.6%、77%、77.7%或78%。在某些实施方案中,癌症患者群体的疾病控制率(特别是由独立审查委员会评估的疾病控制率)为75.0%、75.1%、75.2%、75.3%、75.4%、75.5%、75.6%、75.7%、75.8%、75.9%、76.0%、76.1%、76.2%、76.3%、76.4%、76.5%、76.6%、76.7%、76.8%、76.9%、77.0%、77.1%、77.2%、77.3%、77.4%、77.5%、77.6%、77.7%、77.8%、77.9%、78.0%、78.1%、78.2%、78.3%、78.4%、78.5%、78.6%、78.7%、78.8%、78.9%或79.0%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤、具有靶FGFR突变或融合、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,并且其中所述患者群体中的疾病控制率如上所述。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的中值反应时间的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,疾病控制率由独立审查委员会评估。可以确定个体或患者群体的中值反应时间。在某些实施方案中,癌症患者群体的中值反应时间(特别是由独立审查委员会评估的中值反应时间)为至少约1个月。在某些实施方案中,癌症患者群体的中值反应时间(特别是由独立审查委员会评估的中值反应时间)为约1.4个月。在某些实施方案中,癌症患者群体的中值反应时间(特别是由独立审查委员会评估的中值反应时间)为约1.0个月、1.1个月、1.2个月、1.3个月、1.4个月、1.5个月、1.6个月、1.7个月、1.8个月、1.9个月或2.0个月。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、乳腺癌、鳞状非小细胞肺癌(NSCLC)、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、鳞状细胞头颈癌、宫颈癌、低级别神经胶质瘤、非鳞状NSCLC、食道癌、原发灶不明癌、前列腺癌、唾液腺癌、基底细胞癌、胃肠道间质瘤、甲状旁腺癌或胸腺癌。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤、具有靶FGFR突变或融合、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,并且其中所述患者群体中的中值反应时间如上所述。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的临床受益率的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,临床受益率由独立审查委员会评估。可以确定个体或患者群体的临床受益率。在某些实施方案中,癌症患者群体的临床受益率(特别是由独立审查委员会评估的临床受益率)为约46.1%。在某些实施方案中,癌症患者群体的临床受益率(特别是由独立审查委员会评估的临床受益率)为约46%。在某些实施方案中,癌症患者群体的临床受益率(特别是由独立审查委员会评估的临床受益率)为至少约46%。在某些实施方案中,癌症患者群体的临床受益率(特别是由独立审查委员会评估的临床受益率)为约40%或至少约40%。在某些实施方案中,癌症患者群体的临床受益率(特别是由独立审查委员会评估的临床受益率)为40%、41%、42%、43%、44%、45%、46%、47%、48%、49%或50%。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的中值无进展生存期的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,中值无进展生存期由独立审查委员会评估。可以确定个体或患者群体的中值无进展生存期。在某些实施方案中,癌症患者群体的中值无进展生存期(特别是由独立审查委员会评估的中值无进展生存期)为约4.2个月。在某些实施方案中,癌症患者群体的中值无进展生存期(特别是由独立审查委员会评估的中值无进展生存期)为约4个月。在某些实施方案中,癌症患者群体的中值无进展生存期(特别是由独立审查委员会评估的中值无进展生存期)为至少约4个月。在某些实施方案中,癌症患者群体的中值无进展生存期(特别是由独立审查委员会评估的中值无进展生存期)为至少约3个月。在某些实施方案中,癌症患者群体的中值无进展生存期(特别是由独立审查委员会评估的中值无进展生存期)为3个月、3.5个月、4个月或4.5个月。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体改善癌症患者或患者群体的中值总生存期的方法,所述方法包括向所述患者提供治疗有效量的通常FGFR抑制剂且具体地厄达替尼。在某些实施方案中,中值总生存期由独立审查委员会评估。可以确定个体或患者群体的中值总生存期。在某些实施方案中,癌症患者群体的中值总生存期(特别是由独立审查委员会评估的中值总生存期)为约10.94个月。在某些实施方案中,癌症患者群体的中值总生存期(特别是由独立审查委员会评估的中值总生存期)为约11个月。在某些实施方案中,癌症患者群体的中值总生存期(特别是由独立审查委员会评估的中值总生存
期)为至少约11个月。在某些实施方案中,癌症患者群体的中值总生存期(特别是由独立审查委员会评估的中值总生存期)为至少约9个月。在某些实施方案中,癌症患者群体的中值总生存期(特别是由独立审查委员会评估的中值总生存期)为9个月、9.5个月、10个月、10.5个月、11个月、11.5个月或12个月。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的客观反应率、中值反应持续时间、疾病控制率、中值反应时间、临床受益率、无进展生存期或总生存期所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的客观反应率所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的中值反应持续时间所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的疾病控制率所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的中值反应时间所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的临床受益率所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的无进展生存期所测量的。在某些实施方案中,施用通常FGFR抑制剂且具体地厄达替尼提供了改善的抗肿瘤活性,如通过相对于未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体的总生存期所测量的。
在任何前述治疗方法中,在某些实施方案中,本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤(特别是本文提供的任何肿瘤或肿瘤列表)、具有靶FGFR突变或融合(特别是本文提供的任何FGFR突变或融合或FGFR突变或融合列表)、在最少1个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的剩余治疗选择的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼,并且其中所述患者群体中的客观反应率如上所述。在某些实施方案中,患者无法耐受针对潜在肿瘤类型的标准护理疗法。
在任何前述治疗方法中,在某些实施方案中,本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有晚期实体瘤(特别是本文提供的任何肿瘤或肿瘤列表)、具有靶FGFR突变或融合(特别是本文提供的任何FGFR突变或融合或FGFR突变或融合列表)、在至少一个线数的系统治疗期间或之后已取得进展并且对其而言没有有效替代疗法的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。
在任何前述治疗方法中,在某些实施方案中,本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有局部晚期或转移性实体瘤(特别是本文提供的任何肿瘤或肿瘤列表)、具有靶FGFR突变或融合(特别是本文提供的任何FGFR突变或融合或FGFR突变或融合列表)、在既往治疗后已取得进展并且没有可接受的标准治疗的患者群体施用治疗有效量的通常FGFR抑制剂且更具体地厄达替尼。
在某些实施方案中,抗肿瘤活性的改善是相对于护理标准而言的。在某些实施方案中,抗肿瘤活性的改善通常是相对于未使用通常FGFR抑制剂且具体地厄达替尼治疗而言的。
在一些实施方案中,施用FGFR抑制剂的患者或患者群体以及未接受通常FGFR抑制剂且具体地厄达替尼治疗的比较癌症患者群体,两者先前均已接受过相同或相似的既往治疗方案治疗。
在某些实施方案中,患者群体被定义为完成本文实施例中详述的临床试验的患者群体。在某些实施方案中,患者是成年人。在某些实施方案中,患者是青少年,任选地年龄为15岁至<18岁。在某些实施方案中,患者是青少年,任选地年龄为12岁至<15岁。在某些实施方案中,患者是儿科患者,任选地年龄为6岁至<12岁。
对于本文所述的每种治疗方法,应当理解,治疗方法还可以被定义为制造用于治疗所述适应症的药物的方法,或作为用于制造用于治疗所述适应症的药物的用途,或作为在治疗所述适应症中使用的通常FGFR抑制剂或具体地厄达替尼。在任何所描述的实施方案中,FGFR融合可以是任何FGFR融合,其中FGFR蛋白具有完整FGFR激酶结构域。在某些实施方案中,FGFR融合是FGFR1融合,特别是如本文所述的FGFR1融合。在某些实施方案中,FGFR融合是FGFR2融合,特别是如本文所述的FGFR2融合。在某些实施方案中,FGFR融合是FGFR3融合,特别是如本文所述的FGFR3融合。在某些实施方案中,FGFR融合是FGFR1融合、FGFR2融合或FGFR3融合,特别是如本文所述的FGFR1融合、FGFR2融合或FGFR3融合。在某些实施方案中,FGFR融合是FGFR2融合或FGFR3融合,特别是如本文所述的FGFR2融合或FGFR3融合。在某些实施方案中,FGFR突变是FGFR2突变,特别是如本文所述的FGFR2突变。在某些实施方案中,FGFR突变是FGFR3突变,特别是如本文所述的FGFR3突变。在某些实施方案中,FGFR突变是FGFR2突变或FGFR3突变,特别是如本文所述的FGFR2突变或FGFR3突变。在某些实施方案中,适应症是具有FGFR1融合(特别是如本文所述的FGFR1融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2融合(特别是如本文所述的FGFR2融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR3融合(特别是如本文所述的FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR1融合、FGFR2融合或FGFR3融合(特别是如本文所述的FGFR1融合、FGFR2融合或FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2融合或FGFR3融合(特别是如本文所述的FGFR2融合或FGFR3融合)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2突变(特别是如本文所述的FGFR2突变)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR3突变(特别是如本文所述的FGFR3突变)的晚期实体瘤。在某些实施方案中,适应症是具有FGFR2突变或FGFR3突变(特别是如本文所述的FGFR2突变或FGFR3突变)的晚期实体瘤。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-PTEN、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-CTNND2、FGFR2-YPEL5、FGFR2-SENP6、FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR1-PLAG1、FGFR2-C382R、BAG4-FGFR1、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、RHPN2-FGFR1、FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247、WHSC1-FGFR3、CD44-FGFR2、FGFR2-CTNND2、FGFR2-FAM24B、FGFR2-GOLGA2、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-SENP6、FGFR2-YPEL5、FGFR3-JAKMIP1、WDR11-FGFR2、FGFR1-S125L、FGFR2-E565A、FGFR2-P253L、FGFR2-W72C、FGFR3-P250R或FGFR3-R399C。
在任何所述实施方案中,至少一种FGFR基因改变是FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-NOL4、FGFR2-PAWR、FGFR2-SENP6、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-TACC3、FGFR1-K656E、FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C、FGFR2-Y375C、FGFR3-R248C或FGFR3-S249C。
在某些实施方案中,受试者在所述施用FGFR抑制剂(特别是厄达替尼)之前接受过至少一个线数的系统治疗。在转移性环境中,受试者在所述施用FGFR抑制剂(特别是厄达替尼)之前接受过至少一个线数的系统治疗。在一个实施方案中,受试者在所述施用FGFR抑制剂(特别是厄达替尼)之前的至少一个线数的系统治疗期间或之后已取得进展并且对其而言没有具有确定临床益处的其他可用疗法。在一个实施方案中,受试者在所述施用FGFR抑制剂(特别是厄达替尼)之前的至少一个线数的系统治疗期间或之后已取得进展,并且其不能耐受标准治疗。
在某些实施方案中,所述方法或用途还包括在所述施用厄达替尼之前,评估来自患者的生物样品中至少一种FGFR融合(特别是如本文所述的至少一种FGFR融合)或至少一种FGFR基因改变(特别是如本文所述的至少一种FGFR基因改变)的存在。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。在某些实施方案中,所述方法或用途还包括在所述施用厄达替尼之前,评估来自患者的生物样品中至少一种FGFR突变(特别是如本文所述的至少一种FGFR突变)的存在。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。
在某些实施方案中,所述方法或用途还包括在所述施用厄达替尼之前,确定患者是否具有至少一种FGFR融合(特别是如本文所述的至少一种FGFR融合)或至少一种FGFR基因改变(特别是如本文所述的至少一种FGFR基因改变)。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。在某些实施方案中,所述方法或用途还包括在所述施用厄达替尼之前,确定患者是否具有至少一种FGFR突变
(特别是如本文所述的至少一种FGFR突变)。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。
在一些实施方案中,患者在首次施用FGFR抑制剂之日年龄为15岁或更大。在某些实施方案中,患者是年龄≥18岁的成年人。在某些实施方案中,患者是年龄在15岁至<18岁之间的青少年。在其他实施方案中,FGFR抑制剂(特别是厄达替尼)每天施用,特别是每天一次。在更多其他实施方案中,FGFR抑制剂(特别是厄达替尼)口服施用。在某些实施方案中,FGFR抑制剂(特别是厄达替尼)按连续每天给药日程表口服施用。在一些实施方案中,厄达替尼以每天一次约8mg的剂量口服施用。如本文所用,“之间”包括较低的年龄范围。例如,15岁至<18岁之间包括15岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如18岁)前一天的患者。在一个实施方案中,厄达替尼以8mg(特别是每天一次8mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至9mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。在一些实施方案中,厄达替尼按连续每天给药日程表以每天一次约8mg的剂量口服施用。在其他实施方案中,如果患者表现出低于约7.0mg/dL的血清磷酸盐(PO
在一些实施方案中,患者在首次施用所述FGFR抑制剂之日年龄在12岁至<15岁之间。如本文所用,“之间”包括较低的年龄范围。例如,12岁至<15岁之间包括12岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如15岁)前一天的患者。在一个实施方案中,厄达替尼以5mg(特别是每天一次5mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至6mg,特别是每天一次6mg,以及进一步选择上调剂量至8mg,特别是每天一次8mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量(特别是从每天一次5mg上调剂量至每天一次6mg)的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。如果患者表现出<7mg/dL或在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内的血清磷酸盐水平,则在开始治疗后将厄达替尼的剂量从5mg/天增加至6mg/天。在某些实施方案中,将厄达替尼的剂量从每天一次5mg增加至每天一次6mg同时施用磷酸盐结合剂,特别是如果患者表现出在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内的血清PO
在某些实施方案中,厄达替尼以每天一次约5mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第7或14天(任选的14加2天,特别是第14天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
(任选的14加2天,特别是第14天)表现出低于7.0mg/dL的血清PO
在一些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在6岁至<12岁之间,则FGFR抑制剂(特别是厄达替尼)以约3mg(特别是每天一次3mg)的剂量施用。如本文所用,“之间”包括较低的年龄范围。例如,6岁至<12岁之间包括6岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如12岁)前一天的患者。在一个实施方案中,厄达替尼以3mg(特别是每天一次3mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内,特别是7.0mg/dL至<9.0mg/dL),并根据观察到的治疗相关的不良事件,选择上调剂量至4mg,特别是每天一次4mg,以及进一步选择从4mg上调剂量至5mg,特别是每天一次5mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。在一个实施方案中,在厄达替尼治疗的第二周期期间的治疗日,特别是在厄达替尼施用的第二周期的第7天(第2周期第7天或C2D7),测量用于确定是否上调剂量的血清磷酸盐水平。在某些实施方案中,厄达替尼以每天一次约3mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第14天(任选的14加2天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
在一些实施方案中,患者在首次施用所述FGFR抑制剂之日年龄在6岁至<12岁之间。如本文所用,“之间”包括较低的年龄范围。例如,6岁至<12岁之间包括6岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如12岁)前一天的患者。在一个实施方案中,厄达替尼以3mg(特别是每天一次3mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至4mg,特别是每天一次4mg,以及进一步选择上调剂量至5mg,特别是每天一次5mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量(特别是从每天一次3mg上调剂量至每天一次4mg)的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。如果患者表现出<7mg/dL或在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内的血清磷酸盐水平,则在开始治疗后将厄达替尼的剂量从3mg/天增加至4mg/天。在某些实施方案中,将厄达替尼的剂量从每天一次3mg增加至每天一次4mg同时施用磷酸盐结合剂,特别是如果患者表现出在7.0mg/dL至<9.0mg/dL的范围内并包括端值在内的血清PO
在某些实施方案中,厄达替尼以固体剂型施用。在其他实施方案中,固体剂型是片剂。
基于如表A中所述的厄达替尼相关毒性,应中断或调整厄达替尼治疗。
表A:基于厄达替尼相关毒性严重程度的厄达替尼剂量调整规则
在适用的情况下,应向任何级别(1至4级)的受试者提供对症疗法。
如果厄达替尼由于药物相关毒性而连续中断1周或更长时间,则可以以相同的剂量或从毒性恢复后的第一次降低的剂量水平重新引入研究药物(参见表B、表C和表D中的剂量降低水平)。可在第二次发生药物相关毒性后实施第二次剂量减少。
如果对于未能恢复至可接受水平(例如,≤1级非血液学毒性或回到基线)的药物相关不良事件必须停用厄达替尼超过28天,则应中断用厄达替尼的治疗,除非当受试者已经从治疗中获得益处时,并且研究人员可以证明继续用厄达替尼治疗是受试者最感兴趣的。如果发起人的医疗监测器与评估结果一致,则可以以相同或更低的剂量重新开始使用厄达替尼(表B、表C和表D)。
如果厄达替尼剂量减少并且作为这种剂量减少原因的不良事件已完全解决,则如果受试者从治疗中获得益处,则该剂量可以被重新递增至下一个更高剂量,并且研究人员可以证明厄达替尼的剂量重新递增是受试者最感兴趣的,并且医疗监测器与评估结果一致。
在临床上显著受损的伤口愈合或即将发生的手术或潜在的出血并发症的所有情况下,推荐中断剂量施用,小心监测适当的临床实验室数据(例如,凝血参数),并且在适用的情况下施用支持性疗法。根据研究人员的评估,当认为安全时,可以以合适的剂量重新开始剂量施用。
表B:厄达替尼剂量降低水平:年龄≥15至<18岁的成年人和青少年
表C:厄达替尼剂量降低水平:年龄≥12至<15岁的青少年
/>
表D:厄达替尼剂量降低水平:年龄≥6至<12岁的儿童
本文描述了一种在治疗具有至少一种FGFR融合的患者的癌症中使用的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。在某些实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。FGFR抑制剂将以治疗有效剂量施用。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂(特别是厄达替尼),其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂(特别是厄达替尼),其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文还描述了一种在治疗具有至少一种FGFR基因改变的患者的癌症中使用的FGFR抑制剂(特别是厄达替尼),其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文进一步描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。在某些实施方案中,至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。FGFR抑制剂将以治疗有效剂量施用。
本文还进一步描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文还进一步描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文还进一步描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。FGFR抑制剂将以治疗有效剂量施用。
本文还进一步描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR基因改变的患者,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。FGFR抑制剂将以治疗有效剂量施用。
评价样品中一种或多种FGFR基因改变的存在
本文描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合的存在;以及如果该样品中存在至少一种FGFR融合,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合的存在;以及如果该样品中存在至少一种FGFR融合,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2的至少一种FGFR融合;以及如果该患者具有这些FGFR融合中的至少一种,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2,并且其中在评估来自患者的生物样品中至少一种FGFR融合的存在之后以及如果该样品中存在一种或多种FGFR融合,则施用或将施用厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1的至少一种FGFR融合;以及如果该患者具有这些FGFR融合中的至少一种,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1,并且其中在评估来自
患者的生物样品中至少一种FGFR融合的存在之后以及如果该样品中存在一种或多种FGFR融合,则施用或将施用厄达替尼。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2,并且其中在评估来自患者的生物样品中至少一种FGFR融合的存在之后以及如果该样品中存在一种或多种FGFR融合,则施用或将施用厄达替尼。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1,并且其中在评估来自患者的生物样品中至少一种FGFR融合的存在之后以及如果该样品中存在一种或多种FGFR融合,则施用或将施用厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:评估来自已被诊断患有癌症的患者的生物样品中至少一种FGFR基因改变的存在,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文还描述了治疗癌症的方法,这些方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:确定已被诊断患有癌症的患者是否具有至少一种FGFR基因改变,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌;以及如果该样品中存在至少一种FGFR基因改变,则向该患者施用治疗有效剂量的FGFR抑制剂。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。在一个实施方案中,FGFR抑制剂是厄达替尼。
本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。
本文描述了FGFR抑制剂(特别是厄达替尼)用于制造药物的用途,所述药物用于治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者,并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。
本文还描述了一种在治疗已被诊断患有癌症并且具有至少一种FGFR融合的患者中使用的FGFR抑制剂(特别是厄达替尼),并且其中在评估来自患者的生物样品中至少一种FGFR改变的存在之后以及如果该样品中存在一种或多种FGFR改变,则施用或将施用厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。在某些实施方案中,癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、子宫内膜癌、卵巢癌、原发灶不明癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、唾液腺癌、十二指肠癌或甲状腺癌。
以下用于评估生物样品中一种或多种FGFR基因改变的存在或确定患者是否具有一种或多种FGFR基因改变的方法同样适用于任何上述公开的治疗方法和用途。
如果来自患者的生物样品中存在一种或多种FGFR基因改变,则所公开的方法适于治疗患者的癌症。在一些实施方案中,FGFR基因改变可以是一种或多种FGFR融合基因,特别是一种或多种FGFR1、FGFR2或FGFR3融合基因。在一些实施方案中,FGFR基因改变可以是一种或多种FGFR突变,特别是一种或多种FGFR1、FGFR2或FGFR3突变。在一些实施方案中,一种或多种FGFR基因改变的组合可存在于来自患者的生物样品中。例如,在一些实施方案中,FGFR基因改变可以是一种或多种FGFR融合基因和一种或多种FGFR突变。
示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1或它们的组合。
在某些实施方案中,示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-PTEN、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1或它们的组合。
在某些实施方案中,示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-ENOX1、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1或它们的组合。
示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-CTNND2、FGFR2-YPEL5、FGFR2-SENP6、FGFR1-PLAG1、FGFR2-C382R、FGFR1-BAG4、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、FGFR1-RHPN2、FGFR1-TACC1、FGFR1-WHSC1L1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247或FGFR3-WHSC1或它们的组合。
示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR1-PLAG1、FGFR2-C382R、BAG4-FGFR1、IGSF3-FGFR1、FGFR1-K656E、FGFR1-MTUS1、RHPN2-FGFR1、FGFR1-TACC1、WHSC1L1-FGFR1、FGFR2-AGAP1、FGFR2-AHCYL1、FGFR2-ALDH1L1、FGFR2-AMOT、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-CD2AP、FGFR2-CFAP57、FGFR2-CIT、FGFR2-CLOCK、FGFR2-D101Y、FGFR2-ENOX1、FGFR2-F276C、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-K659M、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-KIF6、FGFR2-L551F、FGFR2-L770V、FGFR2-LGSN、FGFR2-NOL4、FGFR2-NRBF2、FGFR2-PAWR、FGFR2-PDE3A、FGFR2-POC1B、FGFR2-S252L、FGFR2-S267P、FGFR2-SYNPO2、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TBC1D5、FGFR2-TCERG1L、FGFR2-TRA2B、FGFR2-V395D、FGFR2-VPS35、FGFR2-WAC、FGFR2-Y375C、FGFR3-A500T、FGFR3-ENOX1、FGFR3-F384L、FGFR3-MYH14、FGFR3-R248C、FGFR3-S249C、FGFR3-S249F、FGFR3-S371G、FGFR3-TACC3、FGFR3-TMEM247、WHSC1-FGFR3、CD44-FGFR2、FGFR2-CTNND2、FGFR2-FAM24B、FGFR2-GOLGA2、FGFR2-HTRA1、FGFR2-IMPA1、FGFR2-SENP6、FGFR2-YPEL5、FGFR3-JAKMIP1、WDR11-FGFR2、FGFR1-S125L、FGFR2-E565A、FGFR2-P253L、FGFR2-W72C、FGFR3-P250R或FGFR3-R399C或它们的组合。
示例性FGFR改变提供于表9、表14或表19中,并且包括但不限于:FGFR1-MTUS1、FGFR1-PLAG1、FGFR1-TACC1、FGFR2-ATAD2、FGFR2-BICC1、FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-FKBP15、FGFR2-GKAP1、FGFR2-GPHN、FGFR2-KCTD1、FGFR2-KIAA1598、FGFR2-NOL4、FGFR2-PAWR、FGFR2-SENP6、FGFR2-TACC2、FGFR2-TBC1D4、FGFR2-TRA2B、FGFR2-VPS35、FGFR2-WAC、FGFR3-TACC3、FGFR1-K656E、FGFR2-C382R、FGFR2-E565A、FGFR2-F276C、FGFR2-W72C、FGFR2-Y375C、FGFR3-R248C或FGFR3-S249C或它们的组合。
用于评估生物样品中一种或多种FGFR基因改变的存在的合适方法描述于本文的方法部分以及WO 2016/048833和美国专利申请序列号16/723,975中,这两篇专利全文并入本文。例如,并且不旨在限制,评估生物样品中一种或多种FGFR基因改变的存在可包括以下步骤的任何组合:从生物样品中分离RNA;由RNA合成cDNA;以及扩增cDNA(预扩增或非预扩增)。在一些实施方案中,评估生物样品中一种或多种FGFR基因改变的存在可包括:用一对结合并扩增一种或多种FGFR基因改变的引物扩增来自患者的cDNA;以及确定该样品中是否存在一种或多种FGFR基因改变。在本公开的一些方面,cDNA可以被预扩增。在本公开的一些方面,评估步骤可包括从样品中分离RNA,由分离的RNA合成cDNA,以及使cDNA预扩增。
一种或多种FGFR基因改变的存在可在任何合适的时间点评估,包括诊断时、肿瘤切除后、一线疗法后、临床治疗期间或它们的任何组合。
例如,可分析取自患者的生物样品以确定患者患有或可能患有的病况或疾病(诸如癌症)是否是以遗传异常或异常蛋白质表达为特征的病况或疾病,该遗传异常或异常蛋白质表达导致FGFR的水平或活性的上调或导致对正常FGFR活性的途径的敏化,或导致这些生长因子信号传导途径(诸如生长因子配体水平或生长因子配体活性)的上调或导致FGFR激活下游的生化途径的上调。
导致FGFR信号的活化或敏化的此类异常的示例包括细胞凋亡途径的丧失或抑制、受体或配体的上调,或受体或配体(例如PTK变体)的基因改变的存在。具有FGFR1、FGFR2或FGFR3或FGFR4的基因改变或上调(特别是FGFR1的过表达)或FGFR2或FGFR3的功能获得性基因改变的肿瘤可能对FGFR抑制剂特别敏感。
这些方法、批准的药物产品和用途还可包括在施用步骤之前评估生物样品中一种或多种FGFR基因改变的存在。
诊断测试和筛选通常在选自肿瘤活检样品、血液样品(脱落肿瘤细胞的分离和富集)、粪便活检、痰、染色体分析、胸膜液、腹膜液、颊穿刺、活检、循环DNA或尿液的生物样品上进行。在某些实施方案中,生物样品是血液、淋巴液、骨髓、实体瘤样品或它们的任何组合。在某些实施方案中,生物样品是实体瘤样品。在某些实施方案中,生物样品是血液样品。在某些实施方案中,生物样品是尿液样品。
鉴定和分析基因改变和蛋白质上调的方法是本领域技术人员已知的。筛选方法可包括但不限于标准方法,诸如逆转录酶聚合酶链反应(RT PCR)或原位杂交诸如荧光原位杂交(FISH)。
携带FGFR中的基因改变(特别是如本文所述的FGFR基因改变)的个体的鉴定可能意味着该患者将特别适于用FGFR抑制剂(特别是厄达替尼)治疗。在治疗之前可优先筛选肿瘤是否存在FGFR变体。筛选过程通常包括直接测序、寡核苷酸微阵列分析或突变体特异性抗体。此外,可使用本领域技术人员已知的和如本文所述的技术诸如RT-PCR、FISH或下一代测序进行具有此类基因改变的肿瘤的诊断。
此外,例如FGFR的基因改变可通过例如使用PCR的肿瘤活检的直接测序以及如上文所述的直接对PCR产物进行测序的方法来鉴定。技术人员将认识到,用于检测上述蛋白质的过表达、活化或突变的所有此类众所周知的技术都可适用于本情况。
在通过RT-PCR筛选中,通过产生mRNA的cDNA拷贝,随后通过PCR使cDNA扩增来评估肿瘤中mRNA的水平。PCR扩增的方法、引物的选择和扩增的条件是本领域技术人员已知的。核酸操作和PCR通过标准方法进行,如例如Ausubel,F.M.等人编,(2004)CurrentProtocols in Molecular Biology,John Wiley&Sons Inc.,或Innis,M.A.等人编,(1990)PCR Protocols:a guide to methods and applications,Academic Press,San Diego中所述。涉及核酸技术的反应和操作也在Sambrook等人,(2001),第3版,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press中所述。另选地,可使用用于RT-PCR的市售试剂盒(例如Roche Molecular Biochemicals),或如美国专利4,666,828;4,683,202;4,801,531;5,192,659、5,272,057、5,882,864和6,218,529中所述并以引用方式并入本文的方法。用于评估mRNA表达的原位杂交技术的示例是荧光原位杂交(FISH)(参见Angerer(1987)Meth.Enzymol.,152:649)。
通常,原位杂交包括以下主要步骤:(1)将待分析的组织固定;(2)对样品进行预杂交处理以增加靶核酸的可接近性,并减少非特异性结合;(3)使核酸混合物与生物结构或组织中的核酸杂交;(4)杂交后洗涤以除去杂交中未结合的核酸片段,以及(5)检测杂交的核酸片段。用于此类应用的探针通常例如用放射性同位素或荧光报道分子标记。优选的探针足够长,例如约50、100或200个核苷酸至约1000或更多个核苷酸,以能够在严格条件下与靶核酸进行特异性杂交。进行FISH的标准方法在Ausubel,F.M.等人编,(2004)CurrentProtocols in Molecular Biology,John Wiley&Sons Inc和John M.S.的FluorescenceIn Situ Hybridization:Technical Overview,Bartlett in Molecular Diagnosis ofCancer,Methods and Protocols,第2版;ISBN:1-59259-760-2;2004年3月,第077页-第088页;Series:Methods in Molecular Medicine中所述。
由(DePrimo等人,(2003),BMC Cancer,3:3)描述了基因表达谱的方法。简而言之,方案如下:由总RNA合成双链cDNA,使用(dT)24寡聚物引发第一链cDNA合成,随后用随机六聚体引物进行第二链cDNA合成。双链cDNA用作使用生物素化的核糖核苷酸体外转录cRNA的模板。根据Affymetrix(Santa Clara,CA,USA)描述的方案将cRNA化学片段化,然后在人基因组阵列上杂交过夜。
另选地,由mRNA表达的蛋白质产物可通过肿瘤样品的免疫组织化学、用微量滴定板的固相免疫测定、蛋白质印迹、2维SDS-聚丙烯酰胺凝胶电泳、ELISA、流式细胞术和本领域已知的用于检测特定蛋白质的其他方法来测定。检测方法包括使用位点特异性抗体。技术人员将认识到用于检测FGFR上调或检测FGFR变体或突变体的所有此类众所周知的技术都可适用于本情况。
蛋白质(诸如FGFR)的异常水平可使用标准酶测定(例如本文所述的那些测定)来测量。激活或过表达也可在组织样品例如肿瘤组织中检测到。通过使用诸如ChemiconInternational的测定法来测量酪氨酸激酶活性。将感兴趣的酪氨酸激酶从样品裂解物中免疫沉淀并测量其活性。
用于测量FGFR(包括其亚型)的过表达或激活的替代方法包括测量微血管密度。这可例如使用由Orre和Rogers(Int J Cancer(1999),84(2)101-8)所述的方法来测量。测定方法还包括标志物的使用。
因此,所有这些技术也可用于鉴定特别适于用本发明化合物治疗的肿瘤。
药物组合物和施用途径
鉴于其有用的药理学性质,通常FGFR抑制剂且更具体地厄达替尼可配制成用于施用目的的各种药物形式。
在一个实施方案中,药物组合物(例如,制剂)包含至少一种FGFR抑制剂,以及一种或多种药学上可接受的载体、佐剂、赋形剂、稀释剂、填充剂、缓冲剂、稳定剂、防腐剂、润滑剂或本领域技术人员众所周知的其他材料以及任选的其他治疗剂或预防剂。
为了制备药物组合物,将通常有效量的FGFR抑制剂且更具体地厄达替尼作为活性成分与药学上可接受的载体以紧密混合物的形式组合,该载体可根据施用所需的制剂形式采取多种形式。药物组合物可以是适于口服、肠胃外、局部、鼻内、眼、耳、直肠、阴道内或透皮施用的任何形式。这些药物组合物有利地为优选适于口服、直肠、经皮或通过肠胃外注射施用的单位剂型。例如,在制备口服剂型的组合物时,在口服液体制剂诸如混悬剂、糖浆剂、酏剂和溶液剂的情况下,可采用任何常用药物介质,例如水、二醇、油、醇等;或者在散剂、丸剂、胶囊剂和片剂的情况下,可采用固体载体,诸如淀粉、糖、高岭土、润滑剂、粘结剂、崩解剂等。
本发明的药物组合物,特别是胶囊剂和/或片剂,可包括一种或多种药学上可接受的赋形剂(药学上可接受的载体),诸如崩解剂、稀释剂、填充剂、粘结剂、缓冲剂、润滑剂、助流剂、增稠剂、甜味剂、风味剂、着色剂、防腐剂等。一些赋形剂可用于多种目的。
合适的崩解剂是具有大膨胀系数的那些。其示例是亲水性、不溶性或水溶性差的交联聚合物,诸如交聚维酮(交联聚乙烯吡咯烷酮)和交联羧甲纤维素钠(交联羧甲基纤维素钠)。崩解剂在根据本发明的片剂中的量可适宜地在约2.5重量/重量%至约15重量/重量%的范围内并且优选在约2.5重量/重量%至7重量/重量%的范围内,尤其在约2.5重量/重量%至5重量/重量%的范围内。因为当大量使用时,崩解剂根据其性质产生持续释放制剂,用称为稀释剂或填充剂的惰性物质稀释它们是有利的。
多种材料可用作稀释剂或填充剂。示例是乳糖一水合物、无水乳糖、蔗糖、右旋糖、甘露糖醇、山梨糖醇、淀粉、纤维素(例如,微晶纤维素(Avicel
润滑剂和助流剂可用于制备某些剂型并且通常在生产片剂时使用。润滑剂和助流剂的示例是氢化植物油,例如氢化棉籽油、硬脂酸镁、硬脂酸、月桂基硫酸钠、月桂基硫酸镁、胶态二氧化硅、胶态无水二氧化硅、滑石、它们的混合物和本领域已知的其他物质。令人感兴趣的润滑剂是硬脂酸镁,和硬脂酸镁与胶态二氧化硅的混合物,优选硬脂酸镁。优选的助流剂是胶态无水二氧化硅。
如果存在,助流剂通常占总组合物重量的0.2重量/重量%至7.0重量/重量%,特别是0.5重量/重量%至1.5重量/重量%,更特别是1重量/重量%至1.5重量/重量%。
如果存在,润滑剂通常占总组合物重量的0.2重量/重量%至7.0重量/重量%,特别是0.2重量/重量%至2重量/重量%,或0.5重量/重量%至2重量/重量%,或0.5重量/重量%至1.75重量/重量%,或0.5重量/重量%至1.5重量/重量%。
粘结剂可任选地用于本发明的药物组合物中。合适的粘结剂是水溶性聚合物,诸如烷基纤维素,诸如甲基纤维素;羟烷基纤维素,诸如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丁基纤维素;羟烷基烷基纤维素,诸如羟乙基甲基纤维素和羟丙基甲基纤维素;羧烷基纤维素,诸如羧甲基纤维素;羧烷基纤维素的碱金属盐,诸如羧甲基纤维素钠;羧烷基烷基纤维素,诸如羧甲基乙基纤维素;羧烷基纤维素酯;淀粉;果胶,诸如羧甲基支链淀粉钠;几丁质衍生物,诸如壳聚糖;二糖、寡糖和多糖,诸如海藻糖、环糊精及其衍生物、藻酸、其碱金属盐和铵盐、角叉菜胶、半乳甘露聚糖、黄蓍胶、琼脂、阿拉伯胶、瓜尔胶和黄原胶;聚丙烯酸及其盐;聚甲基丙烯酸、其盐和酯、甲基丙烯酸酯共聚物;聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)及其共聚物,例如PVP-VA。优选地,水溶性聚合物是羟烷基烷基纤维素,例如羟丙基甲基纤维素,例如羟丙基甲基纤维素15cps。
其他赋形剂诸如着色剂和色素也可添加到本发明的组合物中。着色剂和色素包括二氧化钛和适用于食品的染料。着色剂或色素是本发明制剂中的任选成分,但是当使用时,着色剂可基于组合物总重量以至多3.5重量/重量%的量存在。
风味剂在组合物中是任选的,并且可选自合成风味油和调味芳香剂或天然油、来自植物叶、花、果实等的提取物和它们的组合。这些可包括肉桂油、冬青油、薄荷油、月桂油、茴香油、桉树油、百里香油。香草、柑橘油(包括柠檬、橙、葡萄、酸橙和柚子)和水果香精(包括苹果、香蕉、梨、桃、草莓、树莓、樱桃、李子、菠萝、杏等)也可用作风味剂。风味剂的量可取决于许多因素,包括期望的感官效果。一般来讲,风味剂将以约0%至约3%(重量/重量)的量存在。
甲醛清除剂是能够吸收甲醛的化合物。它们包括包含与甲醛反应的氮中心的化合物,诸如在甲醛清除剂和甲醛之间形成一个或多个可逆或不可逆键。例如,甲醛清除剂包含一个或多个与甲醛反应以形成能够随后与甲醛结合的席夫碱亚胺的氮原子/中心。例如,甲醛清除剂包含一个或多个与甲醛反应以形成一个或多个5-8元环的氮中心。甲醛清除剂优选包含一个或多个胺或酰胺基团。例如,甲醛清除剂可以是氨基酸、氨基糖、α胺化合物,或它们的缀合物或衍生物,或它们的混合物。甲醛清除剂可包含两种或更多种胺和/或酰胺。
甲醛清除剂包括例如甘氨酸、丙氨酸、丝氨酸、苏氨酸、半胱氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、酪氨酸、天冬氨酸、谷氨酸、精氨酸、赖氨酸、鸟氨酸、瓜氨酸、牛磺酸、吡咯赖氨酸、葡甲胺、组氨酸、阿司帕坦、脯氨酸、色氨酸、瓜氨酸、吡咯赖氨酸、天冬酰胺、谷氨酰胺,或它们的缀合物或混合物;或,只要可能,其药学上可接受的盐。
在本发明的一个方面,甲醛清除剂是葡甲胺或其药学上可接受的盐,特别是葡甲胺碱。
在一个实施方案中,在如本文所述的方法和用途中,施用或将施用作为药物组合物,特别是片剂或胶囊剂的厄达替尼,该药物组合物包含厄达替尼或其药学上可接受的盐,特别是厄达替尼碱;甲醛清除剂,特别是葡甲胺或其药学上可接受的盐,特别是葡甲胺碱;以及药学上可接受的载剂。
本发明的另一个目的是提供一种制备如本文所述的药物组合物,特别是呈片剂或胶囊剂形式的药物组合物的方法,其特征在于将甲醛清除剂(特别是葡甲胺)和厄达替尼、其药学上可接受的盐或其溶剂化物(特别是厄达替尼碱)与药学上可接受的载体共混,并将所述共混物压制成片剂或将所述共混物填充在胶囊剂中。
由于其在施用方面的方便性,片剂和胶囊剂代表了最有利的口服单位剂型,在这种情况下显然采用固体药用载体。对于肠胃外组合物,载体通常至少大部分包括无菌水,但也可包括例如有助于溶解的其他成分。例如,可以制备可注射溶液,其中载体包括盐水溶液、葡萄糖溶液或盐水和葡萄糖溶液的混合物。还可以制备可注射混悬剂,在这种情况下,可以采用合适的液体载体、悬浮剂等。在适于经皮施用的组合物中,载体任选地包括渗透增强剂和/或合适的润湿剂,任选地与小比例的任何性质的合适添加剂组合,该添加剂不对皮肤造成显著的有害作用。所述添加剂可促进对皮肤的施用和/或可有助于制备期望的组合物。这些组合物可以各种方式施用,例如作为透皮贴剂、滴剂(spot-on)、软膏剂。尤其有利的是将上述药物组合物配制成便于施用和剂量均匀的单位剂型。如本说明书和本文的权利要求中所用的单位剂型是指适合作为单一剂量的物理离散单元,每个单元含有预定量的活性成分,其经计算为与所需的药物载体相结合产生期望的治疗效果。此类单位剂型的示例为片剂(包括刻痕片剂或包衣片剂)、胶囊剂、丸剂、粉包、干胶片、可注射溶液或混悬剂、一茶匙量、一汤匙量等、以及它们分开的多倍剂型。
尤其有利的是将上述药物组合物配制成便于施用和剂量均匀的单位剂型。如本文所用的剂量单位形式是指适合作为单一剂量的物理离散单元,每个单元含有预定量的活性成分,其经计算为与所需的药物载体相结合产生期望的治疗效果。此类单位剂型的示例为片剂(包括刻痕片剂或包衣片剂)、胶囊剂、丸剂、粉包、干胶片、可注射溶液或混悬剂、一茶匙量、一汤匙量等、以及它们分开的多倍剂型。优选的形式是片剂和胶囊剂。
在某些实施方案中,FGFR抑制剂以固体单位剂型和适于口服施用的固体单位剂型存在。单位剂型可含有约1、2、3、4、5、6、7、8、9或10mg的FGFR抑制剂/单位剂型或由这些值中的两个所界定的范围内的量,特别是3、4或5mg/单位剂量。
取决于施用模式,药物组合物将优选地包含0.05重量%至99重量%,更优选地0.1重量%至70重量%,甚至更优选地0.1重量%至50重量%的FGFR抑制剂,以及1重量%至99.95重量%,更优选地30重量%至99.9重量%,甚至更优选地50重量%至99.9重量%的药学上可接受的载体,所有百分比均基于组合物的总重量。
本发明的片剂或胶囊剂可进一步被膜包衣例如以改善味道,提供易于吞咽性和优美的外观。聚合物膜包衣材料是本领域已知的。优选的膜包衣是与溶剂基膜包衣相反的水基膜包衣,因为溶剂基膜包衣可含有更多痕量的醛。优选的膜包衣材料是
在根据本发明的片剂中,膜包衣的重量优选占片剂总重量的约4%(重量/重量)或更少。
对于根据本发明的胶囊剂,羟丙甲纤维素(HPMC)胶囊剂比明胶胶囊剂优选。
在本发明的一个方面,如本文所述的药物组合物,特别是呈胶囊剂或片剂形式的药物组合物包含0.5mg至20mg碱当量,或2mg至20mg碱当量,或0.5mg至12mg碱当量,或2mg至12mg碱当量,或2mg至10mg碱当量,或2mg至6mg碱当量,或2mg碱当量、3mg碱当量、4mg碱当量、5mg碱当量、6mg碱当量、7mg碱当量、8mg碱当量、9mg碱当量、10mg碱当量、11mg碱当量或12mg碱当量的厄达替尼、其药学上可接受的盐或其溶剂化物。具体地,如本文所述的药物组合物包含3mg碱当量、4mg碱当量或5mg碱当量的厄达替尼、其药学上可接受的盐或其溶剂化物,特别是3mg或4mg或5mg的厄达替尼碱。
在本发明的一个方面,如本文所述的药物组合物,特别是呈胶囊剂或片剂形式的药物组合物包含0.5mg至20mg,或2mg至20mg,或0.5mg至12mg,或2mg至12mg,或2mg至10mg,或2mg至6mg,或2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg或12mg的厄达替尼碱。具体地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱。具体地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱和约0.5重量/重量%至约5重量/重量%、约0.5重量/重量%至约3重量/重量%、约0.5重量/重量%至约2重量/重量%、约0.5重量/重量%至约1.5重量/重量%或约0.5重量/重量%至约1重量/重量%的甲醛清除剂,特别是葡甲胺。具体地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱和约0.5重量/重量%至约1.5重量/重量%或约0.5重量/重量%至约1重量/重量%的甲醛清除剂,特别是葡甲胺。
在本发明的一个方面,可施用多于一种,例如两种如本文所述的药物组合物以获得期望的剂量,例如日剂量。例如,对于8mg碱当量的厄达替尼的日剂量,可施用各自4mg厄达替尼碱当量的2个片剂或胶囊剂;或者可施用3mg厄达替尼碱当量的片剂或胶囊剂和5mg碱当量的片剂或胶囊剂。例如,对于9mg碱当量的厄达替尼的日剂量,可施用各自3mg厄达替尼碱当量的3个片剂或胶囊剂;或者可施用4mg厄达替尼碱当量的片剂或胶囊剂和5mg碱当量的片剂或胶囊剂。
根据本发明的药物组合物中的甲醛清除剂,特别是葡甲胺的量可在约0.1重量/重量%至约10重量/重量%、约0.1重量/重量%至约5重量/重量%、约0.1重量/重量%至约3重量/重量%、约0.1重量/重量%至约2重量/重量%、约0.1重量/重量%至约1.5重量/重量%、约0.1重量/重量%至约1重量/重量%、约0.5重量/重量%至约5重量/重量%、约0.5重量/重量%至约3重量/重量%、约0.5重量/重量%至约2重量/重量%、约0.5重量/重量%至约1.5重量/重量%、约0.5重量/重量%至约1重量/重量%的范围内。
根据具体实施方案,厄达替尼作为用于口服施用的3mg、4mg或5mg膜包衣的片剂提供,并且含有以下非活性成分或其等同物:片剂芯:交联羧甲基纤维素钠、硬脂酸镁、甘露糖醇、葡甲胺和微晶纤维素;和膜包衣:Opadry amb II:I型单辛癸酸甘油酯、部分水解的聚乙烯醇、十二烷基硫酸钠、滑石、二氧化钛、氧化铁黄、氧化铁红(用于橙色和棕色片剂)、四氧化三铁/氧化铁黑(用于棕色片剂)。
着眼于安全性的研究寻求识别可能因暴露于药物而引起的任何潜在不利影响。当在适当情况下测试时,诸如在严格控制的临床试验中,通常通过确定活性药物成分是否表现出优于安慰剂或其他干预的健康益处来测量有效性。
如本文所用,关于制剂、组合物或成分的术语“可接受的”是指该制剂、组合物或成分对被治疗的人类的总体健康的有益效果在任何存在程度上基本上胜过其有害效果。
所有口服施用的制剂为适于这种施用的剂型。
给药方法和治疗方案
在一个方面,本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-CCDC147、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-LCN10、FGFR2-PDE3A、FGFR2-RANBP2、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1、RHPN2-FGFR1和RRM2B-FGFR2。在一个方面,本文描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR融合的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,该至少一种FGFR融合选自FGFR2-CCDC102A、FGFR2-ENOX1、FGFR2-GPHN、FGFR2-PDE3A、FGFR3-ENOX1、FGFR3-TMEM247、IGSF3-FGFR1和RHPN2-FGFR1。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、小肠腺癌、肝细胞癌、微囊肿性附属器癌、棘细胞癌、胃肠道间质瘤或甲状旁腺癌。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。
本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,其中所述癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状NSCLC、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤或甲状旁腺癌。本文还描述了治疗癌症的方法,所述方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向已被诊断患有癌症并且具有至少一种FGFR基因改变的患者施用治疗有效量的通常FGFR抑制剂且具体地厄达替尼,其中该癌症是胆管癌、高级别神经胶质瘤、胰腺癌、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、乳腺癌、结肠直肠癌、子宫内膜癌、胃癌、卵巢癌、原发灶不明癌、宫颈癌、鳞状细胞头颈癌、食道癌、低级别神经胶质瘤、前列腺癌、唾液腺癌、基底细胞癌、胸腺癌、胃肠道间质瘤、甲状旁腺癌、软组织肉瘤、腺样囊性癌、肛门腺癌、结膜表皮样癌、十二指肠癌、胆囊癌、生殖细胞肿瘤、恶性小圆细胞肿瘤、间皮瘤、睾丸癌或甲状腺癌。
在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每天施用,特别是每天施用一次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每天施用两次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每天施用三次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每天施用四次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每隔一天施用。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每周施用一次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每周施用两次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼每隔一周施用。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼按连续每天给药日程表口服施用。
一般来讲,用于治疗本文所述的人类疾病或病况的FGFR抑制剂且具体地厄达替尼的剂量通常在每天约1mg至20mg的范围内。在一些实施方案中,FGFR抑制剂且具体地厄达替尼以约1mg/天、约2mg/天、约3mg/天、约4mg/天、约5mg/天、约6mg/天、约7mg/天、约8mg/天、约9mg/天、约10mg/天、约11mg/天、约12mg/天、约13mg/天、约14mg/天、约15mg/天、约16mg/天、约17mg/天、约18mg/天、约19mg/天或约20mg/天的剂量口服施用于人类。
本文还描述了治疗癌症患者的癌症的方法,包括向癌症患者施用厄达替尼,其中癌症患者的年龄在15岁至<18岁的范围内并且包括端值在内。本文还描述了厄达替尼用于制造用于治疗癌症患者的癌症的药物的用途,其中癌症患者的年龄在15岁至<18岁的范围内并且包括端值在内。本文还描述了在治疗癌症患者的癌症中使用的厄达替尼,其中癌症患者的年龄在15岁至<18岁的范围内并且包括端值在内。
在一些实施方案中,厄达替尼口服施用。在某些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄为15岁或更大,则FGFR抑制剂(特别是厄达替尼)以每天一次约8mg的剂量口服施用。在另一个实施方案中,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在更多其他实施方案中,如果患者在开始治疗后第14天(任选的14加2天,特别是第14天)表现出低于约7.0mg/dL的血清磷酸盐(PO
在一个实施方案中,厄达替尼以8mg,特别是每天一次8mg的剂量施用。在一个实施方案中,厄达替尼以8mg(特别是每天一次8mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至9mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。在一个实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日为成年人。在一个实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄为18岁或更大。在一个实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日为青少年。在一个实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日的年龄在15岁至<18岁的范围内并且包括端值在内。在一个实施方案中,患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄为15岁或更大。
在一些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在12岁至<15岁之间,则FGFR抑制剂(特别是厄达替尼)以约5mg(特别是每天一次5mg)的剂量施用。如本文所用,“之间”包括较低的年龄范围。例如,12岁至<15岁之间包括12岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如15岁)前一天的患者。在一个实施方案中,厄达替尼以5mg(特别是每天一次5mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至6mg,以及进一步选择从6mg上调剂量至8mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。在一个实施方案中,在厄达替尼治疗的第二周期期间的治疗日,特别是在厄达替尼施用的第二周期的第7天(第2周期第7天或C2D7),测量用于确定是否上调剂量的血清磷酸盐水平。在某些实施方案中,厄达替尼以每天一次约5mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第7或14天(任选的14加2天,特别是第14天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
7.0mg/dL的血清PO
在一些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在6岁至<12岁之间,则FGFR抑制剂(特别是厄达替尼)以约3mg(特别是每天一次3mg)的剂量施用。如本文所用,“之间”包括较低的年龄范围。例如,6岁至<12岁之间包括6岁的患者。还如本文所用,年龄上限包括直至患者达到指定年龄(例如12岁)前一天的患者。在一个实施方案中,厄达替尼以3mg(特别是每天一次3mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至4mg,以及进一步选择从4mg上调剂量至5mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。在一个实施方案中,在厄达替尼治疗的第二周期期间的治疗日,特别是在厄达替尼施用的第二周期的第7天(第2周期第7天或C2D7),测量用于确定是否上调剂量的血清磷酸盐水平。在某些实施方案中,厄达替尼以每天一次约3mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第14天(任选的14加2天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
对于本文所述的所有实施方案,“之间”包括较低的年龄范围。例如,12岁至<15岁之间包括12岁的患者。此外,6岁至<12岁之间包括6岁的患者。
对于本文所述的所有实施方案,年龄上限包括直至患者达到指定年龄前一天的患者。例如,12岁至<15岁之间包括年满15岁前一天的患者。此外,6岁至<12岁之间包括年满12岁前一天的患者。
本文还描述了治疗癌症患者的癌症的方法,包括向癌症患者施用厄达替尼,其中癌症患者的年龄在12岁至<15岁的范围内并且包括端值在内。本文还描述了厄达替尼用于制造用于治疗癌症患者的癌症的药物的用途,其中癌症患者的年龄在12岁至<15岁的范围内并且包括端值在内。本文还描述了在治疗癌症患者的癌症中使用的厄达替尼,其中癌症患者的年龄在12岁至<15岁的范围内并且包括端值在内。
在一些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在12岁至<15岁之间,则FGFR抑制剂(特别是厄达替尼)以约5mg(特别是每天一次5mg)的剂量施用。在一个实施方案中,厄达替尼以5mg(特别是每天一次5mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至6mg,以及进一步选择从6mg上调剂量至8mg。在某些实施方案中,厄达替尼以每天一次约5mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第14天(任选的14加2天,特别是第14天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
本文还描述了治疗癌症患者的癌症的方法,包括向癌症患者施用厄达替尼,其中癌症患者的年龄在6岁至<12岁的范围内并且包括端值在内。本文还描述了厄达替尼用于制造用于治疗癌症患者的癌症的药物的用途,其中癌症患者的年龄在6岁至<12岁的范围内并且包括端值在内。本文还描述了在治疗癌症患者的癌症中使用的厄达替尼,其中癌症患者的年龄在6岁至<12岁的范围内并且包括端值在内。
在一些实施方案中,如果患者在首次施用所述FGFR抑制剂(特别是厄达替尼)之日年龄在6岁至<12岁之间,则FGFR抑制剂(特别是厄达替尼)以约3mg(特别是每天一次3mg)的剂量施用。在一个实施方案中,厄达替尼以3mg(特别是每天一次3mg)的剂量施用,根据血清磷酸盐水平(例如血清磷酸盐水平<7mg/dL,或在7mg/dL至<9mg/dL的范围内并包括端值在内),并根据观察到的治疗相关的不良事件,选择上调剂量至4mg,以及进一步选择从4mg上调剂量至5mg。在一个实施方案中,在厄达替尼治疗的第一周期期间的治疗日,特别是在厄达替尼施用的第一周期的第14加2天,更特别是在第14天,测量用于确定是否上调剂量的血清磷酸盐水平。如本文所用,开始治疗后第14天、厄达替尼施用的第一周期的第14天、第1周期第14天和C1D14可互换使用。在一个实施方案中,在厄达替尼治疗的第二周期期间的治疗日,特别是在厄达替尼施用的第二周期的第7天(第2周期第7天或C2D7),测量用于确定是否上调剂量的血清磷酸盐水平。在某些实施方案中,厄达替尼以每天一次约3mg的剂量施用。在其他实施方案中,如果患者在开始治疗后第14天(任选的14加2天)表现出在7.0mg/dL至<9mg/dL的范围内并包括端值在内的血清磷酸盐(PO
在一个实施方案中,如本文所用的治疗周期是28天周期。在某些实施方案中,治疗周期是长达两年的28天周期。
在一个优选的实施方案中,如本文所用的治疗周期是21天周期。具体地,治疗是连续21天周期治疗。
在一个实施方案中,需要的剂量适宜地以同时(或在短的一段时间)或以适当的间隔,例如两个、三个、四个或更多个亚剂量/天施用的单次剂量或分次剂量提供。在一些实施方案中,FGFR抑制剂适宜地以同时(或在短时间段内)施用的分次剂量提供,每天一次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼适宜地以相等份量施用的分次剂量提供,每天两次。在一些实施方案中,通常FGFR抑制剂且具体地厄达替尼适宜地以相等份量施用的分次剂量提供,每天三次。在一些实施方案中,FGFR抑制剂适宜地以相等份量施用的分次剂量提供,每天四次。
在某些实施方案中,期望的剂量可在一整天内以1、2、3、4、5、6、7、8、9或10个分单位剂量递送,使得在一整天内通过分单位剂量递送的通常FGFR抑制剂且具体地厄达替尼的总量提供总日剂量。
在一些实施方案中,给予人的通常FGFR抑制剂且具体地厄达替尼的量根据多种因素而变化,诸如但不限于疾病或病况的病状和严重程度和人的特性(例如,体重),以及所施用的特定附加治疗剂(如果适用)。
在更多其他实施方案中,厄达替尼不与强CYP3A4抑制剂或诱导剂或温和CyP3A4诱导剂共同施用。在某些实施方案中,厄达替尼不与强CYP3A4抑制剂或诱导剂或温和CyP3A4诱导剂在第一剂量的研究药物之前的14天或5个半衰期内共同施用。
强CYP3A4抑制剂的非限制性示例包括博赛泼维、阿瑞匹坦、克拉霉素、考尼伐坦、葡萄柚汁、茚地那韦、洛匹那韦、伊曲康唑、咪拉地尔、酮康唑、奈法唑酮、利托那韦、泊沙康唑、奈非那韦、沙奎那韦、考尼伐坦、特拉匹韦、博赛泼维、泰利霉素、克拉霉素、伏立康唑、克霉唑、硫氮卓酮、红霉素、氟康唑、异搏定和醋竹桃霉素。
中等到强CYP3A4诱导剂的非限制性示例包括阿伐麦布、圣约翰草、卡马西平、依法韦仑、苯妥英、依曲韦林、波生坦、萘夫西林、利福平、莫达非尼、利福布丁和巴比妥酸盐。
试剂盒和制造的制品
为了在本文所述的方法或用途中使用,还描述了试剂盒和制造的制品。此类试剂盒可以包括包装或容器,该包装或容器被区室化以容纳一个或多个剂量的本文所公开的药物组合物。合适的容器包括例如瓶子。在一个实施方案中,容器由多种材料诸如玻璃或塑料形成。
本文提供的制造的制品包含封装材料。药物封装材料的实例包括但不限于泡罩包装、瓶、管、袋、容器、瓶,以及适合所选制剂和预定施用和治疗模式的任何封装材料。
试剂盒通常包括列出了内容物和/或使用说明的标签和带有使用说明的封装件插页。一般还将包括一套说明书。
在一个实施方案中,标签可位于容器上或与容器关联。在一个实施方案中,当形成标签的字母、数字或其他字符附接、模制或蚀刻到容器自身中时,标签位于容器上;当标签例如作为包装说明书存在于也容纳容器的容座或载体内时,标签与容器相关联。
在一个实施方案中,标签可以用来指明内容物将用于特定的治疗性应用。标签还可以指出内容物的使用说明,如在本文描述的方法中的使用说明。
在某些实施方案中,药物组合物存在于包装或分配装置中,该包装或分配装置包含含有本文提供的化合物的一个或多个单位剂型。包装例如包含金属或塑料油,诸如泡罩包装。在一个实施方案中,包装或分配装置附有施用说明。在一个实施方案中,包装或分配装置也可附有与管理生产的政府机构所规定形式的容器、药品使用或销售有关的注意事项,其中注意事项是人用或兽用组合物形式通过政府机构批准的反映。例如,此类注意事项可以是经美国食品与药物管理局批准的处方药的标签或批准的产品插页。在一个实施方案中,还制备了在相容的药物载剂中配制的本文所提供的化合物的组合物,放置在合适的容器中并且标记用于治疗指定的病况。
实施例
本文描述的实施例和实施方案仅用于例示目的,并且将向本领域的技术人员建议考虑到各种修改或变化,这些修改或变化包括在本申请的实质和范围以及所附权利要求书的范围内。
实施例1:鉴定具有致癌驱动潜力的FGFR突变
A)在某些实施方案中,靶FGFR突变包括:FGFR1-K656E;FGFR1-R189C;FGFR1-S125L;FGFR1-P150S;FGFR2-C390Y;FGFR2-E565G;FGFR2-E565Q;FGFR2-S252L;FGFR2-C382F;FGFR2-P253L;FGFR2-A97T;FGFR2-R251Q;FGFR2-A389T;FGFR2-S252P;FGFR2-R210Q;FGFR2-S252T;FGFR2-R203H;FGFR2-S252A;FGFR2-S351C;FGFR2-Y340C;FGFR2-G338R;FGFR2-S354C;FGFR2-L617F;FGFR2-W290R;FGFR2-L550F;FGFR2-M535I;FGFR2-Y308C;FGFR2-E777*;FGFR2-K641R;FGFR2-T370R;FGFR2-W72C;FGFR2-K526E;FGFR2-D304N;FGFR2-K659M;FGFR2-S267P;FGFR2-E731K;FGFR2-M537I;FGFR2-F276C;FGFR2-I547V;FGFR2-E565A;FGFR2-V395D;FGFR2-W290C;FGFR2-R678G;FGFR2-E777K;FGFR2-C382R;FGFR2-S372C;FGFR2-A315T;FGFR2-D101Y;FGFR2-Y375C;FGFR2-E219K;FGFR2-L770*;FGFR2-L770V;FGFR2-K659N;FGFR3-M528I;FGFR3-K650T;FGFR3-S371G;FGFR3-K650N;FGFR3-G380E;FGFR3-E627D;FGFR3-R399C;FGFR3-Y373N;FGFR3-Y373H;FGFR3-A500T;FGFR3-D641N;FGFR3-S249Y;FGFR3-A391V;FGFR3-S249F;FGFR3-S371R;FGFR3-R248H;FGFR3-G370S;FGFR3-P572A;FGFR3-P572L;FGFR3-R669Q;FGFR3-P250R;FGFR3-Y278C;FGFR3-L324V;FGFR3-S84L;FGFR3-R750C;FGFR3-S433C;FGFR3-K650Q;FGFR3-S371C;FGFR3-S249C;FGFR3-F384L;FGFR3-G370C;FGFR3-R248C;FGFR3-Y373C;和FGFR4-Y367C。对靶FGFR突变进行了对厄达替尼敏感性的临床前评估。
B)在某些实施方案中,靶FGFR突变包括:FGFR1-K656E;FGFR1-R189C;FGFR1-S125L;FGFR1-P150S;FGFR2-C390Y;FGFR2-E565G;FGFR2-E565Q;FGFR2-S252L;FGFR2-C382F;FGFR2-
P253L;FGFR2-R251Q;FGFR2-A389T;FGFR2-S252P;FGFR2-R210Q;FGFR2-S252T;FGFR2-R203H;FGFR2-S252A;FGFR2-S351C;FGFR2-Y340C;FGFR2-G338R;FGFR2-S354C;FGFR2-L617F;FGFR2-W290R;FGFR2-L550F;FGFR2-M535I;FGFR2-
Y308C;FGFR2-E777*;FGFR2-K641R;FGFR2-T370R;FGFR2-
W72C;FGFR2-K526E;FGFR2-D304N;FGFR2-K659M;FGFR2-S267P;FGFR2-E731K;FGFR2-M537I;FGFR2-F276C;FGFR2-I547V;FGFR2-E565A;FGFR2-V395D;FGFR2-W290C;FGFR2-R678G;FGFR2-E777K;FGFR2-C382R;FGFR2-S372C;FGFR2-
A315T;FGFR2-D101Y;FGFR2-Y375C;FGFR2-E219K;FGFR2-L770*;FGFR2-L770V;FGFR2-K659N;FGFR3-M528I;FGFR3-
K650T;FGFR3-S371G;FGFR3-K650N;FGFR3-G380E;FGFR3-E627D;FGFR3-Y373N;FGFR3-Y373H;FGFR3-D641N;FGFR3-S249Y;FGFR3-A391V;FGFR3-S249F;FGFR3-S371R;FGFR3-R248H;FGFR3-G370S;FGFR3-R669Q;FGFR3-P250R;FGFR3-Y278C;FGFR3-L324V;FGFR3-S84L;FGFR3-R750C;FGFR3-S433C;FGFR3-K650Q;FGFR3-S371C;FGFR3-S249C;FGFR3-G370C;FGFR3-R248C;FGFR3-Y373C;和FGFR4-Y367C。
FGFR基因改变,特别是突变和融合,可以作为与潜在肿瘤组织学无关的疾病的致癌驱动因素起作用。
在实体瘤类型中发现了不同频率(1%-29%)的FGFR改变(表2)(来自TCGA(癌症基因组图谱)和GENIE(AACR项目基因组学证据肿瘤信息交换)基因组数据库的数据分析)。
表2.晚期癌症中FGFR突变和融合的频率
NSCLC,非小细胞肺癌
a
b
c
d
实施例2:厄达替尼在具有晚期实体瘤和FGFR基因改变(NCT04083976)的受试者中
本文提供了一个正在进行的单臂、开放标签、2期组织学不可知试验的非限制性实例,该组织学不可知试验研究了厄达替尼(一种选择性泛FGFR抑制剂)在标准系统治疗失败后患有晚期实体瘤和FGFR改变的患者中的有效性和安全性。
总体研究设计
该2期开发标签研究(也称为RAGNAR研究)研究了厄达替尼在≥6岁的具有晚期实体瘤(尿路上皮肿瘤除外)和FGFR基因改变的受试者中的有效性和安全性。将具有靶FGFR突变或任何FGFR基因融合的≥12岁的受试者入组到宽小组队列中。靶FGFR突变包括基于致病性可能性和对厄达替尼临床前敏感性的选择突变,或具有支持纳入的临床或相关证据的那些。将具有预先指定的FGFR标志物的选择小组的宽小组队列中的受试者亚组鉴定为核心小组队列(仅用于分析)。虽然宽小组队列由靶FGFR突变和任何融合组成,但核心小组队列由选定的FGFR突变或融合子集组成。在该研究中包括具有未在宽小组队列中捕获的任何其他FGFR突变的受试者作为探索队列。一旦宽小组队列达到约30名胆管癌受试者的上限,单独的胆管癌扩展队列就入组具有靶FGFR突变或任何FGFR基因融合的受试者。儿科队列入组了所有6岁至<18岁的患有具有FGFR改变的局部晚期或转移性实体瘤的受试者,这些受试者在既往治疗之后已取得进展并且没有可接受的标准治疗,或者具有新诊断的实体瘤并且没有可接受的标准治疗。入组宽小组队列(≥12岁至<18岁)的青少年受试者被认为是宽小组队列和儿科队列的一部分。
筛选阶段从分子资格筛选期开始。具有符合研究资格的FGFR改变的受试者可以通过组织样品的中心下一代测序(NGS)或基于组织或血液的本地执行和商业测试(NGS测试、直接数字计数方法、或Qiagen
来自所有实体瘤组织学(膀胱除外)且通过当地测试结果鉴定的符合条件的FGFR突变或融合的受试者被认为在分子水平上符合本研究的条件。
如果患有晚期实体瘤的受试者已接受至少1个线数的系统治疗并且预期在6个月内满足研究资格标准,则他们可以接受中心分子筛选。中心分子筛选对以下肿瘤组织学具有选择性:高级别神经胶质瘤(例如,胶质母细胞瘤)和低级别神经胶质瘤;鳞状细胞头颈癌;软组织肉瘤;胆管癌;子宫内膜癌、宫颈癌和卵巢癌;鳞状NSCLC;肾细胞癌;食道癌和胃癌;激素敏感性乳腺癌(雌激素阳性[ER]/孕酮阳性[PR]);肝细胞癌、胰腺癌、唾液腺肿瘤、结肠直肠癌和胸腺癌/胸腺瘤。对于儿科受试者,如果认为当地报告不充分,将允许对任何肿瘤类型进行中心筛选。对于每个肿瘤组织学的入组,将样品大小限制在约30名受试者。该上限的肿瘤组织学列表,包括“其他”组,在表4中预先定义。
表4:无效和上限的肿瘤组织学列表
注意:“其他”组入组了未列出的所有其他肿瘤组织学。“其他”组共享约30的相同上限,并且将仅被包括在用于信息借入的BHM评估中,但是在期中分析初期将不被认为是无用的,并且将继续入组直到达到上限。
完整研究筛选期发生在符合分子筛选标准的受试者完成既往治疗并记录疾病进展之后。
治疗阶段持续直至疾病进展、出现无法耐受的毒性、撤回同意或研究人员决定停止治疗。治疗后随访期从治疗结束访视开始,直至受试者死亡、撤回同意、失去随访或研究结束,以先到者为准。
在研究结束时,根据研究人员的确定,已完成研究并从研究干预中获益的受试者将中断试验,并且应当继续用市售药物(作为护理标准的一部分)进行治疗,如果该市售药物是按照当地规定可供受试者使用的。如果无法获得市售药物,根据研究人员的确定,已完成研究并从研究干预中获益的受试者将能够在研究结束时并根据当地法规继续使用厄达替尼(例如,专用扩展/访问研究、访问程序,如适用)。
图1中提供了该研究的示意性概述。
研究概述
受试者数量
干预组和持续时间
纳入标准
1.≥6岁。
2.具有FGFR突变或融合的不可切除、局部晚期或转移性实体瘤恶性肿瘤的组织学证明,如通过当地*或中心实验室筛选所确定的。
用NGS测试、直接数字计数方法或在临床实验室改进修正案(CLIA)认证的或地区同等实验室中进行的Qiagen
宽小组队列的分子标准:
具有靶FGFR突变或任何**FGFR基因融合的受试者有资格入组宽小组队列。具有未在宽小组队列中捕获的其他FGFR突变***的受试者有资格入组探索队列。
儿科队列的分子标准:
具有任何FGFR突变***(排除在排除标准中定义的FGFR缬氨酸看守和耐药性改变之外)或任何**FGFR基因融合或FGFR重复****的受试者有资格入组儿科队列。
**FGFR融合规范:
·有报告表明存在完整FGFR激酶结构域
·与3-引物配偶体的FGFR融合(FGFR基因首先列出,例如FGFR-GENE或FGFR3-TACC3):
ο融合的FGFR部分必须涉及外显子17或更大(≥17)
·与5-引物配偶体的FGFR融合(配偶体基因首先列出,而FGFR基因第二个列出,例如GENE-FGFR或KLK2-FGFR2):
·融合的FGFR部分必须涉及少于或等于外显子11(≤11)并且具有命名的FGFR融合配偶体基因(自融合或重排(例如FGFR-FGFR)不符合条件)(仅宽小组队列)
本研究中的***突变被定义为编码蛋白质的单核苷酸变体(SNV)和插入或缺失(indel)。拷贝数增加或基因水平扩增不符合条件。在当地报告中注释为种系的FGFR突变,或呈现与种系FGFR突变相关的遗传性病况/病症的受试者在不存在合格的FGFR突变或融合的情况下不符合入组资格。注意,该研究不需要测试种系突变。
****仅对于儿科队列:如果一个断点位于内含子8至外显子11,而另一个断点位于内含子17至内含子18(包括3'UTR),则FGFR激酶结构域(FGFR-FGFR)的基因内重复。拷贝数增加或基因水平扩增不符合条件。
3.根据实体瘤反应评估标准(RECIST)1.1版或对原发性脑肿瘤的神经-肿瘤学反应评估(RANO)可测量的疾病。
4.受试者必须在晚期、不可切除或转移性环境中接受过至少一个既往线数的系统治疗,或者是患有新诊断的实体瘤并且没有可接受的标准治疗的儿童或青少年受试者。
5.受试者没有对相关基础组织学和治疗线显示出有意义的临床益处的标准护理选择,或者受试者无法耐受该治疗。
6.记录的疾病进展,定义为在全面研究筛选之前需要改变治疗的任何进展。
7.先前抗癌治疗的毒性应已缓解至基线水平或1级或更低,但脱发、周围神经病变和符合纳入标准9的2级实验室值除外。
8.对于成年人(≥18岁),东部肿瘤协作组织(ECOG)表现状态为0级或1级。对于儿童和青少年(≥6岁至<16岁),Lansky评分≥80。对于青少年(≥16岁至<18岁),Karnofsky评分≥80。
9.足够的骨髓、肝和肾功能。骨髓功能(在前2周没有细胞因子或红细胞生成刺激剂输注的支持):(a)绝对中性粒细胞计数(ANC)≥1,000/mm3;(b)血小板计数≥75,000/mm3;以及(c)血红蛋白≥8.0g/dL。肝功能:(a)总胆红素≤1.5倍机构正常上限(ULN)或总胆红素水平>1.5倍ULN的受试者的直接胆红素≤ULN;并且(b)肝转移受试者的丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)≤2.5倍机构ULN或≤5倍机构ULN。肾功能:肌酸酐清除率>30mL/min/1.73m2,通过24小时尿液收集直接测量或使用用于成年受试者的Cockcroft-Gault公式或用于儿童和青少年受试者(≥6岁<18岁)的CKiD(儿童慢性肾病)Schwartz公式计算。磷酸盐:治疗14天内和第1周期第1天之前 10.受试者必须签署知情同意书(或其法律上可接受的代表必须签署),表明该受试者了解该研究的性质、意义和目的,以及该研究所需的程序和该研究的结果;并且愿意参与该研究。对于儿童和青少年受试者,父母(如果可以或根据当地要求,优选两者)(或其法律上可接受的代表)必须签署ICF,表明该受试者了解研究的目的和所需的程序,并且愿意让儿童参与研究。还需要儿童和青少年受试者的同意。 11.有生育能力的女性在筛查(尿液或血清)时妊娠试验(β-人绒毛膜促性腺激素[hCG])必须呈阴性。 12.男性或女性受试者采用避孕措施应符合当地有关参与临床研究的受试者使用避孕方法的规定。 排除标准 1.既往接受过化疗、靶向治疗或在30天内或在该药剂的<5个半衰期内(以较长者为准)并且在首次给药厄达替尼前最多30天内接受过研究性抗癌剂治疗。在首次给药厄达替尼前30天内接受过既往免疫治疗和/或具有持续的≥2级免疫治疗相关毒性。 2.已知*存在FGFR缬氨酸看守和耐药性改变。在以下位置的突变:FGFR1 V561;FGFR2 V564;FGFR3 V555;FGFR4 V550;FGFR1 N546;FGFR2 N549;FGFR3 N540和FGFR4N535。*观察当地或中心报告中的看守和耐药性改变。如果当地测试未筛选所有四种FGFR,例如FGFR4,则当地报告对于分子筛选仍然是可评估的。 3.对于非小细胞肺癌(NSCLC)受试者,仅EGFR*或BRAFV600E、KRAS中的致病性体细胞突变或基因融合,或以下基因中的任何基因融合:ALK、ROS1或NTRK。*这些基因的评估可以按照机构标准进行,并且不必通过NGS评估。对于结肠直肠癌受试者,仅BRAF、KRAS、NRAS和PIK3CA中的致病性体细胞突变。 4.尿路上皮癌的组织学表现。 5.血液学恶性肿瘤(即,骨髓和淋巴肿瘤)。 6.除需要治疗的疾病之外的活性恶性肿瘤。 7.症状性中枢神经系统转移(患有原发性CNS肿瘤的受试者除外)。 8.接受过既往选择性FGFR抑制剂治疗。 9.已知对厄达替尼或其赋形剂过敏、超敏或不耐受。 10.目前患有任何级别的中心性浆液性视网膜病变(CSR)或视网膜色素上皮脱离。 11.未受控制的心血管疾病史,包括:(a)不稳定型心绞痛、心肌梗死、心室纤维性颤动、尖端扭转型室性心动过速、心脏骤停或已知的在前3个月内的III-V类充血性心力衰竭;前3个月内的脑血管意外或短暂性脑缺血发作;(b)QTc延长(Fridericia:QTc>480毫秒;或对于儿童和青少年受试者,Bazett:QTc>440毫秒。 12.已知AIDS(人免疫缺陷病毒(HIV)感染)病史,除非该受试者在过去6个月或更长时间内已经进行了稳定的抗逆转录病毒治疗方案,在过去6个月内没有机会性感染,并且CD4计数>350。 13.活性乙型肝炎或丙型肝炎感染的证据(例如,允许具有丙型肝炎感染史但丙型肝炎病毒聚合酶链式反应测试正常的受试者和HbsAg抗体阳性的乙型肝炎受试者)。 14.未从既往抗癌治疗的可逆毒性中恢复(除了临床上不显著的毒性,诸如脱发、皮肤变色、神经病变、听力丧失)。 15.伤口愈合能力受损定义为皮肤/褥疮溃疡、慢性腿部溃疡、已知的胃溃疡或未愈合切口。 16.在首次给药厄达替尼前4周内进行过大手术。 17.在首次给药厄达替尼前2周内对靶病灶进行过姑息性放疗。 18.怀孕或哺乳或计划在入组本研究期间或在药物的最后一个剂量之后3个月内怀孕。 19.计划在入组本研究时或在药物最后一次给药后3天内成为孩子父亲。 20.研究者认为参与本研究不符合受试者的最佳利益(例如,损害健康)或者可能阻止、限制或混淆方案指定的评估的任何病症。非限制性实例包括需要系统治疗的持续活性感染和不受控制的持续医学状况。 FGFR标志物 表5. /> /> /> /> /> 1 小组队列 治疗群体将由接受至少1剂研究药物的所有受试者组成。治疗群体是用于有效性和安全性分析的主要群体。可评估反应群体将包括满足以下标准的所有受试者:符合研究的所有资格标准;接受至少1个剂量的研究药物;并且具有基线和至少1次充分的治疗后放射学疾病评估,或具有疾病进展的临床体征或症状,或在第一次治疗后疾病评估之前死亡(这些受试者将被视为非反应者)。充分的疾病评估被定义为具有足够的证据表明进展已经发生或尚未发生。 利用FoundationInsights数据库评估了8种最常观察到的儿科肿瘤的FGFR改变频率。 作为探索性分析,将评估接受至少1个剂量的研究药物的入组探索队列的受试者的有效性和安全性。 治疗群体将用于总结研究群体和特征、有效性和PRO数据;有效性和安全性分析将在宽小组队列中的治疗群体中进行。可评估反应的群体将用于期中分析,以及关键终点诸如ORR和DOR的支持性有效性分析。 评估 统计学方法 次要终点包括通过研究人员评估的ORR、反应持续时间(DOR)、疾病控制率(DCR)、临床受益率(CBR)、无进展生存期(PFS)、总生存期(OS)、药代动力学(PK)暴露参数、不良事件的发生率和严重程度(Aes)以及患者报告结果(PRO)。研究人员评估的ORR的分析方式与IRC评估的ORR相同。使用Kaplan-Meier估计来总结DOR、PFS和OS的分布,并将估计的中值与95%CI一起报告。在每个评估时间点对PRO评估进行描述性概要(即平均值、标准偏差,包括相对于基线的变化)进行分析。儿科队列具有与宽小组队列相同的主要和次要终点;儿科队列中的受试者与宽小组队列分开进行评价。胆管癌扩展队列与宽小组队列分开进行评估。 当宽小组队列中30%、50%和70%的受试者(即,约60、100和140个受试者)已接受治疗并且被认为可评估反应时,计划了三次期中无效分析,无论肿瘤组织学和肿瘤组织学之间的分布如何。对无效的期中分析是基于使用贝叶斯分级模型(BHM)的主要终点(ORR),在FACTS v6.2富集设计-二分法中实施。另外,在第二次期中无效分析的同时,对宽小组队列进行了期中无效分析。主要分析将基于BPC的治疗人群,在约200名可评估反应的受试者接受治疗后6个月进行。 上调剂量指导 下面和图2中提供了在不存在厄达替尼相关毒性的情况下,基于第1周期第14天的血清磷酸盐水平上调厄达替尼剂量的说明。对于6岁至<12岁的儿童和12岁至<15岁的青少年,将在第2周期第7天抽取另外的血液样品用于确定血清磷酸盐水平和对剂量调整的需要。 血清磷酸盐水平高于并包括9.00mg/dL(>2.91mmol/L)的受试者将停止厄达替尼治疗,至少每周评估血清磷酸盐直至其恢复至低于7.00mg/dL(<2.25mmol/L),同时开始用磷酸盐结合剂诸如司维拉姆治疗。 成年受试者和15岁至<18岁的青少年受试者 在第1周期第14天血清磷酸盐水平在7.00mg/dL至8.99mg/dL(2.25mmol/L至2.90mmol/L)之间的成年受试者和15岁至<18岁的青少年受试者将厄达替尼剂量从每天一次8mg增加至每天一次9mg,同时开始用磷酸盐结合剂诸如司维拉姆治疗。 血清磷酸盐水平低于7.00mg/dL(<2.25mmol/L)的成年受试者和15岁至<18岁的青少年受试者将在第1周期第14天将厄达替尼剂量增加至每天一次9mg。这些受试者不需要伴随治疗。 12岁至<15岁的青少年受试者 血清磷酸盐水平在7.00mg/dL至8.99mg/dL(2.25mmol/L至2.90mmol/L)之间的12岁至<15岁的青少年受试者将在第1周期第14天或第2周期第7天将厄达替尼剂量从每天一次5mg增加至每天一次6mg,并且在第2周期第7天进一步从每天一次6mg增加至每天一次8mg(对于在第1周期第14天已经上调剂量至6mg的那些),同时开始用磷酸盐结合剂诸如司维拉姆治疗。该2步上调剂量是逐步进行的,即,不允许受试者直接从5mg上调剂量至8mg。 血清磷酸盐水平低于7.00mg/dL(<2.25mmol/L)的12岁至<15岁的青少年受试者将在第1周期第14天或第2周期第7天将厄达替尼剂量从每天一次5mg增加至每天一次6mg,并且在第2周期第7天进一步从每天一次6mg增加至每天一次8mg(对于在第1周期第14天已经上调剂量至6mg的那些)。该2步上调剂量是逐步进行的,即,不允许受试者直接从5mg上调剂量至8mg。不需要伴随治疗。 6岁至<12岁的儿童 血清磷酸盐水平在7.00mg/dL至8.99mg/dL(2.25mmol/L至2.90mmol/L)之间的6岁至<12岁的儿童将在第1周期第14天或第2周期第7天将厄达替尼剂量从每天一次3mg增加至每天一次4mg,并且在第2周期第7天进一步从每天一次4mg增加至每天一次5mg(对于在第1周期第14天已经上调剂量至4mg的那些),同时开始用磷酸盐结合剂诸如司维拉姆治疗。该2步上调剂量是逐步进行的,即,不允许受试者直接从3mg上调剂量至5mg。 血清磷酸盐水平低于7.00mg/dL(<2.25mmol/L)的6岁至<12岁的儿童将在第1周期第14天或第2周期第7天将厄达替尼剂量从每天一次3mg增加至每天一次4mg,并且在第2周期第7天进一步从每天一次4mg增加至每天一次5mg(对于在第1周期第14天已经上调剂量至4mg的那些)。该2步上调剂量是逐步进行的,即,不允许受试者直接从3mg上调剂量至5mg。不需要伴随治疗。 如果错过给药,则可以在预定时间后至多6小时服用;第二天受试者可以返回到正常日常表。如果距错过剂量已超过6小时,则应当跳过该剂量,并且受试者应当在第二天的预定时间继续治疗。如果伴随药物施用发生呕吐,则不会服用替代剂量,并且剂量施用后多达4小时发生的任何此类事件必须记录在电子病例报告表(eCRF)上。 在具有CYP2C9*3/*3基因型的受试者中,厄达替尼的暴露可增加50%,估计在各种种族中占人口的0.4%至3%。因此,在已知或怀疑具有CYP2C9*3/*3基因型的受试者中监测不良反应增加。剂量滴定由所有受试者的血清磷酸盐水平指导,而与基因型无关;因此,可以解决包括安全性的较高厄达替尼暴露的问题。 目标和终点 表6中提供了主要和次要目标和终点。 表6.目标和终点 /> 期中分析结果 这些结果基于以下期中给药日程表:受试者以21天周期每天一次厄达替尼口服21天,直至疾病进展、无法耐受的毒性、撤回同意或研究者决定停止治疗。成年人(给药年龄为18岁及以上)和15岁至<18岁的青少年受试者以8mg的厄达替尼剂量开始,基于第1周期第14天的血清磷酸盐水平可能上调剂量至9mg。每个剂量大约在每天的同一时间给药,与食物一起或不与食物一起。12岁至<15岁的青少年受试者以5mg的厄达替尼量开始,基于第1周期第7天和第1周期第14天的血清磷酸盐水平可能上调剂量至6mg或进一步至8mg。 以下结果基于以下患者组:15个国家的5758名患者接受了分子筛选(中心或当地)。191名患者(3.3%)满足主要分析分子资格标准。有110名患者入组。中位年龄为57岁,19名患者(17.3%)年龄<40岁;男女分布均匀(表7)。在入组的患者中,14名(12.7%)进行了中心筛选,96名(87.3%)进行了当地下一代测序(NGS)报告(表7)。 表7.RAGNAR入组群体的人口统计和分子测试 在18种肿瘤类型中鉴定出符合条件的FGFR改变,包括罕见癌症(表8以及图3A和图3B)。 表8. 表9示出了单个患者水平的FGFR改变和在期中分析2时的最佳总体反应(135名治疗的宽小组队列患者)。 表9. /> /> /> /> GIST=胃肠道间质瘤。 部分反应(PR);完全反应(CR);稳定疾病(SD);疾病进展(PD);不可评估(NE);未确认的部分反应(uPR) 表10中提供了表9中融合配偶体的全基因名称和UniProt登录号。 表10 /> 以下结果包括来自有效性分析组和安全性分析组的数据。有效性分析组包括在设定日期或之前开始治疗并且具有至少两次疾病评估的在宽小组队列中治疗的所有受试者(n=124)。根据方案对有效性分析组中的所有受试者进行治疗并随访直至临床截止日期,以提供对所有受试者的临床活性的至少5个月的客观证据的充分随访。安全性分析组(在“安全性概述”部分中概述)包括在宽小组队列中的所有受试者,其被治疗直至设定日期(n=144)。 有效性分析组包括患有21种不同肿瘤类型的受试者,包括2名儿科患者(12岁和13岁)。入组的肿瘤类型包括CNS、妇科、胸和胃肠道恶性肿瘤以及罕见肿瘤诸如胸腺癌、甲状旁腺癌和唾液腺癌(表11)。此外,入组的肿瘤类型具有影响FGFR1(8.9%)、FGFR2(47.6%)或FGFR3(44.4%)的一组不同的靶突变(28.2%)或融合(72.6%)(表11)。 表11.按FGFR基因和变异类型划分的肿瘤组织学概述;疗效 治疗的受试者是具有显著肿瘤负荷的经过大量预治疗的患者群体。在患有转移性疾病的受试者中,84%患有内脏转移。所有124名治疗的受试者(100%)根据每个方案的需要在高级环境中接受了最少一次系统治疗。既往系统治疗的中值数量为2(范围1至9)。具体地说,35/124(28.2%)受试者接受过2个既往线数的系统治疗,55/124(44.4%)受试者接受过3种或更多种既往治疗。另外,83/124(66.9%)受试者接受过既往癌症相关手术,52.4%(65/124)接受过既往放射治疗。例如,在患有HGG的受试者(包括患有GBM的受试者)中,20/24(83.3%)接受过既往手术,24/24(100%)接受过既往放射治疗,24/24(100%)接受过至少一个既往线数的系统治疗,18/24(75%)接受过2个或更多个线数的系统治疗。在患有CCA的受试者中,(31/31)100%接受过至少一个既往线数的系统治疗,包括30/31(96.8%)接受过既往基于铂的化疗,以及19/31(61.3%)接受过2个或更多个线数的治疗。类似地,患有胰腺癌的受试者在其符合条件的转移环境中没有进一步的标准治疗选择,具有3个既往线数的抗癌疗法的中值(范围1-9)。这些疗法包括在第一线和随后的线中建立的方案,例如FOLFIRINOX、吉西他滨单一疗法/双重疗法和含有伊立替康的双重疗法,视个体受试者而定。根据分子和其他标准可以使用多种系统治疗的患有乳腺癌的受试者也在入组前以5个既往治疗线的中值进行大量预治疗(范围2-9)。值得注意的是,在整个有效性分析组中,根据研究人员评估,仅有9/124(7.3%)受试者对最后一个既往治疗线有反应。所有治疗的受试者均由研究人员确认符合方案纳入标准,对于该标准没有进一步的护理标准选择,对潜在肿瘤类型具有已知确定的临床益处,或受试者无法耐受那些治疗。表12提供了对有效性分析组的疾病特征的概述。 表12:基线时的疾病特征的概述;有效性分析组 反应和耐久性的概述 有效性分析组中的124名受试者的中值随访时间为11.07个月(95%CI;9.76,11.27)。根据研究人员评估,124名治疗的受试者中有三十六名具有确认的反应,总体反应率(ORR:CR+PR)为29.0%(95%CI;21.2%,37.9%),包括3名完全反应(CR)的受试者和33名部分反应(PR)的受试者。根据RECIST 1.1或RANO标准,通过后续疾病评估确认所有反应。在12种不同的肿瘤类型中观察到对厄达替尼的客观反应率,如表13所示。 表13.跨肿瘤组织学的有效性概述;有效性分析组 在靶FGFR突变(1名CR和8名PR)和融合(2名CR和25名PR)中观察到反应,靶突变(9/35)中的相当ORR为25.7%(95%CI;12.5%,43.3%),融合(27/90)中为30.0%(95%CI;20.8%,40.6%)。在携带FGFR1(11名中的1名CR和2名PR)、FGFR2(59名中的2名CR和22名PR)和FGFR3基因(55名中的9名PR)的融合或靶突变的肿瘤中观察到反应。反应不以一种突变或融合为主,突出显示了不仅跨改变类型(突变/融合)和FGFR基因(FGFR1-3),而且跨这些类别内的多个变体的不同反应特征。表14中提供了关于在每个治疗的受试者中鉴定的FGFR改变的其他信息,包括关于潜在肿瘤类型和反应的详细信息。此外,在接收过不同数量的既往系统治疗线(包括1、2或多个治疗线)的受试者中观察到反应,并且所有这些受试者没有具有确定的临床益处的其他治疗选择。 表14:每个受试者的FGFR改变、最佳反应、反应持续时间和PFS的列表 /> /> *液泡蛋白分选相关蛋白35(VPS35)具有UniProt登录号Q96QK1。 另外,60/124(48.4%)受试者患有稳定疾病(SD),疾病控制率(DCR:CR+PR+SD)为96/124(77.4%)(95%CI;69%,84.4%)。在患有SD的受试者中,大多数表现出肿瘤缩小10%-29%(图4)。值得注意的是,根据研究人员反馈,11/24(45.8%)患有HGG的受试者具有持久的SD或PR,肿瘤缩小且临床改善。此外,一名患有基底细胞癌和FGFR2S252L突变的受试者的面部皮肤病变得到了显著的临床改善,疾病稳定期为约15.01个月。患有胸腺癌和IGSF3-FGFR1融合的另一个受试者也患有约15.05个月的持久稳定疾病。此外,33名患有SD的受试者具有至少4个月的疾病稳定期,临床受益率(CBR:CR+PR+SD>4个月)为69/124(55.6%)(95%CI;46.5%,64.6%),证明了在具有显著肿瘤负荷并且没有可用的标准治疗的患者群体中具有重要的临床益处。 中值缓解时间为1.41个月(范围1.2-7.9)。反应持久,中值反应持续时间(DOR)为6.93个月(95%CI,4.60,9.63)。反应者的中值治疗持续时间为8.26个月。在36名反应者(CR/PR)中,15名受试者具有正在进行的反应。此外,16名受试者具有至少6个月的DOR(7名正在进行),12名反应者具有至少4至6个月的DOR(3名正在进行),并且8名受试者具有<4个月的DOR(5名正在进行)(图5)。值得注意的是,在包括CCA、胰腺癌、HGG、LGG、乳腺癌、子宫内膜癌、卵巢癌、非鳞状NSCLC和鳞状NSCLC的肿瘤类型中观察到至少4个月的持久反应。例如,患有胰腺癌的受试者的中值DOR是8.48个月(95%CI,4.14,NE)。具有最长的正在进行的PR的受试者患有子宫内膜癌和10.9个月的DOR(图5)。具有CR的两名CCA受试者分别具有6.93个月和9.69+个月的DOR,并且具有CR的LGG受试者具有8.67+个月的DOR。此外,根据研究人员要求,13名受试者在放射照相PD后接受了至少4周的治疗,因为受试者继续表现出临床益处。 安全性概述 在该研究中迄今观察到的安全性和耐受性特征与已知的厄达替尼毒性特征一致。在该分析中包括的144名治疗的BPC受试者中,高磷酸盐血症(65.3%)、腹泻(54.2%)、口腔炎(49.3%)和口干(47.9%)是观察到的最频繁的治疗期间出现的不良事件(TEAE),并且大多数是1-2级。6.3%的受试者发生药物相关的严重TEAE,并且3.5%的受试者出现药物相关的TEAE,导致停药。没有导致死亡的药物相关TEAE。 期中分析3(IA3)结果 概述 IA3的患者群体占主要分析的总研究计划患者的约74%(178/~240)。通过IRC评估的有效性表明,在已用尽标准治疗的大量预治疗的患者群体中,ORR为29.2%(CI 95%;22.7%,36.5%)并且DOR为6.90个月(CI 95%;4.37、7.95)。在宽范围的FGFR1-3突变和融合中以及在多种肿瘤类型中观察到有效性,并且在15种不同肿瘤类型中得到了证实的反应。IA3的样品大小(n=178)提供了ORR和DOR的点估计的置信度,其即使在置信区间下限分别为22.7%和4.37个月的情况下也具有临床意义。根据IRC评估(29.2%;6.90个月)和每个研究人员评估(26.4%;7.10个月)分别在IA3群体中观察到相似的ORR和DOR,这增加了所观察到的有效性的稳健性的置信度。根据IRC,具有临床意义的DCR为72.5%并且CBR为46.1%,进一步支持了临床益处,其中安全数据与厄达替尼的已知安全性一致,并且总体风险-益处比良好。 研究群体和疾病特征 178名患者(176名成年患者和2名儿科患者,12岁和13岁)的分析组代表32种不同的肿瘤类型,突出了具有靶FGFR突变或融合的广泛和不同范围的肿瘤类型和患者群体。入组并不以任何单一肿瘤类型为主,并且包括患有CNS、妇科、胸和胃肠道恶性肿瘤以及罕见肿瘤诸如胸腺癌、甲状旁腺癌和唾液腺癌的患者。此外,入组的肿瘤类型包括影响FGFR1(9.0%)、FGFR2(48.9%)或FGFR3(42.1%)的一组不同的靶突变(31.5%)或融合(68.5%),包括几种新型FGFR融合。由于FGFR4改变的罕见性,特别是在成人癌症中,没有将具有这些改变的患者入组报告的分析组。表15提供了入组BPC的肿瘤类型、FGFR基因和改变类型的概述。 表15.按FGFR基因和变异类型划分的肿瘤组织学概述 客观反应和反应持续时间 有效性分析组中的178名患者的中值有效性随访时间为12.3个月(95%CI;9.86,13.60)。根据IRC评估,在入组BPC的178名治疗的患者中,52名具有确认的反应,总反应率(ORR:CR+PR的比率)为29.2%(95%CI;22.7%,36.5%),包括3名CR患者和49名PR患者。根据RECIST 1.1或RANO标准,通过后续疾病评估确认所有反应。反应是持久的,根据IRC,中值DOR为6.90个月(95%CI;4.37,7.95)。在15种不同的肿瘤类型中观察到对厄达替尼的持久反应,这些肿瘤类型代表CNS、头颈、胸、胃肠道和妇科恶性肿瘤以及罕见肿瘤诸如唾液腺癌和LGG。如表16和图6所示,对厄达替尼的反应不以任何单一肿瘤类型为主。表17提供了按肿瘤类型划分的FGFR基因和改变类型的ORR。重要的是,每个研究人员评估的ORR和中值DOR显示出与IRC数据相似的结果,其中研究人员评估的ORR为26.4%(95%CI;20.1,33.5),并且中值DOR为7.10个月(95%CI;5.52,9.33)。 反应者的中值治疗持续时间为7.74个月。中值反应时间为1.41个月(范围:1.1至9.8)。在52名反应者(CR/PR)中,21名患者在CCO时有正在进行的反应。此外,14名患者具有至少6个月的DOR(8名正在进行),14名反应者具有至少4至6个月的DOR(6名正在进行),并且24名患者具有<4个月的DOR(7名正在进行)(图7)。在多种肿瘤类型中观察到至少4个月的反应,这些肿瘤类型包括CCA、胰腺癌、HGG、LGG、乳腺癌、子宫内膜癌、卵巢癌、非鳞状NSCLC、鳞状细胞头颈癌和其他癌症。值得注意的是,在患有胰腺癌的患者中,中值DOR为7.1个月(95%CI;2.76,NE)。最长的正在进行的PR是1名胰腺癌患者(DOR为13.8+个月)和1名子宫内膜癌症患者(DOR为13.7+个月)(图7)。三名患者具有正在进行的确认的CR:一名CCA患者具有12.2+个月的DOR,一名LGG患者具有9.6+个月的DOR,一名非鳞状NSCLC患者具有8.3+个月的DOR。此外,根据研究中心要求,24名患者在研究人员评估放射照相疾病进展之后接受了至少4周的治疗,因为患者继续表现出临床益处。 CCA=胆管癌;HGG=高级别神经胶质瘤;BRST=乳腺癌;PANCR=胰腺癌;sqNSCLC=鳞状NSCLC;nonsqNSCLC=非鳞状NSCLC;CRC=结肠直肠癌;EDMTL=子宫内膜癌;ESOPH=食道癌;LGG=低级别神经胶质瘤;GSTRC=胃癌;HNSCC=鳞状细胞头颈癌;CRVX=宫颈癌;OVAR=卵巢癌;CUP=原发灶不明癌;SALIV=唾液腺癌;PCA=前列腺癌;STS=软组织肉瘤 a 表17 亚组分析 基于IRC对确认的ORR的亚组分析证明,厄达替尼治疗在预定亚组之间递送一致的临床益处,包括年龄、性别、基线ECOG状态、地理区域、既往疗法的行数、FGFR改变类型和FGFR基因类型(图8),具有相似的ORR和重叠的95%CI。 在BPC和核心小组队列中均观察到分析组中的反应,BPC中的相当ORR为29.2%(95%CI;22.7%、36.5%),并且核心小组队列中为30.2%(95%CI;20.8%,41.1%)。此外,在靶FGFR突变(1名CR和14名PR)和融合(2名CR和36名PR)中观察到反应,靶突变(15/56)中的相当ORR为26.8%(95%CI;15.8%,40.3%),融合(38/122)中为31.3%(95%CI;23.1%,40.2%)。在携带FGFR1(16名中的1名CR,,3名PR)、FGFR2(87名中的1名CR,36名PR)和FGFR3基因(75名中的1名CR,11名PR)的融合或靶突变的肿瘤中观察到反应。反应不以任何单一突变或融合为主,突出显示了不仅跨改变类型(突变/融合)和FGFR基因(FGFR1-3),而且跨这些类别内的多个变体的不同反应特征。 跨肿瘤类型的有效性 作为一项对不可知肿瘤的研究,研究CAN2002的主要目的是利用适用的反应评估标准(用于非CNS肿瘤的RECIST 1.1;用于CNS肿瘤的RANO标准),通过IRC评估厄达替尼在实体瘤中ORR方面的有效性。 表18提供了进一步表征临床活性的次要终点的详细信息。在所有肿瘤类型中,观察到72.5%的DCR、46.1%的CBR、4.2个月的PFS和10.9个月的OS。此外,72.5%的患者表现出目标病变缩小,如图6所示。这些数据支持了厄达替尼在肿瘤不可知环境中的上述ORR和DOR结果。评估各肿瘤类型的临床活性。例如,在HGG中,通过IRC的ORR为10.3%(3/29)(通过研究人员为20.7%[6/29]),29名患者中有15名(51.7%)的垂直直径乘积总和有所降低。此外,34.5%(10/29)的患者表现出临床益处,包括7名患有至少4个月的稳定疾病的患者和3名具有部分反应的患者。29名患者中有8名正在进行治疗,包括4名已经治疗了至少12个月的患者。在具有确认的反应的患者中,反应较深,其中2名患者的垂直直径乘积总和降低了>75%。反应具有临床意义(中值:未达到)。 在某些肿瘤类型中,对于报告的分析组没有观察到确认的反应。这些肿瘤类型仅入组了少量患者,反映出这些肿瘤实体中FGFR改变的发生特别罕见。这些包括结肠直肠癌(n=6);胃癌(n=5)和宫颈癌(n=4),以及入组1-2名患者的多种肿瘤类型(表18)。尽管缺乏确认的反应,但几个患有这些肿瘤类型的患者在研究治疗中表示出有意义的临床益处。例如,患有结肠直肠癌、胃癌、宫颈癌、胸腺癌、甲状旁腺癌、GIST、腺样囊性癌、基底细胞癌和软组织肉瘤的患者是具有至少4个月的稳定疾病的患者和具有肿瘤缩小迹象的患者。其中包括2名患有基底细胞癌和胸腺癌的患者,PFS分别为14.75个月和15.05个月。患有甲状旁腺癌、腺样囊性癌和软组织肉瘤的患者继续在临床截止日期(CCO)的时间点进行治疗而没有PFS事件。 CCA=胆管癌;HGG=高级别神经胶质瘤;BRST=乳腺癌;PANCR=胰腺癌;sqNSCLC=鳞状NSCLC;nonsqNSCLC=非鳞状NSCLC;CRC=结肠直肠癌;EDMTL=子宫内膜癌;ESOPH=食道癌;LGG=低级别神经胶质瘤;GSTRC=胃癌;HNSCC=鳞状细胞头颈癌;CRVX=宫颈癌;OVAR=卵巢癌;CUP=原发灶不明癌;SALIV=唾液腺癌;PCA=前列腺癌;STS=软组织肉瘤 CBR定义为基于RECIST v1.1.或RANO获得CR、PR或持久SD(定义为至少4个月的持续时间)的最佳反应的受试者的比例。 DCR定义为基于RECIST v1.1.或RANO获得CR、PR或SD的最佳反应的受试者的比例。 a b 注意:基于单臂研究设计的事件终点解释时间有限 表19中提供了根据个体患者和FGFR改变类型的宽小组队列中的肿瘤评估的列表。 /> /> /> /> 厄达替尼的安全性 这里给出的安全性分析是针对在BPC中治疗的相同分析组(n=178)。在研究CAN2002中迄今观察到的安全性和耐受性特征与已知的厄达替尼毒性特征一致。数据审查委员会在期中分析1、2和3中对安全新数据的审查并未引起新的安全性问题或导致研究行为发生变化。 表20中提供了TEAE的总体概述。BPC中的所有受试者(100.0%)均经历过至少1次TEAE。BPC中超过一半的患者(69.1%)的TEAE为3级或更高,并且44.9%的TEAE为3级或更高,这被研究人员认为与厄达替尼相关(即药物相关)。37.6%的患者报告了严重不良事件,并且7.3%的患者认为与药物相关。超过一半的患者经历过导致剂量中断(74.7%)或减少(61.2%)的TEAE,而较小百分比的TEAE导致治疗中断(12.9%)。报道了13名患者(7.3%)因TEAE导致死亡,包括根据研究人员评估被认为与研究治疗相关的一例死亡。 BPC中178名受试者(>30%)的最频繁报告的TEAE是高磷酸盐血症(68.5%)、腹泻(57.9%)、口腔炎(52.8%)、口干(48.3%)、皮肤干燥(33.7%)、掌跖红细胞感觉异常综合征(32.0%)和便秘(30.3%)(表21);大多数TEAE的严重程度为1级或2级。3级或更高级(≥5%)的TEAE为口腔炎(9.0%)、贫血(7.9%)、丙氨酸转氨酶增加(5.1%)、掌跖红细胞感觉异常综合征(6.2%)和高磷酸盐血症(5.6%)。6名患者报告了腹痛和发热的严重不良事件(各3.4%);5名患者(2.8%)报告了一般身体健康状况恶化,4名患者(2.2%)报告了腹泻和肺炎;其他严重不良事件各发生在≤3名患者中。 /> /> /> BPC中96.1%的受试者报告了药物相关的TEAE。BPC中最频繁报告的药物相关TEAE(>30%)是高磷酸盐血症(68.5%)、口腔炎(52.2%)、腹泻(48.9%)、口干(46.6%)、皮肤干燥(32.6%)和掌跖红细胞感觉异常综合征(32.0%)。大多数药物相关TEAE的严重程度为1、2或3级,除了在疾病进展的情况下,1名受试者出现皮肤钙化和钙化防御的4级TEAE,以及1名受试者出现肺栓塞的5级TEAE。 BPC中26名受试者(14.6%)报告了特别感兴趣的TEAE,即中心性浆液性视网膜病变(CSR)。对于BPC中的受试者最频繁报告的CSR的优选术语是脉络膜视网膜病变(4.5%)、视网膜色素上皮脱离(3.9%)、视网膜脱离(3.4%)和视网膜下液(1.7%);其他优选术语出现在1或2名受试者中。对于BPC中的受试者,所有CSR事件均为1级或2级,并且没有一个是严重的TEAE。CSR导致BPC中17名(9.6%)受试者的剂量减少,并且导致BPC中14名(7.9%)受试者的剂量中断;然而,BPC中没有受试者因CSR而中断。 对于BPC中的患者,TEAE导致74.7%的患者剂量中断。最常见(≥5%)报告的导致给药中断的TEAE是口腔炎(17.4%)、掌跖红细胞感觉异常综合征(14.0%)以及腹泻、甲沟炎和高磷酸盐血症(各自在6.7%的患者中报告)。治疗期间出现的不良事件导致23名(12.9%)患者的治疗中断,3名(1.7%)患者因掌跖红细胞感觉异常综合征的TEAE和一般身体健康状况恶化而中断,而导致治疗中断的其他TEAE分别发生在≤2名患者中。治疗期间出现的不良事件导致61.2%的患者剂量减少;最常见的事件是口腔炎(13.5%)、掌跖红细胞感觉异常综合征(9.0%)、甲剥离(8.4%)、腹泻(7.3%)、高磷酸盐血症(5.6%)、甲沟炎(5.1%)、脉络膜视网膜病变、疲劳、丙氨酸转氨酶增加(各4.5%)和口干(3.9%),而导致剂量减少的其他TEAE发生在≤5名患者中。 概述 来自具有178名患者的IA3群体的数据表明,在已用尽标准护理选项的患有晚期/转移性实体瘤的患者中,在具有FGFR改变的15种肿瘤类型中由IRC观察到的有效ORR为29.2%(CI 95%CI;22.7%,36.5%),并且中值DOR为6.90个月(CI 95%CI;4.37、7.95)。IA3的稳健样品大小提供了ORR和DOR的点估计的置信度,其即使在置信区间下限分别为22.7%和4.37个月的情况下也具有临床意义。根据IRC,具有临床意义的DCR为72.5%并且CBR为46.1%,进一步支持了相同患者群体中的临床益处,其中安全数据与厄达替尼的已知安全性一致,并且总体风险-益处比良好。 总体结论 来自RAGNAR研究中的分子筛选的发现表明,通过采用组织学-组织学-不可知论设计并使用中心测试和当地测试报告进行分子资格筛选,临床试验对于罕见基因改变的患者是可行的。这种方法有助于研究具有FGFR改变的罕见肿瘤,组织学特异性试验对其具有挑战性。在临床环境中,在基因组数据库中不存在FGFR改变的肿瘤类型中观察到FGFR改变。来自RAGNAR研究的结果将有助于确定厄达替尼对患有FGFR改变的晚期实体瘤的患者的益处,这些患者的治疗选择有限。 对于患有具有FGFR突变和融合的晚期实体瘤的患者,这些晚期实体瘤在至少一个系统治疗线时或之后进展,并且对于这些患者没有进一步可用的具有确定的临床益处的治疗或不能耐受标准治疗,没有可用的具有确定的临床益处的治疗。因此,支持性护理是临床上唯一接受的治疗选择,使这些患者的需求显著未得到满足。此外,无论潜在肿瘤类型如何,目前还没有批准用于FGFR改变的实体瘤的FGFR抑制剂。在这种预后特别差的大量预治疗的患者群体中,本文所述的初步临床证据显示出对不同肿瘤类型和广谱FGFR改变(特别是FGFR 1-3突变和融合)的持久反应,包括成年人和青少年中的CCA、胰腺癌、HGG、LGG、NSCLC、乳腺癌、子宫内膜癌和罕见癌症。在FGFR突变和融合中观察到相似的反应频率。临床活性的这种初步客观证据表明,FGFR阳性、肿瘤不可知的患者群体出现了实质和持久的临床改善,这些患者群体在至少一个既往系统治疗线时或之后出现进展,没有进一步可用的有效治疗选择。这些数据支持初步临床证据,即厄达替尼可以为疾病负担高且医疗需求显著未满足的患者群体提供优于现有疗法的实质性改善。 本文描述的实施例和实施方案仅用于例示目的,并且将向本领域的技术人员建议考虑到各种修改或变化,这些修改或变化包括在本申请的实质和范围以及所附权利要求书的范围内。
