一种KDR-CAR-NK细胞的制备方法及其应用
文献发布时间:2023-06-19 11:34:14
技术领域
本发明属于生物技术领域。具体地,属于肿瘤细胞免疫治疗技术领域,尤其涉及一种KDR-CAR-NK细胞的制备方法及其应用。
背景技术
恶性肿瘤是严重威胁人类生命健康的多基因异常、多步骤发生、异质性演进疾病,人类免疫系统在预防癌症的形成和进展方面起着至关重要的作用。肿瘤在体内的发生、发展与机体免疫功能紊乱有关,同时肿瘤细胞也可以通过分泌细胞因子而引起机体免疫抑制。近年来,以激活人体自身免疫系统对抗恶性肿瘤为主要治疗手段的肿瘤免疫疗法已在多种肿瘤如血液系统肿瘤、黑色素瘤、非小细胞肺癌、肾癌和前列腺癌等恶性肿瘤的治疗中展示出了强大的抗肿瘤活性。肿瘤免疫治疗由于其卓越的疗效和创新性,已逐渐成为继手术、放疗和化疗后的第四类肿瘤治疗方法。
其中,利用嵌合抗原受体(chimeric antigen receptors,CAR)修饰来显著增强免疫效应细胞的抗肿瘤活性已成为肿瘤过继性免疫细胞疗法的优选方案。CAR是一种融合分子,其包含的肿瘤抗原结合结构域可以特异性识别肿瘤细胞的表面受体。CAR主要由胞外抗原结合部分、铰链、跨膜段及胞内信号段组成。跨膜段可以是CD4、CD8、CD28、CD3ζ,也可以是CD4、CD8、CD28、CD3ζ、FcεRIγ的单链或者二聚体。随着重组DNA技术的不断发展以及对信号传导通路研究的不断深入,CAR分子的信号域也从刚开始第一代的单一靶向信号发展为包含CD28、CD137(4-1BB)、CD134(OX40)和ICOS等共刺激分子的多信号区域的二代、三代。
第一代的CAR主要是CD3ζ,抗肿瘤时间短暂。第二代引入一个共刺激分子(CD28、4-1BB等),临床试验表现出更好的体内扩增能力及抗肿瘤能力。第三代CAR加入两个或以上的共刺激分子,临床试验发现其抗肿瘤效果大大増加,但同时毒副作用也显著增强。因此,综合疗效与副作用,二代CAR具有明显优势,CAR修饰的T淋巴细胞在肿瘤过继性细胞免疫疗法中已取得了令人瞩目的突破性进展。但是,由于主要组织相容复合体-I(majorhistocompatibility complex class I,MHC-1)分子的限制,CAR-T技术需要自体细胞移植,收集患者T细胞并修改基因的过程既耗时又低效,细胞来源受限,临床还发现,并不是所有的病人都能获得大量的功能性T细胞来满足治疗条件。因而亟需新的肿瘤杀伤性免疫细胞来源,作为一种更直接的免疫治疗方法。
自然杀伤细胞(natural killer,NK细胞)是另一种重要的免疫效应细胞,具有杀死肿瘤细胞和病毒感染细胞的强大能力,而且NK细胞的激活不需要HLA的匹配来介导,在临床试验中,自体和同种异体NK细胞的移植都已经被证实是安全的。在过去的十年中,已经进行了多个基于NK细胞免疫疗法的试验探索,涉及到的NK细胞来源包括外周血、脐带血和NK-92细胞系。在已进行的研究中还发现,同种异体NK细胞移植后,几乎没有发现它们具有诱导移植物抗宿主病(Graft Versus Host Disease,GVHD)、细胞因子释放综合征(CytokineRelease Syndrome,CRS)或神经毒性等毒副作用,因此,CAR修饰NK细胞治疗实体瘤可能是一种更可行和更安全、有效的肿瘤免疫细胞疗法。目前临床研究运用的NK细胞株主要是NK-92细胞。NK-92对肿瘤细胞具有强烈的细胞毒性,研究发现其具有抗白血病,淋巴瘤,黑素瘤,前列腺癌和乳腺癌的作用。NK-92细胞缺乏抑制性KIRs的表达,其通过穿孔素和颗粒酶的活性介导抗肿瘤作用。除此之外,NK-92细胞也是美国FDA(Food and DrugAdministration)批准用于试验的唯一NK细胞系。与CAR-T细胞一样,对NK-92细胞进行基因工程改造,使其表达特定的受体,也可靶向杀死肿瘤细胞。CAR修饰赋予NK细胞特定抗原的受体,允许NK细胞靶向攻击潜在的任何肿瘤,靶向性、杀伤性和活力都相对较高,同时还能打破肿瘤病灶部位微环境的免疫抑制以及缓解宿主的免疫耐受。CAR修饰的NK-92细胞有望成为同种异体细胞过继性免疫治疗的优秀效应细胞。
发明内容
针对现有技术普遍存在的缺陷,本发明创造性地提供了一种构建KDR-CAR-NK细胞的制备方法。提高了NK细胞的靶向性、杀伤性和活力,使NK细胞可以打破肿瘤病灶部位微环境的免疫抑制以及缓解宿主的免疫耐受,实现了对同种异体细胞过继性免疫治疗方面的新突破。
为了实现上述目的,本发明采用的技术方案为:
一种KDR-CAR-NK细胞的制备方法,包括如下步骤:
S1、KDR-CAR序列的构建:分别将CD8α、共刺激分子CD28胞内区和CD3ζ胞内信号传导结构域基因序列依次串联拼接进行全基因合成,两端预留限制性内切酶位点Xhol I和BamH I,利用T4连接酶连接带有相应酶切位点的VEGF165基因,制得KDR-CAR序列;
S2、构建KDR-CAR序列载体:将步骤S1制得的KDR-CAR序列克隆到慢病毒载体pcDNA3.1-EGFP上,得重组质粒KDR-CAR序列载体KDR-CAR/pcDNA3.1-EGFP;
S3、构建KDR-CAR-NK细胞:以Opti-MEM作为转染试剂,将步骤S2得到的KDR-CAR序列载体KDR-CAR/pcDNA3.1-EGFP电穿孔转染至NK细胞,利用荧光检测筛选荧光蛋白阳性的细胞,即得。
优选的,所述步骤S1中的VEGF165基因的序列信息如SEQ ID NO.1所示。
AACTTTCTGCTGTCTTGGGTGCATTGGAGCCTTGCCTTGCTGCTCTACCTCCACCATGCCAAGTGGTCCCAGGCTGCACCCATGGCAGAAGGAGGAGGGCAGAATCATCACGAAGTGGTGAAGTTCATGGATGTCTATCAGCGCAGCTACTGCCATCCAATCGAGACCCTGGTGGACATCTTCCAGGAGTACCCTGATGAGATCGAGTACATCTTCAAGCCATCCTGTGTGCCCCTGATGCGATGCGGGGGCTGCTGCAATGACGAGGGCCTGGAGTGTGTGCCCACTGAGGAGTCCAACATCACCATGCAGATTATGCGGATCAAACCTCACCAAGGCCAGCACATAGGAGAGATGAGCTTCCTACAGCACAACAAATGTGAATGCAGACCAAAGAAAGATAGAGCAAGACAAGAAAAAAAATCAGTTCGAGGAAAGGGAAAGGGGCAAAAACGAAAGCGCAAGAAATCCCGGTATAAGTCCTGGAGCGTATGTGACAAGCCGAGGCGG(SEQ ID NO.1);
优选的,所述步骤S1中CD8α的序列如SEQ ID NO.2所示,所述CD28的序列如SEQ IDNO.3所示,CD3ζ的序列如SEQ ID NO.4所示。
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT(SEQ IDNO.2)
TTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTGAGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC(SEQ ID NO.3);
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGCAGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAAGGATCCCCC(SEQ ID NO.4);
优选的,所述步骤S1中利用PCR技术扩增目的基因VEGF165片段和KDR-CAR片段,扩增VEGF165序列的引物为Primer-VEGF165,上游引物序列信息如SEQ ID NO.5所示,下游引物序列信息如SEQ ID NO.6所示;
5'-ATTGCTAGCAAGAGAGCACCCATGGCAGAAGGAG-3'(SEQ ID NO.5)
5'-GTACTCGAGCCGCCTCGGCTTGTCACATTTTTA-3'(SEQ ID NO.6);
扩增KDR-CAR的引物为Primer-KDR-CAR,上游引物序列信息如SEQ ID NO7所示,下游引物序列信息如SEQ ID NO.8所示。
5'-ATTGCTAGCAAGAGAGCACCCATGGCAGAAGGAG-3'(SEQ ID NO.7);
5'-GTAGAATTCCTCTAGAGCATGCTTAGCGAGGGG-3'(SEQ ID NO.8);
优选的,所述步骤S2中在KDR-CAR序列的两端加入酶切位点粘性末端克隆进入慢病毒载体pcDNA3.1-EGFP载体中,前段粘性末端为Nhe I酶的酶切位点,末端粘性末端为BamH I酶的酶切位点。
优选的,所述步骤S3中电穿孔转染NK细胞为NK-92细胞。
优选的,所述步骤S3中利用荧光检测筛选荧光蛋白阳性的细胞的检测过程为:
(1)收集转染后的NK-92细胞悬液于15mL离心管中,1200rpm离心5min,弃掉上清;
(2)加入1mL opti-MEM缓冲液重悬细胞,离心去除上清,重复2-3次;
(3)加50μL opti-MEM缓冲液重悬细胞后,计数,使NK-92细胞量为1×10
(4)电转结束后将电转杯中的溶液转移至6孔板中,补加完全培养基1mL,置于5%CO
本发明的电转试验是将50μL细胞(至少1×10
优选的,所述步骤(3)中电转前需要在150.0v,5ms条件测试电阻,电阻范围为0.040~0.060Ω。
优选的,所述步骤(4)中加入浓度为600ng/μL的KDR-CAR序列载体3μL在荧光倒置显微镜下观察细胞EGFP的表达。
本发明还提供了一种使用上述备方法得到的表达KDR靶向性抗原受体修饰的NK细胞在过继免疫治疗方向上的应用。
本发明中,所述的荧光检测是是利用的质粒载体本身带有荧光标记物EGFP;电转的时候与细胞一同加入,加入的物质是质粒和细胞,质粒载体带有荧光标记物,通过荧光标记物可以观察质粒是否导入成功.加入质粒的量为3μL,质粒浓度为600ng/μL。
本发明相比现有技术的优点在于:本发明对NK-92细胞进行基因工程修饰,赋予NK细胞特定抗原的受体,提高了NK细胞的靶向性、杀伤性和活力,使NK细胞可以打破肿瘤病灶部位微环境的免疫抑制以及缓解宿主的免疫耐受,允许NK细胞靶向攻击潜在的任何肿瘤,实现了对同种异体细胞过继性免疫治疗方面的新突破。
附图说明
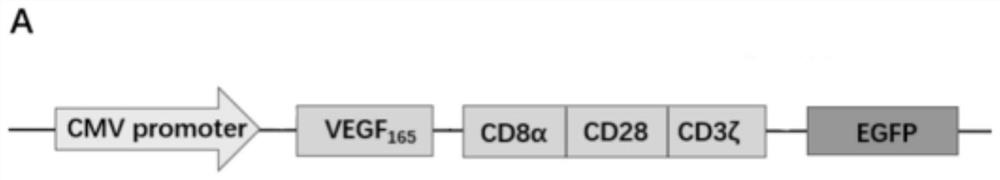
图1是实施例中KDR-CAR结构示意图;
图2是实施例中扩增结果检测图;
图3是实施例中KDR-CAR/pcDNA3.1-EGFP质粒载体的载体图谱;
图4是实施例中KDR-CAR转染的NK-92细胞图;
图5、图6是实施例中肿瘤细胞共孵育后流式检测肿瘤细胞的凋亡图;
图7、图8是实施例中与肿瘤细胞共孵育后流式检测细胞因子IFN-γ和Granzyme B的表达图。
具体实施方式
下面结合具体实施例对本发明做进一步解释,但是应当注意的是,一下实施例仅用以解释本发明,而不能用来限制本发明,所有与本发明相同或相近的技术方案均在本发明的保护范围之内。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料为市售商品。
本发明在进行PCR串联连接时,先确定CD8α(铰链区+跨膜区)、共刺激分子CD28胞内区和CD3ζ胞内信号传导结构域基因序列,依次串联拼接,此部分委托生工生物工程(上海)股份有限公司全基因合成获得,两端预留限制性内切酶位点Xhol I和BamH I,以便于与本实验室保存人靶向基因片段VEGF 165连接,串联形成KDR-CAR。然后将KDR-CAR片段克隆到慢病毒载体pcDNA3.1-EGFP上,得到慢病毒载体KDR-CAR/pcDNA3.1-EGFP。
所述CD8α-CD28-CD3ζ全基因合成片段委托生工生物工程(上海)股份有限公司合成;
所述VEGF165基因委托生工生物工程(上海)股份有限公司合成;
所述限制性内切酶可购买自宝生物工程(大连)有限公司;
所述连接酶可购买自宝生物工程(大连)有限公司;
所述pcDNA3.1-EGFP载体可购自安徽通用生物有限公司;
所述opti-MEM缓冲液可购自Gibco公司;
所述BSA可购买自Labgic,完全培养基配方为1640完全培养基,由90%1640基础培养基和10%胎牛血清(PBS)组成,可购自Gibco公司提供,货号分别为:C11875500BT(500mL)、A31608-02(500mL);
所述配置的细胞破膜剂配方为1mL 10%BSA加入3μL TritonX-100(TritonX-100购自Biosharp);
所述PBS可购买自Gibco公司货号为A31608-02(500mL)、多聚甲醛可购买自塞维尔;
所述实验所使用的未转染的NK-92细胞可购买自中国典型培养物保藏中心、肺癌细胞(A549)可购买自中国科学院细胞库;
所述流式细胞仪厂家和型号为贝克曼库尔特(型号:Navios)。
实施例1一种KDR-CAR-NK细胞的制备方法
所述KDR-CAR-NK细胞的制备方法,包括以下步骤:
S1、KDR-CAR序列的构建:分别将CD8α、共刺激分子CD28胞内区和CD3ζ胞内信号传导结构域基因序列依次串联拼接进行全基因合成,两端预留限制性内切酶位点Xhol I和BamH I,利用T4连接酶连接带有相应酶切位点的VEGF165基因,制得KDR-CAR序列;图2为扩增结果检测图,其中,泳道1为VEGF165基因PCR扩增产物,泳道2为marker泳道,泳道3为全基因合成CD8α-CD28-CD3ζ片段扩增产物;
所述VEGF165基因的序列信息如SEQ ID NO.1所示;所述CD8α的序列如SEQ IDNO.2所示,所述CD28的序列如SEQ ID NO.3所示,CD3ζ的序列如SEQ ID NO.4所示;
所述利用PCR技术扩增目的基因VEGF165片段和KDR-CAR片段,扩增VEGF165序列的引物为Primer-VEGF165,上游引物序列信息如SEQ ID NO.5所示,下游引物序列信息如SEQID NO.6所示;扩增KDR-CAR的引物为Primer-KDR-CAR,上游引物序列信息如SEQ ID NO7所示,下游引物序列信息如SEQ ID NO.8所示;所述PCR反应体系如下表1所述:
表1 PCR反应体系
PCR反应程序如下:
S2、构建KDR-CAR序列载体:将步骤S1制得的KDR-CAR序列克隆到慢病毒载体pcDNA3.1-EGFP上,得重组质粒KDR-CAR序列载体KDR-CAR/pcDNA3.1-EGFP;
所述在KDR-CAR序列的两端加入酶切位点粘性末端克隆进入慢病毒载体pcDNA3.1-EGFP载体中,前段粘性末端为Nhe I酶的酶切位点,末端粘性末端为BamH I酶的酶切位点;
S3、构建KDR-CAR-NK细胞:以Opti-MEM作为转染试剂,将步骤S2得到的KDR-CAR序列载体KDR-CAR/pcDNA3.1-EGFP电穿孔转染至NK细胞,利用荧光检测筛选荧光蛋白阳性的细胞,即得;
所述电穿孔转染NK细胞为NK-92细胞;
所述利用荧光检测筛选荧光蛋白阳性的细胞的检测过程为:
(1)收集转染后的NK-92细胞悬液于15mL离心管中,1200rpm离心5min,弃掉上清;
(2)加入1mL opti-MEM缓冲液重悬细胞,离心去除上清,重复2-3次;
(3)加50μL opti-MEM缓冲液重悬细胞后,计数,使NK-92细胞量为1×10
(4)电转结束后将电转杯中的溶液转移至6孔板中,补加完全培养基1mL,置于5%CO
所述步骤(3)中电转前需要在150.0v,5ms条件测试电阻,电阻范围为0.040~0.060Ω。
所述步骤(4)中加入浓度为600ng/μL的KDR-CAR序列载体3μL在荧光倒置显微镜下观察细胞EGFP的表达,利用荧光检测筛选荧光蛋白阳性的细胞,即得。
实验一细胞杀伤实验效果评估
(1)将未转染的NK细胞、KDR-CAR-NK细胞与肺癌细胞(A549)按效应细胞与靶细胞2:1和5:1的比例混合培养72小时,用流式细胞仪检测细胞因子IFN-γ和Granzyme B的表达;
(2)收集靶细胞(A549)于15mL离心管中,1200rpm离心5min,弃掉上清;
(3)1mL完全培养基重悬细胞,每孔1×10
(4)分别将2×10
(5)收集共培养中的KDR-CAR-NK细胞,加入1mL PBS重悬,弃掉上清液,重复两次;
(6)加500μL多聚甲醛固定30min;
(7)加500μL BSA配置的细胞破膜剂,静置1h;
(8)加入(IFN-γ/Granzyme B抗体,避光孵育后上机检测;
(9)细胞杀伤作用效果评估
未转染的细胞与靶细胞共孵育时,未检测到相应细胞因子的分泌;但是目的细胞与靶细胞孵育后检测到颗粒酶B与干扰素r的分泌明显增多,同时肿瘤细胞与靶细胞孵育后检测到肿瘤细胞凋亡,图5、图6是实施例中肿瘤细胞共孵育后流式检测肿瘤细胞的凋亡图,图7、图8是实施例中与肿瘤细胞共孵育后流式检测细胞因子IFN-γ和Granzyme B的表达图,说明KDR-CAR-NK靶细胞对目的细胞、肿瘤细胞具有杀伤作用。
最后应当说明的是,上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110> 广东药科大学
<120> 一种KDR-CAR-NK细胞的制备方法及其应用
<130> 2021.2.24
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 510
<212> DNA
<213> VEGF165基因序列(VEGF165 gene sequence)
<400> 1
aactttctgc tgtcttgggt gcattggagc cttgccttgc tgctctacct ccaccatgcc 60
aagtggtccc aggctgcacc catggcagaa ggaggagggc agaatcatca cgaagtggtg 120
aagttcatgg atgtctatca gcgcagctac tgccatccaa tcgagaccct ggtggacatc 180
ttccaggagt accctgatga gatcgagtac atcttcaagc catcctgtgt gcccctgatg 240
cgatgcgggg gctgctgcaa tgacgagggc ctggagtgtg tgcccactga ggagtccaac 300
atcaccatgc agattatgcg gatcaaacct caccaaggcc agcacatagg agagatgagc 360
ttcctacagc acaacaaatg tgaatgcaga ccaaagaaag atagagcaag acaagaaaaa 420
aaatcagttc gaggaaaggg aaaggggcaa aaacgaaagc gcaagaaatc ccggtataag 480
tcctggagcg tatgtgacaa gccgaggcgg 510
<210> 2
<211> 135
<212> DNA
<213> CD8α基因序列(CD8α gene sequence)
<400> 2
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 3
<211> 204
<212> DNA
<213> CD28基因序列(CD8α gene sequence)
<400> 3
ttttgggtgc tggtggtggt tggtggagtc ctggcttgct atagcttgct agtaacagtg 60
gcctttatta ttttctgggt gaggagtaag aggagcaggc tcctgcacag tgactacatg 120
aacatgactc cccgccgccc cgggcccacc cgcaagcatt accagcccta tgccccacca 180
cgcgacttcg cagcctatcg ctcc 204
<210> 4
<211> 351
<212> DNA
<213> CD3ζ基因序列(CD3ζ gene sequence)
<400> 4
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgcag agaaggaaga accctcagga aggcctgtac 180
aatgaactgc agaaagataa gatggcggag gcctacagtg agattgggat gaaaggcgag 240
cgccggaggg gcaaggggca cgatggcctt taccagggtc tcagtacagc caccaaggac 300
acctacgacg cccttcacat gcaggccctg ccccctcgct aaggatcccc c 351
<210> 5
<211> 34
<212> DNA
<213> Primer-VEGF165-F
<400> 5
attgctagca agagagcacc catggcagaa ggag 34
<210> 6
<211> 33
<212> DNA
<213> Primer-VEGF165-R
<400> 6
gtactcgagc cgcctcggct tgtcacattt tta 33
<210> 7
<211> 34
<212> DNA
<213> Primer-KDR-CAR-F
<400> 7
attgctagca agagagcacc catggcagaa ggag 34
<210> 8
<211> 33
<212> DNA
<213> Primer-KDR-CAR-R
<400> 8
gtagaattcc tctagagcat gcttagcgag ggg 33
- 一种KDR-CAR-NK细胞的制备方法及其应用
- 一种纯化子宫腔上皮细胞、腺上皮细胞和基质细胞的制备方法及其应用
