一种采集器官捐献供体血液的方法
文献发布时间:2023-06-19 13:48:08
技术领域
本发明具体涉及一种采集器官捐献供体血液的方法。
背景技术
由于无偿献血的公民减少,各地的医疗机构都面临着血液供应危机的严峻挑战,又因为接受肝移植手术的患者皆为终末期肝病患者,其凝血功能较差,并且手术复杂,往往需要充足的血液供应作为保障,否则患者将面临较大的风险。因此,为了避免本已稀缺的器官资源浪费,探索出一种能够缓解血液供应危机的方法势在必行。
目前,由于获取器官捐献供体肝肾器官时,缺乏一套规范采集器官捐献 供体血液回收利用技术,导致了宝贵血液资源的浪费,也使器官捐献受体面 临无充足,安全血液补给的风险,最终影响受体患者的存活率。
发明内容
为解决上述问题,本发明提供了一种采集器官捐献供体血液的方法,它 是在获取脑死亡和/或心脏死亡的器官捐献供体的器官时采集血液,具体包括 如下步骤:
1)取灌注管置入器官捐献供体的腹主动脉和门静脉,再沿腹主动脉上的 置管平面另置入灌注管至下腔静脉,最后将各灌注管与自体血回收机连接;
2)取抗凝剂冲洗步骤1)所述自体血回收机的储血罐和管道,再采集供 体血液至供体出现血流动力学不稳定或者血氧饱和度下降;
3)取步骤2)所得血液,离心,洗涤,再于血液保存液III中保存。
进一步地,步骤2)所述冲洗时抗凝剂的用量为500~1000ml,优选500ml。
进一步地,所述抗凝剂为含肝素的生理盐水;所述含肝素的生理盐水浓 度为25000U肝素/500ml生理盐水。
进一步地,步骤3)所述离心是用自体血回收机离心,速度5600rpm, 离心至游离血红蛋白、白细胞、血浆、血小板、抗凝液被除去。
进一步地,步骤3)所述洗涤是用林格氏液洗涤;所述林格氏液与离心 完的红细胞的体积比为3~5:1,优选4:1。
进一步地,步骤3)所述保存的温度为2~8℃,优选4℃,保存期间每 30分钟摇晃一次。
进一步地,所述采集器官捐献供体血液时收缩压维持在70mmhg以上。
更进一步地,所述器官捐献供体捐献的是肝脏和/或肾脏。
本发明还提供了一种同时获取脑死亡和/或心脏死亡的器官捐献供体血 液和器官的方法,它包括如下步骤:
a、按前述方法采集供体血液;
b、在采集供体血液至供体出现血流动力学不稳定或者血氧饱和度下降 时,立即冷灌注,并在肝周、腹腔、右胸腔内放入碎冰;
c、冷灌注至灌洗液清亮,获取器官。
进一步地,所述冷灌注是近右心房剪断肝上下腔静脉,再分别经腹主动 脉和门静脉灌注管灌注2~8℃HTK液,优选4℃HTK液;所述HTK液的灌 注压力为80~120mmHg,优选100mmHg。
本发明采集器官捐献供体血液的方法,在保证移植器官功能不受影响的 情况下,通过自体血回收机安全完成供体红细胞悬液的采集,将得到的供体 红细胞悬液输注给受体,即采用供体特异性红细胞输血(Donor-specific Red Blood Cell Transfusion,DRBCST)。在紧急情况,DRBCT能够起到部分替代 异基因红细胞悬液的作用,并且由于大多数接受肝移植患者都符合输血原则, 这样也能够有效避免输血并发症的发生。因此,将DRBCT应用于DDLT, 能够保证在血液供应不足情况下肝移植和/或肾脏移植手术能够正常开展,避 免发生因血液供应不足而丢弃供肝或供肾。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段, 在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、 替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步 的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。 凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
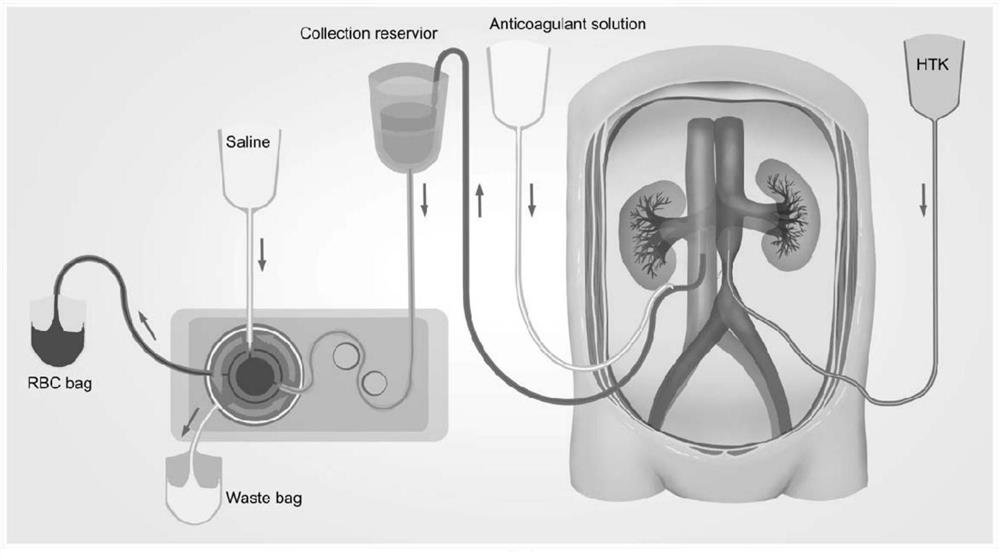
图1肝脏获取过程中的血液采集模式图
具体实施方式
实施例1本发明采集器官捐献供体血液
1)取灌注管分别置入捐献器官的脑死亡患者的腹主动脉和门静脉,再沿 腹主动脉的置管平面另置入灌注管至下腔静脉,最后将各灌注管与自体血回 收机连接;
2)取抗凝剂25000U肝素/500ml生理盐水,冲洗步骤1)所述自体血回 收机的储血罐和管道,再采集供体血液至供体出现血流动力学不稳定或者血 氧饱和度下降(采血时收缩压维持在70mmhg以上);
3)完成血液采集后,利用自体血回收机离心,速度5600rpm离心,去 除游离的血红蛋白、白细胞、血浆、血小板、抗凝液后,将红细胞每250ml 用1000ml林格氏液进行洗涤,最后将得到的红细胞转移至血液保存液III中 保存于4℃环境,每30分钟摇晃一次。
以下通过试验例来说明本发明的有益效果。
试验例1本发明供体血液采集、处理、保存过程研究
一、研究方法
通过比较同一时期术中接受DRBCT(供体特异性红细胞输血)或仅接 受异基因输血(血库库存血)的肝移植受体的短期临床结果来评估DRBCT 应用于DDLT(公民逝世后器官捐献肝移植)的安全性和有效性。本项研究 获得四川大学华西医院伦理委员会批准,并在中国临床实验中心注册 (ChiCTR2000041375),符合《赫尔辛基宣言》中的伦理准则。本研究均获 得每位器官捐献者家属和受体的书面知情同意书。
1、供体纳入标准:
所有器官捐献者均被定义为中国I类供体。对于所有捐献者均完成其社 会史以及医疗史筛查,具体包括居住史、旅行史、冶游史、环境暴露史、既 往感染史以及药物滥用史等。在供肝获取之前,我们还针对供体血液标本、 尿液标本、痰液标本完成细菌、真菌培养以及采集供体血液标本进行宏基因 二代测序(Metagenomic next-generationsequencing,mNGS)以检测任何潜 在的感染。除此之外,我们还进行了巨细胞病毒(Cytomegalovirus,CMV)、 乙型肝炎病毒(Hepatitis B virus,HBV)、丙型肝炎病毒(Hepatitis C virus, HCV)、梅毒、人类免疫缺陷病毒(human immunodeficiency virus,HIV) 血清学抗体检测和CMV、HBV、HCV、HIV的核酸分子检测。在符合以下 标准的器官捐献者进行血液采集:
①COVID-19核酸检测以及抗体检测阴性。
②捐献者年龄大于18岁。
③供体家属同意血液捐献。
④捐献者只进行肝脏和肾脏捐献。
⑤捐献者血液培养结果为阴性。
⑥捐献者痰培养阴性或者供体痰培养阳性但是临床表现、实验室检查、 影像学检查均无感染存在的证据(阳性菌为多重耐药菌除外)。
⑦捐献者CMV-DNA结果为阴性。
⑧捐献无输血传播的感染,包括HIV、HBV、HCV和梅毒感染。
⑨供体血液标本的mNGS检查未发现细菌、真菌、病毒、寄生虫的感染。
⑩捐献者重症监护病房(Intensive care unit,ICU)住院时长不超过7天。
2、受体纳入排除标准
疫情期间于四川大学华西医院接受DDLT的所有成年患者纳入此项研 究,但是排除接受非常规肝移植的受体,包括ABO血型不合肝移植、再次 肝移植、劈离式肝移植、多器官联合移植等。除此之外,术前1周内存在感 染迹象的受体也被排除在本研究之外。
3、DRBCT进行标准
供受体在符合以上纳入排除标准情况下,满足如下要求则进行 DRBCT:
①血库血液资源紧张。
②供体受体血液交叉配型试验阴性。
③根据指南规定,基于供受体的CMV血清学状态(D/R),受体为CMV 感染的低风险(D-/R-)或中风险(D±/R+)。
④受体术中血红蛋白低于70g/L或术中大量出血超过1000ml或术中出现 由于出血引起的血流动力学不稳定。
4、供体血液采集、处理、保存过程
本发明所有血液采集是在器官获取时进行。如图1所示,首先将器官捐 献者取仰卧位,消毒铺巾,监测血压、心率、呼吸;腹部行大“十字”切口, 靠近髂总动脉分叉处结扎腹主动脉远端,髂总动脉分叉处上方约2cm腹主动 脉近端安置灌注管;寻找肠系膜上静脉主干,并远端结扎,近端剪开插入门 静脉灌注管,完成腹主动脉以及门静脉灌注管置入。然后于腹主动脉置管平 面进行下腔静脉置管,再与自体血回收机(P3000,北京京精医疗设备有限 公司)相连接,快速地采集供体血液。在血液采集之前用抗凝剂(25000U肝 素/500ml生理盐水)对储血罐以及管道进行预冲洗500ml。整个采集过程持 续到供体出现血流动力学不稳定或者血氧饱和度下降,然后立刻进入冷灌注 流程(即近右心房水平剪断肝上下腔静脉,经腹主动脉及门静脉灌注管行4℃ HTK液灌注。快速在肝周围、腹腔、右胸腔内放入碎冰,使肝脏快速降温。 根据经验,HTK灌注液的灌洗压力为100mmHg。流出的灌洗液清亮后或者 经腹主动脉灌洗2 000ml HTK液,经门静脉灌注1 000ml的HTK液后停止灌 注)。冷灌注是保证器官移植后移植器官功能恢复的关键,保证移植器官功能 不受影响的情况下,安全采集供体血液,在采集过程中需要密切监测血压及 血氧饱和度,防止供体出现低血压以及重要器官灌注不足,必要时将采取补 液等维护措施,但是禁止增大升压药使用剂量。我们尽可能地在3分钟之内 完成血液采集,且维持供体收缩压在70mmhg以上。
完成血液采集后,利用自体血回收系统进行5600rpm离心,尽可能地去 除游离的血红蛋白、白细胞、血浆、血小板、抗凝液等物质。将离心完的红 细胞每250ml用1000ml林格氏液进行洗涤。最后将得到的红细胞转移至血 液保存液III中保存于4℃环境,每30分钟摇晃一次。
在受体术中如果存在输血指征则进行供体特异性红细胞输血DRBCT, 且利用白细胞过滤器(FTS-RC102,南京双威生物医学科技有限公司)对血 液中的白细胞和杂质等进行进一步的过滤。
5、交叉配血试验步骤
①取两支干净试管,分为主侧管和次侧管。然后准备凝聚胺介质试剂(珠 海贝索生物技术有限公司)。
②将患者的2滴血浆以及捐献者的1滴3%-5%红细胞悬液加入主侧管 中;将捐献者的2滴血浆以及患者的1滴3%-5%红细胞悬液加入次侧管中。
③分别向主侧管和次侧管内加入0.65ml低离子溶液(Low ionic medium),摇晃试管使其混合均匀。
④分别向主侧管和次侧管内加入2滴凝聚胺溶液(Polybrene reagent), 摇晃试管使其混合均匀。
⑤使用离心机进行3400rpm离心10秒钟后去掉上清液。
⑥轻轻摇晃主侧管和次侧管,观察红细胞有无凝集。如果没有出现凝集 反应则重复上述步骤。
⑦分别向主侧管和次侧管内加入2滴悬浮液(Resuspending),摇晃试管 使其混合均匀。如果60秒内凝集散开,则说明凝集是由凝聚胺溶液引起的, 配血结果为相合。如果60秒内凝集不散开,说明凝集是由红细胞抗原抗体特 异性结合所引起的,配血结果为不相合。如果结果可疑,需要在显微镜下进 一步进行观察。主侧管和次侧管的结果均为相合才能进行DRBCT。
6、经自体血回收机处理后血液质量分析
每次完成供体血液采集、离心、洗涤等操作后,抽取2ml供体血液通过 血气分析仪(cobas b 123全自动血气分析仪,罗氏公司)进行血液质量分析。 后又随机对100袋库存异基因红细胞悬液进行血气分析。并对两组血液的PH 值、钾离子浓度、钠离子浓度、氯离子浓度、乳酸含量进行比较分析,以评 估自体血回收机处理后血液的质量。
7、观察结局
所有患者均接受至少30天的术后随访。
主要终点是移植术后30天内感染并发症的发生。对两组中任何感染(细 菌、真菌和病毒)的发生、严重程度和时间进行详细记录。感染是根据美国 移植学会所提出的标准来进行定义。
次要终点包括其他输血相关并发症、30天患者生存率和移植物生存 率、术后总胆红素(Total bilirubin,TB)、术后谷氨酸-丙酮酸转氨酶 (Alanine aminotransferase,ALT)、术后碱性磷酸酶(Alkaline phosphatase, ALP)、术后天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、 术后谷氨酰转移酶(Gamma-glutamyltransferase,GGT)、术后乳酸脱氢酶 (Lactic dehydrogenase,LDH)、术后国际标准化比值(International normalized ratio,INR)、术后肌酐(Creatinine,CREA)和受者术后t淋巴细胞亚群的变化。对于输血相关并发症的定义在相关综述中已得到描述。
二、临床应用
1、方法:
在2020年5月-2020年11月期间,按照上述研究方法将接受DRBCT的 受体纳入DRBCT组,并将其临床特征与只接受来自血库的异基因型红细胞 悬液的受体进行比较,以评估DRBCT的安全性与有效性。
2、结果:
本项研究共纳入患者56名,其中DRBCT组患者23名,异基因型红细 胞悬液的对照组患者33名。DRBCT组患者未观察到输血相关并发症的发生, 且术后1个月内感染发生率与对照组相似(21.7%vs 18.1%,P=1.000)。 DRBCT组患者因输入供体来源红细胞的因素,术中来自血库的异基因红细 胞悬液输注量的中位数为4U(0-8U,IQR),而对照组为7U(4-10U,IQR), 差异有统计学意义(P=0.034)。除此之外,DRBCT组的术后早期天门冬氨 酸转氨酶(aspartate aminotransferase,AST)峰值水平显著低于对照组(P =0.031),并且术后前2天的AST水平同样显著低于对照组(P=0.019,P =0.045)。
3、结论:
DRBCT应用于DDLT是一种可以缓解血液供应不足情况下的安全有效 措施,并且能够在一定程度上降低患者肝移植术后AST水平,为终末期肝病 的患者进行挽救生命的移植手术提供安全保障。
综上,本发明采集器官捐献供体血液的方法,通过自体血回收机完成供体 红细胞悬液的制备,将DRBCT应用于DDLT,能够保证在血液供应不足情 况下肝移植和/或肾脏移植手术能够正常开展,避免发生因血液供应不足而丢 弃供肝或供肾。
