一种酚糖苷化合物及其制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于酚糖苷天然有机化合物技术领域,具体涉及从锥属植物锥中提取分离的酚糖苷化合物及其制备方法和应用,属于植物成分的提取、分离纯化技术领域。
背景技术
糖苷类物质药理活性丰富,具有显著的抗肿瘤、抗感染、免疫调节等功能,临床上对心血管系统、呼吸系统、消化系统、神经系统等也有不同程度的治疗效果。现代药理学研究表明,与芳香酚环相连的部分氧糖苷类化合物还具有抑制乳腺癌迁移和侵袭,抑制胰腺癌和肺癌的生长,阻断脂肪酸合酶的信号通路,对抗ACH诱导大鼠结肠收缩引起的痉挛,保护局灶性脑缺血损伤等多种药理活性。目前多种酚糖苷类天然化合物已经在临床上用于抗菌消炎、增强机体免疫功能、抗肿瘤等方面的治疗。大自然是酚糖苷类化合物的主要原料库,从中提取分离得到新型氧糖苷,发掘潜在的具有较好药理活性的物质是天然产物研究领域的热点话题。
酚糖苷类化合物结构复杂多变、极性较大,现有分离方法难以快速有效获取高纯度的单体化合物。因此,对富含酚酸类成分的天然植物开展化学成分的研究,发现一种酚糖苷类化合物的有效分离方法,不仅是发现新结构化合物和新功能先导化合物的有效途径,还可以开发天然植物的新用途,实现植物资源的高值化利用。
发明内容
本发明的目的之一,是提供一种新结构的酚糖苷化合物。本发明所提供的酚糖苷化合物(以下简称为chinensin D)来源于锥属植物锥(Castanopsis chinensis)的叶子,其结构和药理活性均未被现有技术所报导,具有抗氧化活性,为抗氧化产品提供了新的侯选化合物。
本发明解决上述技术问题的技术方案如下:一种酚糖苷化合物chinensin D,为下式所示的化合物:
本发明的目的之二是提供一种所述酚糖苷化合物chinensin D的制备方法。
本发明解决上述技术问题的技术方案如下:一种化合物chinensin D的制备方法,包括如下步骤:
步骤1:制备锥树叶粗提物
取锥树叶原料,清洗沥干,切碎后进行提取,过滤去掉残渣,滤液减压中低温浓缩,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶吸附进行柱层析,采用梯度洗脱,收集60%-80%甲醇水洗脱剂部分洗脱液,减压中低温浓缩后,得到富含化合物chinensin D的提取物B;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的粗提物B经MCI吸附进行柱层析,采用梯度洗脱,收集80%-100%甲醇水洗脱剂部分洗脱液,减压中低温浓缩后,得到提取物C;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用反向梯度洗脱,收集100%-90%乙醇水洗脱剂部分且在薄层色谱检测中比移值(Rf)为0.8的洗脱液,减压中低温浓缩后,得到提取物D;
步骤5:高速逆流色谱分离
两相溶剂体系由正己烷、乙酸乙酯、甲醇和水按体积比为10:(58-62):30:(38-42)混匀后,静置分层得到上下相;上相作为固定相,下相作为流动相;先将固定相注入高速逆流色谱柱内,待固定相充满高速逆流色谱柱后,调节转速,再将流动相注入高速逆流色谱柱;待整个体系建立动态平衡后,取200mg提取物D,溶解在10mL固定相和10mL流动相组成的混合溶剂中,由进样阀进样;收集流份,根据高速逆流色谱图的保留时间,接收出峰时间为75min-90min的目标成分,减压中低温浓缩,真空干燥后,即可得到化合物chinensin D;
本发明的chinensin D的制备方法的原理是:
本申请的发明人在对锥树叶提取物进行化学成分研究中分离纯化得到新化合物chinensin D。于是,本申请的发明人不断改进提取纯化方法和实验参数,得到高纯度的chinensin D单体化合物。具体如下:
本发明的步骤1中,利用相似相容的原理,采用高浓度甲醇或者乙醇溶液对锥树叶中的酚酸类化合物进行提取,该提取溶剂能够最大程度的对目标化合物进行提取。其中,锥树叶为新鲜树叶。
本发明的步骤2中,步骤1中得到的锥树叶粗提物除了目标化合物之外还含有其他酚酸类化合物和黄酮类成分,通过凝胶的分子筛和吸附作用以及不同比例的醇水溶液洗脱可以使目标化合物与分子量及极性相差较大的杂质实现较好的分离。
本发明的步骤3中,步骤2中得到的提取物B除了目标成分外还含有多种分子量及极性相近的酚酸类化合物,通过树脂吸附洗脱可以除去大部分有极性差异的酚酸类成分。
本发明的步骤4中,步骤3中得到的提取物C经过凝胶吸附,采用反向梯度洗脱系统洗脱可以除去与目标成分极性相近的杂质化合物。
本发明的步骤5中,步骤4中得到的提取物D经液相检测含有一种与目标成分保留时间极其相近的化合物,柱层析和高效液相制备方法均难以得到有效分离,通过方法筛选发现高速逆流分离方法能使目标化合物与相似成分得到有效分离,由正己烷、乙酸乙酯、甲醇和水按体积比为10:(58-62):30:(38-42)混匀后形成的上下相体系对目标成分有较好的分离效果。
高速逆流分离技术是一种连续高效的液-液分配色谱分离技术,利用两相溶剂体系在高速旋转的螺旋管内建立起一种特殊的单向性流体动力学平衡,根据不同物质在两相中分配系数的不同而实现分离,特别适合于天然产物活性成分的分离。现有技术报道中还未见采用高速逆流色谱来分离制备新结构酚糖苷类化合物的的方法。
综上,本发明经过上述操作,可以得到高纯度(纯度>90%)的单体化合物,为锥植物资源的全面开发和深度利用提供新途径。
本发明的高纯度chinensin D的制备方法的有益效果是:
1、本发明首次以锥树叶为原料提取分离得到chinensin D,可以得到高纯度(纯度>90%)的单体化合物,酚糖苷类化合物极性大结构相近,微量成分较难得到有效分离,本发明的制备方法,操作快捷高效,通过凝胶树脂材料的交叉反复运用除去大量杂质,最后通过高速逆流实现两种相近成分的有效分离。本方法得到的产品纯度高,操作容易,适合推广应用。
在上述技术方案的基础上,本发明还可以做如下改进。
进一步,步骤1中,所述切碎的宽度为1-3cm。
采用上述进一步的有益效果是:采用上述大小,更有利于酚糖苷类化合物的提取。
进一步,步骤1中,所述提取采用浸提和超声提取中的任意一种。
采用上述进一步的有益效果是:采用上述提取方式,更有利于酚糖苷类化合物的提取,避免结构被破坏生物活性降低。
更进一步,所述浸提的具体方法是:在切碎后的新鲜树叶中,加入原料7-15倍重量的体积浓度为70%-100%的醇水溶液,于室温提取,每次1-2d,共2-4次。
采用上述进一步的有益效果是:采用上述提取方式,更有利于化合物chinensin D的提取,并保持原有生物活性。
更进一步,所述超声提取的具体方法是:在粉碎后的原料中,加入原料10-20倍重量的体积浓度为70%-100%的醇水溶液,采用功率为100W,频率为30kHz-80kHz超声提取,每次30-60min,共3次。
采用上述进一步的有益效果是:采用上述提取方式,更有利于chinensin D快速有效的提取。
进一步,步骤1、步骤2或步骤3中,所述醇水溶液为甲醇水或者乙醇水溶液,减压中低温浓缩的压力均为35KPa-85KPa,温度均为≤50℃。
采用上述进一步的有益效果是:chinensin D溶液高温易变性,长时间接触空气易氧化,采用上述参数的减压中低温浓缩,可以大大降低chinensin D变性和氧化的可能。
进一步,步骤2中,所述凝胶为Sephadex LH-20,规格为8cm×80cm,填料粒径为100μm-163μm。所述洗脱剂为体积浓度为0%-100%的甲醇水溶液和体积浓度为0%-100%的乙醇水溶液中的任意一种。所述梯度洗脱为每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。
采用上述更进一步的有益效果是:上述Sephadex LH-20的规格和填料粒径较适合粗提物中酚酸类与黄酮类化合物的分离。
上述Sephadex LH-20可以市售购买,如可以购自美国GE公司。
进一步,步骤3中,所述MCI为MCI GEL CHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。所述洗脱剂为体积浓度为0%-100%的甲醇水溶液和体积浓度为0%-100%的乙醇水溶液中的任意一种。所述梯度洗脱为每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。
采用上述更进一步的有益效果是:MCI的规格和填料粒径较适合天然产物中中等极性黄酮类酚酸类化合物的分离。
上述MCI可以市售购买,如可以购自日本三菱化学。
进一步,步骤4中,所述凝胶为Sephadex LH-20,规格为4cm×60cm,填料粒径为100μm-163μm。所述洗脱剂为体积浓度为100%-0%的乙醇水溶液。所述梯度洗脱为每10%体积浓度为一个梯度,每个梯度0.3L,每0.008L为一个流份,洗脱速度为2ml/min。
进一步,步骤4中,所述薄层色谱检测的条件为:硅胶GF
上述显色剂的配制方法是:准确称量0.789g的FeCl
采用上述进一步的有益效果是:通过上述检测参数,可以收集得到含有目标成分的提取物D。
进一步,步骤5中,所述转速为800r/min-900r/min。
采用上述进一步的有益效果是:适宜的转速,可以提高固定相的保留率和分离效果。
进一步,步骤5中,所述收集流份的速度为每3min收集1试管。
采用上述进一步的有益效果是:有助于提高收集色谱峰的纯度。
进一步,步骤5中,所述干燥的温度为45℃,时间为12h。
采用上述进一步的有益效果是:避免高温使化合物发生氧化,真空使化合物干燥的更加彻底。
本发明的目的之三,是提供上述chinensin D制备方法制备得到的chinensin D在抗氧化产品中的应用。chinensin D由上述制备方法制备得到,具有较好的抗氧化生物活性,可以用于制备抗氧化产品,具有广阔的市场空间。
本发明解决上述技术问题的技术方案如下:一种如上所述的chinensin D的制备方法得到的chinensin D。
本发明chinensin D制备方法的有益效果是:本发明的chinensin D由上述制备方法得到,具有较好的抗氧化生物活性,可以用于制备抗氧化产品,例如药品或化妆品,具有较大的开发空间。
本发明进行了chinensin D抗氧化生物活性研究。结果显示,本发明制备得到的chinensin D显示出较好的DPPH自由基清除能力。由此可见,本发明得到的chinensin D在抗氧化产品的开发与应用中具有广阔的前景。
附图说明
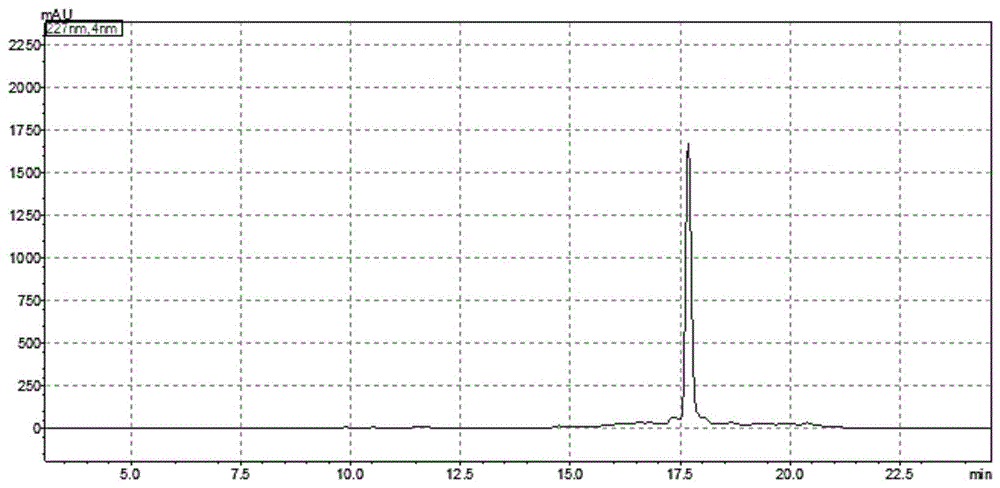
图1为本发明实施例1的高速逆流分离色谱图。
图2为本发明实施例1得到chinensin D的纯度检测图。
图3为本发明实施例1得到chinensin D的
图4为本发明实施例1得到chinensin D的
图5为本发明实施例1得到chinensin D的LCMS-IT-TOF谱。
图6为本发明对比实施例2得到chinensin D的HPLC制备图。
具体实施方式
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
实施例1
本实施例的chinensin D的制备方法,包括如下步骤:
步骤1:制备锥树叶粗提物
取新鲜锥树叶原料3Kg,清洗沥干,切碎至1-3cm。加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间1d,第一次过滤,得第一次滤液和第一次滤渣,第一次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第一次滤渣里加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间1d,第二次过滤,得第二次滤液和第二次滤渣,第二次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第二次滤渣中加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第三次过滤,得第三次滤液,第三次滤液于50KPa,50℃条件下减压浓缩至浸膏。
合并第一次浸膏、第二次浸膏和第三次浸膏,加少量水溶解过滤去掉残渣,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶Sephadex LH-20吸附进行柱层析,采用梯度洗脱,凝胶色谱柱Sephadex LH-20的规格为8cm×80cm,填料粒径为100μm-163μm。
用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。收集60%-80%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到富含化合物chinensin D的提取物B,chinensin D的含量为0.196%;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的提取物B经MCI吸附进行柱层析,采用梯度洗脱,MCI为MCI GELCHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。收集80%-100%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到提取物C,chinensin D的含量为2.32%;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用反向梯度洗脱,凝胶为Sephadex LH-20,层析柱规格为4cm×60cm,填料粒径为100μm-163μm。用2倍柱体积的体积浓度为100%-0%的乙醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.008L为一个流份,洗脱速度为2ml/min。收集100%-90%乙醇水洗脱剂部分且在硅胶GF
步骤5:高速逆流色谱分离
两相溶剂体系由正己烷、乙酸乙酯、甲醇和水按体积比为1:6:3:4混匀后,静置分层得到上下相;
上相作为固定相,下相作为流动相;先将固定相以40ml/min注入高速逆流色谱柱内,待固定相充满高速逆流色谱柱后,调节转速为860r/min,再将流动相以2ml/min注入高速逆流色谱柱;
待整个体系建立动态平衡后,此时固定相流出141ml,固定相保留率为53%。取200mg提取物D,溶解在10mL固定相和10mL流动相组成的混合溶剂中,样品溶液由进样阀进样;
收集流份,根据高速逆流色谱图的保留时间,接收出峰时间为75min-90min的目标成分,收集的流份于50KPa,50℃条件下减压浓缩,真空干燥后,即可得到化合物chinensinD,高速逆流分离图谱如图1所示。
纯度检测:采用HPLC分析法检测纯度。色谱柱:Aiglent ZORBAX SB C18,4.6mm×250mm,填料粒度为5μm,柱温为30℃,流速为1mL/min,检测波长为227nm,流动相为乙腈(A)和水(B),进行梯度流脱,0min-30min,5%A-95%A。液相图谱如图2所示。结果显示chinensin D的纯度为93%。
经
LCIT-TOF-MS:m/z 619.2084[M-H]
通过
实施例2
本实施例的chinensin D的制备方法,包括如下步骤:
步骤1:制备锥树叶粗提物
取新鲜锥树叶原料3Kg,清洗沥干,切碎至1cm。加入原料12倍重量的体积浓度为90%的甲醇水溶液,采用功率为80W,频率为40kHz超声提取30min,第一次过滤,得第一次滤液和第一次滤渣;在第一次滤渣里加入原料12倍重量的体积浓度为80%的甲醇水溶液,采用功率为80W,频率为40kHz超声提取30min,第二次过滤,得第二次滤液和第二次滤渣;在第二次滤渣中加入原料12倍重量的体积浓度为70%的甲醇水溶液,采用功率为60W,频率为40kHz超声提取1h,第三次过滤,得第三次滤液。
合并第一次滤液、第二次滤液和第三次滤液,于50KPa,50℃条件下减压浓缩后过滤去掉残渣,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶Sephadex LH-20进行柱层析,采用梯度洗脱,凝胶色谱柱Sephadex LH-20的规格为8cm×80cm,填料粒径为100μm-163μm。
用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。收集60%-80%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到富含化合物chinensin D的提取物B;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的提取物B经MCI吸附进行柱层析,采用梯度洗脱,MCI为MCI GELCHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。收集80%-100%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到提取物C;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用反向梯度洗脱,凝胶为Sephadex LH-20,层析柱规格为4cm×60cm,填料粒径为100μm-163μm。用2倍柱体积的体积浓度为100%-0%的乙醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.008L为一个流份,洗脱速度为2ml/min。收集100%-90%乙醇水洗脱剂部分且在硅胶GF
步骤5:高速逆流色谱分离
两相溶剂体系由正己烷、乙酸乙酯、甲醇和水按体积比为10:62:30:38混匀后,静置分层得到上下相;
上相作为固定相,下相作为流动相;先将固定相以40ml/min注入高速逆流色谱柱内,待固定相充满高速逆流色谱柱后,调节转速为860r/min,再将流动相以2ml/min注入高速逆流色谱柱;
待整个体系建立动态平衡后,此时固定相流出135ml,固定相保留率为55%。取200mg提取物D,溶解在10mL固定相和10mL流动相组成的混合溶剂中,样品溶液由进样阀进样;
收集流份,根据高速逆流色谱图的保留时间,接收出峰时间为78min-91min的目标成分,收集的流份于50KPa,50℃条件下减压浓缩,真空干燥后,即可得到化合物chinensinD。
纯度检测同实施例1,结果显示chinensin D的纯度为91%。
结构鉴定同实施例1。
实施例3
本实施例的chinensin D的制备方法,包括如下步骤:
步骤1:制备锥树叶粗提物
取新鲜锥树叶原料3.5Kg,清洗沥干,切碎至1-3cm。加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第一次过滤,得第一次滤液和第一次滤渣,第一次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第一次滤渣里加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第二次过滤,得第二次滤液和第二次滤渣,第二次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第二次滤渣中加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第三次过滤,得第三次滤液,第三次滤液于50KPa,50℃条件下减压浓缩至浸膏。
合并第一次浸膏、第二次浸膏和第三次浸膏,加少量水过滤去掉残渣,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶Sephadex LH-20吸附进行柱层析,采用梯度洗脱,凝胶色谱柱Sephadex LH-20的规格为8cm×80cm,填料粒径为100μm-163μm。
用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。收集60%-80%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到富含化合物chinensin D的提取物B;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的提取物B经MCI吸附进行柱层析,采用梯度洗脱,MCI为MCI GELCHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。收集80%-100%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到提取物C;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用反向梯度洗脱,凝胶为Sephadex LH-20,层析柱规格为4cm×60cm,填料粒径为100μm-163μm。用2倍柱体积的体积浓度为100%-0%的乙醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.008L为一个流份,洗脱速度为2ml/min。收集100%-90%乙醇水洗脱剂部分且在硅胶GF
步骤5:高速逆流色谱分离
两相溶剂体系由正己烷、乙酸乙酯、甲醇和水按体积比为10:58:30:42混匀后,静置分层得到上下相;
上相作为固定相,下相作为流动相;先将固定相以40ml/min注入高速逆流色谱柱内,待固定相充满高速逆流色谱柱后,调节转速为800r/min,再将流动相以2ml/min注入高速逆流色谱柱;
待整个体系建立动态平衡后,此时固定相流出145ml,固定相保留率为52%。取200mg提取物D,溶解在10mL固定相和10mL流动相组成的混合溶剂中,样品溶液由进样阀进样;
收集流份,根据高速逆流色谱图的保留时间,接收出峰时间为69min-87min的目标成分,收集的流份于50KPa,50℃条件下减压浓缩,真空干燥后,即可得到化合物chinensinD。
纯度检测同实施例1,结果显示chinensin D的纯度为90%。
结构鉴定同实施例1。
对比实验1
将实施例1步骤4中,提取物C经凝胶吸附进行柱层析,采用正向梯度洗脱。具体步骤为:
步骤1:制备锥树叶粗提物
取新鲜锥树叶原料2Kg,清洗沥干,切碎至1-3cm。加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第一次过滤,得第一次滤液和第一次滤渣,第一次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第一次滤渣里加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第二次过滤,得第二次滤液和第二次滤渣,第二次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第二次滤渣中加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第三次过滤,得第三次滤液,第三次滤液于50KPa,50℃条件下减压浓缩至浸膏。
合并第一次浸膏、第二次浸膏和第三次浸膏,加少量水溶解过滤去掉残渣,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶Sephadex LH-20进行柱层析,采用梯度洗脱,凝胶色谱柱Sephadex LH-20的规格为8cm×80cm,填料粒径为100μm-163μm。
用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。收集60%-80%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到富含化合物chinensin D的提取物B;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的提取物B经MCI吸附进行柱层析,采用梯度洗脱,MCI为MCI GELCHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。收集80%-100%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到提取物C;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用正向梯度洗脱,凝胶为Sephadex LH-20,层析柱规格为4cm×60cm,填料粒径为100μm-163μm。用2倍柱体积的体积浓度为0%-100%的乙醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.008L为一个流份,洗脱速度为2ml/min。收集80%-100%乙醇水洗脱剂部分,该部位在硅胶GF
对比实验2
将实施例1步骤5中高速逆流色谱分离替换为高效液相分离,具体步骤为:
步骤1:制备锥树叶粗提物
取新鲜锥树叶原料2Kg,清洗沥干,切碎至1-3cm。加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第一次过滤,得第一次滤液和第一次滤渣,第一次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第一次滤渣里加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第二次过滤,得第二次滤液和第二次滤渣,第二次滤液于50KPa,50℃条件下减压浓缩至浸膏;在第二次滤渣中加入原料10倍重量的体积浓度为90%的甲醇水溶液,于室温浸泡提取,提取时间2d,第三次过滤,得第三次滤液,第三次滤液于50KPa,50℃条件下减压浓缩至浸膏。
合并第一次浸膏、第二次浸膏和第三次浸膏,加少量水溶解过滤去掉残渣,得到锥树叶粗提物;
步骤2:制备富含化合物chinensin D的提取物
将步骤1得到的锥树叶粗提物经凝胶Sephadex LH-20吸附进行柱层析,采用梯度洗脱,凝胶色谱柱Sephadex LH-20的规格为8cm×80cm,填料粒径为100μm-163μm。
用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每20%体积浓度为一个梯度,每0.2L为一个流份,洗脱速度为2ml/min。收集60%-80%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到富含化合物chinensin D的提取物B;
步骤3:化合物chinensin D的进一步富集
将步骤2得到的提取物B经MCI吸附进行柱层析,采用梯度洗脱,MCI为MCI GELCHP20P,规格为6cm×80cm,填料粒径为37μm-75μm,75μm-150μm。用2倍柱体积的体积浓度为0%-100%的甲醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.01L为一个流份,洗脱速度为2ml/min。收集80%-100%甲醇水洗脱剂部分洗脱液,于50KPa,50℃条件下减压浓缩后,得到提取物C;
步骤4:化合物chinensin D的纯化
将步骤3得到的提取物C经凝胶吸附进行柱层析,采用反向梯度洗脱,凝胶为Sephadex LH-20,层析柱规格为4cm×60cm,填料粒径为100μm-163μm。用2倍柱体积的体积浓度为100%-0%的乙醇水溶液进行梯度洗脱,每10%体积浓度为一个梯度,每0.008L为一个流份,洗脱速度为2ml/min。收集100%-90%乙醇水洗脱剂部分且在硅胶GF
步骤5:高效液相色谱分离
将步骤4得到的提取物D加入80%甲醇水溶液溶解过滤,吸取上述待制备样品溶液50μL,注入高效液相色谱柱内进行制备,高效液相色谱的制备参数为:9.4mm×250mm的Agilent Eclipse XDB C18色谱柱,填料的粒度为5μm,柱温为30℃,流动相流速为2.0mL/min,检测波长为227nm,经过反复条件摸索,目标化合物与杂质均无法得到有效分离。制备色谱图如图6所示。
实验例:chinensin D对DPPH自由基清除实验研究。
以Vc为阳性对照,采用DPPH自由基清除活性测定法,测定化合物抗氧化生物活性。
称取适量实施例1得到的chinensin D和阳性对照品,用95%乙醇溶解,稀释成系列浓度样品溶液,备用。精确称取2mg DPPH粉末溶于24ml 95%乙醇中,充分震荡,得浓度为0.211mmol/L DPPH溶液,避光保存,备用。
将100μL样品溶液加入96孔板中,然后加入上述DPPH溶液300μL,震荡混匀,避光反应30min,于波长517nm处测定吸光值。用95%乙醇代替样品做空白,其它步骤及试剂同上,以相同系列浓度Vc进行上述操作,作为阳性对照实验。
计算各样品系列浓度下DPPH自由基清除率,并由此计算出IC
清除率=(A空白-(A样品-A背景))/A空白×100%,其中,A空白为以95%乙醇代替待测样品的吸光值;A样品为加入待测样品反应后的吸光值;A背景为以95%乙醇代替DPPH溶液的吸光值。
实验结果如下:Vc清除DPPH自由基的IC
由实验结果可知,化合物chinensin D能够有效清除DPPH自由基,清除活性与阳性对照Vc相当,具有较好的抗氧化活性。
本发明所提供的新化合物chinensin D生物活性还未得到开发和应用,本发明为抗氧化产品提供了新的侯选化合物。
由此可见,本发明实施例1得到的chinensin D在抗氧化产品的开发与应用具有广阔的应用前景。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种间苯二酚杯芳烃化合物及制备方法与应用
- 一种具有COX-2抑制活性的系列酚性化合物及制备方法
- 一种酚类化合物及其制备方法
- 一种红树内生真菌来源的1,4-萘醌类化合物及其制备方法和在制备抗炎药物中的应用
- 一种酚糖苷类化合物eyrein F、其制备方法及应用
- 一种增强α葡萄糖苷酶抑制活性的酚苷类化合物及其制备方法和应用
