一种皮肤修复肽及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及蛋白肽技术领域,具体涉及一种皮肤修复肽及其应用。
背景技术
皮肤是机体与外界接触的第一道屏障,是维持内环境稳定和阻止微生物、化学物质等侵入的屏障。多种创伤均会引起皮肤缺损,如外力创伤,再如随着年龄的增大以及紫外线的影响,胶原蛋白大量流失,成纤维细胞合成的胶原蛋白和糖胺聚糖减少,导致支撑皮肤的胶原肽键断裂,皮肤出现损伤。在皮肤损伤中,活性肽起着独特而重要的生理作用,参与皮肤修护的过程,不仅能够促进皮肤细胞的增殖,还可以为皮肤提供营养,延缓皮肤老化,促进皮肤创伤修复。目前,活性肽作为皮肤修复的活性原料之一被广泛添加至皮肤护理产品当中。然而,现有技术中这些多肽不仅存在难以合成、活性有限的问题。因此,研发序列短小、合成简单、活性高效的促皮肤修复的超短肽成为皮肤修复、再生医疗、美容等领域的重点方向之一。
发明内容
本发明的目的在于克服现有技术的不足之处而提供一种皮肤修复肽及其应用。
为实现上述目的,本发明采取的技术方案如下:
第一方面,本发明提供了一种皮肤修复肽,包括大鲵水解胶原肽和/或透皮肽。
本发明的皮肤修复肽能够促进成纤维细胞增殖,促进成纤维细胞划痕修复活性,促进胶原蛋白合成,促进弹性蛋白合成。可用于皮肤损伤修复的改善或治疗中。本发明的皮肤修复肽含有透皮短肽可促进透皮吸收,微量高效,安全性有保证。适用于在皮肤修复的化妆品或药品中应用,以实现皮肤损伤修复的改善或治疗的目的。
作为本发明所述的皮肤修复肽的优选实施方式,所述大鲵水解胶原肽的氨基酸序列为GLYYF。
作为本发明所述的皮肤修复肽的优选实施方式,所述透皮肽的氨基酸序列为ACSSSPSKHCG、CYGRKKRRQRRRC、RGDFK、LCLR、RPARPAR、VVVR、CTWLKY、TWLKYH中的任一种。
优选的,所述透皮肽的氨基酸序列为ACSSSPSKHCG。
进一步的,所述皮肤修复肽的氨基酸序列为ACSSSPSKHCGGLYYF。
第二方面,本发明提供了一种所述大鲵水解胶原肽的制备方法,其特征在于,包括以下步骤:取新鲜养殖大鲵肌肉部位组织,研磨成匀浆加入胰蛋白酶、中性蛋白酶、碱性蛋白酶和胃蛋白酶酶解;离心取上清。采用液相色谱仪分离纯化,收集洗脱液,即得。
作为本发明所述的制备方法的优选实施方式,所述酶解为采用胰蛋白酶80U~120U、中性蛋白酶80U~120U、碱性蛋白酶80U~120U、胃蛋白酶80U~120U酶解4~6小时。
作为本发明所述的制备方法的优选实施方式,所述液相色谱仪分离纯化中采用的色谱填料为UniSil 10-120C18,检测波长为220nm,流速为0.5ml/min,流动相A为乙腈和0.05%三氟乙酸,流动相B为纯化水和0.05%三氟乙酸。
第三方面,本发明将所述的皮肤修复肽在用于皮肤修复的化妆品或药品中应用。
第四方面,本发明提供了一种含所述的皮肤修复肽的化妆品或药品。
与现有技术相比,本发明的有益效果为:
本发明的皮肤修复肽能够促进成纤维细胞增殖,促进成纤维细胞划痕修复活性,促进胶原蛋白合成,促进弹性蛋白合成。可用于皮肤损伤修复的改善或治疗中。本发明的皮肤修复肽含有透皮短肽可促进透皮吸收,微量高效,安全性有保证。适用于在皮肤修复的化妆品或药品中应用,以实现皮肤损伤修复的改善或治疗的目的。
附图说明
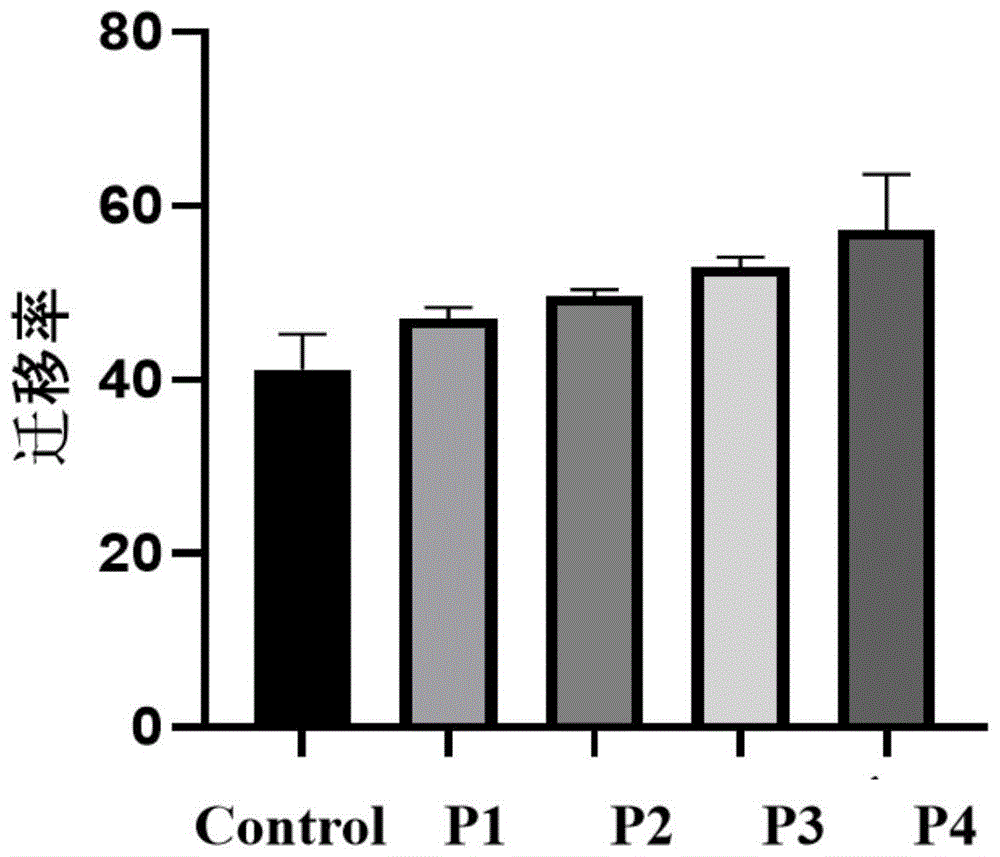
图1为不同组分细胞划痕试验的迁移率统计图;
图2为CCK-8检测合成多肽的细胞毒性统计图;
图3为体外透皮测试合成多肽的含量统计图;
图4为细胞划痕实验测试合成多肽的划痕修复能力电镜图;
图5为合成多肽对中CollagenⅠ、CollagenⅢ、Elastic、MMP-9基因表达量的影响统计图。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
术语“肽”是指通过肽键将氨基酸残基彼此结合形成的线性分子。可以通过本领域已知的化学合成方法,特别是固相合成技术合成肽或液相合成技术合成肽。
实施例中所用的试验方法如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:大鲵多肽的分离和鉴定
(1)分离
取新鲜养殖大鲵,取肌肉部位组织,研磨成匀浆,取10g匀浆,加入胰蛋白酶100U、中性蛋白酶100U、碱性蛋白酶100U、胃蛋白酶100U酶解5小时。12000rpm离心30min,取上清。采用Unique AutoPrep高压制备液相色谱仪进行分离纯化,色谱填料UniSil 10-120C18,检测波长220nm,流速0.5ml/min,流动相A乙腈(0.05%三氟乙酸),流动相B纯化水(0.05%三氟乙酸),采用梯度洗脱。(0%~100%A)洗脱20min,柱温25℃,自动进样,进样量100mL,根据不同峰收集洗脱液。分别标记为P1、P2、P3、P4。采用超微量分光光度计,检测波长280nm,对不同组分进行定量分析,其中P1 1.51μg/μL、P2 1.75μg/μL、P3 3.25μg/μL、P4 2.57μg/μL。
不同组分细胞划痕试验筛选。通过人皮肤成纤维细胞划痕试验检对不同组分P1、P2、P3、P4进行功效筛选。将人皮肤成纤维细胞以2×10
(2)鉴定
组分P4的多肽序列鉴定方法如下:
基于Edman降解法的多肽N-端测序分析:采用氨基酸自动测序仪PPSQ33A对组分P4进行分析,具体步骤如下:置换buffer,取50μL样品至超滤管中,加入8mol/L Urea溶液200μL,于4℃在12000rcf速度下离心10min,并重复操作一次。加入100μL ddH
实施例2:大鲵多肽的透皮修饰
为了使筛选的多肽GF-5在皮肤中应用中具有较好的透皮吸收性能,使用多种透皮肽对其进行修饰,经多肽疏水性、多肽等电点、结构稳定性等分析,透皮肽ACSSSPSKHCG、CYGRKKRRQRRRC、RGDFK、LCLR、RPARPAR、VVVR、CTWLKY、TWLKYH与多肽GF-5匹配具有较好的稳定性,与合适的等电点。
(1)采用多肽固相合成方法,分别合成AF-16(ACSSSPSKHCGGLYYF,透皮肽N端修饰)、GG-16(GLYYFACSSSPSKHCG,透皮肽C端修饰),GF-5(GLYYF),AG-11(ACSSSPSKHCG)、CF-18(CYGRKKRRQRRRCGLYYF)、RF-10(RGDFKGLYYF)、LF-9(LCLRGLYYF)、RF-12(RPARPARGLYYF)、VF-9(VVVRGLYYF)、CF-11(CTWLKYGLYYF)、TF-11(TWLKYHGLYYF)。
具体方法如下:
采用
(2)合成多肽纯化
合成多肽采用Unique AutoPrep高压制备液相色谱仪进行分离纯化,色谱填料UniSil 10-120C18,检测波长220nm,流速0.5ml/min,流动相A乙腈(0.05%三氟乙酸),流动相B纯化水(0.05%三氟乙酸),采用梯度洗脱。(0%-100%A)洗脱20min,柱温25℃,自动进样,收集洗脱峰。
(3)纯度检测
高效液相色谱仪(安捷伦1260,配四元泵,自动进样器和VWD检测器);色谱柱为C18色谱柱(4.6mm×250mm,5μm);流动相A(0.1%TFA水),流动相B(乙腈);梯度洗脱,洗脱程序见表1;柱温:30℃;进样量:20μL;流速:1.0mL/min;检测器:VWD检测器,检测波长220nm。
表1梯度洗脱程序
经检测合成多肽纯度如表2所示。
表2合成多肽纯度
试验例1:细胞毒性测试
采用人成纤维细胞系HSF,通过CCK-8检测受试物的细胞毒性。体外培养的正常哺乳动物细胞不断地分裂增生,毒性物质不论其作用位点和机制如何,都会干扰细胞的分裂增殖过程,导致细胞生长速率下降和数量减少。CCK-8检测试剂中的WST-8被细胞内脱氢酶氧化还原后生成的橙黄色甲能够溶解在培养基中,生成的甲腋物的数量与活细胞数量成正比。最后通过微孔板酶标仪在450nm读取结果后计算细胞存活率。
HSF细胞计数后稀释,在96微孔板中添加细胞悬液进行铺板操作;铺板24±1h后,细胞密度达到40%~60%使用排枪加入是实施例2制备的合成多肽,使其终浓度为设置浓度,设置溶剂对照,且设置试验孔平行不低于3个。加样48h后,去除废液,加入含10% CCK-8的DMEM,培养1~1.5h后酶标仪检测。酶标仪设置为:中速震荡10秒,OD450nm进行读数。仪器完成读数后导出文件。受试物的毒性试验中细胞存活率计算公式如下:
结果如下:
由图2可知,AF-16在浓度区间为0.1~1.56mg/ml时对HSF有提升细胞存活率的体现,且与GF-5相比,其促进HSF细胞增殖效果更为明显。与GG-16相比,GG-16为透皮肽ACSSSPSKHCG在C端修饰的多肽,其在0.78~1.56mg/ml时,对HSF细胞表现出细胞毒性。
试验例2:体外透皮测试
透皮实验前,取小鼠,电动剃须刀刮去鼠毛,处死,然后取腹部皮肤,用生理盐水反复冲洗干净,然后将其置于玻璃板,仔细剥下脂肪层,立即进行透皮试验测定。采用改进Franz双室渗透扩散装置(扩散面积为3.14cm
HPLC检测方法如下:
高效液相色谱仪(安捷伦1260,配四元泵,自动进样器和VWD检测器);多肽(纯度≥98%),乙腈(色谱纯,罗恩试剂公司),三氟乙酸/TFA(分析纯,麦克林试剂),实验用水为超纯水。
C18色谱柱(4.6mm×250mm,5μm);流动相A(0.1%TFA水),流动相B(乙腈);梯度洗脱,洗脱程序见表3;柱温:30℃;进样量:20μL;流速:1.0mL/min;检测器:VWD检测器,检测波长220nm。
表3梯度洗脱程序
记录峰面积积分值,计算合成多肽的含量,带入公式计算累计透过量(Qn,μg/cm
Qn=(Cn*V+∑Ci*Vi)/A
式中,Cn第n个时间点吸取液的浓度(mg/L);Ci第n-1个时间点吸取液的浓度(mg/L);V接收液的总体积,即15mL;Vi每次吸取液体的体积,即1mL;A:接收池的面积,即3.14cm
实验结果如图3所示,与其他透皮短肽相比,AF-16(ACSSSPSKHCGGLYYF)具有更好的透皮性能,可促进皮肤吸收。
试验例3:细胞划痕实验
通过人皮肤成纤维细胞划痕试验检测了AF-16(ACSSSPSKHCGGLYYF)、GF-5(GLYYF)、AG-11(ACSSSPSKHCG)对划痕修复的作用,将人皮肤成纤维细胞以2×10
结果如图4所示,AF-16与其他测试组相比具有较好的划痕修复能力。
试验例4:基因表达检测
检测合成多肽对人成纤维细胞中CollagenⅠ(Ⅰ型胶原蛋白)、CollagenⅢ(Ⅲ型胶原蛋白)、Elastic(弹性蛋白)、MMP-9(基质金属蛋白酶-9)基因表达量的影响。
采用RT-PCR法检测HSF细胞中基因转录水平,将对数生长期的HSF细胞以3×10
表4反应体系
引物序列设计见表5。反应条件为:94℃预变形30s,94℃变性5s;55℃退火30s;72℃延伸10s,共40个循环。
表4反应体系
以GAPDH为参照基因,采用2^-ΔΔct:进行计算,结果如图5,AF-16可促进CollagenⅠ、CollagenⅢ、Elastic基因的表达,抑制MMP-9基因的表达。从而促进细胞外基质的生产,抑制胞外基质的降解。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 一种基于计算机机箱的防水防尘USB接口装置
- 一种用于计算机主机的防尘防水散热机箱
- 一种防尘型计算机散热主机箱
- 一种静音防尘型安全主机箱
- 一种防尘电脑主机箱
- 一种计算机机箱用具有防尘结构的机箱
- 一种计算机机箱用具有防尘结构的机箱
