一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法
文献发布时间:2023-06-19 11:11:32
技术领域
本发明属于分子生物学技术领域,具体涉及一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法。
背景技术
垂体腺瘤是最常见的原发性颅内肿瘤之一,患病率占全球的17%。垂体腺瘤分泌异常的生长激素(Growth hormone;GH)可致临床疾病,在儿童时期,过量的GH分泌导致异常大的骨骼形成巨人症,然而GH分泌不足导致侏儒症;在成人中,由垂体腺瘤引起的GH分泌过多导致肢端肥大症。垂体腺瘤导致一些GH相关疾病长期影响人类的健康。尽管目前有药物治疗以及手术切除等多种治疗手段和方式,但垂体腺瘤导致的一系列GH相关疾病在临床治疗效果上仍然不理想。因此,寻找垂体腺瘤的生长激素蛋白质存在形式(Growth hormoneproteoform;GHP)生物标志物和相关生长激素疾病的GHP生物标志物是治疗垂体腺瘤和生长激素相关疾病的关键手段之一。
发明内容
本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法,该方法可鉴定生长激素分泌型垂体腺瘤与正常垂体组织之间GHPs的变化模式,46种GHPs在生长激素分泌型垂体腺瘤中被鉴定,35种GHPs在正常垂体组织中被鉴定;其中11种GHPs仅在生长激素分泌型垂体腺瘤组织中出现,而正常垂体组织中没有出现。
为解决上述技术问题,本发明采用的技术方案是:一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法,该方法为:
S1、收集人生长激素分泌型垂体腺瘤和正常垂体组织样本,分别裂解组织并提取两组组织蛋白质;
S2、将S1中得到的每组组织蛋白质均分成两份,分别进行双向凝胶电泳,得到含有蛋白质的双向凝胶,均命名为含有蛋白质的双向凝胶a和含有蛋白质的双向凝胶b;
S3、将S2中得到的含有蛋白质的双向凝胶a进行蛋白印迹,得到可视化PVDF膜;
S4、将S2中得到的含有蛋白质的双向凝胶b浸泡在考马斯亮蓝染色液中,得到用考马斯亮蓝染色的双向凝胶b;将S3中进行完蛋白印迹后的含有蛋白质的双向凝胶a浸泡在考马斯亮蓝染色液中,得到用考马斯亮蓝染色的双向凝胶a;
S5、将S3中得到的可视化PVDF膜、S4中得到的考马斯亮蓝染色的双向凝胶b和用考马斯亮蓝染色的双向凝胶a扫描到数字化图像中,将所述数字化图像导入到Bio-RadPDQuest双向凝胶图像分析软件中定量蛋白质点的体积,将呈免疫阳性的蛋白印迹点与相应的用考马斯亮蓝染色的双向凝胶a和用考马斯亮蓝染色的双向凝胶b的蛋白质点相匹配;
S6、将S4中得到的用考马斯亮蓝染色的双向凝胶a和用考马斯亮蓝染色的双向凝胶b中的凝胶点中与S3中所述可视化PVDF膜中呈免疫阳性的蛋白印迹点相对应的双向凝胶蛋白质点,用胰蛋白酶酶解所述双向凝胶蛋白质点中的蛋白质,抽提胰蛋白酶酶解肽混合物,然后用ZipTipC
S7、将S6中得到的纯化后的胰蛋白酶肽混合物进行MALDI-TOF-MS分析、LC-ESI-MS/MS分析或着MALDI-TOF-TOF-MS/MS分析,得到质谱图;
S8、将S7中得到的质谱图的PMF数据和MS/MS数据输入Mascot搜索引擎中,并在UniProt数据库搜索蛋白质进行鉴定;
S9、采用肽质量工具计算GH受胰蛋白酶酶解后的理论肽质量,与GH前体、成熟GH、及GH剪接变异体1、2、3和4的理论序列比对,确定GH前体和成熟GH以及GH剪接变异体1、2、3和4的特征性胰蛋白酶酶解肽;将得到的所述特征性胰蛋白酶酶解肽与S7中得到的每张质谱图进行比对,确定每个GHP是否源于GH前体和成熟GH以及GH剪接变异体1、2、3和4;所述GH前体的氨基酸序列如SEQ ID NO:1所示,所述成熟GH的氨基酸序列如SEQ ID NO:2所示,所述GH剪接变异体1序列如SEQ ID NO:3所示,所述GH剪接变异体2的氨基酸序列如SEQ IDNO:4所示,所述GH剪接变异体3的氨基酸序列如SEQ ID NO:5所示,所述GH剪接变异体4的氨基酸序列如SEQ ID NO:6所示;
S10、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量磷酸化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,通过iTRAQ试剂标记胰蛋白酶肽混合物、用TiO
S11、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量泛素化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,从得到的胰蛋白酶肽混合物中用泛素抗体富集泛素化肽,用LC-MS/MS分析鉴定泛素化蛋白质的氨基酸序列和泛素化位点,并用无标签定量方法定量泛素化肽的丰度;将获得的GH泛素化位点所在的胰蛋白酶肽与S7中获得的每张质谱图进行比对,以确定GHP的泛素化状态;
S12、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量乙酰化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,从得到的胰蛋白酶肽混合物中用乙酰抗体富集乙酰化肽,用LC-MS/MS分析鉴定乙酰化蛋白质的氨基酸序列和乙酰化位点,并用无标签定量方法定量乙酰化肽的丰度;将获得的GH乙酰化位点所在的胰蛋白酶肽与S7中获得的每张质谱图进行比对,以确定GHP的乙酰化状态。
本发明与现有技术相比具有以下优点:
1、本发明可鉴定生长激素分泌型垂体腺瘤与正常垂体组织之间GHPs的变化模式,生长激素分泌型垂体腺瘤有46个点(46种GHPs)和正常垂体组织有35个点(35种GHPs)。正常垂体组织中的35种GHPs与生长激素分泌型垂体腺瘤组织中46种GHPs相一致,但表达量不同;另外11种GHPs仅在生长激素分泌型垂体腺瘤组织中出现,而正常垂体组织中没有出现。这表明这GHPs模式在垂体腺瘤和正常之间明显不同,最有可能是肿瘤异常表达的生物标志物谱。在GHPs中发现了不同的翻译后修饰(PTMs)。通过磷酸化蛋白组学鉴定了GH中Ser77、Ser132、Thr174和Ser176残基的磷酸化,泛素化蛋白组学鉴定了GH中K96残基的泛素化,乙酰化蛋白质组学鉴定乙酰化在GH中驻留位点为K171,在GH中残基Asn(N)178处发生了脱胺。
2、本发明通过研究鉴定了正常垂体组织和生长激素分泌型垂体腺瘤组织之间的GHP蛋白质存在形式的生物标志物表达谱及其翻译后修饰(PTMs),以此寻找生长激素分泌型垂体腺瘤中异常表达的GHP蛋白质存在形式生物标志物谱来治疗生长激素分泌型垂体腺瘤以及生长激素相关疾病。通过采用双向凝胶电泳、基于双向凝胶电泳的蛋白质印迹抗GH抗体、相关质谱以及生物信息学等对生长激素分泌型垂体腺瘤和正常垂体组织的GHP蛋白质存在形式生物标志物谱进行鉴定,并且运用了定量磷酸化蛋白质组学、泛素化蛋白质组学和乙酰化蛋白质组学在整个生长激素分泌型垂体腺瘤和正常垂体组织中去鉴定和定量人GHP蛋白质存在形式生物标志物谱中的磷酸化、泛素化和乙酰化。将鉴定的磷酸化位点、泛素化位点和乙酰化位点分别与生长激素分泌型垂体腺瘤组织中GHPs蛋白质存在形式生物标志物的质谱图谱与正常垂体组织中GHPs蛋白质存在形式生物标志物的质谱图谱进行人工比较,从而发现在生长激素分泌型垂体腺瘤和正常垂体组织中GHP标志物以及其PTMs差异性。更有利于发现在肿瘤异常表达的生长激素蛋白质存在形式生物标志物谱,并研制出相应的诊断试剂盒和靶向治疗药物,将有助于生长激素分泌型垂体腺瘤以及生长激素相关疾病的早期诊断、治疗和防治。
下面结合附图和实施例对本发明作进一步详细说明。
附图说明
图1是本发明的GH前体和GH剪接变异体1-4的氨基酸序列图。
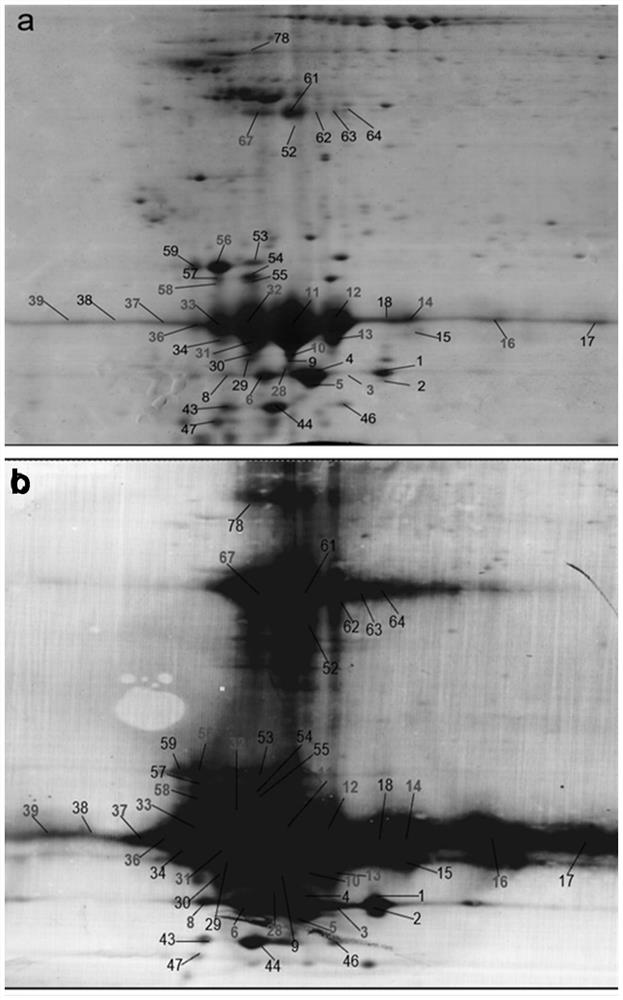
图2是本发明的人生长激素分泌型垂体腺瘤组织中GHPs的考马斯蓝染色的2D凝胶图像(a)和基于2DGE的GH免疫亲和蛋白质印迹图像(b)。
图3是本发明的正常垂体组织中GHPs的考马斯蓝染色的2D凝胶图像(a)和基于2DGE的GH免疫亲和蛋白质印迹图像(b)。
图4是为本发明的人生长激素分泌型垂体腺瘤组织中胶点36中胰蛋白酶肽LHQLAFDTYQEFEEAYIPK(46-64)的MS/MS质谱图。
图5是为本发明的人生长激素分泌型垂体腺瘤组织中胶点36中磷酸化胰蛋白酶肽SVFANSLVYGAS
具体实施方式
实施例1
本实施例的鉴定人生长激素蛋白质存在形式生物标志物谱的方法,该方法为:
S1、收集人生长激素分泌型垂体腺瘤和正常垂体组织样本,分别裂解组织并提取两组组织蛋白质,具体方法为:
(1)、垂体组织样本:
本实施例中所有的人生长激素分泌型垂体腺瘤组织(n=7)均来源于湘雅医院神经外科,经中南大学湘雅医院医学伦理委员会批准。作为对照的正常垂体组织样本(n=7)获得来源有:4例来自田纳西大学医疗健康中心,经田纳西大学医学研究中心伦理机构评审委员会批准;3例来自华中科技大学同济医学院法医学系,经华中科技大学同济医学伦理委员会批准。,这些组织从垂体相关疾病的手术患者中被移除,所得组织的目的和性质都得到了充分的解释,并获得了每个病人或家庭成员的同意。取出这些组织后,立即冷冻在液氮中,并储存在-80℃中直到后续处理。
(2)、蛋白质提取:
将垂体腺瘤和正常垂体组织样品从液氮罐(-80℃冷冻箱)中取出,室温下缓慢解冻。组织样品(约500mg)用0.9%NaCl(5mL毫升,5x)洗涤去除组织表面的血液,并用干净的剪刀充分剪切完全切割成非常小的碎粒片(约1立方毫米;在冰上)。取体积(4mL)的蛋白质提取缓冲液加入,其中含有7mol/L尿素、2mol/L硫脲、60mmol/L二硫苏糖醇(DTT)、4%(w/v)3-[(3-氯胺丙基)二甲基铵]丙烷磺酸盐(CHAPS)、0.5%v/v固向定化pH梯度(IPG)缓冲液(使用前添加)、并加入少量溴酚蓝后,彻底混合(2小时;冰上裂)。然后将样品离心(15000xg,15min,4℃),取上清液作为蛋白质样品溶液。
S2、将S1中得到的每组组织蛋白质均分成两份,分别进行双向凝胶电泳,得到含有蛋白质的双向凝胶,均命名为含有蛋白质的双向凝胶a和含有蛋白质的双向凝胶b,具体方法为:
(3)、双向凝胶电泳和蛋白印迹:
3.1、IEF(第一向等电聚焦丙烯酸胺凝胶电泳)
IEF是在IPGphor等电聚焦系统上进行的。将制备的垂体腺瘤或对照蛋白质样品的量(500μg)加载到18cm IPG胶条上(避免气泡),加入3mL矿物油覆盖IPG条,水化约18小时后再水化。然后在室温下进行IEF,参数如下:每根条IPG胶条固定最大电流设置为至30μA,温度至20o;步骤1:保持250V,1h,125Vh;步骤2:梯度1000V,1h,500Vh;步骤3:梯度8000V,1h,4000Vh;步骤4:8000V,4h,32000Vh;步骤5:保持500V,0.5h,250Vh。最终,IEF的总时间为7.5h,总电压时间积为36,875Vh。在IEF后,将IPG胶取出,并在其塑料背面去除IPG胶条表面的矿物油。3.2、SDS-PAGE(第二向SDS聚丙烯酰胺凝胶电泳)
采用垂直电泳系统对IPG胶条中等电聚焦分离后的蛋白质进行SDS-PAGE分离。12%的PAGE分离凝胶制备(n=12)如下:由180mL40%(w/v)丙烯酰胺/双丙烯酰胺原液(29:1,w:w)、150mL的1.5mol/L Tris-HCl pH 8.8、3mL 10%过硫酸铵、270mL去离子蒸馏水和150μL四甲基乙二胺(TEMED)混合,制成的12%PAGE分离凝胶(n=12)。将混合溶液缓慢地倒入制胶玻璃框室内,直到溶液远离玻璃板上端1cm止,立即加入约3mL去离子蒸馏水覆盖凝胶的上端,然后在室温下放置1小时。从IEF仪器中取出带有聚焦蛋白质的IPG胶条,在25mL的还原平衡缓冲液中轻微摇动约15分钟,还原平衡缓冲液由375mmol/L Tris-HCl pH 8.8、20%v/v甘油、2%w/v SDS、6mol/L尿素、微量溴酚蓝和2%(w/v)DTT混合制成。然后在25mL烷基化平衡缓冲液中轻轻摇动15min,烷基化平衡缓冲液由375mmol/L Tris-HCl pH 8.8、20%v/v甘油、2%w/v SDS、6mol/L尿素、微量溴酚蓝和2.5%w/v碘乙酰胺(使用前添加)混合制成的烷基。将每根条平衡后的IPG条置于12%的PAGE分离溶解SDS-PAGE凝胶的顶部,快速倒入30mL煮沸的含有1%琼脂糖的SDS电泳缓冲液来覆盖PAGE分离SDS-PAGE凝胶(避免胶有气泡),然后将等点聚焦后IEF分离蛋白的IPG胶条均匀快速地推入上端琼脂糖溶液中,待琼脂糖溶液凝固,最后转移到含有10L电泳缓冲液(由25mmol/L Tris、192mmol/L甘油和0.1%w/v SDS)的电泳槽中,然后在200V恒压下电泳约370分钟min。S3、将S2中得到的含有蛋白质的双向凝胶a进行蛋白印迹,得到可视化PVDF膜,具体方法为:
(4)、基于双向凝胶电泳的蛋白印迹:
电泳后取出两个玻璃板之间的双向凝胶,在左上角的负极端切割一小块来标记双向凝胶电泳的方向。将双向凝胶中的蛋白质用Amersham Multiphor-Ⅱ半干式电转移系统设备转移到聚偏二氟乙烯(PVDF)膜上,步骤如下:将阳极电极板放入电转移槽缓冲罐后,用去离子蒸馏水饱和阳极电极板;将6张滤纸浸入阳极转移缓冲液R中平衡后,放置在阳极板上;将3张滤纸浸入转移缓冲液T中平衡后,放置在6张滤纸上;将PVDF膜浸入阳极转移缓冲液中平衡后,放置在3张滤纸上;然后将双向凝胶置于PVDF膜上;将9张滤纸浸入转移缓冲液S中平衡后,放置在双向凝胶的上面;然后在恒定电流0.8mA/cm
S4、将S2中得到的含有蛋白质的双向凝胶b浸泡在考马斯亮蓝染色液中,得到用考马斯亮蓝染色的双向凝胶b;将S3中进行完蛋白印迹后的含有蛋白质的双向凝胶a浸泡在考马斯亮蓝染色液中,得到用考马斯亮蓝染色的双向凝胶a;
S5、将S3中得到的可视化PVDF膜、S4中得到的考马斯亮蓝染色的双向凝胶b和用考马斯亮蓝染色的双向凝胶a扫描到数字化图像中,将所述数字化图像导入到Bio-RadPDQuest双向凝胶图像分析软件中定量蛋白质点的体积,将呈免疫阳性的蛋白印迹点与相应的用考马斯亮蓝染色的双向凝胶a和用考马斯亮蓝染色的双向凝胶b的蛋白质点相匹配;具体方法为:
(5)、双向凝胶的蛋白质染色和图像分析:(标黄色的标注上是a还是b,还是a和b)
将含有蛋白质的双向凝胶a和b浸泡在考马斯亮蓝染色液中约2-3h(缓慢摇动),考马斯亮蓝染色液由0.75g的考马斯亮蓝G250、30mL冰醋酸、135mL甲醇和30mL去离子蒸馏水组成;然后用去离子蒸馏水洗2次,接着用20%v/v无水乙醇褪去凝胶背景至几乎无色(轻轻摇动),最后用去离子蒸馏水洗2次。将可视化的PVDF膜和相应的用考马斯亮蓝染色的双向凝胶a和b进行扫描,得到数字化图像。将这些数字化图像导入到Bio-Rad PDQuest双向凝胶图像分析软件中(7.0版本),定量蛋白点的体积;将呈免疫阳性的蛋白印迹点与相应的用考马斯亮蓝染色的双向凝胶a和b中的双向凝胶蛋白质量点进行匹配。
S6、将S4中得到的用考马斯亮蓝染色的双向凝胶a和用考马斯亮蓝染色的双向凝胶b中的凝胶点中与S3中所述可视化PVDF膜中呈免疫阳性的蛋白印迹点相对应的双向凝胶蛋白质点,用胰蛋白酶酶解所述双向凝胶蛋白质点中的蛋白质,抽提胰蛋白酶酶解肽混合物,然后用ZipTipC
S7、将S6中得到的纯化后的胰蛋白酶肽混合物进行MALDI-TOF-MS分析、LC-ESI-MS/MS分析或者MALDI-TOF-TOF-MS/MS分析,得到质谱图;
S8、将S7中得到的质谱图的PMF数据和MS/MS数据输入Mascot搜索引擎中,并在UniProt数据库搜索蛋白质进行鉴定;
具体方法为:
(6)、对hGH的质谱鉴定:
切除与呈阳性的蛋白印迹点相对应的双向凝胶蛋白点,用胰蛋白酶消化双向凝胶蛋白点中的蛋白质,用ZipTipC
对于MALDI-TOF-MS分析,将纯化的胰蛋白酶酶解肽混合物与a-cyano-4-羟基肉桂酸(CHCA)基质混合,并用MALDI-TOF Voyager DE-RP质谱仪(Framingham,MA,USA)进行分析,获得肽质量指纹数据;将肽质量指纹数据输入Mascot搜索引擎中,查询UniProt数据库91215(日期2019年7月2日;513877个序列;180750753个残基;人类有513,877个序列),鉴定蛋白质。同时,进行了空白对照实验,用MALDI-TOF-MS对边缘凝胶片进行了分析,以消除角蛋白和胰蛋白酶等污染物质衍生的污染质谱离子峰。
对于LC-ESI-MS/MS分析中,用LC-ESI-Q-IT(四离子阱质谱仪,Thermo Finnigan,San Jose,CA,USA)对纯化的胰蛋白酶酶解肽混合物进行分析,获得MS/MS数据。该仪器参数设置为毛细管探针温度110摄氏度、电喷雾质谱电压为2KV、电子倍增器为-900V。将MS/MS数据输入MASCOT软件中,搜索UniProt和NCBInr人类数据库,进行蛋白质鉴定。
在MALDI-TOF-TOF-MS/MS分析中,将纯化的胰蛋白酶酶解肽混合物与CHCA基质混合,用MALDI-TOF-TOF质谱仪进行分析,获得PMF和MS/MS数据;其参数设置为反射模式、加速电压为25kV、扫描范围m/z值为800-4000。MS和MS/MS数据常用MASCOT软件以UniProt人类蛋白质数据库为参照来进行蛋白质鉴定。在本研究中,所有MASCOT搜索的评分为70分,70分是搜索序列与识别序列的同一性或高度同源性的统计阈值,且具有统计学意义(P值小于0.05)。
人生长激素蛋白氨基酸序列来源于UniProt蛋白数据库(www.expasy.ch)。为了准确、可靠地质谱鉴定人生长激素分泌型垂体腺瘤和对照正常垂体组织中的人生长激素,在蛋白质数据库搜索之前,要从质谱图中去除空白凝胶中引入的常见离子质量峰,因为这些空白凝胶中含有常见的污染物如胰蛋白酶、皮肤和头发中提取的角蛋白、基质和其他未知污染物产生的离子质量峰。这些污染物的离子质量峰通常包括m/z值为842.5、870.5、1045.4、1109.3、1179.3、1235.2、1277.4、1307.3、1365.3、1383.3、1434.4、1475.3、1493.3、1638.3、1708.2、1716.3、1791.1、1838.3、1940.2、1994.2、2211.1、2225.1、2239.1、2284.1、2389.8、2705.7和2871.9。
由此,比较分析2DGE的蛋白印迹图像和相应的考马斯亮蓝2DGE图像,我们在生长激素分泌型垂体腺瘤组织中鉴定了46个GH免疫阳性点(图2a和2b),在正常垂体组织中鉴定了35个GH免疫阳性点(图3a和3b);而且,正常垂体中35个GH免疫阳性点与生长激素分泌型垂体腺瘤中46个点中的35个相匹配,11个GH免疫阳性点仅存在于生长激素分泌型垂体腺瘤中,而不存在于正常垂体。此外,运用Bio-Rad PDQuest 2D凝胶图像分析定量了生长激素分泌型垂体腺瘤中46个GH免疫阳性点对应的考马斯亮蓝染色蛋白质点的体积大小(图2a)和正常垂体中35个GH免疫阳性点对应的考马斯亮蓝染色蛋白质子点的体积大小(图3a);只存在于生长激素分泌型垂体腺瘤中的GHPs是9、17、29、30、44、46、47、55、62、64和78(n=11个);与正常垂体组织相比,GHPs 3、38、39、52和63(n=5个)在生长激素分泌型垂体腺瘤中丰度降低,而GHPs 1、2、4、5、6、8、10、11、12、13、14、15、16、18、28、31、32、33、34、36、37、43、53、54、56、57、58、59、61和67(n=30个)在生长激素分泌型腺瘤中丰度增加。
对每个切取的凝胶点中的蛋白质用胰蛋白酶进行酶解,然后提取和纯化胰蛋白酶酶解肽。用MALDI-TOF-TOF-MS对制备的胰蛋白酶酶解肽混合物进行了分析,获得PMF数据或MS/MS数据,通过搜索人类蛋白质数据库来进行蛋白质鉴定。对于生长激素分泌型垂体腺瘤(图2a),质谱分析发现所有46个2D凝胶点都含有hGH(UniProt:P01241)。对于正常垂体组织中(图3a),在35个2D凝胶点中,质谱分析发现25个2D凝胶点含有hGH(UniProt:P01241);而2D凝胶点2、15、18、38、52、53、54、57、61和63(n=10个)中没有任何蛋白质被质谱鉴定,但这10个点(图3a)在其相应的生长激素分泌型垂体腺瘤2D凝胶点中含有hGH(图2a),且其GH免疫亲和力图像为阳性(图3b)。以生长激素分泌型垂体腺瘤组织中点36为例来显示GH的质谱鉴定(图4),该图呈现了人生长激素分泌型垂体腺瘤组织中胶点36中GH衍生的胰蛋白酶肽LHQLAFDTYQEFEEAYIPK(46-64)的MS/MS质谱图。
S9、采用肽质量工具计算GH受胰蛋白酶酶解后的理论肽质量,与GH前体、成熟GH、及GH剪接变异体1、2、3和4的理论序列比对,确定GH前体和成熟GH以及GH剪接变异体1、2、3和4的特征性胰蛋白酶酶解肽;将得到的所述特征性胰蛋白酶酶解肽与S7中得到的每张质谱图进行比对,确定每个GHP是否源于GH前体和成熟GH以及GH剪接变异体1、2、3和4;具体方法为:
(7)、人生长激素的剪接鉴别:
如图1所示,生长激素(GH)的前体(图1中Precursor,SEQ ID NO:1)和成熟GH的胰蛋白酶肽段(图1中Isoform 1,SEQ ID NO:2),生长激素剪接变异体1、2、3和4(图1中的Isoform 1-4,SEQ ID NO:3-6),各自具有不同的特征性氨基酸序列,易于从质谱峰中检测出来。采用肽质量工具(http://us.expasy.org/cgi-bin/peptide-mass.pl)计算了GH前体和成熟GH的胰蛋白酶肽段,以及生长激素剪接变异体1、2、3和4的理论质量值。胰蛋白酶酶切参数设置为胰蛋白酶的裂解位点位于Lys(K)和Arg(R)的C端侧,最大漏切次数=2,所有还原形式的半胱氨酸和氧化的甲硫氨酸,肽质量范围大于500Da,肽氨基酸序列使用单一同位素质量,肽离子设置为[M+H]
结果表明:除了生长激素分泌型垂体腺瘤GHP 46外,特征性肽离子FPTIPLSR(位置27-34,[M+H]
S10、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量磷酸化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,通过iTRAQ试剂标记胰蛋白酶酶解肽混合物、用TiO
S11、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量泛素化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,从得到的胰蛋白酶酶解肽混合物中用泛素抗体富集泛素化肽,用LC-MS/MS分析鉴定泛素化蛋白质的氨基酸序列和泛素化位点,并用无标签定量方法定量泛素化肽的丰度;将获得的GH泛素化位点所在的胰蛋白酶酶解肽与S7中获得的每张质谱图进行比对,以确定GHP的泛素化状态;
S12、对生长激素分泌型垂体腺瘤和正常垂体组织进行定量乙酰化蛋白组学,将两种组织的蛋白质分别进行胰蛋白酶酶解,从得到的胰蛋白酶酶解肽混合物中用乙酰抗体富集乙酰化肽,用LC-MS/MS分析鉴定乙酰化蛋白质的氨基酸序列和乙酰化位点,并用无标签定量方法定量乙酰化肽的丰度;将获得的GH乙酰化位点所在的胰蛋白酶酶解肽与S7中获得的每张质谱图进行比对,以确定GHP的乙酰化状态;具体方法为:
(8)、人生长激素蛋白质存在形式的翻译后修饰状态:
对人生长激素分泌型垂体腺瘤和对照组织分别进行定量磷酸化蛋白组学(TiO
8.1、对于磷酸化蛋白组学分析,使用6-plex iTRAQ试剂盒对人生长激素分泌型垂体腺瘤(重复标记3次)和对照正常垂体组织样本(重复标记3次)的胰蛋白酶酶解肽进行标记。基本步骤是:用胰蛋白酶酶解200μg蛋白质,用C
结果表明:定量磷酸化蛋白组学鉴定了hGH(P02141)中Ser132、Ser134、Thr174和Ser176的四个磷酸化位点,理论计算这4种磷酸化位点所在胰酶肽离子SVFANSLVYGASDSNVYDLLK(121-141),FDTNSHND DALLK(172-184),QTYSKFDTNSHNDDALLK(167-184)以及FDTNS HNDDALLKNYGLLYCFR(172-193)及其相应的磷酸化肽的质量。将这些磷酸化肽质量与每个GHP的肽质量指纹图谱进行比较,以确定GHPs的磷酸化状态。胰肽SVFANSLVYGASDSNVYDLLK(121-141)有一个[M+H]
8.2、对于乙酰化蛋白组学分析,用胰蛋白酶酶解垂体腺瘤和对照垂体的蛋白质,将每个胰蛋白酶酶解肽混合物与抗N-乙酰赖氨酸抗体珠进行孵育2小时,然后离心(1min,4℃,1000xg),丢弃上清液。将含有乙酰化肽的抗N-乙酰赖氨酸抗体珠洗涤去除非特异性结合肽,然后用40μL0.1%TFA溶液洗脱乙酰化肽,用C
结果表明:定量乙酰化蛋白组学在人GH中Lys171(K171)处鉴定了一个乙酰化位点,其残基K171的质量增加了42Da。另外,蛋白质修饰软件预测了人GH(P01241)中残基Lys64、96、141、166、171、194和198是潜在的乙酰化位点,这进一步确定了乙酰化蛋白质组学鉴定的人GH(P012141)中K171乙酰化的准确性。理论计算含有乙酰化位点K171的乙酰化肽及其离子质量;共有6个,包括TGQIFKQTYSK(161-171),QTYSK(167-171),LEDGSPRTGQIFKQTYSK(154-171),QTYSKFDTNSHNDDA LLK(167-184),TGQIFKQTYSKFDTNSHNDDALLK(161-184),以及Q TYSKFDTNSHNDDALLKNYGLLYCFR(167-193)。然后,将这6个理论乙酰化肽与每个GHP的肽质量指纹图进行比对,以确定人GHPs的乙酰化状态,结果只在生长激素分泌型垂体腺瘤组织中胶点T30中GHP的一个肽QTYS*KFDTNSHNDDALLKNYGLLYCFR(167-193,K*=ac-Lys171)发生了乙酰化。
8.3、对于泛素化蛋白组学分析,同样用胰蛋白酶酶解人生长激素分泌型垂体腺瘤和对照正常垂体组织样本的蛋白质,将胰蛋白酶酶解肽混合物与抗K-ε-GG抗体珠[PTMScan泛素残留基序(K-ε-GG)试剂盒]进行孵育,洗涤和离心去除非特异性结合肽;将含有泛素化肽的抗K-ε-GG抗体珠子在40μL 0.15%TFA溶液中洗脱,用C
结果表明:定量泛素化蛋白组学在人GH残基Lys96(K96)处鉴定了一个泛素化位点,并且其残基质量增加了114Da。理论计算发现人GH(P01241)含有泛素化位点K96的泛素化胰蛋白酶酶解肽有4个,包括YSFLQNP QTSLCFSESIPTPSNREETQQK(68-96),EETQQKSNLELLR(91-103),EETQQK(91-96)以及EETQQKSNLELLRISLLLIQSWLEPVQFLR(91-120)。然后,将这4个理论泛素化肽与每个GHP的肽质量指纹图进行比对,以确定人GHPs的泛素化状态,结果只有肽EETQQK*SNLELLR(91-103;K*=ub-Lys96)在胶点T78中GHP上发生了泛素化。
8.4、在蛋白质脱氨分析当中,残基谷氨酰胺(Q)和天冬酰胺(N)的脱胺形成相应的谷氨酸(E)和天冬氨酸(D),并伴随增加1Da质量,其表观pI降低到pH=7.4,羧酸阴离子通常来源于蛋白质老化,也可能来源于储存蛋白质样品的基本条件。脱氨通常出现在2D凝胶中,会导致蛋白质发生一系列不同的pI值和相同的Mr。经过数据分析得知,在生长激素分泌型垂体腺瘤中,检测到25种GHPs(1、5、6、8、9、13、14、16、17、18、28、30、34、36、38、39、43、44、53、54、57、58、59、63和67)在残基Asn178(D178)处脱氨,在正常垂体组织中检测到5种GHPs(1、14、31、32和56)残基Asn178(D178)处脱氨。
总之,通过基于2DGE的蛋白印迹图谱、相应的考马斯亮2DGE图谱、MALDI-TOF-MS、LC-ESI-MS/MS和MALDI-TOF-TOF-MS/MS、定量磷酸化蛋白组学、泛素化蛋白组学、乙酰化蛋白组学数据以及脱氨等技术方法,经过数据处理分析,发现了生长激素分泌型垂体腺瘤组织中有46种GHPs,而正常垂体组织中有35种GHPs;且46种GHPs中的11种仅存在于生长激素分泌型垂体腺瘤组织中,而不存在于正常垂体组织中。这种异常的GHPs变化模式最有可能是肿瘤异常表达的生物标志物。进一步,鉴定出了垂体腺瘤和正常垂体组织之间GHPs的磷酸化、泛素化、乙酰化以及脱氨修饰状态,及其在肿瘤和对照间的差异修饰。
本实施例鉴定了生长激素分泌型垂体腺瘤组织中有46种GHPs和正常垂体组织中有35种GHPs;
生长激素分泌型垂体腺瘤组织中的46种GHPs有35种与对照垂体组织中的35种GHPs相一致,但表达量由不同;
46种GHPs中的11种仅存在于生长激素分泌型垂体腺瘤组织中,而不存在于正常垂体组织中;
表明这种GHPs变化模式最有可能是肿瘤异常表达的生物标志物。
除了生长激素分泌型垂体腺瘤组织中胶点46中GHP是GH前体,其他所有点中GHPs不是GH前体而是成熟的GH;
在生长激素分泌型垂体腺瘤中,GHPs(1和5)是剪接变异体2,GHP 78是剪接变异体3,其他43种GHP是剪接变异体1,没有发现剪接变异体4;而在正常垂体组织中,GHPs(3、4和6)是剪接变异体2,其他GHPs是剪接变异体1,没有发现剪接变异体3和4;
用MS/MS数据测定两个肽的氨基酸序列LHQLAFDTYQEFEEAYIPK(46-64,图4)和SVFANSLVYGAS*DSNVYDLLK(121-141,S*=磷酸化Ser132,图5)。在生长激素分泌型垂体腺瘤中有3种GHPs(12、36和54)在Ser132发生了磷酸化,有9种GHPs(9、10、13、16、17、33、38、43和44)在Ser77发生磷酸化,有3种GHPs(6,39和78)在Thr174或Ser176发生磷酸化;而在正常垂体组织中有4种GHPs(11、32、33和56)在Ser132发生了磷酸化。通过这些数据明显地证明了生长激素分泌型垂体腺瘤与正常垂体组织GHPs在磷酸化上的差异性;
在生长激素分泌型垂体腺瘤中,GHP在T78中的肽EETQQKSNLELLR(91-103,K*=Ub96)发生了泛素化,而在对照垂体组织中则没有泛素化。通过这些数据明显地证明了生长激素分泌型垂体腺瘤与正常垂体组织GHPs在泛素化上的差异性;
在生长激素分泌型垂体腺瘤组织中检测到GHP在T30中的肽QTYSK*FDTNSHNDDALLKNYGLLYCFR(167-193,K*=乙酰化Lys171)发生了乙酰化,而在对照垂体组织中没有鉴定到乙酰化。通过这些数据明显地证明了生长激素分泌型垂体腺瘤与正常垂体组织GHPs在乙酰化上的差异性;
在生长激素分泌型垂体腺瘤中,还检测到25种GHPs(1、5、6、8、9、13、14、16、17、18、28、30、34、36、38、39、43、44、53、54、57、58、59、63和67)在残基Asn178(D178)处脱氨,在正常垂体组织中检测到5种GHPs(1、14、31、32和56)在残基Asn178(D178)处脱氨。通过这些数据明显地证明了生长激素分泌型垂体腺瘤与正常垂体组织GHPs在脱氨上的差异性。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。
序列表
<110> 山东第一医科大学(山东省医学科学院)
<120> 一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法
<130> 2020.12.15
<160> 6
<170> SIPOSequenceListing 1.0
<210> 1
<211> 217
<212> PRT
<213> GH前体(GH Precursor)
<400> 1
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala Phe Pro Thr Ile Pro Leu
20 25 30
Ser Arg Leu Phe Asp Asn Ala Met Leu Arg Ala His Arg Leu His Gln
35 40 45
Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu Glu Ala Tyr Ile Pro Lys
50 55 60
Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro Gln Thr Ser Leu Cys Phe
65 70 75 80
Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg Glu Glu Thr Gln Gln Lys
85 90 95
Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu Leu Leu Ile Gln Ser Trp
100 105 110
Leu Glu Pro Val Gln Phe Leu Arg Ser Val Phe Ala Asn Ser Leu Val
115 120 125
Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp Leu Leu Lys Asp Leu Glu
130 135 140
Glu Gly Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
145 150 155 160
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
165 170 175
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
180 185 190
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
195 200 205
Arg Ser Val Glu Gly Ser Cys Gly Phe
210 215
<210> 2
<211> 191
<212> PRT
<213> 成熟GH(GH maturation)
<400> 2
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser Val
85 90 95
Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp
100 105 110
Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg Leu
115 120 125
Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser
130 135 140
Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn Tyr
145 150 155 160
Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr Phe
165 170 175
Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
180 185 190
<210> 3
<211> 191
<212> PRT
<213> GH剪接变异体1(GH Splice variant 1)
<400> 3
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser Val
85 90 95
Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp
100 105 110
Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg Leu
115 120 125
Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser
130 135 140
Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn Tyr
145 150 155 160
Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr Phe
165 170 175
Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
180 185 190
<210> 4
<211> 176
<212> PRT
<213> GH剪接变异体2(GH Splice variant 2)
<400> 4
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Asn
20 25 30
Pro Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn
35 40 45
Arg Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser
50 55 60
Leu Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser
65 70 75 80
Val Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr
85 90 95
Asp Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg
100 105 110
Leu Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr
115 120 125
Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn
130 135 140
Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr
145 150 155 160
Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
165 170 175
<210> 5
<211> 153
<212> PRT
<213> GH剪接变异体3(GH Splice variant 3)
<400> 5
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Thr Leu Met Gly Arg Leu Glu Asp Gly Ser Pro Arg
85 90 95
Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser Lys Phe Asp Thr Asn Ser
100 105 110
His Asn Asp Asp Ala Leu Leu Lys Asn Tyr Gly Leu Leu Tyr Cys Phe
115 120 125
Arg Lys Asp Met Asp Lys Val Glu Thr Phe Leu Arg Ile Val Gln Cys
130 135 140
Arg Ser Val Glu Gly Ser Cys Gly Phe
145 150
<210> 6
<211> 145
<212> PRT
<213> GH剪接变异体4(GH Splice variant 4)
<400> 6
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Ile Phe Lys Gln Thr
85 90 95
Tyr Ser Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys
100 105 110
Asn Tyr Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu
115 120 125
Thr Phe Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly
130 135 140
Phe
145
- 一种鉴定人生长激素蛋白质存在形式生物标志物谱的方法
- 基于质谱技术发现浅表性胃炎多肽谱生物标志物的一种无创快捷的筛选方法及其应用
