脂肪的放射组学标签
文献发布时间:2023-06-19 11:32:36
技术领域
本发明涉及表征脂肪组织的方法,具体地使用放射组学标签和用于所述方法的系统。本发明还涉及导出此类标签的方法和用于所述方法的系统。
背景技术
尽管脂肪组织功能障碍在糖尿病、肥胖症和相关血管疾病风险的发病机理中处于中心地位,但除执行侵入性活检外,目前尚缺乏研究其生物学的方法。
已知用于对脂肪组织进行成像的技术(例如,参见Wang,H.、Chen,Y.E.&Eitzman,D.T.“对人体脂肪进行成像:技术和心血管代谢影响(Imaging body fat:techniques andcardiometabolic implications)”《动脉硬化、血栓形成和血管生物学(Arteriosclerosis,thrombosis,and vascular biology)》34,2217-2223,doi:10.1161/ATVBAHA.114.303036(2014);Christen,T.等人“通过PET成像显示内脏相对于皮下脂肪组织中的葡萄糖摄取增加(Increased glucose uptake in visceral versus subcutaneousadipose tissue revealed by PET imaging)”《JACC.心血管成像(JACC.Cardiovascularimaging)》3,843-851,doi:10.1016/j.jcmg.2010.06.004(2010);Ran,C.等人“通过TSPO示踪剂对人棕色脂肪组织的PET成像(PET Imaging of Human Brown Adipose Tissue withthe TSPO Tracer)”[(11)C]PBR28.《分子成像和生物学:MIB:分子成像学院的官方出版物(Molecular imaging and biology:MIB:the official publication of the Academy ofMolecular Imaging)》,doi:10.1007/s11307-017-1129-z(2017))。具体地,计算机化断层扫描现在用于对人脂肪组织进行成像,例如以定量脂肪量。
然而,尽管可以使用体积方法可靠地描述和定量人体肥胖,但其与脂肪组织生物学特征间接地联系或很少联系。脂肪组织功能障碍在胰岛素抵抗和肥胖相关血管疾病的发展中起着核心作用。然而,脂肪自身的膨胀并不总是导致胰岛素抵抗的发展,这取决于脂肪组织生物学的各个方面,如脂肪细胞增生或肥大、脂肪形成能力、脂肪组织炎症和纤维化。结果,不能通过简单的人体肥胖的体积定量来准确地捕获脂肪组织生物学表型。
内脏或皮下脂肪的平均放射密度最近已被提出作为脂肪组织质量的简单量度,这与临床队列中的心血管风险独立相关(参见Rosenquist,K.J.等人“内脏和皮下脂肪质量与心血管代谢风险(Visceral and subcutaneous fat quality and cardiometabolicrisk)”《JACC.心血管成像》6,762-771,doi:10.1016/j.jcmg.2012.11.021(2013))。可以使用其它方法(如PET/CT成像)来研究脂肪组织代谢活性(例如,通过定量18F-FDG摄取),但是PET受其可用性、成本和高辐射暴露的限制。
迄今为止,还没有通过非侵入性手段对脂肪组织生物学进行充分表型化的方法。因此,对于用于检测脂肪组织功能障碍和评估肥胖相关的代谢负担的非侵入性方法存在未满足的需求。
发明内容
根据本发明的第一方面,提供了一种用于表征包括脂肪组织的所关注区域(例如,其表型,例如,组成和/或纹理)的方法。所述方法可以用于鉴定或诊断脂肪组织功能障碍,或用于鉴定脂肪组织功能障碍的表型特性。所述方法可以包括使用医学成像数据来计算所述所关注区域的放射组学标签的值。可以基于所关注区域的多个放射组学特征的测量值来计算放射组学标签。放射组学特征的测量值可以根据医学成像数据来计算。
放射组学标签可以提供所关注区域或脂肪组织的纹理的度量。放射组学特征中的至少一个可以提供所关注区域或脂肪组织的纹理的度量。例如,放射组学特征中的至少一个可以是纹理统计量。
放射组学标签(即其值)可以指示脂肪组织功能障碍,具体地所关注区域的脂肪组织或与之相关(例如,统计学上显著地与其相关)。可替代地,放射组学标签可以指示脂肪组织功能障碍的替代标志物或与之相关,例如与脂肪组织功能障碍相关的代谢病症、脂肪组织功能障碍的表型特性或与脂肪组织功能障碍相关的基因表达谱。
放射组学标签(即其值)可以预测受试者患上代谢病症的可能性,具体地与脂肪组织功能障碍(如糖尿病或胰岛素抵抗)相关的代谢病症。
所述多个放射组学特征可以包括选自聚类1到聚类5的所述放射组学特征的至少两个放射组学特征,其中所述至少两个放射组学特征各自选自不同的组,并且其中:
组1由以下组成:大依赖性低灰度级重点、和均值、联合均值、高灰度级重点、短游程高灰度级重点、自相关性和高灰度级游程重点;
组2由以下组成:总能量HHL、能量HHL、尺寸区非均匀性HHH、尺寸区非均匀性HLH、尺寸区非均匀性LHH、归一化灰度级非均匀性HHL(GLDM)、逆方差HHL、归一化灰度级非均匀性HHL(GLSZM)、尺寸区非均匀性LHL、游程长度非均匀性HHH、尺寸区非均匀性HLL、依赖性非均匀性HHL、归一化灰度级非均匀性HHH(GLDM)、逆差矩HHH、逆差HHH、非均匀性HHH、相关性的信息度量2、逆方差HHH、总能量LHL、尺寸区非均匀性、球度、尺寸区非均匀性LLH、归一化游程长度非均匀性HHL、归一化灰度级非均匀性HHH(GLSZM)、归一化依赖性非均匀性HHL、区百分比HHL、小依赖性重点HHL、归一化尺寸区非均匀性HHL、小面积重点HHL、相关性、依赖性非均匀性LHH、总能量LHH、短游程重点HHH、归一化游程长度非均匀性HHH、依赖性非均匀性LHL、逆差LHH、逆差矩LHH、小依赖性重点HHH、依赖性方差HLH、游程百分比HHH、区百分比HHH、逆差LHL、依赖性非均匀性HLH、逆方差LHH、大依赖性重点HLH、归一化游程长度非均匀性HLH、短游程重点HLH、归一化依赖性非均匀性HLH、差方差、长游程重点HLH、能量LHL、对比度(GLCM)、游程百分比HLH、联合熵LHH、差熵、小依赖性重点HLH、归一化尺寸区非均匀性HLH、小面积重点HLH、差熵LHH、差均值、游程方差HLH、逆差矩、逆差、逆方差、游程熵LHH、熵LHH、区百分比HLH、和熵LHH、归一化逆差矩、归一化逆差、小依赖性低灰度级重点、能量LHH、联合熵LHL、小面积低灰度级重点、强度、依赖性非均匀性LLH、游程长度非均匀性HHL、归一化灰度级非均匀性LHL(GLDM)、忙碌度、归一化依赖性非均匀性LHH、小依赖性重点LHH、粗度、区百分比LHH、归一化依赖性非均匀性LHL、游程长度非均匀性HLH、小依赖性重点LHL、联合熵、小面积重点LHL、归一化尺寸区非均匀性LHL、短游程重点HLL、游程长度非均匀性LHH、归一化游程长度非均匀性HLL、大依赖性重点HLL、长游程重点HLL、游程百分比HLL、依赖性方差HLL、依赖性非均匀性HLL、区百分比HLL、依赖性非均匀性、依赖性非均匀性HHH、归一化依赖性非均匀性LLH、低灰度级区重点和短游程低灰度级重点;
组3由以下组成:依赖性熵、区熵、相关性、相关性的信息度量2、区百分比HHH、小依赖性重点HHH、游程百分比HHH、归一化依赖性非均匀性LHL、小依赖性重点LHL、区百分比HHL、小依赖性高灰度级重点、小依赖性重点HHL、归一化依赖性非均匀性HHL、短游程重点HHH、归一化游程长度非均匀性HHH、归一化游程长度非均匀性HHL、归一化尺寸区非均匀性LHL、小面积重点LHL、归一化尺寸区非均匀性HHL、小面积重点HHL、区百分比HLH、游程方差HLH、小依赖性重点HLH、长游程重点HLH、归一化尺寸区非均匀性LLH、小面积重点LLH、归一化尺寸区非均匀性HLH、小面积重点HLH、游程百分比HLH、归一化游程长度非均匀性HLH、短游程重点HLH、大依赖性重点HLH、区百分比LHH、小依赖性重点LLH、小依赖性重点LHH、归一化依赖性非均匀性HLH、区百分比LLH、依赖性方差HLH、归一化依赖性非均匀性LLH、归一化依赖性非均匀性LHH、逆差LHL、逆差矩HHH、逆差HHH、均匀性HHH、归一化灰度级非均匀性LHL(GLSZM)、归一化灰度级非均匀性HHH(GLDM)、归一化灰度级非均匀性HHL(GLDM)、联合熵LHL、归一化逆差、归一化逆差矩、长游程重点HLL、区百分比HLL、逆差、逆差矩、差均值、游程百分比HLL、大依赖性重点HLL、对比度(GLCM)、短游程重点HLL、归一化游程长度非均匀性HLL、逆方差、逆方差HHL、差熵、依赖性方差HLL、逆差矩LHH、差方差、熵LHH、逆方差LHH、逆差LHH、逆方差HHH、和熵LHH、联合熵LHH、归一化灰度级非均匀性HHH(GLSZM)、归一化灰度级非均匀性HHL(GLSZM)、差熵LHH和游程熵LHH;
组4由平均值LLL、中值LLL和能量LLL组成;并且
组5由游程熵组成。
所述至少两个放射组学特征可以包括以下中的至少两个:大依赖性低灰度级重点、总能量HHL、依赖性熵、平均值LLL和游程熵。所述至少两个放射组学特征可以由五个放射组学特征组成,所述五个放射组学特征可以由以下组成:大依赖性低灰度级重点、总能量HHL、依赖性熵、平均值LLL和游程熵。
所述至少两个放射组学特征可以选自聚类A到聚类C的所述放射组学特征,其中所述至少两个放射组学特征各自选自不同的聚类,并且其中:
聚类A由组1到组3的所述放射组学特征组成;
聚类B由组4的所述放射组学特征组成;并且
聚类C由组5的所述放射组学特征组成。
所述多个放射组学特征可以包括选自聚类A到聚类C的所述放射组学特征的至少两个放射组学特征,其中所述至少两个放射组学特征各自选自不同的聚类,并且其中:
聚类A由以下组成:大依赖性低灰度级重点、游程熵、依赖性熵、聚类阴影、偏度、游程方差HLH、体素数和灰度级非均匀性;
聚类B由以下组成:平均值LLL、中值LLL、联合均值、中值、复杂度、长游程高灰度级重点、球度、峰度和粗度HHH;并且
聚类C由以下组成:主轴、小依赖性高灰度级重点、短轴、能量LLL、最大2D直径行、长游程低灰度级重点、总能量HHL、归一化依赖性非均匀性HHH、对比度(GLCM)、表面体积比、和熵、归一化尺寸区非均匀性HHH、聚类突出LHH、对比度LLH(GLCM)和能量LHL。
所述多个放射组学特征可以包括选自以下的至少两个放射组学特征:大依赖性低灰度级重点、游程熵、依赖性熵、聚类阴影、偏度、游程方差HLH、体素数、灰度级非均匀性、平均值LLL、中值LLL、联合均值、中值、复杂度、长游程高灰度级重点、球度、峰度、粗度HHH、主轴、小依赖性高灰度级重点、短轴、能量LLL、最大2D直径行、长游程低灰度级重点、总能量HHL、归一化依赖性非均匀性HHH、对比(GLCM)、表面体积比、和熵、归一化尺寸区非均匀性HHH、聚类突出LHH、对比度LLH(GLCM)和能量LHL。
所述至少两个放射组学特征可以包括至少三个放射组学特征。所述至少两个放射组学特征可以包括至少四个放射组学特征。所述至少两个放射组学特征可以包括至少五个放射组学特征。
医学成像数据可以包括对应于至少所关注区域的多个体素中的每个体素的衰减值。
可以根据衰减值的小波变换来计算所述多个放射组学特征中的至少一个。
所述方法可以进一步包括根据医学成像数据或使用医学成像数据来鉴定所关注区域。可以使用手动轮廓鉴定所关注区域。所关注区域可以被鉴定为仅包含医学成像数据的体素,所述体素具有的衰减值属于给定的衰减值范围内。给定范围可以从约-190亨氏单位(Hounsfield Unit)到约-30亨氏单位。
所述方法可以进一步包括分割所关注区域。所述方法可以进一步包括根据分割的所关注区域计算放射组学特征的值。
所述方法可以进一步包括至少基于至少所述放射组学标签的计算值来预测所述受试者患上代谢病症的风险。代谢病症可以是糖尿病或胰岛素抵抗。
所述方法可以进一步包括基于至少所述放射组学标签的计算值来确定或诊断受试者是否患有脂肪组织功能障碍或脂肪组织功能障碍的表型特性(例如,纤维化或炎症)。
所述放射组学标签可以包括所述多个放射组学特征的加权和。所述放射组学标签可以与放射组学特征的加权和线性相关。
根据本发明的第二方面,提供了一种用于导出放射组学标签的方法。所述放射组学标签可以指示脂肪组织功能障碍。放射组学标签可以适合于鉴定或诊断脂肪组织功能障碍。所述方法可以包括使用放射组学数据集来构建指示脂肪组织功能障碍的放射组学标签。可以基于第二多个放射组学特征来计算放射组学标签。数据集可以包括从所关注区域的医学成像数据获得的第一多个放射组学特征的值,所关注区域包括多个个体中的每个个体的脂肪组织。所述多个个体可以包括被鉴定为患有脂肪组织功能障碍(具体地在收集或记录医学成像数据时)的第一组个体和被鉴定为不患有脂肪组织功能障碍的第二组个体(具体地在收集或记录医学成像数据时)。第二多个放射组学特征可以选自第一多个放射组学特征,具体地如根据数据集或使用数据集(例如,使用机器学习算法)所确定的,提供指示脂肪组织功能障碍的放射组学标签。
至少部分地基于脂肪组织功能障碍的标志物,可以将个体中的每个个体鉴定为患有或不患有脂肪组织功能障碍。放射组学数据集可以进一步包括脂肪组织功能障碍的标志物。
对于所述多个个体中的每个个体,标志物可以是或可以包括或可以指示存在或不存在与脂肪组织功能障碍相关的代谢病症,例如糖尿病或胰岛素抵抗(即,区分个体中的每个个体是否患有或不患有代谢病症的信息)。
标志物可以包括与脂肪组织功能障碍例如纤维化或炎症相关的脂肪组织的表型特性。
标志物可以包括与脂肪组织功能障碍相关的脂肪组织的表型特性的替代标志物,如选择的基因表达谱。具体地,替代标志物可以是或可以包括基因表达谱,所述基因表达谱是脂肪组织功能障碍的表型特性的标志物。
所述方法可以进一步包括如根据数据集所述确定的,鉴定彼此不共线的第一多个放射组学特征的第一子集。第二多个放射组学特征可以包括至少两个放射组学特征,所述至少两个放射组学特征各自被选择为属于第一子集的不同放射组学特征或与之共线或高度相关(如根据数据集所确定的)。
所述方法可以进一步包括使用第一特征选择算法(例如,第一机器学习特征选择算法)从计算放射组学标签应该基于的(即最佳特征)第一子集中鉴定放射组学特征的第二子集。换句话说,例如当基于放射组学特征的第二子集(已优化)来计算放射组学标签时,预测放射组学特征的第二子集以使放射组学标签的准确性(例如,优化或最大化放射组学标签与脂肪组织功能障碍的关联性)最大化。放射组学特征的第二子集可以使初步放射组学标签与脂肪组织功能障碍的关联性(当基于放射组学特征的第二子集计算出初步放射组学标签时)最大化,如根据数据集所确定的。所述至少两个放射组学特征可以被选择为属于第二子集的不同放射组学特征或与之共线(如根据数据集所确定的)。至少两个放射组学特征可以包括属于第二子集的所有放射组学特征,或者其共线等效物,所述共线等效物与放射组学特征共线,如根据数据集所确定的。换句话说,至少两个放射组学特征可以包括属于第二子集的放射组学特征中的每个放射组学特征或与其共线的放射组学特征。
如根据数据集所确定的,至少两个(或第二多个)放射组学特征中的每个放射组学特征可以被选择为稳定的。在选择第二多个放射组学特征之前,可以从第一多个放射组学特征中移除所有不稳定的放射组学特征。
如果针对放射组学特征的组内相关性系数(例如,扫描-再扫描和/或多重描绘)小于稳定性阈值(例如,如根据数据集所确定的),则可以将放射组学特征鉴定为不稳定的。稳定性阈值可以是至少约0.9。
所述方法可以进一步包括通过(例如,使用聚类算法,具体地机器学习聚类算法)执行聚类分析例如相关性聚类分析,来鉴定第一多个放射组学特征(例如,放射组学特征的第一子集)的多个聚类。第二多个或至少两个放射组学特征可以各自选自不同的聚类或选择与来自不同的聚类的放射组学特征共线。聚类分析可以基于放射组学特征之间的相关性强度来鉴定聚类。聚类内相关性可以比聚类间相关性更强。例如,每个聚类内的放射组学特征与各自的相关程度可以比它们与其它聚类中的放射组学特征的相关程度更大。
聚类分析可以是分层聚类分析、k平均值聚类分析、基于分布的聚类分析或基于密度的聚类分析。具体地,聚类分析可以是分层聚类分析。例如,在相关性图中,聚类分析,例如聚类算法,可以基于放射组学特征之间的距离,例如放射组学特征之间的平方欧几里德距离(Euclidean distance),鉴定聚类。聚类算法可以基于相关性空间中特征之间的距离来鉴定聚类,其中每对特征之间的距离对应于那些特征相关的程度,即,两个特征在相关性空间中越接近,它们彼此就越相关。
所述方法可以包括鉴定放射组学特征的多个聚类。每个聚类可以包括所述多个放射组学特征的子集。每个聚类可以包含原始放射组学特征,利用所述原始放射组学特征,所述聚类中的其它放射组学特征中的每个放射组学特征被选择为共线的,例如,如根据数据集所确定或计算的。至少两个放射组学特征可以各自选自不同的聚类。
可以选择原始放射组学特征中的每个原始放射组学特征与其它聚类中的任何聚类的原始放射组学特征中的任何原始放射组学特征不共线,例如,如根据数据集所确定或计算的。
可以选择每个聚类中放射组学特征中的每个放射组学特征与同一聚类中的所有其它放射组学特征共线,例如,如根据数据集所确定或计算的。
可以选择原始放射组学特征中的每个原始放射组学特征与临床终点显著相关,例如,如根据数据集所确定或计算的。
可以选择原始放射组学特征中的每个原始放射组学特征与其聚类中所有放射组学特征的临床终点密切相关,例如,如根据数据集所确定或计算的。
可以选择至少两个放射组学特征彼此不共线,例如,如根据数据集所确定或计算的。
所述方法可以包括鉴定放射组学特征的多个组。每个组可以包括所述第一多个放射组学特征的子集。每个组可以包含原始放射组学特征(例如,第一子集之一),利用所述原始放射组学特征,所述组中的其它放射组学特征中的每个放射组学特征被选择为共线的,例如,如根据数据集所确定或计算的。第二多个放射组学特征,例如至少两个放射组学特征,可以各自选自不同的组。
可以选择原始放射组学特征中的每个原始放射组学特征与其它组中的任何组的原始放射组学特征中的任何原始放射组学特征不共线,例如,如根据数据集所确定或计算的。
可以选择每个组中放射组学特征中的每个放射组学特征与同一组中的所有其它放射组学特征共线,例如,如根据数据集所确定或计算的。
可以选择第二多个或至少两个放射组学特征彼此不共线,例如,如根据数据集所确定或计算的。
如果两个放射组学特征的相关程度至少等于相关性阈值,则可以将它们鉴定为彼此共线,如根据数据集所确定的。可以使用斯皮尔曼(Spearman)的rho系数来计算相关性阈值。相关性阈值可以为至少约|rho|=0.75,例如至少约|rho|=0.9。如果两个放射组学特征的相关程度为至少约|rho|=0.75,则可以将它们鉴定为高度相关。
放射组学标签可以被构建成与脂肪组织功能障碍相关,如根据数据集所确定的。例如,所述放射组学标签可以被构建成与脂肪组织功能障碍显著相关。如果放射组学标签与高于显著性阈值的脂肪组织功能障碍相关,则可以将其鉴定为与脂肪组织功能障碍显著相关。显著性阈值为至少约α=0.05。可以基于或使用受试者工作特性(ROC)曲线分析,具体地使用曲线下的面积(AUC)测量(即,C统计量)来计算放射组学标签与AT功能障碍的关联性。
构建放射组学标签的步骤可以包括细化第二多个放射组学特征中的每个放射组学特征对放射组学标签的作用,以增加放射组学标签与脂肪组织功能障碍的关联性,如根据数据集所确定的。
可以将数据集划分为训练队列数据集和验证队列数据集,并且构建放射组学标签的步骤可以包括使用至少用于训练队列的数据导出标签,以及使用用于验证队列的数据验证标签。
可以使用机器学习算法来执行构建所述放射组学标签的步骤。所述方法可以包括使用机器学习算法从第一多个放射组学特征中,具体地从第一子集中选择第二多个放射组学特征,以提供指示脂肪组织功能障碍的放射组学标签,如根据数据集所确定的。
可以使用多倍交叉验证来执行构建所述放射组学标签的步骤。构建放射组学标签的步骤可以使用递归特征消除来执行,例如利用随机森林算法。可以使用逻辑回归来执行构建所述放射组学标签的步骤。
例如,构建放射组学标签的步骤可以包括例如使用特征选择机器学习算法来鉴定要包含在标签中的放射组学特征的子集。特征选择可以使用递归特征消除来执行,例如使用随机森林算法。然后,构建放射组学标签的步骤可以包括基于在特征选择步骤中鉴定出的放射组学特征的子集(例如,第二子集),例如使用逻辑回归,再次任选地使用机器学习算法,来细化或优化放射组学标签。例如,第二机器学习算法(例如,放射组学标签优化算法,如逻辑回归算法)可以用于细化或优化使用放射组学特征的子集计算出的放射组学标签,例如使用多倍交叉验证。换句话说,第二机器学习算法细化或优化基于放射组学特征的子集计算的放射组学标签。
所述放射组学标签可以包括所述第二多个放射组学特征的加权和。所述放射组学标签可以与第二多个放射组学特征的加权和线性相关。
构建放射组学标签的步骤可以包括调整第二多个放射组学特征中的每个放射组学特征的相对加权,以增加放射组学标签与脂肪组织功能障碍的关联性,如根据数据集所确定的。
放射组学标签可以被构建成提供所关注区域的纹理的度量。
第二多个放射组学特征中的至少一个(例如,至少两个放射组学特征之一)可以提供所关注区域的纹理的度量。例如,第二多个放射组学特征中的至少一个可以是纹理统计量。例如,第二多个放射组学特征中的每个放射组学特征可以提供所关注区域的纹理的度量(即,放射组学特征中的每个放射组学特征可以是纹理统计量)。
所述方法可以进一步包括配置用于计算患者的所述放射组学标签的所述值的系统,具体地针对包括脂肪组织的患者的所关注区域。例如,所述方法可以进一步包括配置系统,所述系统用于通过计算针对患者或受试者所导出的放射组学标签的值来表征患者或受试者的所关注区域。所述系统可以被配置成使用或基于患者或受试者的至少一个所关注区域的医学成像数据来计算所导出的放射组学标签的值。所述系统可以被配置成使用或至少基于患者或受试者的所关注区域的第二多个放射组学特征的值来计算所导出的放射组学标签的值。
因此,所述方法可以是用于导出放射组学标签并且配置用于使用所导出的放射组学标签来表征患者的所关注区域(包括脂肪组织)的系统。
所述系统可以被配置成接收医学成像数据或第二多个放射组学特征的值作为输入。所述系统可以被配置成输出(例如,显示)放射组学标签的计算值或基于放射组学标签的计算值的值。所述系统可以被配置成输出患者是否患有脂肪组织功能障碍的指示。所述系统可以被配置成输出患者患上代谢病症的风险的指示。所述系统可以是计算机系统。
所述方法可以包括提供用于配置系统的指令,所述系统用于计算针对患者或受试者的所导出的放射组学标签的值。
所述方法可以进一步包括针对患者或受试者的所关注区域计算所导出的放射组学标签的值。例如,所述方法可以进一步包括通过计算针对所导出的放射组学标签的值来表征患者或受试者的所关注区域。可以基于或使用患者或受试者的至少所关注区域的医学成像数据来计算所导出的放射组学标签的值。可以使用或至少基于患者或受试者的所关注区域的第二多个放射组学特征的值来计算所导出的放射组学标签的值。患者的所关注区域包括脂肪组织。
因此,所述方法可以是用于导出放射组学标签并且用于使用所导出的放射组学标签来表征所关注区域。
医学成像数据可以是射线照相数据。医学成像数据可以是计算机断层扫描数据。
脂肪组织可以是皮下脂肪组织。脂肪组织可以是内脏脂肪组织。脂肪组织可以是胸部脂肪组织。
脂肪组织可以包括非心血管脂肪组织(即,非心脏或非血管脂肪组织)或由其组成。例如,脂肪组织可以包括非心外膜、非心包膜或非血管周脂肪组织或由其组成。例如,脂肪组织可以包括非心血管脂肪组织的大部分(即,按体积计大于约50%)。例如,脂肪组织可以包括基本上非心血管脂肪组织。例如,脂肪组织可以包括小于约10%(按体积计)的心血管脂肪组织,具体地小于约5%的心血管脂肪组织。
可替代地,所关注区域可以远离(即不邻近或不附接到)心血管系统。例如,所关注区域可以远离如心脏等心血管器官和血管,具体地动脉和静脉。脂肪组织可以不是心脏或血管脂肪组织。例如,脂肪组织可以不是心外膜、心包膜或血管周脂肪组织。
除了上文所提到的至少两个放射组学特征之外,还可以基于所关注区域的另外的放射组学特征来计算本发明的放射组学标签。例如,放射组学标签可以包括除至少两个放射组学特征之外的其它放射组学特征。因此,可以说放射组学标签是基于多个放射组学特征计算的,并且所述多个放射组学特征可以包括至少两个放射组学特征。
本发明的方法还可以包括根据医学成像数据计算放射组学特征的步骤。
根据本发明的第三方面,提供了一种被配置成执行如上文所描述的方法中的任何方法的系统。所述系统可以是计算机系统。所述系统可以包括被配置成执行所述方法的步骤的处理器。所述系统可以包括装载有用于执行所述方法的步骤的可执行指令的存储器。
根据本发明的第四方面,提供了放射组学标签用于上文所描述的目的中的任何一个的用途,例如用于表征所关注区域,检测脂肪组织功能障碍或预测患上代谢病症的风险。可以基于所关注区域的多个放射组学特征的测量值来计算放射组学标签。
医学成像数据可以是射线照相数据。医学成像数据可以是计算机断层扫描数据。
附图说明
现在将参考附图描述本发明,其中:
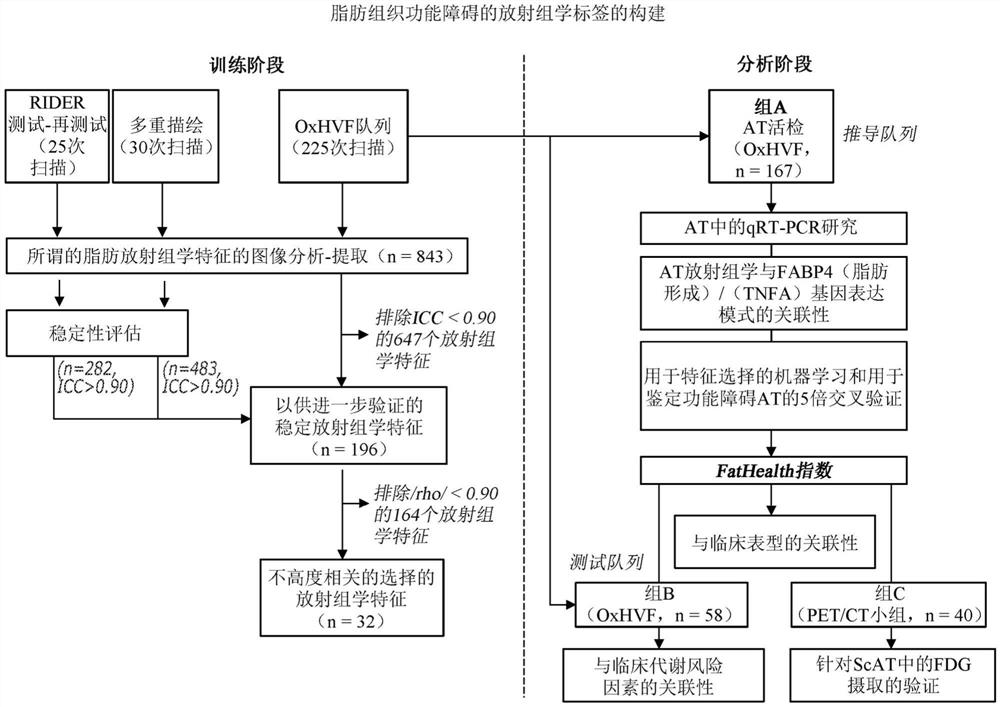
图1概述了导出放射组学标签的方法。分析阶段包含总共225例接受冠状动脉搭桥术的患者。非对比增强计算机断层扫描(CT)图像用于将脂肪组织放射组学特征与组织生物学联系起来。分析中仅包含稳定的放射组学特征(即,那些在训练阶段示出类内相关性系数(ICC)≥0.90的放射组学特征)。使用五重交叉验证的机器学习算法对与脂肪组织生物学相关的放射组学特征进行内部验证。然后,在小组(Arm)2中外部地验证主要放射组学特征作为针对
图2展示了脂肪组织放射组学特征的主成分分析的各方面。图2(a)是由前86个主成分说明的变异百分比的陡坡图,所述变异占小组1(225个患者的843个放射组学特征)变异的99.5%。图2(b)是三个主要主成分的成分图。图2(c)是小组1患者的脂肪组织中前三个成分与人口统计学、生化特性(n=225)和基因表达谱模式(n=167)的相关性图。
图3展示了患者和放射组学特征的无监督分层聚类的各方面。图3(a)展示了在小组1群体中使用196个稳定的放射组学特征(在稳定性评估之后),小组1患者的无监督分层聚类。X轴表示不同的放射组学特征,并且Y轴表示观测数(n=225个患者)。行树状图表示两个不同的患者聚类。图3(b)是示出了选择的放射组学特征(稳定性评估后,n=196)之间的欧几里得距离(即,非相似性)的类似性-非类似性图,用于视觉识别小组1队列患者中的可能聚类。图3(c)是排除高度相关(即,共线)特征(|rho|>0.90)之后的32个经过滤的(非共线)放射组学特征的相关性图。卡方的P值。
图4展示了通过使用放射组学标签的放射组学表型对脂肪组织功能障碍的检测。图4(a)和(b)分别展示了脂肪组织基因表达谱(FABP4是脂肪细胞分化的替代标志物,并且TNFA是炎症的替代标志物)与非糖尿病患者的糖尿病和胰岛素抵抗(HOMO-IR)的关联性。图4(c)和(d)展示了多变量逻辑回归模型分别对同一患者脂肪组织中高FABP4和TNFA表达的敏感性,证明了分别用于检测脂肪细胞分化和脂肪组织炎症状态的放射组学标签的鉴别价值的递增。图4(e)展示了通过使用递归特征消除(RFE)进行机器学习的放射组学标签构建的各方面,所述递归特征消除具有五重交叉验证,并且选择了主要放射组学特征以检测脂肪组织功能障碍。图4(f)证明了通过临床风险因素、肥胖指数和胰岛素抵抗稳态模型(HOMA-IR)来检测脂肪组织功能障碍的主要放射组学特征的递增诊断价值。
图5展示了包括脂肪组织的所关注区域(在这种情况下是皮下区域)的放射组学标签可以用作脂肪组织健康和代谢风险的放射组学生物标志物。图5(a)示出了基于FABP4和TNFA的表达水平,本发明的放射组学标签(被称为“FatHealth”)与脂肪组织分化/炎症表型的关联性。图5(b)绘制了通过放射组学标签(FatHealth)对功能障碍的脂肪组织进行分类的逻辑回归。分别使用图5(c)和(d)中的盒须图展示了小组1患者的派生和测试队列中心脏代谢风险因素(即,吸烟、高血压、糖尿病)数量和FatHealth之间的关联性。图5(e)展示了PET/CT成像中皮下脂肪组织对18-氟脱氧葡萄糖摄取的放射组学标签(FatHealth)的外部验证,并且图5(f)展示了放射组学标签对高脂肪组织炎症的诊断准确性(定义为最高三分位数中的组织与背景之比)。AUC:曲线下面积;TBR:靶本底比值。
具体实施方式
发明人已经发现,基于包括脂肪组织的所关注区域(ROI)的两个或更多个放射组学特征计算的放射组学标签(也被称为“分数”或“指数”)与脂肪组织(AT)的不同生物学表型独立关联,所述生物学表型与AT功能障碍相关。通常,如本文所使用的,“相关”可以被理解为意指“统计上相关”,例如“统计上显著相关”。具体地,放射组学标签能够区分具有AT功能障碍的特性的基因标志物的表达,如脂肪细胞的分化和脂肪组织炎症。因此,本发明的放射组学标签优选地基于包括AT的所关注区域的两个或更多个放射组学特征来计算,并且提供了用于表征所关注区域(具体地脂肪(fat)或脂肪(adipose))以及用于非侵入性检测或鉴定脂肪组织功能障碍的工具。
本发明的放射组学标签可以单独用于表征所关注区域以提供诊断或预后信息,或者其可以与现有模型和风险因素结合使用,如年龄、性别、高血压、血脂异常、吸烟、糖尿病、体重指数、稳态模型评估胰岛素抵抗(HOMA-IR)指数和/或皮下脂肪量。
本发明利用以下发现:脂肪组织中的特定成像模式(例如,与组织纹理和放射密度有关)与脂肪组织特性的不同生物学表型和基因标志物或指示AT功能障碍(如脂肪细胞分化和脂肪组织炎症)的表型有关。本发明的放射转录组学方法提供了非侵入性地检测、鉴定或诊断脂肪组织功能障碍的手段,所述脂肪组织功能障碍迄今为止只有通过侵入性手段如脂肪活检才可行。本发明的放射组学标签可以用于评估脂肪组织健康或鉴定脂肪功能障碍,捕获风险因素对脂肪组织生物学的影响,这在内分泌学和糖尿病领域具有价值。因此,放射组学标签可以用作代谢风险(例如心脏代谢风险)的量度或预测代谢风险。例如,本发明的放射组学标签可以用于根据患者的代谢风险,即他们发生代谢病症,如糖尿病(糖尿病),具体地II型糖尿病的风险,对患者进行分类。本发明的放射组学标签可以用于评估对治疗干预的应答。例如,可以在针对代谢病症的一轮治疗之前计算放射组学标签,并且然后在该轮治疗之后,标签差异用于评估对治疗的应答。
本发明的放射组学标签利用了以下发现:除了简单的脂肪量测量之外,脂肪纹理(即,空间不均匀性或变异性)与代谢风险和脂肪组织功能障碍的特征有关。因此,本发明的放射组学标签可以被构建成提供所关注区域的纹理的度量。因此,如果ROI是皮下区域,则本发明的放射组学标签也可以被称为纹理指数,例如皮下纹理指数(STI)。
所关注区域(ROI)是包括脂肪组织的个人的(即,患者的)身体的区域或体积。因此,ROI可以是AT的区域或体积,或者可以包括AT或由AT组成。脂肪组织可以是皮下脂肪组织(ScAT)、内脏(或腹部)脂肪组织或胸部脂肪组织。具体地,脂肪组织可以是皮下脂肪组织,所述皮下脂肪组织受邻近器官的生物学影响最小。皮下组织,也被称为下皮,是位于皮肤附近和下方的组织。组织是复杂的生物结构,并且可以包括细胞(例如,脂肪细胞、神经元等)以及可能占据细胞间空间的细胞外结构和物质(如水)。例如,皮下脂肪组织通常包括成纤维细胞、脂肪细胞和巨噬细胞。内脏脂肪组织,有时被称为腹部或腹内脂肪组织,位于腹内器官之间的腹腔内。胸部脂肪组织位于胸部(或胸部)腔内。
优选地,ROI包括非心血管脂肪组织或由其组成。例如,脂肪组织可以包括非心血管脂肪组织的大部分(即,基于脂肪组织的总体积,按体积计大于50%)。例如,脂肪组织可以包括基本上非心血管脂肪组织。例如,脂肪组织可以包括小于10%(按体积计,基于脂肪组织的总体积)的心血管脂肪组织,具体地小于5%(按体积计)的心血管脂肪组织。脂肪组织可以被定义为ROI中具有给定范围内(如约-190Hu到约-30HU)的放射密度的所有体素。心血管脂肪组织是与心血管系统相关(即,与之相邻、附接或与其一部分)的脂肪组织。具体地,心血管脂肪组织包括心脏(即,心脏)脂肪和血管脂肪。例如,心血管脂肪可以指心外膜、心包和血管周脂肪组织。因此,所关注区域可以不含有心血管脂肪组织,具体地所关注区域可以不含有心外膜、心包或血管周脂肪组织,或者可以包括心外膜、心包或血管周脂肪组织以外的脂肪组织。因此,ROI可以不邻近于(即,可以远离或与之间隔开)心血管系统的器官(即,心血管器官如心脏或主要血管如动脉和静脉)。心血管脂肪组织受心血管系统的基础健康影响,具体地受其附接的器官组织(例如,心肌或血管组织)的表型影响。因此,如果ROI包括非心血管脂肪组织或由非心血管脂肪组织组成,则本发明的标签是代谢健康以及与代谢健康有关的脂肪组织功能障碍的更可靠的指标,其反映代谢健康和脂肪本身的健康比心血管脂肪更直接。
本发明采用放射组学方法。放射组学是成像领域,其中使用数据表征化算法从成像数据中提取了大量定量信息。所得特征(被称为放射组学特征)的范围从简单的体积、形状相关或一阶统计量(如平均值或中值衰减)到描述分割体积或区域的纹理以及具有类似或不同衰减值的体素的空间关系的二阶和更高阶统计量。此类特征可以鉴定肉眼无法识别的具有重要临床价值的成像模式,并且具有使非侵入性AT表型的诊断产量最大化的潜力。
基于放射组学特征,例如从医学成像数据中提取的放射组学特征,导出并计算本发明的标签。具体地,从中提取放射组学特征的医学成像数据对应于所关注区域(ROI),并且任选地还对应于邻近或围绕ROI的其它组织,如皮肤。医学成像数据通常包括针对相关区域(在这种情况下为ROI)的多个体素的放射密度(或衰减)值,通常以亨氏单位(HU)表示,并且任选地还包括邻近组织。
医学成像数据优选地是计算机断层扫描(CT)数据,但是可以替代地使用其它形式的医学成像数据(例如,放射线照相数据),所述其它形式的医学成像数据为成像区域的体素提供衰减(或放射密度)数据,如三维计算机分层照像术数据。通常,本发明中使用的医学成像数据是三维成像数据。贯穿以下,在提到CT或另一种医学成像技术的情况下,应当理解,可以可替代地使用其它合适的医学成像技术。
ROI可以由如操作者等人来鉴定,例如通过手动轮廓(描绘)。操作者可以通过检查成像数据(例如CT图像)来鉴定ROI。可替代地,或除了使用手动轮廓鉴定ROI的空间标识外,还可以通过对数据施加射线密度(或衰减)掩码并且将ROI鉴定为仅包含在给定或预先确定范围内具有放射密度的那些体素来鉴定ROI。例如,ROI可以仅包含在亨氏单位范围内具有约-190HU到约+30HU的射线密度并且任选地还位于由操作者鉴定的轮廓区域内的那些体素。具体地,ROI可以被定义为在亨氏单位范围内具有约-190Hu到约-30HU的辐射密度的所有体素。衰减值的此范围通常对应于脂肪组织的放射密度。然而,可以使用或包含其它范围,例如约-30到约+30亨氏单位,其通常对应于水的放射密度。
可以在计算放射组学特征和从分割数据计算出的放射组学特征之前对ROI进行分割。分割体积或区域对应于ROI,并且分割可以移除对应于ROI外部的体素的数据。因此,可以通过鉴定如上文所描述的ROI,并且然后从被鉴定为不属于ROI一部分的数据中移除任何体素,例如对应于周围或邻近组织体素的那些体素,来实现分割。然后可以提取分割ROI,并且将其用于计算放射组学特征。
可以使用计算机程序或软件来执行根据医学成像数据的放射组学特征的计算。出于此目的,存在各种可商购获得的软件包,如3D Slicer(可从http://www.slicer.org获得;参见Fedorov,A.等人“3D Slicer作为定量成像网络的图像计算平台(3D Slicer as animage computing platform for the Quantitative Imaging Network)”《磁共振成像(Magn Reson Imaging)》30,1323-1341,doi:10.1016/j.mri.2012.05.001(2012))。放射组学特征可以是与形状有关的统计量、一阶统计量或纹理统计量(例如,二阶和更高阶统计量)。可以使用ROI体素的原射线密度(HU)值来计算形状相关和一阶放射组学特征。对于计算纹理特征(例如,灰度级共生矩阵[GLCM]、灰度级依赖性矩阵[GLDM]、灰度级游程长度矩阵[GLRLM]、灰度级尺寸区矩阵[GLSZM]和邻域灰度色调差矩阵[NGTDM],参见表R1-R7),ROI体素放射密度或衰减值优选地离散成多个箱(bin),优选地16个箱,优选地具有相等的宽度(例如,十HU的宽度),以减少噪声,同时允许足够的分辨率来检测ROI衰减的生物学上显著的空间变化。建议将离散成为16个箱作为增加放射组学分析图像的信噪比的最佳方法。然而,离散成多于或少于16个箱也是可能的。为了强化对称的、旋转不变的结果,可以在所有(正交)方向(例如,正方形像素或体素的四侧的四个方向)上计算放射组学特征中的一些或全部,具体地纹理统计量(GLCM等),然后取均值(例如,在所述方向中的每个方向上使用特征的单独计算值的平均值或其它均值)。
还可以针对原始图像数据的三维小波变换计算放射组学特征中的一些或全部,具体地与基于一阶和基于纹理的统计量有关的放射组学特征,从而产生许多另外的放射组学特征集,例如,如以下所描述的:Guo等人(Guo X、Liu X、Wang H等人“通过小波变换的增强CT图像提高胸部结节的诊断准确性(Enhanced CT images by the wavelet transformimproving diagnostic accuracy of chest nodules)”《数字成像杂志(J DigitImaging)》2011;24(1):44-9)。小波变换将数据分解为高频分量和低频分量。在高频下(较短的时间间隔),所得小波可以捕获原始数据中的不连续性、破裂和奇异点。在低频(较长的时间间隔)下,小波表征数据的粗糙结构,以鉴定长期趋势。因此,小波分析允许提取原始数据的隐藏和显著的时间特征,同时提高成像研究的信噪比。可以通过使数据通过多级(例如,三级)滤波器组,通过离散小波变换将数据分解为多个(例如,八个)小波分解。在每级下,数据分别通过高通和低通滤波器分解为高频分量和低频分量。因此,如果使用三级滤波器组,则会产生八个小波分解,对应于HHH、HHL、HLH、HLL、LHH、LHL、LLH和LLL,其中H是指“高通”,并且L是指“低通”。当然,可以可替代地使用多于或少于八级来分解数据。可以使用广泛可用的软件(如并入了Pyradiomics库的Slicer放射组学软件包)执行此类分解。任选地,可以全部基于原始(原)数据来计算放射组学特征,即不应用小波变换。因此,在本文公开了放射组学特征的列表、组或聚类的情况下,应当理解,可以将这些减少以排除基于小波变换计算出的那些放射组学特征。在基于数据的小波分解或变换来计算放射组学特征的情况下,这由后缀表示,所述后缀指示已基于(例如,高通、高通、高通的HHH)计算了放射组学特征的小波分解。因此,例如,“偏度LLL”表示基于LLL小波分解计算出的放射组学特征“偏度”。在不存在后缀的情况下,基于原始(或原)数据计算放射组学特征。
本发明提供了一种用于导出放射组学标签的方法,所述放射组学标签用于表征ROI(例如,包括脂肪组织或脂肪或由其组成的区域),例如用于检测或鉴定脂肪组织功能障碍或用于预测代谢风险,例如患上代谢病症或疾病(如糖尿病)的风险。使用针对多个个体的医学成像数据以及指示所述多个个体(例如,患者)中的每个个体的脂肪组织功能障碍或与其相关的数据来导出放射组学标签。具体地,指示脂肪组织功能障碍的数据可以包括脂肪组织功能障碍的一种或多种标志物(例如,生物标志物)或由其组成,如代谢病症的存在或不存在、与脂肪组织功能障碍相关的脂肪组织表型或允许推断出个体是否患有脂肪组织功能障碍的任何其它信息。
脂肪组织功能障碍被广泛理解为意指脂肪的导致例如炎症和纤维化的异常功能。如先前所提及的,脂肪功能障碍在如胰岛素抵抗和糖尿病等代谢病症的发展中起着至关重要的作用。指示脂肪组织功能障碍的数据因此可以包含所述个体中的每个个体的关于与脂肪组织功能障碍(如糖尿病或胰岛素抵抗)相关的代谢病症的存在或不存在(即,个体是否患有代谢病症)的信息,所述信息可以用作脂肪功能障碍的标志物。具体地,数据可以包含与脂肪组织功能障碍(如脂肪细胞增生或肥大、炎症、脂肪形成(脂肪细胞分化)和/或纤维化)相关和/或具有其的特性的脂肪组织生物学的一种或多种特征(即,脂肪组织表型)的测量结果,并且这些可以用作脂肪组织功能障碍的标志物。可替代地(或另外地),可以使用脂肪组织生物学的这些特征的替代生物标志物,如选择的基因表达谱。具体地,可以使用作为脂肪组织功能障碍的特性的标志物的基因表达谱,例如,数据可以包含FABP4(与脂肪形成相关的脂肪酸结合蛋白4)和/或TNFA(与炎症相关的肿瘤坏死因子α)的基因表达谱。具体地,如以下实例部分以及图4(a)和(b)所示,可以使用FABP4和TNFA基因表达谱两者,其中高TNFA表达与低FABP4表达组合用作脂肪组织功能障碍的替代标志物,并且被用来指示脂肪功能障碍。在此上下文中,“高”和“低”可以相对于相关基因表达的中值(或其它均值,如平均值)来定义,例如,如针对所述多个个体或其它群体所测量的。因此,“高”可以包含高于(并且任选地还等于)中值的值,并且“低”可以包含低于(并且任选地还等于)中值的值。可替代地,“高”和“低”的其它定义是可能的。例如,“高”可以意指最高的三分位数或四分位数,并且“低”可以意指最低的三分位数或四分位数。然而,通常将会是以下情况:“低”的上限将低于(或等于)均值(例如,平均值或中值),并且“高”的下限将高于(或等于)均值。因此,可以根据个体的基因表达谱和具有某些基因表达谱的个体(如上文所描述的个体)对个体进行分类、将个体分类或鉴定为患有脂肪组织功能障碍。其它个体可以被分类或鉴定为不患有脂肪组织功能障碍。基于标志物(例如,标志物的值),可以将所述多个个体各自鉴定为患有或不患有(具体地在收集医学成像数据时)脂肪组织功能障碍。
可以遵循逐步的方法来发展放射组学标签。首先,例如,如上文所描述的,针对所述多个个体中的每个个体,根据医学成像数据计算出多个放射组学特征。放射组学特征可以包括表R1-R7中定义的放射组学特征中的一部分或全部,并且可以基于原图像数据和/或图像数据的一个或多个小波变换(或小波分解)来计算放射组学特征中的每个放射组学特征,如上文所描述的。优选地,针对原图像数据以及针对图像数据的前述八个三维小波分解计算放射组学特征中的每个放射组学特征。
不稳定的特征可以从所述多个放射组学特征中移除。可以对特征施加z分数变换(即,根据与平均值的标准差的数量表达放射组学特征的值),并且可以基于z分数执行稳定性分析。稳定性分析可以包括计算放射组学特征的扫描-再扫描稳定性(即,在多个成像数据采集或扫描上的稳定性)和/或在多重或重复的所关注区域描绘(例如,分割或轮廓)上的稳定性。多重描绘稳定性分析可以包括计算多重描绘上的稳定性,每个描绘由不同的操作者或个人来执行。优选地,稳定性分析包括执行扫描-再扫描稳定性和多重描绘稳定性,并且仅保留根据两种分析被发现是稳定的特征。可以通过组内相关性系数(ICC)来测量稳定性,并且可以将不稳定的放射组学特征鉴定为在重复成像数据采集(例如,成像扫描)和/或在稳定性阈值以下的多重描绘中具有组内相关性系数(ICC)的那些。例如,稳定性阈值可以是至少约0.9,例如约0.9,以便排除具有ICC<0.9的所有放射组学特征。然而,可以替代地使用其它稳定性阈值,如0.85或0.95。可以针对多个重复扫描,例如两次到十次扫描,具体地两次或十次扫描,计算扫描-再扫描ICC。换句话说,可以对从多个放射组学特征移除的放射组学特征和不稳定的放射组学特征执行稳定性分析。稳定性分析可以基于所述多个个体的成像数据来执行,或者可以使用其它数据来执行,例如参考数据,如RIDER数据集(“RIDER:用于评估疗法应答的参考图像数据库(RIDER:The Reference Image Database toEvaluate Therapy Response)”;从https://wiki.cancerimagingarchive.net/display/Public/RIDER+Collections;jsessionid=C78203F71E49C7EA3A43E0D213CE5555在线获得)。
然后,可以通过移除成对相关性,即通过移除每对已鉴定的共线放射组学特征中的至少一个来减小或消除保留的放射组学特征(即,稳定的放射组学特征)的共线性。成对相关性的移除可以以逐步的方式执行。可以将共线放射组学特征鉴定为彼此相关程度至少等于给定相关性阈值的那些放射组学特征。相关性阈值优选地适用于正相关性和负相关性,例如,相关性阈值可以表示为模量。可以使用斯皮尔曼的rho系数计算成对相关性,并且相关性阈值为至少约|rho|=0.75,例如约|rho|=0.75,使得在|rho|≥0.75的水平下的所有成对相关性被消除。优选地,相关性阈值可以为至少约|rho|=0.9,例如约|rho|=0.9。如本领域中将容易理解的,相关性或共线性是两个放射组学特征一起从一个个体与下一个个体变化的紧密程度的度量,并且可以基于所述多个个体的测得的放射组学特征值来计算。
例如,当鉴定出一对共线的放射组学特征时,优选地从所述多个特征中消除两个特征中的一个。例如,可以消除根据数据计算出的与两者的AT功能障碍关联性较弱的放射组学特征,并且可以保留与AT功能障碍关联性最强的放射组学特征,但这不是必须的,并且任意一个都可以保留或消除。例如,共线消除步骤可以在不考虑AT功能障碍的情况下以无监督的方式执行,并且算法可以消除对研究群体的变异作用最小的最大冗余特征(例如,如跨所述多个个体测得的方差较小的特征)。在一个实例中,当鉴定出一对共线特征时,具有最大均值(例如,平均值)绝对相关性(即与所有其它放射组学特征的平均相关性值(或平均模量或平方相关性值))的特征被移除。这可以以逐步的方式执行,直到没有共线的放射组学特征保留。
共线消除步骤可以使用算法或函数(例如,函数claret::findCorrelation,R软件包,参见Kuhn,M.&Johnson,K.《应用预测建模(Applied Predictive Modelling)》(斯普林格出版社(Springer),2013))执行。例如,所述函数或算法可以构建成对相关性矩阵,所述成对相关性矩阵含有放射组学特征之间的成对相关性。然后,所述函数可以搜索相关矩阵,并且返回对应于列的整数向量以移除以减少成对相关性。然后可以从所述多个放射组学特征中移除这些列所对应的放射组学特征。在确定要移除哪些列时,所述算法可以首先鉴定放射组学特征之间的成对相关性。当鉴定出两个共线放射组学特征时,所述算法然后鉴定对应于具有最大平均值绝对相关性的特征的列以进行移除。
不管如何执行共线消除步骤,最终结果优选地是产生减少的多个放射组学特征,其中所述特征中的每个特征与其它剩余特征中的每个特征的相关度小于相关性阈值。换句话说,所述方法可以涉及移除放射组学特征以消除放射组学特征之间的共线性的步骤,使得剩余放射组学特征都不与其它剩余放射组学特征中的任何放射组学特征共线。这可以涉及计算放射组学特征之间的成对相关性,并且移除任何鉴定的共线特征对中的至少一个。
共线性的减少具有减少放射组学特征的冗余的优点。共线特征,即那些倾向于在个体之间以相同方式变化的特征,很可能对AT的相同或类似表型方面敏感。因此,移除共线特征确保最终标签中信息多样性的增加,最终标签中包含的每个放射组学特征表示AT的不同表型特性。
然后可以基于剩余放射组学特征中的至少两个构建放射组学标签,无论执行上文所描述的哪些步骤(例如,稳定性分析和/或共线性消除),所述剩余放射组学特征都可以幸存。例如,然后可以基于在共线消除步骤中幸存的减少的多个非共线放射组学特征中的至少两个来构建放射组学标签。在共线消除步骤中幸存的减少的多个特征以其它方式被称为“原始特征”。然而,由于消除的放射组学特征各自与原始特征中的至少一个强烈相关,因此其中原始特征中的一个或多个被与替代的原始特征共线的特征中的一个或多个替代的标签通常将与仅基于原始特征计算出的标签类似地执行。例如,可以将原始特征之一交换为计算为与所述原始特征共线的特征之一,并且标签应类似地执行。
因此,构建放射组学标签的过程可能涉及构建放射组学特征的“组”(每个组包括原始特征之一),其中每组中的放射组学特征中的每个放射组学特征与所述组中的至少“原始”特征共线(即,例如在共线消除步骤中幸存的所述组的特征)。以此方式,每个原始特征与其自身的共线等效物组相关,这些共线等效物是放射组学特征,这些放射组学特征被计算为与数据中的所述原始特征共线。可以针对原始放射组学特征中的每个原始放射组学特征或仅针对原始放射组学特征的子集构建这些共线等效物组,如例如通过特征选择算法(参见下文),鉴定为使标签与AT功能障碍的关联性最大化的那些。可以代替共线消除步骤来执行这些组的构建。例如,代替消除每对共线特征之一,可以将共线特征分配给同一组。可替代地,可以如上文所描述的执行成对消除步骤,并且然后,一旦鉴定出原始特征,可以通过将消除的特征分配给与它们最相关或共线的原始特征的组来重新引入消除的特征。
但是,无论如何构建这些组,最终结果应该是,每个放射组学特征被分配到与它共线的一个或多个原始放射组学特征相同的一个或多个组。如果放射组学特征与两个“原始”特征共线,则优选地将所述放射组学特征分配到与之最共线的原始特征的组,但也可以将所述放射组学特征分配到与之共线的所有原始特征的组。
因此,每个组中的“原始”放射组学特征表示所述组中其它放射组学特征中的每个放射组学特征的“伙伴”放射组学特征,其中每个组中的放射组学特征中的每个放射组学特征都与其“伙伴”特征共线。因此,从这个意义上讲,原始放射组学特征可以被认为是其自己的“伙伴”放射组学特征,因为它与自身完全共线。
尽管按照定义,“原始”特征不与每个其它特征共线,但是原始特征中的一些将比其它特征彼此更类似或内相关。因此,“原始”放射组学特征本身可以被分组或“聚类”为类似或相关特征的多个聚类。如前所述,放射组学特征之间的相关性程度是两个放射组学特征在不同个体之间趋于彼此变化的程度的度量。可以使用斯皮尔曼的rho系数或其它相关性度量(如皮尔森(Pearson)的相关系数)来计算成对相关性。聚类可以例如使用分层聚类方法(如分层聚类算法)来执行,以将显著的放射组学特征分类到所述多个聚类中。可以在无监督的情况下执行分级聚类,即独立于放射组学特征与AT功能障碍(或其标志物)的相关性强度。换句话说,可以对所述特征与彼此的相关性强度执行聚类,使得放射组学特征与它们最相关的那些一起被聚类。具体地,聚类内相关性可能比聚类间相关性强,即,聚类内的特征之间的相关性比不同聚类中的特征之间的相关性强。可以通过人例如操作者检查相关性数据来执行对聚类的最终鉴定。例如,操作者可以检查表示放射组学特征的层次聚类的树状图和/或二维相关性图(或热图),所述图绘制放射组学特征中的每个放射组学特征与每个其它放射组学特征(及其本身)的相关性,并且可以基于对放射组学特征内相关性数据的检查来鉴定聚类。在相关性热图中,放射组学特征可以按照根据层次聚类确定的顺序沿着相关性图的x轴和y轴布置(即,特征位于与它们关联性或相关性最密切的特征附近)。此视觉检查可以与分层聚类一起使用,以鉴定放射组学特征的适当聚类。可替代地,可以仅通过分级聚类或视觉检查来鉴定聚类。
如在聚类分析中所鉴定的,可以基于从不同聚类中选择的原始特征中的至少两个来有利地构建放射组学标签。例如,可以基于从每个聚类中选择的至少一个放射组学特征来构建放射组学标签。如果原始特征的共线等效物被包含在标签中以代替原始特征,则共线等效物优选地对应于属于不同聚类的原始放射组学特征。优选地,放射组学标签包括原始放射组学特征(或其共线等效物)中的至少两个,所述原始放射组学特征被发现使标签的准确性最大化以预测心脏状况或心肌疾病。其它放射组学特征也可以包含在标签中,例如,来自聚类的任何一个或全部的两个或更多个放射组学特征可以包含在标签中。然而,为了提供与AT功能障碍更密切相关的标签,因此具有提高诊断和预后实用性,优选地包含至少两个放射组学特征,每个来自不同的聚类。同样,这是因为来自不同聚类的特征提供了与ROI相关的互补表型信息,因为所述特征与彼此较弱地相关。具体地,来自不同聚类的放射组学特征可能对ROI的不同表型特性敏感,因为发现所述放射组学特征不以类似方式彼此变化,这表明所述放射组学特征对ROI的不同表型特性敏感。因此,应当优选地基于至少两个放射组学特征(的测量值)来计算放射组学标签,每个放射组学标签选自不同的聚类。例如,放射组学标签可以包括至少三个放射组学特征,每个放射组学特征选自不同的聚类。优选地,初始放射组学标签可以包括来自每个聚类的一个放射组学特征。
可以基于减少的多个特征(例如,“原始”特征)中的至少两个(或全部)或其共线等效物来构建放射组学标签。例如,如果构建了上文所描述的共线等效物的组,则可以根据至少两个放射组学特征来构建初始放射组学标签,每个放射组学特征选自不同的组。
可以使用一种或多种机器学习算法来构建放射组学标签。机器学习算法可以包括递归特征消除算法,例如随机森林算法,并且可以包括多倍(例如,5倍)交叉验证。可以将共线消除步骤中幸存的剩余(或“原始”)放射组学特征中的一些(优选地全部)输入到一种或多种机器学习算法中,以鉴定使放射组学标签与AT功能障碍关联性最大化的放射组学特征的最佳数量和身份。如上文所提及的,可以使用共线等效物代替原始放射组学特征或除了原始放射组学特征之外,并且将共线等效物输入到一种或多种机器学习算法中。例如,一种或多种机器学习算法可以细化输入的放射组学特征中的每个输入的放射组学特征对标签的作用,以改善放射组学标签与AT功能障碍(例如,AT的标志物)的关联性。这样做,机器学习算法可以鉴定使标签区分或鉴定AT功能障碍的能力最大化的放射组学特征的子集,并且可以基于放射组学特征的至少所述子集来计算放射组学标签。除了放射组学特征之外,临床轮廓特性(例如,年龄、性别、糖尿病、血脂异常、高血压、HOMA-IR、体重指数和皮下脂肪面积)也可以输入到机器学习算法中,并且还可以任选地包含在最终标签中。
具体地,可以使用机器学习算法来细化放射组学特征对标签的作用,以增加或最大化标签与心脏状况或心肌疾病的关联性。例如,可以将多个(优选地全部)原始放射组学特征(即,在共线消除步骤中幸存的那些)和/或原始放射组学特征的共线等效物(例如,属于同一组的那些)输入到第一机器学习算法中。第一机器学习算法可以用于鉴定要包含在标签中的放射组学特征的最佳数量和身份,具体地以使所述第一机器学习算法用于区分AT功能障碍的准确性最大化。换句话说,放射组学标签的构建可以包括特征选择步骤,其中选择要包含在标签中的放射组学特征。在特征选择步骤中,特征选择算法(例如,机器学习算法)可以选择要包含在最终标签中的放射组学特征的子集,具体地是被预测为使最终标签与AT功能障碍的关联性最大化的放射组学特征的子集。这具有减少优化最终标签的复杂性的优势,因为它减少了需要考虑的放射组学特征的数量。执行此特征选择步骤的第一机器学习算法可以例如通过随机森林算法来使用递归特征消除。然而,可以可替代地使用其它算法。第一机器学习算法可以被约束为要求所得标签包括选自聚类分析步骤(例如,使用聚类算法)中鉴定的不同聚类的至少两个放射组学特征。例如,机器学习算法可以被约束为要求所得标签包括选自聚类中的每个聚类中的至少一个放射组学特征。
一旦鉴定出要包含在标签中的放射组学特征的数量和身份,就可以使用第二机器学习算法来优化由第一机器学习算法鉴定的特征中的每个特征对标签的作用。换句话说,放射组学标签的构建可以包括使用第二机器学习算法来完细化或优化放射组学标签以增加或最大化所述放射组学标签与AT功能障碍的关联性的步骤。第二机器学习算法可以是逻辑回归算法。可以使用用于训练队列的数据来导出或细化标签,并且使用用于测试队列的数据来验证标签。例如,可以使用内部交叉验证来构建标签。内部交叉验证可以是多倍的,例如5倍。
可替代地,可以使用单个机器学习算法,而不是在上文所描述的两步过程中,根据放射组学特征,例如根据“原始”放射组学特征来构建标签。例如,可以使用单个机器学习算法来鉴定要包含在最终标签中的特征,并且细化或优化标签。例如,可以预先选择或预先确定要包含在最终标签中的放射组学特征的数量,并且将所述数量作为参数输入到机器学习算法中,或者可以由机器学习算法本身将所述数量保持开放并选择,这也可以细化或优化放射组学标签。换句话说,机器学习算法可以包含特征选择功能。
通常,放射组学标签的构建涉及细化或优化放射组学标签,例如,放射组学特征中的每个放射组学特征的每个对标签的作用,以基于数据改善标签与AT功能障碍的相关性或关联性。例如,标签可以包括初始标签中包含的放射组学特征中的每个放射组学特征的值的加权总和,并且可以逐步地优化或细化放射组学特征中的每个放射组学特征的权重。放射组学特征中的每个放射组学特征相乘的系数通常被称为β(β)系数,并且正是这些β系数可以被优化或细化。如本领域技术人员将容易理解的,可以基于受试者工作特性(ROC)曲线分析,具体地使用曲线下的面积(AUC)测量(即,C统计量)来计算放射组学标签与AT功能障碍的关联性。
优选地,在共线性消除步骤中幸存的原始特征被输入到一种或多种机器学习算法中,并且一种或多种机器学习算法鉴定出这些原始特征的子集,这些原始特征使标签的用于AT功能障碍的分类的准确性最大化。然后优选地由属于对应于这些原始放射组学特征的共线等效物组的两个或更多个放射组学特征来构建放射组学标签,其中两个或更多个放射组学特征选自不同的组。
此方法是有利的,因为为了提供与AT功能障碍更密切相关的标签,因此具有提高诊断和预后实用性,标签优选地包含至少两个放射组学特征,每个来自不同的组。这是因为来自不同的组的特征(并且因此对应于不同的非共线原始特征)提供了与ROI相关的补充信息。具体地,来自不同的组的放射组学特征将对ROI的不同表型特性敏感,所述放射组学特征与不同的“原始”或“伙伴”特征共线。例如,起始放射组学标签可以包括至少三个放射组学特征,每个放射组学特征选自不同的组。可替代地,起始放射组学标签可以包括至少四个放射组学特征,每个放射组学特征选自不同的组。可替代地,起始放射组学标签可以包括至少五个放射组学特征,每个放射组学特征选自不同的组。优选地,初始放射组学标签可以包括来自每个组的一个放射组学特征。
如上文所提及的,标签可以包括多个放射组学特征的计算值的加权和。标签还可以包含其它术语,如常数的加法或减法或乘以因子。然而,通常,标签将以某种方式与放射组学特征值的加权和线性相关。
放射组学标签可以采用所述术语的形式或包含所述术语(例如,可以基于包含所述术语的函数来计算标签):
Σb
其中c是常数(可以为零或非零),b
基于从医学成像数据获得的放射组学特征的测量值来计算本发明的放射组学标签。具体地,放射组学标签优选地基于至少两个放射组学特征来计算。
如上文所描述的,为了改善标签的预后和诊断值,标签优选地是基于选自类似或相关的原始放射组学特征的不同的聚类的至少两个不同的放射组学特征来计算的。这减少了冗余并改善了标签计算中包含的信息多样性,因为来自不同的聚类的特征与ROI的不同纹理方面有关。
已使用分层聚类算法鉴定出“原始”(即非共线)放射组学特征的三个聚类(A-C)(参见实例和图3(c))。表1(和图3(c))中鉴定了三个聚类的成员。放射组学标签可以包括来自表1的非共线放射组学特征中的至少两个。有利地,可以基于选自表1中鉴定出的聚类A-C中的至少两个聚类的放射组学特征来计算放射组学标签,至少两个放射组学特征选自不同的聚类。优选地,可以基于选自表1中鉴定出的聚类A-C中的每一个聚类的至少一个放射组学特征来计算放射组学标签。
表1:放射组学特征聚类
发现了五个放射组学特征,以使放射组学标签与AT功能障碍的关联性(参见以下实例)最大化,并且这些在表2中列出。可以有利地基于来自表2的放射组学特征中的至少两个放射组学特征来计算放射组学标签。优选地,基于来自表2的至少两个放射组学特征来计算放射组学标签,所述至少两个放射组学特征中的每个放射组学特征选自不同的聚类。进一步优选地,可以基于选自表2中鉴定出的聚类A-C中的每一个聚类的至少一个放射组学特征来计算放射组学标签。为了使放射组学标签与AT功能障碍的关联性最大化,优选地基于表2中列出的所有放射组学特征来计算放射组学标签。
表2:进一步优化的放射组学特征聚类
如先前所提及的,表1和2的“原始”放射组学特征可以被与替代的“原始”放射组学特征(即,共线等效物)共线的其它放射组学特征取代,以获得具有类似诊断和预后实用性的标签。因此,可以基于(即,包括)选自表3的放射组学特征中的至少两个放射组学特征来计算放射组学标签。表3中鉴定出的组中的每个组包含表2中列出的五个“原始”放射组学特征之一,已发现,这些放射组学特征可以使标签与AT功能障碍以及那些放射组学特征的关联性最大化,已计算出这些放射组学特征与原始放射组学特征共线的程度为至少|rho|=0.75,其中rho是斯皮尔曼的rho。因此,可以如上文所阐述的构建放射组学标签,但是用与所述特征共线的放射组学特征替代表2的放射组学特征中的一个或多个放射组学特征,如表3所阐述的。例如,可以基于选自表3的不同的组的至少两个放射组学特征来计算放射组学标签。例如,可以基于选自表3的不同的组的至少三个放射组学特征来计算放射组学标签。例如,可以基于选自表3的不同的组的至少四个放射组学特征来计算放射组学标签。例如,可以基于选自表3的不同的组的至少五个放射组学特征来计算放射组学标签。具体地,可以基于选自对应于属于不同的聚类A-C的原始特征的组中的至少两个放射组学特征来计算放射组学标签。具体地,可以基于选自下文表3中鉴定出的聚类A-C中的每一个聚类的至少一个放射组学特征来计算放射组学标签。
表3.放射组学特征组与表2的放射组学特征共线
可以将表3中鉴定的组简化为仅包含与所述组的原始特征(即,特征选择算法鉴定的五个原始特征之一)的相关程度为至少|rho|=0.800(这包含原始特征本身,根据定义,原始特征与自身的相关程度为rho=1)的那些放射组学特征。例如,组可以简化为与所述组的原始特征的相关程度为至少|rho|=0.850的那些特征。例如,组可以简化为与所述组的原始特征的相关程度为至少|rho|=0.900的那些特征。例如,组可以简化为与所述组的原始特征的相关程度为至少|rho|=0.950的那些特征。
除了基于来自不同的聚类或组的至少两个放射组学特征来计算放射组学标签之外,还可以基于另外的放射组学特征来计算放射组学标签。例如,放射组学标签可以包含来自任何给定聚类或组的一个以上放射组学特征,或者可以包含不包含在聚类或组中的任何聚类或组中的放射组学特征。因此,可以说放射组学标签是基于多个放射组学特征来计算的,并且所述多个放射组学特征可以包括上文所提到的至少两个放射组学特征。
本发明的放射组学特征中的每个放射组学特征提供了用于使用医学成像数据表征ROI并鉴定AT功能障碍的直接手段。因为本发明的放射组学特征中的每个放射组学特征基于可以测量的可能放射组学特征总数的相对较少的数量,所以所述标签易于计算和理解,并且临床医生可以更好地理解其生理学意义。
本发明的方法可以在如计算机系统等系统上执行。因此,本发明还提供一种系统,所述系统被配置或布置成执行本发明的方法中的一个或多个。例如,所述系统可以包括计算机处理器,所述计算机处理器被配置成执行本发明的方法或步骤中的一种或多种。所述系统还可以包括装载有用于执行本发明的方法中的任何方法的步骤的可执行指令的计算机可读存储器。
具体地,可以在此类系统上执行导出放射组学标签的方法,并且因此根据本发明提供了此类系统。例如,所述系统可以被配置成接收并且任选地存储数据集,所述数据集包括从针对多个个体中的每个个体的医学成像数据获得的ROI的多个放射组学特征的值。所述系统可以被配置成根据本发明的方法使用此类数据集来构建(例如,导出和验证)放射组学标签。
可替代地,所述系统可以被配置成执行表征ROI或鉴定AT功能障碍的方法。具体地,本发明提供一种用于使用受试者的医学成像数据来表征ROI的系统。所述系统可以被配置成使用医学成像数据来计算ROI的放射组学标签的值。可以基于ROI的至少两个放射组学特征的测量值来计算放射组学标签,并且可以根据医学成像数据来计算至少两个放射组学特征的测量值。
所述系统还可以被配置成根据医学成像数据来计算放射组学特征,如上文更详细地描述的。因此,所述系统可以被配置成接收和任选地存储医学成像数据,并且处理成像数据以计算放射组学特征。
通常仅通过引用放射组学特征的名称就可以在放射组学领域内很好地理解本文所指的放射组学特征的定义。然而,为了易于引用,在文的表R1到R7中提供了本文所使用的特征的定义。表R1到R7中的放射组学特征是根据Pyradiomics软件包所使用的放射组学特征定义的(http://pyradiomics.readthedocs.io/en/latest/features.html,参见vanGriethuysen,J.J.M.、Fedorov,A.、Parmar,C.、Hosny,A.、Aucoin,N.、Narayan,V.、Beets-Tan,R.G.H.、Fillon-Robin,J.C.、Pieper,S.、Aerts,H.J.W.L.(2017)“解码射线照相表型的计算放射组学系统(Computational Radiomics System to Decode the RadiographicPhenotype)”《癌症研究(Cancer Research)》,77(21),e104–e107.https://doi.org/10.1158/0008-5472.CAN-17-0339)。表R1到R7中定义的大多数特征符合成像生物标志物标准化倡议(Imaging Biomarker Standardization Initiative)(IBSI)所描述的特征定义,所述特征定义可在以下中获得:Zwanenburg等人(2016)(Zwanenburg,A.、Leger,S.、Vallières,M.和
这些统计量描述了给定所关注区域(ROI)中的衰减值的集中趋势、变异性、均匀性、不对称性、偏度和大小,而忽略了各个体素的空间关系。如此,这些统计量描述了整个ROI的定量和定性特征。对于八个小波变换中的每一个小波变换和原始CT图像,总共计算了19个特征,如下:
使:
·X为所关注区域(ROI)中包含的一组N
·P(i)为具有N
·P(i)为归一化一阶直方图,并且等于
·c为使强度发生偏移以防止X中出现负值的值。这确保灰度值最低的体素对能量的作用最小,而不是灰度级强度最接近0的体素。由于在ROI(-190到-30HU)内的脂肪组织(AT)的HU范围不包含零,因此可以将c设置为c=0。因此,较高的能量对应于较少的放射密集AT以及因此较高的亲脂性含量。
·∈为任意小的正数(例如,≈2.2×10
表R1:用于ROI表征的一阶放射组学特征
形状相关统计量描述了给定ROI的尺寸和形状,而不考虑其体素的衰减值。由于形状相关统计量与灰度级强度无关,因此形状相关统计量在所有小波变换和原始CT图像中都是一致的,并且因此仅计算一次。这些定义如下:
使:
V为ROI的体积,以mm
A为ROI的表面积,以mm
表R2:用于ROI表征的形状相关放射组学特征
简单来说,GLCM描述了位于具有j的体素旁边的具有给定衰减值i的体素的次数。尺寸为N
使:
∈为任意小的正数(例如,≈2.2×10
P(i,j)为任意δ和θ的共生矩阵
p(i,j)为归一化共生矩阵,并且等于
Ng为图像中的离散强度级的数量
μ
μ
σ
σ
对于距离加权,通过加权因子W对GLCM矩阵进行加权,并且然后求和并归一化。通过以下计算邻域体素之间的距离的权重因子W:
表R3:用于ROI表征的灰度级共生矩阵(GLCM)统计量
灰度级尺寸区(GLSZM)描述ROI中的灰度级区,所述灰度级区定义为共享相同灰度级强度的连接体素的数量。如果距离根据无穷大范数为1(3D中的26-连接区域,2D中的8-连接区域),则将体素视为已连接。在灰度级尺寸区矩阵P(i,j)中,第(i,j)个元素等于出现在图像中的具有灰度级i和尺寸j的区的数量。与GLCM和GLRLM相反,GLSZM与旋转无关,仅针对ROI中的所有方向计算一个矩阵。
使:
N
N
N
N
P(i,j)为尺寸区域矩阵
p(i,j)为归一化尺寸区域矩阵,其被定义为
∈为任意小的正数(例如,≈2.2×10
表R4:用于ROI表征的灰度级尺寸区矩阵(GLSZM)统计量
灰度级游程长度矩阵(GLRLM)描述了具有相同灰度级值的连续像素的灰度级游程,所述灰度级游程定义为像素数量的长度。在灰度级游程长度矩阵P(i,j|θ)中,第(i,j)个元素描述了沿着角度θ出现在图像(ROI)中的灰度级为i并且长度为j的游程数量。
使:
N
N
N
N
P(i,j|θ)为任意方向θ的游程长度矩阵
p(i,j|θ)为归一化游程长度矩阵,其被定义为
∈为任意小的正数(例如,≈2.2×10
默认情况下,在GLRLM上针对每个角度分别计算特征的值,然后返回这些值的平均值。如果启用了距离加权,则将GLRLM通过邻域体素之间的距离加权,然后求和并归一化。然后在所得矩阵上计算特征。使用“weightingNorm”中指定的范数针对每个角度计算邻域体素之间的距离
表R5:用于ROI表征的灰度级游程长度矩阵(GLRLM)统计量
邻域灰度色调差矩阵对灰度值与距离δ内其邻域的平均灰度值之间的差进行定量。灰度级i的绝对差之和存储在矩阵中。使X
其中(k
在此,W为邻域中体素的数量,所述体素也位于X
使:
n
Nv,p为X
p
N
N
表R6:用于ROI表征的邻域灰度色调差矩阵(NGTDM)
灰度级依赖性矩阵(GLDM)对图像中的灰度级依赖性进行定量。灰度级依赖性定义为距离δ内的连接体素的数量,所述连接体素取决于中心体素。如果|i-j|≤α,则认为灰度级为j的邻域体素取决于灰度级为i的中心体素。在灰度级依赖性矩阵P(i,j)中,第(i,j)个元素描述了邻域中具有j个依赖体素的灰度级为i的体素出现在图像中的次数。
N
N
N
P(i,j)为依赖性矩阵
p(i,j)为归一化依赖性矩阵,其被定义为
表R7:用于ROI表征的灰度级依赖性矩阵(GLDM)统计量
实例
研究设计
研究小组1由来自牛津心脏血管和脂肪(OxHVF)队列的225例接受冠状动脉搭桥术(CABG)的患者组成。排除标准是任何炎性、感染性肝/肾疾病或恶性肿瘤。接受非甾体抗炎药的患者也被排除在外。如下文所描述的,所有患者都接受了非对比增强CT扫描,目的是探讨脂肪组织(AT)的非侵入性放射组学表型是否可以提供有关AT生物学和代谢风险的信息。在组A(n=167)中,在手术期间从皮下脂肪(从胸部切口处)采集脂肪组织样品。将样品速冻以供基因表达研究,如下文所描述的。
研究小组2由接受了18-氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(PET/CT)成像以供临床指征的40个患者组成。此小组用于外部验证选择的放射组学特征,所述放射组学特征作为针对体内组织炎症定量的金标准成像方式(即
基因表达研究
将脂肪(或脂肪细胞)和主动脉组织的样品在QIAzol(凯杰公司(Qiagen))中速冻并且保存在-80℃。使用RNeasy Micro或迷你试剂盒(凯杰公司)提取RNA并且将核糖核酸转化为互补DNA(Quantitect Rev.转录试剂盒-凯杰公司)。然后针对FABP4(测定ID:Hs00609791_m1)、PREF1(测定ID:Hs00171584_m1)、TNFA(测定ID Hs01113624_g1)、IL6(测定ID Hs00985639_m1)、Col1A1(测定ID Hs00164004_m1)和Sfrp5(测定ID Hs00169366_m1)使用TaqMan探针(应用生物系统公司(Applied Biosystems))对cDNA进行定量聚合酶链反应(qPCR)。亲环蛋白A(PPIA)用作管家基因(测定ID Hs04194521_s1)。在ABI 7900HT快速实时PCR系统(应用生物系统公司)上,每个反应使用5ng cDNA,一式三份在384孔板中执行反应。基于标准曲线的斜率确定每个板中的反应效率;使用Pfaffl方法计算每个所关注基因相对于其管家基因的表达。
计算机化断层扫描研究
研究小组1和2的参与者使用64层扫描仪(LightSpeed Ultra,通用电气公司(General Electric))接受了CT成像。使用β阻滞剂的静脉内注射优化心率,并且还施用舌下三硝酸甘油酯(800μg)以实现最大冠脉血管扩张。通过将隆突和膈膜分别用作颅骨和尾骨标志,获得了非对比、前瞻性ECG触发的轴向采集CT扫描(旋转时间为0.35秒,轴向切片厚度为2.5mm,探测器覆盖范围为20mm,管能量为120kV和200mA)。肺部视野扩展到覆盖整个胸部软组织(用于脂肪组织分析)。为了分析脂肪组织放射组学特征,将原dicom图像转移到专用工作站中,并且使用3D Slicer进行进一步后期处理(参见下文)。
冠状动脉钙化评分
通过计算Agatston评分,在Aquarius
脂肪组织的放射组学特征提取
使用3D Slicer软件在CT扫描中执行皮下脂肪组织中的放射组学特征的计算(v.4.9.0-2017-12-18r26813,可从http://www.slicer.org获得;Fedorov,A.等人“3DSlicer作为定量成像网络的图像计算平台”《磁共振成像》30,1323-1341,doi:10.1016/j.mri.2012.05.001(2012))。脂肪组织的分割是通过在胸骨尾缘水平处选择2.5mm厚的轴向切片来执行的。通过手动轮廓和使用-190到-30亨氏单位(HU)掩码对脂肪进行鉴定来跟踪位于胸肋外部的所有体素。随后使用3D Slicer的SlicerRadiomics扩展将分割的脂肪组织用于计算和提取一系列放射组学特征,所述扩展将Pyradiomics库并入到3D Slicer中(参见van Griethuysen,J.J.M.等人“解码射线照相表型的计算放射组学系统”《癌症研究》77,e104-e107,doi:10.1158/0008-5472.CAN-17-0339(2017))。使用分割的脂肪组织的原HU值来计算形状相关和一阶放射组学特征。为了计算纹理特征(GLCM、GLDM、GLRLM、GLSZM和NGTDM),将AT体素离散化为16个等宽(宽度为10HU)的箱,以减少噪声,同时允许足够的分辨率来检测脂肪组织衰减的生物学上显著的空间变化。为了强化对称的、旋转不变的结果,在所有四个方向上计算纹理统计量(GLCM等),然后取均值。
小波变换:还针对原始图像的三维小波变换计算基于一阶和基于纹理的统计量,从而产生了八组另外的放射组学特征。
正电子发射断层扫描/计算机化断层扫描成像研究
使用PET/CT(这是评估体内组织炎症的金标准方法),对选择的脂肪组织的放射组学特征进行了针对
统计分析
主成分分析:在小组1中,所有843个计算出的AT放射组学特征都包含在主成分分析中,以鉴定描述研究群体中的大多数表型变异的主成分(PC)。构建了针对其特征值的PC的陡坡图。使用三个第一成分(PC1,PC2,PC3)在相关的相关性图中探索与人口统计、生化和脂肪组织基因表达数据的关联性。
特征选择和稳定性评估:为了将分析限制到作为成像生物标志物最有价值的放射组学特征上,对所有843种不同的放射组学特征执行稳定性评估。出于此目的,使用来自RIDER数据集的30个配对扫描(RIDER:用于评估疗法应答的参考图像数据库;从https://wiki.cancerimagingarchive.net/display/Public/RIDER+Collections在线获得;jsessionid=C78203F71E49C7EA3A43E0D213CE5555)来评估每个放射组学特征的扫描-再扫描ICC。然后,在来自OxHVF队列的20个患者中(由两名独立的操作者描绘),还对所有放射组学特征的ICC进行所关注区域的多重描绘。在另外的分析中,仅包含那些具有扫描-再扫描和多重描绘组内相关性系数(ICC)≥0.90的放射组学特征(n=196)。
通过脂肪组织放射组学特征对研究群体进行无监督聚类:将小组1中的AT的196个选择的放射组学特征转化为Z评分,以供进一步分析。然后,使用所有196个放射组学特征对小组1中的观测结果执行分层聚类(使用沃德方法(Ward method)和平方欧几里德距离,hclust R软件包)。在小组1队列的n=225次观测中,在相关热图中表示196个不同放射组学特征中的每个放射组学特征的变化,其中行树状图指示患者的聚类。然后,适当地通过使用卡方或独立的t测试探索患者的两个聚类之间的风险因素、生化或AT基因表达数据的分布的差异。
特征选择和与AT生物学的关联性:在类似性-非类似性图中直观地检查了196个稳定放射组学特征之间的关系。接下来应用逐步方法,并且通过应用已知的自动化算法(参见Kuhn,M.&Johnson,K.《应用预测建模》(斯普林格出版社,2013))从另外的分析中移除高度相关的放射组学特征(|rho|>0.9)。此函数(函数caret::findCorrelation,R包)搜索相关性矩阵,并且返回对应于列的整数向量以移除以便减少成对相关性。考虑成对相关性的绝对值。如果两个变量具有高相关性,则所述函数查看每个变量的平均绝对相关性,并且移除具有最大平均绝对相关性的变量。
然后鉴定特定的放射组学特征作为描述脂肪组织生物学的成像生物标志物。在上文所描述的步骤中幸存的最终32个放射组学特征(列于表1中)包含在逻辑回归模型中,以寻找与人类AT中的靶基因(TNFA,FABP4)的表达水平的独立关联性,这些独立关联性被用作脂肪组织生物学(炎症、脂肪细胞分化、纤维化、脂肪形成能力和脂肪因子表达)的特征的替代物。将靶基因的表达水平分为多组(基于最高三分位数),并且在多变量逻辑回归模型中用作分类变量。在所关注的靶基因作为因变量的情况下,将最终31个放射组学特征(通过方差膨胀因子测试共线性后,从模型中排除了1个特征)馈送到逻辑回归模型中。调整基线模型的经典风险因素(年龄、性别、糖尿病、高血压、吸烟)、HOMA-IR、体重指数和皮下脂肪面积(模型1);进一步调整模型2的通过向后选择(输入水平:0.05,移除水平:0.10)所选择的放射组学特征。借助于嵌套模型相应的C统计量和曲线下面积的变化(Δ[AUC]),比较了用于鉴定AT生物学特征的嵌套模型的区分值。
机器学习和内部交叉验证:机器学习用于对经过滤的放射组学特征和最终特征选择进行内部交叉验证。通过5倍交叉验证使用具有随机森林算法(rfecontrol,caret软件包R)的机器学习来选择能够对功能障碍的脂肪组织(即,高脂肪组织炎症加低脂肪细胞分化,分别基于TNFA和FABP4基因表达水平的中值)进行分类的主要特征。从此算法验证过程中鉴定的前五个放射组学特征(平均值LLL、总能量HHL、大依赖性低灰度级重点、依赖性熵和游程熵)用于计算复合放射组学标签(被称为FatHealth)作为脂肪组织健康的量度(FatHealth=Σb
放射组学特征提取和主成分分析
研究设计概述在图1中。接受冠状动脉搭桥术的225个患者的CT扫描用于通过皮下脂肪组织的分割计算总共843个放射组学特征。如表R1到R7所定义的,这些包含15个形状相关特征、18个一阶统计量、15个灰度级共生矩阵(GLCM)、18个灰度级依赖性矩阵(GLDM)、16个灰度级游程长度矩阵(GLRLM)、16个灰度级尺寸区矩阵(GLSZM)和5个邻域灰度色调差矩阵(NGTDM)特征,以及这些中的每一个的八个小波变换。最初,通过将可能具有相关特征的原始放射组学数据集简化为其主成分,执行了探索性数据分析。总共86个成分构成了研究群体中99.5%的变异(陡坡图,图2(a)),而前3个成分解释了所观察到的变异的60.6%(图2(b))。前3个成分与小组1患者皮下脂肪组织的临床人口统计学、生化特性和基因表达模式可变地相关(图2(c)),这表明人脂肪的标准非对比增强CT图像含有丰富的可提取信息,所述信息与脂肪组织的不同生物表型和代谢风险特征相关。
基于脂肪组织放射组学表型的无监督聚类
由于主成分是所研究样品群体固有的,而不是作为可定量生物标志物的可转移值,因此对放射组学特征本身执行了分析。根据843个测量的放射组学特征的初始库,执行了稳定性评估,并且计算了扫描-再扫描(RIDER数据集)和多重轮廓(OxHVF队列,图1)的组内相关性系数(ICC)。仅ICC≥0.90(n=196)的那些放射组学特征包含在进一步的分析中。然后使用这组196个放射组学特征对小组1中的群体执行无监督分层聚类(图3a)。基于脂肪组织放射组学特征的分层聚类鉴定了两个不同的患者聚类,所述两个不同的患者聚类在代谢风险因素和胰岛素抵抗状态的发生率方面存在显著差异(图3(a))。这些发现表明脂肪贮库(例如,皮下脂肪贮库)的放射组学特征对于其生物学的非侵入性表型和代谢风险评估应是有用的。
放射组学标签对脂肪组织功能障碍检测的递增值
在表明了脂肪组织的放射组学特征与其生物学联系的概念证明之后,接下来鉴定了可以用作代谢风险生物标志物的放射组学标签。类似性-非类似性图的构建(图3(b))表明,脂肪组织放射组学特征聚集在具有高度类似的聚类内特征的不同组中。这些196个稳定的放射组学特征与稳态模型评估胰岛素抵抗(HOMA-IR)可变地相关。为了确保最终标签中较高量的信息多样性,应用了自动算法,所述算法以逐步的方式移除了高度相关的特征。最终组的经过滤的32个放射组学特征(列出于表1中),它们的相互性关系和聚类呈现在相关性矩阵上(图3(b))。
脂肪的脂肪细胞分化状态和炎症是脂肪组织功能障碍和胰岛素抵抗发展的主要特征。首先探讨了TNFA和FABP4在皮下脂肪组织中的基因表达谱与临床表型的相关性。基于TNFA和FABP4的中值水平将患者分为四个亚组。具有低FABP4和高TNFA表达的亚组在非糖尿病患者中具有较高的糖尿病患病率(图4a)以及胰岛素抵抗(图4(b))。因此,接下来探讨了脂肪组织的放射组学特征是否可以用于捕获脂肪组织生物学,即其分化和炎症状态。
为此目的,通过将FABP4和TNFA基因表达的最高三分位数分别作为因变量,通过向后选择过程将皮下脂肪组织的放射组学特征包含到多变量逻辑回归模型中。在多变量模型中包含放射组学特征显著改善了基线模型对超出和超过临床风险因素、HOMA-IR或肥胖症测量值的脂肪细胞分化(Δ[AUC]=0.121,p=0.0086,图4(c))和脂肪组织炎症(Δ[AUC]=0.287,p=0.0001,图4(d))状态的区分。
内部验证和代谢风险的放射转录组学评分的构建
然后将经过滤的放射组学特征与临床轮廓特性(年龄、性别、糖尿病、血脂异常、高血压、HOMA-IR、体重指数和皮下脂肪面积)一起馈送到机器学习算法中,以鉴定能够捕获脂肪组织功能障碍(基于其中值,定义为高TNFA和低FABP4表达)的主要放射组学特征。具有五倍交叉验证的递归特征消除算法鉴定了一组7个变量,这些变量使脂肪组织功能障碍模型的准确性最大化(图4(e))。这些主要预测因素包含年龄和体重指数以及一组五个放射组学特征:大依赖性低灰度级重点(LDLGLE,GLDM纹理特征,用于测量具有较低灰度级值的大依赖性的联合分布)、平均值LLL(在LLL小波变换上计算的平均值衰减)、游程熵(RE,GLRM特征和脂肪组织纹理图案中的异质性指数)、依赖性熵(DE,用于对图像中灰度级依赖性进行定量的GLDM特征)和总能量HHL(一阶特征,其中最低灰度值对HHL小波变换上计算的作用最小)。这五个放射组学特征(列出于表2中)的组合增加了用于鉴定功能障碍的脂肪组织的基线临床模型的c统计量((Δ[AUC]=0.124,p=0.001,图4(f))。放射组学标签(FatHealth)的确切形式如下:
标签(FatHealth)=((((-1264629630*(大依赖性低灰度级重点)+(259259.2593*平均值_LLL)+(101629629.6*依赖性熵)+(-121148148.1*游程熵)+(总能量_HHL)+37222222.22)/1000000)+350)/10,
其中“*”表示乘法(x)。
然后使用这五个放射组学特征来构建脂肪组织健康的放射透热组学标签,即FatHealth(图5(a))。FatHealth与体重指数无关(r=0.068,p=0.307),并且与C反应蛋白的循环水平呈正相关(CRP,r=0.315,p=0.0006)。在推导队列中-通过可用的脂肪组织活检-FatHealth与风险因素(吸烟、动脉高压和糖尿病)的存在显著相关,反映了它们对脂肪组织生物学的累积有害作用(图5(c))。这种关联性在测试队列中也很显著,表明FatHealth可以用作脂肪组织健康的非侵入性量度(图5(d))。
针对正电子发射断层扫描对脂肪组织炎症的放射组学评分的验证
在接受PET/CT成像的40个患者的独立队列中,测量皮下脂肪组织的
验证本发明的替代性放射组学标签
上文的讨论表明,基于表2中列出的五个放射组学特征(即FatHealth)计算出的放射组学标签是脂肪组织功能障碍的有效量度。为了验证本发明的包含放射组学特征的不同选择的替代性放射组学标签的性能,测试了一系列若干种不同的放射组学特征的其鉴定脂肪组织功能障碍(先前定义为高炎症和低分化状态,即高TNFA表达与低FABP4表达结合)的能力。结果示出在下文表4和5中,其中内戈尔科(Nagelkerke)的伪R
在表4和表5中,呈现了组A队列的模型性能。在实例1-3中的每个实例中,当前现有技术模型(包含年龄、性别、高血压、血脂异常、吸烟、糖尿病、体重指数、HOMA-IR指数和皮下脂肪量)逐渐被放射组学标签所补充,所述放射组学特征包含来自表3的不同的组的逐渐更多的放射组学特征。因此,除了在先前行中列出的那些放射组学标签之外,每个实例的每个渐进行对应于将所指示的放射组学特征包含到放射组学标签中。实例1的模型仅包含表2中列出的“原始”放射组学特征。在实例2中,原始放射组学特征中的每个原始放射组学特征已被与其共线性最大的放射组学特征所取代,并且在实例3中,原始放射组学特征中的每个原始放射组学特征已被与其共线性最小的放射组学特征所替代(参见表3)。从表4中可以看出,用原始放射组学特征取代共线等效物仍产生放射组学特征,所述放射组学特征在区分脂肪组织功能障碍方面提供了超过当前现有技术的递增值。
在实例4中,表2的“原始”放射组学特征中的每个原始放射组学特征已被来自同一聚类的替代性放射组学特征所替代,如使用分层聚类算法所鉴定的(参见表1)。再次,实例4表明了用相同聚类中的替代性放射组学特征替代原始放射组学特征中的每个原始放射特征仍产生放射组学特征,所述放射组学特征在区分脂肪组织功能障碍方面提供了超过当前现有技术的递增值。
表4:由共线等效物构建的替代性标签的性能
表5:从相同聚类的不同特征构建的替代性标签的性能
因此,表4和5中呈现的数据表明,无论从鉴定的聚类或组中的每个聚类或组中选择了哪些特征,本发明的放射组学标签在当前现有技术上都提供了对脂肪组织功能障碍的改善的区分。
针对其它脂肪贮库还导出了本发明的放射组学标签,具体地胸部和内脏脂肪组织,所述脂肪贮库还是用于鉴定与代谢健康有关的脂肪组织功能障碍的有用靶标。胸部和内脏脂肪组织的最佳放射组学标签如下:
标签=(((-1264629630*大依赖性低灰度级重点)+(259259.2593*平均值_LLL)+(101629629.6*依赖性熵)+(-121148148.1*游程熵)+(总能量_HHL))/100000000)+50,
其中“*”表示乘法(x)。因此,本发明的放射组学标签也可应用于其它脂肪贮库,如胸部和内脏脂肪组织。
本发明的放射组学标签能够非侵入性地鉴定脂肪组织功能障碍本身和脂肪组织功能障碍的特性,如纤维化和炎症。因此,本发明的放射组学标签可以用于预测患上与脂肪组织功能障碍相关的代谢病症,如糖尿病的风险。
出人意料的是,放射组学标签不需要由与脂肪组织功能障碍最强烈独立相关的放射组学特征构成。相反,实际上有利的是包含从相关或类似的放射组学特征的不同“聚类”中选择放射组学特征,而不是仅包含单独地与AT功能障碍最相关的那些放射组学特征。此外,“原始”放射组学特征可以用共线等效物取代,同时仍然提供指示脂肪组织功能障碍的有效标签。
本发明的特别有吸引力的方面是,本发明可以对先前已经收集的历史医学成像数据执行。可以基于历史成像数据来导出和计算本发明的标签,因此本发明提供了用于评估大量患者的便利工具,而无需执行进一步的扫描。因此,本发明的方法不必包含收集医学成像数据的步骤,并且可以基于对现有医学成像数据的事后分析来执行。
- 脂肪的放射组学标签
- 心外膜区域的放射组学标签
