具有背衬的医疗制品
文献发布时间:2023-06-19 12:02:28
背景技术
防腐剂通常用于外科手术部位的常规术前皮肤清洁,以降低患者皮肤表面上的微生物负载。若干防腐剂可用于术前皮肤制剂,包括作为防腐剂的醇和氯己定或碘/碘伏。
患者的皮肤是潜在感染性微生物诸如金黄色酿脓葡萄球菌(Staphylococcusaureus)和凝固酶阴性葡萄球菌(Staphylococci)的重要来源,这些微生物变得越来越耐受抗生素并占所有外科伤口感染的三分之一以上。单独外科手术消毒制剂可能难以消除在消毒后连续再生的细菌。留下的细菌可迁移到外科手术伤口中,从而增加伤口污染和感染的风险。
带有防腐剂的外科手术盖布已使用碘/碘伏诸如美国明尼苏达州圣保罗的3M公司(3M,St.Paul,MN)出售的Ioban获得。一些患者对碘敏感,从而使得替代防腐剂诸如二葡萄糖酸氯己定(CHG)成为期望的。然而,当掺入盖布中时,这些防腐剂具有有限的皮肤粘附性,特别是当与成膜组合物(例如,外科手术消毒制剂)组合时。
发明内容
本公开的一些方面涉及一种制品,该制品包括具有相对的第一主表面和第二主表面的可适形背衬。可适形背衬可由选自聚氨酯、聚酯以及它们的组合物的热塑性聚合物形成。根据拉伸和伸长率测试方法,可适形背衬在25%纵向伸长率下具有不大于60克/厘米力的拉伸强度。疏水性粘合剂可设置在背衬的第一主表面的一部分上。疏水性粘合剂包含阳离子生物活性剂、能够溶解生物活性剂的至少一部分的疏水性增溶剂、以及具有高于1500的重均分子量的疏水性增塑剂。
另外的方面包括一种包括该制品的系统。该制品可为医疗装置,诸如外科手术盖布,并且还包括包含醇的防腐剂溶液。当制品的第一侧接触施加到形貌表面的防腐剂溶液层时,制品的任何部分从形貌表面的统计相关的样品组翘起的频率可不大于80%。
另外的方面还包括一种制备该制品的方法以及一种将该制品与成膜防腐剂组合物一起使用的方法。
附图说明
图1A至图1C示出了根据本公开的一个方面的粘附到形貌表面的制品。
图2A至图2C示出了根据本公开的一个方面的设置在形貌表面上的图1A至图1C的制品。
图3示出了根据本公开的一个方面的施加制品的方法的流程图。
图4示出了根据本公开的一个方面的制备制品的方法的流程图。
图5为根据本公开的一个方面的本文所述的膝盖模型屈曲研究的图示。
图6为根据本公开的一个方面的膝盖与用于本文所述的膝盖模型屈曲研究的制品的照片。
图7为根据本公开的一个方面的膜背衬的代表性拉伸和伸长率曲线的曲线图。
图8A示出了根据本公开的一个方面的树脂类型和厚度对纵向膜背衬适形能力的影响的曲线图。
图8B示出了根据本公开的一个方面的树脂类型和厚度对横向膜背衬适形能力的影响的曲线图。
图9A示出了根据本公开的一个方面的树脂类型和厚度对纵向膜背衬拉伸强度的影响的曲线图。
图9B示出了根据本公开的一个方面的树脂类型和厚度对横向膜背衬拉伸强度的影响的曲线图。
图10示出了根据本公开的一个方面的示出不同研究中翘起的几何平均值与背衬适形能力的曲线图。
具体实施方式
已发现,热塑性聚合物膜背衬的适形能力与湿环境挑战条件下已消毒皮肤上的切口盖布翘起高度相关。可通过使用更适形的热塑性聚合物膜背衬显著减少湿环境挑战下已消毒皮肤上的盖布翘起。
本公开的一些方面涉及一种在形貌表面上方具有适形能力的制品。更具体地,本公开的一些方面涉及对患者的解剖表面具有适形能力的医疗制品。适形能力可以是为背衬选择肖氏硬度A等级不大于75的聚合物的结果,这导致背衬在25%的纵向伸长率下具有不大于200克-力的拉伸强度。在其他方面,当与成膜组合物组合时,制品可最大程度减少翘起。
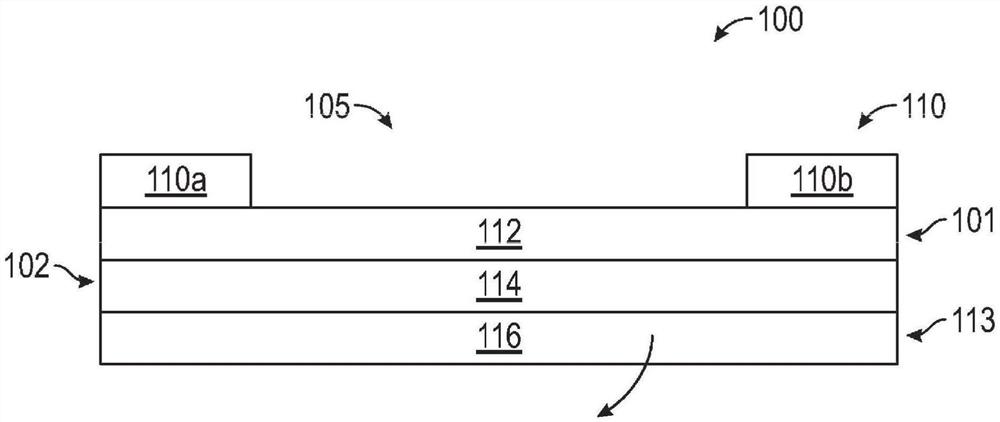
图1A至图1B示出了制品100。制品100可为医疗制品,诸如盖布、伤口敷料等。在至少一个实施方案中,制品100为可用于外科手术中的切口盖布。
制品100可包括可适形背衬112、粘合剂114、以及任选的支撑层110和剥离衬垫116。粘合剂114可设置在可适形背衬112上以形成具有允许制品100粘附到形貌表面诸如动物解剖关节的特性的制品。当关节屈曲并随后恢复到其不屈曲位置时,背衬112可被制成使得其拉伸以适应关节的屈曲,但具有足够的回弹力以在关节恢复到其不屈曲状态时继续适形于关节。背衬112通常适形于解剖表面。因此,当将背衬112施加到解剖表面上时,即使当该表面移动时它也适形于该表面。
背衬112可为浇铸的(例如,由溶剂或水)或挤出的。虽然取决于聚合物材料的选择,背衬112可能具有各种厚度,但背衬112可具有如使用ASTM D6988-13计算的0.5密耳至2密耳(12.7微米至50.8微米)(包括端值在内),优选0.7密耳至1.2密耳(18微米至30微米)(包括端值在内),更优选0.8密耳至1.2密耳(20微米至30微米)(包括端值在内)的平均厚度。
在至少一个实施方案中,背衬112可为一体的;即,它可由单层组成。在某些实施方案中,背衬112可为复合材料背衬。通常,背衬至少为基本上均匀的,但并非必须如此。背衬112可为打孔的;然而,如果为打孔的,则不使用打孔的区域测定平均厚度,在打孔的区域厚度将当然为零,因为此处不存在背衬112。
在至少一个实施方案中,如使用ASTM E96BW所测量的,背衬112可以等于或大于人体皮肤的速率透过湿气。在一个示例中,单独背衬的湿气透过率可为至少400g/m
背衬112可由热塑性聚合物形成。热塑性聚合物可包括聚氨酯、聚酯、聚酰胺、聚烯烃、苯乙烯嵌段共聚物以及它们的组合物。
在至少一个实施方案中,背衬112可由热塑性聚氨酯、共聚酯、或聚醚嵌段酰胺膜形成。这些膜结合了回弹性、高水蒸汽渗透性和透明性等背衬所需的特性。
在至少一个实施方案中,背衬可包含一种或多种聚氨酯。在实施方案中,聚氨酯包含至少一种热塑性聚氨酯(TPU)或至少基本上由至少一种热塑性聚氨酯(TPU)组成。如本上下文中所用的术语“基本上由...组成”意指添加剂化合物(例如,芳香剂、着色剂、染料、抗氧化剂、阻燃剂、熔融加工助剂、UV光稳定剂、和/或填料)可存在于背衬中,前提是拉伸强度和极限伸长率保持基本上不受其存在的影响。例如,添加剂可对拉伸强度和极限伸长率具有小于5%、或优选小于1%的影响。
在至少一个实施方案中,背衬112可包含单一热塑性聚氨酯或热塑性聚氨酯的组合物。
热塑性聚氨酯为人们所熟知,并且可根据许多已知技术制备,或者它们可从商业供应商处获得。例如,俄亥俄州克利夫兰市的路博润公司(Lubrizol Corp.,Cleveland,Ohio)是各种热塑性聚氨酯的一个商业供应商,诸如例如:以商品名“ESTANE GP TPU(B系列)”购得的基于聚酯的芳族TPU(例如,等级52DB、55DB、60DB、72DB、80AB、82A、85AB和95AB);和以商品名“ESTANE 58000TPU系列”购得的基于聚酯和聚醚的TPU(例如,等级58070、58091、58123、58130、58133、58134、58137、58142、58144、58201、58202、58206、58211、58212、58213、58215、58219、58226、58237、58238、58244、58245、58246、58248、58252、58271、58277、58280、58284、58300(或EZ10、58309、58311、58315、58325、58370、58437、58610、58630、58810、58863、58881和58887)。
又如,美国密歇根州怀恩多特的BASF(Wyandotte,Michigan)是以商品名“Elastollan”购得的各种基于聚酯和聚醚的热塑性聚氨酯(例如800系列,包括ET 870、880AN)的另一个商业供应商。
背衬112或任何部件也可由一种或多种特性限定。例如,由热塑性聚合物形成的均聚物材料可具有不大于85、不大于80、不大于78、不大于76、不大于75、不大于74、不大于73、不大于72、不大于71或不大于70的肖氏硬度A等级。
背衬112还可具有在约25℃至约80℃范围内的温度下不大于Dahlquist标准(即10
在至少一个实施方案中,背衬112具有如本文所述的拉伸和伸长率测试方法所测量的在25%纵向伸长率下不大于200克力/厘米、不大于150克力/厘米、不大于100克力/厘米、不大于60克力/厘米、或不大于50克力/厘米的拉伸强度。在至少一个实施方案中,如本文所述的拉伸和伸长率测试方法所测量的,背衬112在25%纵向伸长率下可具有介于40克力/厘米和5克力/厘米之间(包括端值在内)的拉伸强度。
在至少一个实施方案中,背衬112可具有介于5MPa和20MPa(包括端值在内)之间,优选介于8MPa和12MPa(包括端值在内)之间,并且最优选介于8MPa和10MPa(包括端值在内)之间的杨氏模量。
在至少一个实施方案中,制品100可包括任选的支撑层110或载体。用于形成支撑层110的材料通常基本上比背衬112显著更硬,以防止背衬112在施加至患者时产生不适宜的褶皱。一般来讲,支撑层110材料可以包括(但不限于)弹性膜、非弹性膜、非织造纤维网、织造纤维网、针织物、以及聚乙烯/乙酸乙烯酯共聚物涂覆的纸张和聚酯膜。图1A示出了邻近周边106设置的两个支撑层110a、110b结构。
在至少一个实施方案中,支撑层110直接或通过粘合剂114永久性地粘附到或附接到背衬112上。该支撑层可以通过将支撑层切割成期望的图案,并用粘合剂将支撑层层合到背衬上来形成。如图1A至图1C所示,支撑层也可以层合到粘合剂114上以将支撑层110附接到背衬112上。
永久性地附接支撑层110的其他方式包括不可逆热粘结或将支撑层110超声焊接到背衬112上。在至少一个实施方案中,支撑层110可以附接到背衬112的顶部、背衬112和粘合剂114之间,或附接到粘合剂114上。
制品100包括粘合剂114或粘合剂114。本公开的一个方面是,粘合剂114与背衬112一起作用以改善所得制品的适形能力,特别是与皮肤或用亲水性物质消毒的皮肤的适形能力。在至少一个实施方案中,粘合剂114是压敏粘合剂(PSA)。
粘合剂114包括生物活性剂,该生物活性剂包括抗微生物剂、抗病毒剂、抗细菌剂或抗真菌剂中的一者或多者。在另一个方面,抗微生物剂、抗病毒剂、抗细菌剂或抗真菌剂包括但不限于上述生物活性剂。在又一个方面,PSA包括抗微生物剂、抗病毒剂、抗细菌剂或抗真菌剂中的一者或多者。在另一个方面,PSA包含抗微生物剂。
在至少一个实施方案中,抗微生物剂为阳离子抗微生物剂。在至少一个实施方案中,阳离子抗微生物剂是有机的。例如,这可包括氯己定盐、季铵盐、奥替尼啶二盐酸盐(和其他奥替尼啶盐)或它们的组合物。氯己定的示例可包括氯己定葡糖酸盐、氯己定二葡糖酸盐(CHG)、氯己定醋酸盐或氯己定二氯化物。优选的生物活性剂为CHG。
季铵盐的示例包括苯扎氯铵、苄索氯铵、甲基苄索氯铵、西他氯铵、十六烷基氯化吡啶鎓、十六烷基三甲基铵、溴棕三甲铵、多法氯铵、溴化四乙基铵、二癸基二甲基氯化铵和杜灭芬。在至少一个实施方案中,阳离子抗微生物剂是无机的,例如银离子。
生物活性剂也可以是碘的组合物,例如聚维酮-碘。
在至少一个实施方案中,生物活性剂通常为亲水性的或具有亲水性组分。一般来讲,0.5重量%至10重量%、1重量%至10重量%、2重量%至10重量%的生物活性剂可存在于总粘合剂组合物中。在一些实施方案中,0.5重量%至8重量%、或0.5重量%至5重量%的生物活性剂可存在于粘合剂114的总重量中。
在至少一个实施方案中,制品100包含生物活性剂,其中生物活性剂浸渍可适形背衬112和/或涂覆到可适形背衬112上的粘合剂114中的一者或两者。粘合剂114设置在背衬112的主表面上。在至少一个实施方案中,粘合剂114仅设置在背衬112的一侧上。
粘合剂114可包括(甲基)丙烯酸类共聚物或包含(甲基)丙烯酸类前体的可固化组合物或非交联组合物的交联反应产物(包括部分交联的反应产物)的共聚物,该(甲基)丙烯酸类前体为第一单体或第二单体的至少部分聚合的反应产物。
相对于总的粘合剂组合物(例如前体和增塑剂、生物活性剂、染料、或其他添加剂),(甲基)丙烯酸类前体可以是70重量%至90重量%的前体、75重量%至85重量%的前体或甚至75重量%至80重量%的前体。
(甲基)丙烯酸类前体可包括第一单体。第一单体可占(甲基)丙烯酸类前体的75重量%至95重量%(包括端值在内)、80重量%至90重量%(包括端值在内)、81重量%至89重量%(包括端值在内)、82重量%至88重量%(包括端值在内)、83重量%至87重量%(包括端值在内)、或84重量%至86重量%(包括端值在内)。
第一单体可具有式CH
(甲基)丙烯酸类前体可包括第二单体。第二单体可占(甲基)丙烯酸类前体的5重量%至25重量%(包括端值在内)、10重量%至20重量%(包括端值在内)、11重量%至19重量%(包括端值在内)、12重量%至18重量%(包括端值在内)、13重量%至17重量%(包括端值在内)、或14重量%至16重量%(包括端值在内)。
在至少一个实施方案中,第二单体可为乙烯基单体。第二单体可由式CHR
在至少一个实施方案中,R
粘合剂114也可以包括增溶剂。增溶剂通常可增加生物活性剂在粘合剂组合物中的溶解度。增溶剂将取决于生物活性剂。用于CHG的增溶剂在美国专利申请US 2016/0296678和US2015/0238444A1中作为疏水性载体进行了讨论,这两篇专利全文以引用方式并入本文。
增溶剂通常为疏水性的并且具有不大于10的亲水-亲脂平衡。增溶剂包括单酰基甘油酯、醇(诸如二醇)和醚基团。单酰基甘油酯的具体示例包括单辛酸甘油酯、单月桂酸甘油酯、单异硬脂酸甘油酯、单油酸甘油酯、三硬脂酸十甘油酯、L-酒石酸二丁酯、L-酒石酸二乙酯、D-酒石酸二乙酯以及它们的组合物。醇的具体示例包括1,2-辛二醇、1,2-癸二醇、1,2-戊二醇、1,2-丙二醇、1,2,6-三羟基己烷、1,3-丙二醇、1,4-丁二醇、2-丁烯-1,4-二醇、1,3-丁二醇、3-甲基-1,3-丁二醇、1,3-环己二醇、2,3-丁二醇以及它们的组合物。醚的具体示例包括三乙二醇、四乙二醇、三乙二醇单甲醚、二乙二醇单甲醚、二乙二醇单乙醚、山梨醇聚醚-6,1,3-二羟基丙酮二聚体、乙基己基甘油以及它们的组合物。
在至少一个实施方案中,基于生物活性剂和增溶剂的合并重量计,至少3重量%、4重量%、5重量%、6重量%、10重量%、15重量%或20重量%的生物活性剂溶解于增溶剂中。
在至少一个实施方案中,基于粘合剂组合物的重量计,至少5重量%、至少6重量%、至少7重量%、至少8重量%、至少9重量%或至少10重量%的生物活性剂溶解于粘合剂114中。在至少一个实施方案中,基于粘合剂组合物的重量计,不大于20重量%、不大于10重量%的生物活性剂溶解于粘合剂114中。
在至少一个实施方案中,粘合剂114不具有显著量的具有高于10的亲水-亲脂平衡(HLB)的亲水性载体(不包括水),诸如醇或甘油。在一些实施方案中,粘合剂114几乎不含或不含亲水性载体(即具有大于10的HLB的载体)。如本文所用,认为水是与任何亲水性载体无关的单独的组分;因此,下面的量不包括组合物中可能存在的任何水。在一些实施方案中,该组合物包含每1重量份生物活性剂不大于2重量份亲水性载体,例如,每1重量份生物活性剂不大于1重量份、不大于0.5重量份或甚至不大于0.1重量份亲水性载体。
在一些实施方案中,粘合剂114包含每1重量份生物活性剂不大于1重量份水,例如,每1重量份生物活性剂不大于0.5重量份、不大于0.1重量份、或甚至不大于0.01重量份水。
粘合剂114还可以包括添加到粘合剂组合物中的增塑剂。增塑剂基于疏水性来选择。具体地,增塑剂使得所得粘合剂114整体疏水。在至少一个实施方案中,增塑剂可具有至少1500、至少1700、至少1900、至少2000、或至少2500的重均分子量。
在至少一个实施方案中,增塑剂的用量取决于所得活化粘合剂114(即,增塑的压敏粘合剂)中的期望粘性水平、期望的剥离和剪切强度水平、期望的持久性水平以及潜在过度增粘的粘合剂的增粘水平。例如,随着潜在过度增粘的粘合剂的模量增加,需要较高含量的增塑剂以使得粘合剂模量降至用于压敏粘结部制备的有效范围(即,剪切储能模量低于Dahlquist标准)。
随着粘合剂114中增塑剂的量增加,维持内聚强度变得越加困难,因此对最终粘合剂114中可允许的增塑剂的量设立实际上限。如果需要诸如干粘性(aggressive tack)、低温性能或平滑剥离的特性,则高含量增塑剂可为有利的。考虑到对压敏粘合剂制剂有实际限制,显然也应存在以潜在过度增粘的粘合剂开始的剪切模量的上限并且仍能够使用100pph或更小的增塑剂负载实现压敏粘合剂行为。实际模量值难以限定,因为其强烈取决于增塑剂类型、增塑效率和增塑剂与潜在过度增粘的粘合剂的相容性。
在至少一个实施方案中,可添加增塑剂使得增塑剂的量在3重量%、2重量%、1重量%内,或至少等于所添加的增溶剂的量。在至少一个实施方案中,增塑剂的量可为粘合剂组合物的总重量的至少5重量%、至少6重量%、至少7重量%、至少8重量%、至少9重量%、或至少10重量%。
增塑剂可为多元醇,诸如低聚多元醇,包括单体多元醇、羟基封端的聚链二烯、氢化聚链二烯多元醇和有机硅多元醇。在至少一个实施方案中,增塑剂可不同于可形成聚氨酯键的多元醇。例如,可使用单体多元醇,例如以商品名PRIPOL 2033购自美国伊利诺伊州芝加哥的Unichema北美公司(Unichema North America,Chicago,Ill.,USA)的C
在至少一个实施方案中,增塑剂可将潜在过度增粘的粘合剂的T
在至少一个实施方案中,可适形背衬112可以是纱布、具有吸收特性的片状材料、贴剂等,其中可适形背衬112用生物活性剂浸渍。在至少一个实施方案中,粘合剂114为疏水性的,并且生物活性剂(诸如阳离子抗微生物剂诸如CHG)溶解于粘合剂114中。
粘合剂114可在背衬112上形成足以赋予背衬112粘合特性的基本上均匀的层。粘合剂114可为适度皮肤相容的和“低变应原的”,诸如美国专利RE 24,906中描述的丙烯酸酯共聚物。
在至少一个实施方案中,粘合剂涂覆的背衬113(即粘合剂114和背衬112的组合)使用如美国专利4,595,001所述的倒杯法,以下述速率透过湿气:至少300g/m
制品100还可具有设置在粘合剂114的一部分上的剥离衬垫116。适合与本公开的实施方案一起使用的剥离衬垫116膜可由牛皮纸、聚乙烯、聚丙烯、聚酯或这些材料中任何材料的复合物制成。所述膜优选地用诸如含氟化合物或有机硅的剥离剂涂布。例如,美国专利4,472,480描述了低表面能的全氟化合物衬垫。该衬垫是有机硅剥离材料涂覆的纸张、聚烯烃膜或聚酯膜。可商购获得的有机硅涂覆的剥离纸的示例为购自伊利诺伊州贝德福德帕克的瑞克斯姆剥离品公司(Rexam Release,Bedford Park,Ill.)的POLYSLIK
如图1B所示,剥离衬垫116可从粘合剂114移除并剥离,使得粘合剂114可放置在表面诸如形貌表面(例如,涂有或不涂有防腐剂溶液的完整或刺穿的人类皮肤)上。
如图1C所示,制品100可具有邻近制品100的第一侧边101和第二侧边102的抓持部分(未示出)。抓持部分可用作抓持点以供用户将制品100施加到患者身上。在至少一个实施方案中,用户可以是临床医生诸如医生或护士、机器人助手或患者他或她自己。
侧边缘101、102以及顶部边缘103和底部边缘104可形成制品100的周边106的至少一部分。另外,制品100被示出为具有顶部表面105,其中任选的载体110沿着周边106形成框架。
图2A至2C示出了包括形貌表面240的系统200。形貌表面240可以是解剖表面,并且更具体地是干燥的人类皮肤部位或平坦区域,诸如患者的腹部区域。如本文所述,图2A至图2C可示出图3的方法300处的概念。
在图2A中,外科手术制品230(诸如盖布)可以放置在形貌表面240上。外科手术制品230可以是常用的非织造材料或塑料膜。在至少一个实施方案中,外科手术制品230是可以商品名Steri-Drape(由3M公司出售)商购获得的切口盖布的一部分。
施用装置220可用于向形貌表面240提供含有生物活性剂的防腐剂溶液224。施用装置220可包括可分配防腐剂溶液224的施用表面222(例如,海绵状构件)和盛有防腐剂溶液224的贮存器221。
在至少一个实施方案中,防腐剂溶液224可包含也可用作主要防腐剂的醇载体。防腐剂溶液224可包含聚合物以使防腐剂溶液224或生物活性剂稳定。防腐剂溶液224也可为成膜的,这意味着其在醇载体已蒸发之后形成残留物的膜。成膜组合物可以商品名ChloraPrep(由新泽西州富兰克林湖的BD公司(BD,Franklin Lakes,NJ)出售)或DuraPrep(由明尼苏达州圣保罗的3M公司(3M,Saint Paul,MN)出售)商购获得。
在图2B中,使用者可向形貌表面240施加防腐剂溶液224。这可对应于图3中的框320,其中将防腐剂溶液224施用至形貌表面240的至少一部分。防腐剂溶液224可以非连续层形式施加。用户可允许防腐剂溶液224干燥。例如,在一段时间之后,一部分醇载体可蒸发,从而在形貌表面上留下膜。膜和醇载体两者均可妨碍制品100的粘附并导致翘起。本公开的一个方面是,在施加防腐剂溶液224之后,制品将基本上不从形貌表面240翘起。
在图2C中,用户获得图1中的制品100,其在图3的框425中有所描述。如图所示,用户也可任选地从粘合剂114中移除剥离衬垫116,如图1C和图3的框330中所述。
在图3的框340中,用户还可抓持邻近制品100的第一侧边和第二侧边的部分(如图1C所示)。
在图3的框350中,用户可将制品置于形貌表面240上方并用力将制品100朝向形貌表面240施加。
在框360中,可将制品100置于形貌表面240和防腐剂溶液224的至少一部分或由防腐剂溶液224留下的残留物两者上方。制品100还可粘附到外科制品230并且基本上适形于外科制品230、防腐剂溶液224和形貌表面240。
图4示出了用于制备图1中的制品100的方法400的流程图。方法400可始于框410,其中提供生物活性剂。可用于本公开的一些生物活性剂可以水溶液形式提供。例如,可商购获得的CHG可以至多20重量%的浓度存在于水中。
在框420中,可任选地对生物活性剂进行调理。在至少一些实施方案中,可将水从生物活性剂中移除以易于处理。例如,可存在至少三种不同的用于制备CHG在非水性载体中的溶液的方法。第一种方法涉及将CHG水性溶液与相对较高沸点的载体混合,然后对混合物抽真空以移除水(“真空方法”)。第二种方法涉及冷冻干燥CHG,然后将CHG溶解到载体中(“冷冻干燥方法”)。第三种方法涉及通过使葡萄糖酸内酯、有限量的水及氯己定游离碱反应原位生成CHG(“原位方法”)。
在框430中,可将(甲基)丙烯酸类共聚物与生物活性剂、增溶剂和增塑剂混合以形成粘合剂组合物。在至少一个实施方案中,(甲基)丙烯酸类共聚物也可与溶剂组合。(甲基)丙烯酸类共聚物也可在室温或更高的温度(包括高温)下与生物活性剂混合。
在框440中,可将粘合剂组合物沉积在背衬上。在至少一个实施方案中,可在框430或框440处添加溶剂以有助于加工。框440处的沉积也可在不借助于溶剂的情况下执行(例如,热熔融粘合剂技术,如美国专利4049483所述)。
通过以下实施例,进一步示出了本公开的各种实施方案的目的和优点,但在这些实施例中引用的具体材料及其量以及其他条件和细节不应被视为对本公开的各种实施方案的不当限制。除非另外指明,否则所有的份数和百分比均以重量计,所有的水为蒸馏水,并且所有的分子量为重均分子量。除非另外指明,否则组合物以重量百分比(重量%)报告。
基于ASTM D882和ASTM D3759,使用型号Z005的Zwick Universal Tabletop拉伸测试仪(佐治亚州肯内索的Zwick美国公司(Zwick USA,Kennesaw,GA))测量拉伸特性。测试样品尺寸:1英寸(2.54cm)宽×5英寸(12.7cm)长。标距:1英寸(2.54cm),夹头速度为10英寸(25.4cm)/min。用1英寸(2.54cm)宽的一块标签胶带在每个端部处以正方形横向标记测试样品,该标签胶带以仅使指定标距暴露并且使胶带标签的端部处于钳口面之外的方式重叠一次。使测试样品伸长至25%应变所需的力(Fx25)用于表示背衬或盖布适形能力。
使用Zwick拉伸测试仪测量将压敏粘合剂从其背衬移除所需的力,其中使用阳极化铝板作为测试表面,并采用背衬胶带3M#2525胶带和(如果需要的话)3M#2262粘合剂(两者均购自明尼苏达州圣保罗的3M公司(3M Company,St.Paul,MN))以用于增强膜。样品尺寸:1/2英寸(1.27cm)宽×4英寸(10.16cm)长。标距:10英寸(25.4cm),夹头速度为200mm/min。
使用膝盖屈曲模型来评估二葡萄糖酸氯己定(CHG)抗微生物切口盖布对皮肤的盖布粘附性和盖布移除性能。膝盖屈曲模型用于模拟外科手术。
在该研究中,测试受试者坐在或躺在有衬垫的诊疗台上。如果在测试部位上存在过量的毛发,则在研究开始之前修剪这些区域以确保良好的样品-皮肤接触。两条腿用期望的外科手术消毒剂诸如ChloraPrep Hi-Lite
将盖布样品穿戴大约1/2小时。在干燥屈曲环境挑战(将膝盖屈曲10次,尽可能舒适并笔直延伸)、湿屈曲环境挑战(施加盐水浸泡的纱布以覆盖中线5分钟,之后进行10次膝盖屈曲)之后,以及在脉冲灌洗挑战(使用低设置脉冲灌洗法沿两个盖布之间的中线施加200-300cc盐水溶液)之后,评估盖布翘起。在每次挑战之后标记并拍摄消毒盖布翘起的区域,如图6所示。在脉搏灌洗法翘起评估结束时,移除盖布样品和多余的皮肤消毒制剂。在盖布移除之后进行皮肤状况(发炎和剥皮)、粘合剂残留物、移除容易性和受试者疼痛水平的评估。报告每次临床研究的所有测试受试者的翘起面积的几何平均值(mm
进行全长盖布移除研究以使用健康受试者腿部上的全尺寸盖布来评估盖布的处理和移除性能。测试受试者坐在或躺在有衬垫的诊疗台上。如果在测试部位上存在过量的毛发,则在研究开始之前修剪这些区域以确保良好的样品-皮肤接触。在1小时穿戴时间内,受试者需要留在研究室中。
用DuraPrep
将二葡萄糖酸氯己定(CHG)防腐剂溶解于疏水性载体中,如美国专利9,713,659中所述。
通过下列方式来制备抗微生物粘合剂溶液:使用简单的手动搅拌将压敏粘合剂[溶于溶剂中的25%PSA]和疏水性载体中的CHG的溶液与GMIS、PRIPLAST 3197和溶于溶剂中的染料共混在一起,以产生包含78.48重量%PSA、2重量%CHG、10重量%GMIS和9.75重量%Priplast 3197以及0.02重量%FD&C红40号染料的含CHG抗微生物粘合剂溶液。
使用得自德国赛默飞世尔科技公司(Thermo Fisher Scientific Inc.,Germany)的Haake单螺杆挤出机(工作台300),根据表3中的挤出条件在纸张衬垫上挤出聚合物膜,用作背衬材料。
如拉伸和伸长率测试方法中所述,测试膜背衬的拉伸和伸长率特性。确定使测试样本伸长25%所需的力(Fx25)以最佳地表示膜背衬的适形能力。代表性的拉伸和伸长率曲线示于图7中。图8A至图8B示出了聚合物化学成分(树脂类型)和厚度对膜背衬的纵向(MD)和横向(CD)适形能力的影响。还记录了膜背衬在纵向和横向上的拉伸强度(UTS,使测试样本断裂的最大力),并且结果示于图9A至图9B中。
较低的Fx25是优选的以获得更好的适形能力。膜背衬的适形能力从高到低顺序为在相似膜厚度下的Estane 58123/Texin 1209、Elastollan ET870、Estane 58300和Estane58309。较低的膜厚度还提供更好的适形能力。然而,较低的膜厚度导致更低的拉伸强度。与由类似膜厚度的其他树脂制成的膜相比,由Estane 58309制成的膜具有更高的拉伸强度。
通过使用刮刀涂覆机在硅化剥离衬垫的剥离表面上施加粘合剂的均匀层随着手动铺展来涂覆以上制备的抗微生物粘合剂组合物的各部分。湿粘合剂涂覆厚度在50微米至510微米(2密耳-20密耳)的范围内。将经涂覆的粘合剂在烘箱中于介于65℃和93℃(150℉至200℉)之间的温度下干燥1分钟-10分钟。在室温下使用轧辊将干燥的粘合剂层合至预先制备的挤出膜背衬上。在施加粘合剂溶液之前,使用空气电晕或N
使用测试方法部分中所述的方法评估抗微生物压敏粘合剂对背衬的粘结强度,并且所得的值提供于表4中。较高的粘结强度(优选大于600克,更优选大于800克)是优选的,以确保在使用期间无残留的粘合剂留在患者的皮肤上。在表4中,“无菌”是指样品在测试之前是否被灭菌,并且EO是使用环氧乙烷灭菌。
使用上述涂覆程序,用上述抗微生物压敏粘合剂制剂以目标涂覆重量涂覆选定的挤出聚合物膜。表5提供了实施例的细节。然后将这些实施例转化成期望的测试样品尺寸,并进行EO灭菌以用于膝盖屈曲模型研究,该研究如上所述进行。制备另外的样品以用于Fx25测量。
背衬适形能力测试和膝盖屈曲模型研究的结果在表6和图10中示出。对于使用更适形的背衬膜制备的切口盖布而言,观察到较低的翘起面积(非零值的几何平均值)。
按照上述涂覆程序,用先前所述的压敏粘合剂制剂以目标涂覆重量涂覆选定的挤出膜。然后将经涂覆的样品转化成期望的测试样品尺寸,并进行EO灭菌以用于全长盖布移除研究。表7提供了这些实施例的细节。选择可商购获得的IOBAN 2切口盖布6650EZ作为对照。
在健康受试者的腿上进行处理性能和盖布移除研究,以将实施例11-15与对照(IOBAN 2切口盖布,6650EZ,购自明尼苏达州圣保罗的3M公司(3M Company,St.Paul,MN))进行比较。评估了盖布施加容易性、盖布移除容易性、舒适度/不适等级和撕裂性能,并报告于表8中。
还将经涂覆的样品转化成期望的测试样品尺寸,并使用上述程序针对膝盖屈曲模型研究进行EO灭菌。对照样本(Hytrel 4056)的厚度为1.0密耳,具有9格令/24in
在整篇本说明书内,除非上下文另外要求,否则单词“包含”或变型诸如“包括”或“含有”将理解为表示包括所述的整数或步骤,或整数或步骤的组,但是不排除任意其他整数或步骤,或整数或步骤的组。
除非上下文明确地另有规定,否则单数形式的“一个”和“该”包括多个指代物。因此,例如,提及“生物活性剂”包括两种或更多种此类试剂的混合物等。
范围在本文中可表示为从“约”一个特定值,和/或到“约”另一个特定值。当表示此类范围时,另一个方面包括从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”将值表示为近似值时,应当理解,该特定值形成另一个方面。还应当理解,范围中的每个范围的端值相对于另一个端值都是显著的,并且独立于另一个端值。
“生物活性剂”是指包括其等同物、“药物”和“药剂”,并且旨在具有最广泛的含义,如包括旨在用于疾病的诊断、治愈、缓解、治疗或预防,或旨在影响身体的结构或功能的物质。生物活性剂或其可接受的盐将以这样的量存在,使得组合物为正治疗的适应症诸如患者皮肤的正常皮肤菌群的消毒递送治疗有效量。
“可适形的”或“适形能力”是指可适形于表面(包括但不限于解剖表面)的材料。因此,当背衬施加到表面时,它适形于表面。在一些应用中,所选的材料即使在表面移动和拉伸以适应移动时也适形,但具有足够的回弹力以在表面返回到其未移动状态时继续适形于表面。合适的材料包括例如非织造纤维网、织造纤维网、机织材料、膜、片材、胶带和其他熟悉的背衬材料。此类材料可由天然材料和人造材料(包括聚合物材料)制成。此类可适形材料至少在35摄氏度-45摄氏度的温度下是可适形的。关于可适形的合成膜背衬,如根据ASTMD-638和D-882所测量的,膜应具有小于约400,000psi,优选小于约300,000psi的拉伸模量。
“干燥的人类皮肤部位”是指人的膝盖或肘部。
“成膜”是指当允许在环境条件(例如,23℃和50%相对湿度(RH))下在完整皮肤上干燥时形成连续层的组合物,该连续层在组织简单屈曲之后不剥落。
“疏水性”意指对于水滴具有低滚动角的材料。材料通常具有介于90°和140°之间的水的静态接触角(θ)。一般来讲,疏水性材料或涂层的特征在于90°或更高的水的静态接触角。
“正常皮肤菌群”是指存在于健康人的皮肤上的常居菌群,并通常主要由表皮葡萄球菌(Staphylococcus epidermidis)组成。
“增塑剂”是指增加材料的塑性或降低材料的粘度的添加剂。这些是为了改变其物理特性而添加的物质。这些是具有低挥发性的液体,或者甚至可以是固体。它们降低了聚合物链之间的吸引力,使它们更具柔性。
“相容的”是指增塑剂:(1)当以规定量组合时,不表现出与潜在过度增粘的粘合剂的总相分离;(2)一旦与潜在过度增粘的粘合剂混合,在老化时就不与其发生显著地相分离;以及(3)用作潜在过度增粘的粘合剂的流变改性剂,使得增塑组合物表现出如上所定义的压敏特性。
“聚合物”包括均聚物和共聚物,并且“共聚物”包括任何长度的两种或更多种类型的可聚合单体的聚合物(包括低聚物),因此包括三元共聚物、四元共聚物等,其可包括无规共聚物、嵌段共聚物或序列共聚物。
“多元醇”包括包含根据由C.R.Noller,Chemistry of Organic Compounds,第6章,第121-122页,1957年(C.R.Noller,Chemistry of Organic Compounds,Chapter 6,pages 121-122(1957))描述的Zerevitanov测试的活性氢的化合物。术语“多元醇”还意指平均官能度大于1,优选大于1.8,并且最优选为约2.0或更大但小于约6,优选小于约4,并且最优选为约3或更小的化合物。应当理解,包括在伯、仲和叔碳原子上具有(i)醇基团,(ii)伯胺和仲胺,(iii)硫醇,以及(iv)这些官能团的混合物的化合物。
“压敏粘合剂”通常包括固有发粘的或通过添加增粘树脂而增粘的材料(例如,弹性体)。它们可通过在《压敏粘合剂技术手册》,D.Satas,第2版,第172页,1989年(Handbookof Pressure Sensitive Adhesive Technology,D.Satas,2
“形貌表面”是指具有诸如凹陷和凸起之类的特征的表面,特别是参照对解剖学区域或部件的描述。
“伤口”是指对哺乳动物组织的损伤,其涉及膜诸如皮肤或粘膜表面的破裂,通常由(但不限于)外科切口、穿刺或撕裂引起对下面组织造成损伤。
1.一种制品,所述制品包括:
可适形背衬,所述可适形背衬具有相对的第一主表面和第二主表面并且包含选自聚氨酯、聚酯以及它们的组合物的热塑性聚合物,并且根据拉伸和伸长率测试方法,背衬在25%纵向伸长率下具有不大于60克/厘米力的拉伸强度;和
疏水性粘合剂,所述疏水性粘合剂设置在背衬的第一主表面的一部分上,该疏水性粘合剂包含阳离子生物活性剂、能够溶解生物活性剂的至少一部分的疏水性增溶剂、以及具有高于1500的重均分子量的疏水性增塑剂。
2.根据实施方案1所述的制品,其中所述热塑性聚合物为聚氨酯。
3.根据实施方案2所述的制品,其中所述热塑性聚合物为基于聚醚的热塑性聚氨酯。
4.根据实施方案3所述的制品,其中所述基于聚醚的热塑性聚氨酯包含芳族基团。
5.根据实施方案2所述的制品,其中所述热塑性聚合物为基于聚酯的热塑性聚氨酯。
6.根据实施方案1至5中任一项所述的制品,其中所述背衬是布置在连续层中的合成膜背衬。
7.根据实施方案1至5中任一项所述的制品,其中所述背衬具有0.5密耳至2密耳的平均厚度。
8.根据实施方案1至7中任一项所述的制品,其中所述背衬包含生物活性剂。
8a.根据实施方案1至8中任一项所述的制品,其中所述背衬具有与商品名为Elastolan ET870的均聚物基本上等同的特性。
8b.根据实施方案1至8a中任一项所述的制品,其中所述背衬具有介于8MPa和10MPa(包括端值在内)之间的杨氏模量。
9.根据实施方案1至7中任一项所述的制品,其中5格令至10格令的粘合剂设置在每30平方英寸的背衬上(16.5g/m
10.根据实施方案9所述的制品,其中6格令至9格令的粘合剂设置在每30平方英寸的背衬上(20g/m
11.根据实施方案13所述的制品,其中5格令至8格令的粘合剂(包括端值在内)设置在每30平方英寸的背衬上(16.5g/m
12.根据实施方案1至5中任一项所述的制品,其中所述热塑性聚合物具有不大于700%的极限伸长率。
13.根据实施方案1至9中任一项所述的制品,其中所述粘合剂包含生物活性剂。
14.根据实施方案1至13中任一项所述的制品,其中所述粘合剂为疏水性的。
15.根据实施方案1至14中任一项所述的制品,其中所述粘合剂为压敏粘合剂。
16.根据实施方案15所述的制品,其中所述压敏粘合剂包含:
(甲基)丙烯酸类共聚物,所述(甲基)丙烯酸类共聚物包含可固化组合物的交联反应产物,所述可固化组合物包含(甲基)丙烯酸类前体,所述(甲基)丙烯酸类前体为一价单体混合物的至少部分聚合的反应产物,所述一价单体混合物包含:
(1)第一单体,所述第一单体具有式CH
(2)第二单体,所述第二单体为由下式表示的乙烯基单体:
CHR
其中R
17.根据实施方案16所述的制品,其中R
18.根据实施方案17所述的制品,其中所述第二单体为乙酸乙烯酯。
19.根据实施方案16所述的制品,其中R
20.根据实施方案19所述的制品,其中R
21.根据实施方案16所述的制品,其中所述第一单体的R
22.根据实施方案21所述的制品,其中所述第一单体的R
23.根据实施方案22所述的制品,其中所述第一单体的R
24.根据实施方案23所述的制品,其中所述第一单体的R
25.根据实施方案21至24中任一项所述的制品,其中所述第一单体的R
26.根据实施方案21至25中任一项所述的制品,其中所述第一单体的R
27.根据实施方案21至26中任一项所述的制品,其中所述第一单体的R
28.根据实施方案27所述的制品,其中所述第一单体的R
29.根据实施方案21至28中任一项所述的制品,其中所述第一单体选自:丙烯酸异辛酯、丙烯酸-2-乙基己酯、丙烯酸月桂酯、丙烯酸异丁酯单体以及它们的组合物。
30.根据实施方案1至29中任一项所述的制品,其中所述第二单体选自乙酸乙烯酯、N-乙烯基己内酰胺(NVC)、N-乙烯基吡咯烷酮(NVP)、N,N-二甲基丙烯酰胺(nnDMA)、N,N-二乙基丙烯酰胺(nnDEA)和N,N-二甲基甲基丙烯酰胺以及它们的组合物。
31.根据实施方案1至30中任一项所述的制品,其中所述增溶剂为单酰基甘油酯、二醇、酯或它们的组合物。
32.根据实施方案31所述的制品,其中所述单酰基甘油酯的酰基基团为C8至C18酰基基团。
33.根据实施方案32所述的制品,其中所述单酰基甘油酯包含两个相邻的氢键合基团。
34.根据实施方案32至33中任一项所述的制品,其中所述单酰基甘油酯选自单辛酸甘油酯、单月桂酸甘油酯、单异硬脂酸甘油酯、单油酸甘油酯以及它们的组合物。
35.根据实施方案16至34中任一项所述的制品,其中所述(甲基)丙烯酸类共聚物占粘合剂的介于75重量%和85重量%(包括端值在内)之间。
36.根据实施方案35所述的制品,其中所述(甲基)丙烯酸类共聚物占粘合剂的介于75重量%和80重量%(包括端值在内)之间。
37.根据实施方案16至36中任一项所述的制品,其中所述一价单体混合物包含80重量%至90重量%(包括端值在内)的第一单体和10重量%至20重量%(包括端值在内)的第二单体。
38.根据实施方案16至37中任一项所述的制品,其中1重量%至3重量%(包括端值在内)的生物活性剂存在于粘合剂中。
39.根据实施方案16至38中任一项所述的制品,其中8重量%至11重量%(包括端值在内)的增溶剂存在于粘合剂中。
40.根据实施方案16至39中任一项所述的制品,其中所述粘合剂包含8重量%至11重量%(包括端值在内)的疏水性增塑剂。
41.根据实施方案1至40中任一项所述的制品,其中所述疏水性增塑剂具有降低或减小粘合剂的玻璃化转变温度至足以使粘合剂满足Dahlquist标准的能力。
42.根据实施方案41所述的制品,其中所述粘合剂具有不大于0.3兆帕斯卡(MPa)的弹性模量。
43.根据实施方案42所述的制品,其中所述粘合剂具有不大于0.1MPa的弹性模量。
44.根据实施方案1至43中任一项所述的制品,其中所述疏水性增塑剂具有1至2的HLB。
45.根据实施方案16至40中任一项所述的制品,其中所述粘合剂包含染料。
46.根据实施方案1至45中任一项所述的制品,所述制品还包括设置在背衬的第二主表面上的支撑层。
47.根据实施方案1至46中任一项所述的制品,所述制品还包括设置在粘合剂上的剥离衬垫。
48.根据实施方案1至47中任一项所述的制品,其中由热塑性聚合物形成的材料具有不大于75的肖氏硬度A等级。
49.一种系统,所述系统包括:
根据实施方案1至48中任一项所述的制品,其中所述制品具有第一侧和第二侧;
包含醇的防腐剂溶液,其中当制品的第一侧接触施加到形貌表面的防腐剂溶液层时,制品的任何部分从形貌表面的统计相关的样品组翘起的频率不大于80%。
50.根据实施方案49所述的系统,其中所述防腐剂溶液为包含生物活性剂的成膜组合物。
51.根据实施方案49所述的系统,其中所述形貌表面为解剖表面。
52.根据实施方案49所述的系统,其中所述解剖表面是人膝盖。
53.根据实施方案49至52中任一项所述的系统,其中制品的不大于7.5%、或更优选不大于5.8%、或最优选不大于5.0%的表面区域从形貌表面翘起。
54.根据实施方案49所述的系统,其中所述成膜组合物包含聚合物。
55.根据实施方案49所述的系统,其中所述生物活性剂包括碘。
56.根据实施方案49所述的系统,其中所述生物活性剂包括氯己定盐。
57.根据实施方案49所述的系统,其中所述表面为哺乳动物皮肤。
58.根据实施方案49所述的系统,其中所述形貌表面为成年人的关节。
59.一种方法,所述方法包括:
提供生物活性剂;
将根据前述实施方案中任一项所述的(甲基)丙烯酸类共聚物、根据前述实施方案中任一项所述的生物活性剂、根据前述实施方案中任一项所述的增溶剂和根据前述实施方案中任一项所述的增塑剂混合以形成粘合剂组合物;
将粘合剂组合物沉积到可适形背衬上以形成制品,所述背衬具有相对的第一主表面和第二主表面并且包含选自聚氨酯、聚酯以及它们的组合物的热塑性聚合物,其中由热塑性聚合物形成的材料具有大于70的肖氏硬度A等级,并且背衬在25%的纵向伸长率下具有不大于60克/厘米力的拉伸强度。
60.根据实施方案59所述的方法,所述方法还包括:
调理生物活性剂。
61.根据实施方案59所述的方法,其中调理生物活性剂包括从生物活性剂中去除水。
62.根据实施方案61所述的方法,其中去除水包括冻干生物活性剂。
63.根据实施方案59至62中任一项所述的方法,所述方法还包括:将制品施加于患者。
64.一种方法,所述方法包括:
将成膜组合物施加到患者的表面;
将根据实施方案1至48中任一项所述的制品施加到表面;
使用膝盖模型所测量的话,能够使得制品的不大于7.5%的表面区域从表面翘起。
65.根据实施方案64所述的方法,其中施加制品包括:
从制品中移除剥离衬垫;
抓握邻近膜的第一侧边和第二侧边的部分;
将制品定位在手术部位上方,并且使粘合剂朝向患者身体上的手术部位;以及
将制品适形地粘附在手术部位上方。
- 具有背衬的医疗制品
- 具有泡沫背衬的带涂层磨料制品以及制备方法
