可再次应答的记忆B细胞及其用途
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,具体地,本发明涉及可再次应答的记忆B细胞。更具体地,本发明涉及可再次应答的记忆性B细胞、调节其在记忆性B细胞群中的比例的方法、药物和治疗用途,还涉及评价疫苗效力的方法。
背景技术
记忆B细胞是B细胞的一种亚型,在原始感染后在生发中心内形成,在再次感染的情况下,记忆B细胞在产生加速和更强的抗体介导的免疫反应(也称为二次免疫应答)中起重要作用。作为对抗原再暴露的响应,记忆B细胞可以迅速生成产生抗体的浆细胞(PC),并在不同程度上产生次级生发中心(GC)(Weisel,F.&Shlomchik,M.Memory B Cells of Miceand Humans.Annual Review of Immunology 35,255–284(2017))。
Zfp318是一种具有Cys2/His2锌指基序的基因,主要在睾丸的生殖细胞中表达。它编码两种替代转录物,通过它们的过表达来调节雄激素受体介导的转录激活或抑制,其可以调节幼稚B细胞中精子形成(Ishizuka,M.et al.Abnormal spermatogenesis and maleinfertility in testicular zinc finger protein Zfp318-knockout mice.Dev GrowthDiffer 58,600–608(2016).),其锌指结构域表现出结合RNA的U1型锌指的特征,调节初始B细胞中Igm/Igd基因的转录终止,调节IgD表达。ZFP318在免疫系统中唯一已知的功能是通过抑制转录终止位点的识别以允许IgD表达(Enders,A.et al.Zinc-finger proteinZFP318 is essential for expression of IgD,the alternatively spliced Ighproduct made by mature B lymphocytes.Proc National Acad Sci 111,4513–4518(2014);Pioli,P.D.,Debnath,I.,Weis,J.J.&Weis,J.H.Zfp318 Regulates IgDExpression by Abrogating Transcription Termination within the Ighm/IghdLocus.J Immunol 193,2546–2553(2014))。然而,GC后MBC并不表达IgD。在发明人之前在UBP-2A-Fucci报道小鼠中鉴定GC记忆前体的工作中,注意到Zfp318在准备迁出GC和记忆发育的选择后细胞中上调(Wang,Y.et al.Germinal-center development of memory Bcells driven by IL-9from follicular helper T cells.Nature immunology 18,921–930(2017).)。
先前的研究将次级GC的记忆生成与未转换的或PDL2
发明内容
本发明人令人惊讶地发现,ZFP318在B细胞上的表达揭示了一类可再次应答的记忆B细胞,这样的一类记忆B细胞可以提供有意义的反应,与体液免疫的强度和/或体液免疫的持久性相关联。本发明人还发现了可用于调节这样的一类记忆B细胞在整体记忆B细胞群中的比例的手段。通过这样的手段,可以调节这样的一类记忆B细胞在整体记忆B细胞群中的比例,进而调节体液免疫的强度和/或体液免疫的持久性,提供治疗和/或预防方面的益处。
因此,本发明在一个方面提供了一种调节体液免疫的强度和/或体液免疫的持久性的方法,该方法包括调节ZFP318在B细胞上的表达,以改变该表达ZFP318的B细胞在记忆性B细胞群中的比例的步骤。
根据前述本发明的方法,其中经由BCR和/或CD40信号传导通路调节ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用CD40或CD40L的激动剂或表达促进剂上调ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用CD4
根据前述本发明的方法,其中使用CD40或CD40L的拮抗剂或表达抑制剂下调ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用拮抗性抗CD40抗体或拮抗性抗CD40L抗体下调ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用BCR的激动剂或表达促进剂下调ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用抗Ig抗体下调ZFP318在B细胞上的表达。
根据前述本发明的方法,其中使用BCR的拮抗剂或表达抑制剂上调ZFP318在B细胞上的表达。
本发明在另一个方面提供了一种分离表达ZFP318的可再次应答的记忆性B细胞的方法,该方法包括针对细胞标志物ZFP318以及CD19、B220、CD138、GL7、FAS、CD38和/或IgD等进行流式细胞分选的步骤。
根据前述本发明的方法,其中所分离的记忆性B细胞为ZFP318
根据前述本发明的方法,其中所分离的记忆性B细胞为ZFP318
本发明在又一个方面提供了BCR和/或CD40或CD40L调节剂在制备药物中的用途,其中所述药物通过调节表达ZFP318的B细胞在记忆性B细胞群中的比例,以治疗与可再次应答的记忆B细胞的数量相关的疾病。
根据前述本发明的用途,其中所述疾病选自系统性红斑狼疮、类风湿性关节炎、系统性血管炎、硬皮病、皮肌炎等自身免疫疾病;各类免疫缺陷症;以及有B细胞沁润的肿瘤。
根据前述本发明的用途,其中使用CD40或CD40L的激动剂或表达促进剂上调ZFP318在B细胞上的表达。
根据前述本发明的用途,其中使用CD4
根据前述本发明的用途,其中使用CD40或CD40L的拮抗剂或表达抑制剂下调ZFP318在B细胞上的表达。
根据前述本发明的用途,其中使用拮抗性抗CD40抗体或拮抗性抗CD40L抗体下调ZFP318在B细胞上的表达。
根据前述本发明的用途,其中使用BCR的激动剂或表达促进剂下调ZFP318在B细胞上的表达。
根据前述本发明的用途,其中使用抗Ig抗体下调ZFP318在B细胞上的表达。
根据前述本发明的用途,其中使用BCR的拮抗剂或表达抑制剂上调ZFP318在B细胞上的表达。
本发明在再一个方面提供了一种疫苗组合物,该疫苗组合物包含抗原和ZFP318表达促进剂。
根据前述本发明的疫苗组合物,其中所述ZFP318表达促进剂经由BCR和/或CD40信号传导通路上调ZFP318在B细胞上的表达。
根据前述本发明的疫苗组合物,其中所述ZFP318表达促进剂选自BCR的拮抗剂或表达抑制剂、表达CD40L的T辅助细胞如CD4
本发明在还一个方面提供了一种评价疫苗效力的方法,其中包括检测初次免疫后表达ZFP318的可再次应答MBC的丰度的步骤。
本发明在又一个方面提供了一种用于评价疫苗效力的试剂盒,其中包括用于检测初次免疫后表达ZFP318的可再次应答MBC的丰度的试剂。
通过在分子水平上定义可再次应答的MBC,本发明为生物标志物的未来发展提供了信息,为调节获得性免疫过程提供了不同的途径和手段,且可通过该生物标志物更准确地预测疫苗诱导的体液免疫记忆的强度和持久性。
附图说明
以下参考附图仅示例性描述本发明。需强调的是,所示细节仅作为示例且说明性地表示本发明的优选实施方案,用以描述本发明的原理和概念。本领域技术人员容易知晓如何参考附图描述以本发明的各种形式进行实践。
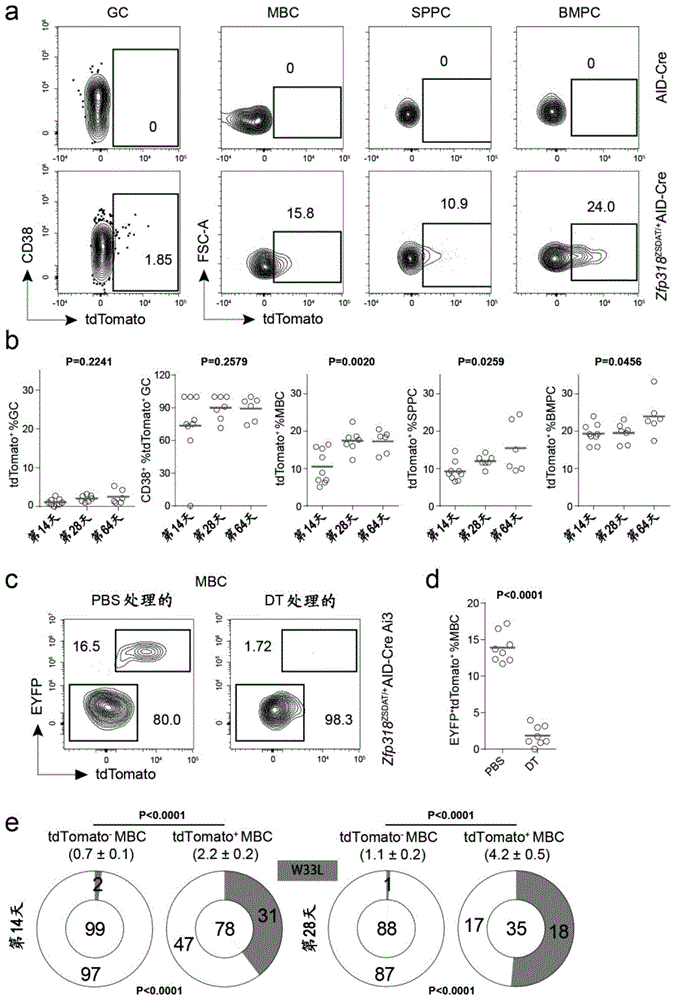
图1.ZSDAT报告基因揭示的MBC异质性。
a.NP-KLH免疫后14天,来自AID-Cre(顶行)或Zfp318
图2.表达ZFP318的MBC携带可再次应答的记忆。
a-c.Zfp318
图3.ZFP318是MBC可再次应答的基础。
a-d.野生型和ZFP318缺陷型B细胞的唤醒测试。a.实验设计。b.c.用于识别GC、脾脏PC(b)和Ai3+GC、PC(c)的门控策略以及这些细胞丰度的汇总数据(d)。数据来自2个独立实验。Mann-Whitney t检验获得P值。e-f.MBC唤醒实验利用过继转移表达GFP的Zfp318
图4.ZFP318表达由CD40信号促进并与抗原结合亲和力相关。
a-b.在用抗IgM/IgG(a)、抗CD40(b)或各自的对照(a-b)刺激4小时后,幼稚B细胞、DZ GC B细胞或LZ GC B细胞中的Zfp318 mRNA水平。数据来自5个独立实验,每对圆圈表示一个实验。用比例配对t检验获得P值。c-d.tdTomato平均荧光强度(MFI)和单个抗原结合MBC的相对亲和力(计算为抗原结合的MFI除以IgM或IgG的MFI)的散点图,在Zfp318
图5.ZFP318协调有利于唤醒的线粒体状态。
a-e.ZFP318
图6.可消融细胞的ZSDAT报告基因的验证。
a-b.B细胞中的ZFP318表达。a.用于分选CD38
图7.功能性ZFP318的一个等位基因的缺失不会影响初级反应。
a-c.NP-KLH免疫后第14天Zfp318
图8.表达ZFP318的MBC负责GC依赖性唤醒。
a-c.利用来自Zfp318
图9.表达ZFP318的MBC的同种型组成和CD80-PDL2表征。
a.b.同种型组成。NP-KLH免疫后第28天,来自Zfp318
图10.初级B细胞反应不需要ZFP318。
a-c.NP-KLH免疫后第28天,Zfp318
图11.ZFP318是MBC可再次应答的基础。
a-c.MBC唤醒实验利用过继转移表达GFP的Zfp318
图12.ZFP318协调有利于唤醒的线粒体状态。
a-b.MBC唤醒实验利用过继转移表达GFP的Zfp318
图13.在B6中表面标记标签ZSDAT
a.NP-KLH免疫后28天,tdTomato
图14.表达ZFP318的MBC的丰度可预测疫苗接种结果的质量。
a-b.两种佐剂之间的比较。a.在Zfp318
图15.CXCR3可以部分指征T+群体且CXCR3的表达可能受到ZFP318的调控。
将表达Zfp318
图16.测量次级宿主中携带NP特异性BCR的记忆B细胞在过表达ZFP318后的唤醒反应的实验流程图。
图17.流式分选画门示意图。
从左上开始横向:圈到B细胞,再到nonGC细胞,再到CD38阳性的MBC细胞,再到NP抗原特异的细胞,再区分CD73的表达。
图18.CD73-的MBC在过表达ZFP318后,其二次应答能力会显著增强。
图示了CD73-的不含诱导元件组和CD73-的含诱导元件组的二次免疫应答中生发中心GC和浆细胞PC的生成情况。
图19.CD73+的MBC在过表达ZFP318后,其二次应答能力增强不明显。
图示了CD73+的不含诱导元件组和CD73+的含诱导元件组的二次免疫应答中生发中心GC和浆细胞PC的生成情况。
图20.CD73-和CD73+的MBC在过表达ZFP318后,其二次应答能力的测定。
具体实施方式
发明人在本发明中的研究工作发现,无论是通过在次级宿主中过继转移后的抗原再攻击,还是通过体外直接抗BCR再刺激,大部分抗原特异性MBC无法有效唤醒。基于ZFP318表达,在具有完整多克隆库的小鼠中进行明矾佐剂的NP-KLH免疫后8周,只有10-20%的半抗原特异性MBC是可再次应答的。在流感PR8感染模型中,HA特异性MBC含有20-50%的表达ZFP318的细胞。还值得注意的是,大多数(如果不是全部)表达ZFP318的MBC都具有近似的GC起源(图1c)。产生GC或PC的不同唤醒能力依赖于ZFP318,并且ZFP318的表达由T辅助细胞所促进并与亲和力呈正相关。ZFP318是可再次应答所必需的,并且其被T辅助细胞上调这一事实表明,那些无法有效唤醒的MBC在成为MBC之前没有接触足够水平的T辅助细胞。不可再次应答的MBC可能代表B细胞无反应状态,对BCR刺激反应不佳。根据本发明的研究结果可以确定,T辅助细胞能够将这些细胞拯救回有意义的反应。
通过分子定义可再次应答的MBC,发明人的工作为生物标志物的未来发展提供了信息,以更准确地预测疫苗诱导的体液免疫的强度和/或体液免疫记忆的持久性。在T细胞依赖性反应中,发明人的工作揭示了在GC反应期间个体B细胞所接触的T辅助细胞的质量和数量是真正的功能性B细胞记忆的决定因素。发明人的工作还揭示了,通过连续免疫成功诱导针对病原体的重度突变抗体的关键是确保在多抗原攻击中维持任何所需谱系的ZFP318依赖的可再次应答性。本发明由此鉴定了可再次应答的记忆B细胞,并明确ZFP318是功能性B细胞记忆的调节器。
发明人还发现可以通过改变表达ZFP318的B细胞在记忆性B细胞群中的比例来调节体液免疫的强度和/或体液免疫记忆的持久性。在一些实施方式中,可以通过调节ZFP318在B细胞上的表达来改变表达ZFP318的B细胞在记忆性B细胞群中的比例。
在一些实施方式中,可以改变表达ZFP318的B细胞在记忆性B细胞群中的比例。
在一些实施方式中,可以使用CD40或CD40L的激动剂或表达促进剂上调ZFP318在B细胞上的表达。
在一些实施方式中,可以使用现有技术公开的任何激动性抗CD40抗体或激动性抗CD40L抗体上调ZFP318在B细胞上的表达。优选地,在一些实施方式中,激动性抗CD40抗体是CP-870,893、Dacetuzmumab、APX005M、ADC-1013、Chi Lob 7/4、Mitazalimab、Sotigalimab、ABBV-927、CDX-1140、SEA-CD40、Selicrelumab、ADC-1013、anti-CD40(克隆FGK4.5/FGK45,BioXCell)。更优选地,在一些实施方式中,激动性抗CD40抗体是anti-CD40(克隆FGK4.5/FGK45,BioXCell)。
本文所述的激动性抗CD40抗体或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂等可呈组合物形式,这些组合物包含抗体(或激动剂或表达促进剂)及一种或多种运载体、赋形剂和/或稀释剂。可以将组合物配制用于特定用途,例如用于兽医用途或人类的药物用途。组合物的形式(例如干粉、液体配制品等)和使用的赋形剂、稀释剂和/或运载体将取决于调节体液免疫的强度和/或体液免疫记忆的持久性的用途,以及给药方式。该组合物可利用各种途径来向受试者施用,这些途径诸如,经口、经皮、皮下、鼻内、经静脉内、肌内、瘤内、鞘内、表面或局部。在任何给定情况下的最合适施用途径将视特定抗体、受试者、及受试者的生理条件而定。通常,该组合物应经静脉内或皮下施用。
含有激动性抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)的组合物可以以每剂量含有预定量的抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)的单位剂量形式存在。包括于单位剂量中的抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)的数量将视治疗所需而定。此类单位剂量可呈含有适合于单次施用的一定量的抗体的冻干干粉形式,或呈液体形式。干燥粉单位剂型可以与注射器、适量的稀释剂和/或其他可用于给予的组分包装在试剂盒中。呈液态形式的单位剂量可宜呈预填有适合于单次施用的一定量的抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)的注射器形式来提供。
所施用抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)的组合物量将视各种因素而定,这些因素包括但不限于:施用模式、施用频率、所需益处及其他参数(诸如,患者的年龄、体重及其他特征等)。针对特定模式及施用频率的有效提供益处的剂量的测定是在本领域普通技术人员的能力内。在一些实施方式中,抗CD40抗体(或激动性抗CD40L抗体或CD40或CD40L的激动剂或表达促进剂)以每1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28天一次以静脉注射或其他给药形式按以下剂量来施用:0.005mg/kg、0.01mg/kg、0.02mg/kg、0.03mg/kg、0.04mg/kg、0.05mg/kg、0.06mg/kg、0.08mg/kg、0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、1.0mg/kg、1.1mg/kg、1.2mg/kg、1.3mg/kg、1.4mg/kg、1.5mg/kg、1.6mg/kg、1.7mg/kg、1.8mg/kg、1.9mg/kg、2.0mg/kg、2.2mg/kg、2.4mg/kg、2.6mg/kg、2.8mg/kg、3.0mg/kg、3.2mg/kg、3.4mg/kg、3.6mg/kg、3.8mg/kg或4.0mg/kg。
如本领域普通技术人员应了解,上文所描述的各种试剂的建议剂量可能需要调整以使受试者反应优化且使受试者益处最大化。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解的相同的含义。为了本发明的目的,下文定义了下述术语。
冠词"一个/一种(a/an)"和"该/所述(the)"在本文中用于指一个/一种或超过一个/一种(即至少一个/一种)所述冠词的语法对象。例如,"要素"意指一个/一种要素或超过一个/一种要素。
替代(例如"或")的使用应理解为意指替代方案中任一、两者或其任何组合。
术语"和/或"应理解为意指替代方案中任一或两者。
如本文使用的,术语"约"或"大约”是指与参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度相比较,改变多达15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度。在一个实施方式中,术语"约"或"大约”是指围绕参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度±15%、±10%、±9%、±8%、±7%、±6%、±5%、±4%、±3%、±2%或±1%的数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度范围。
在本说明书全文,除非上下文另有要求,否则术语"包含",“包括”、“含有”和“具有”应理解为暗示包括所述步骤或要素或者步骤或要素组,但不排除任何其他步骤或要素或者步骤或要素组。在特定实施方式中,术语"术语"包含",“包括”、“含有”和“具有”同义使用。
"由……组成"意指包括但限于在短语"由……组成"后的任何。因此,短语"由……组成”是指示所列出的要素是需要的或强制性的,并且没有其他要素是可以存在的。
"基本上由……组成"意指包括在短语"基本上由……组成"后列出的任何要素,并且限于不干扰或贡献于所列出的要素的公开内容中指定的活动或动作的其他要素。因此,短语"基本上由……组成”是指示所列出的要素是需要的或强制性的,但没有其他要素是任选的,并且取决于它们是否影响所列出的要素的活动或动作而可以存在或不存在。
在本说明书全文,提到"一个实施方式"、"实施方式"、"特定实施方式"、"相关实施方式"、"某个实施方式"、"另外的实施方式"或"进一步的实施方式"或其组合意指与所述实施方式结合描述的特定特征、结构或特性被包括在本发明的至少一个实施方式中。因此,前述短语在本说明书全文的各个地方的出现不一定全部指相同实施方式。此外,特定特征、结构或特性可以以任何合适方式在一个或多个实施方式中组合。
如本文使用的,术语“表达促进剂”是指能够提高或上调相应基因在细胞(如B细胞)中表达的任何试剂。本领域技术人员能够理解,所述提高或上调可以以本领域常规技术方法测定(如:蛋白质免疫印迹、RT-qPCR、流式细胞术等)。
在一些实施方式中,所述表达提高或表达上调1%、2%、5%、10%、20%、50%、100%或更多,或前述数值中的任意两者组成的范围中的百分比。
如本文使用的,术语“表达抑制剂”是指能够降低或下调相应基因在细胞(如B细胞)中表达的任何试剂。本领域技术人员能够理解,所述降低或下调可以以本领域常规技术方法测定(如:蛋白质免疫印迹、RT-qPCR、流式细胞术等)。
在一些实施方式中,所述表达降低或表达下调1%、2%、5%、10%、20%、50%、100%或更多,或前述数值中的任意两者组成的范围中的百分比。
如本文使用的,术语“调节表达”是指能够提高或上调或降低或下调相应基因的表达。
方法
老鼠
57BL/6(Jax 664)、GFP转基因(Jax 4353)、AID-Cre(Jax 018422)、Rosa26-Ai3(Jax 7903)和OVA323-339特异性T细胞受体转基因OT-II(Jax 4194)和HEL特异性Ig转基因MD4(Jax 2595)小鼠最初来自Jackson实验室。ZFP318报告性ZSDAT敲入/敲除小鼠是在BIOCYTOGEN通过CRISPR/Cas9技术开发的。B1-8
免疫和病毒感染
为了用SRBC进行免疫,每只小鼠腹膜内注射1ml SRBC悬浮液(郑州百吉公司)。为了测量不同实验中的NP特异性反应,小鼠腹膜内注射与2μg LPS(Sigma)一起混合在明矾(Thermo Scientific)或PBS中的100μg NP-KLH、100μg或20μg或10μg NP-OVA(BiosearchTechnologies,20μg用于唤醒)。为了准备用于MBC转移的已引入载体的小鼠,用与2μg LPS一起混合在明矾中的100μg OVA对小鼠进行腹膜内免疫。对于某些实验,小鼠在麻醉下通过腹膜内三溴乙醇(250mg/kg)鼻内感染50PFU的PR8流感病毒,或用50μg血凝素腹膜内免疫。对于佐剂比较实验,如前所述,用100μg NP-KLH与明矾中的脂多糖混合或与300μg MnJ(MnStarter Biotechnology)混合对小鼠进行腹膜内免疫(Zhang,R.et al.Manganesesalts function as potent adjuvants.Cell Mol Immunol 18,1222–1234(2021))。在比较RBD和3×RBD三聚体mRNA疫苗的实验中,小鼠分别用10μg的mRNA LNP(苏州艾博公司)进行肌内免疫。在比较重组RBD二聚体或IFN-Pan-RBD-Fc蛋白的实验中,如前所述,用3.4μgRBD二聚体或10.4μg IFN-Pan-RBD-Fc蛋白对小鼠进行皮下免疫(Sun,S.etal.Interferon-armed RBD dimer enhances the immunogenicity of RBD forsterilizing immunity against SARS-CoV-2.Cell Res 1–13(2021)doi:10.1038/s41422-021-00531-8)。
流式细胞术
为了通过流式细胞术分析不同的细胞群,用PBS洗涤单细胞悬液,然后用MACS缓冲液中的指定抗体染色(PBS补充有1%FBS和5mM EDTA)。染色试剂包括来自BD生命科学的PerCP Cy5.5 anti-IgD、PE-Cy7 anti-CD95、FITC anti-IgG3、PE anti-CD86、FITC anti-I-A/I-E;eBioscience的AF700抗CD38、EF450抗GL7、APC抗CD80、APC抗CD86、FITC抗PD-L2;Biolegend的别藻蓝蛋白(APC)-Cy7抗B220、BV510抗CD138、FITC抗IgG1、FITC抗IgG2b、BV421抗IgM、PerCP Cy5.5抗Gr1、PE-CD73、链霉亲和素-APC、链霉亲和素-PE、MitoSpy
记忆B细胞的唤醒试验
首先,为了测量初级宿主的唤醒反应,在初次NP-KLH免疫30天后,再次用10μg NP-KLH攻击Zfp318
电镜成像
分选的记忆B细胞或幼稚B细胞用2.5%戊二醛在0.1M PB缓冲液中固定2小时,然后用PB缓冲液冲洗3×10分钟。用1%四氧化锇/K
B细胞的体外刺激
分选的记忆B细胞或微珠选择的幼稚B细胞(每孔约5×10
NP特异性B细胞的V
通过在冰上用330ng/ml的生物素化NIP
定量RT-PCR
使用SYBR Premix Ex Taq II(Tli RNaseH Plus)(RR820;Takara)在7500实时PCR系统(Thermo Fisher)上进行定量RT-PCR。使用的引物是:Actb有义链5'-GCTTCTTTGCAGCTCCTT、反义链5'-TGCCAGATCTTCTCCATGT;Zfp318有义链5'-ATGTGAGCCCTCGGGAAATG,反义链5'-TGCCGGTTCCAGATGAGATT。Dtr有义链5'-AGGGAAGAAGAGGGACCCAT,反义链5'-AAACATGAGAAGCCCCACGAT。
通过ELISA测量血清NP特异性IgG
从相关小鼠中收集血清并储存于-80℃直至使用。在PBS中用NP23-BSA(BiosearchTechnologies)包被96孔ELISA板(42592,Costar)过夜并洗涤。然后将1:2系列稀释(从1:800开始)的每个血清样品加载到ELISA板中,37℃下孵育1小时。洗涤后,将ELISA板与HRP缀合的山羊抗小鼠IgG(poly4053,Biolegend)以1:20000的比例进一步孵育1小时,然后用TMB底物组(421101,Biolegend)进行显影。用1M HCL终止显色反应,并在iMark读板器上读取光密度(OD)。对于每组动物,所得稀释曲线与Prism(Graphpad)中的3参数剂量反应曲线拟合。两组用于比较的曲线通过额外的平方和F检验进行分析,它们的标称EC50用于计算NP特异性IgG滴度的倍数变化。
RNA-seq和数据分析
在6μl裂解缓冲液(0.2%Triton X-100和2U/μl RNase抑制剂)中裂解大约200-1000个所需类型的细胞。裂解液与3μl锚定oligo-dT引物(10μM,5'-AAGCAGTGGTATCAACGCAGAGTACT30VN-3')和3μl dNTP混合物(10mM,Fermentas)混合,在72℃下变性3分钟,然后立即置于冰上。第一链反应混合物包含1μl SuperScript II逆转录酶(Invitrogen)、0.5μl RNAse抑制剂(Clontech)、4μl SuperScript II第一链缓冲液(Invitrogen)、1μl DTT(100mM,Invitrogen)、4μl甜菜碱(5M,Sigma)、0.12μl MgCl2(1M,Sigma)、0.2μl TSO(100μM)和0.58μl无核酸酶水添加到每个样品中。如下进行逆转录反应:42℃下孵育90分钟,然后进行10个循环(50℃2分钟,42℃2分钟),最后,70℃下孵育15分钟来灭活逆转录酶。将含有25μl KAPA HiFi HotStart ReadyMix、0.5μl IS PCR引物(10μM)和1.1μl无核酸酶水的PCR混合物添加到每个样品中。进行如下反应:98℃下孵育3分钟,然后循环17次(98℃20秒、67℃15秒、72℃6分钟),最后在72℃下延伸5分钟。按照制造商的说明,通过Vazyme DNA清洁珠纯化cDNA。1ng cDNA用于使用Tn5(Vazyme)的标记反应。标记反应物(20μl)在55℃下孵育10分钟,添加2μl 0.2%SDS终止孵育并在70℃下孵育20分钟。使用Q5聚合酶(NEB)进行第二次扩增,如下所示:72℃3min,98℃30s,然后进行12个循环(98℃15s,60℃30s,72℃3min),在72℃下最后延伸5分钟。使用Vazyme DNA清洁珠纯化文库。清楚的读数通过STAR v2.2.0以默认设置映射到小鼠基因组(mm10)。用FeatureCounts软件收集位于每个基因编码序列(CDS)中的读数。标准化为可制图读数的CDS计数用于测量基因表达。使用GSEA_4.1.0软件和KEGG(缬氨酸、亮氨酸和异亮氨酸降解途径;糖酵解途径;氧化磷酸化途径)进行GSEA分析,所述GSEA_4.1.0软件使用来自Gene Ontology的基因列表(线粒体基因;脂肪酸氧化途径)。
实验分组和统计数据分析
对于所有相关的动物实验,随机选择年龄和性别匹配的小鼠包括在不同的处理组中。每组通常有3至5只动物,每个测定进行2至6次独立实验。这项工作中涉及的动物实验不需要盲法。使用双尾Student’s t检验来比较不同组的终点平均值,除非另有说明。图形是在Prism(GraphPad)中制作的。
实施例
下面结合实施例对本发明作进一步的详细描述,该实施例仅用于说明本发明,而不应视为限定本发明的范围。在不偏离本发明基础上所做的修改或改进,均属于本发明的保护范围。如无特殊说明,下述实施例所用的实验方法,均为常规方法;所用的试剂、材料均可从商业途径得到。
实施例1 GC衍生的MBC表达ZFP318
发明人构建了一个功能丧失的Zfp318等位基因,它与细胞消融装置一起有条件地表达荧光报告基因(图6c)。在紧接Zfp318基因转录起始位点的下游插入了一个包含STOP框的构建体,其两侧是两个flox位点,紧随其后的是白喉毒素受体(DTR)的编码序列、Theseaasigna病毒自切割2A肽的编码序列和tdTomato的编码序列(图6c)。该突变等位基因不能表达Zfp318基因,但通过Cre驱动子切除STOP框后,它允许在内源性Zfp318基因控制下表达DTR和tdTomato。发明人将这个修饰的等位基因表示为ZSDAT,进一步用其繁殖AID-Cre小鼠以获得Zfp318
之前有报道称,在完全没有ZFP318的情况下,B细胞发育正常
实施例2 GC衍生的而非GC非依赖性的MBC负责抗原唤醒
MBC最重要的功能是通过产生次级PC和GC来快速响应抗原再攻击,而尚未正式证明不依赖GC和依赖于GC的MBC是否不同或同等地有助于唤醒反应
这些结果表明,在每个细胞的基础上,表达ZFP318的GC衍生的MBC在产生次级GC和PC方面比不依赖GC的MBC更优越并且使占主导地位的唤醒响应者。另一方面,长期以来人们一直观察到,次级GC的唤醒生成受到未切换或PDL2
实施例3 MBC唤醒需要ZFP318
为了了解ZFP318本身是否是MBC可再次应答所必需的,发明人培育了纯合Zfp318
实施例4 ZFP318表达由T辅助细胞促进
ZFP318在GC记忆前体中上调(图6)并控制GC衍生的MBC的可唤醒性。为了确定可能驱动ZFP318上调的潜在因素,用抗Ig抗体处理分选的亮区(LZ)或暗区(DZ)GC B细胞以模拟BCR的抗原刺激,或用激动性抗CD40抗体(克隆FGK4.5/FGK45,BioXCell)处理以模拟T辅助细胞经由CD40配体发挥作用。幼稚B细胞用来作为对照。有趣的是,ZFP318表达仅通过CD40信号传导且仅在LZ GC B细胞中上调,而实际上它在所有类型的B细胞中被BCR刺激下调(图4a),这表明T辅助细胞在基于亲和力的正选择过程中在促进ZFP318表达中起关键作用,这是由T辅助细胞驱动的,主要发生在GC光区
与ZFP318表达和T辅助细胞之间的正相关一致,当相对于个体MBC上的表面Ig表达水平对结合NIP的荧光强度进行标准化以反映它们的相对亲和力时,发明人还观察到ZFP318表达水平(tdTomato荧光)与相对亲和力之间存在强烈的正相关性(图4c)。这种类型的正相关并不是NP半抗原特异性反应所特有的,因为它也在PR8流感感染后结合血凝素的tdTomato
实施例5 ZFP318是有助于抗原唤醒的线粒体状态所必需的
为了了解ZFP318如何控制MBC的唤醒能力,发明人进行了mRNA测序以比较来自AID-Cre、Zfp318
由于在第30天很难恢复足够数量的抗原特异性MBC来进行超微结构分析。为了避免这个问题,发明人采用了之前使用的B1-8
随后,发明人通过电子显微镜对分选的MBC进行了超微结构研究。如图5h所示并在图5i中定量,异源型ZFP318中的线粒体比缺陷型ZFP318 MBC中的线粒体更多,而幼稚B细胞中的线粒体在两种基因型之间具有可比性,并且水平显著低于杂合MBC。由于在没有ZFP318的情况下初级免疫反应不受影响(图10),并且幼稚B细胞的激活不受ZFP318的影响(未显示),在没有ZFP318的情况下,线粒体数量丰度的差异不能成为MBC可唤醒性严重受损的唯一解释。另一方面,通过仔细检查单个线粒体,发明人发现结构受损的线粒体,即具有肿胀形态和很少完整嵴的线粒体,在ZFP318缺陷型MBC中更为常见(图5j-k)。这种结构受损的线粒体可能会引发MBC激活诱导的细胞死亡。与这个想法一致,用抗Ig进行短暂的体外激活导致ZFP318缺陷型MBC的细胞凋亡显著增加,如激活的Caspase 3和γH2AX
实施例6表达ZFP318的GC衍生的MBC在CD73
CD73和CCR6都被认为是与源自GC的抗原特异性MBC相关的标志物
实施例7表达ZFP318的MBC的丰度与疫苗诱导的体液免疫质量相关
最后,鉴于表达ZFP318的GC衍生MBC是唤醒中的主要记忆功能这一事实,由GC衍生的MBC的丰度而不是在初次免疫后产生的总抗原结合MBC的丰度来预测由初免-加强疫苗接种诱导的抗体免疫强度。发明人在三个已发表的初免加强疫苗设置中测试了这个想法。首先,胶体锰盐(Mn jelly,MnJ)作为潜在的佐剂,通过部分激活cGAS-STING和NLRP3通路,与使用明矾作为佐剂可实现的反应相比,可促进更好的抗体反应
实施例8 CXCR3的表达受到ZFP318的调控
将表达Zfp318
实施例9诱导ZFP318的表达,可以显著提升本身不太参与二次免疫的MBC群体(CD73-MBC)的再次应答能力
为了测量次级宿主中携带NP特异性BCR的记忆B细胞在过表达ZFP318后的唤醒反应是否增强,将含有时空特异可诱导ZFP318表达元件的小鼠TetO-ZFP318 Mb1
结果表明,CD73-的MBC在过表达ZFP318后,其二次应答能力会显著增强(图18,图20);而CD73+的MBC在接受诱导后能力增强不明显(图19,图20),这可能和CD73+细胞已经表达了更高水平的ZFP318,难以再提升有关。这一结果证明,在二次免疫应答阶段,时空特异性的诱导ZFP318的表达,可以显著提升本身不太参与二次免疫的MBC群体(CD73-MBC)的再次应答能力。
讨论
与GC衍生的MBC(其在功能上占优势且可有效唤醒,但在所有抗原结合MBC中占少数)相比,GC非依赖性MBC占多数,但即使在非竞争环境中也很难唤醒。ZFP318是唤醒所必需的,并且其表达被CD40信号上调,这表明那些无法有效唤醒的MBC没有经历足够的T细胞帮助。不依赖GC的MBC可能来自被抗原激活但未能获得足够的T细胞帮助以参与GC或滤泡外PC发育的B细胞克隆。这可能是由于本质上BCR亲和力较低,加上在初级反应的进展过程中抗原可用性越来越有限
在记忆T细胞中,由扩大的线粒体网络提供的备用呼吸能力的增加对于抗原唤醒至关重要
从目的的角度考虑,不依赖GC的MBC让人想起在没有CD4 T细胞的情况下产生的记忆CD8 T细胞,这些细胞不会对继发性感染产生有效的记忆反应
尽管已结合本发明的具体实施方式描述了本发明,但显然许多替代、修饰和变化对本领域的技术人员是显而易见的。相应地,本发明包括了落在所附权利要求的精神和范围之内的所有这类替代、修饰和变化。在本说明书中提及的所有公开文件、专利和专利申请均通过引用至本说明书中的方式全文并入本文。
参考文献
1.Weisel,F.&Shlomchik,M.Memory B Cells of Mice and Humans.AnnualReview of Immunology 35,255–284(2017).
2.Ishizuka,M.et al.Abnormal spermatogenesis and male infertility intesticular zinc finger protein Zfp318-knockout mice.Dev Growth Differ 58,600–608(2016).
3.Enders,A.et al.Zinc-finger protein ZFP318 is essential forexpression of IgD,the alternatively spliced Igh product made by mature Blymphocytes.Proc National Acad Sci 111,4513–4518(2014).
4.Pioli,P.D.,Debnath,I.,Weis,J.J.&Weis,J.H.Zfp318 Regulates IgDExpression by Abrogating Transcription Termination within the Ighm/IghdLocus.J Immunol 193,2546–2553(2014).
5.Wang,Y.et al.Germinal-center development of memory B cells drivenby IL-9 from follicular helper T cells.Nature immunology 18,921–930(2017).
6.Roes,J.&Rajewsky,K.Immunoglobulin D(IgD)-deficient mice reveal anauxiliary receptor function for IgD in antigen-mediated recruitment of Bcells.J Exp Medicine 177,45–55(1993).
7.Shinnakasu,R.et al.Regulated selection of germinal-center cellsinto the memory B cell compartment.Nature Immunology(2016)doi:10.1038/ni.3460.
8.Kurosaki,T.,Kometani,K.&Ise,W.Memory B cells.Nature ReviewsImmunology 15,149–159(2015).
9.Akkaya,M.,Kwak,K.&Pierce,S.K.B cell memory:building two walls ofprotection against pathogens.Nat Rev Immunol 20,229–238(2020).
10.Mesin,L.et al.Restricted Clonality and Limited Germinal CenterReentry Characterize Memory B Cell Reactivation by Boosting.Cell 180,92-106.e11(2020).
11.Shlomchik,M.J.Do Memory B Cells Form Secondary Germinal Centers?Yes and No.Csh Perspect Biol 10,a029405(2018).
12.McHeyzer-Williams,L.J.,Dufaud,C.&McHeyzer-Williams,M.G.Do Memory BCells Form Secondary Germinal Centers?:Impact of Antibody Class and Qualityof Memory T-Cell Help at Recall.Csh Perspect Biol 10,a028878(2017).
13.Pape,K.A.&Jenkins,M.K.Do Memory B Cells Form Secondary GerminalCenters?:It Depends.Csh Perspect Biol 10,a029116(2017).
14.Victora,G.D.et al.Germinal center dynamics revealed by multiphotonmicroscopy with a photoactivatable fluorescent reporter.Cell 143,592–605(2010).
15.Liu,B.et al.Affinity-coupled CCL22 promotes positive selection ingerminal centres.Nature 592,133–137(2021).
16.Liu,D.et al.T–B-cell entanglement and ICOSL-driven feed-forwardregulation of germinal centre reaction.Nature 517,214–218(2015).
17.Akkaya,M.et al.Second signals rescue B cells from activation-induced mitochondrial dysfunction and death.Nat Immunol 19,871–884(2018).
18.Mah,L.-J.,El-Osta,A.&Karagiannis,T.C.γH2AX:a sensitive molecularmarker of DNA damage and repair.Leukemia 24,679–686(2010).
19.Taylor,J.J.,Pape,K.A.&Jenkins,M.K.A germinal center–independentpathway generates unswitched memory B cells early in the primary response.JExp Med 209,597–606(2012).
20.Suan,D.et al.CCR6 Defines Memory B Cell Precursors in Mouse andHuman Germinal Centers,Revealing Light-Zone Location and Predominant LowAntigen Affinity.Immunity 47,1142-1153.e4(2017).
21.Elgueta,R.et al.CCR6-Dependent Positioning of Memory B Cells IsEssential for Their Ability To Mount a Recall Response to Antigen.J Immunol194,505–513(2015).
22.Zhang,R.et al.Manganese salts function as potent adjuvants.CellMol Immunol 18,1222–1234(2021).
23.Wang,C.et al.Manganese Increases the Sensitivity of the cGAS-STINGPathway for Double-Stranded DNA and Is Required for the Host Defense againstDNA Viruses.Immunity 48,675-687.e7(2018).
24.Sun,S.et al.Interferon-armed RBD dimer enhances the immunogenicityof RBD for sterilizing immunity against SARS-CoV-2.Cell Res 1–13(2021)doi:10.1038/s41422-021-00531-8.
25.Liang,Q.et al.RBD trimer mRNA vaccine elicits broad and protectiveimmune responses against SARS-CoV-2 variants.Iscience 25,104043(2022).
26.van der Windt,G.J.W.et al.Mitochondrial Respiratory Capacity Is aCritical Regulator of CD8+T Cell Memory Development.Immunity 36,68–78(2012).
27.Windt,G.J.W.van der et al.CD8 memory T cells have a bioenergeticadvantage that underlies their rapid recall ability.Proc National Acad Sci110,14336–14341(2013).
28.Glaros,V.et al.Limited access to antigen drives generation ofearly B cell memory while restraining the plasmablast response.Immunity 54,2005-2023.e10(2021).
29.Shedlock,D.J.&Shen,H.Requirement for CD4 T Cell Help in GeneratingFunctional CD8 T Cell Memory.Science 300,337–339(2003).
30.Sun,J.C.&Bevan,M.J.Defective CD8 T Cell Memory Following AcuteInfection Without CD4 T Cell Help.Science 300,339–342(2003).
