活化血小板修饰脂质体与红细胞搭便车技术联用的靶向治疗药物
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于医药领域,具体涉及活化血小板修饰脂质体与红细胞搭便车技术联用的靶向治疗药物。
背景技术
纳米载体的出现与发展为诊治、预防疾病以及减轻患者负担提供了比单纯药物更有效的治疗手段,部分纳米相关药物已经应用于临床。但是这些纳米载体依旧存在不足:1.纳米药物是人工合成的外源物质,在进入机体后引起机体的免疫排斥作用,会很快被肝肾等脏器清除;2.一些特殊成分的纳米载体在体内不易降解,会累积在肝脏中引起炎症或毒性损伤;3.未经特殊处理的纳米药物没有靶向性,通过血液循环给药效率较低,加上机体免疫系统的清除,从而达到治疗效果的药物量极低,需要多次给药。
血小板(Platelet,PLT)是公认的血管“创可贴”、机体自身的无核细胞,直径约为1-3mm。单个血小板的寿命约为8-10天,人体血液中的PLT浓度大概为100-400×10
1970年,Hebden HF团队发现PLT是长春花碱的主要载体,因此发现PLT可负载药物参与疾病治疗;Hughes K团队利用电穿孔的方法使PLM包裹荧光色素和药物用于靶向巨噬细胞。2015年,Hu CM团队将PLM包裹了多西他赛和万古霉素的纳米药物,用于治疗动脉狭窄和细菌感染,这是最初的PLM与纳米载药协同给药系统。由于PLM表面存在的p-选择素(CD62p)蛋白可以靶向识别肿瘤细胞表面的黏蛋白CD44,PLM修饰的纳米载体能主动靶向肿瘤细胞,从而增加药物在肿瘤处的富集量,能提高其抗肿瘤的疗效。基于上述优异的性能,PLM修饰的纳米载体已经被设计和制造用于多种生物医学应用。除此之外,研究还证明血液中的CTCs可招募血小板在其表面粘附作为伪装外衣,结合形成“血小板-CTC聚集体”,从而保护CTCs实现免疫逃逸,形成肿瘤转移灶,故中和或者清除CTCs可能是一种预防肿瘤转移的有效策略。基于此,Zhang等制备了p-选择素靶向肽(PSN)修饰的紫杉醇胶束,可以轻松黏附到活化PLT的表面,进而在血液循环中捕获CTCs,有效抑制了肺转移,降低了肝转移的发生率。张良方教授报道了基于血小板膜包裹的PLGA仿生纳米递送系统,用于递送抗癌药物多西紫杉醇。该仿生纳米颗粒完整地保留了血小板膜的生物学功能,部分纳米粒能靶向作用聚集在肿瘤区域,并抑制肿瘤生长。2018年Zhang X团队利用基因工程技术改造巨核细胞,使其释放的PLT能够表达PD-1,从而参与癌症治疗。目前,PLT/PLM纳米给药系统可以负载不同类型药物,并在癌症、验证、免疫病等多种疾病的治疗研究中取得一定成果。
尽管通过PLM对纳米载体进行修饰后,在一定程度上能增强载体的靶向性以及延长其半衰期,但大部分的PLM-纳米粒依然在肝脏和脾富集。此外,为了达到治疗效果,则需要注射较大剂量并缩短注射周期,容易对肝脏产生较大的副作用,并且导致靶细胞产生耐药性。因此,需进一步研究提高现有的PLM-纳米药物递送系统的效率。
红细胞(Red Blood Cells,RBCs)药物递送系统是研究最多的细胞药物输送系统之一。红细胞药物递送系统的优点主要有:1.红细胞是血液中最多的细胞,易于获得,无需体外培养,成熟的RBC无细胞核和细胞器,安全性高;2.红细胞表面的多糖和蛋白能够有效避免RES的清除,从而在体内循环长达120天;3.红细胞比表面积大,有利于负载各类药物纳米粒在其表面进行递送,因此RBC是一种理想的药物递送载体。红细胞搭便车(RH)技术是近年来一种新兴而有效的递送方法。RH技术是指将药物纳米颗粒通过静电作用力、范德华力和疏水相互作用力附着于RBC表面,然后通过静脉或者动脉方式输注RBC-纳米粒,当RBC通过小于自身尺寸的毛细血管时,纳米粒受到挤压时从RBC上脱落。该技术能使部分纳米载体在肺部富集,有效改善纳米药物载体的肝脾摄取,减少不良反应的同时,提高药物对于肺部的靶向性。
可见,虽然PLM修饰与RH技术都具有提升药物靶向性的优势,但也都依然存在一定缺陷。两种方式的联合运用会对彼此的优势特性带来何种影响,是否能够有效补足或提升彼此的缺陷尚难以预料,目前,也未见相关技术的报道。
发明内容
本发明的目的在于提供一种活化血小板修饰脂质体与红细胞搭便车技术联用的靶向治疗药物。
本发明提供了一种复合脂质体药物递送载体,它是血小板膜修饰的脂质体与红细胞结合而成。
进一步地,上述血小板膜包裹于脂质体表面,所述血小板膜修饰的脂质体粘附于红细胞膜表面或与红细胞膜融合。
进一步地,上述血小板膜是活化的血小板膜,活化程度为30%~50%。
更进一步地,上述活化血小板膜是按照如下步骤制成:
(1)血小板在22℃±5℃的条件下震荡保存7天自然活化;
(2)自然活化后的血小板于35℃~40℃和-75℃~-85℃下交替反复冻融6~8次,离心,重悬,超声即得。
进一步地,上述脂质体由黄卵磷脂、1-棕榈酰基-2-油酰基卵磷脂、大豆磷脂、二棕榈酰磷脂酰胆碱、二油酰基卵磷脂、二油酰磷脂酰乙醇胺、二油酰基卵磷脂、二硬脂酰基磷脂酰胆碱中的一种、两种或三种以上原料与胆固醇制备而成;
优选地,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱50~60份、胆固醇1~5份;
或者,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱40~50份、二油酰磷脂酰乙醇胺10~20份、胆固醇1~5份;
更优选地,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱59.5份、胆固醇3.5份;
或者,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱46.2份、二油酰磷脂酰乙醇胺13.4份、胆固醇3.5份。
进一步地,上述血小板膜修饰的脂质体是血小板膜和脂质体混合后超声,再过不同孔径的聚碳酸脂膜制成;优选地,所述血小板膜和脂质体的用量为:每2~6mg脂质体混合2×10
进一步地,上述的药物递送载体是由血小板膜修饰的脂质体与红细胞共孵育制成;优选地,所述共孵育的条件是35~40℃孵育0.5~1.5小时。
本发明还提供了上述药物递送载体的制备方法,包括如下步骤:
(1)血小板膜和脂质体混合超声3~5分钟,依次过孔径为0.35~0.45μm、0.15~0.25μm和0.05~0.15μm的聚碳酸脂膜各3-5次,离心,重悬得到血小板膜修饰的脂质体溶液;
(2)血小板膜修饰的脂质体溶液与红细胞混合,35~40℃共孵育0.5~1.5小时,离心,去上清液即得;优选地,所述血小板膜修饰的脂质体溶液与红细胞的用量为:每100~200μL血小板膜修饰的脂质体溶液混合3×10
本发明还提供了一种药物制剂,它是上述的药物递送载体载药所得;
优选地,所述药物为抗肿瘤、抗菌、抗炎、抗过敏或抗病毒药物;
更优选地,所述药物为紫杉醇、长春新碱、地塞米松或多柔比星。
进一步地,上述载药的方法为:在制备脂质体时加入药物制备载药脂质体,然后载药脂质体与血小板膜和红细胞按照权利前述方法制备而得。
本发明的有益效果:本发明选用特定比例活化的血小板膜对脂质体进行修饰,与红细胞结合后,成功构建了具有肿瘤靶向性的药物载体,实现了血小板膜修饰脂质体技术与红细胞搭便车技术的有效联合,能够显著提高靶向性和血液半衰期,以更低的药物剂量达到更有效的药物缓释以及临床治疗效果,具有广阔应用前景。
本发明血小板膜的“活化程度”是指通过流式细胞仪检测得到的血小板膜CD62p(p-选择素)的表达率。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
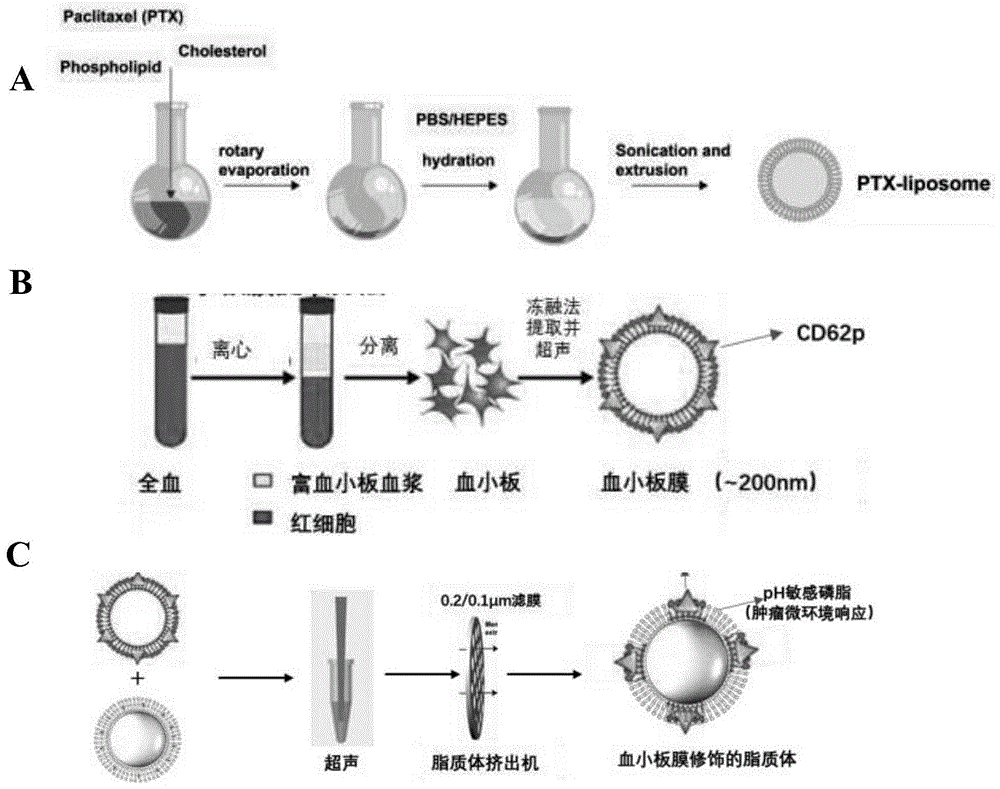
图1(A)通过薄膜法制备负载PTX的脂质体;(B)PLM提取方法示意图;(C)PLM与脂质体结合后获得具有肿瘤主动靶向性的脂质体。
图2PLM-lipo以及RBC-PLM-lipo在体内的脏器分布。
图3(A)小鼠皮下LLC移植瘤模型的抗肿瘤治疗结果(PTX=5mg/kg),每两天注射一次;(B)治疗结束后,处死小鼠,剥离肿瘤后拍照(n=5)。
图4(A)小鼠CTC模型的体重变化趋势图;(B)小鼠CTC模型的抗肿瘤治疗结果图(PTX=5mg/kg,每两天注射一次)。
图5(A)立C57小鼠CTC肺转移模型的示意图;(B)小鼠CTC肺转移模型肺部生物发光信号变化图;(C)小鼠CTC肺转移模型的体重变化趋势图。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
本发明动物模型的建模方法如下:1、建立小鼠肺癌循环肿瘤(CTCs)模型,通过尾静脉注射5x10
2、建立小鼠肺癌转移模型,通过尾静脉注射5x10
实施例1、本发明药物制剂的制备
1、载药脂质体的制备
1)PTX-lipo-DPPC的制备
将59.5g二棕榈酰磷脂酰胆碱(DPPC)与3.5g胆固醇(CHO)溶于3mL三氯甲烷中,并加入1.8g紫杉醇(PTX)溶解,然后在45-50℃条件下进行薄膜法真空旋蒸60min,随后加入5mL pH=7.4的磷酸盐缓冲液(PBS),在50-55℃条件下水化30min。水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得载PTX脂质体溶液。
2)PTX-lipo-DOPE的制备
将46.2g DPPC、13.4g二油酰磷脂酰乙醇胺(DOPE)和3.5g胆固醇于3mL三氯甲烷中,并加入1.8g PTX溶解,然后在45-50℃条件下进行薄膜法真空旋蒸60min,随后加入5mLpH=7.4的磷酸盐缓冲液(PBS),在50-55℃条件下水化30min。水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得含DOPE的PTX脂质体溶液。
表1PTX-lipo(Lipo-DPPC/DOPE)的PTX包封率
3)长春新碱-lipo-DPPC脂质体的制备
用DPPC:CHO=9:1加上1.8mg长春新碱于圆底烧瓶中。37℃旋蒸60min,得到透明薄膜。37℃水化条件下水化30min,水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得含长春新碱脂质体溶液。
4)长春新碱-lipo-DOPE脂质体的制备
DPPC:DOPE:胆固醇=7:2:1加上1.8mg长春新碱于圆底烧瓶中。37℃旋蒸60min,得到透明薄膜。37℃水化条件下水化30min,水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得含长春新碱脂质体溶液。
2、冻融法提取活化血小板的PLM
将从全血中分离浓缩的血小板置于血小板专用保存袋中,在22℃±5℃的条件下震荡保存7天,让血小板自然活化,活化程度大约为30%-50%(以通过流式细胞仪检测CD62p(p-选择素)的表达率表示;D0天的活化率低于5%);将自然活化的血小板(保存7天)从-80度冰箱取出,于37℃与-80℃之间反复冻融6-8次。离心(20000g,5min)去除血浆,重悬在pH=7.4的PBS(5mL)中,于超声细胞破碎仪中超声4min(750W,40s)。
3、PLM-脂质体的制备
将步骤2中制备出的PLM与步骤1中制备出的任一种脂质体共同于超声细胞破碎仪中超声4min(750W,40s)(4mg脂质体与2×10
表2PLM-lipo的PTX包封率
4、活化PLM-脂质体与RBC结合
将上述所得载PLM-脂质体溶液重新悬浮在PBS缓冲液(PH=7.4)中。将150μL 4)中制备出的PLM-脂质体溶液与RBC(3×10
制备过程示意图如图1所示。
以下通过实验例证明本发明的有益效果。以下实验均采用包载紫杉醇的Lipo-DPPC、Lipo-DOPE、PLM-DPPC、PLM-DOPE、RBC-PLM-DPPC和RBC-PLM-DOPE进行。
实验例1、本发明药物制剂的体内分布情况
通过亲脂性荧光染料染色标记Lipo-DPPC和Lipo-DOPE,建立C57小鼠LLC肺癌原位转移瘤模型,分别通过尾静脉注射6组样品(Lipo-DPPC、Lipo-DOPE、PLM-DPPC、PLM-DOPE、RBC-PLM-DPPC和RBC-PLM-DOPE),1h后处死小鼠并剥离脏器,通过小动物活体成像检测荧光标记的脂质体在脏器富集情况。结果可以看出,用DOPE制备的脂质体在肺部(即肿瘤部位)有明显富集,这是由于DOPE对酸性条件的敏感性。当PLM与脂质体融合后,对于肺部的富集程度加强,证明PLM确实对肿瘤细胞有着天然的靶向性;RBC与PLM结合后,对于肺部的靶向性进一步加强;因此,当DOPE脂质体与PLM融合后,再将其与RBC结合拥有RH技术的特点(能在肺部毛细血管处将PLM-lipo挤压脱落),在肺部拥有6组中最好的肺部靶向性,证明PLM载药系统联合RH技术能够大大提高药物对肺部的靶向性,同时由于RBC膜上的CD47,还能很好的避免被免疫系统清除,达到增强疗效的作用(图2)。
实验例2、本发明药物制剂对肺癌移植瘤的治疗效果
建立C57小鼠LLC移植瘤模型,当肿瘤大小约100mm3时,分别通过尾静脉注射上述6组样品。结果可知,RBC-PLM组的抗肿瘤效果均要好于脂质体组或者PLM-脂质体组,并且DOPE组的结果均要好于DPPC组。图3均证明RBC-PLM-DOPE组可以有效抑制皮下抑制瘤的生长,这是由于DOPE和PLM可以同时增强肿瘤靶向性,并且RH技术可以有效提高纳米载体在血液中的半衰期。
实验例3、本发明药物制剂对循环肿瘤细胞(CTC)的治疗效果
建立C57小鼠CTC模型,分别通过尾静脉注射上述6组样品。隔一天给药一次(5mg/kg),每隔5天检测肺部生物发光信号,探究PLM-lipo以及RBC-PLM-lipo对CTC的发生发展的影响,结果可知,各组小鼠体重在20天内没有明显差异,证明本发明的给药方式对小鼠没有显著的毒性作用(图4A);RBC-PLM组的抗CTC效果均要好于脂质体(lipo)组或者PLM-脂质体(PLM-lipo)组,并且DOPE组的结果均要好于DPPC组(图4B)。结果证明RBC-PLM-DOPE组可以有效抑制CTC的发展及其在肺部的转移,这是由于DOPE可以靶向肿瘤部位,同时PLM可以有效结合血液中的CTC。
实验例4、本发明药物制剂对循环肿瘤细胞肺转移肿瘤的治疗效果
建立C57小鼠CTC肺转移模型,分别通过尾静脉注射上述6组样品。隔一天给药一次(5mg/kg,图5A),每隔5天检测肺部生物发光信号,探究PLM-lipo以及RBC-PLM-lipo对CTC导致的肺转移肿瘤的影响。
结果可知,各组小鼠体重在20天内有明显差异,证明本发明RBC-PLM-DPPC和RBC-PLM-DOPE的给药方式可降低化疗的毒性作用(图5C);RBC-PLM组的抗肿瘤效果均要好于脂质体(lipo)组或者PLM-脂质体(PLM-lipo)组,并且DOPE组的结果均要好于DPPC组(图5B)。结果证明RBC-PLM-DOPE组可以有效抑制CTC在肺部的转移后病灶的发展,这是由于DOPE可以靶向肿瘤部位,PLM可以有效结合血液中的CTC,同时红细胞搭便车技术可提高纳米粒在肺部的富集,进一步提高药物在肺部的富集,减少肝脾清除和相关副作用。
综上,本发明提供了一种特定活化程度的活化血小板修饰脂质体与红细胞搭便车技术联用的靶向治疗药物;能够有效结合PLM修饰和RH技术的优势,显著提高靶向性和血液半衰期,以更低的药物剂量达到更有效的药物缓释以及临床治疗效果,具有广阔应用前景。
