具有可酶促释放的检测部分和条形码部分的缀合物
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种包含检测部分和抗原识别部分的缀合物,以及此类缀合物用于检测或鉴定靶部分或靶细胞或对来自细胞样品的靶部分或靶细胞进行检测或鉴定的用途,该检测部分和该抗原识别部分可选地经由可酶促降解的间隔子连接,其中该抗原识别部分具有作为条形码的寡核苷酸。
背景技术
用检测后能够从细胞中去除的缀合物进行细胞检测是已知的过程。例如,US7776562公开了一种可逆荧光标记过程,其中通过添加竞争分子来打破缀合物中的非共价结合,从细胞中去除缀合物。
EP3037821A1中公开了一种不同的可逆荧光标记的方法,其中缀合物具有可酶促降解的间隔子。通过添加适当的酶,破坏缀合物,并且从细胞中去除该缀合物的检测部分和抗原识别部分。
已知的过程使得能够检测细胞样品中的不同细胞。例如,通过用具有不同抗原识别部分的缀合物进行反复染色、检测和脱色,可以检测或区分细胞的数种表型及其在组织中的位置。
然而,无法对单个的、分离细胞的遗传信息进行分析。
在不同的技术领域,已知的是,通过将细胞与作为条形码的多核苷酸缀合来鉴定从单个细胞获得的遗传信息。这些方法涉及合成不同多核苷酸的文库,能够对这些多核苷酸进行测序以便鉴定单个细胞。
例如,在US9388456或US9695468中公开了分离细胞的生物学和必要的硬件。然而,该技术专注于单个分离的细胞,而不涉及细胞间相互作用的组织或细胞培养背景下的细胞。
发明内容
因此,本发明的目的是提供一种缀合物,其能够鉴定单个细胞及其在组织上或组织内的定位/位置以及它们的表型。进一步地,用于鉴定的手段应是可擦除的,以便允许进行多个鉴定步骤。
结果发现,由抗原结合部分与a)条形码部分和b)能够被擦除的检测部分偶联组成的缀合物适用于单细胞鉴定。
由于可擦除的检测部分,生物标本能够再次经受相同或不同的缀合,而不会受到先前各自标签的干扰。所有条形码部分都保留在细胞上,从而使得能够经由测序使通过结合子检测到的细胞的表型与通过测序检测到的单个细胞的遗传信息之间联系起来。
因此,本发明的目的是一种具有通式(I)的缀合物
X
其中X是检测部分,
P是间隔子单元,
Y是抗原识别部分,
B是包含2至300个核苷酸残基的寡核苷酸,
并且n、m、o是介于1和100之间的独立整数,
其中P和B与Y共价结合,并且X与P共价结合,并且其中X是可擦除的。
在优选实施例中,间隔子单元P是可酶促降解的。
本发明的又一个目的是一种用于通过以下方式检测细胞上的靶部分的方法:
a)提供至少一种具有通式(I)的缀合物
X
其中X是检测部分,
P是间隔子单元,
Y是抗原识别部分,
B是包含2至300个核苷酸残基的寡核苷酸,
并且n、m、o是介于1和100之间的独立整数,
其中P和B与Y共价结合,并且X与P共价结合,并且其中X是可擦除的;b)将生物标本的样品与该至少一种缀合物接触,从而标记由该抗原识别部分Y识别的该靶部分;
c)检测用具有该检测部分X的该缀合物标记的该靶部分;
d)分离用具有该检测部分X的该缀合物标记的该细胞;
e)擦除该检测部分X。
附图说明
图1示出了在用0.25% PFA(顶部)和2% PFA(底部)交联两分钟之后,在20x放大倍率下CD3 FITC染色之间的比较。
图2示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用0.25% PFA(图2a)或0.5% PFA(图2b)交联之后,通过机械力脱离的细胞的流式细胞术分析。
图3示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用1% PFA(图3a)或2% PFA(图3b)交联之后,通过机械力脱离的细胞的流式细胞术分析。
图4示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用0.25% PFA(图4a)或0.5% PFA(图4b)交联之后,通过酶法处理脱离的细胞的流式细胞术分析。
图5示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用1% PFA(图5a)或2% PFA(图5b)交联之后,通过酶法处理脱离的细胞的流式细胞术分析。
图6示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用0.25% PFA(图6a)或0.5% PFA(图6b)交联之后,通过酶法处理和机械力脱离的细胞的流式细胞术分析。
图7示出了在用抗体-荧光染料-寡核苷酸标记CD3(PE)、CD4(APC)和CD8(FITC)并且用1% PFA(图7a)或2% PFA(图7b)交联之后,通过酶法处理和机械力脱离的细胞的流式细胞术分析。
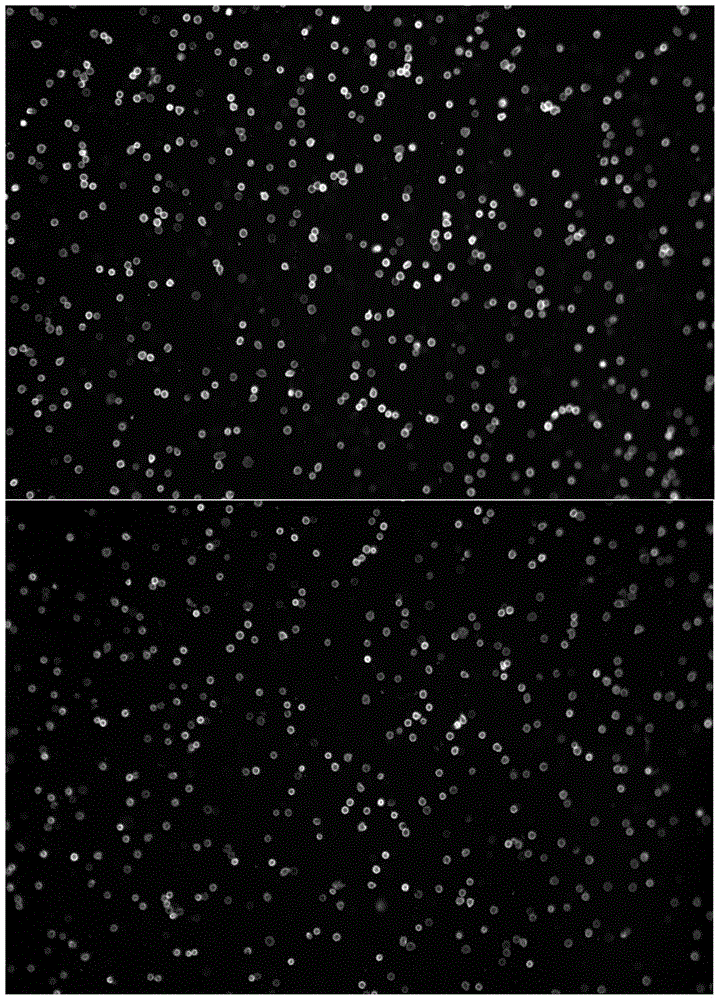
图8示出了用DAPI和CD4特异性抗体标记的PBMC,该CD4特异性抗体与a)条形码部分(寡核苷酸)和b)能够被擦除的检测部分以及c)可交联的部分偶联。将寡核苷酸与用Cy5标记的反义寡核苷酸杂交。图像显示了DAPI的荧光信号。
图9示出了用DAPI和CD4特异性抗体标记的PBMC,该CD4特异性抗体与a)条形码部分(寡核苷酸)和b)能够被擦除的检测部分以及c)可交联的部分偶联。将寡核苷酸与用Cy5标记的反义寡核苷酸杂交。图像显示了Cy5的荧光信号。
图10示出了用DAPI和CD4特异性抗体标记的PBMC,该CD4特异性抗体与a)条形码部分(寡核苷酸)和b)能够被擦除的检测部分以及c)可交联的部分偶联。将寡核苷酸与用Cy5标记的反义寡核苷酸杂交。图像显示了Cy5(红色)和DAPI(绿色)的荧光信号的叠加。
具体实施方式
术语“共价结合”是指具有解离常数≤10
此类破坏或降解X的化学性质能够通过例如酶促降解、辐射或氧化漂白来实现。漂白所需的化学品可从上述关于“多表位配体制图”、“基于芯片的细胞术”或“Multioymx”技术的出版物中了解到。
“擦除检测部分X”的另一种方法是从缀合物中去除X。这可以通过向根据通式(I)的缀合物提供可酶促降解的间隔子单元P来实现。当(在检测到X之后)通过添加适当的酶来消化可酶促降解的间隔子P时,X不再与缀合物结合,并且能够通过例如洗涤而被去除。
取决于抗原识别部分Y的性质,该实施例可具有以下效果:在酶促降解间隔子P之后,抗原识别部分Y被或能够被从抗原中去除,而不接触靶细胞。需要数个结合位点来提供与抗原(诸如FAB)的稳定结合的抗原识别部分Y容易在酶促降解间隔子P时从抗原中被去除。
如果不希望从抗原中去除抗原识别部分Y,这可以通过本发明的进一步实施例来阻止,其中抗原识别Y和/或寡核苷酸B具有交联剂单元。在本发明方法的此类变体中,抗原识别Y和/或寡核苷酸B具有交联剂单元,该交联剂单元能够提供与被抗原识别部分Y识别出的细胞(优选抗原)的共价结合,并且交联剂与细胞(优选抗原)的共价结合(优选抗原)是由辐射、化学反应或酶促反应引发的。
交联剂与细胞或抗原的共价结合能够通过辐射、化学反应或酶促反应来引发。
本发明的方法(即步骤a)至e))能够随后用至少两种具有不同抗原识别部分Y的缀合物进行重复。另选地,步骤a)至e)能够随后至少用两种具有不同抗原识别部分Y和不同寡核苷酸B的缀合物进行重复。
在本发明的另外的实施例中,除了以下步骤之外,步骤a)至e)至少重复一次:
f)分离用至少2种具有检测部分X的缀合物标记的细胞;
g)裂解该细胞;
h)向寡核苷酸B添加第二条形码;
i)向细胞的遗传信息添加相同的第二条形码(其中可以同时执行g)和h),并且可以以交替的顺序执行h)和i))。
可选地,可以通过将遗传信息中表示的序列的反义寡核苷酸与寡核苷酸B进行杂交来执行步骤h),由此反义寡核苷酸共价连接到第二条形码。包含2至100个核苷酸残基的寡核苷酸B'能够用作第二条形码。
优选地,使用含有寡核苷酸的Oligo(dT)与所述细胞的mRNA的poly(A)并且与Oligo B中包含的oligo(dA)序列杂交,其中Oligo(dT)与第二条形码共价连接。
靶部分
要用本发明的方法检测的靶部分能够在任何生物标本上,如组织切片、细胞聚集体、悬浮细胞或贴壁细胞。细胞可以是活的或死的。优选的,靶部分是在生物标本上表达的细胞内或细胞外的抗原,该生物标本如整个动物、器官、组织切片、细胞聚集体、或无脊椎动物(例如,秀丽隐杆线虫、黑腹果蝇)、脊椎动物(例如,斑马鱼、非洲爪蟾)和哺乳动物(例如,小家鼠、智人)的单细胞。
条形码部分
在本申请中,具有不同序列的寡核苷酸B被称为“条形码”,因为其允许通过其独特的序列来鉴定单个靶。条形码部分B包含含有2至300个核苷酸残基、优选5至70个核苷酸残基的寡核苷酸。作为核苷酸残基,优选天然存在的胞嘧啶(C)、腺嘌呤(A)、鸟嘌呤(G)和胸腺嘧啶(T)。通过随机聚合这些单元,能够获得具有不同序列的寡核苷酸的文库。例如,随机产生包含10个核苷酸残基的寡核苷酸的文库将具有4
生成寡核苷酸及其文库的技术,以及扩增分离的寡核苷酸以获得更大量的寡核苷酸的技术都是本领域技术人员所熟知的。US 9388465对这些技术进行了总结。
因此,本发明的又一个目的是提供一种已经讨论过的缀合物的文库,该文库包括至少10种、优选至少100种、优选至少1000种、优选至少10000种带具有不同序列的寡核苷酸B的缀合物。
检测部分
缀合物的检测部分X可以是具有可用于检测目的的特性或功能的任何部分,如选自由以下组成的组的那些:发色团部分、荧光部分、磷光部分、发光部分、光吸收部分、放射性部分和过渡金属同位素质量标签部分。
合适的荧光部分是免疫荧光技术领域已知的那些,例如流式细胞术或荧光显微镜。在本发明的这些实施例中,用缀合物标记的靶部分通过激发检测部分X并检测产生的发射(光致发光)来检测。在该实施例中,检测部分X优选为荧光部分。
有用的荧光部分可以是蛋白质类(诸如藻胆蛋白)、聚合物(诸如聚芴)、有机小分子染料(诸如氧杂蒽,如荧光素)、或罗丹明、青色素、噁嗪、香豆素、吖啶、噁二唑、芘、亚甲基吡咯或金属有机配合物(诸如Ru、Eu、Pt配合物)。除单分子实体外,荧光蛋白簇或有机小分子染料,以及纳米颗粒(诸如量子点、上转换纳米颗粒、金纳米颗粒、染色聚合物纳米颗粒)也能够用作荧光部分。
另一组光致发光检测部分是激发后延时发光的磷光部分。磷光部分包括金属有机配合物(诸如Pd、Pt、Tb、Eu配合物),或掺入磷光颜料的纳米颗粒(诸如镧系元素掺杂的SrAl
在本发明的另一个实施例中,用缀合物标记的靶无需事先通过照射激发即可检测。在该实施例中,检测部分可以是放射性标记。检测部分能够采用放射性同位素标记的形式,通过将非放射性同位素交换为其放射性同位素(诸如氚、
在另一个实施例中,检测部分能够在鲁米诺存在的情况下引起化学发光,即辣根过氧化物酶标记。
在本发明的另一个实施例中,用缀合物标记的靶不是通过辐射发射来检测的,而是通过紫外、可见光或NIR辐射的吸收来检测的。合适的光吸收检测部分是没有荧光发射的吸光染料,诸如有机小分子淬灭染料,如N-芳基罗丹明、偶氮染料和二苯乙烯。
在另一个实施例中,光吸收检测部分X能够被脉冲激光照射,产生光声信号。
在本发明的另一个实施例中,用缀合物标记的靶通过质谱检测过渡金属同位素来进行检测。过渡金属同位素质量标签标记能够作为共价结合的金属有机配合物或纳米颗粒组分被引入。本领域已知的是镧系元素和相邻的晚期过渡元素的同位素标签。
通过检测部分或间隔子P上的活化基团与间隔子P或检测部分X上的官能团直接反应、或者经由异双官能接头分子(其首先与一个结合伴侣反应,然后与另一个结合伴侣反应),能够将检测部分X与间隔子P共价偶联。
例如,大量异双官能化合物可用于与实体连接。示例性实体包括:叠氮基苯甲酰肼、N-[4-(对叠氮水杨基氨基)丁基]-3'-[2'-吡啶基二硫代]丙酰胺)、双-磺基琥珀酰亚胺基辛二酸酯、二亚胺代己二酸二甲酯、二琥珀酰亚胺酒石酸酯、N-y-马来酰亚胺基丁酰氧基琥珀酰亚胺酯、N-羟基磺基琥珀酰亚胺基-4-叠氮基苯甲酸酯、N-琥珀酰亚胺基[4-叠氮苯基]-1,3'-二硫代丙酸酯、N-琥珀酰亚胺基[4-碘乙酰基]氨基苯甲酸酯、戊二醛、琥珀酰亚胺基-[(N-马来酰亚胺基丙酰胺基)聚乙二醇]酯(NHS-PEG-MAL)和琥珀酰亚胺基4-[N-马来酰亚胺甲基]环己烷-1-羧酸酯。优选的连接基团为3-(2-吡啶基二硫基)丙酸N-羟基琥珀酰亚胺酯(SPDP)或4-(N-马来酰亚胺甲基)-环己烷-1-羧酸N-羟基琥珀酰亚胺酯(SMCC),其中检测部分上具有活性巯基基团,并且间隔子P上具有活性氨基基团。
检测部分X与间隔子P的准共价结合能够通过提供≤10
间隔子P
一般而言,能够使用在抗原识别缀合物(如LCLC或PEG寡聚物)领域已知的任何间隔子P。
在一个优选的实施例中,根据本发明的缀合物包含可酶促降解的间隔子单元P。可酶促降解的间隔子P可以是能够被特异性酶(尤其是水解酶)切割的任何分子。适于作为可酶促降解的间隔子P为:例如,多糖、蛋白质、肽、缩酚酸肽、聚酯、核酸及其衍生物。
合适的多糖为例如右旋糖酐、普鲁兰多糖、菊粉、直链淀粉、纤维素、半纤维素(诸如木聚糖或葡甘露聚糖)、果胶、壳聚糖或甲壳素,它们能够被衍生化以提供与检测部分X和抗原识别部分Y共价或非共价结合的官能团。本领域已知多种此类修饰,例如通过使多糖与N,N’-羰基二咪唑反应,能够引入咪唑基氨基甲酸酯。随后,通过使该咪唑基氨基甲酸酯基团与己二胺反应,能够引入氨基基团。多糖也可以使用高碘酸盐进行氧化以提供醛基,或用N,N'-二环己基碳二亚胺和二甲基亚砜进行氧化以提供酮基。醛或酮官能团随后能够优选在还原胺化条件下与二胺反应以提供氨基基团,或直接与含蛋白质的结合部分上的氨基取代基反应。羧甲基基团能够通过用氯乙酸处理多糖被引入。用本领域已知的产生活化酯(诸如N-羟基琥珀酰亚胺酯或四氟苯基酯)的方法来活化羧基基团,允许与二胺的氨基基团反应以提供氨基基团,或者直接与含蛋白质的结合部分的氨基基团反应。一般,通过在碱性条件下用卤素化合物处理多糖,可以引入含官能团的烷基基团。例如,通过使用烯丙基溴能够引入烯丙基基团。烯丙基基团能够进一步用于与含硫醇的化合物(诸如胱胺)的硫醇-烯反应以引入氨基基团,或者直接与含蛋白质的结合部分进行硫醇-烯反应,其中硫醇基团通过二硫键还原而被释放或者举例来说通过用2-亚氨基硫进行烷硫醇化而被引入。
用作可酶促降解的间隔子P的蛋白质、肽和缩酚酸肽能够经由氨基酸的侧链官能团进行官能化,以附着检测部分X和抗原识别部分Y。举例来说,适用于修饰的侧链官能团为由赖氨酸提供的氨基基团或在二硫桥还原后由半胱氨酸提供的硫醇基团。
用作可酶促降解的间隔子P的聚酯和聚酯酰胺既能够用提供侧链官能度的共聚单体合成,也能够随后进行官能化。在支化聚酯的情况下,能够经由羧基或羟基端基团进行官能化。聚合物链的聚合后官能化能够经由例如不饱和键的加成(即硫醇反应或叠氮化物碱性反应)进行,或经由通过自由基反应引入官能团进行。
用作可酶促降解的间隔子P的核酸优选地使用在适于附着检测部分X和抗原识别部分Y的3’-端和5’-端的官能团来合成。举例来说,用于核酸的合成的合适的亚磷酰胺构建块提供氨基或硫醇官能团,这是本领域已知的。
可酶促降解的间隔子P能够由一个以上不同的可酶促降解的单元组成,这些单元可由相同或不同的酶降解。
抗原识别部分Y
术语“抗原识别部分Y”是指针对生物标本上表达的靶部分(如在细胞上于细胞内或细胞外表达的抗原)的任何种类的抗体、片段化抗体或片段化抗体衍生物。该术语涉及完全完整的抗体、片段化抗体或片段化抗体衍生物,例如Fab、Fab′、F(ab′)2、sdAb、scFv、di-scFv、纳米抗体。此类片段化抗体衍生物可以通过重组程序合成,包括含有这些种类分子的共价和非共价缀合物。抗原识别部分的其他示例为靶向TCR分子的肽/MHC配合物、细胞粘附受体分子、共刺激分子的受体、人工工程化的结合分子(例如,靶向例如细胞表面分子的肽或适配体)。
用于本发明方法的缀合物可包含多达100个、优选1-20个、优选2-10个抗原识别部分Y。
抗原识别部分与靶抗原的相互作用能够具有高亲和力或低亲和力。与单个低亲和力抗原识别部分的结合相互作用太低,无法为抗原提供稳定的键。低亲和力抗原识别部分能够通过与可酶促降解的间隔子P缀合进行多聚化,以提供高亲和力。当间隔子P被酶切或酶促降解时,低亲和力抗原识别部分将被单体化,这导致检测部分X、间隔子P和抗原识别部分Y被完全去除。高亲和力抗原识别部分提供稳定的键,这导致检测部分X和间隔子P被去除。
优选地,术语“抗原识别部分Y”是指针对生物标本(靶细胞)在细胞内表达的抗原(如IL2、FoxP3、CD154)或在细胞外表达的抗原(如CD3、CD14、CD4、CD8、CD25、CD34、CD56和CD133)的抗体。
抗原识别部分Y、特别是抗体能够通过侧链氨基或巯基基团与间隔子P偶联。在一些情况下,抗体的糖苷侧链能够被高碘酸盐氧化,从而产生醛官能团。
抗原识别部分Y能够与间隔子P共价或非共价偶联。用于共价或非共价缀合的方法是本领域技术人员已知的,并且与所提及的用于检测部分X的缀合的方法相同。
本发明的方法特别适用于从复杂混合物中检测和/或分离特定的细胞类型,并且能够包括步骤a)至e)中的多于一个连续或并行序列。该方法能够使用缀合物的各种组合。例如,缀合物可以包含特异性于两种不同表位的抗体,如两种不同的抗CD34抗体。不同的抗原可以用包含不同抗体的不同缀合物来处理,例如,抗CD4和抗CD8用于区分两种不同的T细胞群,或抗CD4和抗CD25用于测定不同的细胞亚群,如调节性T细胞。
酶
作为脱模剂的酶的选择是由可酶促降解的间隔子P的化学性质决定的,并且能够是一种酶或不同酶的混合物。酶优选为水解酶,但也可以是裂解酶或还原酶。例如,如果间隔子P是多糖,则糖苷酶(EC 3.2.1)最适合作为脱模剂。优选的是识别特定糖苷结构的糖苷酶,例如右旋糖酐酶(EC 3.2.1.11),其在右旋糖酐的α(1—>6)键处进行切割;普鲁兰酶(EC3.2.1.142),其对普鲁兰多糖的α(1—>6)键进行切割,或普鲁兰酶(EC 3.2.1.41),其对普鲁兰多糖的α(1—>6)和α(1—>4)键进行切割;新普鲁兰酶(EC 3.2.1.135)和异普鲁兰酶(EC 3.2.1.57),其对普鲁兰多糖的α(1—>4)键进行切割。α-淀粉酶(EC 3.2.1.1)和麦芽糖淀粉酶(EC 3.2.1.133),其对直链淀粉中的α(1—>4)键进行切割;菊粉酶(EC 3.2.1.7),其对菊粉中的β(2—>1)果糖苷键进行切割;纤维素酶(EC 3.2.1.4),其在纤维素的β(1—>4)键处进行切割;木聚糖酶(EC 3.2.1.8),其在木聚糖的β(1—>4)键处进行切割;果胶酶诸如内切果胶切割酶(EC 4.2.2.10),其在α(1—>4)D-半乳糖醛聚糖甲酯键处进行消除性切割;或者聚半乳糖醛酸酶(EC 3.2.1.15),其在果胶的α(1—>4)D-半乳糖苷醛酸键处进行切割;壳聚糖酶(EC 3.2.1.132),其在壳聚糖的β(1—>4)键处进行切割;以及内切壳多糖酶(EC3.2.1.14),其用于切割甲壳素。
蛋白质和肽可以被蛋白酶切割,蛋白酶需要具有序列特异性以避免细胞上的靶结构发生降解。举例来说,序列特异性蛋白酶为:TEV蛋白酶(EC 3.4.22.44),其是在序列ENLYFQS处进行切割的半胱氨酸蛋白酶;肠肽酶(EC 3.4.21.9),其是在序列DDDDK之后进行切割的丝氨酸蛋白酶;因子Xa(EC 3.4.21.6),其是在序列IEGR或IDGR之后进行切割的丝氨酸内肽酶;或HRV3C蛋白酶(EC3.4.22.28),其是在序列LEVLFQGP处进行切割的半胱氨酸蛋白酶。
缩酚酸肽(即肽骨架中含有酯键的肽)或聚酯可以被酯酶切割,诸如猪肝酯酶(EC3.1.1.1)或猪胰脂肪酶(EC 3.1.1.3)。核酸可以被可以是序列特异性的内切酶切割,诸如限制性内切酶(EC 3.1.21.3、EC 3.1.21.4、EC 3.1.21.5),诸如EcoRI、HindII或BamHI,或者更一般地,诸如DNAse I(EC 3.1.21.1),其对与嘧啶相邻的磷酸二酯键进行切割。
添加的酶量需要足以在所需时间段内使间隔子基本降解。通常,检测信号至少降低约80%、更通常至少约95%、优选至少约99%。脱模条件能够在温度、pH、金属辅因子的存在、还原剂等方面进行经验优化。降解通常将会在至少约15分钟内完成、更通常至少在约10分钟内完成,并且通常不会超过约30分钟。
细胞检测方法
用本发明的缀合物标记的靶的检测方法和设备由检测部分X确定。
在本发明的一个变型中,检测部分X是荧光部分。通过激发荧光部分X并分析产生的荧光信号,对用荧光染料缀合物标记的靶进行检测。激发的波长通常根据荧光部分X的吸收最大值进行选择,并且由本领域已知的激光源或LED源来提供。如果使用数个不同的检测部分X进行多颜色/多参数检测,则应注意选择吸收光谱不重叠的、至少吸收最大值不重叠的荧光部分。在荧光部分作为检测部分的情况下,能够在例如荧光显微镜下、在流式细胞仪、分光荧光计或荧光扫描仪中对靶进行检测。化学发光发出的光能够通过省略激发的类似仪器来检测。
在本发明的另一个变型中,检测部分是光吸收部分,其通过照射光强度与透射或反射的光强度之间的差进行检测。光吸收部分也可以通过光声成像进行检测,该光声成像使用脉冲激光束的吸收来产生如超声波信号一般的声学效果。
放射性检测部分通过放射性同位素发出的辐射进行检测。用于检测放射性辐射的合适仪器包括例如闪烁计数器。在β发射的情况下,也能够使用电子显微镜进行检测。
过渡金属同位素质量标签部分通过质谱方法进行检测,诸如集成在质谱细胞术仪器中的ICP-MS。
方法的用途
本发明的方法可用于研究、诊断和细胞治疗中的各种应用。
在本发明的第一变型中,为了计数的目的,即从具有由缀合物的抗原识别部分识别的一组特定抗原的样品中确定细胞的量,检测生物标本(如细胞)。
在第二变型中,从样品中检测一个或多个生物标本群并将其分离为靶细胞。该变型可以例如在临床研究、诊断和免疫治疗中用于纯化靶细胞。在该变型中,可以在步骤a)、b)、c)、d)和可选的洗涤步骤e)中的任一步骤之后,执行一个或多个分类步骤。
在本发明的另一个变型中,确定被缀合物的抗原识别部分识别的靶部分(如抗原)在生物标本上的位置。此类技术被称为“多表位配体制图”、“基于芯片的细胞术”或“Multioymx”,并且在例如EP 0810428、EP1181525、EP 1136822或EP1224472中有描述。在该技术中,细胞被固定并且使其与和荧光部分偶联的抗体接触。抗体被生物标本(例如细胞表面)上的相应抗原识别,并且在去除未结合的标记物并激发荧光部分后,通过荧光部分的荧光发射来检测抗原的位置。在某些变型中,能够使用与MALDI成像或CyTOF可检测到的部分偶联的抗体,而不是与荧光部分偶联的抗体。本领域技术人员明白如何对基于荧光部分的技术进行修改以使用这些检测部分。
靶部分的位置是通过针对荧光辐射的波长具有足够分辨率和灵敏度的数字成像装置实现的。数字成像装置可以与例如荧光显微镜在用或不用光学放大的情况下一起使用。生成的图像例如以RAW、TIF、JPEG或HDF5格式存储在适当的存储装置(如硬盘驱动器)上。
为了检测不同的抗原,可以提供具有相同或不同荧光部分或抗原识别部分Y的不同抗体缀合物。由于对具有不同波长的荧光发射进行并行检测受到限制,因此抗体-荧光染料-缀合物被依次单独使用,或者以小组(2-10)的形式被相继使用。
在根据本发明的方法的又一个变型中,样品的生物标本、特别是悬浮细胞通过在微腔中捕获或通过粘附进行固定。
示例
以下示例旨在对本发明进行更详细的解释,但本发明并不限于这些示例。
示例1:循环免疫荧光分析后分离细胞用于免疫荧光分析中使用的抗体的核酸信
将新鲜分离的外周血单核细胞(PBMC)用100xg旋转到24孔板(每孔1E06 PBMC)上,并且用4% PFA固定10分钟。将固定后的细胞洗涤3次,并且用缀合物染色10分钟,所述缀合物由抗原结合部分与a)条形码部分,b)能够被擦除的检测部分(抗体-荧光染料-寡核苷酸缀合物)以及c)可交联的部分(伯氨基基团)偶联而成。抗原结合部分是特异性于蛋白质CD8、CD3和CD4(CD8-FITC-寡核苷酸、CD3-PE-寡核苷酸、CD4-APC-寡核苷酸)的抗体。然后,将抗体-荧光染料-寡核苷酸缀合物用0.25%对位甲醛(PFA)、0.5% PFA、1% PFA或2%PFA与细胞交联2分钟。所有孔一式三份制备。
通过显微镜控制对细胞的标记。图1显示了在用0.25% PFA(顶部)和2%PFA(底部)交联两分钟后CD3 FITC染色之间的比较示例。
使用以下三种方法之一从显微镜下脱离细胞:变型1:通过刮擦掉细胞进行机械脱离;变型2:通过与弹性蛋白酶孵育进行酶促脱离;变型3:使用弹性蛋白酶的酶促脱离和使用刮擦的机械脱离的组合。
脱离后,收集细胞并且通过流式细胞术进行分析。
对于变型1(刮擦),能够在点图中检测到许多碎片。用于交联的不同百分比的PFA不会导致显著差异(图2、图3)。
对于变型2(弹性蛋白酶),只能检测到很少的碎片。同样,四种交联等级之间没有差异(图4、图5)。
对于变型3(弹性蛋白酶加刮擦),存在适量的碎片。同样,固定后四种等级之间没有差异(图6、图7)。
作为示例,图3(变型2,弹性蛋白酶)左侧部分(0.25%)的点图沿每个轴显示两个不同的群,类似于APC(CD4)与FITC(CD8)标记的细胞。正如预期,无法检测到双重标记的细胞。CD8-FITC细胞占群的11%,CD4-APC细胞占5.22%,这与分析PBMC时的预期相关联。CD8-FITC和CD4-APC阳性细胞都与CD3-PE密切相关,沿CD3-PE轴也有非CD8-FITC细胞和非CD4-APC细胞的单独的群。
这些结果表明,可以从显微镜载玻片中对细胞进行脱离和分析,而不会损失细胞完整性和标记。抗体-荧光染料-寡核苷酸的交联程度对完整细胞的脱离没有影响。酶促脱离在保持细胞完整性方面显然更胜一筹。
示例2:抗体-荧光染料-寡核苷酸缀合物上寡核苷酸条形码的功能测试
将新鲜分离的外周血单核细胞(PBMC)用100xg旋转到24孔板(每孔1E06 PBMC)上,并且用4% PFA固定10分钟。将固定后的细胞洗涤3次,并且在室温下用DAPI 1:20在黑暗中染色10分钟。将细胞洗涤5次,然后用缀合物染色10分钟,所述缀合物由抗原结合部分与a)条形码部分,b)能够被擦除的检测部分(抗体-荧光染料-寡核苷酸缀合物)以及c)可交联的部分(伯氨基基团)偶联而成。抗原结合部分是特异性于蛋白质CD8、CD3和CD4的抗体。
然后,将缀合物用0.25% PFA与细胞交联2分钟。将抗体-荧光染料-寡核苷酸缀合物杂交到用Cy5标记的反义寡核苷酸中。通过显微镜控制对细胞的标记(图8-X)。
图8显示了使用DAPI(核染色)对细胞进行细胞核染色。图9显示了使用CD4特异性抗体-寡核苷酸缀合物与相应的CY5标记的反义寡核苷酸(细胞表面染色)标记细胞的示例。可清楚看到,细胞亚群由抗体-寡核苷酸缀合物在表面上标记。因此,能够得出以下结论,寡核苷酸与细胞的交联不会抑制反义寡核苷酸的杂交,即保留了寡核苷酸作为条形码的功能。图10显示了图8和图9的叠加,证实了由抗体-寡核苷酸缀合物进行标记的特异性。
