一种卵巢癌相关的基因甲基化检测组合物及其用途
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物技术领域,特别是涉及一种卵巢癌相关的基因甲基化检测组合物及其用途。
背景技术
卵巢癌的发病率在全部妇科恶性肿瘤中居第三位,但致死率最高。卵巢癌是卵巢肿瘤的一种恶性肿瘤,是指生长在卵巢上的恶性肿瘤,其中90%~95%为卵巢原发性的癌,另外5%~10%为其它部位原发的癌转移到卵巢。卵巢癌具有很高的异质性,约90%属于上皮性卵巢癌,其中约70%为浆液性,预后较差。早期(Ⅰ期)卵巢癌患者的5年生存率超过90%,然而早期卵巢癌无明显的临床症状,大多数患者很难在早期及时发现,70%以上的卵巢癌发现时已处于晚期,5年生存率不足70%。卵巢癌异质性强、进展较快、缺乏合适的早期检测方法是卵巢癌早期检测的重要挑战。因此,寻找可靠的卵巢癌早期检测标志物具有十分重要的意义。
目前,血清糖类抗原125(carbohydrate antigen 125,CA125)是临床中使用最广泛的上皮性卵巢癌诊断及复发监测的标志物。但在早期卵巢癌患者中,其灵敏度不到50%,且特异度不高,且单独检测CA125并不适合用于上皮性卵巢癌的早期诊断。临床具有较高应用前景的卵巢癌诊断组合是人附睾蛋白4(human epididymis protein 4,HE4)联合CA125检测,但仅被美国药监局FDA批准为仅批准其用于卵巢癌的复发或进展监测。卵巢癌病人约2/3伴有腹水和(或)胸水,胸腹水的出现不仅提示癌患已广泛播散,治疗困难,且极易造成误诊,以致延误治疗。对于卵巢癌的早期诊断可使用的样本包括血浆、腹腔积液、卵巢囊肿积液等体液和手术的组织样本。
胸腹水(含腹腔冲洗液)细胞学对于卵巢肿瘤的诊断有重要作用,不但是卵巢癌分期的依据,对卵巢癌的诊断、治疗、监测及预后判断都有重要意义。1956年腹水细胞学即开始用于妇科肿瘤管理,1975年国际妇产科联盟(FIGO)开始应用腹水细胞学对卵巢癌进行分期,而目前卵巢癌采用的是FIGO2014年修订后的分期系统,其中Ⅰ期中ⅠA和ⅠB期分期标准之一是“腹水中无恶性肿瘤细胞”,ⅠC期的其中一条分期标准是“腹水中有恶性肿瘤细胞”。因卵巢癌早期无特异性症状,患者就诊时70%已处于晚期,很多病人已有腹水,而有的病例则以腹水为首发症状,此时腹水细胞学可以尽早明确诊断,从而使临床医生能够据此为患者尽早制订治疗方案,施以有效治疗。在治疗过程中,还可以通过腹水细胞学监测治疗情况。此外,腹水细胞学还有助于临床医师判断患者预后。术中腹水一般由临床医生手术时剖开腹腔,在未进行任何探查前取材。如发现腹水,哪怕量很少,也要吸出并加抗凝剂立即送检;如没有发现明显腹水,则用消毒过的混有抗凝剂的温生理盐水冲洗腹腔,尤其是容易出现肿瘤细胞种植的区域,如子宫直肠陷凹等,冲洗液用针筒吸出,立即送检。手术结束关闭腹腔前,再次冲洗腹腔送检腹腔冲洗液,以观察肿瘤切除后是否有溢出的肿瘤细胞。非手术腹水一般由临床医生根据患者具体病情行腹腔穿刺抽取腹水,加入抗凝剂后送检。病理科或细胞室接收样本之后,离心富集细胞直接涂片或制备液基细胞涂片,固定染色后由细胞病理医生阅片诊断报告结果。但传统细胞学诊断主要依靠病理医生在显微镜下寻找癌细胞,诊断灵敏度较低,并不能满足临床诊断的需求。近年来,随着科技发展和医学的进步,新的医学技术不断涌现,除了免疫组化检查外,分子生物学技术也应用到腹水/腹腔冲洗液细胞学中,使得其诊断更为精准,为卵巢癌患者诊治提供了更好的病理支持。
胃肠道反应是卵巢癌的早期症状。更年期女性如果经常感到腹胀、食欲不振,经消化科检查没有发现胃肠道的疾病,应及时去妇科就诊。因为卵巢肿瘤会使周围的韧带受到压迫、牵拉,加上腹水刺激,往往会出现胃肠道症状。卵巢癌病人约2/3伴有腹水和(或)胸水,胸腹水的出现不仅提示癌患已广泛播散,治疗困难,且极易造成误诊,以致延误治疗。消化系统肿瘤包括胃癌、肠癌、肝癌、胰腺癌、胆管癌等也是引发胸腹水产生的主要恶性肿瘤。因此对于高度怀疑卵巢癌且有胸腹水的患者,临床迫切需要可以提高胸腹水的检测高灵敏,给予明确诊断,除明确卵巢癌的恶性诊断外,临床还进一步希望能和消化系统肿瘤之间做好鉴别诊断。
近年来,随着根治性手术的进步和化疗方案的发展,使得卵巢癌的疗效较前有所改善,但卵巢癌细胞的原发性或继发性化疗耐药,往往导致化疗失败,是引起卵巢癌复发、转移及死亡率居高不下的关键环节,严重制约了卵巢癌患者生存率的提高。为了改善卵巢癌患者的预后,需要新的能够早期预测化疗耐药的标志物以及克服耐药性的新的治疗策略。研究显示,异常的DNA甲基化与卵巢癌铂类药物获得性耐药有关,去甲基化药物可恢复卵巢癌化疗耐药患者对铂类药物的敏感性,改善其预后,是潜在的卵巢癌治疗的靶点。目前国内临床普遍使用的DNA甲基化转移酶抑制剂(DNMT抑制剂),又称为去甲基化药物,有地西他滨和阿扎胞苷。两者磷酸化后可直接惨入DNA,抑制DNA甲基化转移酶,引起DNA低甲基化、细胞分化或凋亡,从而起到抗肿瘤的作用。目前去甲基化药物还主要应用于初治及复治的原发和继发性骨髓增生异常综合征,在卵巢癌治疗方面还没有成熟的应用。其次,去甲基化药物的使用还没有明确的靶点,整体使用的有效率仅在40-60%。临床也急需一种可对卵巢癌选择治疗性和依据耐药情况进行选择性治疗的判断方法和依据,如果寻找到能够应用于去甲基化药物使用的明确的靶点,有利于提高去甲基化药物临床治疗效能。
发明内容
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种卵巢癌相关的基因甲基化检测组合物及其用途,用于解决现有技术中对卵巢癌的检测缺乏有效的手段。
本发明的一方面提供了HOXA9、SHOX2、RASSF1A、SEPTIN9四基因联合用于制备卵巢癌诊断试剂的用途,所述试剂用于检测所述四基因的甲基化程度。
进一步地,所述诊断试剂检测的样本为生物体的胸水、腹水、腹腔冲洗液、卵巢疾病患者组织样本中的任一种。所述卵巢疾病患者组织样本可以是卵巢囊肿积液、或其他卵巢组织样本。
进一步地,所述用途具体包括以下至少一项:
a)若样本HOXA9、SHOX2、RASSF1A任一基因甲基化阳性,提示卵巢恶性病变的可能性增加,建议患者及时接受进一步临床检查。
b)若SEPTIN9甲基化检测阳性,提示非卵巢癌。
进一步地,所述用途具体包括以下至少一项:
c)若RASSF1A甲基化检测阳性,提示可联合使用去甲基化药物恢复卵巢癌铂类药物化疗敏感性;
d)若SEPTIN9阳性,且HOXA9阴性提示消化系统肿瘤,若SEPTIN9阴性、且HOXA9阳性提示卵巢癌。
本发明的另一方面提供了一种卵巢癌诊断试剂,所述试剂包括SHOX2、RASSF1A、SEPTIN9以及HOXA9四基因甲基化检测试剂。所述试剂用于检测所述四基因的甲基化程度。所述诊断试剂检测的样本为生物体的胸水、腹水、腹腔冲洗液、卵巢囊肿积液、或卵巢组织样本中的任一种。
进一步地,所述甲基化检测试剂包括SHOX2基因检测引物、RASSF1A基因检测引物以及HOXA9基因检测引物、SEPTIN9基因检测引物。
进一步地,所述SHOX2基因检测引物如SEQ ID No.3和SEQ ID No.4所示、所述RASSF1A基因检测引物如SEQ ID No.1和SEQ ID No.2所示、所述HOXA9基因检测引物如SEQID No.5和SEQ ID No.6所示、所述SEPTIN9基因检测引物如SEQ ID No.7和SEQ ID No.8所示。
进一步地,所述甲基化检测试剂还包括SHOX2基因检测探针、RASSF1A基因检测探针、SEPTIN9基因检测探针、以及HOXA9基因检测探针,每个所述探针的两端分别连接有荧光报告/淬灭基团。
进一步地,所述SHOX2基因检测探针的核苷酸序列如SEQ ID No.10所示、RASSF1A基因检测探针核苷酸序列如SEQ ID No.9所示、以及HOXA9基因检测探针核苷酸序列如SEQID No.11所示、所述SEPTIN9基因检测探针核苷酸序列如SEQ ID No.12。
进一步地,所述甲基化检测试剂还包括以下试剂中的一种或多种:RASSF1A阳性质控品、SHOX2阳性质控品、HOXA9阳性质控品、SEPTIN9阳性质控品、RASSF1A阴性质控品、SHOX2阴性质控品、HOXA9阴性质控品、SEPTIN9阴性质控品、亚硫酸氢盐、或PCR反应液、酶混合液。
如上所述,本发明的卵巢癌相关的基因甲基化检测组合物及其用途,具有以下有益效果:
本发明通过对RASSF1A、SHOX2、HOXA9、SEPTIN9四基因的甲基化水平的检测达到对卵巢癌辅助诊断、与消化系统肿瘤尤其是胃肠肿瘤鉴别诊断和作为去甲基化药物靶点检测的目的。本方法快速有效,具有较好的灵敏度和特异性。
附图说明
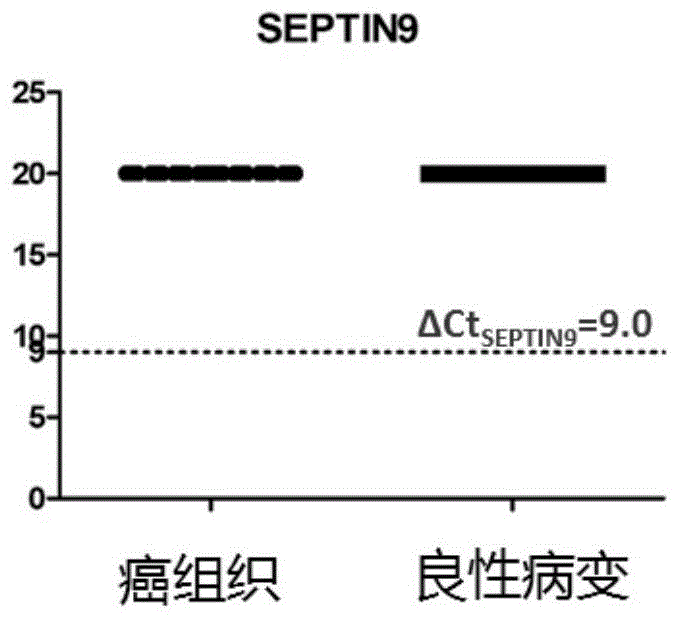
图1显示为SEPTIN9基因甲基化在癌组织、癌旁组织、良性病变组织中的表达情况。
图2显示为HOXA9基因甲基化在癌组织、癌旁组织、良性病变组织中的表达情况。
图3显示为RASSF1A基因甲基化在癌组织、癌旁组织、良性病变组织中的表达情况。
图4显示为SHOX2基因甲基化在癌组织、癌旁组织、良性病变组织中的表达情况。
具体实施方式
DNA甲基化(DNA methylation)为DNA化学修饰的一种形式,能够在不改变DNA序列的前提下,改变遗传表现。所谓DNA甲基化是指在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5号碳位共价键结合一个甲基基团。大量研究表明,DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。在恶性肿瘤发生之前的癌前病变阶段,相较于正常组织细胞,病变组织细胞的基因组已经产生了广泛的DNA甲基化修饰。因此,相对于DNA突变而言,DNA甲基化修饰是肿瘤发生的最早期事件,具有更高的灵敏度与特异度,更适合作为诊断的标志物。
Ras相关区域家族1(RASSF1)基因有5个不同的转录本:RASSF1A~E,其中RASSF1A最为常见。RASSF1A基因全长1 873bp,含340个氨基酸的开放阅读框,编码相对分子质量为388 000的蛋白多肽,其N端与富含半胱氨酸的甘油二酯或氟波酯结合区高度同源,故又称蛋白激酶C保守区。研究发现,多种肿瘤组织中存在RASSF1A启动子区异常甲基化和表达缺失,提示RASSF1A作为抑癌基因在多种肿瘤发生发展中发挥重要作用。RASSF1A作为抑癌基因发挥作用的机制目前尚不明确。
SHOX2,全称Short Stature Homobox 2,译为“矮小同源盒基因”,是同源盒基因家族的一员,其基因表达调控与器官发育密切相关。此基因是同源家族编码包含表示的DNA结合结构域的60个氨基酸残基序的蛋白质的基因的一个成员。同源基因已经被广泛地表征为在两个无脊椎动物和脊椎动物物种涉及图案形成转录调节。一些人类遗传疾病是由人类同源基因畸变造成的。这个轨迹代表了被认为是负责特发性身材矮小一个假常同源基因,它是在特纳综合征患者的身材矮小表型有关。
HOXA9基因是同源盒(HOX)基因家族中的一员,其编码产物是一种重要的转录调节因子,在控制胚胎发育和调节细胞分化过程中发挥重要作用。近年来的研究发现,HOXA9基因的异常表达与急性白血病,恶性胶质瘤,卵巢癌,肺癌,乳腺癌等多种肿瘤密切相关。在不同类型肿瘤或肿瘤的不同阶段,HOXA9通过参与肿瘤细胞的增殖,凋亡或分化过程而具有双重作用(促癌作用或抑癌作用)。
Septin是一类广泛分布于除植物外所有真核生物中具有GTPase活性的保守骨架蛋白基因家族,与细胞分裂有关。在人类,其由14个家族成员组成,分别命名为Septin1~14,其中Septin9定位于17q25.3,含有17个外显子,编码Septin9蛋白其有多个亚型(如Septin 9-vl、v2、v3、v4,),且各亚型间具有结构相似性,由位于中央的P-loop GTP结合域、可变的N端和C端结构域组成,与染色体分离、DNA修复、迁移、凋亡等细胞功能有关。研究发现Septin9与肿瘤的发生直接相关且在不同的肿瘤中,其表达及功能不尽相同。本文中,检测DNA甲基化的方法本领域周知,例如基于重亚硫酸盐转化的PCR(例如甲基化特异性PCR(Methylation-specific PCR,MSP))、DNA测序(如亚硫酸氢盐测序(Bisulfitesequencing,BS)、全基因组甲基化测序(Whole-genome bisulfitesequencing,WGBS)、简化甲基化测序(Reduced Representation Bisulfite Sequencing,RRBS))、芯片、甲基化敏感的限制性内切酶分析法(Methylation-Sensitive DependentRestriction Enzymes)、荧光定量法、甲基化敏感性高分辨率熔解曲线法(Methylation-sensitivity High-resolutionMelting,MS-HRM)、基于芯片的甲基化图谱分析、质谱(例如飞行质谱)。在一个或多个实施方案中,检测包括检测基因或位点处的任一条链。
因此,本发明涉及检测DNA甲基化的试剂。本领域周知上述检测DNA甲基化的方法中所用的试剂。此外,在涉及DNA扩增的检测方法中,检测DNA甲基化的试剂包括引物。所述引物序列为甲基化特异的或非特异的。优选地,所述引物的序列包括非甲基化特异的封闭序列(Blocker)。封闭序列可以提高甲基化检测的特异性。
示例性地,当使用荧光定量PCR时,检测DNA甲基化的试剂还可包括探针。所述探针的序列的5’端标记荧光报告基团,3’端标记淬灭基团。通常,PCR的反应液包含Taq DNA聚合酶、PCR缓冲液(buffer)、dNTPs、Mg2+。优选地,Taq DNA聚合酶为热启动Taq DNA聚合酶。示例性地,Mg2+终浓度为1.0-10.0mM;各引物浓度为200-700nM;各探针浓度为100-400nM;PCR反应条件为,95℃预变性5min;95℃变性15s,60℃退火延伸1min,45个循环。
本领域知晓甲基化水平的计算方法。示例性地,在通过PCR检测甲基化的实施方案中,甲基化水平=2–ΔCt待检样品/2–ΔCt阳性标准品×100,其中ΔCt=Ct目的基因–Ct内参基因。或者,在通过测序检测甲基化的实施方案中,甲基化水平=甲基化碱基数/总碱基数。
本文所述“DNA”或“DNA分子”即脱氧核糖核酸。DNA的碱基(bp)主要有腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)。DNA形式包括cDNA、基因组DNA、片段化DNA或人工合成的DNA。DNA可以是单链的或是双链的。
本文所述“尿嘧啶”或“U”是RNA的组成部分。“RNA”或“RNA分子”即核糖核酸。RNA由核糖核苷酸经磷酸二酯键缩合而成长链状分子。RNA的碱基主要有4种,即腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、尿嘧啶(U)。在RNA的碱基配对中,U取代了DNA中的T的位置,即A与U经氢键配对,G与C经氢键配对。
在一个具体实施方案中,所述甲基化检测方法包括:(1)样本准备:包括DNA抽提、质检;(2)DNA转化:对步骤(1)得到的DNA进行重亚硫酸盐转化,未甲基化的胞嘧啶(cytosine,C)经过转化变为尿嘧啶(uracil,U);甲基化的胞嘧啶转化后不发生改变;(3)反应混合液准备:包括PCR反应液,引物混合物,探针混合物;(4)PCR混合物准备:向步骤(3)中加入步骤(2)重亚硫酸盐转化的模板DNA,以及阳性标准品、阴性对照或者非模板对照(NTC);(5)PCR反应:进行PCR反应,收集荧光。所述PCR反应液包括:Taq DNA聚合酶、PCR缓冲液(buffer)、dNTPs、Mg
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置。此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
方法
一、前期样本处理
1、对组织石蜡切片样本前处理:
1.1取2-3片石蜡切片放置于离心管中,加入1mL二甲苯,盖紧管盖,涡旋震荡10s。
1.2 12000rpm离心2min,小心吸弃上清,注意不要吸弃沉淀。
1.3加入1mL无水乙醇,涡旋振荡混匀。12000rpm离心2min,小心吸弃上清,注意不要吸弃沉淀。
1.4打开管盖,室温或37℃孵育10min,直至无乙醇残留。
1.5加入180μL裂解缓冲液1,重悬沉淀,加入20μL蛋白酶K,涡旋震荡混匀
1.6 56℃孵育1小时,直至样品完全溶解。
1.7 90℃孵育1小时。短暂离心,使管壁上的溶液收集到管底。
1.8加入200μL裂解缓冲液2,涡旋震荡彻底混匀。加入200μL无水乙醇,涡旋震荡彻底混匀。短暂离心,使管壁上的溶液收集到管底。
1.9将1.8所得溶液全部转移至吸附柱中,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
2.对肺泡灌洗液、胸水及腹水样本前处理:
2.1将样本转移至15mL离心管(不同样本类型取样量略有不同,其中肺泡灌洗液和腹水为10mL,胸水为5mL),2000rpm离心5min,倒弃上清,用残留液体(100-200μL)重悬细胞沉淀。
2.2将上述液体转移至1.5mLEP管中,2000rpm离心5min,吸弃上清。
2.3加入200μL裂解缓冲液1,震荡至样品彻底悬浮。
2.4向样本中依次加入20μL蛋白酶K、200μL裂解缓冲液2,涡旋震荡充分混匀。
2.5 56℃金属浴中孵育10min,期间每隔2-3min混匀一次。
2.6短暂离心,加入200μL无水乙醇,涡旋震荡充分混匀,短暂离心。
2.7将EP管中液体转移至收集管的吸附柱中,注意枪头不要接触滤膜,以免捅破。二、对吸附柱进行洗涤、洗脱及核酸样本的定量
1.12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
2.向吸附柱中加入500μL漂洗缓冲液1,12000rpm离心1min,倒掉收集管中废液。
3.向吸附柱中加入500μL漂洗缓冲液2,12000rpm,1min,倒掉收集管中废液。
4.重复步骤3一次,提高DNA纯度。
5.12000rpm离心2min(此步目的为去除残留乙醇,残留乙醇会抑制PCR扩增,此步骤不可省略),准备新的1.5ml EP管,将吸附柱放置到EP管中,扔掉收集管,并将吸附柱室温开盖静置5min。
6.向吸附柱的滤膜中间部位悬空加入50μL洗脱缓冲液,室温静置5min。12000rpm离心1min,收集DNA溶液。
7.取新的EP管配制检测DNA浓度的试剂(奥盛/Qubit试剂盒),根据样本数量配制相应的试剂(每人份199μL Buffer+1μL染料),涡旋震荡。
8.取配制好的试剂199μL和1μL的DNA,放置在试剂盒自带的0.5ml配套管中,轻微震荡,轻甩气泡,避光3min.
9.使用Qubit或奥盛Fluo-100荧光计检测DNA浓度,DNA浓度应大于10ng/μL。(若DNA浓度<10ng/μL,建议重新抽提)。如果测得DNA浓度显示超出检测范围(高于100ng/μL),取2μL DNA原液+8μL洗脱液,旋涡震荡,瞬时离心,重新测浓度。
10.使用洗脱液将样本DNA均稀释至10ng/μL,将样本进行归一化处理。(后续亚硫酸盐修饰步骤需要10ng/μL的DNA,20μL)
三、亚硫酸氢盐修饰DNA:
1.按需处理DNA样本数量,准备PCR反应管;在每个PCR反应管中加入130μL的CT转化试剂,然后按顺序加入20μL DNA样本,做好标记,轻微震荡,短暂离心;
2.将PCR反应管放到PCR仪的反应板上,盖好热盖,按以下步骤设置反应程序
98℃,8min
64℃,3.5h
4℃,forever
3.按处理的DNA样本数量,准备纯化柱和收集管(试剂盒自带),在纯化柱上标记样本编号,将纯化柱放入收集管中。
4.取600μL的结合缓冲液,加入到纯化柱中。
5.把步骤2反应的产物全部转移到纯化柱中(含有600μL结合缓冲液),盖上盖,颠倒数次(10次以上),混合样品。然后12,000rpm离心30s,倒掉收集管中的液体。
6.加入100μL的洗涤液到纯化柱中,12,000rpm离心30s。
7.加入200μL的去磺酸化液到纯化柱中,室温孵育20min(此时可将PCR试剂盒从-20℃拿出,室温解冻),12,000rpm离心30s。
8.加入200μL的洗涤液到纯化柱中,12,000rpm离心30s,再加入200μL的洗涤液,12,000rpm离心30s,倒废液,12,000rpm离心1min。
9.将纯化柱放置在新的1.5ml的EP管(做好标记)中,直接加入20μL的洗脱液到纯化柱基质(必须加在基质上)上,12,000rpm离心30s,洗脱DNA。
四、PCR扩增
1.取出亚硫酸盐修饰后待测样本DNA。
2.试剂盒室温解冻30min,从试剂盒中取出PCR反应液和DNA聚合酶,PCR反应液需要震荡混匀20s(充分震荡),然后跟酶一起短暂离心。
备注:酶需低温放置,现用现配,且不许震荡。
3.配制PCR反应液:根据检测标本数量(样本数+阴阳质控),按照以下试剂配比配置PCR混合液,PCR反应液:DNA聚合酶=15:0.3(一人份)。根据配比将各组分加入一个新的EP管中,颠倒混匀,瞬时离心。
4.把PCR反应管按顺序摆放在PCR管架上,将配好的PCR反应液按每孔15μL加入PCR反应管,再加入DNA样本5μL,小心盖上反应管盖,做好标记(标记在管盖两端的柄上)。
5.瞬时离心,除去反应体系中的气泡,把PCR反应管放入仪器。
6.打开仪器设置窗口,设置PCR扩增与信号收集程序。
a)第一阶段:95℃,10分钟,1个循环;
b)第二阶段:95℃,15秒,60℃30秒,5个循环;
c)第三阶段:95℃,15秒,57℃30秒,40个循环;
信号收集:第三阶段57℃时收集FAM、VIC(或HEX)和CY5信号。
7.保存文件,运行程序。
实施例1卵巢癌甲基化诊断指标的筛选
筛选出在卵巢癌组织中甲基化高表达,在癌旁组织中不表达或者相对于癌中心低表达的指标,在良性病变中应该没有甲基化。具体的筛选方法如下:
由华西医科大学附属第二医院提供10例卵巢癌以及10例配对癌旁组织样本,并10例良性卵巢癌组织样本进行7种基因甲基化检测,其检测结果如表1所示:
表1卵巢癌组织、癌旁组织以及良性病变组织中7种基因甲基化检测结果
*Noct:“no Ct”缩写,表明PCR检测曲线完全不起跳,样本中无目标检测物
结果表明:
1、HOXA9、SHOX2甲基化在检测卵巢癌中有较高临床价值,在卵巢癌组织样本中的诊断灵敏度为90%和70%,良性病变中均未检测到其基因甲基化;RASSF1A在卵巢癌组织样本中的诊断灵敏度为20%,良性病变中未检测到其基因甲基化;SEPTIN9在卵巢良性和恶性样本中完全不起他跳,为“Noct”,而p16在癌组织、癌旁组织和良性病变样本中PCR扩增曲线均有翘尾。
2、HOXA9、SHOX2、RASSF1A在癌旁组织中检测甲基化为阳性的样本,与其配对的癌组织样本比较,甲基化的强度在癌旁组织较癌中心均有下降(数据未展示),说明这三个指标甲基化的改变具有癌特异性,也表明分子甲基化的改变是早于形态学的。
3、8例HOXA9、SHOX2、RASSF1A甲基化检测单独或联合阳性的癌旁组织,通过复查病理重新读片,7例找到少量癌细胞。
但多项研究表明RASSF1A甲基化与肿瘤的强侵袭转移密切相关,最新研究表明,RASSF1A甲基化还可以作为去甲基化药物使用的重要靶点;SEPTIN9作为胃肠肿瘤诊断灵敏度非常好的甲基化指标,但在本实验检测的所有卵巢良性和恶性样本中完全不起他跳,为“Noct”。
综上所述,通过筛选最终确定RASSF1A、SHOX2、HOXA9、SEPTIN9四个指标的甲基化作为诊断卵巢癌的标志物,用于构建卵巢癌甲基化诊断试剂盒。四指标联合检测的价值是:
1)若样本HOXA9、SHOX2、RASSF1A任一基因甲基化阳性,提示卵巢恶性病变的可能性增加,建议患者及时接受进一步临床检查明确诊断;
2)若样本SEPTIN9甲基化检测阳性,提示非卵巢癌,胃肠肿瘤原发可能性大。
实施例2卵巢癌甲基化诊断试剂盒的构建及使用
通过实验,最终确定选择基因RASSF1A、SHOX2、HOXA9、SEPTIN9作为检测靶标,用于卵巢癌的相关诊断使用。
一、试剂盒(命名为OncoMe
a)、RASSF1A、SHOX2、HOXA9、SEPTIN9基因甲基化检测反应液;
针对RASSF1A的正向引物(SEQ ID No.1):CGGGGTTCGTTTTGTGGTTTC;
针对RASSF1A的反向引物(SEQ ID No.2):CCGATTAAATCCGTACTTCG;
针对SHOX2的正向引物(SEQ ID No.3):TTGTTTTTGGGTTCGGGTT;
针对SHOX2的反向引物(SEQ ID No.4):CATAACGTAAACGCCTATACTCG;
针对HOXA9的正向引物(SEQ ID No.5):GGTATATCGTAGCGGGTATAGC;
针对HOXA9的反向引物(SEQ ID No.6):AACTTCCAATCCAAAACGACG;
针对SEPTIN9的正向引物(SEQ ID No.7):GCGTTTTTTCGTCGTTGTT;
针对SEPTIN9的反向引物(SEQ ID No.8):CGCGTTAACCGCGAAATC;
b)、RASSF1A、SHOX2、HOXA9、SEPTIN9阳性质控品;
c)、阴性质控品;
d)、PCR聚合酶;
e)、亚硫酸氢盐;
f)探针:
针对RASSF1A的探针核苷酸序列(SEQ ID No.9):TCGCGTTTGTTAGCGTTTAAAGT;
针对SHOX2的探针核苷酸序列(SEQ ID No.10):ATCGAACAAACGAAACGAAAATTACC;
针对HOXA9的探针核苷酸序列(SEQ ID No.11):TTCGTCGCGTGTATTGGGTTTTAC;
针对SEPTIN9的探针核苷酸序列(SEQ ID No.12):TCGCGCGATTCGTTGTTT;
g)内参基因
β-actin
AC-正向引物(SEQ ID No.13):AAGATAGTGTTGTGGGTGTAGGT
AC-反向引物(SEQ ID No.14):TACTTAATACACACTCCAAAACCG
AC-探针(SEQ ID No.15):ACACCAACCTCATAACCTTATCACAC
二、试剂盒的使用方法
具体参见上述方法部分记载。其中,
a)第一阶段:95℃,10分钟,1个循环;
b)第二阶段:95℃,15秒,60℃30秒,5个循环;
c)第三阶段:95℃,15秒,57℃30秒,40个循环;
信号收集:第三阶段57℃时收集FAM、VIC(或HEX)和CY5信号。其中FAM分别为检测RASSF1A、SEPTIN9的探针荧光信号,VIC分别为SHOX2、HOXA9的探针荧光信号,CY5为内参检测用探针荧光信号。
三、各个检测指标结果的判断
SEPTIN9在所有的卵巢良恶性细胞中均不表达;cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
HOXA9在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
RASSF1A在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
SHOX2在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0。
四、试剂盒检测结果的判断:
1)若样本HOXA9、SHOX2、RASSF1A任一基因甲基化阳性,提示卵巢恶性病变的可能性增加,建议患者及时接受进一步临床检查;
2)SEPTIN9甲基化检测阳性,提示非卵巢癌;
3)RASSF1A甲基化检测阳性,提示可联合使用去甲基化药物恢复卵巢癌铂类药物化疗敏感性;
4)SEPTIN9(+),HOXA9(-)提示胃肠肿瘤,而SEPTIN9(-),HOXA9(+)提示卵巢癌。
实施例3卵巢癌甲基化诊断试剂盒对组织样本的诊断截断值、灵敏度和特异性
1、利用卵巢组织样本建立各指标判断的截断值
华西医科大学附属第二医院提供了不同病理类型的卵巢癌组织样本140例,其中包括:50例浆液性腺癌,30例粘液性腺癌、30例子宫内膜样癌、30例透明细胞癌。同时提供了40例良性卵巢组织样本做为对照。180例组织样本临床诊断信息全面,全部进行了HOXA9、SHOX2、RASSF1A、SEPTIN9四个指标的甲基化检测,结果如表2和图1-4。
实验结果表明:
如图1,SEPTIN9在所有的卵巢良恶性细胞中均不表达;cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
如图2,HOXA9在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
如图3,RASSF1A在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0;
如图4,SHOX2在良性病变甲基化程度很低,其指标特异性非常好,cutoff值设定在指标PCR稳定检测范围内ΔCT=9.0。
2、检测指标的灵敏度
表2卵巢癌不同病理类型组织样本中四基因甲基化检测结果
实验结果表明:
HOXA9、RASSF1A、SHOX2在卵巢癌组织样本中检测的灵敏度分别为87%、45%、39%。HOXA9对卵巢癌的诊断灵敏度非常高,特别是对粘液性腺癌、子宫内膜样癌以及透明细胞癌的诊断灵敏度达到了100%,但对卵巢癌最常见病理类型浆液性卵巢癌的诊断灵敏度仅为64%,RASSF1A、SHOX2对浆液性卵巢癌的检出有很好的互补作用(18例HOXA9阴性的浆液性腺癌样本中,发现RASSF1A单独阳性4例,SHOX2单独阳性2例,RASSF1A和SHOX2双阳性4例(数据未展示))。HOXA9、RASSF1A、SHOX2三基因甲基化联合对浆液性卵巢癌的检测的灵敏度从HOXA9检测阳性的64%,提高到84%。
HOXA9、RASSF1A、SHOX2在卵巢良性组织样本中检测的灵敏度分别为5%、0%、0%,表明指标对卵巢癌的检测特异非常好,分别为95%、100%、100%。
SEPTIN9在140份卵巢癌组织样本和40例良性病变组织样本中均未检出,表明卵巢组织具有SEPTIN9甲基化阴性的特征。
实施例4试剂盒临床应用之一:提高卵巢癌小穿刺活检样本的诊断灵敏度
华西医科大学附属第二医院提供15例临床最终确诊为卵巢癌的手术样本和其配对小活检样本(手术大活检样本病理细胞学均确诊为卵巢癌,15例小活检9例未见癌细胞或6例样本见异型,恶性不排除),所有的组织样本进行了四基因甲基化检测,其结果如表3。
表3卵巢癌手术样本及其配对穿刺小活检样本四基因甲基化检测
*3基因联合(+):HOXA9、SHOX2、RASSF1A三个基因甲基化检测任一基因甲基化检测阳性为“3基因联合”甲基化检测阳性。
以上实验表明:
“3基因联合”检测15例卵巢癌大活检样本为14例阳性,“3基因联合”检测15例小活检样本细胞学诊断为阴性或疑似为11例为阳性。所有卵巢癌样本SEPTIN9甲基化检测为阴性。
HOXA9、SHOX2、RASSF1A三基因甲基化联合检测可显著提高卵巢癌活检小穿刺样本的诊断灵敏度,现有细胞形态学诊断为阴性或异型的卵巢癌小活检样本15例(细胞学诊断灵敏度为0%),三基因甲基化联合检测为阳性11例,其诊断灵敏度为73.3%。
实施例5试剂盒临床应用之二:胸腹样本中4基因甲基化检测提高卵巢癌的诊断灵敏度以及与消化系统肿瘤的鉴别诊断
由河北省肿瘤医院提供恶性胸腹水样本共97例,其中卵巢癌引发的为50例,由胃肠肿瘤引发的33例,由肝胆胰等消化系统肿瘤引发的为14例。同时医院提供了40例良性胸腹水样本作为对照。全部137例胸腹水样本都进行了病理细胞学诊断,同时进行了4基因甲基化的联合检测,其检测结果如表4:
表4胸腹水样本中四基因甲基化检测
*4基因联合(+):HOXA9、SHOX2、RASSF1A、SEPTIN9四个基因甲基化检测任一基因甲基化检测阳性为“4基因联合”甲基化检测阳性。
实验检测结果表明,对于卵巢癌引发的胸腹水细胞学诊断灵敏度仅为14%,但4基因甲基化联合检测的灵敏度提高到了86%。4基因中HOXA9、RASSF1A、SHOX2在卵巢癌诊断的灵敏度分别为70%、18%和36%,而SEPTIN9在卵巢癌中的阳性率为0%。
对于消化系统肿瘤引发的胸腹水细胞学诊断灵敏度为14.9%,4基因甲基化联合检测的灵敏度提高到了93.6%。4基因中SEPTIN9在消化系统肿瘤的诊断的灵敏度为70.2%,而RASSF1A、SHOX2甲基化诊断灵敏度为23.4%和46.8%,而HOXA 9在消化系统肿瘤的甲基化检测阳性率仅为8.5%。
在40例良性胸腹水样本中共检出甲基化阳性2例,其中1例为SHOX2阳性和1例为HOXA9阳性。4基因联合检测对恶性胸腹水检测的特异性为95%。
胸腹水4基因甲基化联合检测一方面可以及时明确样本的性质,即良恶性鉴别,另一方面,4基因联合检测可以对卵巢癌和消化系统肿瘤有一定鉴别诊断的提示作用,当HOXA9甲基化阳性多指向恶性卵巢癌而SEPTIN9甲基化阳性则多指向恶性消化系统肿瘤。
实施例6试剂盒临床应用之三:腹腔冲洗液4基因甲基化检测
上海市肿瘤医院提供手术中腹腔冲洗液42例,后期确诊其中19例患者未发现淋巴结转移,23例肿瘤已发生淋巴结转移。收集的术中腹腔冲洗液同时进行了细胞学诊断和4基因甲基化(HOXA9、SHOX2、RASSF1A、SEPTIN9)联合检测,其检测结果如表5:
表5卵巢癌手术腹腔冲洗液四基因甲基化检测结果
实验的检测结果表明,在出现淋巴节转移患者腹腔冲洗液中细胞学检测的灵敏度仅为39.1%,4基因甲基化联合检测的灵敏度为87%。在临床诊断未发生淋巴结转移的19例患者中,腹腔冲洗液中细胞学未检测到癌细胞,但4基因甲基化检测发现2例患者为甲基化阳性。
在后期对2例形态病理诊断为无淋巴结转移但甲基化为阳性的患者进行了密切的随访观察。1例患者术后接受化疗,3个月随访出现了腹腔积液,其腹腔积液细胞学检测和4基因甲基化检测均为阳性。根据这次检测结果,医生调整了其化疗的剂量和疗程。另1例患者,术后诊断为卵巢癌I期,无淋巴结转移,故未进行化疗治疗。患者术后6个月,出现腹水,细胞学和甲基化检测均为阳性,继而临床实施了化疗。
卵巢癌术中腹腔冲洗液脱落细胞学检测对于判断早期发现肿瘤腹腔种植非常重要,其检测结果直接影响了后期的治疗方案。4基因甲基化联合检测可以大幅提高恶性腹腔冲洗液的诊断灵敏度,具有非常高的临床应用价值。
实施例7试剂盒临床应用之四:一例胃肠肿瘤继发卵巢癌的诊断
河北省肿瘤医院,送检1例卵巢癌患者腹腔冲洗液样本。经四基因甲基化检测为SHOX2(+)、SEPTIN9(+)、RASSF1A(-)、HOXA9(-)。根据甲基化检测结果SEPTIN9(+)高度提示患者可能是原发胃肠肿瘤,而不是卵巢原发(HOXA9(-))。患者经近一步影像学诊断,确诊为原发结直肠癌发生了卵巢转移。
基因甲基化检测指标在多种肿瘤中均有表达,但特定的甲基化指标仍然具有一定的组织器官的特异性,对于临床的肿瘤组织溯源有一定的提示作用。胃肠肿瘤多具有SEPTIN9(+),HOXA9(-)的特性,而卵巢癌具有SEPTIN9(-),HOXA9(+),故SEPTIN9联合HOXA9检测具有一定的对卵巢癌和消化系统肿瘤,特别是胃肠肿瘤的鉴别诊断价值。
实施例8试剂盒临床应用之五:RASSF1A作为去甲基化药物地西他滨药物使用的靶点
上海复旦大学附属第六人民医院进行了低剂量地西他滨联合卡铂治疗复发性铂类药物耐药的卵巢癌患者的临床试验。实验入组12例化疗耐药卵巢癌患者,给予患者静脉滴注低剂量(10mg/m2)地西他滨,连续5d,第8天使用卡铂,结果显示,12例患者中,5例对治疗有效,其中1例患者无进展生存时间达17个月。
患者在临床实验入组后去甲基化药物使用前均抽取了10ml静脉血,分离游离DNA进行了4基因甲基化检测,12位患者血液甲基化检测11例阳性,整体阳性率为92%。其中RASSF1A检测阳性4例,阳性率为33.3%。后期观察结果表明5例治疗有效的患者均为RASSF1A阳性,4例为RASSF1A阳性。研究结果表明,对于卡铂治疗复发性铂类药物耐药的卵巢癌患者进行血液RASSF1A甲基化检测,检测阳性患者采用地西他滨联合卡铂治疗,可恢复了耐药卵巢癌患者对铂类化疗药物的敏感性,具有显著的临床疗效。
综上所述,本发明发现RASSF1A、SHOX2、HOXA9、SEPTIN9甲基化联合检测在卵巢检测中有较高临床价值。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
序列表
<110> 上海透景生命科技股份有限公司
<120> 一种卵巢癌相关的基因甲基化检测组合物及其用途
<130> 22F006
<141> 2022-05-31
<160> 15
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
cggggttcgt tttgtggttt c 21
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ccgattaaat ccgtacttcg 20
<210> 3
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ttgtttttgg gttcgggtt 19
<210> 4
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
cataacgtaa acgcctatac tcg 23
<210> 5
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ggtatatcgt agcgggtata gc 22
<210> 6
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
aacttccaat ccaaaacgac g 21
<210> 7
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
gcgttttttc gtcgttgtt 19
<210> 8
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
cgcgttaacc gcgaaatc 18
<210> 9
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
tcgcgtttgt tagcgtttaa agt 23
<210> 10
<211> 26
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
atcgaacaaa cgaaacgaaa attacc 26
<210> 11
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
ttcgtcgcgt gtattgggtt ttac 24
<210> 12
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
tcgcgcgatt cgttgttt 18
<210> 13
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
aagatagtgt tgtgggtgta ggt 23
<210> 14
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 14
tacttaatac acactccaaa accg 24
<210> 15
<211> 26
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
acaccaacct cataacctta tcacac 26
- 一种用于敲除CCR5基因的gRNA、gRNA组合物和CRISPR-Cas9系统及其用途
- 一种用于检测多靶点基因突变、甲基化修饰和/或羟甲基化修饰的检测探针、方法和试剂盒
- 一种微卫星生物标志物组合、检测试剂盒及其用途
- 一种用于粪便检测进展期腺瘤、结直肠癌相关基因甲基化位点的试剂盒
- 一种用于检测卵巢癌相关基因甲基化的核酸组合物、试剂盒和检测方法
- 一种甲状腺癌相关的基因突变和甲基化检测组合物及其用途
