一种具有免疫调控功能的可注射双网络水凝胶及其制备方法和应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及生物医用材料及可注射水凝胶技术领域,尤其涉及一种具有免疫调控功能的可注射双网络水凝胶及其制备方法和应用。
背景技术
生物材料和组织工程领域正在迅速发展,为各种医疗保健问题开发主流解决方案。生物材料在促进伤口愈合、修复受损组织和提供可移植医疗设备方面发挥了核心作用,生物材料应用后,会引发一系列细胞和分子事件(生物材料与宿主之间的炎症相互作用),导致直接的急性后果,如巨大的疼痛、过度的炎症、组织破坏,甚至医疗器械的隔离和排斥,阻碍组织修复和伤口愈合。随着炎症越来越被认为是影响再生的关键因素,免疫调节或免疫工程已成为克服再生医学这一关键挑战的潜在解决方案。目前,使用的抗炎药制剂(如地塞米松、雷帕霉素)、抗炎和/或伤口修复分子、细胞和/或细胞因子从载体或涂层局部递送的免疫调节策略,存在药代动力学、有效药物浓度、组织毒性、高成本和生产复杂等各方面的局限性。
皮肤包括复杂的多层结构,是人体面积最大的器官。皮肤及其附属物在维持身体功能和保护内部器官免受恶劣外部环境的影响方面发挥着至关重要的作用。由于各种因素等对皮肤造成的严重缺损是当今世界各国普遍面临的重大医疗及公众健康问题。伤口愈合是一个高度协调的过程,可分为四个不同阶段:止血、炎症、增殖和重塑。炎症反应在伤口愈合中起着关键作用,未解决的炎症会阻碍愈合进程,导致慢性甚至无法愈合的伤口。事实上,慢性不愈合伤口是糖尿病最常见的并发症之一。慢性糖尿病伤口背后是一个复杂的微观环境,其中持续的炎症、晚期糖基化终产物的积累和过度的氧化应激导致局部伤口区域的微血管并发症、神经病变和细胞衰老。随着老龄化和肥胖人口的增加,慢性糖尿病伤口正成为对公共健康的严重威胁,对于慢性伤口的有效治疗得到越来越多的关注。
水凝胶长期以来一直被认为是一种有前途的生物材料平台,能够模拟各种组织的天然细胞基质环境,抵抗感染,吸收伤口渗出物,保持水平衡和气体交换,封装、保护和递送生物活性分子,在生物医学中具有各种应用。水凝胶作为临床组织修复材料应用,应具有良好的成胶能力、流动性和形状自适应能力,以适应形状不规则、深度不同的创面。此外,它们还需要保护伤口表面免受创伤修复过程中可能发生的内外部机械变形的影响。早期水凝胶的静态化学共价交联机制无法精确匹配不规则和深部组织缺损区域,并且需要侵入性手术植入非浅表组织,极大限制了其最终的临床转化应用。可注射水凝胶为个性化、局部定向和可持续、以及在目标部位以微创方式施用治疗开辟了新的可能途径。可注射水凝胶通常由物理非共价相互作用或者动态可逆共价交联来构建,使得其具有一个较弱的无法与组织相匹配的机械性能,另外由于交联的快速交换动力学,大多数可注射水凝胶都经历了快速的降解,缺乏长期稳定性,无法实现长期持续性的调节作用和支持作用,这大大限制了其应用的效果。相比之下,共价交联水凝胶具有稳定的交联网络,然而,通常共价非可逆交联水凝胶无法进行注射应用。
3D生物打印在组织工程领域展现出巨大的应用潜力,但在适用性打印生物墨水的材料选择方面存在很多限制,成功进行3D生物打印需要一个合适的生物制造窗口,该窗口生物墨水实现可打印性和生物相容性之间的平衡,同时提供各种合适的流变学、机械和生物学特性,而往往细胞存活和定向生长所需材料的生物特性通常与可加工性和打印保真度所需的材料理化特性相冲突。如何兼顾可注射水凝胶的可注射性和理想力学性能,并利用3D打印技术制备慢性不愈合伤口的修复材料成为亟需解决的问题。
发明内容
(一)要解决的技术问题
鉴于现有技术的上述缺点、不足,本发明提供一种具有免疫调控功能的可注射双网络水凝胶及其制备方法和应用,其解决了可注射水凝胶无法兼顾可注射性和理想力学性能,以及水凝胶免疫调控策略中存在药代动力学、组织毒性、高成本和生产复杂的局限性的技术问题。
(二)技术方案
为了达到上述目的,本发明采用的主要技术方案包括:
第一方面,本发明提供一种可注射双网络水凝胶,在溶液中,以富含氨基的天然多糖或其衍生物和甲基丙烯酰化的蛋白质类生物高分子材料作为生物基质材料,以亚精胺作为生物活性功能成分,在苯甲醛封端的高分子交联剂的作用下,富含氨基的天然多糖或其衍生物上的胺基、亚精胺分子链上的胺基以及甲基丙烯酰化的蛋白质类生物高分子材料上的部分胺基与苯甲醛封端的高分子交联剂上的醛基发生席夫碱反应,形成第一层动态可逆交联网络结构;再在光引发下,甲基丙烯酰化的蛋白质类生物高分子材料发生自由基聚合,形成第二层静态非可逆共价交联网络结构,得到具有双网络结构的可注射水凝胶。
本发明的具有双网络结构的可注射水凝胶中,第一层动态可逆交联网络结构与第二层静态非可逆共价交联网络结构之间相互穿插、部分缠绕,形成了一个稳固的结构,使水凝胶具有优异的机械性能。
可选地,所述富含氨基的天然多糖或其衍生物为壳聚糖、壳聚糖衍生物、透明质酸、透明质酸衍生物、纤维素及纤维素衍生物中至少一种;
所述甲基丙烯酰化的蛋白质类生物高分子材料为甲基丙烯酰化明胶、甲基丙烯酰化纤维蛋白及甲基丙烯酰化胶原蛋白中至少一种;
所述苯甲醛封端的高分子交联剂为至少含有一个苯甲醛基团的多臂聚乙二醇。
进一步地,所述至少含有一个苯甲醛基团的多臂聚乙二醇为两臂苯甲醛封端的聚乙二醇、四臂苯甲醛封端的聚乙二醇、六臂苯甲醛封端的聚乙二醇、八臂苯甲醛封端的聚乙二醇、五臂苯甲醛三臂三碘苯甲酸酯中至少一种。
优选地,所述富含氨基的天然多糖及其衍生物为壳聚糖衍生物;进一步优选地,所述壳聚糖衍生物为羟基位取代羧甲基壳聚糖;
所述甲基丙烯酰化的蛋白质类生物高分子材料为甲基丙烯酰化明胶;
所述苯甲醛封端的高分子交联剂为四臂苯甲醛封端的聚乙二醇。
第二方面,本发明提供一种所述的可注射双网络水凝胶的制备方法,包括如下步骤:
S1、分别配制苯甲醛封端的高分子交联剂溶液、富含氨基的天然多糖或其衍生物溶液、甲基丙烯酰化的蛋白质类生物高分子材料溶液;
S2、将所配制的富含氨基的天然多糖或其衍生物溶液、甲基丙烯酰化的蛋白质类生物高分子材料溶液、亚精胺溶液和光引发剂混合,得到可注射水凝胶的前体溶液;
S3、在自然环境温度下,将步骤S2所得可注射水凝胶的前体溶液与苯甲醛封端的高分子交联剂溶液混合,使富含氨基的天然多糖或其衍生物上的胺基、亚精胺分子链上的胺基以及甲基丙烯酰化的蛋白质类生物高分子材料上的部分胺基与苯甲醛封端的高分子交联剂上的醛基发生席夫碱反应,形成第一层可逆交联网络结构;然后通过激发光照射,引发体系中甲基丙烯酰化的蛋白质类生物高分子材料发生自由基聚合,形成第二层静态非可逆共价交联网络,即得所述可注射双网络水凝胶。
可选地,步骤S2中,所述可注射水凝胶的前体溶液中,所述富含氨基的天然多糖及其衍生物的浓度为1wt%-4wt%,所述甲基丙烯酰化的蛋白质类生物高分子材料的浓度为4wt%-10wt%。
可选地,步骤S2中,所述可注射水凝胶的前体溶液中,亚精胺的浓度为25-500μM。
可选地,苯甲醛封端的高分子交联剂与富含氨基的天然多糖或其衍生物溶液的摩尔比为1:5-4:1。
可选地,步骤S3中,所述激发光的波长为395nm或405nm,照射时间为15-60s。
优选地,使用PBS(pH=7.2-7.4)溶液配制苯甲醛封端的高分子交联剂溶液、富含氨基的天然多糖或其衍生物溶液、含有光引发剂的甲基丙烯酰化的蛋白质类生物高分子材料溶液配制。
优选地,苯甲醛封端的高分子交联剂的分子量为10-20kDa。
优选地,配制甲基丙烯酰化的蛋白质类生物高分子材料溶液时,可在60-70℃条件下溶解。
第三方面,本发明提供一种所述的可注射双网络水凝胶或者所述的制备方法制备的可注射双网络水凝胶在制备慢性不愈合伤口敷料中的应用。
可选地,所述慢性不愈合伤口包括糖尿病创面。
可选地,所述慢性不愈合伤口敷料以所述可注射双网络水凝胶为3D打印生物墨水,通过3D打印的方式制备得到。
(三)有益效果
本发明的有益效果是:本发明的一种具有免疫调控功能的可注射双网络水凝胶,采用两步交联策略,以富含氨基的天然多糖及其衍生物和甲基丙烯酰化的蛋白质类生物高分子材料作为生物基质材料,以亚精胺作为生物活性功能成分,在苯甲醛封端的高分子交联剂的作用下,形成第一层动态可逆交联网络结构;再在光引发下形成第二层静态共价交联网络结构,得到具有双网络结构的可注射水凝胶。本发明将动态可逆交联网络可注射、自修复的优势与非动态共价交联提供增强力学性能和结构稳定性的优势相结合,解决了大多数可注射水凝胶面临的机械性能差、降解速度快的劣势,实现了水凝胶优异可注射性和理想力学性能及结构稳定性的平衡。
本发明提出的可注射双网络水凝胶,所采用的生物基质材料和生物免疫调控活性成分亚精胺都属于天然生物材料,所使用的交联剂也是具有良好的生物相容性、非免疫原性的高分子合成聚合物。因此,本发明所提出的可注射双网络水凝胶保证了较高的生物安全性和生物可完全降解性。
本发明提出的可注射双网络水凝胶,极大程度上模拟了天然细胞外基质环境,有效支持其细胞在水凝胶3D空间当中的各种活动。其中,所采用的生物基质材料模拟了天然细胞外基质成分(蛋白和多糖),所构建的动静态相结合的双网络结构模拟了天然细胞外基质的微观结构动力学特性。解决了静态网络水凝胶限制细胞与底物相互作用,阻碍细胞正常功能发挥的局限性,为水凝胶作为3D仿生基质在生物医学的应用当中开辟了新的可能。
本发明提出的可注射双网络水凝胶引入亚精胺生物活性成分,亚精胺具有抗炎、抗氧化和免疫调控作用,避免了使用抗炎药物制剂、抗炎和/或伤口修复分子、细胞和/或细胞因子时,存在的药代动力学、有效药物浓度、组织毒性及过量给药导致不良反应的风险,赋予水凝胶优异的固有抗炎免疫调控活性功能。另外,亚精胺通过在室温下与交联剂发生席夫碱反应负载在水凝胶体系中,避免了负载小分子药物、细胞和/或细胞因子时所涉及的成本高昂,生产复杂的问题,并且可以提供一个持续的治疗效果。
制备本发明的可注射双网络水凝胶的过程中,富含氨基的天然多糖的胺基、亚精胺分子链上胺基以及蛋白质上的部分胺基与苯甲醛封端的高分子交联剂上的醛基发生席夫碱反应,形成亚胺键,构成第一层可逆动态共价交联网络。亚胺键不稳定,具有pH响应性,在不同的pH条件下,亚胺键解离速度不同,在酸性pH值下,亚胺键解离较快。在不同的pH条件下,随着亚胺键的解离,亚精胺从水凝胶中释放出来,因此,SPD的释放具有pH值响应性。
本发明提出的可注射双网络水凝胶,具有优异的抗炎、抗氧化、抗菌和免疫调控生物学功能,能够显著减轻生物材料所引发的宿主免疫炎症反应。其优异的免疫调控和抗氧化性能,可以有效调控巨噬细胞表型极化,降低糖尿病慢性伤口愈合过程中的过度炎症累积,加速炎症期向增殖期过渡,抑制过度氧化应激水平,促进血管生成,从而加速伤口愈合,促进功能性皮肤再生。
本发明提出的可注射双网络水凝胶,具有优异的可注射、自愈合和形状自适应性,能够适用于不规则和深度缺损伤口区域,以及以微创的方式应用于非浅表组织或非开放创面的修复,解决了静态交联只能应用于浅表组织和开放性的创面的局限性。
本发明提出的可注射双网络水凝胶可以进一步应用于3D生物打印技术。本发明提出的可注射双网络水凝胶,在完成第一步交联后所形成的动态单网络水凝胶可以用作3D生物打印墨水,本发明所提出的具有动态网络的可注射水凝作为3D生物打印墨水能够实现可打印性和生物相容性之间的平衡,同时提供各种合适的流变学、机械力学和生物学特性。对于负载细胞的3D生物打印,提出的可注射水凝胶能够保护细胞在印刷过程免受高剪切应力的影响,提高了打印细胞的活性,同时保证打印结构的形状保真度,打印后原位光固化策略,打印结构优异的力学性能和结构稳定性,提供支持细胞生存和功能的三维培养环境,更好地实现组织再生。
附图说明
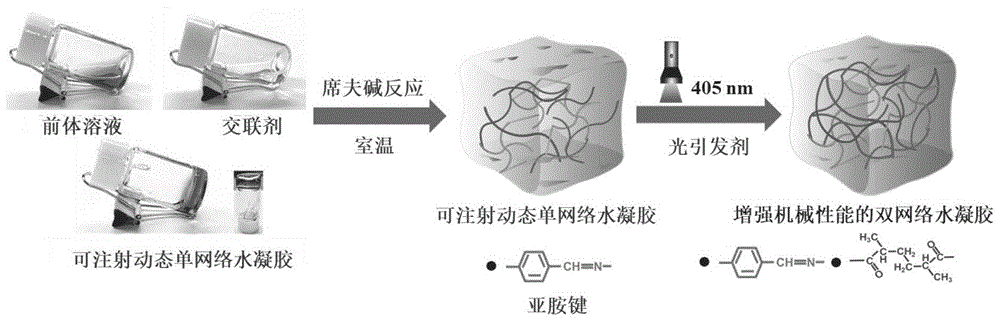
图1为本发明的可注射双网络水凝胶的制备过程示意图;
图2为本发明的可注射双网络水凝胶的增强力学性能表征图;
图3为本发明的可注射双网络水凝胶可注射和自修复性能表征图;
图4为本发明的可注射双网络水凝胶抗氧化性能表征图;
图5为本发明的可注射双网络水凝胶抗炎免疫调控性能图;
图6为本发明的可注射双网络水凝胶促进糖尿病伤口愈合表征图;
图7为本发明的可注射双网络水凝胶应用于3D生物打印的结果图。
具体实施方式
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
为了更好的理解上述技术方案,下面将参照附图更详细地描述本发明的示例性实施例。虽然附图中显示了本发明的示例性实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更清楚、透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
本发明的具有免疫调控活性的可注射双网络水凝胶的制备方法,制备过程如图1,具体步骤如下:
(1)将苯甲醛封端的高分子交联剂室温下溶解于PBS(pH=7.2-7.4)溶液中,作为交联剂溶液。
(2)将富含氨基的天然多糖及其衍生物在室温转速600-1000r/min的搅拌条件下溶于PBS(pH=7.2-7.4)缓冲液中,获得浓度范围为1wt%-8wt%的富含氨基的天然多糖及其衍生物溶液。
(3)将甲基丙烯酰化的蛋白质类生物高分子材料于60-70℃条件下溶解在含有0.1wt%-0.8wt%光引发剂的PBS(pH=7.2-7.4)缓冲液中,获得含有光引发剂的浓度范围为4wt%-18wt%的甲基丙烯酰化的蛋白质类生物高分子材料溶液。
(4)将所配制的富含氨基的天然多糖及其衍生物溶液和甲基丙烯酰化的蛋白质类生物高分子材料溶液按照1:1体积比混合,2000-3000rpm转速,25-37℃温度下,离心2-5min,形成混合均匀的溶液。
这种混合方式用离心取代剪切搅拌,其优势是能够让两种分子保持原有分子形态(避免被破坏)同时互相穿插为第一层反应提供条件。
(5)将亚精胺溶液加入到上述步骤(4)得到的混合溶液中,溶液中的亚精胺浓度为25-500μM,混匀作为可注射水凝胶的前体溶液。
(6)在自然环境温度下,将步骤(5)得到的可注射水凝胶的前体溶液与交联剂溶液按照一定的比例混合,满足苯甲醛封端的高分子交联剂与富含氨基的天然多糖或其衍生物溶液的摩尔比为1:5-4:1。发生席夫碱反应形成第一层交联网络,在15min内,得到具有可注射性能的单网络水凝胶,随后引入激发光(395nm或者405nm波长),照射所得可注射单网络水凝胶15-60s引发体系中甲基丙烯酰化明胶发生自由基聚合,形成第二层非可逆共价交联网络,得到具有免疫调控活性的可注射双网络水凝胶。
以下结合较佳实施例对本发明方案和效果具体说明。
实施例1
本实施例提供一种可注射双网络水凝胶的制备方法,本实施例选用羟基位取代的羧甲基壳聚糖和甲基丙烯酰化明胶作为生物基质材料,亚精胺作为生物活性功能成分,四臂苯甲醛封端的聚乙二醇作为交联剂,采取了两步交联策略制备了兼具理想力学性能和可注射性的双网络水凝胶。
本实施例的可注射双网络水凝胶的具体制备方法如下:
(1)配置水凝胶前体溶液
(a)将0.6g羟基位取代的羧甲基壳聚糖(OCMCS)加入到20mL PBS溶液中,放在磁力搅拌机上,转速900r/min,室温条件搅拌6h,直至OCMCS固体完全溶解,获得浓度为3wt%的OCMCS溶液。
(b)将0.05g光引发剂苯基(2,4,6-三甲基苯甲酰基)磷酸锂盐(LAP)加入到10mLPBS溶液中,置于水浴锅中,加温50℃至完全溶解,获得浓度为0.5wt%的LAP溶液。
(c)将1.2g甲基丙烯酰化明胶(GMA)溶于步骤(b)得到的0.5wt%LAP溶液中,置于水浴锅中,加温至65℃至完全溶解,获得含有0.5wt%LAP的浓度为12wt%的GMA溶液。
(d)将步骤(a)中所配制好OCMCS溶液与步骤(c)中配置好的GMA溶液按照体积比1:1混合,离心机2500rpm,离心2.5min,使二者完全混匀。获得1.5wt%OCMCS/6wt%GMA的水凝胶前体溶液。
(2)四臂苯甲醛封端的聚乙二醇(4mPEG-BA,分子量为10-20kDa)交联剂溶液的配制
将0.1g四臂苯甲醛封端的聚乙二醇(4mPEG-BA)溶于1mL PBS溶液中,涡旋后,室温静置直至4mPEG-BA固体完全溶解,获得浓度为10wt%的4mPEG-BA交联剂溶液。
(3)不含亚精胺(SPD)可注射单网络水凝胶的配制
将50μL 4mPEG-BA交联剂溶液,加入到1mL OCMCS/GMA水凝胶前体溶液中,涡旋20s,静置等待成胶,该体系内的OCMCS上的胺基和GMA上的部分胺基与交联剂上的醛基发生席夫碱反应,形成第一层动态可逆交联网络,水凝胶的凝胶化时间确定为试剂瓶倒置后60秒内样品不流动的时间,本实施例所用时间为5min内。此时获得的水凝胶为具有可注射和自修复性能的单网络水凝胶,记为SN。
(4)不同浓度亚精胺(SPD)溶液的配制
(a)SPD溶液的稀释:将7.58μL SPD原液加入到0.5mL PBS溶液中,充分混匀,得到浓度为100000μM的SPD溶液,记作SPD-1。
(b)将37.5μL SPD-1溶液加入到0.5mL PBS溶液中,充分混匀,得到浓度为7500μM的SPD溶液,记作SPD-2。
(c)将15μL SPD-1溶液加入到0.5mL PBS溶液中,充分混匀,得到浓度为3000μM的SPD溶液,记作SPD-3。
(d)将7.5μL SPD-1溶液加入到0.5mL PBS溶液中,充分混匀,得到浓度为1500μM的SPD溶液,记作SPD-4。
(e)将7.5μL SPD-1溶液加入到1mL PBS溶液中,充分混匀,得到浓度为750μM的SPD溶液,记作SPD-5。
(5)含亚精胺(SPD)可注射单网络水凝胶的配制
取34μL步骤(4)配制好的不同浓度的SPD溶液(即SPD-2、SPD-3、SPD-4、SPD-5)分别加入到1mL OCMCS/GMA水凝胶前体溶液中,涡旋20s充分混匀,将50μL 4mPEG-BA交联剂溶液,加入到该混匀溶液中,涡旋涡旋20s,静置等待成胶,前体溶液中SPD上的胺基、OCMCS上的胺基和GMA上的部分胺基与交联剂上的醛基发生席夫碱反应,形成第一层动态可逆交联网络,水凝胶的凝胶化时间同样确定为试剂瓶倒置后60秒内样品不流动的时间,本实施例所用时间为4min内。此时获得的水凝胶为含有SPD的可注射自愈合单网络水凝胶,水凝胶内SPD的浓度分别为250、100、50、25μM,所形成的水凝胶分别记为SN-SPD 250、SN-SPD 100、SN-SPD 50、SN-SPD 25。
(6)双网络水凝胶的制备
将步骤(3)和步骤(5)中得到的可注射单网络水凝胶,在405nm波长的固化灯下照射30s,光引发GMA发生自由基聚合反应,形成第二层化学共价静态交联网络,即得到的双网络水凝胶,分别记为DN、DN-SPD 25、DN-SPD 50、DN-SPD 100和DN-SPD 250。
实施例2
通过压缩试验对实施例1得到的可注射水凝胶进行了力学性能测试。具体实验步骤和结果分析如下:
取0.7mL实施例1中步骤(1)中配制好的前体溶液加入到1.5mL EP管中,然后加入17.5μL实施例1中步骤(2)中配制好的交联剂溶液,涡旋20s,倒入到直径为10mm,高为10mm的圆形聚四氟乙烯模具中,静置至完全成胶后取出,得到一个直径为10mm,高为8mm的圆柱状SN水凝胶。
取0.7mL实施例1中步骤(1)中配制好的前体溶液加入到1.5mL EP管中,加入24μL实施例1中步骤(4)中配制好的SPD-3溶液,涡旋20s充分混匀,加入35μL实施例1中步骤(2)中配制好的交联剂溶液,涡旋20s充分混匀,然后倒入直径为10mm,高为10mm的圆形聚四氟乙烯模具中,静置至完全成胶后取出,得到一个直径为10mm,高为8mm的圆柱状SN-SPD 100水凝胶。
取0.7mL实施例1中步骤(1)中配制好的前体溶液加入到1.5mL EP管中,然后加入35μL实施例1中步骤(2)中配制好的交联剂溶液,涡旋20s,倒入到直径为10mm,高为10mm的圆形聚四氟乙烯模具中,静置成胶后,在405nm波长的固化灯下照射30s,得到一个直径为10mm,高为8mm的圆柱状DN水凝胶。
取0.7mL实施例1中步骤(1)中配制好的前体溶液加入到1.5mL EP管中,加入24μL实施例1中步骤(4)中配制好的SPD-3溶液,涡旋20s充分混匀,加入35μL实施例1中步骤(2)中配制好的交联剂溶液,涡旋20s充分混匀,然后倒入直径为10mm,高为10mm的圆形聚四氟乙烯模具中,静置成胶后,在405nm波长的固化灯下照射30s,得到一个直径为10mm,高为8mm的圆柱状DN-SPD 100水凝胶。
用万能试验机(Instron 1121,Instron,USA)将上述得到SN、SN-SPD 100、DN和DN-SPD 100水凝胶样品,以5mm/min的压缩速度,压缩至70%的最大应变,得到每个水凝胶样品的应力-应变曲线,并用应力-应变曲线线性区域(0–10%)的斜率定义为水凝胶压缩模量。
测试结果如图2所示,SN水凝胶表现出最弱的机械性能,其压缩模量为9.95kPa,加入SPD后,水凝胶的机械性能有所提升,这归因于SPD的胺基与交联剂的醛基发生席夫碱反应,增加了水凝胶的交联密度,从而提升了其机械性能,同时也证明SPD已被成功引入该水凝胶体系内,SN-SPD 100的压缩模量为14.67kPa。引入光交联,形成第二层静态共价交联网络后,双网络水凝胶的机械性能得到了显著提升,其中DN-SPD 100水凝胶在形变70%时,能够承受超过200kPa的压缩应力并且没有发生任何破损,其压缩模量能够达到23kPa,与天然软组织机械性能相匹配。同时,DN-SPD 100水凝胶的压缩模量高于DN水凝胶,也同样印证了SPD的加入能够提升水凝胶的机械性能。该实验结果表明本发明提出的可注射双网络水凝胶能够通过两步交联策略,实现光引发原位增强的机械性能,解决了以往可注射水凝胶通常面临较弱机械性能的局限性。
实施例3
本实施例在宏观条件下对实施例1制备的DN-SPD 100水凝胶的可注射性和自修复性能进行了表征。如图3所示,将两部分不同颜色DN-SPD 100水凝胶放在一起后,在不施加任何外力的情况下,其可以形成一个完整的水凝胶。愈合后的DN-SPD 100水凝胶用镊子拉伸没有出现裂痕,表明两部分DN-SPD 100已经完全愈合形成一个整体,并能够承受一定的拉力。
DN-SPD 100水凝胶可以通过注射器连续注出绘制字母“MMB”而不会堵塞针头,注射后可以立即用镊子夹起,突出了其的优异的可注射特性以及注射后水凝胶状态和强度的快速恢复。另外,将DN-SPD 100水凝胶注入心形模具中,其能够顺应模具进行填充形成特定的形状的水凝胶,表现出良好的形状适应性,具备填充不规则伤口的能力。以上结果表明了本发明提出的可注射水凝胶具有优异的可注射性和自修复性能,能够填充不规则或深部创伤区域,具有广泛了临床应用前景。
实施例4
本实施例通过1,1-二苯基-2-苦基肼(DPPH)、羟基自由基(·OH)和过氧化氢(H
DPPH清除实验:配置100μM DPPH乙醇溶液。然后,取实施例1制备的DN、DN-SPD 25、DN-SPD 50和DN-SPD 100各150mg分别与2mL DPPH乙醇溶液混合,并在37℃的黑暗中孵育。使用纯DPPH乙醇溶液作为对照组。在不同时间间隔孵育后,通过UV-Vis分光光度计(TU-1901)在516nm的波长下测量DPPH溶液的吸光度。DPPH自由基的清除效率通过以下公式计算:
DPPH清除率(%)=(Ab-As)/Ab×100%
其中Ab表示DPPH乙醇溶液在516nm波长处的吸光度;As表示DPPH溶液在与不同水凝胶样品反应后的吸光度。
·OH清除实验:取实施例1制备的DN、DN-SPD 25、DN-SPD 50和DN-SPD 100各150mg分别与FeSO
·OH清除率(%)=(Ab-As)/Ab×100%
其中Ab表示空白对照组在650nm波长处的吸光度;As表示不同水凝胶样品组在650nm波长处的吸光度。
体外H
H
其中Ab表示PBS组在405nm波长处的吸光度;As表示水凝胶样品组孵育在405nm波长处的吸光度。
本发明所提出可注射双网络水凝胶的抗氧化实验结果如图4所示,相比于DN水凝胶,DN-SPD水凝胶以SPD浓度依赖的方式表现出优异的抗氧化性能,DN-SPD 100水凝胶的DPPH自由基清除率为78.02%(反应6小时后),·OH清除率为54.55%,H
实施例5
本实施例提供了可注射双网络水凝胶的体外免疫调控结果,具体实验步骤为:
将RAW 264.7小鼠单核巨噬细胞细胞以每孔5×10
结果如图5所示,从显微拍照图中可以看出,空白对照组RAW264.7细胞呈现圆形簇状形态,用1μg/mL LPS刺激后,RAW264.7细胞呈现出多个伪足的“煎蛋状”(M1促炎表型),40ng/mL IL-4刺激的RAW264.7细胞多呈现细长伪足的梭形状态(M2抗炎表型)。加入1μg/mLLPS刺激同时用本发明的可注射水凝胶处理后,在DN-SPD 50和DN-SPD 100组RAW264.7细胞呈现较多梭形(M2)和圆形(M0)的状态,“煎蛋状”形态(M1)的细胞显著减少,而在不含SPD的DN水凝胶组,多数细胞都是呈现“煎蛋状”形态(M1)。ELSA检测结果表明,在DN-SPD 100水凝胶组上清液中有较低浓度促炎因子浓度,其中IL-6和TNF-α的浓度分别为230.05pg/mL和431.56pg/mL,与LPS对照组相比分别降低了46.12%和52.35%;相反,在DN-SPD 100水凝胶组上清液中检测到更高浓度的抗炎因子IL-10,其浓度为310.24pg/mL,是LPS组的2.1倍,并且达到与IL-4组相当的水平。以上结果表明,本发明提供的含有SPD的可注射双网络水凝胶能够显著降低巨噬细胞向M1促炎表型极化,抑制过度炎症因子的分泌;并促进其向M2抗炎表型极化,表现出优异的抗炎和巨噬细胞免疫调控作用。本发明提供的含有SPD的可注射双网络水凝胶作为伤口敷料,具备控制伤口愈合过程中抑制过度炎症反应,调控巨噬细胞表型极化,极速愈合过程从炎症期向增殖期过渡,从而加速伤口愈合的应用潜能。
实施例6
由于过度氧化应激、过度炎症反应和免疫调控系统功能失调,糖尿病伤口往往需要更长的时间才能愈合并增加并发症的风险。鉴于本发明提供的含有SPD可注射双网络水凝胶在体外表现出的抗氧化、抗炎及对于巨噬细胞MI/M2表型极化免疫调控作用,本实施例进一步建立了II型糖尿病db/db小鼠全层皮肤缺损模型,以评估本发明提供的DN-SPD水凝胶对糖尿病慢性伤口的治疗效果。具体实验步骤如下:
将雄性db/db小鼠(35-40g,6-8周龄),腹腔注射水合氯醛麻醉,背部剃毛,并在去除毛发后用75%乙醇清洁皮肤。然后,使用直径为8mm的无菌活检冲头在剃光的小鼠背部形成两个大小相等的全厚皮肤伤口。将小鼠模型随机等效地分为3组,空白组:用PBS处理,并用固化灯照射伤口部位30s;DN组:用1mL一次性无菌注射器将实施例1制备的无菌SN水凝胶(200μL)注射到伤口部位,用固化灯照射30s,原位固化形成DN水凝胶;DN-SPD组:用1mL一次性无菌注射器将实施例1制备的无菌SN-SPD 250水凝胶(200μL)注射到伤口部位,用固化灯照射30s,原位固化形成DN-SPD 250水凝胶。在治疗过程中的不同时间点,对伤口进行拍照,并通过图像J计算伤口面积(每组n≥6)。伤口闭合率根据以下公式计算:
伤口闭合率(%)=(A0-At)/A0×100%
其中A0和At分别表示第0天和第t天的伤口面积。
实验结果如图6所示,从伤口愈合宏观观察看出,空白组伤口愈合过程缓慢,在伤口床上可以观察到感染形成的脓性渗出物。然而,与空白组相比,DN和DN-SPD水凝胶处理显示出更快的伤口愈合速度,并且DN-SPD水凝胶组在促进慢性伤口愈合方面效果最好,所需时间要短得多,几乎没有观察到脓液症状。DN-SPD水凝胶治疗组在第7天和第14天的愈合率分别为41.2%和87.9%,而空白组在第14天仅实现36.7%的闭合。经过18天的治疗,DN-SPD水凝胶组治疗的伤口几乎完全愈合,愈合率为96.8%,而空白组和DN水凝胶组可以看到未愈合伤口,空白组的愈合率仅为53.7%。结果表明,本发明提供的含有SPD可注射双网络水凝胶显著加速了糖尿病慢性创面的愈合。
实施例7
本实施例提供了本发明的可注射双网络水凝胶在3D生物打印技术上的应用。本发明将实施例1制备的SN、SN-SPD 50和SN-SPD 100可注射水凝胶分别作为3D打印生物墨水进行了挤出式3D打印尝试,挤出式3D打印机打印压力设置为25kPa,打印针头为22G规格,打印结果如图7所示,本发明进行了单层和多层打印尝试,都得到了较好的网格状打印结构,打印过程中没有出现堵塞针头的情况,证明了本发明所提供的可注射水凝胶有作为3D打印墨水应用于3D打印技术的前景。为解决3D生物打印领域目前存在的生物墨水的可打印性和生物相容性之间的不相平衡,实现同时提供各种合适的流变学、机械力学和生物学特性提供了可能。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 具有多栅结构的氮化物高电子迁移率晶体管制造方法
- 一种非极性InAlN/GaN高电子迁移率晶体管及制备方法
- 一种半导体器件结构及其制造方法、高电子迁移率晶体管
- 半导体结构、高电子迁移率晶体管及半导体结构制造方法
