一种仿生血管芯片及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于医用血管领域,具体涉及一种仿生血管芯片及其应用。
背景技术
微流控芯片技术是21世纪重要的科学技术前沿之一,为体外模拟人体代谢模型提供了重要平台。血管芯片是一种典型的微流控芯片。为了解决动物实验中存在的诸多不足,提出了血管芯片的概念。血管芯片技术除了具有小型化、集成化、低功耗等特点外,还可以精确控制多个系统参数。如化学浓度梯度、流体剪切力,以及构建细胞图形培养等,模拟人体血管的复杂结构、微环境和生理功能。目前,血管芯片技术发展迅速,各种方法层出不穷,包括流体刺激下的血管化类器官芯片、3D打印血管化微流控芯片、单层三维血管网络微流控芯片、组织与血管共培养微流控芯片等。
3D打印技术也被称为增材制造技术,是通过对原材料层层叠加的方式来加工三维复杂结构的制造方法。随着加工精度的提高和可打印材料种类的增加,3D打印也被用于器官芯片的制备。与其他制备方法相比,3D打印不需要使用任何夹具和模具,只需要设计好模型导入计算机切片软件,然后连接打印机,就可以实现芯片的结构进行打印,有生产过程简单,操作方便的优势。
目前在临床应用小口径人工血管(直径<6mm)的相关研究中发现其植入人体后通常存在着末端再狭窄、通畅率低等问题。医学影像研究发现冠脉、外周小血管内表面存在螺纹样结构会导致血液呈旋动流态。血液的这种旋动流态能够起到减少湍流、抑制有害脂质在血管壁面的沉积,促进氧气的吸收的作用,进而抑制血管疾病的发生。本发明采用PDMS微流控芯片制备仿生血管芯片,在仿生血管芯片内壁设置芯片流道,且在芯片流道中间位置设置螺纹样分布的半圆状凸起,并进一步提升仿生血管芯片的性能。
发明内容
本发明的目的在于提供一种仿生血管芯片及其应用,该仿生血管芯片采用PDMS微流控芯片制得,该PDMS微流控芯片具有良好的力学性能、生物相容性能;另外,该仿生血管芯片可以使细胞保持良好的活力。
本发明为实现上述目的所采取的技术方案为:
一种仿生血管芯片,上述仿生血管芯片中设置有芯片流道;上述芯片流道位于仿生血管芯片中间位置(平行于长度方向的中间位置);上述芯片流道中间位置设置有半圆状凸起,上述半圆状凸起呈螺纹样分布于芯片流道内;上述仿生血管芯片由改性PDMS微流控芯片制得;上述改性PDMS微流控芯片由冬凌草甲素改性PDMS微流控芯片制得。
根据本发明的实施方式,上述仿生血管芯片长58-62mm,宽18-22mm,高8-12mm。
根据本发明的实施方式,上述芯片流道为圆柱状,上述芯片流道直径为2.8-3.2mm,上述芯片流道全长14-16mm。
根据本发明的实施方式,上述半圆状的凸起半径为0.1-0.12mm,螺纹样的尺寸为螺距是2.8-3.2mm,圈数为3-3.5圈。
本发明公开了一种仿生血管芯片的制备方法,包括:
1)将墨水加入到3D打印机中,制备出具有特定图案的微流控芯片模板;
2)再利用PDMS高温固化的特性对微流控芯片模板进行倒模、脱模和封接,得到PDMS微流控芯片,再采用冬凌草甲素改性PDMS微流控芯片,制得改性PDMS微流控芯片;
3)将改性PDMS微流控芯片进行血管化培养,得到仿生血管芯片。
本发明提供了一种仿生血管芯片的制备方法,以明胶溶液作为墨水,经3D打印制得微流控芯片模板,再采用PDMS对微流控芯片模板进行倒模、脱模和封接,得到PDMS微流控芯片;然后将微流控芯片进行血管化培养,得到仿生血管芯片;该仿生血管芯片可以使细胞保持良好的活力。
具体地,上述仿生血管芯片的制备方法,包括以下步骤:
1)在35-40℃,将墨水加入到3D打印机中,设置打印参数,制备出具有特定图案的微流控芯片模板;
2)将PDMS和固化剂按照9-11:1的质量比混合搅拌均匀,干燥除去PDMS中的气泡;然后倒入到微流控芯片模板中,在30-35℃放置7-8h,在55-60℃放置4-5h;将完全固化成型的PDMS取出脱模,除去多余打印料,剪裁,打孔,依次用丙酮、异丙醇、无水乙醇对PDMS擦洗,等离子体对PDMS上有图案的一面进行4-7min的清洗处理,将两片PDMS按照微流控芯片图案进行对齐,在55-65℃封接2-2.5d后,得到PDMS微流控芯片,再采用冬凌草甲素改性PDMS微流控芯片,制得改性PDMS微流控芯片;
3)在改性PDMS微流控芯片中注入HUVECs悬浮液(浓度为1-1.5×10
根据本发明的实施方式,上述墨水包含明胶溶液,上述明胶溶液浓度为18-22wt%。
本发明还公开了一种改性PDMS微流控芯片的制备方法,包括:以Karstedt’s Pt为催化剂,采用冬凌草甲素与PDMS微流控芯片发生接枝反应,制得改性PDMS微流控芯片。
本发明公开了一种改性PDMS微流控芯片的制备方法,采用冬凌草甲素与PDMS微流控芯片发生接枝反应,制得的改性PDMS微流控芯片,具有良好的力学性能,生物相容性。原因可能是冬凌草甲素提高了PDMS微流控芯片表面的亲水性,使得其生物相容性进一步提升;另外可能由于冬凌草甲素中环状结构的存在,在PDMS微流控芯片表面形成了网状交联结构,使得改性PDMS微流控芯片在抗拉强度方面表面优异,具有良好的力学性能。
具体地,上述改性PDMS微流控芯片的制备方法,包括以下步骤:
将PDMS微流控芯片加入到加氢硅油和甲醇的混合溶液(其中,加氢硅油、甲醇的体积比为1:1.5-1.8,PDMS微流控芯片与混合溶液的质量体积比为1g:3-5mL)中,然后加入三氟甲磺酸(PDMS微流控芯片与三氟甲磺酸的质量体积比为1g:0.02-0.035mL),室温条件下搅拌25-35min,取出,采用正己烷、甲醇洗涤,干燥,然后放入冬凌草甲素的DMSO溶液(其中,冬凌草甲素与DMSO的质量体积比为1g:4-6mL;PDMS微流控芯片与冬凌草甲素的质量比为1:1-1.5)中,加入Karstedt’s Pt催化剂(PDMS微流控芯片与Karstedt’s Pt的质量体积比为1g:0.01-0.015mL),35-40℃反应10-15h,取出用丙酮、蒸馏水依次洗涤3-5次,干燥,制得改性PDMS微流控芯片。
本发明还公开了上述的改性PDMS微流控芯片在制备仿生血管芯片中的用途。
为进一步提升仿生血管芯片的性能,本发明还在PDMS微流控芯片表面增加了功能化涂层。
本发明还提供了一种PDMS微流控芯片功能化涂层的制备方法,包括:采用浸泡法将七叶皂苷快速沉积到PDMS微流控芯片表面,然后再采用同样的方法将聚赖氨酸沉积到PDMS微流控芯片表面,获得PDMS微流控芯片功能化涂层。
本发明公开了一种PDMS微流控芯片功能化涂层的制备方法,采用浸泡法将七叶皂苷、聚赖氨酸沉积到PDMS微流控芯片表面,制得的PDMS微流控芯片功能化涂层,具有良好的力学性能,生物相容性。原因可能是由于七叶皂苷是一种植物提取物,聚赖氨酸是一种天然的生物代谢产物,且两者的羟基、氨基等亲水性基团提升了PDMS微流控芯片的亲水性能,使得PDMS微流控芯片的生物相容性进一步提升;另外可能因为该功能化涂层由两种不同的高分子网络构成,双网络结构利于外力耗散,进一步增强了PDMS微流控芯片的力学性能。
具体地,上述PDMS微流控芯片功能化涂层的制备方法,包括以下步骤:
将PDMS微流控芯片放入七叶皂苷溶液(采用浓度为10-12mM的Tris水溶液配制七叶皂苷溶液,配制浓度2-2.5mg/mL)中,浸泡15-20min,取出后用氩气吹干,然后放入聚赖氨酸溶液(采用浓度为10-12mM的Tris水溶液配制聚赖氨酸溶液,配制浓度1.5-2mg/mL)中,浸泡15-20min,取出后用氩气吹干,制得PDMS微流控芯片功能化涂层。
根据本发明的实施方式,上述PDMS微流控芯片与七叶皂苷溶液的质量体积比为1g:20-30mL;PDMS微流控芯片与聚赖氨酸溶液的质量体积比为1g:20-30mL。
本发明还公开了上述PDMS微流控芯片功能化涂层在制备仿生血管芯片中的用途。
本发明的有益效果包括:
本发明获得了一种仿生血管芯片及其应用,采用明胶溶液作为墨水,3D打印出微流控芯片模板,再利用PDMS高温固化的特性对微流控芯片模板进行倒模、脱模和封接,得到PDMS微流控芯片;采用冬凌草甲素接枝改性PDMS微流控芯片,制得的改性PDMS微流控芯片具有良好的力学性能、生物相容性能;然后将微流控芯片进行血管化培养,得到仿生血管芯片;该仿生血管芯片可以使细胞保持良好的活力;另外在PDMS微流控芯片表面,采用七叶皂苷制备功能化涂层,可进一步提升PDMS微流控芯片的力学性能,生物相容性;且制得的仿生血管芯片可保持更优的细胞活力。
因此,本发明提供了一种仿生血管芯片及其应用,该仿生血管芯片采用PDMS微流控芯片制得,该PDMS微流控芯片具有良好的力学性能、生物相容性能;另外,该仿生血管芯片可以使细胞保持良好的活力。
附图说明
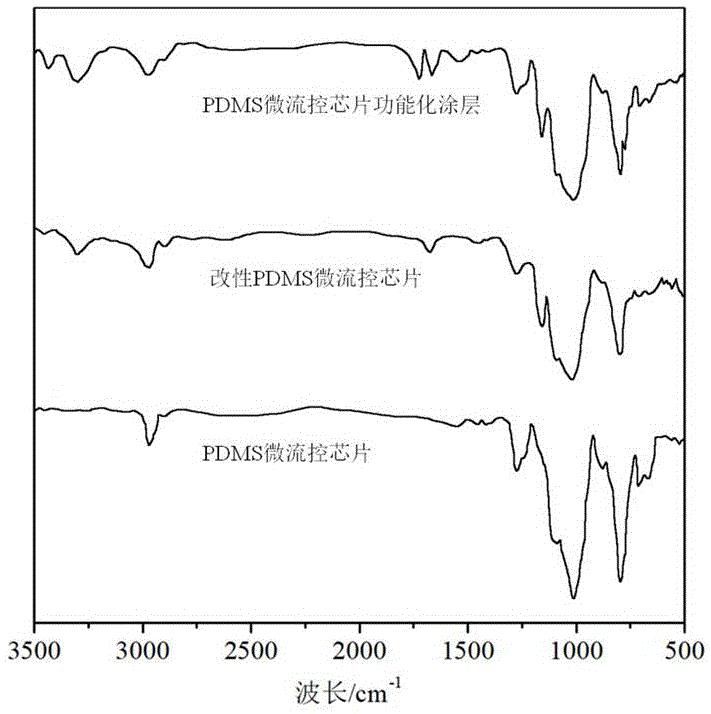
图1为实施例2制备的改性PDMS微流控芯片、实施例3制备的PDMS微流控芯片功能化涂层及PDMS微流控芯片的红外光谱图测试结果。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明确,以下结合具体实施方式对本发明的技术方案作进一步详细描述:
本发明实施例所用PDMS和固化剂购自北京瑞德佑业科技有限公司,型号DC184。
实施例1:
一种仿生血管芯片的制备方法,包括以下步骤:
1)在35℃,将浓度为20wt%的明胶溶液加入到3D打印机中,设置打印参数(仿生血管芯片长60mm,宽20mm,高10mm;芯片流道直径为3mm,芯片流道全长15mm;半圆状的凸起半径为0.1mm,螺纹样的尺寸为螺距是3mm,圈数为3圈),打印针头内径为250μm,内层通道挤出压力为0.2bar,外层通道挤出压力为0.3bar,打印速度为9mm/s,纤维丝之间间距为200μm,低温平台温度为4℃,制备出具有特定图案的微流控芯片模板;
2)将PDMS和固化剂按照10:1的质量比混合搅拌均匀,干燥除去PDMS中的气泡;然后倒入到微流控芯片模板中,在35℃放置7h,在60℃放置4h;将完全固化成型的PDMS取出脱模,除去多余打印料,剪裁,打孔,依次用丙酮、异丙醇、无水乙醇对PDMS擦洗,等离子体对PDMS上有图案的一面进行5min的清洗处理,将两片PDMS按照微流控芯片图案进行对齐,在60℃封接2d后,得到PDMS微流控芯片;
3)在微流控芯片中注入HUVECs悬浮液(浓度为1×10
实施例2:
一种仿生血管芯片的制备方法与实施例1的区别:对PDMS微流控芯片进行改性处理。
改性PDMS微流控芯片的制备方法,包括以下步骤:
将PDMS微流控芯片加入到加氢硅油和甲醇的混合溶液(其中,加氢硅油、甲醇的体积比为1:1.5,PDMS微流控芯片与混合溶液的质量体积比为1g:3mL)中,然后加入三氟甲磺酸(PDMS微流控芯片与三氟甲磺酸的质量体积比为1g:0.02mL),室温条件下搅拌25min,取出,采用正己烷、甲醇洗涤,干燥,然后放入冬凌草甲素的DMSO溶液(其中,冬凌草甲素与DMSO的质量体积比为1g:4mL;PDMS微流控芯片与冬凌草甲素的质量比为1:1)中,加入Karstedt’s Pt催化剂(PDMS微流控芯片与Karstedt’s Pt的质量体积比为1g:0.01mL),35℃反应10h,取出用丙酮、蒸馏水依次洗涤3次,干燥,制得改性PDMS微流控芯片。
实施例3:
一种仿生血管芯片的制备方法与实施例1的区别:在PDMS微流控芯片表面进行功能化涂层制备。
PDMS微流控芯片功能化涂层的制备方法,包括以下步骤:
将PDMS微流控芯片放入七叶皂苷溶液(采用浓度为10mM的Tris水溶液配制七叶皂苷溶液,配制浓度2mg/mL)中,浸泡15min,取出后用氩气吹干,然后放入聚赖氨酸溶液(采用浓度为10mM的Tris水溶液配制聚赖氨酸溶液,配制浓度1.5mg/mL)中,浸泡15min,取出后用氩气吹干,制得PDMS微流控芯片功能化涂层;其中,PDMS微流控芯片与七叶皂苷溶液的质量体积比为1g:30mL;PDMS微流控芯片与聚赖氨酸溶液的质量体积比为1g:30mL。
实施例4:
一种仿生血管芯片的制备方法与实施例3的区别:采用改性PDMS微流控芯片替代PDMS微流控芯片,制得改性PDMS微流控芯片功能化涂层。
改性PDMS微流控芯片的制备方法与实施例2相同。
试验例1:
红外光谱测试
采用红外光谱仪对样品进行测定,扫描波数为500-4000cm
对实施例2制备的改性PDMS微流控芯片、实施例3制备的PDMS微流控芯片功能化涂层及PDMS微流控芯片进行上述测试,结果如图1所示。由图1可知,与PDMS微流控芯片的红外光谱图相比,改性PDMS微流控芯片的红外光谱图在3302cm
试验例2:
生物相容性测试
取5mL抗凝兔全血,以3000rpm的转速离心15min,去掉上层清液,加入PBS缓冲液清洗3次后,得下层液,取1mL下层液,加入34mL的PBS缓冲液,混合均匀即可得到红细胞悬液。取1mL红细胞悬液,加入4mL的PBS缓冲液,混合均匀后,取0.2g样品置于混合溶液中;阴性对照组设置:取1mL红细胞悬液,加入4mL的PBS缓冲液,混合均匀;阳性对照组设置:取1mL红细胞悬液,加入4mL的去离子水,混合均匀;然后放置在37℃的细胞培养箱中孵育1h,孵育完成后在3000rpm的离心速度下离心10min。离心结束后,吸取100μL上清液于96孔板中,通过多功能酶标仪检测上清液的吸光度(波长设定为540nm);溶血率N/%计算公式如下:
N/%=[(A1-A0)/(A2-A0)]×100%
其中,A0为阴性对照组吸光度;A1为样品组吸光度;A2为阳性对照组吸光度。
表1 生物相容性测试结果
对实施例1制备的PDMS微流控芯片、实施例2制备的改性PDMS微流控芯片、实施例3制备的PDMS微流控芯片功能化涂层、实施例4制备的改性PDMS微流控芯片功能化涂层进行上述测试,结果如表1所示,由表1可知,实施例2与实施例1相比,溶血率有所下降,说明采用冬凌草甲素制备的改性PDMS微流控芯片相比于PDMS微流控芯片具有良好的生物相容性;实施例4与实施例3相比,溶血率也有所下降,说明采用冬凌草甲素制备的改性PDMS微流控芯片功能化涂层相比于PDMS微流控芯片功能化涂层也具有良好的生物相容性;实施例3与实施例1相比,溶血率明显降低,说明采用七叶皂苷、聚赖氨酸制备的PDMS微流控芯片功能化涂层相比于PDMS微流控芯片具有更优的生物相容性;实施例4与实施例2相比,溶血率也明显降低,说明采用七叶皂苷、聚赖氨酸制备的改性PDMS微流控芯片功能化涂层相比于改性PDMS微流控芯片也具有更优的生物相容性。
试验例3:
力学性能测试
采用万能材料试验机进行测试,为方便测试,将样品制备成3cm×1.5cm×1.3mm大小,测试条件为25℃,湿度50%,拉伸速率10mm/min。
表2 力学性能测试结果
对实施例1制备的PDMS微流控芯片、实施例2制备的改性PDMS微流控芯片、实施例3制备的PDMS微流控芯片功能化涂层、实施例4制备的改性PDMS微流控芯片功能化涂层进行上述测试,结果如表2所示,由表2可知,实施例2与实施例1相比,断裂强度明显提升,说明采用冬凌草甲素制备的改性PDMS微流控芯片相比于PDMS微流控芯片具有良好的力学性能;实施例4与实施例3相比,断裂强度也明显提升,说明采用冬凌草甲素制备的改性PDMS微流控芯片功能化涂层相比于PDMS微流控芯片功能化涂层也具有良好的力学性能;实施例3与实施例1相比,断裂强度明显增强,说明采用七叶皂苷、聚赖氨酸制备的PDMS微流控芯片功能化涂层相比于PDMS微流控芯片具有更优的力学性能;实施例4与实施例2相比,断裂强度也明显增强,说明采用七叶皂苷、聚赖氨酸制备的改性PDMS微流控芯片功能化涂层相比于改性PDMS微流控芯片也具有更优的力学性能。
试验例4:
细胞活力测试
将微流控芯片样品浸入22.5mol/L葡萄糖的标准培养基,并以空白标准培养基作为对照组,平衡过夜后,嵌入48孔板,接种1×10
表3 细胞活力测试结果
对实施例1制备的PDMS微流控芯片、实施例2制备的改性PDMS微流控芯片、实施例3制备的PDMS微流控芯片功能化涂层、实施例4制备的改性PDMS微流控芯片功能化涂层进行上述测试,结果如表3所示,由表3可知,实施例2与实施例1相比,细胞存活率明显提升,说明采用冬凌草甲素制备的改性PDMS微流控芯片相比于PDMS微流控芯片具有良好的细胞活力;实施例4与实施例3相比,细胞存活率也明显提升,说明采用冬凌草甲素制备的改性PDMS微流控芯片功能化涂层相比于PDMS微流控芯片功能化涂层也具有良好的细胞活力;实施例3与实施例1相比,细胞存活率明显增强,说明采用七叶皂苷、聚赖氨酸制备的PDMS微流控芯片功能化涂层相比于PDMS微流控芯片具有更优的细胞活力;实施例4与实施例2相比,细胞存活率也明显增强,说明采用七叶皂苷、聚赖氨酸制备的改性PDMS微流控芯片功能化涂层相比于改性PDMS微流控芯片也具有更优的细胞活力。
上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 一种反应堆退役三维辐射场仿真方法及系统
- 一种大规模滑坡地质灾害快速数值仿真模拟方法及系统
- 一种核反应堆退役方案的数值仿真方法和系统
- 霍尔推力器的全流程数值仿真系统及使用该系统的全流程数值仿真方法
