急性肾损伤特异性生物标志物、急性肾损伤的诊断方法、急性肾损伤的检查用试剂盒、动物治疗方法以及急性肾损伤用医药
文献发布时间:2023-06-19 10:55:46
技术领域
本发明涉及生物标志物、诊断方法、检查用试剂盒、动物治疗方法以及医药,特别涉及急性肾损伤特异性生物标志物、急性肾损伤的诊断方法、急性肾损伤的检查用试剂盒、动物治疗方法以及急性肾损伤用医药。
背景技术
急性肾损伤(Acute kidney injury,AKI)是在感染、药物摄入、外科手术后等产生的急性的肾功能损伤,与患者的生命预后密切相关。
急性肾损伤(AKI)是肾功能在数小时至数天这样的短时间内急剧下降的病状。无法通过尿排泄体内废物,或者溢水。有可能需要透析。
以往,由KDIGO(Kidney Disease:Improving Global Outcomes,改善全球肾脏疾病预后组织)提供了有关急性肾损伤的诊断指南。在该KDIGO分类中,急性肾衰竭基于血清肌酐浓度上升和尿量减少而被诊断。
具体而言,(在用于急性肾损伤的KDIGO诊疗指南中,AKI的病期(阶段)分类由以下任一项定义:
1.血清肌酐值在48小时以内上升0.3mg/dl以上的情况,
2.血清肌酐值比之前7天以内已知或预期的基础值增加1.5倍以上的情况,
3.尿量在6小时内减少至0.5ml/kg/小时的情况。
然而,以该基准,则大多已经错过了治疗干预的时机。因此,期望开发急性肾损伤用的生物标志物。
然而,近年来,报道了miRNA(microRNA、微RNA(micro Ribonucleic Acid,微小核糖核酸))参与多种病状,作为疾病早期诊断的生物标志物是有效的。
参照专利文献1,作为以往的生物标志物的一个例子,记载了表示慢性糖尿病状态的指标的miRNA。
现有技术文献
专利文献
专利文献1:日本特表2013-514277号公报。
发明内容
发明要解决的问题
然而,专利文献1的生物标志物不是能够诊断急性肾损伤的生物标志物。
本发明是鉴于这样的状况而完成的,其课题在于解决上述问题。
解决问题的方案
本发明的急性肾损伤特异性生物标志物的特征在于,该急性肾损伤特异性生物标志物为miRNA-5100。
本发明的急性肾损伤的诊断方法的特征在于,使用上述急性肾损伤特异性生物标志物。
本发明的急性肾损伤的诊断方法的特征在于,在上述miRNA-5100的表达降低的情况下,诊断为急性肾损伤。
本发明的检查用试剂盒的特征在于,包含测定miRNA-5100的试剂。
本发明的动物治疗方法的特征在于,为人以外的动物的治疗方法,其中,对miRNA-5100的功能活性进行调整。
本发明的急性肾损伤用医药的特征在于,包含miRNA-5100的功能活性调整剂。
本发明的急性肾损伤用医药的特征在于,上述功能活性调整剂包含上述miRNA-5100的功能活性增强剂。
本发明的急性肾损伤用医药的特征在于,上述功能活性增强剂是与上述miRNA-5100对应的miRNA模拟物。
发明效果
根据本发明,通过使用miRNA-5100,可以提供能够特异性地诊断急性肾损伤的生物标志物。
附图说明
图1是本发明的实施例1的急性肾损伤模型小鼠的施术的示意图。
图2A是表示本发明实施例1的微阵列分析(缺血再灌注模型)的结果的照片。
图2B是表示本发明实施例1的微阵列分析(LPS(Lipopolysaccharides,脂多糖)给药模型)的结果的照片。
图3是表示本发明实施例1的miRNA-5100的表达量的变化的图表。
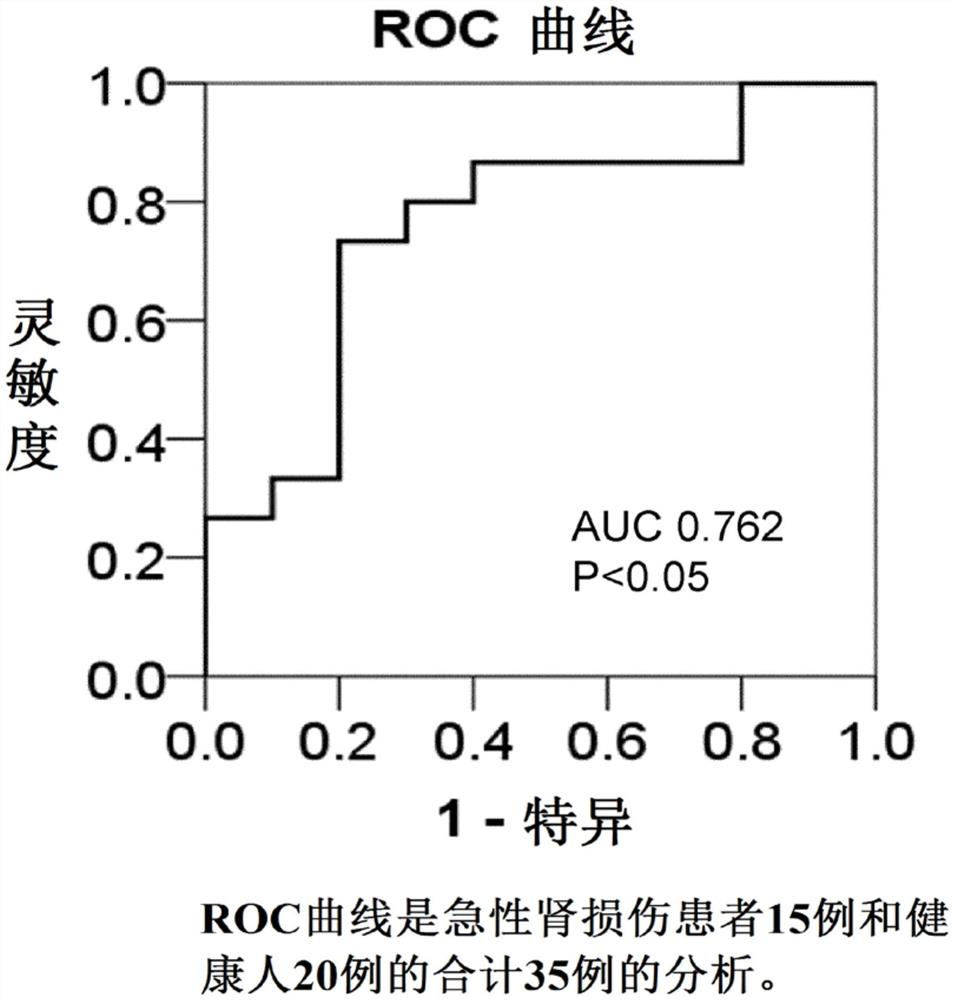
图4是表示本发明实施例1的miRNA-5100的ROC(receiver operatingcharacteristic,受试者操作特性)曲线的图表。
图5是对本发明实施例1的急性肾损伤小鼠中的miRNA-5100的过表达进行说明的示意图。
图6是表示本发明实施例1的miRNA-5100的过表达时的实际表达量的图表。
图7是表示本发明实施例1的miRNA-5100的过表达时的肾肿大的图表。
图8A是表示本发明实施例1的miRNA-5100的过表达时的急性肾损伤的治疗效果(NGAL,Neutrophil Gelatinase-Associated Lipocalin,中性粒细胞明胶酶相关脂质运载蛋白)的图表。
图8B是表示本发明实施例1的miRNA-5100的过表达时的急性肾损伤的治疗效果(KIM-1,Kidney Injury Molecule-1,肾损伤分子-1)的图表。
图8C是表示本发明实施例1的miRNA-5100的过表达时的急性肾损伤的治疗效果(L-FABP,Liver-type Fatty Acid-Binding Protein,肝型脂肪酸结合蛋白)的图表。
图8D是表示本发明实施例1的miRNA-5100的过表达时的急性肾损伤的治疗效果(IL-18,Interleukin-18,白细胞介素-18)的图表。
图9是表示本发明实施例2的miRNA-5100的过表达时的内质网应激反应基因的表达变化的图表。
图10是表示本发明实施例2的miRNA-5100的过表达时的内质网应激反应基因的表达变化的图表。
图11是表示本发明实施例2的miRNA对急性肾损伤的进展抑制的推断机制的示意图。
具体实施方式
<实施方式>
以往的急性肾损伤的生物标志物候选在临床上是否真正有效尚不明确,急性肾损伤的特异性治疗法完全未实用化。
因此,本发明人等着眼于已知参与多种病状的miRNA。知道miRNA在包括人在内的哺乳类中有2000种左右,其碱基序列注册在公共数据库(miRBase等)中。
然而,作为急性肾损伤的生物标志物有用的miRNA是未知的。
因此,本发明人等反复进行深入实验,探索了能够成为对急性肾损伤的特异性的生物标志物的miRNA。
具体而言,如后述的实施例1中详细说明那样,本发明人等通过微阵列法和作为实时PCR(polymerase chain reaction,聚合酶链反应)的一种的qRT-PCR(Quantitativereal-time reverse transcription polymerase chain reaction,实时荧光定量PCR)法对两种急性肾损伤模型小鼠的肾脏和血液中发生变化的miRNA进行了全面分析、鉴定。进而,针对人的血清样本,利用qRT-PCR在健康人和急性肾损伤患者中对鉴定出的miRNA表达变化进行比较研究,鉴定了在急性肾损伤患者的血清中特异性地变化的miRNA,能够作为诊断方法使用。
进而,在急性肾损伤模型小鼠中确认了通过使该miRNA过表达,能够得到作为医药使用时的效果,从而完成了本发明。
〔生物标志物〕
更详细地说明,本发明的实施方式的急性肾损伤特异性生物标志物的特征在于,其为急性肾损伤患者的miRNA。
miRNA是不翻译成蛋白质的RNA,是功能性的非编码RNA中的一种。miRNA在真核生物的基因组上被编码,经过多阶段的生成过程,最终成为20~25个碱基左右的单链RNA,参与基因的转录后表达调控。miRNA通过转录后表达调控,从而在发育、增殖、分化、细胞凋亡、代谢之类的广泛的生物学过程中起重要作用。
具体而言,本发明的实施方式的急性肾损伤特异性生物标志物的特征在于,其为miRNA-5100。
其中,小鼠的成熟型miRNA-5100(miRbase编号:MI0018008)的序列如下所示:
5’-ucgaaucccagcggugccucu-3’(序列号1)
人的成熟型miRNA-5100(miRbase编号:MI0019116)的序列如下所示:
5’-uucagaucccagcggugccucu-3’(序列号2)
作为本实施方式的miRNA-5100,在小鼠和人以外的真核生物,具体而言各种动物中,可以使用具有同源性的miRNA。对于该动物,没有特别限定,例如包括家畜动物种类、野生动物等。各miRNA在哺乳类中为大致相同的碱基序列,因此可以基于同源性进行检索并使用。作为该同源性,优选为80%以上,进一步优选为90%以上。进而,也可以包含与这些序列互补的序列,或者以能够杂交的程度相同的序列。
此外,本实施方式的各miRNA和后述的功能活性调整剂也可以以pri-miRNA(primary miRNA,初始转录产物)或pre-miRNA(precursor miRNA,前体)的形式提供。在该情况下,本实施方式的miRNA可以不是单链,也可以通过茎和环结构等形成双链部分。
此外,本实施方式的各miRNA可以是编码miRNA、pri-miRNA、pre-miRNA等的RNA、DNA等核酸分子。另外,该核酸分子还包括人工核酸分子,例如肽核酸(Peptide NucleicAcid,PNA)、锁核酸(Locked Nucleic Acid,LNA)等。
对于本实施方式的各miRNA和功能活性调整剂的制造,可以通过对于本领域技术人员而言通常的化学合成法或重组方法等制造。在该重组方法中,可以使如上所述那样的成熟(mature)型的miRNA、pri-miRNA和pre-miRNA中的任一种或编码它们的DNA的碱基序列包含在适当的载体中。该载体例如是在真核生物中适于核酸的表达的表达载体。该载体中包含的核酸分子可以靶向各miRNA分子的转录、成熟为miRNA之前的前体或初级转录产物。进而,还可以包含改变各miRNA的基因组上的拷贝等那样的序列、转录制备序列等。
〔诊断方法〕
本发明的实施方式的急性肾损伤的诊断方法的特征在于,使用上述急性肾损伤特异性生物标志物。
在本发明的实施方式的急性肾损伤的诊断方法中,主要是通过检测患者的血清中或血浆(以下,简称为“血液”)中存在的miRNA水平来诊断急性肾损伤。即,本实施方式的急性肾损伤的诊断方法也可以用作急性肾损伤的检查方法。
具体而言,在本实施方式中,在miRNA-5100的表达降低的情况下,可以诊断为急性肾损伤。
关于该miRNA-5100的表达量的降低,例如测定在患者的血液中存在的表达量,针对得到的数值检验是否存在统计学上的显著性差异。
进而,通过将miRNA-5100的表达的降低和其他诊断相结合,可以诊断为急性肾损伤。该其他诊断也可以是例如KDIGO中公开的急性肾损伤的早期生物标志物候选分子。作为该分子,例如也可以包括NGAL(Neutrophil Gelatinase-Associated Lipocalin:中性粒细胞明胶酶相关脂质运载蛋白)、KIM-1(Kidney Injury Molecule-1:肾损伤分子-1)、作为脂肪酸结合蛋白的L-FABP(Liver-type Fatty Acid-Binding Protein:肝型脂肪酸结合蛋白)。
作为miRNA-5100的血液中的表达量的测定,例如,从人等患者采血,将其上清离心,从除去了血细胞后的血清或血浆中提取总RNA。作为总RNA的提取方法,例如可以使用胍-氯化铯超速离心法、AGPC(Acid Guanidinium-Phenol-Chloroform:酸-异硫氰酸胍-苯酚-氯仿)法、对于本领域技术人员而言通常的RNA提取用柱等。在此基础上,从提取到的总RNA中测定本实施方式的各miRNA的表达量。该测定例如可以通过使用北方印迹(Northernblot,Northern印迹)、微阵列、QCM(Quartz Crystal Microbalance:石英晶体微天平)传感器测定法、包括qRT-PCR的实时PCR法等对于本领域技术人员而言通常的方法实现。在使用实时PCR法的情况下,可以进行使用内源性对照(endogenous control)miRNA的表达修正。关于此时的内源性对照,本领域技术人员优选从以前报道为适合作为内源性对照的序列中适当地选择在健康和疾病中不发生变化的序列。
然后,在根据测定出的表达量来检验统计上的显著性差异的情况下,与由来自于健康者的样本得到的miRNA的表达量进行比较,例如统计检验是否为5%显著性(p<0.05)。该检验例如可以与数据量、数据的性质等对应地适当使用T检验、F检验、卡方检验等方法。
如果检验的结果是统计学上显著的,则该患者可以被诊断为是急性肾损伤。相反,如果不是统计学上显著的,则该患者可以被诊断为不是急性肾损伤。在该情况下,也可能根据其他指标等诊断为是并非急性肾损伤的其它肾病的患者。
通过这样的诊断方法,即使在发病初期的阶段,也能够以高可靠性对是急性肾损伤进行判定。由此,能够对治疗方针的确定提供重要信息。
对本发明的实施方式的诊断方法进行总结,本实施方式的诊断方法是急性肾损伤的诊断方法,其特征在于,包括如下工序:从疑似急性肾损伤的患者采集血液的工序;对所采集的血液测定miRNA-5100的表达量的工序;将所测定的miRNA-5100的表达量与健康者的miRNA-5100的表达量(标准量)进行比较的工序;检测miRNA-5100的表达量低于标准量这一情况的工序;以及将检测到的患者确定为是急性肾损伤的风险高的工序。
〔检查用试剂盒〕
本发明的实施方式的急性肾损伤的检查用试剂盒的特征在于,包含测定作为上述急性肾损伤特异性生物标志物的miRNA的试剂。
作为这样的miRNA测定用的试剂,例如包括对应于Northern印迹、微阵列、QCM传感器测定法、实时PCR法等检测用的方式的试剂。即,还包括本实施方式的各miRNA检测用的探针、引物等、各种酶类、缓冲液、清洗液、溶解液等。除此以外,还可以包括用于通过上述方式检测miRNA的资材、器材等。
进而,为了分析诊断结果,本实施方式的急性肾损伤的检查用试剂盒也可以包括用于在计算机上判断检查结果、进行数据处理、进行可视化的程序、具备该计算机的装置和系统等。这样的装置和系统等可以使用对于本领域技术人员而言通常的技术、方式等来开发。通过这样的装置和系统等,能够进行高吞吐量的检查,患者的诊断变得容易。
〔急性肾损伤用医药〕
本实施方式的急性肾损伤用医药(医疗用组合物)的特征在于,其包含使miRNA的表达量增加或降低的组合物。
具体而言,本实施方式的医疗用组合物的特征在于,其包含miRNA-5100的功能活性调整剂。该功能活性调整剂是具有调节miRNA的表达的作用的组合物。
在本实施方式中,针对miRNA-5100的功能活性调整剂使用功能活性增强剂。该功能活性增强剂包含与miRNA-5100对应的碱基序列的miRNA模拟物。该miRNA模拟物也可以是包含合成的miRNA的组合物。即,通过利用miRNA模拟物使急性肾损伤的肾脏内的miRNA的浓度增加(过表达),从而使针对miRNA-5100的、细胞的功能的活性增强。
对于本实施方式的与miRNA-5100对应的miRNA模拟物,在小鼠的情况下,可以使用以下的序列的模拟物:
5’-UCGAAUCCCAGCGGUGCCUCU-3’(序列号3)
对于与人的miRNA-5100对应的miRNA模拟物,也可以使用与人的miRNA-5100对应的相同的模拟物。
在该情况下,作为给药量,例如可以使用在肾脏的细胞内成为对健康人给药miRNA-5100时的表达量的1.5~2.5倍的那样的量的miRNA-5100模拟物等。其中,特别优选成为2.0倍左右的那样的量。
此外,本实施方式的急性肾损伤用医药以在体外(in vitro)或体内(in vivo)导入到所期望的靶细胞中的对于本领域技术人员而言通常的方式,导入到患者的细胞中。因此,可以包含对于本领域技术人员而言通常的各种介质来提供本实施方式的医疗用组合物。
作为该介质,例如也可以使用质粒、病毒载体。该病毒载体可以使用腺病毒、腺相关病毒、逆转录病毒等对于本领域技术人员而言通常的病毒构成。
另外,本发明的实施方式的急性肾损伤用医药也可以包含任意的制剂上可允许的载体。该载体例如可以为脂质体载体、胶体金颗粒、多肽、脂多糖类、多糖类、脂质膜等。优选使用其中使功能活性调整剂的表达调整效果提高的载体。例如,对于miRNA抑制剂、miRNA模拟物,优选使用脂质体,特别是阳离子性脂质体。
进而,作为制药上允许的载体,也可以包含例如生理盐水、含有葡萄糖或其他辅助药的等渗液,例如D-山梨糖醇、D-甘露糖、D-甘露醇、氯化钠等。进而,可以与合适的增溶剂一起给药,例如醇,具体而言乙醇、多元醇,例如丙二醇、聚乙二醇、非离子性表面活性剂,例如聚山梨醇酯80(TM)、HCO-50等。另外,可以进一步包含适当的赋形剂等。
另外,为了制备制剂上可允许的载体,本实施方式的急性肾损伤用医药也可以包含适当的药学上可允许的载体。该载体可以包含硅酮、胶原、明胶等生物相容性材料。另外,载体也可以作为乳浊液提供。此外,还可以含有例如稀释剂、香料、防腐剂、赋形剂、崩解剂、润滑剂、粘合剂、乳化剂、增塑剂等制剂用添加物中的任一种或任意的组合。
对于本发明的医药组合物的给药途径,没有特别限定,可以以非口服或口服的方式进行给药。作为非口服给药,例如可以进行静脉内、动脉内、皮下、真皮内、肌肉内、腹腔内的给药、或对肾脏等的直接给药。
本发明的实施方式的急性肾损伤用医药可以在适于非口服或口服给药的给药方式中使用该领域中公知的制剂上可允许的载体开处方。
在将本发明的实施方式的急性肾损伤用医药用于上述治疗时,对于给药间隔和给药量,可以根据疾病的状况、以及对象的状态等各种条件适当选择和变更。
对于本发明的实施方式的急性肾损伤用医药的1次给药量和给药次数,可以根据给药的目的,进一步根据患者的年龄和体重、症状和疾病的严重程度等各种条件适当选择和变更。
给药次数和期间可以仅为1次,也可以为1天给药1次~数次、数周左右,监测疾病的状态,根据该状态再次或反复进行给药。
此外,本发明的组合物也可以与其他组合物等并用。另外,可以将本发明的组合物与其他组合物同时给药,另外也可以隔开间隔地给药,但其给药顺序没有特别限制。
另外,在本发明的实施方式中,对于疾病被改善或减轻的期间,没有特别限定,可以是暂时的改善或减轻,也可以是一定期间的改善或减轻。
〔治疗法〕
本发明的实施方式的动物治疗方法是动物的治疗方法,其特征在于,其中,对miRNA-5100的功能活性进行调整。
具体而言,本发明的实施方式的急性肾损伤用医药也能够用于进行动物的治疗的动物治疗。对于该动物,没有特别限定,广泛地包括脊椎动物和无脊椎动物。作为脊椎动物,包括鱼类、两栖类、爬虫类、鸟类和哺乳类。具体而言,例如,哺乳类例如可以包括小鼠、大鼠、雪貂、仓鼠、豚鼠或兔等啮齿类、狗、猫、绵羊、猪、牛、马或非人类的转基因灵长类等以及人。另外,作为野生动物,除了哺乳类以外,还包括鱼类、包括家禽在内的鸟类、爬虫类等。另外,也广泛地包含包括虾、昆虫等在内的甲壳类、其他乌贼等无脊椎动物等。
即,本发明的实施方式的急性肾损伤用医药除了可以用于人的治疗以外,还可以用于各种动物的治疗、家畜的成长促进等方法中。因此,本实施方式的患者也包括人和上述的人以外的动物。
对本发明的实施方式的治疗方法进行总结,本实施方式的治疗方法是急性肾损伤的治疗方法,其特征在于,包括如下工序:从疑似急性肾损伤的患者采集血液的工序;对所采集的血液测定miRNA-5100的表达量的工序;将所测定的miRNA-5100的表达量与健康者的miRNA-5100的表达量(标准量)进行比较的工序;检测miRNA-5100的表达量低于标准量这一情况的工序;以及对检测到的患者进行急性肾损伤的治疗的工序。
并且,该急性肾损伤的治疗的特征在于,其中包括对miRNA-5100的功能活性进行调整的治疗。此外,该对miRNA-5100的功能活性进行调整的治疗的特征在于,其中包括给药上述急性肾损伤用医药。
具体而言,在本实施方式中,不依赖于病状(病因)、病期等,作为对急性肾损伤特异性的治疗,通过调整miRNA-5100的功能活性,能够进行急性肾损伤的治疗。特别地,通过给药上述急性肾损伤用医药等而使miRNA-5100过表达的补充疗法等,能够治疗急性肾衰竭。此时,例如可以通过上述脂质体那样的DDS(DrugDeliverySystem,药物递送系统)等来给药miRNA-5100模拟物。
进而,通过组合如下所示的由本领域技术人员执行的典型的治疗法,能够更有效地治疗急性肾损伤。
在此,急性肾损伤根据病状被分类为肾前性、肾性、肾后性的病因。
其中,肾前性的急性肾损伤是流向肾脏的血流降低的情况,因脱水、血压降低等而产生。另外,肾性的急性肾损伤在肾脏本身存在损伤的情况下产生。该肾性的急性肾损伤按照原发病进一步细分为胆固醇栓塞症、肾梗塞等引起的血管性的急性肾损伤、急性肾小球肾炎、狼疮肾炎、ANCA(anti-neutrophil cytoplasmic antibodies,抗中性粒细胞胞浆抗体)相关血管炎等引起的肾小球性的急性肾损伤、以及急性间质性肾炎、急性肾小管坏死、药剂等引起的肾小管、间质性的急性肾损伤。另一方面,肾后性的急性肾损伤是由于尿路的狭窄或闭塞而产生的。这由于双侧肾积水等而产生。
在典型的不同病状(病因)的急性肾损伤的治疗中,对于肾前性的急性肾损伤进行补液,对于肾性的急性肾损伤进行原疾病的治疗,对于肾后性的急性肾损伤进行尿路狭窄、闭塞的解除等治疗。
此外,根据用于急性肾损伤的KDIGO诊疗指南,典型的急性肾损伤的按病情阶段的治疗是在“高风险”状态下进行以下疗法:尽可能中止肾毒性物质,确保体液量和回流压力,考虑功能性血液动力学监测,监测血清肌酸值和尿量,预防高血糖,考虑不使用造影剂的替代方案等。在此基础上,在等级1,除了这些以外,还进行非侵入式精密检查,也考虑侵入式精密检查。在等级2,除了这些以外,还进行根据肾功能调整药剂给药量、考虑肾脏置换疗法、考虑进入ICU之类的疗法。在等级3,进一步,如果可能的话,避免锁骨下导管。
此外,本发明的实施方式的急性肾损伤用医药也可以将动物的体内的一部分,或从动物摘出或排出的脏器、组织等作为治疗用的对象。进而,该治疗为广义的治疗,也可以应用于生物反应器、模型动物中的培养、人体移植样的培养脏器的培养等。
通过以上那样地构成,能够得到如下的效果。
急性肾损伤在KDIGO分类中基于血清肌酐值上升和尿量减少等进行诊断。但是,在该基准下,治疗干预的时机已经错失的情况也不少。此外,还不明确是否能够使用KDIGO诊断基准来预测肾预后。
因此,近年来,还报道了尿中NGAL、L-FABP等急性肾损伤的早期生物标志物候选分子。
具体而言,作为以往的急性肾损伤的早期生物标志物候选分子的NGAL用于进行尿中的中性粒细胞明胶酶相关脂质运载蛋白的测定,可以用作急性肾损伤(AKI)的诊断辅助。NGAL的ROC曲线下面积为0.50-0.98,75%(12/16)的研究中为0.70以上,为中等以上的诊断精度(参照AKI诊疗指南2016)。
另一方面,L-FABP是定位于人近端肾小管的细胞质中的14kd的蛋白质,并且由于肾小管的缺血、氧化应激而被排泄到尿中,因此用于肾小管功能损伤的早期诊断。L-FABP的ROC曲线下面积为0.70-0.95,在所有的研究中为0.70以上,为中等以上的诊断精度(参照AKI诊疗指南2016)。
然而,这些生物标志物候选在临床上是否真正有效尚不明确。这是因为存在多种测定方法,未进行标准化,测定的时机未确定。此外,在L-FABP中,临界值也未确定。即,不知道利用这些以往的生物标志物的诊断是否真正有用。
另外,对于专利文献1中记载的miRNA,原本并不是急性肾损伤特异性的miRNA的分析。
相对于此,本发明的实施方式的急性肾损伤特异性生物标志物是存在于血液中的miRNA,通过使用miRNA-5100,能够用于急性肾损伤的诊断。
即,利用本实施方式的生物标志物,能够早期准确地诊断作为预后差的肾脏疾病的急性肾损伤,并且能够期待治疗效果。
此外,本发明的实施方式的急性肾损伤的诊断方法能够早期、有创地诊断肾病中的急性肾损伤。
此外,如下述实施例2所示,与以往的NGAL和L-FABP相比,本实施方式的生物标志物能够在更早的阶段(阶段1)诊断急性肾损伤。
此外,对于以往的急性肾损伤的早期生物标志物候选分子即NGAL和L-FABP,由于测定时的试样为尿,所以有时无法对没有尿的患者进行测定。
相对于此,本实施方式的生物标志物能够以血液(血清)作为试样进行测定,因此即使是没有尿的患者也能够可靠地进行测定。
另一方面,急性肾损伤的特异性治疗法完全没有实用化。即,在急性肾损伤的治疗中不存在特异性的治疗药。
具体而言,在以往的急性肾损伤的指南中,作为药剂、透析疗法,采用了低用量心房利钠肽的给药、袢利尿药的给药、低用量多巴胺的给药、血液净化疗法。然而,在急性肾损伤的预防和治疗中,给药低用量心房利钠肽的证据不充分。进而,不推荐以预防急性肾损伤为目的而给药袢利尿药,并且,提出了除了以校正体液过剩为目的的使用以外,不给药袢利尿药作为急性肾损伤的治疗。另外,在急性肾损伤的预防和治疗中不推荐低用量多巴胺的给药。此外,对于急性肾损伤,早期开始血液净化疗法改善预后的证据不足,广泛考虑临床症状、病状来确定开始的时期。
这样,对于急性肾损伤,并没有已经确立的治疗药、治疗法,仅限于输液、避免致病药物等对症疗法。
相对于此,通过使用miRNA-5100的功能活性调整剂,能够提供新型的急性肾损伤用医药,与上述诊断配合能够进行早期治疗。
特别是,通过用DDS等给药miRNA-5100模拟物等而使miRNA-5100过表达的补充疗法等,能够抑制输尿管细胞等的细胞凋亡,预防、抑制由急性肾损伤的发病、进展导致的肾功能降低。
具体而言,能够抑制肾脏的肾小管的坏死和肾小管腔内蛋白性圆柱的充满等。进而,通过在急性肾损伤的发生时、预测发生时预防性地给药,能够期待抑制急性肾损伤的发病、进展。
此外,在上述实施方式中,作为急性肾损伤的检查方法,记载了从血液中获得miRNA的例子。
然而,miRNA除了血液以外,例如在尿中也稳定地存在。因此,也可以构成为,根据从血液以外的组织、体液、尿等中获得的miRNA的量来检测为是急性肾损伤。
进而,本实施方式的诊断方法也能够作为为了早期诊断而进行初步诊断的诊断方法使用。即,对于急性肾损伤,如上所述,以往的诊断有时也为时已晚。因此,通过对急性肾损伤早期进行诊断,能够进行准确的早期治疗,能够提高治疗效果。
此外,作为成为急性肾损伤用医药的、miRNA-5100的功能活性调整剂,也可以使用miRNA模拟物以外的物质。
进而,也可以将介由miRNA-5100对成为表达调整对象的基因、基因产物、激动剂/拮抗剂和其他途径的作用的组合物,作为功能活性调整剂使用。
进而,就作为急性肾损伤用医药的miRNA-5100的功能活性调整剂而言,也可以使用其他miRNA的转录调节因子,或者进行利用各种载体的表达调节、利用CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR Associated,常间回文重复序列丛集关联蛋白)等的基因治疗等。
此外,也可以介由miRNA-5100对于作为表达调整的对象的基因、途径的作用来进行基因治疗。
另外,本发明的实施方式的医药也可以与其他组合物等并用。也可以将本发明的组合物与其他组合物同时给药、喷撒、涂布等。
此外,也可以将miRNA-5100的功能活性调整剂用于医药以外的用途。进而,作为该功能活性调整剂,也可以使用miRNA抑制剂等活性抑制剂。由此,也可以用于动物的急性肾损伤中的作用机制的实验、模型等。
对于该miRNA抑制剂,例如可以使用包含阻碍成熟型的miRNA的生成、切断pri-miRNA和pre-miRNA等而抑制表达的反义、siRNA(Small interfering RNA,小干扰RNA)、核酶等核酸分子的各种组合物。
【实施例1】
以下,对于本发明的实施方式的急性肾损伤特异性生物标志物,基于具体的实验,作为实施例进一步具体地进行说明。然而,该实施例只不过是一个例子,并不限于此。
〔材料和方法〕
(微阵列分析)
miRNA表达的分析使用microRNA完全标记试剂(microRNA Complete LabelingReagent)和Hyb试剂盒(Agilent Technologies,美国加利福尼亚州安捷伦科技公司制),外包给北海道系统科学株式会社(北海道System Science,日本)来执行。使用小牛肠磷酸酶在37℃下将100ng的总RNA去磷酸化30分钟,并使用100%二甲基亚砜在100℃下使其变性7分钟。接下来,将该样本在冰上冷却2分钟。接下来,使用T4连接酶在16℃下孵育样本2小时,并用pCp-Cy3标记。然后,将pCp-Cy标记样本在8×15K格式安捷伦(Agilent)小鼠microRNA阵列上杂交。然后清洗板,使用安捷伦科技微阵列(Agilent Technologies Microarray)扫描仪以3μm的分辨率进行扫描。使用安捷伦特征提取(Agilent Feature Extraction)软件10.7.3.1版本对数据进行分析。
(微阵列数据处理和统计分析)
将Agilent数据输入GeneSpring GX(Agilent Technologies公司制)并归一化为每个芯片的90百分位数。使用单向方差分析(ANOVA,Analysis of Variance)分析不同组之间的差异。在通过ANOVA检测到统计显著性时,进行图基(Tukey)检验作为事后检验以比较2个不同组的平均。将P<0.05判定为有显著性差异。
(qRT-PCR)
(小鼠肾脏)
使用玻璃均质器和过滤柱切碎机(QIA切碎机,美国加利福尼亚洲瓦伦西亚Qiagen公司制),将小鼠肾脏均质化。然后,使用microRNA提取试剂盒miRNeasy mini kit(Qiagen),从均质化的肾脏样本中分离包含miRNA的总RNA。接下来,使用miScript II RT试剂盒(Qiagen),逆转录所分离的1μg的总RNA。接下来,使用miScript SYBR green PCR试剂盒(Qiagen)进行实时RT-PCR(qRT-PCR)。对于qRT-PCR的条件,使用QuantStudio 12K FlexFlex实时PCR系统(QuantStudio 12K Flex Flex Real-Time PCR system),在95℃下进行15分钟的预孵育,接下来,进行40个循环的(1)在94℃下进行15秒钟的变性、(2)在55℃下进行30秒钟的退火、以及(3)在70℃下进行30秒钟的延伸的循环,对于结果,使用RNU6-2(QUIAGEN公司制)作为内源性对照(endogenous control),用2-ΔΔCT法进行分析。
(人血清)
人血清的miRNA水平分析中,使用NucleoSpin柱式血浆miRNA提取试剂盒NucleoSpin miRNA Plasma(美国宾夕法尼亚州Macherey-Nagel公司制),从400μl的血清中分离总RNA。接下来,使用miScript II RT试剂盒(Qiagen)逆转录所分离的总RNA。接下来,使用miScript SYBR green PCR试剂盒(Qiagen)进行实时RT-PCR。对于qRT-PCR的条件,使用QuantStudio 12K Flex Flex实时PCR系统(QuantStudio-12K Flex Flex Real-TimePCR system),在95℃下进行15分钟的预孵育,接下来,进行40个循环的(1)在94℃下进行15秒钟的变性、(2)在55℃下进行30秒钟的退火、以及(3)在70℃下进行30秒钟的延伸的循环,对于结果,使用miRNA-423-3p作为内源性对照(endogenous control),用2-ΔΔCT法进行分析。
使用以下的引物。
小鼠miRNA-5100PCR中使用的引物(QIAGEN公司制):
5’-UCGAAUCCCAGCGGUGCCUCU-3’(序列号4)
人miRNA-5100PCR中使用的引物(QIAGEN公司制):
5’-UUCAGAUCCCAGCGGUGCCUCU-3’(序列号5)
(急性肾损伤模型小鼠)
利用图1,对试验中使用的急性肾损伤模型小鼠进行说明。在本实施例1中,准备缺血再灌注模型小鼠(IRI Model,Ischemia-reperfusion injury Model)和脂多糖(LPS)给药模型小鼠(LPS Model,Lipopolysaccharides Model)。
对于缺血再灌注模型小鼠,摘出C57/B6小鼠(9周龄,雄)的右肾脏后,将左肾动脉夹持45分钟而阻断肾血流,诱导急性肾衰竭,24小时后进行了解剖。
对于LPS给药模型小鼠,对C57/B6小鼠(9周龄,雄)单次给药脂多糖(Lipopolysaccharide,LPS,10μg/g)PBS水溶液,诱导急性肾衰竭,24小时后进行了解剖。
成为这些的基础的小鼠、其他对照小鼠购自动物繁殖研究所。
(microRNA-5100的过表达)
(miRNA-5100模拟物和对照miRNA)
用于在小鼠中过表达(Overexpression)的miRNA-5100模拟物和对照的miRNA购自日本GeneDesign株式会社。
miRNA-5100模拟物(日本GeneDesign株式会社制)的序列与上述的序列号3相同。
对照的miRNA(Control-miRNA)是与miRBase中注册的miRNA不相同的合成序列,是阴性对照。
(miRNA-5100模拟物-PEI-NP的制备)
作为给药miRNA-5100时的非病毒性载体,使用了作为纳米尺寸的脂质体的线性聚乙烯亚胺纳米颗粒(Linear polyethylenimine-based nanoparticle,PEI-NP)。PEI-NP的生物相容性、稳定性、转染能力优异,因此适合用于miRNA的给药。在本实施例1中,作为PEI-NP,使用了in vivo-jetPEI(注册商标,Polyplus-transfection公司制)。
具体而言,将miRNA-5100模拟物溶解于浓度50μM的5%葡萄糖溶液中。PEI-NP溶解在5%葡萄糖溶液中。将miRNA模拟物和PEI-NP混合,在室温下孵育15分钟来制备miRNA-5100模拟物-PEI-NPs。由此,凝聚的miRNA-5100模拟物被脂质体包封。
使用相同的方式,制备在对照的miRNA中混合有PEI-NPP的对照-miRNA-PEI-NPs。
〔结果〕
(微阵列分析和qRT-PCR结果)
在本实施例1中,进行了因急性肾损伤而变化的miRNA的分析和作为生物标志物的可能性的研究。因此,为了排除外科手术、药物给药本身等实验因素的影响,使用机制不同的已确立的2种急性肾损伤模型小鼠,利用微阵列法对在急性肾损伤肾脏中发生变化的miRNA进行了全面分析。
其中,缺血再灌注模型小鼠是外科手术后等由缺血引起的急性肾损伤模型小鼠。另一方面,LPS给药模型小鼠是败血症中的急性肾损伤模型小鼠。
首先,利用微阵列法对在急性肾损伤下共同变化的微RNA进行了全面分析。在图2A、图2B中示出微阵列分析的结果。图2A是缺血再灌注模型小鼠的结果。图2B是LPS给药模型小鼠的结果。
分别用各急性肾损伤小鼠(4只)和正常小鼠(对照小鼠)(4只)的肾脏进行1881种miRNA的微阵列分析。
作为结果,从1881种miRNA中选出在缺血再灌注急性肾损伤小鼠和LPS给药急性肾损伤小鼠肾脏中共同上升1.2倍以上的18种miRNA,降低1.2倍以上的19种miRNA,合计37种。
(人的qRT-PCR结果)
对于在小鼠的血清中特异性变化的miRNA,在人中,利用血清检索与健康人相比在急性肾损伤患者中变化的miRNA,鉴定成为急性肾损伤的生物标志物的miRNA。
对于在急性肾损伤模型小鼠的肾脏中表达显著变化的37种miRNA,使用NucleoSpin(注册商标)血浆miRNA提取试剂盒,从急性肾损伤患者(31例)(通过KDIGO分类来诊断)、健康人(23例)的血清中提取miRNA,使用miScript II RT Kit(注册商标)制作cDNA(complementary DNA,互补DNA),通过qRT-PCR比较研究miRNA的表达。
由此,鉴定出作为仅在急性肾损伤患者的血清中特异性地表达减少的miRNA的miRNA-5100。
(miRNA-5100的表达分析)
接下来,利用图3,对miRNA-5100的表达量的变化进行说明。
图3是将健康人标准化为1,观察基于qRT-PCR的表达量的差异的图表。miRNA-5100的表达量在P<0.05时显著降低。
对于该分析结果,在下述的表1中示出平均和标准偏差。
【表1】
图4是表示关于miRNA-5100的基于ROC曲线的精度评价(可信性)的图表。在此,进行了分为急性肾损伤患者15例和健康人20例的合计35例的分析。AUC为0.762,P<0.05,是特异性的标志物。
将该曲线下的区域面积的检验结果示于下述的表2。
【表2】
a基于非参数假设
b零假设:真实面积=0.5
(miRNA-5100作为急性肾损伤的医药的研究)
接下来,在急性肾损伤模型小鼠中,对miRNA-5100作为急性肾损伤的医药的效果进行了研究。
具体而言,使用PEI-NP给药miRNA-5100模拟物,使其到达肾脏,进行肾脏中的miRNA-5100的表达量、肾重量、反映肾损伤而上升的分子的量的测定,并评价效果。
根据图5,在实际的给药中,按照日本GeneDesign株式会社的方案,对各小鼠从尾静脉静脉注射合计200μL的miRNA-5100-PEI-NP(miRNA:5nmol,N/P比=6)。
在此,将对缺血再灌注模型小鼠给药了miRNA-5100模拟物-PEI-NPs的小鼠作为给药组。作为对此的对照,使用缺血再灌注模型小鼠的不施术也不给药PEI-NP的组(假手术,Sham)、不给药PEI-NP的缺血再灌注模型小鼠组(IRI)、对缺血再灌注模型小鼠给药了对照-miRNA-PEI-NPs的组(对照miRNA给药组)。
图6是表示肾中的miRNA-5100的表达量的结果的图表。在各图表中,示出将t检验后假手术的值设为1的相对的miRNA-5100的表达量。“※”表示p<0.05,“※※”表示p<0.01,是显著的。
作为结果,在给药组(miRNA-5100模拟物-PEI-NPs)中,相对于各对照,肾中的miRNA-5100的相对表达量在统计学上显著增加。
图7是表示各组中的两侧肾重量(mg)/体重(g)的图表。在各图表中,将t检验后假手术的值设为1。
作为结果,miRNA-5100给药组(miRNA-5100模拟物-PEI-NPs)确认到最大的肾肿大。在初步实验中推测,在急性肾损伤中,通过肾重量进一步增加,能够抑制对肾脏的损伤。
接下来,利用图8A~图8D,对由miRNA-5100模拟物的给药带来的、反映肾损伤而上升的分子的量的测定结果进行说明。作为该分子,使用KDIGO急性肾损伤治疗有关的指南(KDIGO Clinical Practice Guideline for Acute Kidney Injury,KDIGO急性肾脏损伤临床实践指南)中介绍的作为生物标志物“候选”分子的NGAL、KIM-1(Kidney injurymolecule-1)、L-FABP、IL-18(Interleukin 18,白细胞介素-18)。图8A是针对各组示出NGAL的相对表达量的图表。图8B是针对各组示出KIM-1的相对表达量的图表。图8C是针对各组示出L-FABP的相对表达量的图表。图8D是针对各组示出IL-18的相对表达量的图表。各图中,表示将t检验后假手术的值设为1时的相对表达量。
关于NGAL、KIM-1、L-FABP,相对于缺血再灌注模型小鼠组(IRI)和对照miRNA给药组(对照-miRNA-PEI-NPs),miRNA-5100给药组(miRNA-5100模拟物-PEI-NPs)中表达分别以p<0.05显著减少。即,miRNA-5100在肾中的过表达显著抑制了在急性肾损伤中反映肾损伤而上升的分子。
这样,作为效果显示出,miRNA-5100有可能成为急性肾损伤的治疗药。
此外,关于IL-18,miRNA-5100给药组相对于缺血再灌注模型小鼠组和对照miRNA给药组,在统计检验中不显著。然而,在对于缺血再灌注模型小鼠组和对照miRNA给药组的检验中,p<0.05。因此,启示了IL-18的表达量有可能因为缺血再灌注模型小鼠的施术后的miRNA的给药所导致的某种机制而发生变化。即,推测出,在外科手术后等由缺血引起的急性肾损伤中IL-18作为生物标志物的特异性低的可能性。
【实施例2】
〔人的诊断结果〕
(miRNA-5100与以往的AKI标志物的比较)
对于实际的急性肾损伤患者(14例),进行作为以往的AKI标志物的尿中NGAL值、尿中L-FAB值与基于miRNA-5100的表达降低的诊断的比较。
基于miRNA-5100的表达降低的诊断与上述实施例1相同。
关于尿中NGAL,从患者采尿后,以400G以上离心分离5分钟,采集上清,提交给日本SRL(エスア一ルエル)株式会社,利用CLIA(chemiluminescent immunoassay,化学发光免疫分析法)法进行测定。
对于尿中L-FABP而言,对采集到的尿进行冷藏保存,由日本SRL株式式会社通过CLEIA(chemiluminescentenzymeimmunoasssay,化学发光酶免疫测定)法进行测定。
将其结果示于下述的表3。
【表3】
在上述表3中,排除由于无尿而无法测定NGAL、L-FABP的3人,并进行比较。
作为结果,在NGAL、L-FABP未变化的早期阶段(阶段1)的急性肾损伤中也观察到miRNA-5100的表达降低。由此,认为miRNA-5100作为急性肾损伤的生物标志物比NGAL、L-FABP更具有优势。
〔急性肾损伤进展抑制的推断机制〕
在上述实施例1中,显示出:在通过miRNA-5100模拟物的给药而过表达时,作为肾小管间质细胞的损伤标志物的NGAL和KIM-1被抑制。认为这些可能与内质网应激(Endoplasmic Reticulum Stress,ER应激)时的ATF-6途径、PERK(PKR-like ER kinase,蛋白激酶样内质网激酶)途径、IRE-1(inositol-requiring enzyme 1,肌醇需酶1)途径这3个途径中的ATF-6途径、PERK的途径的mRNA相关。因此,与上述实施例1同样地,对于ATF-6途径、PERK的途径的基因,另行通过qRT-PCR测定miRNA-5100模拟物的给药后的表达。
其结果是,ATF-6、BID、IP3R、P53的表达显著变化。其中,ATF-6(ActivatingTranscription Factor 6:激活转录因子6)是属于CREB/ATF家族的膜结合型转录因子。激活内质网应激反应(Unfolded Protein Response,UPR:未折叠蛋白反应)蛋白质的表达。BID是促细胞凋亡的Bcl-2家族蛋白质之一。IP3R是整合到细胞内的内质网膜中的肌醇三磷酸受体(Inositol trisphosphate receptor)。P53是与细胞凋亡相关的癌抑制基因。
在图9和图10中示出对于各组示出这些分子的相对表达量的图表。图9中(a)是针对各组示出ATF-6的相对表达量的图表。图9中(b)是针对各组示出BID的相对表达量的图表。各图表示将t检验后假手术的值设为1时的相对表达量。
ATF-6和BID均通过miRNA-5100模拟物的给药而表达减少。这些基因与内质网应激反应的ATF-6途径有关。即,认为通过miRNA-5100模拟物的给药,这些基因的表达降低,由此抑制该途径的下游的BiP/GRP78、GRP94,也抑制XBP-1、CHOP,从而能够抑制细胞凋亡。
图10中(a)是针对各组示出IP3R的相对表达量的图表。图10中(b)是针对各组示出P53的相对表达量的图表。这些图也表示将t检验后假手术的值设为1时的相对表达量。
IP3R通过miRNA-5100模拟物的给药,表达显著地上升。另一方面,P53通过miRNA-5100模拟物的给药而表达减少。这些基因与内质网应激反应的PERK途径有关。具体而言,如果IPR的表达上升,则Ca向内质网的流入降低受到抑制,细胞凋亡受到抑制。此外,如果P53的表达减少,则细胞凋亡受到抑制。
图11中示出对利用这些基因抑制急性肾损伤的进展的机制的推断进行汇总的图。
即,认为通过miRNA-5100模拟物的给药,ATF-6、BID、IP3R、P53的表达发生变化,抑制肾脏的内质网应激,抑制肾脏的细胞凋亡,从而作为结果,抑制急性肾损伤的发病和进展。
此外,上述实施方式的构成和动作是例子,当然可以在不脱离本发明的主旨的范围内适当变更来执行。
工业实用性
根据本发明,通过使用血液中存在的miRNA作为急性肾损伤特异性生物标志物,能够期待急性肾损伤的早期诊断和治疗用医药的提供,能够在工业上实用。
- 急性肾损伤特异性生物标志物、急性肾损伤的诊断方法、急性肾损伤的检查用试剂盒、动物治疗方法以及急性肾损伤用医药
- 使用热休克蛋白72作为敏感生物标志物来检测急性肾损伤的诊断方法
