肺炎克雷伯菌外膜膜孔蛋白、重组质粒、重组菌株、试剂盒以及它们的应用
文献发布时间:2023-06-19 12:13:22
技术领域
本发明涉及基因工程或兽医微生物领域,具体地,涉及一种肺炎克雷伯菌外膜膜孔蛋白。进一步地,本发明还涉及一种重组质粒、一种重组菌株,一种试剂盒,一种检测肺炎克雷伯菌抗体的方法和它们在检测肺炎克雷伯菌抗体中的应用。
背景技术
肺炎克雷伯菌(Klebsiella pneumoniae)为肠杆菌科(Enterobacteriaceae)克雷伯菌属(Klebsiella)的革兰氏阴性菌,其感染宿主范围广泛,是继大肠杆菌之后常见的条件性致病菌之一。当宿主免疫力低下或长期使用抗生素导致机体正常菌群失调和有外伤的情况下,该菌可寄于人或动物的呼吸道、消化道和泌尿生殖道,引发肺炎、肠炎、脑膜炎、肝脓肿、泌尿系统炎症和创伤性感染,严重时引发全身败血症。
由于抗生素在养殖领域的广泛使用,导致肺炎克雷伯菌耐药菌株的出现以及耐药率的显著上升,给该病的防控与治疗带来极大的挑战。近年来,国内研究人员已先后从猪、牛、羊、犬、梅花鹿、水貂、鲤鱼、对虾和水禽等动物体内分离到该菌,并且该菌引发的动物疫情频繁发生,给养殖业带来了严重的经济损失,更重要的是该菌对食品动物和伴侣动物的感染对人类的健康构成了潜在的威胁,而且宿主感染该菌后增加了其他病原感染的机率。鉴于肺炎克雷伯杆菌感染宿主范围广泛,潜在危害性大,而兽医临床上抗生素的广泛使用导致其耐药菌的出现和耐药率的显著上升,给该病的治疗带来严峻的挑战。因此,提供一种新型高效准确的肺炎克雷伯菌诊断方法显得尤为重要。
发明内容
本发明的目的是为了克服现有技术存在的问题,提供一种肺炎克雷伯菌外膜膜孔蛋白,一种重组质粒、一种重组菌株,一种试剂盒,一种检测肺炎克雷伯菌抗体的方法和它们在检测肺炎克雷伯菌抗体中的应用。该肺炎克雷伯菌外膜膜孔蛋白能够通过细菌高效表达而作为抗原,能够准确、高效地检测体内肺炎克雷伯菌的抗体。
为了实现上述目的,本发明第一方面提供一种肺炎克雷伯菌外膜膜孔蛋白,所述肺炎克雷伯菌外膜膜孔蛋白含有SEQ ID NO.1所示的氨基酸序列。
本发明第二方面提供一种编码肺炎克雷伯菌外膜膜孔蛋白的基因,该基因具有编码含有SEQ ID NO.1所示氨基酸序列的蛋白的核苷酸序列;
优选地,所述基因具有SEQ ID NO.2所示的核苷酸序列。
本发明第三方面提供一种重组质粒,所述重组质粒含有上述的基因;
优选地,所述重组质粒的表达载体为pET28a载体。
本发明第四方面提供一种重组菌株,所述重组菌株含有上述的基因或者上述的重组质粒。
优选地,所述重组菌株的出发菌株为大肠杆菌或者枯草芽孢杆菌;
优选地,所述重组菌株的出发菌株为大肠杆菌BL21。
本发明第五方面提供一种肺炎克雷伯菌外膜膜孔蛋白的制备方法,包括以下步骤:将上述的重组菌株接种至培养基中进行培养得到培养产物,对所述培养产物进行分离纯化,得到所述肺炎克雷伯菌外膜膜孔蛋白。
优选地,对所述培养产物进行分离纯化的过程包括:将所述培养产物进行细胞破碎后,经离心收集上清液,将所述上清液进行纯化。
本发明第六方面提供一种试剂盒,所述试剂盒含有上述的制备方法制得的肺炎克雷伯菌外膜膜孔蛋白。
本发明第七方面提供一种检测肺炎克雷伯菌抗体的方法,包括以下步骤:
步骤(1)、将上述的肺炎克雷伯菌外膜膜孔蛋白或者上述的制备方法制得的肺炎克雷伯菌外膜膜孔蛋白作为包被抗原,加入酶标板,进行酶标板的包被;
步骤(2)、向包被后的酶标板内加入封闭液进行封闭;
步骤(3)、将稀释后的血清样品、阴性对照及阳性对照加入酶标板,孵育后加入二抗,并继续孵育;
步骤(4)、向装有所述血清样品的酶标板内加入底物,避光反应后,加入终止液终止反应,利用酶标仪测定并记录每孔的OD
步骤(5)、结果判读,根据各孔OD
本发明第八方面提供上述的肺炎克雷伯菌外膜膜孔蛋白、上述的基因、上述的重组质粒、上述的重组菌株、上述的试剂盒和上述的检测方法中的至少一者在检测肺炎克雷伯菌抗体中的应用。
通过上述技术方案,本发明的有益效果为:本发明所提供的肺炎克雷伯菌外膜膜孔蛋白对肺炎克雷伯菌的检测具有特异性,不存在与其他菌株的交叉反应;以肺炎克雷伯菌外膜膜孔蛋白为包被抗原的间接ELISA检测方法不仅对肺炎克雷伯菌的检出准确率高,而且操作步骤简单、检测效率高,便于在兽医临床等领域进行推广与应用。
附图说明
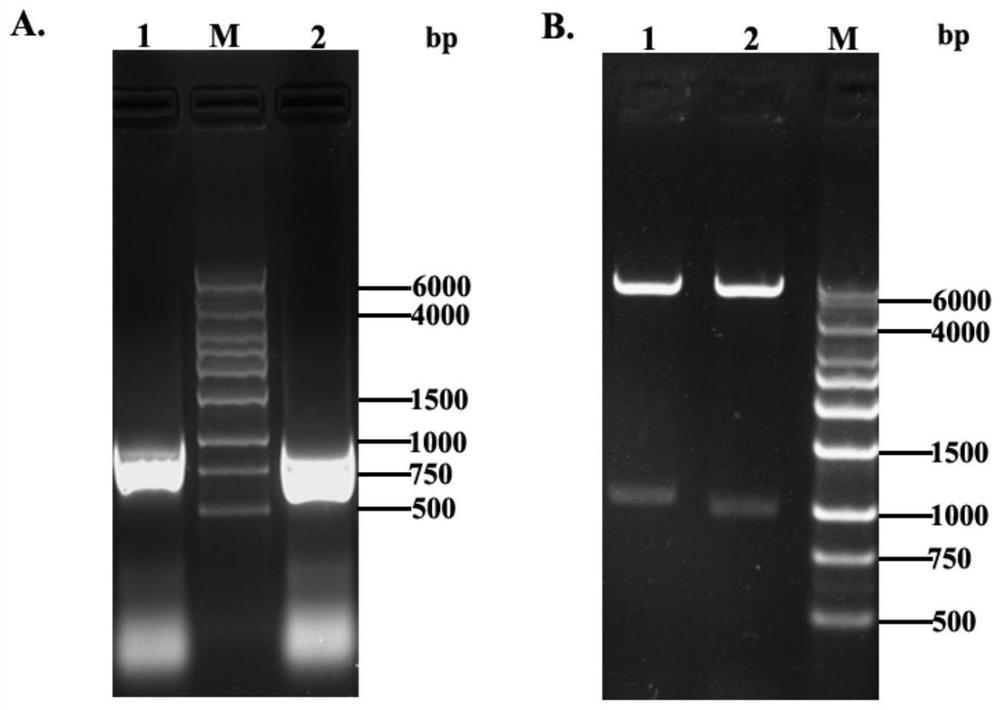
图1是本发明中DNLS-phoE和FL-phoE的PCR扩增产物、重组质粒pET28a-DNLS-phoE和pET28a-FL-phoE酶切后的电泳鉴定结果;其中,A:琼脂糖凝胶电泳检测FL-phoE和DNLS-phoE基因PCR扩增产物;1为FL-phoE基因扩增片段,2为DNLS-phoE基因片段,M为1kb DNAMarker I;B:重组质粒pET28a-DNLS-phoE和pET28a-FL-phoE经限制性内切酶BamH I和XhoI酶切后的产物;1为pET28a-FL-phoE的酶切产物;2为pET28a-DNLS-phoE的酶切产物;M为1kb DNA Marker I;bp为碱基对;6000、4000、1500、1000、750、500为对应片段的碱基对数量。
图2是在线软件SWISS-MODEL对FL-phoE和DNLS-phoE蛋白的空间结构模拟;A为FL-phoE的空间结构,B为DNLS-phoE的空间结构。
图3是重组蛋白DNLS-phoE和FL-phoE的表达和纯化;A:SDS-PAGE分析pET28a-FL-phoE和pET28a-DNLS-phoE的表达,M为蛋白质分子质量标准;1为含质粒pET28a-FL-phoE菌体总蛋白;2为含质粒pET28a-FL-phoE菌体裂解液上清;3为含质粒pET28a-FL-phoE菌体裂解液沉淀;4为含质粒pET28a-DNLS-phoE菌体裂解液上清;5为含质粒pET28a-DNLS-phoE菌体裂解液沉淀;6为含质粒pET28a-DNLS-phoE菌体总蛋白;B:SDS-PAGE分析pET28a-FL-phoE和pET28a-DNLS-phoE经镍柱纯化后的产物,1-3为纯化后的pET28a-FL-phoE产物;4-6为纯化后的pET28a-DNLS-phoE产物。
图4是Western blotting检测DNLS-phoE的免疫原性;M为预染蛋白质分子质量标准;1为含pET28a(+)空载体菌体蛋白(阴性对照);2为纯化后的DNLS-phoE蛋白;3为CVCC4080肺炎克雷伯菌的菌体裂解液(阳性对照)。
图5是PCR检测猪血清样本的结果;其中,M为1kb DNA Marker I;1-30为临床血液基因组DNA的PCR扩增产物;bp为碱基对;6000、4000、1500、1000、750、500为对应片段的碱基对数量。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
第一方面,本发明提供了一种肺炎克雷伯菌外膜膜孔蛋白(DNLS-phoE),所述肺炎克雷伯菌外膜膜孔蛋白含有SEQ ID NO.1所示的氨基酸序列。
上述肺炎克雷伯菌外膜膜孔蛋白可以通过人工合成得到,也可以先合成其编码基因,再通过生物表达获得。
本发明第二方面提供一种编码肺炎克雷伯菌外膜膜孔蛋白的基因,该基因具有编码含有SEQ ID NO.1所示氨基酸序列的蛋白的核苷酸序列;
优选地,所述基因具有SEQ ID NO.2所示的核苷酸序列。
SEQ ID NO.2:
CGCggatccATGGCGGAAGTTTATAATAAGAACGCGAACAAGCTGGATGTGTACGGCAAGATCAAAGCCATGCACTATTTCAGCGACTATGACAGCAAGGATGGCGATCAGACCTACGTGCGTTTCGGTATTAAAGGCGAAACGCAGATTAACGACGACCTGACCGGCTATGGCCGTTGGGAATCTGAATTCTCCGGTAACAAAACCGAGAGCGACTCCAGCCAGAAAACCCGTCTGGCGTTCGCCGGCGTGAAGCTGAAGAACTACGGCTCCTTCGATTACGGTCGTAACCTTGGCGCCCTGTACGACGTGGAAGCCTGGACCGATATGTTCCCGGAATTCGGCGGCGATTCCTCTGCCCAGACCGATAACTTTATGACCAAGCGCGCCAGCGGCCTGGCGACCTACCGCAACACCGACTTCTTCGGTCTGGTGGATGGCCTGGATCTGACCCTGCAGTACCAGGGTAAAAACGAAGGCCGTGAAGCGAAGAAACAGAACGGCGACGGCGTCGGCACCTCGTTAAGCTATGATTTCGGCGGCAGCGACTTCGCCGTCAGCGCAGCCTACACCAGCTCCGACCGTACCAACGATCAGAACCTGCTGGCCCGCGGCCAGGGTTCGAAAGCGGAAGCCTGGGCGACCGGCCTGAAATATGACGCCAACAATATCTACCTGGCGACCATGTACTCTGAAACCCGCAAGATGACCCCGATCAGCGGCGGCTTTGCCAACAAAGCGCAGAACTTTGAAGCGGTGGCGCAATATCAGTTCGACTTCGGTCTGCGTCCGTCCCTCGGCTATGTGCTGTCGAAAGGGAAGGATATCGAAGGGGTGGGGAGTGAAGATCTGGTTAACTACATCGACGTGGGCCTGACCTACTACTTCAACAAAAACATGAACGCCTTCGTGGATTACAAAATCAACCAGCTGAAAAGCGATAACAAACTCGGCATCAACGATGACGACATCGTCGCGCTGGGCATGACCTACCAGTTCTGActcgagCGG,其中,ggatcc为BamH I限制性内切酶位点,ctcgag为Xho I酶切位点。
本发明提供的核苷酸序列通常可以用聚合酶链式反应(PCR)扩增法、重组法、或人工合成的方法获得。例如,本领域技术人员根据本发明所提供的核苷酸序列,可以很容易得到模板和引物,利用PCR进行扩增获得有关序列。一旦获得了有关的核苷酸序列,就可以用重组法大批量的获得有关氨基酸序列。通常将所得核苷酸序列克隆入载体,再转入基因工程菌中,然后通过常规的方法从增殖后的宿主细胞分离得到有关核苷酸序列。此外,还可用公知的人工化学合成的方法来合成有关核苷酸序列。
示例性地,本发明中获得上述肺炎克雷伯菌外膜膜孔蛋白的编码基因的引物对为:
P1:5'-CGCGGATCCATGGCGGAAGTTTATAAT-3',
P2:5'-CCGCTCGAGTCAGAACTGGTAGGTCATGCC-3',
以肺炎克雷伯菌株CVCC4080的基因组为模板,经PCR扩增到目的基因片段。
第三方面,本发明提供了一种重组质粒,所述重组质粒含有编码肺炎克雷伯菌外膜膜孔蛋白的基因,所述肺炎克雷伯菌外膜膜孔蛋白含有SEQ ID NO.1所示的氨基酸序列。
优选地,所述基因具有SEQ ID NO.2所示的核苷酸序列。
重组质粒中使用的载体可选用本领域已知的各种载体,如市售的各种质粒、粘粒、噬菌体及反转录病毒等,本发明优选的表达载体为pET28a质粒。重组质粒构建可采用能够在载体多克隆位点具有切割位点的各种核酸内切酶(如对于pET28a,可用BamH I、Xho I等)进行酶切获得线性质粒,与采用相同核酸内切酶切割的基因片段连接,获得重组质粒。本发明优选采用BamH I和Xho I双酶切pET28a及与其连接的基因片段,经连接酶连接,构建得到重组质粒pET28a-DNLS-phoE。
第四方面,本发明提供了一种重组菌株,所述重组菌株含有上述的基因或者上述的重组质粒。
可以通过本领域常规的方法将所述重组质粒转化、转导或者转染到宿主细胞(菌株)中,如氯化钙法化学转化、高压电击转化,优选电击转化。所述宿主细胞可以为原核细胞或真核细胞,优选为大肠杆菌或者枯草芽孢杆菌,更优选地,所述宿主细胞为大肠杆菌,比如可以为大肠杆菌BL21。
第五方面,本发明提供了一种肺炎克雷伯菌外膜膜孔蛋白的制备方法,包括以下步骤:将上述的重组菌株接种至培养基中进行培养得到培养产物,对所述培养产物进行分离纯化,得到所述肺炎克雷伯菌外膜膜孔蛋白。
上述制备方法通过培养本发明提供的重组菌株,诱导编码肺炎克雷伯菌外膜膜孔蛋白的基因表达;分离纯化所表达的肺炎克雷伯菌外膜膜孔蛋白。所述重组菌株的培养可以是液体形式培养,也可以是固体形式培养。所述培养产物中可以含有本领域常规制备菌剂时添加的辅料,本领域技术人员可以根据需要选择。
其中,所述培养条件为常规的培养条件,如使用LB培养基(溶剂为水,溶质及其终浓度分别为:胰蛋白胨5-15g/L、酵母提取物1-10g/L、NaCl5-15g/L),在35-37℃下培养。
由于本发明提供的重组菌株中含有编码肺炎克雷伯菌外膜膜孔蛋白的基因,其可以高效地表达肺炎克雷伯菌外膜膜孔蛋白,其培养后经过分离提纯,即可得到高纯度的肺炎克雷伯菌外膜膜孔蛋白。
根据本发明,可以采用本领域技术人员公知的方法进行分离提纯,优选地,所述培养采用液体培养,对所述培养产物进行分离纯化的过程包括:将所述培养产物进行细胞破碎后,经离心收集上清液,将所述上清液进行纯化。
第六方面,本发明提供了一种试剂盒,所述试剂盒含有上述的制备方法制得的肺炎克雷伯菌外膜膜孔蛋白。
所述试剂盒可以以固体、半固体或液体形式存在,所述试剂盒可以含有制备试剂盒的辅料或添加剂等,本领域技术人员可以根据需要进行选择,在此不再赘述。
示例性地,所述试剂盒可以包括肺炎克雷伯菌外膜膜孔蛋白包被的酶标板、样品稀释液、阴阳性对照血清、浓缩洗涤液、酶标二抗、显色液A、显色液B、终止液。
第七方面,本发明提供了一种检测肺炎克雷伯菌抗体的方法,包括以下步骤:
步骤(1)、将上述的肺炎克雷伯菌外膜膜孔蛋白或者上述的制备方法制得的肺炎克雷伯菌外膜膜孔蛋白作为包被抗原,加入酶标板,进行酶标板的包被;
步骤(2)、向包被后的酶标板内加入封闭液进行封闭;
步骤(3)、将稀释后的血清样品、阴性对照及阳性对照加入酶标板,孵育后加入二抗,并继续孵育;
步骤(4)、向装有所述血清样品的酶标板内加入底物,避光反应后,加入终止液终止反应,利用酶标仪测定并记录每孔的OD
步骤(5)、结果判读,根据各孔OD
其中,S/N值为血清样品的OD
上述的试剂盒可以适用于该检测肺炎克雷伯菌抗体的方法。
第八方面,本发明提供了上述的肺炎克雷伯菌外膜膜孔蛋白、上述的基因、上述的重组质粒、上述的重组菌株、上述的试剂盒和上述的检测方法中的至少一者在检测肺炎克雷伯菌抗体中的应用。
以下将通过实施例对本发明进行详细描述。
下述实施例中,所使用的实验方法如无特殊说明,均为常规方法;肺炎克雷伯菌(CVCC4080)和猪伤寒沙门菌(CVCC3783)购自中国兽药监察所、猪大肠杆菌(C83902)由扬州大学兽医学院提供,其它所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
本实施例用于说明肺炎克雷伯菌外膜膜孔蛋白和重组质粒的获取。
根据NCBI中公布的phoE基因(GenBank:M28295),以SEQ ID NO.3所示的引物序列P1和SEQ ID NO.4所示的引物序列P2为引物对,在上下游引物中分别引入BamH I和Xho I限制性内切酶酶切位点。其中,
SEQ ID NO.3:5'-CGCGGATCCATGGCGGAAGTTTATAAT-3',
SEQ ID NO.4:5'-CCGCTCGAGTCAGAACTGGTAGGTCATGCC-3',
以肺炎克雷伯菌株CVCC4080的基因组(采用上海生工生物工程有限公司的细菌基因组DNA快速抽提试剂盒提取)为模板,进行PCR扩增,PCR反应体系为:
PCR体系如下:10×Buffer 5μL,25mM MgCl
PCR反应条件:94℃预变性3min,94℃变性15S,55℃退火30S,72℃延伸1min,30个循环,72℃继续延伸5min,4℃保存。
PCR产物分别进行琼脂糖凝胶电泳分析后,切胶回收目的基因,得到肺炎克雷伯菌外膜膜孔蛋白(DNLS-phoE)。
以SEQ ID NO.5所示的引物序列P3和SEQ ID NO.3所示的引物序列P2为引物对,其中,
SEQ ID NO.5:5-CGCGGATCCATGAAAAAGAGTACTCTGGC-3',
在上下游引物中分别引入BamH I和Xho I限制性内切酶酶切位点,以肺炎克雷伯菌株CVCC4080的基因组为模板,进行PCR扩增(PCR反应体系与DNLS-phoE相同),PCR产物分别进行琼脂糖凝胶电泳分析后,切胶回收目的基因,得到全长phoE基因(FL-phoE)。
对表达载体进行双酶切,酶切反应体系为:载体pET28a(5μL),限制性内切酶BamHI(1μL),限制性内切酶Xho I(1μL),10×Buffer(1μL),ddH
将目的基因(DNLS-phoE和FL-phoE)分别连接到表达载体pET28a上,连接反应体系为:载体1μL,目的基因5μL,T4 DNA连接酶(NEB)1μL,10×Buffer 1μL,ddH
将连接产物pET28a-DNLS-phoE和pET28a-FL-phoE分别转化入大肠杆菌DH5α感受态细胞中,具体方法为:取50μL感受态细胞在冰浴上融化,加入连接反应液;冰浴静置30min;42℃水浴热击60sec,迅速转移到冰上静置2min,加入500μL灭菌LB培养基(无抗生素),37℃,200rpm培养1h;6000rpm离心3min,去除部分上清,重悬细胞,取100μL涂布在含100μg/mL氨苄青霉素的LB培养基固体平板上,37℃培养过夜。挑选阳性克隆,提取重组质粒,并进行酶切初步鉴定,质粒的构建成功以送去上海生工进行序列测定为准。
DNLS-phoE和FL-phoE的PCR产物经1%琼脂糖凝胶电泳鉴定,结果如图1A所示,泳道1和泳道2分别扩增到单一的条带为FL-phoE和DNLS-phoE基因,理论大小分别为1065bp和1011bp;将重组质粒pET28a-FL-phoE和pET28a-DNLS-phoE经限制性内切酶BamH I和Xho I进行鉴定,结果如图1B所示,重组质粒经酶切后可释放出FL-phoE和DNLS-phoE基因片段以及pET28a载体。
测序结果显示,DNLS-phoE基因编码全长1011bp,其核苷酸序列如SEQ ID NO.2所示。目的基因共编码330个氨基酸和1个终止密码子,其氨基酸序列如SEQ ID NO.1所示,预测蛋白质分子量为37kDa。
DNLS-phoE和FL-phoE的蛋白序列分析与空间结构模拟
使用在线数据库Uniprot(https://www.uniprot.org/)对肺炎克雷伯菌的FL-phoE蛋白进行分析,数据库PTM/Processing注释模块显示,FL-phoE蛋白的1-21位氨基酸为信号肽序列。利用SWISS-MODEL在线蛋白结构模拟软件分别对FL-phoE和DNLS-phoE(删除信号肽后的phoE)进行空间结构模拟,结果见图2。从图2可以看出DNLS-phoE与FL-phoE形成的三聚体空间结构极其相似,说明删除信号肽后不会引起phoE空间结构发生变化。
实施例2
本实施例用于说明重组菌株的获取和DNLS-phoE的制备方法。
将实施例1中获得的测序正确的pET28a-FL-phoE质粒和pET28a-DNLS-phoE质粒分别转化入大肠杆菌BL21感受态细胞中,得到pET28a-FL-phoE重组菌株和pET28a-DNLS-phoE重组菌株,具体方法参考上述将pET28a-DNLS-phoE和pET28a-FL-phoE分别转化入大肠杆菌DH5α感受态细胞的转化步骤;
分别挑取pET28a-FL-phoE重组菌株和pET28a-DNLS-phoE重组菌株的单菌落接种到50μg/mL的LB培养基中,37℃、200rpm培养至OD
根据两种重组蛋白表达情况的不同,分别取pET28a-FL-phoE重组菌株和pET28a-DNLS-phoE重组菌株的菌裂解液上清进行纯化。纯化方法参考上海生工生物Ni-NTA纯化树脂预装柱(产品编号:C600793)的说明书进行。包涵体处理如下:收集包涵体后用10mL的Lysis buffer(137mM/LNaCl,2.7mM/L KCl,10mM/L Na
以上结果说明,FL-phoE中信号肽的存在不仅影响phoE蛋白的表达水平而且影响重组蛋白His标签与镍柱上镍离子的结合,从而影响其纯化。需要说明的是,为了使得重组蛋白FL-phoE与镍离子更好地结合,延长了其与柱子结合的时间,所以出现了杂蛋白;而DNLS-phoE穿流过镍柱一次后便实现很好的结合,经SDS-PAGE分析发现可获得纯度较高的DNLS-phoE重组蛋白。
实施例3DNLS-phoE的免疫原性鉴定
取实施例2中纯化得到的重组蛋白DNLS-phoE(5μg)经SDS-PAGE电泳后,利用半干转印仪将重组蛋白转移至PVDF膜上,5%脱脂乳,4℃封闭过夜;PBST洗3遍,置于1:5000稀释的肺炎克雷伯菌CVCC4080株感染小鼠的阳性血清中,37℃孵育2h,PBST洗膜3次,每次10min,洗膜后用1:10000稀释的HRP标记羊抗鼠IgG于37℃孵育1h,PBST洗膜5次,ECL化学发光显色液进行避光显色,拍照分析,结果如图4所示。重组蛋白DNLS-phoE能够与肺炎克雷伯菌阳性血清发生特异性结合,出现约为37kDa大小的阳性条带,说明DNLS-phoE具有良好的免疫原性。
实施例4动多抗制备及间接ELISA检测抗体效价
利用BCA法定量试剂盒测定重组蛋白DNLS-phoE的浓度,以10μg/只与弗氏完全佐剂进行混合,乳化,皮下注射免疫接种Balb/C小鼠;中间间隔2周加强免疫1次,一共免疫3次,第2次和第3次接种使用DNLS-phoE与弗氏不完全佐剂;在最后一次接种后的第14天,收集小鼠血清,利用间接ELISA法检测小鼠的血清效价。
间接ELISA检测法检测小鼠血清的步骤包括:
步骤(1)、分别将购自中国兽药监察所的肺炎克雷伯菌(CVCC4080)和猪伤寒沙门菌(CVCC3783)、扬州大学兽医学院提供的猪大肠杆菌(C83902)、实施例2中纯化得到的DNLS-phoE作为抗原进行包被,稀释液稀释至10μg/mL,以100μL/孔加入到96孔酶标板中,4℃包被过夜,PBST清洗3次,每次5min;
步骤(2)、每孔加入200μL含2%BSA的封闭液,37℃孵育1.5h;
步骤(3)、血清(一抗)孵育:PBST清洗3次,每次5min,拍干酶标板,加入100μL/孔血清,阴性血清(注射PBS小鼠的血清)按照1:2000进行稀释,多抗按照1:2000、1:4000、1:8000、1:16000、1:32000、1:64000和1:128000进行稀释,37℃孵育30min;
步骤(4)、PBST清洗5次,每次5min,拍干酶标板,加入100μL/孔的辣根过氧化酶标记的羊抗鼠IgG抗体,37℃孵育40min;
步骤(5)、甩干酶标板,PBST清洗3次,每次5min,加入100μL/孔TMB底物显色缓冲液,37℃孵育10-20min,待颜色出现后加入100μL 2M的H
步骤(6)、将酶标板置于酶标分析仪中读取OD
从表1可以看出,Balb/C小鼠的血清可产生针对DNLS-phoE的抗体,而且仅能和肺炎克雷伯菌发生结合反应,针对DNLS-phoE,血清中产生抗体的效价要大于1:128000。
表1
实施例5利用DNLS-phoE的间接ELISA检测法在兽医临床猪血清抗体检测中的应用
临床采集猪血清样本30份,部分血液使用柱式血液基因组DNA抽提试剂盒(方法参考说明书进行)提取血液基因组DNA,其余部分制备血清,进行1:500稀释,按照实施例4中所述的间接ELISA检测法对猪血清样本进行检测。
结果的判定:根据是S/N(待测样品OD
表2临床采集的猪血清样本的间接ELISA检测结果
实施例6利用DNLS-phoE的间接ELISA检测法的阳性符合率检测
将实施例5中提取的猪血清样本的血液基因组为模板,以SEQ ID NO.2所示的引物序列P1和SEQ ID NO.3所示的引物序列P2为引物对,进行PCR扩增DNLS-phoE基因,鉴定猪血清样本中肺炎克雷伯菌的感染率,结果如图5所示,将本实施例中PCR方法检测出的猪血清样本中感染肺炎克雷伯菌的检出结构,与实施例5获得的检测结果进行比较。临床收集的30份猪血清样本,经间接ELISA检测共检出10份阳性样品,PCR可检出11份阳性样品(编号为2、4、8、9、11、20、22、23、27、29、30),因此,利用DNLS-phoE的间接ELISA检测法的符合率为90.9%。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
SEQUENCE LISTING
<110> 台州学院
<120> 肺炎克雷伯菌外膜膜孔蛋白、重组质粒、重组菌株、试剂盒以及它们的应用
<130> 20210429
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 330
<212> PRT
<213> 人工合成
<400> 1
Met Ala Glu Val Tyr Asn Lys Asn Ala Asn Lys Leu Asp Val Tyr Gly
1 5 10 15
Lys Ile Lys Ala Met His Tyr Phe Ser Asp Tyr Asp Ser Lys Asp Gly
20 25 30
Asp Gln Thr Tyr Val Arg Phe Gly Ile Lys Gly Glu Thr Gln Ile Asn
35 40 45
Asp Asp Leu Thr Gly Tyr Gly Arg Trp Glu Ser Glu Phe Ser Gly Asn
50 55 60
Lys Thr Glu Ser Asp Ser Ser Gln Lys Thr Arg Leu Ala Phe Ala Gly
65 70 75 80
Val Lys Leu Lys Asn Tyr Gly Ser Phe Asp Tyr Gly Arg Asn Leu Gly
85 90 95
Ala Leu Tyr Asp Val Glu Ala Trp Thr Asp Met Phe Pro Glu Phe Gly
100 105 110
Gly Asp Ser Ser Ala Gln Thr Asp Asn Phe Met Thr Lys Arg Ala Ser
115 120 125
Gly Leu Ala Thr Tyr Arg Asn Thr Asp Phe Phe Gly Leu Val Asp Gly
130 135 140
Leu Asp Leu Thr Leu Gln Tyr Gln Gly Lys Asn Glu Gly Arg Glu Ala
145 150 155 160
Lys Lys Gln Asn Gly Asp Gly Val Gly Thr Ser Leu Ser Tyr Asp Phe
165 170 175
Gly Gly Ser Asp Phe Ala Val Ser Ala Ala Tyr Thr Ser Ser Asp Arg
180 185 190
Thr Asn Asp Gln Asn Leu Leu Ala Arg Gly Gln Gly Ser Lys Ala Glu
195 200 205
Ala Trp Ala Thr Gly Leu Lys Tyr Asp Ala Asn Asn Ile Tyr Leu Ala
210 215 220
Thr Met Tyr Ser Glu Thr Arg Lys Met Thr Pro Ile Ser Gly Gly Phe
225 230 235 240
Ala Asn Lys Ala Gln Asn Phe Glu Ala Val Ala Gln Tyr Gln Phe Asp
245 250 255
Phe Gly Leu Arg Pro Ser Leu Gly Tyr Val Leu Ser Lys Gly Lys Asp
260 265 270
Ile Glu Gly Val Gly Ser Glu Asp Leu Val Asn Tyr Ile Asp Val Gly
275 280 285
Leu Thr Tyr Tyr Phe Asn Lys Asn Met Asn Ala Phe Val Asp Tyr Lys
290 295 300
Ile Asn Gln Leu Lys Ser Asp Asn Lys Leu Gly Ile Asn Asp Asp Asp
305 310 315 320
Ile Val Ala Leu Gly Met Thr Tyr Gln Phe
325 330
<210> 2
<211> 1011
<212> DNA
<213> 人工合成
<400> 2
cgcggatcca tggcggaagt ttataataag aacgcgaaca agctggatgt gtacggcaag 60
atcaaagcca tgcactattt cagcgactat gacagcaagg atggcgatca gacctacgtg 120
cgtttcggta ttaaaggcga aacgcagatt aacgacgacc tgaccggcta tggccgttgg 180
gaatctgaat tctccggtaa caaaaccgag agcgactcca gccagaaaac ccgtctggcg 240
ttcgccggcg tgaagctgaa gaactacggc tccttcgatt acggtcgtaa ccttggcgcc 300
ctgtacgacg tggaagcctg gaccgatatg ttcccggaat tcggcggcga ttcctctgcc 360
cagaccgata actttatgac caagcgcgcc agcggcctgg cgacctaccg caacaccgac 420
ttcttcggtc tggtggatgg cctggatctg accctgcagt accagggtaa aaacgaaggc 480
cgtgaagcga agaaacagaa cggcgacggc gtcggcacct cgttaagcta tgatttcggc 540
ggcagcgact tcgccgtcag cgcagcctac accagctccg accgtaccaa cgatcagaac 600
ctgctggccc gcggccaggg ttcgaaagcg gaagcctggg cgaccggcct gaaatatgac 660
gccaacaata tctacctggc gaccatgtac tctgaaaccc gcaagatgac cccgatcagc 720
ggcggctttg ccaacaaagc gcagaacttt gaagcggtgg cgcaatatca gttcgacttc 780
ggtctgcgtc cgtccctcgg ctatgtgctg tcgaaaggga aggatatcga aggggtgggg 840
agtgaagatc tggttaacta catcgacgtg ggcctgacct actacttcaa caaaaacatg 900
aacgccttcg tggattacaa aatcaaccag ctgaaaagcg ataacaaact cggcatcaac 960
gatgacgaca tcgtcgcgct gggcatgacc taccagttct gactcgagcg g 1011
<210> 3
<211> 27
<212> DNA
<213> 人工合成
<400> 3
cgcggatcca tggcggaagt ttataat 27
<210> 4
<211> 30
<212> DNA
<213> 人工合成
<400> 4
ccgctcgagt cagaactggt aggtcatgcc 30
<210> 5
<211> 29
<212> DNA
<213> 人工合成
<400> 5
cgcggatcca tgaaaaagag tactctggc 29
- 肺炎克雷伯菌外膜膜孔蛋白、重组质粒、重组菌株、试剂盒以及它们的应用
- 一种空肠弯曲菌外膜蛋白的串联表位多肽、基因、重组质粒、重组菌的构建及其应用
