间充质干细胞外泌体组合物的制备方法及在皮肤抗衰老中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物技术领域,具体涉及间充质干细胞外泌体组合物的制备方法及在皮肤抗衰老中的应用。
背景技术
外泌体(Exosome)是由细胞内囊泡结构释放到细胞外的一种膜性囊泡,直径大约30-150nm,具有脂质双层膜结构,由于质膜和多囊泡体之间融合的结果,外泌体样囊泡通过胞吐作用被分泌到胞外空间。几乎所有的细胞都分泌胞外囊泡,包括间充质干细胞,间充质干细胞来源的胞外囊泡含有与母细胞相似的成分,如细胞因子、生长因子、脂类、mRNAs及调控型miRNAs等,具有丰富的生理功能,主要参与细胞与细胞间的交流通讯及改变组织的微环境等,在免疫调控,组织损伤修复等方面起着不可低估的作用。
皮肤作为人体最大的器官,是抵御外界机械、化学、物理及生物等各种刺激的第一道防线,皮肤老化的临床上表现为皱纹形成、弹性降低、水分流失、色素沉积等,主要由刺激性的外界环境(如强紫外线)、不良的生活习惯(如熬夜)、严重的心理压力等导致。随着人们对皮肤的保养越来越重视,抗氧化剂凭借其安全有效、天然无毒、防御氧化损伤及延缓衰老等优点,已广泛应用于皮肤科领域;而外泌体由于具有易于透过细胞膜的特点,与抗氧化剂组合使用,可以提高抗氧化剂的生物利用率;申请号为202111507419.2的专利提供了一种用于皮肤抗衰老的脐带来源的间充质干细胞外泌体组合物的制备方法,将获取的脐带来源的间充质干细胞外泌体与抗氧化剂(花青素、白藜芦醇、维生素A、维生素C等)通过物理混合的方式,制备得到具有促进细胞增殖、抗细胞衰老作用的间充质干细胞外泌体组合物,但简单的物理混合,使间充质干细胞外泌体对于促进抗氧化剂的吸收利用具有一定的局限性。
发明内容
本发明的目的在于针对现有技术的不足,提供了间充质干细胞外泌体组合物的制备方法及在皮肤抗衰老中的应用,该间充质干细胞外泌体组合物能够高效地进入细胞中发挥作用,不仅能够高效抑制黑色素合成,减少黑色素累积,延缓皮肤的衰老,还能够有效提升皮肤弹性、减少肌肤皱纹,具有较好的抗衰老效果。
本发明为实现上述目的所采取的技术方案为:
一种间充质干细胞外泌体组合物的制备方法,包括以下步骤:
S1、将第3-8代的脐带来源的间充质干细胞按照5-10×10
S2、将上清液1在2-8℃,100-200g条件下离心5-10min,得到上清液2,将上清液2用2000-5000g离心10-30min,得到上清液3,将上清液3通过100000NWCO超滤膜进行超滤,所得滤液用无菌过滤膜过滤除菌,获得间充质干细胞外泌体;
S3、将天然抗氧化剂的无水醇溶液与间充质干细胞外泌体充分混合,向混合体系中加入占混合体系质量0.2-0.8%的咪唑基表面活性剂,搅拌均匀,得到混合液;所述咪唑基表面活性剂的结构式为:
,式中,n为2、3或4;优选n为3,咪唑基表面活性剂为化合物1-2,结构式如下:
;
S4、在冰浴的条件下,将所得混合液进行超声处理1-5min,将超声后的混合液用2000-5000g离心10-30min,得到上清液,再用无菌滤膜过滤除菌,得到间充质干细胞外泌体组合物;其中超声频率为30-90KHz,超声功率为0.2-0.8W/cm
进一步地,步骤S2和S4中所述无菌滤膜的孔径相同,为0.2μm或0.22μm,优选无菌滤膜的孔径为0.2μm。
进一步地,步骤S3中所述天然抗氧化剂为木犀草素、茶多酚、姜黄素、白藜芦醇中的一种或几种,优选天然抗氧化剂为木犀草素;所述天然抗氧化剂在无水醇溶液中的质量占比为5-10%,优选天然抗氧化剂在无水醇溶液中的质量占比为10%;所述无水醇溶液为无水甲醇、无水乙醇、无水丙醇、无水正丁醇、无水异丁醇中的一种或几种,优选无水醇溶液为无水甲醇;所述天然抗氧化剂的无水醇溶液与间充质干细胞外泌体的质量比为1:2-4,优选天然抗氧化剂的无水醇溶液与间充质干细胞外泌体的质量比为1:4。
进一步地,步骤S3中所述咪唑基表面活性剂的制备方法为:咪唑与1-氯己醇在三乙胺的作用下,反应生成化合物2,结构式如下:
,其中反应溶剂为N,N-二甲基甲酰胺或N,N-二甲基乙酰胺,反应温度为70-80℃,反应时间为10-12h;化合物2与二氯亚砜在四丁基溴化铵的作用下,反应生成化合物3,结构式如下:
,其中反应溶剂为石油醚,反应温度为60-80℃,反应时间为3-5h;化合物3与十二烷基二甲基叔胺发生季铵化反应,生成化合物4,结构式如下:
,其中反应溶剂为异丙醇,反应温度为83℃,反应时间为10-12h;马来酸酐与一元醇反应,生成化合物5,结构式如下:/>
,式中,n为2、3或4,其中反应温度为90℃,反应时间为4-6h;其中所述一元醇为正丙醇、正丁醇或正戊醇,优选一元醇为正丁醇;最后化合物4与化合物5发生加成反应,生成咪唑基表面活性剂,其中反应溶剂为二氯甲烷,反应温度为30-35℃,反应时间为15-18h。
本发明提供了一种间充质干细胞外泌体组合物,经由上述一种间充质干细胞外泌体组合物的制备方法制备得到。
本发明还提供了一种间充质干细胞外泌体组合物的应用,所述间充质干细胞外泌体组合物用于制备包括水剂、乳剂、粉剂、凝胶或膏霜的皮肤抗衰老化妆品。
本发明具有如下有益效果:
本发明合成的咪唑基表面活性剂化合物1-1、1-2、1-3既具备离子液体的特性,又具备表面活性剂的特性,在结构中含有咪唑环阳离子的基础上,均引入了亲水性的季铵盐及疏水的长链烷烃结构,进一步提高了咪唑基表面活性剂的润湿、乳化性能;结果表明化合物1-1、1-2、1-3均能够在较宽的浓度范围内达到较低的油水界面张力,具有良好的降低油水界面张力能力及乳化性能,其中化合物1-2的降低油水界面张力能力及乳化性能最好;将化合物1-2应用于间充质干细胞外泌体组合物的制备中,在乳化超声步骤中,咪唑基表面活性剂化合物1-2由于其良好的润湿、乳化作用,可以快速形成水包油的纳米乳结构,将天然抗氧化剂分子与外泌体挤压在一起,超声的作用使外泌体的双层膜穿孔,膜的通透性增加,促进了被挤压在一起的天然抗氧化剂分子快速进入外泌体中,随着超声强度不断变化的过程,外泌体双层膜产生的孔可发生自我修复,双分子膜结构恢复正常,从而形成外泌体对天然抗氧化剂的有效包裹。
通过乳化超声形成的间充质干细胞外泌体包裹天然抗氧化剂的组合物,间充质干细胞外泌体作为天然抗氧化剂的载体,其双层膜结构能够携带天然抗氧化剂高效的穿过皮肤组织细胞的细胞膜,进而高效进入细胞中发挥作用,提高了组合物中各有效成分的生物利用率;本发明所提供的间充质干细胞外泌体组合物能够高效抑制黑色素合成,减少黑色素累积,延缓皮肤的衰老,同时还能够有效提升皮肤弹性及减少肌肤皱纹,具有较好的抗衰老效果。
附图说明
图1咪唑基表面活性剂的质量分数与界面张力关系图;
图2不同间充质干细胞外泌体组合物抑制黑色素合成能力的对比图。
具体实施方式
下面将结合本申请实施例,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
咪唑CAS号288-32-4;1-氯己醇CAS号2009-83-8;三乙胺CAS号121-44-8;硫酸钠CAS号7757-82-6;四丁基溴化铵CAS号1643-19-2;二氯亚砜CAS号7719-09-7;氯化钠CAS号7647-14-5;氢氧化钠CAS号1310-73-2;十二烷基二甲基叔胺CAS号112-18-5;马来酸酐CAS号108-31-6;乙醇CAS号64-17-5;正丙醇CAS号71-23-8;乙酸乙酯CAS号141-78-6;石油醚CAS号8032-32-4;二氯甲烷CAS号75-09-275-09-2;N,N-二甲基甲酰胺CAS号68-12-2;异丙醇CAS号67-63-0;所有化学试剂均为市售。
实施例1咪唑基表面活性剂的制备
1.1化合物2的制备
按照1:1:0.5摩尔比称取一定量的咪唑、1-氯己醇、三乙胺加入到N,N-二甲基甲酰胺溶液(5mL/1g咪唑)中,升温至80℃,反应12h,反应完成后,自然冷却至室温,过滤,向滤液中加入与N,N-二甲基甲酰胺相同体积的硫酸钠水溶液和N,N-二甲基甲酰胺溶液二倍量的二氯甲烷溶液进行萃取,水相用二氯甲烷反萃一次,合并有机相,干燥后减压浓缩得到化合物2,ESI(m/z):169.1[M+H]
1.2化合物3的制备
按照1:0.2摩尔比称取一定量的化合物2、四丁基溴化铵加入到石油醚溶液(5mL/1g化合物2)中,搅拌混合均匀,加热至40℃,使用恒压滴液漏斗缓慢滴加二氯亚砜(化合物2与二氯亚砜的摩尔比为1:1.1),滴加速度约1滴/2秒,滴加完成后,升温至60℃,反应3h,反应完成后,自然冷却至室温,依次用饱和食盐水、5%的氢氧化钠水溶液、蒸馏水洗至中性,收集石油醚溶液,干燥后减压浓缩得到化合物3,ESI(m/z):187.1[M+H]
1.3化合物4的制备
按照1:1.5摩尔比称取一定量的化合物3、十二烷基二甲基叔胺加入到异丙醇溶液(5mL/1g化合物3)中进行季铵化反应,升温至83℃,回流反应10h,反应结束后,自然冷却至室温,减压蒸除溶剂,残余物用无水乙醇结晶得到化合物4,ESI(m/z):364.3[M-Cl]
1.4化合物5的制备
化合物5-1的制备:
按照1:1摩尔比称取一定量的马来酸酐、正丙醇加入到反应容器内,先加热至60℃使马来酸酐熔化,再继续升温至90℃反应6h,反应结束后,自然冷却至室温,粗品产物用乙酸乙酯和石油醚(体积比1:1)的混合溶液重结晶得到化合物5-1,ESI(m/z):159.1[M+H]
化合物5-2的制备:
具体操作步骤参照化合物5-1的制备,其中将正丙醇替换成正丁醇,反应温度为90℃,反应时间为4.5h,制得化合物5-2,ESI(m/z):173.1[M+H]
化合物5-3的制备:
具体操作步骤参照化合物5-1的制备,其中将正丙醇替换成正戊醇,反应温度为90℃,反应时间为5h,制得化合物5-3,ESI(m/z):187.1[M+H]
1.5咪唑基表面活性剂的制备
咪唑基表面活性剂化合物1-1的制备:
/>
按照1:1摩尔比称取一定量的化合物4、化合物5-1加入到二氯甲烷溶液中,升温至30℃反应16h,反应结束后,自然冷却至室温,减压蒸除溶剂,残余物用乙酸乙酯结晶得到化合物1-1,ESI(m/z):522.4[M-Cl]
咪唑基表面活性剂化合物1-2的制备:
具体操作步骤参照化合物1-1的制备,其中将化合物5-1替换成化合物5-2,反应温度为35℃,反应时间为15h,制得化合物1-2,ESI(m/z):536.4[M-Cl]
咪唑基表面活性剂化合物1-3的制备:
具体操作步骤参照化合物1-1的制备,其中将化合物5-1替换成化合物5-3,反应温度为35℃,反应时间为16h,制得化合物1-3,ESI(m/z):550.4[M-Cl]
1.4咪唑基表面活性剂化合物1-1、1-2、1-3的性能测试
油水界面张力测试:分别配制质量分数为1×10
乳化能力测试:分别配制出质量分数为0.1%的咪唑基表面活性剂化合物1-1、1-2、1-3、十二烷基苯磺酸钠(LAS)、十二烷基三甲基溴化铵(DTAB)的水溶液备用,向100mL具塞量筒中加入20ml配制好的咪唑基表面活性剂化合物1-1、1-2、1-3的水溶液和20mL石蜡油(正己烷),塞紧玻璃塞,上下剧烈震荡20次左右,水平静置1min后,再震荡20次,静置1min,重复该震荡、静置过程5-6次,可以发现混合体系中的水相和油相逐渐分层,将分出10ml水所用的时间记录下来,作为衡量乳化性能好坏的标准,并比较不同咪唑基表面活性剂化合物1-1、1-2、1-3的分水时间,时间越长则说明表面活性剂的乳化能力越强;结果如表1所示。
表1咪唑基表面活性剂的乳化性能
由表1结果可知,咪唑基表面活性剂化合物1-1、1-2、1-3的分水时间远远大于LAS、DTAB的分水时间,说明咪唑基表面活性剂化合物1-1、1-2、1-3的乳化性能明显优于普通表面活性剂(LAS、DTAB),其中咪唑基表面活性剂化合物1-2的乳化性能最好。
实施例2
本实施例提供一种间充质干细胞外泌体组合物的制备方法,包括以下步骤:
S1、将第8代的脐带来源的间充质干细胞按照5×10
S2、将上清液1在4℃,200g条件下离心5min,得到上清液2,将上清液2用5000g离心10min,得到上清液3,将上清液3通过100000NWCO超滤膜进行超滤,所得滤液用孔径为0.2μm的无菌过滤膜过滤除菌,获得间充质干细胞外泌体;
S3、将木犀草素的无水甲醇溶液与间充质干细胞外泌体按照质量比1:4充分混合,向混合体系中加入占混合体系质量0.5%的咪唑基表面活性剂,搅拌均匀,得到混合液;其中木犀草素在无水甲醇溶液中的质量占比为10%,咪唑基表面活性剂为化合物1-2,结构式如下:
;/>
S4、在冰浴的条件下,将所得混合液进行超声处理1min,将超声后的混合液用5000g离心20min,得到上清液,再用孔径为0.2μm的无菌滤膜过滤除菌,得到间充质干细胞外泌体组合物;其中超声频率为90KHz,超声功率为0.8W/cm
实施例3
本实施例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S1中间充质干细胞的培养条件不同,包括以下步骤:
S1、将第5代的脐带来源的间充质干细胞按照10×10
S2、与实施例2中步骤S2相同;
S3、与实施例2中步骤S3相同;
S4、与实施例2中步骤S4相同。
实施例4
本实施例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S2中间充质干细胞外泌体的制备方法不同,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、将上清液1在8℃,100g条件下离心10min,得到上清液2,将上清液2用2000g离心30min,得到上清液3,将上清液3通过100000NWCO超滤膜进行超滤,所得滤液用孔径为0.2μm的无菌过滤膜过滤除菌,获得间充质干细胞外泌体;
S3、与实施例2中步骤S3相同;
S4、与实施例2中步骤S4相同。
实施例5
本实施例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S3中混合体系中咪唑基表面活性剂的含量、木犀草素的无水醇溶液及其与间充质干细胞外泌体的配比不同,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、与实施例2中步骤S3相同;
S3、将木犀草素的无水乙醇溶液与间充质干细胞外泌体按照质量比1:3充分混合,向混合体系中加入占混合体系质量0.8%的咪唑基表面活性剂,搅拌均匀,得到混合液;其中木犀草素在无水甲醇溶液中的质量占比为10%,咪唑基表面活性剂为化合物1-2,结构式如下:
;
S4、与实施例2中步骤S4相同。
实施例6
本实施例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S4中超声处理条件不同,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、与实施例2中步骤S2相同;
S3、与实施例2中步骤S3相同;
S4、在冰浴的条件下,将所得混合液进行超声处理5min,将超声后的混合液用5000g离心20min,得到上清液,再用孔径为0.2μm的无菌滤膜过滤除菌,得到间充质干细胞外泌体组合物;其中超声频率为30KHz,超声功率为0.2W/cm
对比例1
本对比例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S3中使用表面活性剂为吐温-80,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、与实施例2中步骤S2相同;
S3、将木犀草素的无水甲醇溶液与间充质干细胞外泌体按照质量比1:4充分混合,向混合体系中加入占混合体系质量0.5%的吐温-80,搅拌均匀,得到混合液;其中木犀草素在无水甲醇溶液中的质量占比为10%;
S4、与实施例2中步骤S4相同。
对比例2
本对比例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,步骤S3中不使用任何表面活性剂,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、与实施例2中步骤S2相同;
S3、将木犀草素的无水甲醇溶液与间充质干细胞外泌体按照质量比1:4充分混合均匀,得到混合液;其中木犀草素在无水甲醇溶液中的质量占比为10%;
S4、与实施例2中步骤S4相同。
对比例3
本对比例提供一种间充质干细胞外泌体组合物的制备方法,与实施例2相比,通过物理混合制得间充质干细胞外泌体组合物,包括以下步骤:
S1、与实施例2中步骤S1相同;
S2、与实施例2中步骤S2相同;
S3、将木犀草素与间充质干细胞外泌体按照质量比1:1充分混合均匀,得到间充质干细胞外泌体组合物;
相关实验
1.间充质干细胞外泌体对天然抗氧化剂木犀草素荷载率的测定
将实施例2-6及对比例1-2中得到的间充质干细胞外泌体组合物分别用丙酮重悬,破坏外泌体的结构,使蛋白变性沉淀;用1000G离心15min,取上清液,在旋转蒸发仪上将上清液浓缩干燥,使用甲醇重新溶解;HPLC检测木犀草素的含量,色谱柱为ZORBAXSB-C18柱(250mm×4.6mm,5μm),流动相为甲醇-0.5%磷酸溶液(体积比为70∶30),流速为1.0mL/min,进样量为10μL,柱温为30℃,检测波长(λ)为348nm;将检测到的木犀草素的含量与初始木犀草素的含量做比值,即得到间充质干细胞外泌体对天然抗氧化剂木犀草素的荷载率,结果如表2所示。
表2间充质干细胞外泌体对天然抗氧化剂木犀草素的荷载率
由表2结果可知,实施例2-6制得的间充质干细胞外泌体对木犀草素的荷载率明显大于对比例1-2;其中实施例2的荷载率高达50.1%,与对比例1(使用表面活性剂为吐温-80)、对比例2(不使用任何表面活性剂)相比,实施例2中所使用的表面活性剂为咪唑基表面活性剂化合物1-2能够有效促进外泌体对木犀草素的荷载,由于化合物1-2具有良好的润湿、乳化作用,可以快速形成水包油的纳米乳结构,从而将木犀草素分子与外泌体挤压在一起,同时在超声的作用下,液体中的微小泡核被激活,形成空化泡,空化泡崩溃瞬间产生高温高压和激流使外泌体的双分子膜穿孔,从而增加外泌体膜的通透性,促进被挤压在一起的木犀草素分子快速进入外泌体中,当超声强度适当时,外泌体膜产生的孔可在一定时间内自我修复,双分子膜结构恢复正常,从而形成外泌体对木犀草素的有效包裹或荷载。
2.间充质干细胞外泌体组合物抑制黑色素合成能力的测定
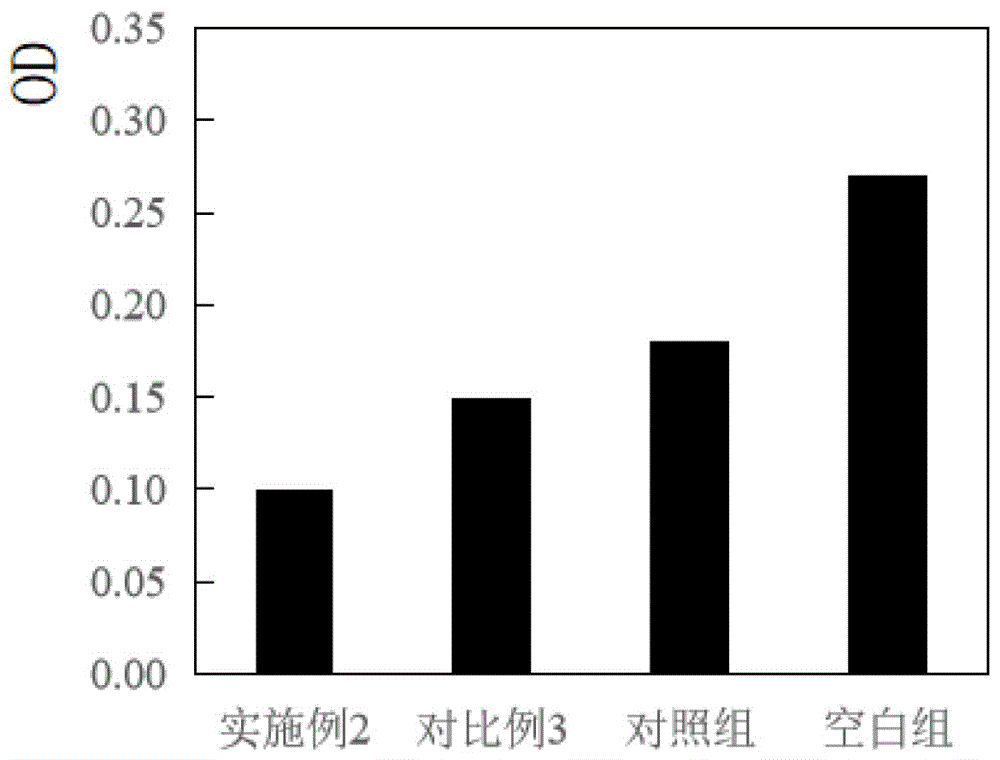
取B16黑色素细胞系传代培养,接种6小时候后,分别添加10μg/mL实施例2、对比例3制备得到的间充质干细胞外泌体组合物,对照组添加10μg/mL的木犀草素,空白组不添加任何物质,培养48小时;将培养到期的B16细胞用0.25%胰酶消化后,用磷酸缓冲盐溶液清洗,并在800g条件下离心10s,按照清洗离心的顺序共进行2次,用磷酸缓冲盐溶液调节细胞密度至10
结果如图2所示,实施例2制得的间充质干细胞外泌体组合物抑制黑色素合成能力明显高于对比例3(通过物理混合制得的间充质干细胞外泌体组合物)、对照组(木犀草素)及空白组,说明实施例2中通过乳化超声,能使间充质干细胞外泌体有效包裹木犀草素,外泌体作为木犀草素的载体,其双层膜结构能够携带木犀草素高效的穿过黑色素细胞膜,充分发挥该组合物中各有效成分抑制黑色素合成的作用,减少了黑色素累积,延缓了皮肤的衰老。
3.间充质干细胞外泌体组合物的皮肤抗衰老实验
精华液1的制备:按照百分配比将10%间充质干细胞外泌体组合物(由实施例2通过乳化超声制得)、3%甘油、0.3%聚丙烯酸钠、0.05% EDTA-2NA、0.5%苯氧乙醇、余量为去离子水直接混合均匀,得到精华液1;
精华液2的制备:按照百分配比将10%间充质干细胞外泌体组合物(由对比例3通过物理混合制得)、3%甘油、0.3%聚丙烯酸钠、0.05% EDTA-2NA、0.5%苯氧乙醇、余量为去离子水直接混合均匀,得到精华液2;
精华液3的制备:按照百分配比将3%甘油、0.3%聚丙烯酸钠、0.05% EDTA-2NA、0.5%苯氧乙醇、余量为去离子水直接混合均匀,得到精华液3;
选取年龄在30-50岁之间的150名志愿者,平均分成A组,B组,C组3组。要求A组志愿者每天早晚在脸上使用精华液1(含有实施例2通过乳化超声制备的间充质干细胞外泌体组合物),B组(对照组)志愿者每天早晚在脸上使用精华液2(含有对比例3通过物理混合制备的间充质干细胞外泌体组合物),C组(空白组)志愿者每天早晚在脸上使用精华液3(不含间充质干细胞外泌体组合物);使用前和使用1周、2周、4周时随访,随访时间为日间的同一时间,测试前受试者需在恒温恒湿(室温22±2℃、相对湿度45±5%)环境下静坐20min,然后通过MPA580皮肤弹性测试仪和PROMOS PICO皮肤皱纹检测仪对受试者面部进行检测和分析。表3为A、B、C组志愿者在不同时间节点,肌肤弹性测试结果平均值,其中R2表示皮肤总弹性,R5表示皮肤净弹性,R2、R5数值越大则表示皮肤弹性越大;表4为A、B、C组志愿者在不同时间节点,肌肤皱纹测试结果平均值,其中Sa、Sq、Sk、Sv、Wd为皱纹深度因子,用于表征皱纹深浅,Sa、Sq、Sk、Wd与皱纹深度正相关,Sv与皱纹深度负相关;aWa、pWa为皱纹面积因子,与皱纹面积正相关;Wv为皱纹严重程度综合因子,与皱纹严重程度正相关。
表3肌肤弹性测试结果
由表3结果可知,使用前、使用1周、2周、4周后的MPA580皮肤弹性测试仪测试的R2和R5数值,A组(精华液1,含有实施例2通过乳化超声制备的间充质干细胞外泌体组合物)、B组(精华液2,含有对比例3通过物理混合制备的间充质干细胞外泌体组合物))的R2、R5值在逐渐升高,C组(精华液3,不含间充质干细胞外泌体组合物)的R2、R5值基本无变化,且A组的R2、R5值的升高速度明显高于B组,说明了A组中所使用的通过乳化超声形成的外泌体包裹木犀草素的组合物,能够高效进入细胞中发挥作用,提高了组合物中各有效成分的生物利用率,有效提升了皮肤弹性,且提升皮肤弹性的效果明显优于B组中通过物理混合形成的外泌体、木犀草素单一存在的组合物。
表4肌肤皱纹测试结果
/>
由表4结果可知,使用前、使用1周、2周、4周后PROMOS PICO皮肤皱纹检测仪测试的数值,A组(精华液1,含有实施例2通过乳化超声制备的间充质干细胞外泌体组合物)、B组(精华液2,含有对比例3通过物理混合制备的间充质干细胞外泌体组合物)的各皱纹正相关因子(Sa、Sq、Sk、Wd、aWa、pWa、Wv)随使用时间有明显下降,皱纹负相关因子(Sv)则随使用时间有明显上升,而C组(精华液3,不含间充质干细胞外泌体组合物)的各数据仅有微小变化,而且A组的下降或上升的幅度明显优于B组,同样说明了A组中所使用的通过乳化超声形成的外泌体包裹木犀草素的组合物,能够高效进入细胞中发挥作用,提高了组合物中各有效成分的生物利用率,有效减少了肌肤皱纹,且减少肌肤皱纹的效果明显优于B组中通过物理混合形成的外泌体、木犀草素单一存在的组合物。
需要说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
