一种抗PD-L1纳米抗体及其用途
文献发布时间:2023-06-19 19:30:30
本申请是申请日为2020年11月20日、申请号为202011309419.7、发明名称为“一种抗PD-L1纳米抗体及其用途”的专利的分案申请。
相关申请的交叉引用
本申请要求于2019年12月5日申请的专利申请号为CN201911235055.X且发明名称为“一种含有TGF-β抑制剂的三功能融合蛋白及其应用”的优先权,其全部内容通过引用并入本文。
技术领域
本发明属于生物医药领域,更具体地,本发明涉及一种抗PD-L1纳米抗体及其Fc融合蛋白,以及该抗PD-L1纳米抗体及其Fc融合蛋白的用途。
背景技术
在经典免疫监视理论中,免疫系统可以识别肿瘤抗原并将其消除。如果免疫系统能够完全消除肿瘤细胞,那么免疫清除可以稳定进行。如果肿瘤细胞通过突变逃避免疫系统的清除,免疫系统将会进行重新平衡。在这一过程中,肿瘤细胞的免疫原性逐渐降低。肿瘤细胞的增殖能力在免疫系统的压力下变弱,使得肿瘤细胞的侦测变得更为困难。
致癌基因的激活导致肿瘤细胞改变自身及肿瘤微环境,使得免疫系统和肿瘤细胞间的平衡被打破。当免疫系统和肿瘤细胞进入逃逸阶段,肿瘤细胞的恶性程度会提高,而肿瘤细胞丢失MHC分子使其避免被免疫细胞识别和消除。肿瘤微环境也可以通过释放免疫抑制因子抑制免疫系统,例如IL-10、TGF-β等。肿瘤细胞表面也会高表达免疫抑制蛋白(例如程序化死亡配体-1、PD-L1),当效应T细胞与肿瘤细胞结合时,PD-L1与PD-1相互作用并诱导T细胞发生凋亡,这是肿瘤对免疫系统产生耐受的主要原因之一,肿瘤迅速生长,发生转移。如果人为激活宿主的免疫系统并将其重定向到肿瘤细胞,从理论上来讲肿瘤组织就能够被清除,而免疫治疗的理论已经在临床治疗中得到广泛证明。
免疫疗法可分为两类:特异性治疗和非特异性治疗。在类别中特定疗法,包括以下治疗策略:肿瘤疫苗通过注射肿瘤激活免疫细胞对患者的抗原。肿瘤疫苗包括:灭活的肿瘤细胞疫苗,肿瘤抗原疫苗,肿瘤DNA疫苗,树突状细胞(DC)疫苗和细菌疫苗。特异性ACT免疫疗法主要包括三种治疗方法:
a)肿瘤浸润淋巴细胞(TIL):淋巴细胞从肿瘤组织中分离并在体外培养。TIL可以分泌具有特异性抗肿瘤的IL-2能力。
b)T细胞受体(TCR)治疗:T细胞识别肿瘤抗原通过其单链抗体片段(scFv),并将单链抗体片段TCR通过病毒载体克隆到正常T细胞中。因此,正常T细胞变为特异性肿瘤杀伤T细胞。
c)CAR-T:T细胞通过基因修饰获得具有肿瘤特异性受体T细胞。与常规T细胞识别机制不同,CAR-T细胞识别肿瘤抗原不受到MHC分子的限制。因此,CAR-T细胞能够通过增加共刺激信号分子克服肿瘤的免疫逃逸机制,增强T细胞对肿瘤细胞的杀伤能能力。
在非特异性ACT免疫疗法中,有两种主要应用治疗方法:分别为淋巴因子激活的杀手(lymphokine activated killer,LAK)细胞治疗和细胞因子诱导的杀手(cytokineinduced killer,CIK)细胞治疗。
a)LAK细胞治疗:LAK细胞一方面利用IL-2刺激外周血淋巴细胞中的免疫细胞,包括NK细胞和T细胞等,另一方面通过过表达FAS配体,增强对靶细胞的识别能力,并通过释放穿孔素和颗粒酶细胞杀死肿瘤细胞。
b)CIK细胞治疗:CIK细胞来源于病人或健康人的外周血淋巴细胞(PBL),在体外条件下受到抗CD3抗体、IFN-γ和IL-2刺激下扩增。CIK细胞主要通过FasL和穿孔素发挥抗肿瘤的作用。
免疫检查点是人体免疫系统中的保护性分子,在正常机体中防止由于T细胞过度活化引起的炎性损伤。肿瘤细胞能够利用这一特性,过度表达免疫检查点分子,抑制机体的免疫反应,逃避人体免疫系统的监视和杀伤,从而促进肿瘤细胞的生长。免疫检查点抑制剂治疗可以通过抑制肿瘤微环境中的免疫检查点活性,重新激活T细胞对肿瘤的免疫应答反应,实现抗肿瘤的效果。T细胞的完全活化受“双信号”系统调节:第一信号来自其自身TCR(T细胞受体)与抗原的MHC的特异性结合,即T细胞识别抗原;第二信号来自共刺激分子,该信号参与由抗原呈递细胞(APC)表达的共刺激分子与T细胞表面上的相应受体或配体(例如CD28)的相互作用。例如CD28-B7是正向共刺激信号,而负向共刺激分子主要是CTLA4-B7途径和PD-1/PD-L1途径。在肿瘤细胞侵入后,这种抑制途径被肿瘤细胞利于抑制T细胞活化,从而逃避免疫系统的清除作用。
PD-1(CD279)最早于1992年被报道,人PD-1编码基因PDCD1位于2q37.3,全长2097bp,由6个外显子组成,翻译产物为288个氨基酸组成的PD-1前体蛋白,剪切前20个氨基酸组成的信号肽后得到成熟蛋白质。PD-1包括胞外免疫球蛋白可变区IgV结构域,疏水跨膜结构域和胞内结构域,胞内尾部结构域N端ITIM基序包含2个磷酸化位点,C端则是一个ITSM基序。PD-1是膜蛋白,属于CD28免疫球蛋白超家族,主要表达在激活后的T细胞表面,此外还在胸腺的CD4-CD8-T细胞、活化的NK细胞和单核细胞有低丰度表达。PD-1有2个配体,分别是B7蛋白家族的PD-L1(CD274,B7-H1)和PD-L2(CD273,B7-DC),PD-L1和PD-L2氨基酸序列有40%相同。两者区别主要在于表达模式不同,PD-L1组成性的低表达于APC、非造血细胞(如血管内皮细胞、胰岛细胞)和免疫豁免部位(如胎盘、睾丸和眼睛),炎性细胞因子如I型和II型干扰素、TNF-α和VEGF等均可以诱导PD-L1的表达。PD-L2则只在被激活的巨噬细胞和树突细胞中有表达。PD-1与PD-L1在激活的T细胞结合后,PD-1的ITSM基序发生酪氨酸磷酸化,进而导致下游蛋白激酶Syk和PI3K的去磷酸化,抑制下游AKT、ERK等通路的活化,最终抑制T细胞活化所需基因及细胞因子的转录和翻译,发挥负向调控T细胞活性的作用。
在肿瘤细胞中,肿瘤细胞及肿瘤微环境通过上调PD-L1表达并与肿瘤特异的CD8+T细胞表面的PD-1结合,负调控T细胞活性,抑制免疫反应。肿瘤细胞可以通过以下4种途径上调PD-L1表达:1.编码PD-L1的基因扩增(9p24.1);2.EGFR、MAPK、PI3K-Akt信号通路激活,HIF-1转录因子等可以从转录水平上调PD-L1表达;3.EB病毒的诱导(EB病毒阳性的胃癌和鼻咽癌表现为PD-L1高表达);以及4.表观遗传学的调控。在肿瘤微环境中,干扰素-γ等炎症因子的刺激同样可以诱导PD-L1和PD-L2的表达。炎症因子可以诱导肿瘤微环境中其他细胞,包括巨噬细胞、树突状细胞和基质细胞表达PD-L1和PD-L2,而能够识别肿瘤抗原的肿瘤浸润性T细胞能够分泌干扰素-γ,进而诱导PD-L1表达上调,这一过程被称为“适应性免疫抵抗”,肿瘤细胞通过这一机制可以实现自我保护。有越来越多的证据表明肿瘤利用PD-1依赖的免疫抑制免疫逃避。在各种实体瘤和血液系统恶性肿瘤种均已经发现PD-L1和PD-L2的高表达。此外,PD-Ls的表达与肿瘤细胞的不良预后之间具有很强相关性,证明了包括食道癌、胃癌、肾癌、卵巢癌、膀胱癌、胰腺癌和黑色素瘤等。
目前FDA已经批准上市的PD-1治疗性单抗包括Nivolumab(Opdivo,2014年9月)、Pembrolizumab(Keytruda,2014年12月)和Cemiplimab(Libtayo,2018年9月),并且已上市的PD-L1治疗性单抗包括Atezolizumab(Tecentriq,2014年9月)、Avelumab(Bavencio,2016年5月)和Duravulumab(Imfinzi,2017年5月),已批准的适应症见下表所示。
此外还有诸如Pidilizumab、AMP-224、AMP-514和PDR001等的PD-1单抗、以及诸如BMS-936559和CK-301等的PD-L1单抗处于研发和临床试验中。
然而,在现有的单抗中,亲和力并未达到理想状态,并且由于体积较大,因而免疫原性较强。
发明内容
本发明的目的在于根据本领域的现有需求,提供一种新型的抗PD-L1纳米抗体及其Fc融合蛋白,以及该抗PD-L1纳米抗体及其Fc融合蛋白的用途。
在一方面,本发明提供了一种抗PD-L1纳米抗体及其衍生物,其特征在于,所述抗PD-L1纳米抗体至少包含一个VHH片段,在所述VHH片段中,包含CDR1、CDR2和CDR3三个氨基酸片段,并且CDR1、CDR2和CDR3分别具有以下氨基酸序列:
/>
进一步地,根据本发明的抗PD-L1纳米抗体,其特征在于,所述抗PD-L1纳米抗体的氨基酸序列如SEQ ID NO:1至SEQ ID NO:20所示。
进一步地,根据本发明的抗PD-L1纳米抗体,其特征在于,在所述抗PD-L1纳米抗体的氨基酸序列中,除CDR1、CDR2和CDR3以外,有至少80%(例如90%、95%、98%、99%或99.9%等)的氨基酸序列与SEQ ID NO:1至SEQ IDNO:20所示的氨基酸序列相同。
进一步地,根据本发明的抗PD-L1纳米抗体,其特征在于,所述衍生物来源于与多肽的融合,包括血清白蛋白及片段、或血清白蛋白结合蛋白;与FCRn结合蛋白的融合;以及与诸如聚乙二醇的聚合物的化学偶联。
另一方面,本发明还提供了一种抗PD-L1纳米抗体的Fc融合蛋白,其特征在于,所述抗PD-L1纳米抗体的Fc融合蛋白包含如上所述的抗PD-L1纳米抗体以及Fc段,所述Fc段选自由人IgG1、IgG2、IgG3、IgG4及其突变体组成的组,例如SEQ ID NO:61或SEQ ID NO:62所示。
另一方面,本发明还提供了一种人源化抗PD-L1纳米抗体及其衍生物,其特征在于,所述人源化抗PD-L1纳米抗体通过对如上所述的抗PD-L1纳米抗体进行修饰而得到,并且具有SEQ ID NO:43至SEQ ID NO:57所示的氨基酸序列。
另一方面,本发明还提供了一种人源化抗PD-L1纳米抗体的Fc融合蛋白,其特征在于,所述人源化抗PD-L1纳米抗体的Fc融合蛋白包含如上所述的抗PD-L1纳米抗体以及Fc段,所述Fc段选自由人IgG1、IgG2、IgG3、IgG4及其突变体组成的组,例如SEQ ID NO:61或SEQ ID NO:62所示。
进一步地,根据本发明的人源化抗PD-L1纳米抗体,其特征在于,所述衍生物来源于与多肽的融合,包括血清白蛋白及片段、或血清白蛋白结合蛋白;与FCRn结合蛋白的融合;以及与诸如聚乙二醇的聚合物的化学偶联。
另一方面,本发明还提供了如上所述的抗PD-L1纳米抗体或其Fc融合蛋白、以及人源化抗PD-L1纳米抗体或其Fc融合蛋白在制备用于阻断PD-L1和PD-1结合的试剂盒中的用途。
另一方面,本发明还提供了如上所述的抗PD-L1纳米抗体或其Fc融合蛋白、以及人源化抗PD-L1纳米抗体或其Fc融合蛋白在制备用于抑制肿瘤生长的药物中的用途。
另一方面,本发明还提供了如上所述的抗PD-L1纳米抗体或其Fc融合蛋白、以及人源化抗PD-L1纳米抗体或其Fc融合蛋白在制备用于治疗癌症、感染或免疫调节疾病的药物中的用途。
进一步地,根据本发明的用途,其特征在于,所述癌症或肿瘤为结直肠癌、乳腺癌、卵巢癌、胰腺癌、胃癌、食管癌、前列腺癌、肾癌、宫颈癌、骨髓癌、淋巴癌、白血病、甲状腺癌、子宫内膜增生、子宫癌、膀胱癌、神经内分泌肿瘤、头颈癌、肝癌、鼻咽癌、睾丸癌、小细胞肺癌、非小细胞肺癌、黑素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤,或者骨髓增生异常综合症。
本发明的有益效果
本发明的抗PD-L1纳米抗体及其Fc融合蛋白的特异性强,亲和力高,对人的免疫原性弱,具有显著的抗肿瘤效果。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
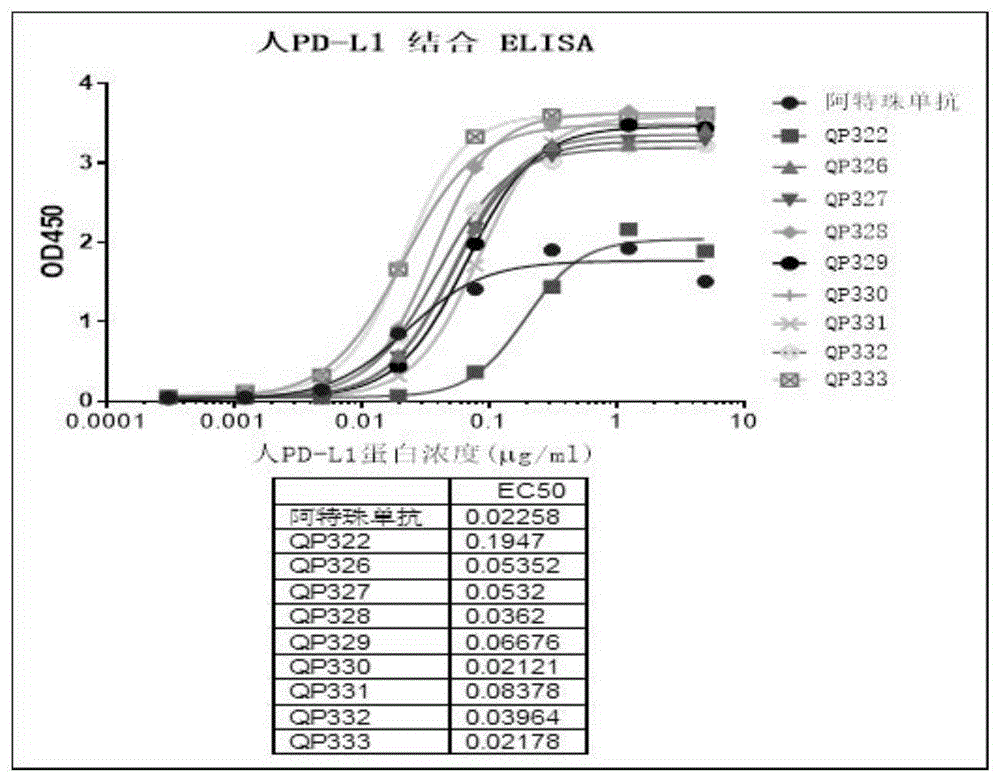
图1示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP326-QP333对人PD-L1蛋白结合的结果;
图2示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP334-QP341对人PD-L1蛋白结合的结果;
图3示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP342-QP345对人PD-L1蛋白结合的结果;
图4示出了FACS检测PD-L1纳米抗体Fc融合蛋白对天然表达人PD-L1的人非小肺癌细胞HCC827的结合的结果;
图5示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP326-QP335阻断人PD-L1和PD-1蛋白结合的结果;
图6示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP336-QP345阻断人PD-L1和PD-1蛋白结合的结果;
图7示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP326-QP329、以及QP331-QP333阻断人PD-L1和CD80蛋白结合的结果;
图8示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP334、QP341、以及QP343-QP345阻断人PD-L1和CD80蛋白结合的结果;
图9示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP326-QP329、以及QP331-QP333对食蟹猴PD-L1蛋白结合的结果;
图10示出了ELISA检测PD-L1纳米抗体Fc融合蛋白QP334、QP341、以及QP343-QP345对食蟹猴PD-L1蛋白结合的结果;
图11示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP341、以及QP508-QP512对人PD-L1蛋白结合的结果;
图12示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP344、以及QP513-QP517对人PD-L1蛋白结合的结果;
图13示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP332、以及QP518-QP522对人PD-L1蛋白结合的结果;
图14示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP341、以及QP508-QP512阻断人PD-L1和PD-1蛋白结合的结果;
图15示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP344、以及QP513-QP517阻断人PD-L1和PD-1蛋白结合的结果;
图16示出了ELISA检测人源化PD-L1纳米抗体Fc融合蛋白QP332、以及QP518-QP522阻断人PD-L1和PD-1蛋白结合的结果;
图17示出了通过ELISA检测人源化PD-L1纳米抗体的Fc融合蛋白对食蟹猴PD-L1蛋白结合的结果;
图18示出了通过ELISA检测人源化PD-L1纳米抗体的Fc融合蛋白QP509及QP3447对人PD-L1蛋白结合的结果;
图19示出了通过ELISA检测人源化PD-L1纳米抗体的Fc融合蛋白阻断人PD-L1蛋白与PD-1蛋白结合的结果;
图20示出了通过FACS检测PD-L1纳米抗体FC融合蛋白QP3447结合天然表达人PD-L1的人非小肺癌细胞HCC827的结果;
图21至图24示出了人源化纳米抗体Fc融合蛋白QP509和QP3447在混合淋巴细胞反应中促进T细胞增殖的结果;
图25和图26示出了在转基因鼠模型中评价抗PD-L1纳米抗体对肿瘤生长的抑制作用的结果。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本实施方式中未注明具体条件的实验方法,通常是按照常规条件,或按照原料或商品制造厂商所建议的条件。如分子克隆,实验室手册,冷泉港实验室,当代分子生物学方法,细胞生物学等等。未注明具体来源的试剂,为市场购买的常规试剂。
实施例1:羊驼免疫以及构建噬菌体免疫库
羊驼免疫:用PD-L1胞外区重组蛋白(义翘神州,10084-H08H)免疫一只健康羊驼(vicugnapacos,alpaca,lamapacos),每次免疫0.11mg蛋白,总共5次,首次使用弗式完全佐剂CFA,第2到第5次均使用弗式不完全佐剂IFA乳化与抗原混合后皮下多点注射。
建库:取50ml外周血分离外周血单个核细胞(PBMC),提取PBMC总RNA,RT-PCR反转录成cDNA,设计引物PCR扩增VHH基因,建免疫库。外周血淋巴细胞分离,采集50mL外周血,按照淋巴细胞分离液使用说明分离PBMC,用TRIzol试剂提取PBMC总RNA。反转录,参见
实施例2:纳米抗体免疫库筛选鉴定
用PDL1胞外区重组蛋白筛选2轮。
第一轮淘筛:在免疫管中,分别包被PDL1-hFc(蛋白编号QP004)和hFc蛋白,50nM,1ml,4℃过夜。封闭:2%Milk/PBS封闭免疫管,37℃,1小时。消减:倒掉封闭液,在包被hFc免疫管中,加入900μl 2%Milk/PBS,再加入100ul噬菌体免疫库,室温旋转1小时。结合:将噬菌体免疫库转移至包被PDL1-hFc的免疫管中,室温旋转1小时。洗涤:1×PBST洗免疫管5遍,1×PBS洗免疫管5遍。洗脱:800μl 100mM TEA,室温10min。中和:转移洗脱液至1.5ml EP管中,加入400μl 1M pH 7.4Tris。侵染:中和后的洗脱噬菌体,加入到10ml OD600=0.5的TG1中。37℃4min。测滴度,其余菌液涂大平板。37℃,培养过夜。第一轮淘筛输出:3.7E+06。
包装噬菌体库:2×TY培养基刮菌,菌接种到50ml 2×TY培养基+Amp+1%葡萄糖至OD约为0.1,37℃200rpm,生长约1小时20分至OD约为0.4-0.6。加入500μl M13KO7,37℃感染40min,离心去上清,沉淀重悬100ml 2×TY培养基+Amp+Kana,30℃200rpm过夜。收集噬菌体库:离心过夜培养的菌液,取上清,加入1/4体积的5×PEG/NaCl。4℃离心20min,弃上清,重新离心,吸弃多余的上清,每50ml上清加入1ml PBS重悬吞噬体沉淀,13000g离心10min,将上清转移至新的EP管。此为第二轮的噬菌体库输入噬菌体,用于接下来的淘筛。
第二轮(2nd)淘筛:在免疫管中,分别包被PDL1-hFc(蛋白编号QP004)10nM和hFc蛋白50nM,2ng/μl,1ml,4℃过夜。封闭:2%Milk/PBS封闭免疫管,37℃,1小时。消减:倒掉封闭液,在包被hFc免疫管中,加入2ml 2%Milk/PBS,再加入400μl输入噬菌体,室温旋转1小时。结合:将上清转移至包被PDL1-hFc的免疫管中,室温旋转1小时。清洗:1×PBST洗免疫管10遍,再用1xPBS洗免疫管10遍。洗脱:800μl 100mM TEA,室温10min。中和:转移洗脱液至1.5ml EP管中,加入400μl 1M pH 7.4Tris。侵染:中和后的洗脱噬菌体,加入到10ml OD600=0.5的TG1中。37℃4min。测滴度,其余菌液涂大平板。37℃,培养过夜。第二轮的淘筛结果:8.5E+08。
免疫库筛选鉴定:经过2轮淘筛,挑取单克隆进行噬菌体ELISA,筛选结合PDL1的阳性克隆。将阳性克隆测序,获得抗体PD-L1抗体的VHH序列。
VHH抗体分泌表达:在96孔板中,每孔150μl 2×YT+氨苄西林+1%葡萄糖培养基中,接种第二轮筛选的单克隆,37℃培养3小时。取50μl转移到新的96孔板,加入25μl 50%甘油,冻存。在原板中,加入2×YT+氨苄西林+3mM IPTG,50μl/孔。30℃,220r培养过夜。
结合ELISA:包被PDL1-hFc(蛋白编号QP004)2μg/ml,50μl/孔,4℃过夜。3%BSA封闭ELISA板,37℃,1小时。离心过夜培养菌液,取上清转移至新96孔板中。在PDL1-hFc板中,孵育上清25μl/孔+5%BSA25μl/孔,RT,1h。PBST 3次,PBS 6次。孵育二抗:HRP-抗HA(1:5000),50ul/孔,RT,1h。PBST 6次,PBS 3次。TMB显色,H
阻断ELISA:包被PD1-hFc蛋白(蛋白编号QP1138)5μg/ml,50μl/孔,4℃过夜。3%BSA封闭ELISA板,37℃,1小时。离心过夜培养菌液,取上清转移至新96孔板中。将上清和Biotin-PDL1-FC(蛋白编号Biotin-QP004.3)蛋白0.3μg/ml按照1:1比例混合,50μl/孔,RT,1h。PBST 3次,PBS 6次。孵育二抗:HRP-链霉亲和素(1:5000),50μl/孔,RT,1h。PBST 6次,PBS 3次。TMB显色,H
阳性克隆ELISA结果如下表1所示:
表1
选择与PDL1-hFc(蛋白编号QP004)结合阳性,阻断PD1/PD-L1结合的克隆,即为特异结合PD-L1蛋白的阳性克隆,测序,获得抗体PD-L1抗体的VHH序列,将CDR1、2、3均相同的序列视为同一个克隆,从而获得20个独特的纳米抗体序列,氨基酸序列如SEQ ID NO:1-20所示。
实施例3:纳米抗体构建FC融合蛋白,克隆、表达、纯化蛋白
克隆设计构建:将20个克隆转化为C端为人IgG1 FC的PD-L1-FC融合蛋白。重新构建的质粒在HEK293细胞中进行表达,通过proteinA亲和层析纯化,一共获得20个候选PD-L1VHH-FC融合蛋白QP326-QP345,序列为SEQ ID NO:1-20所示的纳米抗体后端连接人IgG1 Fc段如序列SEQ ID NO:61组成。相应的纳米抗体的Fc融合蛋白的编号通过在相应的纳米抗体后加Fc后缀形成。
另外,在实施例中以QP322作为参考,可参考专利CN201910567277.5,其抗PD-L1VHH的序列为:
EVQLLESGGGLVQPGGSLRLSCAASGFTYGTYAMSWFRQAPGKGREGVACIDIYGRASYTDPVKGRFTISQDNSKNTLYLQMNSLKAEDTAVYYCAARDFGYCTASWVHEGFSRYWGQGTLVTVSS
另外,在实施例中以阿特珠单抗(Atezolizumab)作为阳性对照,蛋白编号为QP11801181,轻重链序列分别由SEQ ID NO:58和SEQ ID NO:59组成。
蛋白表达:293E细胞培养密度维持在0.2-3×10
ProteinA亲和层析纯化:用平衡液过柱,至少3CV,实际体积20ml,确保最终仪器中流出的溶液pH和电导与平衡液一致,流速1ml/min;将离心后培养液上清过柱,上样40ml,流速0.33ml/min;用平衡液过柱,至少3CV,实际体积20ml,确保最终仪器中流出的溶液pH和电导与平衡液一致,流速0.33ml/min;用洗脱液过柱,当UV280上升至15mAU时开始收集洗脱峰(PAC-EP),UV280下降至15mAU时停止收集,流速1ml/min。样品收集完成后,用pH调节液将PAC-EP调至中性。
实施例4:ELISA检测PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合实验步骤:
包板:包被阳性抗体阿特珠单抗(Atezolizumab)2μg/ml,PD-L1 VHH-FC1μg/ml(13.3nM),60μl/孔,4℃过夜,PBS*3;
封闭:5%milk/PBS,200μl/孔,25℃,孵育1h;
抗原:孵育PD-L1-his蛋白QP003,5μg/ml起4倍稀释,8个梯度,60μl/孔,25℃,1h,PBST*5;
二抗:抗his HRP,1:8000稀释,60μl/孔,25℃,1h,PBST*5;
显色:TMB 100μl/孔,5-10min,2M的H
结果如图1-3所示,PD-L1纳米抗体Fc融合蛋白均结合人PD-L1蛋白。
实施例5:SPR检测PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合亲和力
表面等离子体共振(SPR)检测亲和力,通过Biacore T200(GE)测定待检分子与蛋白人PD-L1及人PD-L1的亲和力。
抗原及对照抗体信息如下:
抗原:人PD-L1重组蛋白(义翘神州,10084-H08H),编号为QPJ08;
对照抗体:阿特珠单抗(Atezolizumab),编号为QP11801181。
SPR亲和力结果如下表2所示:
表2:Biacore检测PD-L1纳米抗体Fc融合蛋白与人PD-L1蛋白结合亲和力。
结果:筛选得到的PD-L1纳米抗体Fc融合蛋白都与人PD-L1蛋白结合。
实施例6:FACS检测PD-L1纳米抗体Fc融合蛋白对天然表达人PD-L1的人非小肺癌细胞HCC827的结合
人非小细胞肺癌细胞HCC827天然高表达PD-L1。准备对数期生长HCC827细胞(汇合度80%),调整浓度并铺板种于costar 96孔板中,1E5细胞/孔,1×PBS洗板一次,加入3%BSA,250μl/孔,37℃孵育1h;加入4倍梯度稀释(33.33nM至0.008nM,对应质量浓度为5μg/mL至0.001μg/mL)待测抗体,50μl/孔,冰上孵育1h;1×PBS洗板2次,加入PE-抗hFc(1∶200),50μl/孔,冰上孵育1h;1×PBS洗板3次,上机读数。
结果如图4所示,FACS检测PD-L1纳米抗体Fc融合蛋白均结合天然表达人PD-L1的人非小肺癌细胞HCC827。
实施例7:ELISA检测PD-L1纳米抗体Fc融合蛋白阻断人PD-L1和PD-1蛋白结合
包被蛋白QP1138(PD1-FC)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA250μl/孔,室温孵育1h。分别配制2μg/ml PDL1-小鼠FC和不同浓度抗体,等体积混匀,室温孵育1h。PBST洗3次,PBS洗3次。孵育二抗:HRP-小鼠IgG(1:5000)50μl/孔,PBST洗6次,PBS洗3次。显色:TMB 100μl/孔,显色10min。2M H
结果如图5和图6所示,PD-L1纳米抗体Fc融合蛋白能阻断人PD-L1和PD-1蛋白结合。
实施例8:ELISA检测PD-L1纳米抗体Fc融合蛋白阻断人PD-L1和CD80蛋白结合
包被蛋白CD80-hFC 2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA250μl/孔,室温孵育1h。分别配制2μg/ml PDL1-小鼠FC和不同浓度抗体,3倍稀释,等体积混匀,室温孵育1h。PBST洗3次,PBS洗3次。孵育二抗:HRP-小鼠IgG(1:5000)50μl/孔,PBST洗6次,PBS洗3次。显色:TMB 100μl/孔,显色10min。2M H
结果如图7和图8所示,PD-L1纳米抗体Fc融合蛋白能阻断人PD-L1和CD80蛋白结合。
实施例9:ELISA检测PD-L1纳米抗体Fc融合蛋白对食蟹猴PD-L1蛋白结合
包被兔His抗体(金斯瑞,A00174)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA250μl/孔,室温孵育1h。孵育猴PDL1-his(sinobio 90251-C08H)1μg/ml,50μl/孔,25℃1h,PBS洗3遍。孵育抗体QP11801181起始浓度20μg/ml,QP322,QP326……起始浓度10μg/ml,1:4稀释8个梯度。50μl/孔,25℃1h,PBS洗6遍。孵育二抗HRP-抗人FC,1:5000倍稀释,60μl/孔,25℃1h,PBST洗6遍。TMB显色,H
结果如图9和图10所示,PD-L1纳米抗体Fc融合蛋白均结合食蟹猴PD-L1蛋白。
实施例10:纳米抗体人源化设计,克隆、表达、纯化蛋白
纳米抗体人源化设计:通过比对IMGT人类抗体重轻链可变区种系基因数据库和MOE软件,分别挑选与QP341、QP344、QP332同源性高的重轻链可变区种系基因作为模板,将鼠源抗体的CDR分别移植到相应的人源模板中,形成次序为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4的可变区序列。再选择一些重要的氨基酸残基做回复突变组合。其中氨基酸残基由Kabat编号系统确定并注释。设计引物PCR搭建各人源化抗体VH基因片段,再与带信号肽及恒定区基因(FC)片段的表达载体pQD同源重组,构建抗体全长表达载体VH-FC-pQD。利用在线软件DNAWorks(v3.2.4)(http://helixweb.nih.gov/dnaworks/)设计多条引物合成VH/VK含重组所需基因片段:5’-30bp信号肽+VH+30bp FC-3’。按照TaKaRa公司Primer STARGXL DNA聚合酶操作说明书,用上面设计的多条引物,分两步PCR扩增得到VH/VK含重组所需基因片段。带信号肽及恒定区基因(FC)片段的表达载体pQD的构建及酶切,利用限制性内切酶,如BsmBI,识别序列与酶切位点不同的特性设计构建带信号肽及恒定区基因(FC)片段的表达载体pQD。BsmBI酶切载体,切胶回收备用。重组构建表达载体VH-FC-pQD。VH含重组所需基因片段与BsmBI酶切回收表达载体pQD(带信号肽及恒定区基因(FC)片段)按3:1比例分别加入DH5H感受态细胞中,0℃冰浴30min,42℃热击90s,加入5倍体积LB介质,37℃孵育45min,涂布LB-Amp平板,37℃培养过夜,挑取单克隆送测序得到各目的克隆。
各克隆人源化设计轻重链可变区序列及蛋白表达编号如下表3所示,其中所有抗体在其C端融合人IgG1-FC恒定区。
表3QP341、QP344、QP332人源化设计
克隆构建:将上面人源化设计克隆转化为C端为人IgG1 FC的PD-L1-FC融合蛋白。重新构建的质粒在HEK293细胞中进行表达,通过proteinA亲和层析纯化,一共获得15个人源化PD-L1 VHH-FC融合蛋白QP509-QP522,序列为SEQ ID NO:43-57所示的纳米抗体后端连接人IgG1 FC段,序列如SEQ ID NO:61所示。
蛋白表达:293E细胞培养密度维持在0.2-3×10
ProteinA亲和层析纯化:用平衡液过柱,至少3CV,实际体积20ml,确保最终仪器中流出的溶液pH和电导与平衡液一致,流速1ml/min;将离心后培养液上清过柱,上样40ml,流速0.33ml/min;用平衡液过柱,至少3CV,实际体积20ml,确保最终仪器中流出的溶液pH和电导与平衡液一致,流速0.33ml/min;用洗脱液过柱,在UV280上升至15mAU时开始收集洗脱峰(PAC-EP),UV280下降至15mAU时停止收集,流速为1ml/min。样品收集完成后,用pH调节液将PAC-EP调至中性。
实施例11:ELISA检测人源化PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合
包被人源化纳米抗体QP509等分子1μg/ml,阳性对照阿特珠单抗(Atezolizumab)2μg/ml。4℃过夜,PBS洗3遍。5%milk封闭,RT 1h。孵育Biotin-QP004(Biotin-PD-L1 hFC)0.5μg/ml起始浓度,5倍稀释,RT 1h,PBST洗3遍。HRP-链霉亲和素5000倍稀释,PBST洗5遍。TMB显色10min。450nm读数。
结果如图11-13所示,ELISA检测人源化PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合,选择结合且EC50值低的分子进一步验证。
实施例12:ELISA检测人源化PD-L1纳米抗体Fc融合蛋白阻断人PD-L1和PD-1蛋白结合
包被蛋白QP1138(PD1-FC)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA 250μl/孔,室温孵育1h。分别配制2μg/ml PDL1-小鼠FC和不同浓度QP509等人源化纳米抗体15μg/ml,阳性对照阿特珠单抗(Atezolizumab)30μg/ml,1:3稀释,等体积混匀,室温孵育1h。PBST洗3次,PBS洗3次。孵育二抗:HRP-小鼠IgG(1:5000)50μl/孔,PBST洗6次,PBS洗3次。显色:TMB 100μl/孔,显色10min。2M H
结果如图14-16所示,ELISA检测人源化PD-L1纳米抗体Fc融合蛋白阻断人PD-L1蛋白与PD-1蛋白的结合,进一步验证。
实施例13:SPR检测人源化PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合亲和力
表面等离子体共振(SPR)检测亲和力,通过Biacore T200(GE)测定待检分子与蛋白人PD-L1及人PD-L1的亲和力。
抗原及对照抗体信息如下:
抗原:人PD-L1重组蛋白(sinobiologic,10084-H08H);
对照抗体:阿特珠单抗(Atezolizumab)。
SPR亲和力结果如下表4所示:
表4
人源化PD-L1纳米抗体Fc融合蛋白结合人PD-L1蛋白。
实施例14:ELISA检测人源化PD-L1纳米抗体Fc融合蛋白对食蟹猴PD-L1蛋白结合
包被兔His抗体(金斯瑞,A00174)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA 250μl/孔,室温孵育1h。孵育猴PDL1-his(sinobio 90251-C08H)1μg/ml,50μl/孔,25℃1h,PBS洗3遍。孵育阳性对照阿特珠单抗(Atezolizumab)起始浓度20μg/ml,QP322,QP326……起始浓度10μg/ml,1∶4稀释8个梯度。50μl/孔,25℃1h,PBS洗6遍。孵育二抗HRP-抗人FC,1∶5000倍稀释,60μl/孔,25℃1h,PBST洗6遍。TMB显色,H
结果如图17所示,人源化PD-L1纳米抗体Fc融合蛋白结合食蟹猴PD-L1蛋白。
为了评估PD-L1体外功能活性,设计了人源化纳米抗体Fc融合蛋白的两种形式,具体地,第一种形式为将QP509 VHH融合在FC蛋白的N端,蛋白编号设计为QP509(QP509 VHH-hFC);第二种形式为将QP509 VHH融合在人IgG1 FC段突变消除FCγR功能(EU计数L234A/L235A/K338A)的C端,蛋白编号为QP3447(hFC(L234A/L235A/K338A)-QP509 VHH),QP3447的氨基酸序列见SEQ ID NO:60所示。
实施例15:SPR检测人源化PD-L1纳米抗体Fc融合蛋白对人PD-L1蛋白结合亲和力
表面等离子体共振(SPR)检测亲和力,通过Biacore T200(GE)测定待检分子与蛋白人PD-L1及人PD-L1的亲和力。
抗原及对照抗体信息如下:
抗原:人PD-L1重组蛋白(SinoBio,10084-H08H)
对照抗体:阿特珠单抗(Atezolizumab)(ROCHE)。
实验结果如表5所示。
表5:QP3447等分子与人PD-L1结合亲和力。
实施例16:ELISA检测QP3447对人PD-L1蛋白结合
包被兔His抗体(金斯瑞,A00174)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA 250μl/孔,室温孵育1h。孵育人PDL1-his(sinobio 10084-H08H)1μg/ml,50μl/孔,25℃1h,PBS洗3遍。孵育阳性对照阿特珠单抗(Atezolizumab)、QP509、QP3447起始浓度67nM,5倍稀释7个梯度,最后一孔稀释100倍。50μl/孔,25℃1h,PBS洗6遍。孵育二抗HRP-抗人FC,1∶5000倍稀释,60μl/孔,25℃1h,PBST洗6遍。TMB显色,H
ELISA检测人源化PD-L1纳米抗体的Fc融合蛋白QP509及QP3447对人PD-L1蛋白结合的结果示于图18中。
实施例17:ELISA检测人源化PD-L1纳米抗体Fc融合蛋白阻断人PD-L1和PD-1蛋白结合
包被蛋白QP1138(PD1-FC)2μg/ml 50μl/孔,4℃过夜。PBS洗3次。封闭:3%BSA 250μl/孔,室温孵育1h。配制2μg/ml PDL1-小鼠FC融合蛋白,50μl/孔,室温孵育1h,PBST洗3次,PBS洗3次。孵育不同浓度QP509、QP3447和阳性对照阿特珠单抗(Atezolizumab)333nM起始浓度,5倍稀释8个浓度梯度,室温孵育1h。PBST洗3次,PBS洗3次。孵育二抗:HRP-小鼠IgG(1∶5000)50μl/孔,PBST洗6次,PBS洗3次。显色:TMB 100μl/孔,显色10min。2M H
ELISA检测人源化PD-L1纳米抗体的Fc融合蛋白阻断人PD-L1蛋白与PD-1蛋白结合的结果示于图19中。
实施例18:FACS检测PD-L1纳米抗体Fc融合蛋白QP3447对天然表达人PD-L1的人非小肺癌细胞HCC827的结合
人非小细胞肺癌细胞HCC827天然高表达PD-L1。准备对数期生长HCC827细胞(汇合度80%),调整浓度并铺板种于96孔板中,1E5细胞/孔,1×PBS洗板一次,加入3%BSA,250μl/孔,37℃孵育1h;加入不同浓度待测抗体,50μl/孔,冰上孵育1h;1×PBS洗板2次,加入PE-抗hFc(1:200),50μl/孔,冰上孵育1h;1×PBS洗板3次,上机读数。
FACS检测PD-L1纳米抗体FC融合蛋白QP3447结合天然表达人PD-L1的人非小肺癌细胞HCC827的结果示于图20中。
实施例19:人源化纳米抗体Fc融合蛋白在混合淋巴细胞反应中促进T细胞增殖
PD-L1功能体外活性鉴定(混合淋巴细胞反应MLR):准备DC(供体1)细胞:复苏PBMC,用EasySep
准备抗体:用培养基1:5梯度稀释抗体(初始浓度10μg/ml)6个浓度。将DC细胞:T细胞为1:10的比例混合,加入不同浓度的抗体,混合培养,第2天检测培养上清中IL2的表达,第5天检测培养上清中IFNγ的表达。
结果如图18-21所示,在混合淋巴细胞反应实验中,QP509及QP3447对T细胞激活后产生的细胞因子IFNγ及IL-2的浓度有明显的抗体浓度依赖。
实施例20:在转基因鼠模型中评价抗PD-L1纳米抗体对肿瘤生长的抑制作用
实验步骤:由于PDL1抗体不能识别小鼠PDL1,因此采用免疫检查点人源化小鼠模型(C57BL/6-hPDL1)评价抗PD-L1纳米抗体对小鼠结肠癌肿瘤细胞MC38的生长抑制作用。收集对数生长期的MC38-hPDL1(tg)-mPDL1(KO)细胞,PBS重悬至适合浓度接种。然后,对每只实验小鼠于右侧背部皮下接种1×10
表6
/>
给药体积为10μl/g体重。
每周观察3次小鼠体重和肿瘤体积,用游标卡尺测量肿瘤长短径,并按公式肿瘤体积(mm
表7
根据实验终点时D24天肿瘤体积和肿瘤重量统计分析,与对照组相比,G2组QP3447的肿瘤体积(TGItv%=62.97%)和肿瘤重量(TGItw%=62.77%)均有显著性差异(P<0.05);G3组对照分子阿特珠单抗(Atezolizumab)的肿瘤体积(TGI%=65.08%)和肿瘤重量(TGI tw%=58.36%)均有显著性差异(P<0.05)。QP3447和阿特珠单抗(Atezolizumab)均在该模型中表现出较强的抗肿瘤活性。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
