用于产生治疗性蛋白的方法
文献发布时间:2024-04-18 19:52:40
相关申请的交叉引用
本申请要求2020年9月22日提交的美国临时申请序列号63/081380和2021年7月26日提交的美国临时申请序列号63/225832的优先权,将其整体内容通过引用并入本文。
技术领域
本发明总体上涉及用于产生从宿主细胞分泌的目的治疗性蛋白的方法。
背景技术
治疗性蛋白在多种人类疾病的治疗中变得更受欢迎。已知由于宽范围的翻译后修饰,它们在制造期间具有一定的异质性。其中,例如在单克隆抗体(mAb)中非常普遍地观察到电荷变体种类(酸性种类、主峰和酸性种类)(Hintersteiner等人,2016)。从监管的角度来看,衍生自C末端赖氨酸的碱性较高的种类较少受到关注,因为它们在静脉内注射于患者后会被内源性血清羧肽酶B(CpB)迅速切割,估计的半衰期短至一小时(Brorson和Jia,2014)。然而,仍然需要监测电荷变体以确保制造一致性和产品可比性(Chung等人,2019)。在mAb产品的出厂规格中需要控制主峰。成功控制制造工艺对于确保治疗性蛋白的产品质量、安全性以及批次间一致性至关重要。
据信,在mAb制造工艺期间在mAb重链处具有零个、一个或两个残留赖氨酸的C末端赖氨酸变体是由内源性羧肽酶对C末端赖氨酸残基的非有效切割产生的(Zhang等人,2015)。更多的赖氨酸残留物增加了碱性种类在电荷变体谱中的比例,因为赖氨酸带正电,因此降低了mAb分子的PI(Brorson等人,2014)。为了降低mAb C末端赖氨酸在制造工艺中的异质性,一种解决方案是在生产阶段以较短的时间段培养宿主细胞。然而,此方法显著降低了mAb的生产率。
因此,需要开发一种改进的细胞培养方法,以提高治疗性蛋白的生产率,同时获得更高的滴度和更低的异质性。
发明内容
在本发明的某些实施方案中,通过在上游细胞培养工艺结束时直接在生物反应器中实施CpB处理而开发出了有成本效益的酶处理策略。出于许多优势选择了这种策略。首先,细胞培养条件通常在温度、pH、混合等方面与酶反应条件相当,使得在添加CpB后无需另外的条件调整。在一系列下游纯化步骤前引入了CpB,并且在随后的纯化工艺期间很容易去除CpB。已表明,即使当将酶以50×其工作浓度添加时,蛋白A步骤也可以在通过ELISA测定测得的检出限下去除引入的CpB。这些极大地简化了总体工艺并且提高了滴度,同时实现了生产合格的治疗性蛋白产品的目标。
在本发明的某些实施方案中,本公开文本提供了一种产生目的治疗性蛋白的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶(CP)添加到所述培养的细胞中;c)收集澄清的物料(CB);以及d)使所述澄清的物料经受纯化工艺。
在本发明的某些实施方案中,本公开文本提供了一种提高目的治疗性蛋白的生产率的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶(CP)添加到所述培养的细胞中;c)收集澄清的物料(CB);以及d)使所述澄清的物料经受纯化工艺。
在本发明的某些方面,所述生物反应器是生产生物反应器。
在本发明的某些方面,所述蛋白质是在C末端具有赖氨酸或精氨酸残基的蛋白质。
在本发明的某些方面,所述蛋白质是Fc融合蛋白或抗体。
在本发明的某些方面,所述抗体是mAb。
在本发明的某些方面,所述羧肽酶选自羧肽酶A(CPA)、羧肽酶B(CpB)、羧肽酶D(CPD)、羧肽酶H(CPH)、羧肽酶E(CPE)、羧肽酶M(CPM)、羧肽酶N(CPN)、羧肽酶T(CPT)、羧肽酶Y(CPY)、羧肽酶M32、谷氨酸羧肽酶(GCP)、脯氨酰羧肽酶(PCP)、D-丙氨酰-D-丙氨酸羧肽酶(AACP)或羧肽酶原。
在本发明的某些方面,所述羧肽酶是羧肽酶B。
在本发明的某些方面,将所述细胞培养约14天。
在本发明的某些方面,在所述培养的细胞的生产阶段期间添加所述羧肽酶。
在本发明的某些方面,在收获前0至24小时之间将所述羧肽酶添加到所述培养的细胞中。
在本发明的某些方面,在收获前约2小时将所述羧肽酶添加到所述培养的细胞中。
在本发明的某些方面,在收获时将所述羧肽酶添加到所述培养的细胞中。
在本发明的某些方面,其中所述细胞处于灌注、分批或补料分批细胞培养物中。
在本发明的某些方面,以足以减少所述蛋白质的碱性种类的量添加所述羧肽酶。
在本发明的某些方面,以CP:目的蛋白在0.001%至1%w/w之间的比率添加所述羧肽酶。在本发明的某些方面,将所述羧肽酶不止一次添加到所述生产生物反应器中。
在本发明的某些方面,所述宿主细胞是CHO细胞。
在本发明的某些方面,所述抗体结合选自以下的抗原:PD-1、PD-L1、CTLA-4、LAG-3、TIGIT、GITR、CXCR4、CD73 HER2、VEGF、CD20、CD40、CD11a、组织因子(TF)、PSCA、IL-8、IL-13、SARS-CoV-2刺突蛋白、EGFR、HER3和HER4。
在本发明的某些方面,所述mAb是纳武单抗。
附图说明
图1A、图1B和图1C示出了在实验室生物反应器中CHO细胞培养物的mAb-1生产性能:分别地,(图1A)工艺B(使用富集的N-1种子的强化补料分批生产)(n=4)、(图1B)工艺C(使用灌注N-1种子的强化补料分批生产)(n=4)和(图1C)工艺D(强化灌注生产)(n=2:分别地,批次1和批次2)的归一化空间产率(实线,相对于作为100%的工艺B的第10天滴度的平均值归一化)和归一化时空产率(虚线,基于相对于持续时间的归一化滴度计算)。由于标准差非常小,在一些时间点未观察到误差条。
图2A、图2B和图2C示出了在实验室生物反应器中在CpB处理物(虚线)和未处理对照(实线)的情况下mAb-1的归一化主峰水平(相对于作为100%的主峰的出厂规格(Spec)归一化)(与图1A-图1C中相同):分别地,(图2A)工艺B(n=4)、(图2B)工艺C(n=4)和(图2C)工艺D(n=2:分别地,批次1和批次2)。由于标准差非常小,在一些时间点未观察到误差条。
图3A、图3B和图3C示出了在实验室生物反应器中在CpB处理物(虚线)和未处理对照(实线)的情况下mAb-1的归一化碱性种类水平(相对于作为100%的主峰的出厂规格归一化)(与图1A-图1C中相同):分别地,(图3A)工艺B(n=4)、(图3B)工艺C(n=4)和(图3C)工艺D(n=2:分别地,批次1和批次2)。由于标准差非常小,在一些时间点未观察到误差条。
图4示出了在CpB处理物(实线)和未处理对照(虚线)的情况下mAb-1的iCE色谱图比较。将主峰和碱性种类水平相对于作为100%的主峰的mAb-1出厂规格归一化。
图5示出了分别在以下不同基质中在34℃下以不同酶浓度进行2小时CpB处理后mAb-1的归一化主峰和碱性种类水平:全细胞培养物,浓度为1%、0.05%、0.01%(w/w);细胞培养上清液,浓度为0.01%和0.001%(w/w);以及pH 7.6的Tris缓冲液中的5mg/mL mAb-1,浓度为0.01%和0.001%(w/w),使用CpB未处理样品作为对照(n=3)。
图6示出了在以0.01%(w/w)CpB浓度在从工艺B产生的细胞培养上清液中在不同温度(例如,室温(RT)、32℃、34℃和36.5℃)下进行2小时CpB处理后mAb-1的归一化主峰和碱性种类水平,使用CpB未处理样品作为对照(n=3)。
图7示出了在以0.01%(w/w)CpB浓度在34℃下在不同pH值(例如,pH 5.0(25mM乙酸钠、12mM乙酸);pH 6.1(25mM乙酸钠、12mM乙酸);pH 7.0(25mM Tris-HCl、100mM NaCl);pH 8.0(25mM Tris-HCl、100mM NaCl);pH 8.9(25mM Tris-HCl、100mM NaCl))下(掺有纯化的mAb-1)进行2小时CpB处理后mAb-1的归一化主峰和碱性种类水平,使用CpB未处理样品作为对照(n=3)。
图8示出了mAb-1的制造工艺流程图。
图9示出了在采用工艺B的情况下在5L生物反应器中mAb-1细胞培养物的性能谱(例如,VCD、活力和归一化滴度)(n=2),对于CpB处理条件和未处理条件,将工艺B均用于随后在34℃下以0.05%(w/w)浓度进行2小时CpB处理,然后运行经过整个下游处理(表1)。
图10示出了体外CpB处理方案的示意图。
图11A和图11B示出了对于在250mL摇瓶中生产mAb-8,补料分批细胞培养物的VCD、活力和归一化滴度的性能谱(图11A)以及葡萄糖、乳酸盐和铵水平的代谢物谱(图11B)。
图12A、图12B和图12C示出了对于在250mL摇瓶中生产mAb-8,全细胞培养物对照和CpB:mAb-8比率为1:10,000(w/w)的CpB处理条件的过程中质量属性(以下的水平:归一化碱性电荷变体种类和归一化主峰,图12A;N聚糖,包括G0、G0F、G1F、G2F和Man5,图12B;SEC杂质,包括高分子量物质(HMW)、低分子量物质(LMW)和单体,图12C)。
图13A和图13B示出了在250mL摇瓶中在mAb-3生产期间补料分批细胞培养物的VCD、例如活力和归一化滴度的性能谱(图13A)以及葡萄糖、乳酸盐和铵水平的代谢物谱(图13B)。
图14A、图14B和图14C示出了对于在250mL摇瓶中生产mAb-3,全细胞培养物对照和CpB:mAb-3比率为1:10,000(w/w)的CpB处理条件的过程中质量属性(以下的水平:归一化碱性电荷变体种类和归一化主峰,图14A;N聚糖,包括G0、G0F、G1F、G2F和Man5,图14B;SEC杂质,包括高分子量物质(HMW)、低分子量物质(LMW)和单体,图14C)。
具体实施方式
本发明提供了产生目的治疗性蛋白的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶添加到培养的细胞中;c)收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
在本发明的某些实施方案中,本公开文本提供了提高目的治疗性蛋白的生产率的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶(CP)添加到培养的细胞中;c)收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
定义
为了可以更容易地理解本公开文本,首先定义某些术语。如本申请所用,除非本文另外明确提供,否则以下术语中的每一个应当具有下文所阐述的含义。另外的定义贯穿本申请进行阐述。
不定冠词“一个/一种(a)”或“一个/一种(an)”应当理解为是指任何所列举或枚举的组分中的“一个/一种或多个/多种”。
如本文所用的术语“约”是指在如通过本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,可接受误差范围将部分取决于如何测量或确定所述值或组成,即测量系统的限制。例如,“约”可以意指所陈述参考值的±50%的范围,优选±25%的范围,或更优选±10%的范围。当在本申请和权利要求中提供特定值或组成时,除非另外陈述,否则应当假定“约”的含义在该特定值或组成的可接受误差范围内。
术语“和/或”在本文中使用的情况下被视为对两个指定特征或组分中的每一个与或不与另一个的具体公开。因此,如在本文中以短语如“A和/或B”使用的术语“和/或”旨在包括“A和B”、“A或B”、“A”(单独)和“B”(单独)。同样,如以短语如“A、B和/或C”使用的术语“和/或”旨在涵盖以下方面中的每一个:A、B和C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A(单独);B(单独);以及C(单独)。替代方案(例如,“或”)的使用应当理解为意指替代方案中的任一者、两者或其任何组合。
如本文所用的术语“蛋白质”是指氨基酸的肽连接链,而无论长度如何。蛋白质中的一个或多个氨基酸残基可以含有修饰,如但不限于糖基化、磷酸化或二硫键形成。术语“蛋白质”在本文中与“多肽”可互换使用。
如本文所用的术语“目的蛋白”以其最广泛的含义使用,以包括存在于混合物中期望纯化的任何蛋白质(天然的或重组的)。此类目的蛋白包括但不限于酶、激素、生长因子、细胞因子、免疫球蛋白(例如,抗体)和/或任何融合蛋白。
如本文所用,术语“治疗性蛋白”是指已知可用于预防、治疗或改善疾病或障碍的任何蛋白质,例如抗体、生长因子、细胞表面受体、细胞因子、激素、毒素或上述任一项的片段和/或融合蛋白。
如本文所用,术语“Fc融合蛋白”意在涵盖这样的治疗性蛋白,其包含免疫球蛋白衍生的部分(即,Fc部分)和衍生自第二非免疫球蛋白的部分。
“抗体”(Ab)应当包括但不限于糖蛋白免疫球蛋白(Ig)(其与抗原特异性结合并包含通过二硫键相互连接的至少两条重(H)链和两条轻(L)链)或其抗原结合部分。
如本文所用的“分离的”或“纯化的”Ab是指这样的Ab,其基本上不含具有不同抗原特异性的其他Ab。此外,分离的Ab也可以意指这样的Ab,其被纯化以使得基本上不含其他细胞材料和/或化学物质。
如本文所用的术语“单克隆抗体”(mAb)是指具有单一分子组成的Ab分子(即,其一级序列基本上相同并且对特定表位展现出单一结合特异性和亲和力的Ab分子)的非天然存在的制剂。mAb是分离的Ab的例子。mAb可以通过杂交瘤技术、重组技术、转基因技术或本领域技术人员已知的其他技术产生。
如本文所用的术语“目的mAb”是指存在于混合物中期望纯化的mAb。
如本文所用的“嵌合”Ab是指可变区衍生自一种物种并且恒定区衍生自另一种物种的Ab,如可变区衍生自小鼠Ab并且恒定区衍生自人Ab的Ab。
如本文所用的“人”mAb(HuMAb)是指具有框架区和CDR区均衍生自人种系免疫球蛋白序列的可变区的mAb。此外,如果Ab含有恒定区,则恒定区也衍生自人种系免疫球蛋白序列。本发明的人Ab可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人”Ab不旨在包括衍生自另一种哺乳动物物种(如小鼠)的种系的CDR序列已经被移植到人框架序列上的Ab。术语“人”Ab和“全人”Ab同义地使用。
如本文所用的“人源化”mAb是指非人mAb的CDR结构域外的一些、大部分或所有氨基酸被衍生自人免疫球蛋白的相应氨基酸替代的mAb。在人源化形式的Ab的一个实施方案中,CDR结构域外的一些、大部分或所有氨基酸已经被来自人免疫球蛋白的氨基酸替代,而一个或多个CDR区内的一些、大部分或所有氨基酸未改变。氨基酸的少量添加、缺失、插入、取代或修饰是可允许的,只要它们不消除Ab与特定抗原结合的能力即可。“人源化”Ab保留与原始Ab的抗原特异性类似的抗原特异性。
如本文所用的“抗抗原”Ab是指与抗原特异性结合的Ab。例如,抗PD-1Ab是与PD-1特异性结合的Ab。
如本文所用的术语“培养物”、“细胞培养物”和“哺乳动物细胞培养物”是指在适合于细胞群体存活和/或生长的条件下悬浮于培养基中的哺乳动物细胞群体。如本领域普通技术人员将清楚的,如本文所用的这些术语可以指代包含哺乳动物细胞群体和所述群体悬浮于其中的培养基的组合。
术语“培养”或“细胞培养”意指在一组受控的物理条件下使哺乳动物细胞在液体培养基中维持或生长。
如本文所用的术语“接种(seeding)”、“接种(seeded)”、“接种(inoculation)”、“接种(inoculating)”和“接种(inoculated)”是指向生物反应器或另一种容器提供细胞培养物的工艺。细胞可能先前已经在另一个生物反应器或容器中繁殖。可替代地,细胞可以一直是冷冻的,并且在提供给生物反应器或容器之前即时解冻。所述术语是指任何数量的细胞,包括单个细胞。
如本文所用的术语“基础培养基”是指含有滋养生长中的哺乳动物细胞的营养物的溶液。通常,溶液提供细胞最低限度的生长和/或存活所需的必需和非必需氨基酸、维生素、能源、脂质和微量元素。溶液还可以含有增强高于最小速率的生长和/或存活的组分,包括激素和生长因子。优选地将溶液配制成对细胞存活和增殖最佳的pH和盐浓度。可以将各种组分添加到基础培养基中以利于细胞生长。培养基也可以是不含血清、水解产物或具有未知组成的组分的“化学成分确定的培养基”。成分确定的培养基不含动物衍生的组分,并且所有组分均具有已知的化学结构。
如本文所用的术语“分批”或“分批培养”是指培养细胞的方法,其中在培养工艺开始时提供最终将用于培养细胞的所有组分(包括基础培养基以及细胞本身)。通常在某一点停止分批培养,并且收获并任选地纯化培养基中的细胞和/或组分。
术语“补料分批”或“补料分批培养”意指向初始细胞培养物中增量式或连续添加补料培养基,而不从细胞培养物中大量或显著去除初始的基础培养基。在一些情况下,补料培养基与初始的基础培养基相同。在一些情况下,补料培养基是浓缩形式的基础培养基。在一些情况下,补料培养基可以不同于基础培养基,但是含有所期望的营养补充剂。
如本文所用的术语“灌注”或“灌注工艺”是指培养细胞的方法,其中在将细胞保留在反应器中的同时,从生物反应器同时添加和去除等体积的培养基(含有营养补充剂)。通常在连续或半连续的基础上去除对应于补充培养基的一定体积的细胞和培养基,并且任选地进行纯化。通常,涉及灌注工艺的细胞培养工艺被称为“灌注培养”。新鲜培养基可以与在细胞培养工艺中使用的基础培养基相同、类似或不同。
如本文所用的术语“N-1阶段”是指临生产接种前的最后的种子扩增阶段。N-1阶段是接种生产生物反应器以生产目的蛋白前最终的细胞生长步骤。如本文所用的术语“N-2阶段”和“N-3阶段”是指细胞生长和扩增期间以及通常在接种N生产阶段前的时间段。N-3阶段是用于增加待在N-2阶段使用的活细胞密度的细胞生长阶段。N-2阶段是用于增加待在N-1阶段使用的活细胞密度的细胞生长阶段。
术语细胞培养的“生产阶段”或“N生产阶段”是指细胞培养的最后阶段。在生产阶段期间,以产生目的蛋白(例如mAb)为主要重点培养细胞。生产阶段通常被称为细胞培养物制造的“N”或最后阶段。
如本文所用的术语“生物反应器”是指用于使哺乳动物细胞培养物生长的任何容器。生物反应器可以具有任何大小,只要它可用于培养哺乳动物细胞即可。通常,生物反应器将为至少1升,并且可以为2、5、10、100、250、500、1000、2500、5000、8000、10,000、12,000、15,000、20,000升或更多或者其间的任何体积。通常在培养期期间控制生物反应器的内部条件,包括但不限于pH和温度。生物反应器可以由适合于在本发明的培养条件下维持悬浮在培养基中的哺乳动物细胞培养物的任何材料构成,所述材料包括玻璃、塑料或金属。
如本文所用的术语“生产生物反应器”是指在细胞培养的生产阶段用于生产目的蛋白(例如mAb)的最终生物反应器。大规模细胞培养生产生物反应器的体积通常为至少500升,并且可以为1000、2500、5000、8000、10,000、12,000、15,000、20,000升或更多或者其间的任何体积。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适生物反应器。
如本文所用的术语“滴度”是指由哺乳动物细胞培养物产生的重组表达的目的蛋白(例如,mAb)的总量除以给定量的培养基体积。滴度通常以每升培养基中多肽或蛋白质的克数为单位来表示。
术语“收获”是指去除细胞和细胞碎片以产生适合于蛋白质纯化的澄清的物料(CB)的程序。这通常通过任何合适的技术(包括但不限于离心、深度过滤和无菌过滤,取决于规模和设备能力)来实现。
如本文所用,“澄清的物料(clarified bulk)”和“CB”可互换使用,并且是指在用于澄清细胞培养液的初次回收步骤(如离心、深度过滤或絮凝)后收集的溶液。
术语“纯化”是指将目的蛋白从存在于细胞培养基中的一种或多种其他组分(例如,哺乳动物细胞或培养基蛋白)或者存在于哺乳动物细胞裂解物中的一种或多种其他组分(例如,DNA、RNA或其他蛋白质)中至少部分地纯化或分离的程序(例如,按重量计至少或约5%纯,例如至少或约10%、15%、20%、25%、30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或至少或约95%纯)。通常,通过从组合物中去除(完全或部分)至少一种杂质来提高目的蛋白的纯度。
术语“羧肽酶”是指从C末端切割蛋白质的多功能酶。存在许多不同类型的羧肽酶,包括羧肽酶A(CpA)、羧肽酶B(CpB)、羧肽酶D(CpD)、羧肽酶E(CpE)、羧肽酶M(CpM)、羧肽酶N(CpN)、羧肽酶T(CpT)、羧肽酶Y(CpY)、羧肽酶M32、谷氨酸羧肽酶(GCP)、脯氨酰羧肽酶(PCP)、D-丙氨酰-D-丙氨酸羧肽酶(AACP)、羧肽酶原等。
在本发明的某些实施方案中,本公开文本提供了产生目的治疗性蛋白的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶添加到培养的细胞中;c)收获并且收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
在本发明的某些实施方案中,本公开文本提供了提高目的治疗性蛋白的生产率的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶添加到培养的细胞中;c)收获并且收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
术语“羧肽酶B”是指从蛋白质的C末端连续切割碱性氨基酸(如精氨酸和赖氨酸)的羧肽酶。
在本发明的某些方面,羧肽酶是羧肽酶B(CpB)。
在本发明的某些实施方案中,本公开文本提供了产生目的治疗性蛋白的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶B添加到培养的细胞中;c)收获并且收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
在本发明的某些实施方案中,本公开文本提供了提高目的治疗性蛋白的生产率的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶B添加到培养的细胞中;c)收获并且收集澄清的物料(CB);以及d)使澄清的物料经受纯化工艺。
在以下小节中进一步详细描述了本公开文本的各个方面。
在本发明的某些实施方案中,本公开文本提供了提高目的单克隆抗体(mAb)的生产率的方法,所述方法包括:a)将表达所述mAb的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)将羧肽酶(CP)添加到培养的细胞中;c)收集澄清的物料;以及d)使澄清的物料经受纯化工艺。
在本发明的某些方面,蛋白质在C末端具有赖氨酸或精氨酸。
在本发明的某些方面,蛋白质是Fc融合蛋白或抗体。
在本发明的某些方面,抗体是mAb。
在本发明的某些方面,生物反应器是生产生物反应器。
在本发明的某些方面,在收获前将羧肽酶添加到分批、补料分批或灌注细胞培养物中。
在本发明的某些方面,羧肽酶选自羧肽酶A(CPA)、羧肽酶B(CpB)、羧肽酶D(CPD)、羧肽酶H(CPH)、羧肽酶E(CPE)、羧肽酶M(CPM)、羧肽酶N(CPN)、羧肽酶T(CPT)、羧肽酶Y(CPY)、羧肽酶M32、谷氨酸羧肽酶(GCP)、脯氨酰羧肽酶(PCP)、D-丙氨酰-D-丙氨酸羧肽酶(AACP)或羧肽酶原。
在本发明的某些方面,将细胞在生产生物反应器中培养约14天。在本发明的某些方面,将细胞在生产生物反应器中培养约15天。在本发明的某些方面,将细胞在生产生物反应器中培养约16天。在本发明的某些方面,将细胞在生产生物反应器中培养约17天。在本发明的某些方面,将细胞在生产生物反应器中培养约18天。在本发明的某些方面,将细胞在生产生物反应器中培养约19天。在本发明的某些方面,将细胞在生产生物反应器中培养约20天。在本发明的某些方面,将细胞在生产生物反应器中培养约21天。在本发明的某些方面,将细胞在生产生物反应器中培养约22天。
在本发明的某些方面,在培养的细胞的生产阶段期间添加羧肽酶。
在本发明的某些方面,在收获前0至24小时之间将羧肽酶添加到培养的细胞中。
在本发明的某些方面,在收获前约0.5小时、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或24小时,将羧肽酶添加到培养的细胞中。
在本发明的某些方面,在收获前约2小时将羧肽酶添加到培养的细胞中。
在本发明的某些方面,在收获前约2小时将羧肽酶B添加到培养的细胞中。
在本发明的某些方面,在收获时将羧肽酶添加到培养的细胞中。
在本发明的某些方面,细胞处于灌注、分批或补料分批细胞培养物中。
在本发明的某些方面,以足以减少目的蛋白的碱性种类的量添加羧肽酶。
在本发明的某些方面,以CP:目的蛋白在0.001%至1%w/w之间的比率添加羧肽酶。在本发明的某些方面,以CP:目的蛋白为约0.001%、约0.002%、约0.005%、约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.5%或约1%w/w的比率添加羧肽酶。
在本发明的某些方面,以足以减少目的mAb的碱性种类的量添加羧肽酶。
在本发明的某些方面,以CP:目的mAb在0.001%至1%w/w之间的比率添加羧肽酶B。
在本发明的某些方面,以CP:目的mAb为约0.001%、约0.002%、约0.005%、约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.5%或约1%w/w的比率添加羧肽酶B。
在本发明的某些方面,以CP:目的mAb为约0.01%w/w添加羧肽酶B。
在本发明的某些方面,将羧肽酶不止一次添加到生产生物反应器中。
在本发明的某些方面,宿主细胞是CHO细胞。
在本发明的某些方面,抗体结合选自以下的抗原:PD-1、PD-L1、CTLA-4、LAG-3、TIGIT、GITR、CXCR4、CD73 HER2、VEGF、CD20、CD40、CD11a、组织因子(TF)、PSCA、IL-8、IL-13、SARS-CoV-2刺突蛋白、EGFR、HER3和HER4。
在某些方面,mAb是纳武单抗。
mAb电荷变体
由于多种翻译后修饰和降解事件,单克隆抗体(mAb)在其生物化学特性和生物物理特性方面是异质的。mAb的电荷异质性可能会受到这些修饰的影响,导致净电荷或局部电荷分布的改变。mAb的电荷变体被鉴定为酸性种类、碱性种类和主要种类。如本文所用的术语mAb的“主要种类”、“主峰”或“主要变体”是指作为具有中性等电点(pI)的主峰洗脱的mAb。本文所用的术语mAb的“酸性种类”或“酸性变体”是指pI低于主要种类的变体。如本文所用的术语mAb的“碱性种类”或“碱性变体”是指pI高于主要种类的变体。mAb的C末端赖氨酸残基可能产生另外的正电荷,增加mAb的碱性种类。在抗体生产期间内源性羧肽酶对C末端赖氨酸残基的非有效切割是产生具有零个、一个或两个C末端赖氨酸的mAb的主要原因之一(Zhang等人,2015)。
可以使用基于电荷的分离技术(如等电聚焦(IEF)凝胶电泳、毛细管等电聚焦(cIEF)凝胶电泳、阳离子交换色谱(CEX)和阴离子交换色谱(AEX))来分离电荷变体。在本文中,使用带有Alcott 720NV自动进样器的Protein Simple iCE3仪器通过成像毛细管等电聚焦(iCIEF)分析电荷变体种类。将样品与适当的pI标记物、两性电解质和尿素混合,然后注射到氟碳化合物包被的毛细管中。施加高电压,并且在所述电压下在柱内产生pH梯度。电荷变体根据其各自的pI迁移。UV照相机在280nM处捕获图像。鉴定出主峰,并且对迁移到酸性范围和碱性范围内的峰进行求和、定量,并且将其报告为相对百分比面积。
电荷变体谱控制的几种方式包括使用具有较低铜浓度的细胞培养基(Kim等人,2016),调整培养基中的赖氨酸浓度,转变温度(Kim等人,2016),延长培养持续时间,构建具有赖氨酸的C末端缺失的mAb(Luo等人,2012;Jiang等人,2016)。这些策略发生在细胞培养阶段期间或之前,因此完全影响多途径,并且将导致总体细胞培养物的性能、滴度性能或产品质量不可预测。美国专利号5,672,347公开了向澄清的物料中添加羧肽酶的方法,所述方法涉及额外的工艺和孵育时间。
相比之下,本发明的方法在细胞培养生产阶段接近结束时利用羧肽酶,以避免这些影响细胞培养的不确定性。在原始运行设置中没有任何其他改变的情况下,由于添加的羧肽酶将经历正常的下游纯化工艺并被去除,因此不需要另外的步骤来去掉引入的新实体。这极大地简化了总体程序。
电荷变体谱是mAb依赖性的,并且当一些mAb(例如mAb-1)在细胞培养期间从宿主细胞分泌时,它们具有较高百分比的碱性种类和较低百分比的主要种类。例如,在生产生物反应器中培养10天后,mAb-1碱性种类的百分比大于8%。随着生产时间的延长,mAb碱性变体的百分比将不断增加。因此,对于这些mAb,在延长生产时间的同时获得较高滴度但较低百分比的mAb碱性变体可能是不可能的。在本发明中,对于这些有高百分比的碱性变体问题的mAb,在生产生物反应器中细胞培养持续时间可以从10天延长到14天。所述方法可以应用于具有类似电荷变体谱问题的其他生物制剂。
在本发明中,申请人开发出了简单、稳健且有成本效益的CpB处理方法,用于提高使用工业CHO细胞系生产mAb-1的强化细胞培养工艺的质量和生产率。强化工艺(例如,通过非灌注N-1强化的工艺B、通过灌注N-1强化的工艺C和通过生产阶段的灌注强化的工艺D)获得了比常规的补料分批制造工艺A高得多的生产率。然而,强化补料分批工艺B和C必须早得多地收获,并且由于主峰较低(不符合出厂规格)而无法实施灌注工艺D。主峰较低主要是由于强化工艺的较高C末端赖氨酸变体引起的碱性种类较高。在CpB处理后,C末端赖氨酸被有效去除,这导致所有强化工艺的碱性种类显著减少并且主峰水平显著增加,在整个培养持续时间内均符合出厂规格。在CpB处理后更长的细胞培养生产窗口内,补料分批工艺B和C获得了高得多的最终滴度。此外,证明了CpB在下游处理期间的清除,并且无论是否进行CpB处理,下游步骤产率和过程中质量属性谱类似。
在本发明的某些方面,将羧肽酶以足以减少目的mAb的碱性种类的量添加到培养的细胞中。
在本发明的某些方面,将羧肽酶以足以增加目的mAb的主要种类的量添加到培养的细胞中。
宿主细胞
根据本发明,可以利用对细胞培养和对蛋白质表达敏感的任何哺乳动物细胞或细胞类型。可以根据本发明使用的哺乳动物细胞的非限制性例子包括BALB/c小鼠骨髓瘤系(NSO/1,ECACC编号:85110503);人视网膜母细胞(PER.C6(CruCell,荷兰莱顿));由SV40转化的猴肾CV1系(COS-7,ATCC CRL 1651);人胚肾系(293细胞或亚克隆用于悬浮培养生长的293细胞,Graham等人,J.Gen Virol.,36:59(1977));幼仓鼠肾细胞(BHK,ATCC CCL 10);中国仓鼠卵巢细胞±DHFR(CHO,Urlaub和Chasin,Proc.Natl.Acad.Sci.USA,77:4216(1980));小鼠支持细胞(TM4,Mather,Biol.Reprod.,23:243-251(1980));猴肾细胞(CV1ATCC CCL 70);非洲绿猴肾细胞(VERO-76,ATCC CRL-1 587);人宫颈癌细胞(HeLa,ATCCCCL 2);犬肾细胞(MDCK,ATCC CCL 34);水牛大鼠肝细胞(BRL 3A,ATCC CRL 1442);人肺细胞(W138,ATCC CCL 75);人肝细胞(Hep G2,HB 8065);小鼠乳腺肿瘤(MMT 060562,ATCCCCL5 1);TRI细胞(Mather等人,Annals N.Y.Acad.Sci.,383:44-68(1982));MRC 5细胞;FS4细胞;和人肝细胞瘤系(Hep G2)。在本发明的一个实施方案中,宿主细胞是CHO细胞系。
提供哺乳动物细胞培养物
一旦已经鉴定出表达目的蛋白的细胞,就将所述细胞通过本领域普通技术人员熟知的多种方法中的任何一种在培养物中繁殖。表达目的蛋白的细胞通常通过在有助于细胞存活、生长和活力的温度下和培养基中使它生长来繁殖。初始培养体积可以是任何大小,但是通常小于在最终生产目的蛋白中使用的生产生物反应器的培养体积,并且通常在接种生产生物反应器之前将细胞在体积渐增的生物反应器中传代数次。一旦细胞已经达到特定的活细胞密度,就使细胞在生物反应器中生长以进一步增加活细胞的数量。这些生物反应器被称为N-1、N-2、N-3等。“N”是指主要生产培养生物反应器,而“N-1”意指主要生产培养之前的生物反应器,以此类推。
通常,在接种下一生产生物反应器前,可以使N-1的细胞培养物生长到所期望的密度。尽管不需要完全或接近完全活力,但优选的是大部分细胞在接种之前保持存活。
表达的蛋白质的生产
在生产阶段期间,以产生目的蛋白(例如目的mAb)为主要重点培养细胞。生产阶段通常被称为细胞培养物制造的“N”或最后阶段。通常,应用生产生物反应器作为在细胞培养的生产阶段用于生产目的蛋白(例如mAb)的最终生物反应器。大规模细胞培养生产生物反应器的体积通常为至少500升,并且可以为1000、2500、5000、8000、10,000、12,000、15,000、20,000升或更多或者其间的任何体积。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适生物反应器。
在本发明的某些方面,细胞培养物是灌注、分批或补料分批细胞培养物。在某些优选方面,生产生物反应器中的细胞培养物是补料分批细胞培养物。
在过去的几十年里,通过细胞系工程化、培养基开发和生物反应器优化来延长细胞培养生产的持续时间一直是提高补料分批工艺的滴度的主要策略之一(Druz,Son,Betenbaugh和Shiloach,2013;Fan等人,2015;Powers等人,2019;Wurm,2004)。无论细胞培养生产的持续时间如何,一个生产批次都需要类似的达到峰值VCD的细胞生长时间、批次之间的周转时间以及类似的批次设置(包括种子扩增、培养基制备和生物反应器操作)的成本(Chen等人,2018;Xu等人,2020)。因此,通过在稳定期延长细胞培养生产窗口来增加滴度可以提高制造生产率并降低制造成本(Wurm,2004;Xu等人,2012;Xu等人,2020)。然而,持续时间为2周或更长的补料分批细胞培养物最终将进入死亡期,其中毒性代谢物增加、VCD降低且细胞活力降低,这可能导致产品质量较差(Arden和Betenbaugh,2004;Henry等人,2020)。在一些情况下,为了符合质量要求和出厂规格,可能需要在稳定期的中间期间较早地收获补料分批细胞培养物。
此处的情况就是这样,强化工艺B和C必须提前终止,因为主峰在第14天不符合规格(图1A-图1C)。然而,在CpB处理后,对于所有强化工艺,主峰在整个持续时间期间均符合规格(图1A-图1C)。通过CpB处理,工艺B从10天延长到14天,空间产率提高38%并且每克最终药品的上游消耗品成本降低22%。类似地,工艺C从6天延长到14天,空间产率提高108%并且上游消耗品成本降低约46%(图1A-图1C和表2)。与常规工艺A相比,通过添加此CpB处理步骤和先前描述的工艺强化策略,工艺B、C和D的时空产率分别大幅提高了3.7、5.4和11倍(图1A-图1C)。
在文献中报道了影响C末端赖氨酸水平的其他缓解策略,例如细胞系工程化以及细胞培养基和工艺优化。Hu等人(Hu等人,2017)报道了具有C末端赖氨酸缺失DNA序列的CHO细胞确实产生了较少的C末端赖氨酸相关碱性变体,但是由于比野生型CHO细胞更普遍的脯氨酸酰胺化,导致滴度较低且总碱性种类较高。此外,发现与野生型CHO细胞相比,C末端赖氨酸和甘氨酸缺失CHO细胞所产生的碱性种类较低,而滴度相当。然而,在用于商业制造之前仍有待在患者中测试赖氨酸和甘氨酸缺失mAb的安全性(Hu等人,2017)。此外,在敲除羧肽酶D基因后,CHO细胞在mAb重链的末端产生了100% C末端赖氨酸(Hu等人,2016)。尽管这提供了消除C末端赖氨酸异质性的另一种解决方案,但它与我们的在不能选择改变细胞系的情况下将C末端赖氨酸降至最低从而产生更均匀的产品的目的相反。一般来讲,由于细胞系产生、先导克隆筛选和新工艺开发所需的时间,改变细胞系可能花费很长时间。最重要的是,根据开发阶段,细胞系的改变是需要严格监管审查的主要工艺改变。因此,与采用此处开发的酶处理相比,细胞系的改变实施起来可能更具挑战性。
还已经使用细胞培养基来调节C末端赖氨酸。据报道,较低的铜浓度和较高的锌浓度(Luo等人,2012;Yuk等人,2015)以及调整培养基中的赖氨酸浓度(Zhang等人,2015)可以用于降低C末端水平。对于工艺控制策略,已经充分研究了温度转变至较低程度可以增加细胞培养物中的主峰水平(Kishishita等人,2015;McHugh,Xu,Aron,Borys和Li,2020)。然而,正如所预期的,此类培养基和温度转变策略将是细胞系和工艺依赖性的。
在本发明的某些实施方案中,允许细胞生长确定的时间段以在生物反应器中产生目的蛋白。例如,根据细胞培养物的起始浓度、细胞生长的温度和细胞的固有生长速率,可以使细胞在生物反应器中生长5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20天或更多天。本发明的从业人员将能够根据多肽生产要求和细胞本身的需要来选择生长的持续时间。在本发明的某些方面,在已经使细胞在生产生物反应器中生长至少8天、至少9天、至少10天、至少11天、至少12天、至少13天、至少14天、至少15天、至少16天、至少17天、至少18天、至少19天、至少20天、至少21天或至少22天后添加羧肽酶。
在生产生物反应器运行结束时,取出并通过去除细胞和细胞碎片来收获细胞培养液,以产生适合于蛋白质纯化的澄清的物料。这通常通过任何合适的技术(包括但不限于离心、深度过滤和无菌过滤,取决于规模和设备能力)来实现。
在本发明的某些方面,将羧肽酶添加到细胞培养的生产阶段的任何点。在本发明的一些方面,在收获之前或期间,将羧肽酶添加到在生产生物反应器中生长0、2、4、6、8、10、12、14、16、18、20、22、24小时或更长时间或者其间的任何时间的细胞中。在本发明的某些优选方面,在收获前约2小时添加羧肽酶。
在本发明的某些方面,在将羧肽酶添加到生产生物反应器中后,保持培养温度与在先前培养条件中使用的相同,或者转变温度。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适温度。
在本发明的某些方面,在将羧肽酶添加到生产生物反应器中后,保持培养pH与在先前培养条件中使用的相同,或者转变pH。在某些方面,在添加羧肽酶后,pH高于7.0。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适pH。
在本发明中开发的CpB处理提供了一种简单、稳健、灵活且有成本效益的方法用于有效去除C末端赖氨酸,并且预期对细胞培养物制造具有最小的影响。由于潜在机制的性质,这种酶处理策略可能适用于具有类似质量问题的其他工艺。
表达的蛋白质的纯化
一般来讲,通常将需要从澄清的物料中分离和/或纯化目的蛋白(例如mAb)。通常,澄清的物料将经历一系列纯化步骤,包括但不限于亲和色谱(例如蛋白A色谱)、病毒灭活和深度过滤、疏水相互作用色谱、离子交换色谱、病毒过滤、浓缩和渗滤。
在本发明的某些方面,在这些纯化工艺中的任何一种期间添加羧肽酶。
在本发明的某些实施方案中,本公开文本提供了提高目的治疗性蛋白的生产率的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)收集澄清的物料;c)使澄清的物料经受纯化工艺;以及d)将羧肽酶添加到纯化工艺中。
在本发明的某些实施方案中,本公开文本提供了产生目的治疗性蛋白的方法,所述方法包括:a)将表达所述蛋白质的宿主细胞在生物反应器中在优化的培养条件下培养至少6天;b)收集澄清的物料;c)使澄清的物料经受纯化工艺;以及d)将羧肽酶添加到纯化工艺中。
重组抗体
本发明的方法可以用于大规模生产任何抗体。在本发明的范围内的抗体包括但不限于:抗HER2抗体,包括曲妥珠单抗
在本发明的某些方面,mAb是纳武单抗。
在本发明的某些方面,本公开文本提供了降低细胞培养物中目的单克隆抗体(mAb)的异质性的方法,所述方法包括:a)将表达所述mAb的宿主细胞在生产生物反应器中在优化的培养条件下培养至少6天,其中mAb碱性种类的百分比高于总mAb的8%;b)将羧肽酶添加到培养的细胞中;c)收集澄清的物料;以及e)经受纯化工艺。
在本发明的某些方面,本公开文本提供了降低细胞培养物中目的单克隆抗体(mAb)的异质性的方法,所述方法包括:a)将表达所述mAb的宿主细胞在生产生物反应器中在优化的培养条件下培养至少10天,其中mAb碱性种类的百分比高于总mAb的10%;b)将羧肽酶添加到细胞培养物中;c)收集澄清的物料;以及e)经受纯化工艺。
在本发明的某些方面,将羧肽酶以足以减少mAb碱性种类的CP:mAb的比率添加到生产生物反应器中,其中mAb碱性种类的百分比降至CP处理的澄清的物料中的总mAb的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.1%或更少。
在本发明的某些方面,将羧肽酶以足以减少mAb碱性种类的CP:mAb的比率添加到生产生物反应器中,其中mAb碱性种类的百分比降至CP处理的澄清的物料中的总mAb的少于8%。
在本发明的某些优选方面,mAb碱性种类的百分比降至CP处理的澄清的物料中的总mAb的少于5%。
先前的描述应理解为仅是代表性的,并不旨在是限制性的。用于实施本发明的替代方法和材料以及另外的应用对于本领域技术人员而言将是清楚的,并且旨在包括在所附权利要求中。
实施例1
材料和方法
用于mAb-1的细胞系、培养基和上游细胞培养工艺
在本研究中,使用四种不同的细胞培养工艺(工艺A、B、C和D)进行mAb-1(IgG4)生产。将重组CHO细胞系(其具有内源性谷氨酰胺合成酶(GS)基因并通过使用GS作为选择标记物将其工程化)用于采用专有无血清培养基的工艺A。对于工艺B、C和D,发生了变化,将具有内源性GS敲除(GS
工艺A是一种常规的为期14天的补料分批工艺,接种细胞密度为0.3×10
用于mAb-1的上游细胞培养物滴度、生产率和其他过程中测定
使用蛋白A UPLC测量产物浓度或滴度(g/L)。为了比较补料分批模式与灌注模式之间的生产率,在本研究中使用时空产率或总体容积生产率(g/L/天)和空间产率(g/L)。时空产率被定义为在从第0天到测量mAb-1浓度的那天的培养持续时间内,每L培养体积产生的总mAb-1(Bausch等人2019)。空间产率(在本研究中提出的一个新的细胞培养术语)被定义为每升培养体积产生的总mAb-1。补料分批工艺的空间产率等于生物反应器滴度,而灌注工艺的空间产率远高于生物反应器滴度,因为将包括产物的细胞培养液移出生物反应器并将新鲜培养基连续补料到生物反应器中。将归一化空间产率或滴度(归一化重量/L)相对于作为100%的工艺B的第10天平均滴度进一步归一化。归一化时空产率(归一化重量/L/天)等于归一化空间产率(相对于工艺B的第10天平均滴度)除以培养持续时间。
如下进行其他过程中细胞培养物测定。使用Bioprofile pHOx分析仪(NovaBiomedical,美国)检测离线pH、pCO
CpB处理方法
用于完全切割C末端赖氨酸残基的CpB处理方案如下:CpB酶浓度为在含有25mMTris-HCl和100mM NaCl的pH 7.6Tris缓冲液中的1%(w/w)比率的CpB:mAb,并且在37℃下孵育过夜。所述方法适用于不同基质,包括全细胞培养物或上清液。用于mAb-1的CpB处理方案使用低得多的0.01%(w/w)的CpB浓度,在34℃下持续2小时,这也实现了完全C末端赖氨酸切割。未调整全细胞培养物或上清液的pH,因为mAb-1全细胞培养物和上清液的pH值在pH7.5-8.0的最佳范围内。从以1000g离心10min的生物反应器样品中获得上清液。在CpB处理中使用的上清液是新鲜制备的,或者是从-80℃下储存的冷冻样品中解冻的。不同pH和温度研究的方法描述于结果部分。
在本研究中使用来自不同来源的三种不同的CpB产品:从大肠杆菌(E.coli)制备的重组CpB(ProSpec-Tany TechnoGene Ltd.,以色列)、从巴斯德毕赤酵母(P.pastoris)制备的GMP级重组CpB(Roche,美国)和从猪胰腺中提取的猪CpB(Sigma-AldrichCorporation,美国)。
下游处理和CpB清除研究
为了产生用于下游处理的细胞培养材料并且评价CpB清除,使用工艺B的两个5L生物反应器,如结果部分所述。在第14天收获时,将在收获之前的一个5L全细胞培养物用0.05%(w/w)CpB在34℃下处理2小时,而将另一个5L生物反应器在不进行CpB处理的情况下在34℃下维持2小时作为对照。然后将处理的和未处理的5L全细胞培养物均通过相同的下游步骤处理。在以1000g离心30min后,将上清液通过0.2μm无菌过滤进行过滤。然后通过由以下组成的下游步骤处理澄清的物料:通过蛋白A亲和色谱纯化、低pH病毒灭活和深度过滤、疏水相互作用色谱(HIC)、阳离子交换色谱(CEX)、通过超滤和渗滤(UF/DF)浓缩,以产生最终配制的DS。
产物质量属性
评估全细胞培养物和上清液样品的质量属性需要在提交进行质量属性测定之前通过蛋白A色谱纯化。将蛋白A步骤(蛋白A洗脱、HIC和CEX收集等)后的下游过程中样品直接提交进行质量属性测定。
使用带有Alcott 720NV自动进样器(加利福尼亚州圣何塞)的Protein SimpleiCE3仪器通过成像毛细管等电聚焦(iCIEF)测定电荷变体种类(主峰、酸性峰和碱性峰)。将样品与适当的pI标记物、两性电解质和尿素混合,然后注射到氟碳化合物包被的毛细管中。施加高电压,并且电荷变体根据其各自的pI迁移。UV照相机在280nM处捕获图像。鉴定出主峰,并且对迁移到酸性范围和碱性范围内的峰进行求和、定量,并且将其报告为相对百分比面积。将主峰的mAb-1规格相对于100%归一化。如果归一化主峰水平≥100%,则mAb-1药品符合规格。如果归一化主峰水平<100%,则mAb-1药品不符合该规格。在本研究中,将所有主峰和碱性种类水平均相对于作为100%的使用DS规格的主峰值归一化。未报告酸性种类水平,因为对于所有工艺,无论CpB处理如何,酸性种类水平都完全在规格内。
使用来自Waters(马萨诸塞州米尔福德)的Glyco Works RapiFluor-MS试剂盒进行N-聚糖分析。在配备有温控自动进样器和荧光检测器的Waters Acquity H-Class系统(马萨诸塞州米尔福德)上使用采用洗脱梯度的Acquity UPLC Glycan BEH酰胺,
使用Waters Acquity BEH200,4.6mm×30mm,1.7μm柱联用Waters Acquity保护柱进行杂质的尺寸排阻色谱(SEC),在配备有温控自动进样器和Waters 2996PDA检测器的Waters Acquity UPLC系统(马萨诸塞州米尔福德)上在280nm处监测等度梯度。
在还原和非还原两种条件下制备样品用于通过CE-SDS得到蛋白质纯度。然后使用32Karat软件将样品注射到带有UV检测器和50μm内径预切毛细管的PA800仪器(AB Sciex,美国马萨诸塞州弗雷明汉)上。通过施加恒定的15kV发生分离。使用来自Waters(美国马萨诸塞州米尔福德)的Empower 3软件输出和分析数据。
使用工艺特异性夹心酶联免疫吸附测定(ELISA)定量HCP。将样品加载到来自VWR(美国宾夕法尼亚州拉德诺)的包被的测定板上,并且使用来自Tecan Inc.(美国北卡罗来纳州莫里斯维尔)的Magellan Infinite M1000 Pro读板仪测量吸光度。使用四参数逻辑斯谛曲线拟合算法反算浓度。
使用来自Integrated DNA Technologies(美国伊利诺伊州斯科基)的正向和反向引物以及来自Applied Biosystems(美国加利福尼亚州福斯特城)的TaqMan提取试剂盒通过qPCR测定残留宿主细胞DNA。使用来自Applied Biosystems(美国加利福尼亚州福斯特城)的7900实时PCR系统分析样品,并且使用标准曲线处理数据。
使用来自Repligen(美国马萨诸塞州沃尔瑟姆)的可商购获得的ELISA试剂盒测定残留蛋白A,并且使用来自Tecan Inc.(美国北卡罗来纳州莫里斯维尔)的MagellanInfinite M1000 Pro读板仪测量吸光度。使用四参数逻辑斯谛曲线拟合算法反算浓度。
通过ELISA测量整个纯化步骤的残留CpB。抗CpB抗体是在内部产生的,而辣根过氧化物酶缀合的二抗是从美国Thermo Fisher Scientific Inc.购买的。
上游成本分析
上游消耗品成本计算为每克最终配制的DS的美元数,如我们的先前出版物(J.Xu,Xu等人,2020)中详细描述的。在本研究中,将所有上游成本均相对于作为100%的在第10天收获的工艺B的成本归一化。简言之,上游消耗品成本集中在培养基、过滤器、探针和袋上,而下游处理(包括收获)成本不包括在内。假设在本研究中描述的强化实验室工艺可以以2000L一次性生物反应器规模放大,具有与在5L生物反应器中相同的滴度或空间产率和相同的原料消耗比率。对于为期14天的工艺B和工艺C,假设有0.01%(w/w)的另外的CpB成本,因为需要CpB处理来增加主峰以符合DS出厂规格。为了计算每克DS的上游成本,假设总体下游产率为基于实验室规模性能的70%。
结果
通过CpB处理提高强化工艺的mAb-1生产率和质量(主峰)
为了提高传统制造工艺A的mAb-1生产率,在本报告中开发出了三种强化工艺。如方法部分所述,使用空间产率(一个新术语,在本研究中定义为每升生物反应器培养物产生的蛋白质的总克数)和时空产率进行不同补料分批和灌注工艺的生产率比较。空间产率对于补料分批工艺等于生物反应器滴度,但是对于连续工艺,由于通过灌注将产物从生物反应器中移出,比生物反应器滴度高得多。目标接种细胞密度为0.3×10
如上所述,强化工艺的空间产率和时空产率从工艺B到工艺C和D均显著提高,与工艺A相比,工艺B、C和D的空间产率和时空产率均大幅提高。然而,对于补料分批工艺B(图2A)和C(图2B),主峰的水平均随着培养持续时间的增加而显著降低。此特定mAb-1的主峰的DS规格限值是100%(归一化值),其是基于商业制造中的工艺A建立的。尽管提高细胞培养物的生产率是极大的益处,但蛋白质质量属性必须符合出厂规格。因此,即使在整个为期14天的持续时间内,空间产率继续增加,对于工艺B在第10天收获(图1A)以及对于工艺C在第6天收获(图1B)也是有必要的。尽管灌注工艺D在所有工艺中获得了最高的空间产率和时空产率,但无法在制造中实施工艺D,因为工艺D的主峰水平在整个培养持续时间内低于规定的限值(图2C)。应当注意,在下游处理期间电荷变体谱没有改变。在本研究中,无论细胞培养持续时间如何,强化工艺B、C和D的其他质量属性(例如,SEC杂质和N-聚糖)都不是什么问题(数据未显示)。
强化工艺的归一化碱性种类水平(范围为从25%-65%)(图3)远高于工艺A(范围为从5%-18%)(n=164)。如图4所示,作为强化工艺的例子,碱性种类主要是由于C末端赖氨酸,如通过在标准CpB处理测定后大幅降低的值所证明的。在CpB处理后,大部分碱性种类被转化为主峰(从91.8%增加到107.7%)。尽管91.8%的主峰不符合规格(即,对于主峰,≥100%),但CpB处理后107.7%的主峰是令人满意的(图4)。应当注意,无论CpB处理如何,从工艺B、C和D制备的所有样品的酸性种类水平均符合规格(数据未显示)。因此,CpB处理后酸性种类的变化不是什么问题,并且在本研究中仅报告了主峰和碱性种类。
在多个时间点对从工艺B、C和D产生的所有过程中样品进行CpB处理,以评价其对主峰水平的影响。如图2所呈现,在CpB处理(虚线)后,对于所有强化工艺,主峰水平均随碱性种类的减少而大幅增加(图3)。在所测试的整个持续时间内,所有强化工艺在不同时间点的归一化主峰水平均高于100%(图2)。因此,对于工艺B,细胞培养持续时间可以从10天延长到14天,最终收获滴度平均增加38%(与第10天滴度相比,图1A),并且对于工艺C,细胞培养持续时间可以从6天延长到14天,最终收获滴度平均增加108%(与第6天滴度相比,图1B)。对于工艺D,CpB处理(图2C和图3C)具有最显著的影响,允许此工艺成为制造的潜在可行选择。
用于mAb-1的CpB处理优化
在初步的实验室研究(数据未显示)后,选择CpB处理的2小时持续时间,因为2小时的反应时间足以去除C末端赖氨酸并且易于在生物制造操作中实施。基于初始的1%(w/w)的酶:mAb比率,进一步优化CpB处理方法。首先,评价了不同基质中酶浓度的CpB处理效率。在全细胞培养液中,正如所预期的,标准CpB处理方法(例如,1%(w/w)酶浓度)将大部分碱性种类转化为主峰(图5)。观察到可以将CpB浓度降低100倍为0.01%(w/w),而获得了与在1%(w/w)CpB下的标准处理相同的效率(图5)。此外,0.01%(w/w)CpB浓度在细胞培养上清液和Tris缓冲液中也很有效(图5)。然而,如图5所示,当CpB浓度降低到0.001%(w/w)时,在细胞培养上清液(t检验,p<0.0001)和Tris缓冲液(t检验,p<0.01)中的主峰水平均显著低于用0.01%(w/w)处理的处理物的主峰水平。为了确保C末端赖氨酸的有效剪切,选择0.01%(w/w)浓度来进行所有以下研究。
其次,研究了CpB处理的温度。在36.5℃下开始补料分批细胞培养,并且将其转变至34℃的较低温度,而在室温下进行收获和下游纯化步骤。因此,使用0.01%(w/w)CpB持续2小时持续时间研究了范围为从室温、32℃、34℃和36.5℃的不同温度(图6)。在室温与36.5℃之间观察到类似的高CpB处理效率(图6)。
第三,研究了pH的影响。补料分批培养物可以从pH 6.5-8.0操作,而下游步骤通常在宽得多的pH范围内操作。因此,在34℃下用0.01%(w/w)CpB持续2小时持续时间评估了pH范围在pH 5与9之间的影响。选择34℃的温度,因为出于便于操作,最终的CpB处理步骤优选地在细胞培养工艺结束时进行(这将在本研究的后面详细描述)。从pH 7.2至8.9观察到碱性种类向主峰转化的类似的高效率,而在pH 6.0-7.0下观察到低约4%的效率(图7)。在pH5.0下观察到低得多的效率(图7)。
总之,CpB处理在不同基质(包括全细胞培养物、细胞培养上清液(或收获时澄清的物料)和Tris缓冲液)中在宽范围的pH和温度内有效(图5-图7)。发现CpB处理在其他缓冲液(如柠檬酸盐、磷酸盐)中也是有效的(数据未显示)。理论上,结果表明,可以将CpB处理引入生物制造工艺的许多步骤(从生物反应器操作、收获和不同的下游纯化步骤)之一中(图8)。决定在补料分批工艺的细胞培养部分结束时引入2小时CpB处理。主要原因如下。在开始通过过滤收获之前,将生物反应器从34℃冷却至室温,这在商业生物制造中花费>2小时。从34℃至室温的此温度范围以及冷却时间对于有效的CpB处理是理想的(图6)。尽管细胞培养需要无菌操作,但在冷却阶段的短持续时间期间,将CpB添加到生产生物反应器中不需要无菌操作。这使得CpB处理更容易,对现有制造工艺的影响最小。全细胞培养物的pH在pH 7.5-8.0之间,这对于处理是最佳的(图7)。在生产生物反应器步骤完成时引入CpB允许在收获和下游纯化步骤期间将它有效去除,因为需要充分证明CpB(一种新原料)在最终的药品中被清除。对于灌注工艺D,可以在室温下将CpB处理引入缓冲容器中持续2小时,然后进行0.2μm无菌过滤和蛋白A纯化步骤。
在5L规模下应用CpB的工艺的展示
由于在生物制造中使用的所有原材料的清除必须在最终的DS中得到证明(FDA,2016;J.Xu,Rehmann,Tian等人,2020),使用工艺B作为例子运行两个5L补料分批生物反应器。进行随后的收获和下游步骤,一个进行CpB处理,一个不进行。为了确保在最终的DS中稳健地去除CpB,使用0.05%(w/w)的5倍高的CpB水平。细胞培养物的性能参数(例如,VCD、细胞活力和归一化滴度)与未处理的对照工艺B中的性能参数类似(图9)。仅蛋白A步骤显示出CpB的超过2-log的降低。CpB在蛋白A洗脱物中低于检测限(<50μg/L),并且在其余下游步骤中仍不可检测(表1)。对于电荷变体谱,CpB处理的样品的主峰水平高于那些未处理的样品,并且贯穿下游步骤,每个组维持类似的水平(表1)。所有其他质量属性(例如,工艺相关杂质和产物相关杂质)在这两种条件之间均是相当的,同时获得了类似的步骤和总体下游产率(表1)。
用于mAb-1的CpB处理成本分析
由于实施CpB处理延长了细胞培养持续时间,分别地,工艺B的平均最终滴度提高了38%,并且工艺C的平均最终滴度提高了108%(图1和表2)。尽管添加0.01%(w/w)CpB使每个上游批次的总消耗品成本略微增加(对于工艺B为5%,并且对于工艺C为6%),但由于通过将培养持续时间延长到14天而获得的滴度显著提高,工艺B和C的每克DS的上游消耗品成本分别减少了22%和46%(表2)。
表1.使用从图7中描述的5 L生物反应器运行产生的细胞培养液贯穿整个下游处理未处理的对照与用0.05%(w/w)CpB处理的条件之间的CpB清除、过程中质量属性和产率。将主峰和碱性种类水平相对于作为100%的mAb-1主峰的出厂规格归一化。NA:不可用,因为未测试那些样品。
表2.使用强化补料分批工艺B和C生产mAb-1的CpB处理的商品成本分析。基于在1000 L规模下的滴度与图1中报告的5L规模相同和70%的总体下游产率的假设计算上游消耗品成本(每克药品的归一化值)。将每克配制的药品的滴度和上游消耗品成本均相对于作为100%的工艺B的第10天收获条件归一化。NA:不适用。
CpB处理用于其他mAb产品的潜在应用
除mAb-1外,还使用1%(w/w)CpB浓度用标准CpB处理方法测试了6种其他mAb产品。在CpB处理后,mAb-2、mAb-3和mAb-4的碱性种类大幅减少并且主峰大幅增加(表3)。对于mAb-5,对碱性种类和主峰的影响也很明显,但是程度较小。然而,未观察到mAb-6和mAb-7的变化(表3)。CpB对碱性种类减少的有效性的差异是由于在用于这些mAb的细胞培养物中存在不同量的C末端赖氨酸。CpB处理只能转化由C末端赖氨酸产生的碱性种类,而不能转化由于其他分子修饰(如N末端焦谷氨酸盐、酰胺化等)产生的碱性种类。这些结果表明,通过增加主峰来提高蛋白质均匀性的CpB处理策略可能适用于那些含有C末端赖氨酸种类的mAb产品。
表3.不同mAb产品的未处理的药品或用1%(w/w)酶浓度的CpB处理的处理物的归一化主峰和碱性种类水平。将主峰和碱性种类水平相对于作为100%的主峰的mAb-1出厂规格归一化。
实施例2
材料和方法
细胞系、培养基和细胞培养工艺
使用CHO GS细胞系进行专有人mAb-8的表达,而使用CHO DG44细胞系进行专有人mAb-3的表达。使用专有化学成分确定的种子培养基、基础培养基和补料培养基。使用摇瓶(Corning Life Sciences)进行小瓶解冻和种子扩增步骤,所述摇瓶含有具有甲硫氨酸亚砜亚胺作为CHO GS细胞系的选择剂的种子培养基和具有甲氨蝶呤作为CHO DG44细胞系的选择剂的另一种种子培养基。将细胞每3-4天传代持续至少2周,然后接种生产培养物。使用含有初始体积为80mL的基础培养基和目标接种活细胞密度(VCD)为1.5×10
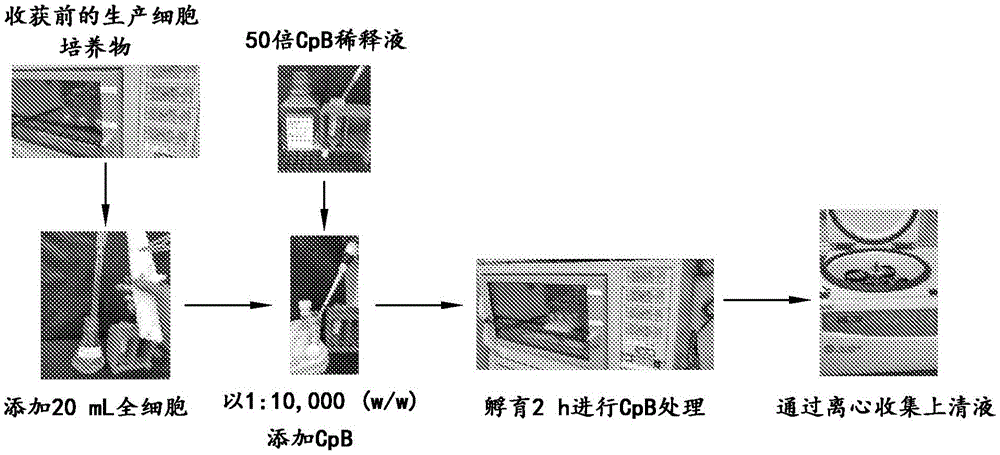
体外CpB处理方案
在本实验中使用之前,将2.6mg/mL的从巴斯德毕赤酵母制备的GMP级重组CpB(Roche)保持在-20℃下冷冻。用于切割C末端赖氨酸残基的体外CpB处理方案示于图10中。临用前,将1mL冷冻的CpB等分试样解冻并且在杜氏磷酸盐缓冲盐水(Gibco)中稀释50倍。在补料分批生产结束时,将来自每个摇瓶的20mL全细胞培养物等分到两个50mL Falcon管中。把一组Falcon管(n=3)作为无CpB对照。然后将50倍稀释的CpB以1:10,000(w/w)的CpB:mAb比率添加到另一组Falcon管(n=3)中。随后,在相同的生产细胞培养条件(150rpm、34℃和5% CO
过程中细胞培养物和质量属性测定
从每个摇瓶中取样细胞培养液,并且直接分析其细胞计数、营养物质和代谢物。使用Vi-CELL XR自动细胞计数器(Beckman Coulter)离线定量VCD和细胞活力。使用CEDEXBio HT分析仪(Roche)定量葡萄糖、乳酸盐和氨。
为了测量滴度,将细胞培养液以1000×g离心10分钟,并且使用蛋白A UPLC方法分析上清液。对于mAb-1,归一化滴度(表示为归一化重量/L)等于每个时间点的真实滴度(g/L)除以第10天滴度的平均值(g/L),如我们的先前报道(Xu等人2021b)所述。归一化容积生产率(表示为归一化重量/L/天)计算为两个时间点之间的归一化滴度的差除以持续时间。
对于质量属性测定,首先将在-80℃下的进行和不进行CpB处理的所有上清液解冻并且通过蛋白A色谱纯化。如先前所述(Yongky等人2019)进行质量属性测定。通过成像毛细管等电聚焦测量电荷变体种类(酸性种类、主要种类和碱性种类)。如我们的先前报道(Xu等人2021b)所述,将mAb-8和mAb-3的主峰和碱性种类均相对于作为100%的主峰的mAb-1规格归一化。使用可商购获得的来自Waters的RapiFluor-MS N-聚糖试剂盒测量N-聚糖谱(例如G0、G0F、G1F、G2F和Man5)。使用SEC来测量SEC杂质(例如,高分子量物质(HMW)、低分子量物质(LMW)和单体)。
统计分析
除非另外说明,否则图中呈现的数据是样品平均值与标准差。使用显著性水平设置为p值<0.05的Microsoft Excel进行学生t检验分析。
结果
用于通过工业CHO GS细胞系生产mAb-8的体外CpB处理之前和之后的细胞培养物
使用平台补料分批细胞培养工艺进行在250mL摇瓶(n=3)中通过工业CHO GS细胞系的mAb-8生产,持续时间为12天。初始接种VCD为1.65±0.13×10
归一化滴度从第6天的13.5%±0.0%线性增加到第10天的43.1%±0.0%,平均生产率为7.41%归一化重量/L/天。随后,滴度逐渐趋于平稳,在第12天的最终归一化滴度为48.5%±0.0%,并且在第10天与第12天之间的平均生产率为2.69%(图11A)。
mAb-8补料分批生产的代谢物谱示于图11B中。在整个持续时间内,将葡萄糖浓度维持在1与6g/L之间。正如所预期的,在早期细胞生长阶段期间乳酸盐增加,在第5天的峰值乳酸盐浓度为3.16±0.01g/L,然后从第10天到第12天转变为乳酸盐消耗阶段,降低的浓度在1.2-1.4g/L之间(图11B)。在早期细胞生长阶段期间,铵在第4天增加到3.60±0.02mM的峰值铵浓度,在第7天降低到1.12±0.04mM的最低水平,并且从第7天到第12天逐渐再次增加到2.70±0.02mM的最终浓度(图11B)。这种铵在细胞培养的早期阶段期间增加、在中间减少以及在后期阶段再次增加的模式对于补料分批细胞培养是正常的,并且与我们先前关于通过其他CHO细胞系生产不同mAb的报道(Xu等人2020b;Xu等人2020c)一致。
进行和不进行CpB处理用于mAb-8生产的电荷变体和其他关键质量属性示于图12A、图12B和图12C中(n=3)。未经受CpB处理的对照条件所显示的归一化碱性种类的平均值为47.6%±1.60%。值得注意的是,在CpB处理的条件下,归一化碱性种类显著降低到29.0%±0.37%(p<0.0001)(图12A)。对于CpB处理的条件,观察到归一化主峰的平均值相应增加到108.8%±0.31%,相对于对照展现的93.9%±1.12%的归一化主峰值显著增加(p<0.0001)(图12A)。因此,因CpB处理减少的碱性种类中的大部分(18.6%中有14.8%)被转化为主峰,而因CpB处理减少的碱性种类中的剩余3.8%被转化为酸性种类。尽管CpB处理显著增加了mAb-8的主峰,但SEC杂质(图12B)和N-聚糖(图12C)不受处理的影响,表明这种CpB处理减少了mAb的碱性电荷变体,而不影响其他关键质量属性。
用于通过工业CHO DG44细胞系生产mAb-3的体外CpB处理之前和之后的细胞培养
如方法部分所述,对于mAb-3,使用与mAb-8类似的持续时间为12天的在250mL摇瓶(n=3)进行中的平台补料分批细胞培养工艺,不同之处在于mAb-3是采用与用于mAb-8的不同的种子和基础培养基由工业CHO DG44细胞系产生的。初始接种VCD为1.51±0.08×10
归一化滴度从第6天的13.5%±0.0%增加到第8天的26.9%±0.0%,平均生产率为6.73%归一化重量/L/天,而在第8天与第10天之间观察到9.43%的最高平均生产率。平均生产率在第10天与第12天之间趋于平稳,为5.84%归一化重量/L/天,并且最终归一化滴度为57.5%±0.8%(图13A)。
mAb-3补料分批生产的代谢物谱示于图13B中。在整个持续时间内,将葡萄糖浓度维持在1与9g/L之间。乳酸盐在整个持续时间内增加,在第12天mAb-3的峰值乳酸盐浓度为2.67±0.07g/L(图13B),这低于mAb-8的3.16g/L的峰值乳酸盐浓度(图11B)。尽管mAb-3没有乳酸消耗阶段,但2.67g/L的峰值乳酸盐较低,表明乳酸盐本身不应当影响补料分批细胞培养物的性能。在早期细胞生长阶段期间,铵在第7天增加到5.31±0.03mM的峰值浓度。然后,在后期细胞生长阶段期间,铵在第10天降低到1.76±0.02mM的最低水平,但是在第11天和第12天,铵略微增加回到约2.5mM(图13B)。
与mAb-8类似,全细胞培养物的体外CpB处理增加了mAb-3的主峰,而不影响其他关键质量属性(图14A、图14B和图14C,n=3)。对于CpB处理的条件,归一化碱性种类的平均值为14.3%±0.44%,这显著低于未处理的对照的51.8%±0.25%(p<0.0001)(图14A)。另一方面,对于CpB处理的条件,归一化主峰的平均值为114.6%±0.37%,这显著高于对照的92.1%±0.51%(p<0.001)(图14A)。这表明,在CpB处理后,碱性种类的37.5%中有22.5%被转化为主峰,而碱性种类中的剩余15%被转化为酸性种类。至关重要的是,尽管CpB处理相对于未处理的对照显著增加了mAb-3的主峰,但其他关键质量属性(包括SEC杂质(图14B)和N-糖基化(图14C))不受CpB处理的影响。
