一种丝状真菌生长曲线测定方法及其测定装置
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物技术领域,涉及一种丝状真菌生长曲线测定方法及其测定装置。
背景技术
微生物生长时期一般分为:迟缓期、对数期、稳定期、衰亡期。一般常规的细菌等微生物,可以直接比浊法来测定其生长曲线。一般具有菌丝的真菌,也有很多测定方法,如离心称重法、菌丝浓度法、菌丝长度测量法。离心称重法由于每隔一段时间就需要取出全部离心称量,耗时长,且称重后,培养物就没有了,测定生长曲线的时候,若使用离心称重法,便在初始的时候,就需要配制很多数量的培养基,同时接种,且离心称重法有可能因为每瓶个体的不同,会有误差;菌丝浓度法是通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况,但由于该方法相对粗放简便,离心沉淀物中夹杂有一些固体营养物,从而易导致结果出现偏差;菌丝长度测量法则是在培养基上测定一定时间内菌丝生长的长度,或是利用一只一端开口并带有刻度的细玻璃管,到入合适的培养基,卧放,在开口的一端接种微生物,一段时间后记录其菌丝生长长度,借此衡量丝状微生物的生长,该方法操作相对复杂,且对无菌环境要求高。
发明内容
本发明的目的在于提供一种丝状真菌生长曲线测定方法及其测定装置,具有操作简便快捷,对菌体生长影响小、准确性高的特点。
本发明的目的可以通过以下技术方案实现:
一种丝状真菌生长曲线测定装置,包括:
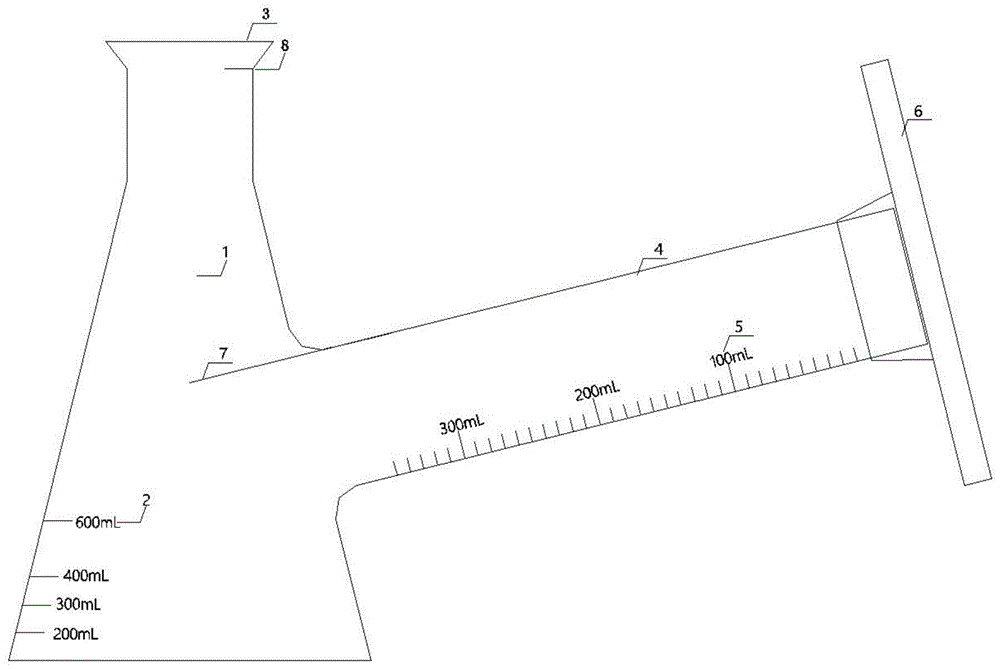
培养装置1、测量筒4及承载架6;
所述培养装置1上设有培养装置液位刻度线2,内设有第一液体挡板7及第二液体挡板8,顶部开有瓶口3;
所述测量筒4上设有测量筒液位刻度线5及实心管401;
所述承载架6通过嵌套的方式固定于实心管401上。
作为本发明的一种优选技术方案,其特征在于,所述测定装置成分为玻璃、高分子材料或具有可视刻度窗口便于测定的不锈钢。
作为本发明的一种优选技术方案,其特征在于,所述测定装置中的测量筒(4)为圆柱形的测量筒或六棱柱形的测量筒。
一种利用上述测定装置测定丝状真菌生长曲线的方法,包括以下步骤:
W1.配制一定体积的液体培养基,并记录此时体积为V
W2.使培养装置1的底面与水平面平行,将液体培养基从瓶口3处倒入培养装置1中,并用透气硅胶塞塞好或纱布加牛皮纸包好瓶口3,然后进行湿热灭菌;
W3.湿热灭菌结束后,取出装置并使其自然冷却至室温后,在超净工作台中接入菌种,菌种密度为>10
W4.将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降10~20min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
W5.记录完毕后,拆下承载架6,把装置正放使培养装置1的底面与水平面平行,然后放入摇床中培养;
W6.每培养一段时间取出测量,将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降2~4min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
作为本发明的一种优选技术方案,其特征在于,步骤W1所述的液体培养基含有助剂;
所述助剂由聚乙烯醇、乙酰化酶及乙酰辅酶A组成。
作为本发明的一种优选技术方案,其特征在于,所述的聚乙烯醇、乙酰化酶、乙酰辅酶A的质量比为3~6:1~2:2~4。
作为本发明的一种优选技术方案,按重量份计算,每420份所述的液体培养基含有6~12份助剂。
本发明的有益效果:
(1)本发明所提供的测定方法通过利用丝状真菌振荡培养后产生一定体积的菌丝,测定其菌丝的量来实现,其测定装置中的测量筒4与培养装置1连接在一起,在培养过程中,可以随时测量,不需要把微生物倒出来,不会因测量造成污染而影响下一次测量的结果,且相比于称重法或菌丝长度测量法更加简单,相比于菌丝浓度法更加精确。
(2)本发明所提供的测定方法及测定装置只需要配置几瓶用于平行实验数据结果的培养基,并接种培养即可,具有操作简单,耗时短,经济性好,且测量的数据都来源于同一瓶的数据,准确性更强的效果,可以在极短的时间内给科研人员相应的丝状真菌生长状态指导。
(3)本发明测定方法中所提供的助剂,可以加快丝状真菌在测量筒4中的沉降速度。助剂中的乙酰化酶和乙酰辅酶A对丝状真菌的细胞壁进行乙酰化修饰,乙酰化酶通过将乙酰辅酶A的乙酰基转移到细胞壁表面上的氨基酸残基上,提高其菌丝的疏水性,从而使得装置从摇床中取出测定丝状真菌生长情况时,由于脱离了摇床的振动,其菌丝的疏水性可使其快速沉降于测量筒4的底部,大大减少了测定的耗时,一定程度上减少了取出测试时对丝状真菌生长的影响,确保其生长的连续性;另助剂中的聚乙烯醇可以一定程度上减少丝状真菌菌丝的粘附性,使得在摇床中振动培养时丝状真菌在液体培养基中分散得更均匀,减少了菌丝间因粘附成团从而影响其正常生长。
附图说明
为了便于本领域技术人员理解,下面结合附图对本发明作进一步的说明。
图1为本发明测量装置主视图;
图2为本发明测量装置局部示意图;
图3为本发明实施例1和对比例1的米曲霉生长曲线图。
其中:1-培养装置;2-培养装置液位刻度线;3-瓶口;4-测量筒;5-测量筒液位刻度线;6-承载架;7-第一液体挡板;8-第二液体挡板。
具体实施方式
为更进一步阐述本发明为实现预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明的具体实施方式、结构、特征及其功效,详细说明如下。
实施例1
所用菌种:米曲霉;
所用液体培养基及配比:酵母粉2g,蛋白胨4g,葡萄糖4g,蒸馏水197mL,聚乙烯醇1.5g,乙酰化酶0.5g,乙酰辅酶A1.0g,pH调节至6.0。W1.按液体培养基配方成分配制液体培养基,并记录此时体积为V
W2.使培养装置1的底面与水平面平行,将液体培养基从瓶口3处倒入培养装置1中,并用透气硅胶塞塞好或纱布加牛皮纸包好瓶口3,然后115℃湿热灭菌20min;
W3.湿热灭菌结束后,取出装置并使其自然冷却至30℃,在超净工作台中接入0.1%米曲霉固体菌种,菌种密度为2ⅹ10
W4.将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降10min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
W5.记录完毕后,拆下承载架6,把装置正放使培养装置1的底面与水平面平行,然后放入摇床中180rpm,28℃进行培养;
W6.每培养4h取出测量一次,将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降2min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
实施例2
所用菌种:蛹虫草;
所用液体培养基及配比:酵母粉2g,蛋白胨4g,葡萄糖4g,蒸馏水196mL,聚乙烯醇2.0g,乙酰化酶0.7g,乙酰辅酶A1.3g,pH调节至6.5。W1.按液体培养基配方成分配制液体培养基,并记录此时体积为V
W2.使培养装置1的底面与水平面平行,将液体培养基从瓶口3处倒入培养装置1中,并用透气硅胶塞塞好或纱布加牛皮纸包好瓶口3,然后115℃湿热灭菌20min;
W3.湿热灭菌结束后,取出装置并使其自然冷却至30℃,在超净工作台中接入0.1%蛹虫草固体菌种,菌种密度为2ⅹ10
W4.将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降15min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
W5.记录完毕后,拆下承载架6,把装置正放使培养装置1的底面与水平面平行,然后放入摇床中190rpm,29℃进行培养;
W6.每培养4h取出测量一次,将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降3min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
实施例3
所用菌种:蛹虫草;
所用液体培养基及配比:酵母粉2g,蛋白胨4g,葡萄糖4g,蒸馏水194mL,聚乙烯醇3.0g,乙酰化酶1.0g,乙酰辅酶A 2.0g,pH调节至7.0。W1.按液体培养基配方成分配制液体培养基,并记录此时体积为V
W2.使培养装置1的底面与水平面平行,将液体培养基从瓶口3处倒入培养装置1中,并用透气硅胶塞塞好或纱布加牛皮纸包好瓶口3,然后115℃湿热灭菌20min;
W3.湿热灭菌结束后,取出装置并使其自然冷却至30℃,在超净工作台中接入0.1%蛹虫草固体菌种,菌种密度为2ⅹ10
W4.将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降20min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
W5.记录完毕后,拆下承载架6,把装置正放使培养装置1的底面与水平面平行,然后放入摇床中200rpm,30℃进行培养;
W6.每培养4h取出测量一次,将装置翻转使承载架6的底面与水平面平行,使含有菌种的液体培养基从培养装置1中流入测量筒4中,待自然沉降4min,此时含有菌种的液体培养基出现明显分层,上层为液体培养基层下层为菌种层,读取此时菌种层的体积,记录为V
对比例1
参照实施例1的液体培养基配方及培养条件,利用离心称重法对米曲霉菌进行测量记录及绘制生长曲线。
对比例2
液体培养基中不添加乙酰化酶及乙酰辅酶A,其余操作步骤参照实施例1。
对比例3
液体培养基中不添加聚乙烯醇,其余操作步骤参照实施例1。
测试
每个测量时间点,米曲霉生长速率v
如图3中所示,V/mL曲线为利用本装置测量的生长曲线,G/g曲线为利用常规的离心称重法测的生长曲线。从V/mL曲线中,可以看出约在12h之前为延滞期,12h后米曲霉开始较快速生长,12~32小时为对数生长期,在32h左右进入稳定期。这一结论基本也可以从G/g曲线中得出,从而验证本装置测量方法的有效性以及科学性。
表1菌种生长测量数据记录结果
记录对比例2步骤W6中菌种沉降完全(即对应取样记录时间沉降至相近体积读数)所需时间,记录如下表2所示。
表2对比例2菌种沉降时间记录结果
观察实施例1及对比例3中菌种摇床培养时菌种在培养液中的分布情况,记录结果如下表3所示。
表3菌种分布情况记录结果
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明,任何本领域技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容做出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简介修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 基于全卷积网络的交叠、粘连染色体自动分割方法
- 一种基于深度学习的染色体识别方法
- 一种基于同源同类染色体信息的染色体分割方法及装置
- 一种基于同源同类染色体信息的染色体分割方法及装置
