稳定的阿匹莫德组合物和其用途
文献发布时间:2024-04-18 20:01:23
相关申请
本申请根据35 U.S.C.§119(e)要求于2021年6月11日提交的题为“稳定的阿匹莫德组合物(STABILIZED APILIMOD COMPOSITIONS)”的美国临时申请第63/202,438号的优先权,所述美国临时申请的全部内容通过引用并入本文。
技术领域
本发明涉及阿匹莫德(apilimod)的稳定形式、阿匹莫德的稳定调配物以及将其用于疗法的方法。
背景技术
阿匹莫德,也被称为STA-5326,以下称为“阿匹莫德”,被认为是IL-12和IL-23的有效转录抑制剂。参见例如,Wada等人《血液(Blood)》109(2007):1156-1164。IL-12和IL-23是通常由如B细胞和巨噬细胞等免疫细胞响应于抗原刺激而产生的炎性细胞因子。自身免疫性病症以及以慢性炎症为特征的其它病症的特征部分地在于这些细胞因子的不适当产生。在免疫细胞中,阿匹莫德对IL-12/IL-23转录的选择性抑制最近被证明是由阿匹莫德与磷脂酰肌醇-3-磷酸5-激酶(PIKfyve)的直接结合介导的。参见例如,Cai等人《化学与生物学(Chemistry and Biol.)》20(2013):912-921,Gayle等人,《血液》129(2017);1768-1778。PIKfyve在Toll样受体信号传导中发挥作用,这在先天免疫中很重要。
基于其作为免疫调节剂和IL-12/IL-23的特异性抑制剂的活性,阿匹莫德已被认为可用于治疗自身免疫性和炎性疾病和病症。参见例如,US 6,858,606和6,660,733(描述了嘧啶化合物家族,包含阿匹莫德,据称可用于治疗以IL-12或IL-23过量产生为特征的疾病和病症,如类风湿性关节炎、败血症、克罗恩氏病(Crohn's disease)、多发性硬化症、银屑病或胰岛素依赖型糖尿病)。类似地,基于其抑制c-Rel或IL-12/23的活性,阿匹莫德被认为可用于治疗某些癌症,尤其是在这些细胞因子被认为在促进异常细胞增殖中发挥作用的癌症中。参见例如,WO 2006/128129以及Baird等人,《肿瘤学前沿(Frontiers inOncology)》3:1(2013,分别)。
针对阿匹莫德的三项临床试验中的每一项都集中在其对自身免疫性和炎性疾病的潜在功效上。这些试验是在患有银屑病、类风湿性关节炎和克罗恩氏病的患者中进行的。一项针对患有银屑病的患者的开放标签临床研究得出结论,阿匹莫德的口服施用显示出支持抑制IL-12/IL-23合成以用于治疗TH1和TH17介导的炎性疾病的免疫调节活性。Wada等人,《公共科学图书馆期刊(PLosOne)》7:e35069(2012年4月)。但是类风湿性关节炎和克罗恩氏病的对照试验的结果并不支持阿匹莫德对IL-12/IL-23的抑制转化为这两种适应症的临床改善的观点。在一项针对患有类风湿性关节炎的患者的随机、双盲、安慰剂对照的阿匹莫德II期临床试验中,阿匹莫德未能改变滑膜IL-12和IL-23的表达。Krauz等人,《关节炎与风湿病(Arthritis&Rheumatism)》64:1750-1755(2012)。作者得出结论,“结果不支持阿匹莫德对IL-12/IL-23的抑制能够诱导RA的稳健临床改善的观点”。类似地,一项针对阿匹莫德用于治疗活动性克罗恩氏病的随机、双盲、安慰剂对照试验得出结论,尽管阿匹莫德耐受性良好,但与安慰剂相比,没有表现出功效。Sands等人《炎性肠病(Inflamm Bowel Dis)》.2010年7月;16(7):1209-18。
WO 2005112938中描述了IL-12的双盐抑制剂,包含阿匹莫德。
发明内容
本发明提供了阿匹莫德的药物制剂,其对化学降解是稳定的,尤其是当在25℃和60%相对湿度(RH)的环境条件下储存时,稳定持续至少1个月的时间段,优选地持续1-3个月、1-6个月或1-12个月的时间段。在一些实施例中,本文所描述的阿匹莫德盐呈固体口服剂型(例如,作为口服崩解片剂(ODT))。另外,本文所描述的阿匹莫德盐(例如,呈固体口服剂型,如口服崩解片剂)在酸性条件(例如,pH为1-2)下快速溶解,并且具有良好的生物利用度,而出乎意料的是,阿匹莫德游离碱ODT溶解缓慢。本文进一步提供了包括阿匹莫德盐,优选地单盐的组合物和相关组合物以及其用于疗法的方法,所述组合物耐化学降解,包含2-乙烯基吡啶和STA-6066的形成,所述方法包含用于治疗神经退行性疾病和病症、癌症和病毒感染的方法。在实施例中,所述神经退行性疾病或病症选自阿尔茨海默氏病(Alzheimer's disease,AD)、拳击性痴呆、弥漫性路易体病(diffuse Lewy body disease)、额颞叶痴呆(FTD)、肌萎缩性侧索硬化症(ALS)、混合性痴呆、路易体型老年痴呆(seniledementia ofLewy body type)、帕金森氏病(Parkinson's Disease)、亨廷顿氏病(Huntingdon'sdisease)和血管性痴呆。在实施例中,所述神经退行性疾病或病症选自额颞叶痴呆(FTD)和肌萎缩性侧索硬化症(ALS)。在实施例中,所述癌症是非霍奇金氏淋巴瘤(non-Hodgkin'slymphoma)、滤泡性淋巴瘤、肾癌、结直肠癌或黑色素瘤。在实施例中,病毒性疾病是由冠状病毒引起的。在实施例中,所述病毒感染是由冠状病毒引起的。在实施例中,所述冠状病毒选自SARS-CoV-1、MERS-CoV和SARS-CoV-2。在实施例中,所述冠状病毒是SARS-CoV-2。在实施例中,所述病毒感染是由埃博拉病毒(Ebola virus)或马尔堡病毒(Marburg virus)引起的。在一个实施例中,所述病毒是埃博拉病毒。在一个实施例中,所述埃博拉病毒属于选自由以下组成的组的株:本迪布焦(Bundibugyo)株、苏丹(Sudan)株、塔伊森林(Tai Forest)株和扎伊尔(Zaire)株。在一个实施例中,所述埃博拉病毒是扎伊尔埃博拉病毒。
本公开的一些方面提供了一种药物组合物,其包括稳定的阿匹莫德的药学上可接受的盐以及一种或多种药学上可接受的赋形剂。在一些实施例中,当在25℃和60%相对湿度(RH)的条件下储存至少3个月,优选地至少6个月时,所述阿匹莫德被稳定以防止形成一种或多种降解产物。在一些实施例中,所述一种或多种降解产物选自2-乙烯基-吡啶和STA-6066中的一者或两者。在一些实施例中,所述盐选自由以下组成的组:盐酸盐、磷酸盐、乳酸盐、L-酒石酸盐、富马酸盐、马来酸盐、丙二酸盐和乙醇酸盐。在一些实施例中,所述盐为盐酸盐、丙二酸盐或L-酒石酸盐。
在一些实施例中,所述组合物被调配物成固体口服剂型。在一些实施例中,所述固体口服剂型为硬或软明胶胶囊、片剂、口服溶解片剂或舌下剂型。在一些实施例中,所述固体口服剂型为口服崩解片剂。在一些实施例中,所述固体口服剂型在酸性条件下快速溶解,任选地其中所述酸性条件的pH为1-2。在一些实施例中,所述一种或多种药学上可接受的赋形剂选自一种或多种稀释剂、润滑剂、助流剂、润湿剂、崩解剂和稳定剂。在一些实施例中,所述稀释剂选自以下中的一种或多种:甘露醇、乳糖、玉米淀粉和微晶纤维素。
在一些实施例中,所述组合物进一步包括助流剂、润滑剂或两者。在一些实施例中,所述助流剂为胶体无水二氧化硅,并且所述润滑剂为硬脂酸镁。
在一些实施例中,所述组合物进一步包括超级崩解剂。在一些实施例中,所述超级崩解剂选自由以下组成的组:羟乙酸淀粉钠、交联羧甲基纤维素和交联聚维酮。
本公开的其它方面提供了阿匹莫德的固体口服剂型,其包括阿匹莫德盐以及一种或多种药学上可接受的赋形剂,其中所述阿匹莫德盐为阿匹莫德的盐酸盐、丙二酸盐或L-酒石酸盐。在一些实施例中,所述阿匹莫德盐是微粒化的。
在一些实施例中,所述固体口服剂型进一步包括明胶和/或甘露醇。在一些实施例中,所述固体口服剂型进一步包括鱼明胶和甘露醇。
在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括15%-20%w/w的盐酸阿匹莫德、2%-5%w/w的鱼明胶、1%-4%w/w的甘露醇和72%-78%w/w的水。在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括18%-22%w/w的丙二酸阿匹莫德、2%-5%w/w的鱼明胶、1%-4%w/w的甘露醇和70%-75%w/w的水。在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括21%-25%w/w的酒石酸阿匹莫德、2%-5%w/w的鱼明胶、1%-4%w/w的甘露醇和68%-72%w/w的水。
在一些实施例中,所述固体口服剂型为口服崩解片剂。在一些实施例中,所述固体口服剂型在酸性条件下快速溶解。在一些实施例中,所述固体口服剂型在酸性条件下在15分钟内实现至少80%的溶解。在一些实施例中,所述酸性条件的pH为1-2。在一些实施例中,当在25℃和60%相对湿度(RH)的条件下储存时,所述固体剂型是稳定的,持续至少3个月。
提供了包括本文所描述的药物组合物或阿匹莫德的固体口服剂型的试剂盒。
在一些实施例中,本文所描述的药物组合物或阿匹莫德的固体口服剂型用于治疗有需要的受试者的疾病。
在一些实施例中,本文所描述的药物组合物或阿匹莫德的固体口服剂型用于制备用于治疗有需要的受试者的疾病的药物。
本文进一步提供了用于治疗有需要的受试者的神经退行性疾病或病症的方法,所述方法包括向所述受试者施用本文所描述的药物组合物或阿匹莫德的固体口服剂型。
在一些实施例中,所述神经退行性疾病或病症为痴呆。在一些实施例中,所述痴呆选自AIDS痴呆综合征(ADC)、与阿尔茨海默氏病(AD)相关的痴呆、拳击性痴呆、弥漫性路易体病、额颞叶痴呆(FTD)、混合性痴呆、路易体型老年痴呆和血管性痴呆。在一些实施例中,所述神经退行性疾病或病症为额颞叶痴呆(FTD)或肌萎缩性侧索硬化症(ALS)。在一些实施例中,需要治疗的受试者是在C9ORF72基因中具有重复序列扩张的受试者。在一些实施例中,所述需要治疗的受试者是在SOD1基因中具有突变的受试者。
本文还提供了用于治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用本文所描述的药物组合物或阿匹莫德的固体口服剂型。在一些实施例中,所述癌症选自脑癌、乳腺癌、宫颈癌、结直肠癌、白血病、肺癌、淋巴瘤、非霍奇金氏淋巴瘤、滤泡性淋巴瘤、黑色素瘤或其它皮肤癌、卵巢癌、前列腺癌、肾癌、胰腺癌、肝癌和睾丸癌。
本文还提供了用于治疗有需要的受试者的病毒感染的方法,所述方法包括向所述受试者施用本文所描述的药物组合物或阿匹莫德的固体口服剂型。在一些实施例中,所述病毒感染是由冠状病毒引起的。在一些实施例中,所述冠状病毒选自SARS-CoV-1、MERS-CoV和SARS-CoV-2。在一些实施例中,所述病毒感染是由埃博拉病毒或马尔堡病毒引起的。在一些实施例中,所述受试者是人。
本公开的其它方面提供了制备阿匹莫德的固体口服剂型的方法,所述方法包括混合阿匹莫德盐以及一种或多种药学上可接受的赋形剂,其中所述阿匹莫德盐为阿匹莫德的盐酸盐、丙二酸盐或L-酒石酸盐。在一些实施例中,所述阿匹莫德盐是微粒化的。在一些实施例中,所述药学上可接受的赋形剂包括鱼明胶和甘露醇。在一些实施例中,所述固体剂型为口服崩解片剂。
附图说明
图1A-B:参考胶囊调配物中的二甲磺酸阿匹莫德的化学不稳定性。(图1A)示出了2-乙烯基吡啶在各种条件下随时间的量:在5℃下冷藏(圆形)、环境条件(25℃/60%RH,正方形)、中间条件(30℃/60%RH,三角形)、加速条件(40℃/75%RH,菱形);通过高压液相色谱(HPLC)测定2-乙烯基吡啶的量;2-乙烯基吡啶的检测下限为0.10%。(图1B)示出了另一种降解产物STA-6066在各种条件下随时间的量:在5℃下冷藏(正方形)、环境条件(25℃/60%RH,三角形)、中间条件(30℃/60%RH,圆形)、加速条件(40℃/75%RH,菱形)。
图2示出了在环境温度下阿匹莫德游离碱和九种盐在FaSSGF(pH 1.6)中的动力学溶解度的结果的汇总。
图3示出了在环境温度下阿匹莫德游离碱和九种盐在FaSSiF(pH 6.5)中的动力学溶解度的结果的汇总。
图4示出了微粒化的盐酸阿匹莫德作为口服崩解片剂(ODT)的溶出曲线。
图5示出了微粒化的丙二酸阿匹莫德作为口服崩解片剂(ODT)的溶出曲线。
图6示出了微粒化的L-酒石酸阿匹莫德作为口服崩解片剂(ODT)的溶出曲线。
图7示出了微粒化的阿匹莫德游离碱作为口服崩解片剂(ODT)的溶出曲线。出乎意料的是,游离碱ODT溶解缓慢。
具体实施方式
本发明人出乎意料地发现,当使用常见的药学上可接受的赋形剂将二甲磺酸阿匹莫德调配成口服剂型的粉末混合物时,二甲磺酸阿匹莫德在室温下不稳定。具体地,阿匹莫德易发生化学降解并形成不期望的降解产物,包含2-乙烯基吡啶和STA-6066。2-乙烯基吡啶在啮齿类动物模型(小鼠、大鼠)中从胃肠道吸收,并且导致虚弱、共济失调、血管舒张、呼吸窘迫和抽搐。参见Clayton,G.D.和F.E.Clayton(编辑).帕蒂工业卫生与毒理学(Patty'sIndustrial Hygiene and Toxicology):第2A卷,第2B卷,第2C卷:《毒理学(Toxicology)》.第3版.纽约:约翰威利父子公司(John Wiley Sons),1981-1982.,第2735页。
本发明解决了对阿匹莫德的药物制剂的需求,所述药物制剂在环境温度(25℃)下对化学降解是稳定的,尤其是对2-乙烯基吡啶和STA-6066的形成是稳定的。本公开提供了包括阿匹莫德的药学上可接受的盐的组合物,其与参考组合物相比对化学降解具有抗性。在实施例中,参考组合物是赋形剂和二甲磺酸阿匹莫德在明胶胶囊中的干粉混合物。本公开提供了多种酸,其各自与熔点高于130℃的阿匹莫德形成结晶固体,并且对于多晶型物形成和化学降解是稳定的,尤其是对于2-乙烯基吡啶和STA-6066的形成,并且尤其是当与常见的赋形剂调配成粉末混合物时。
在实施例中,本公开提供了一种呈干粉混合物形式的药物组合物,所述药物组合物包括阿匹莫德的药学上可接受的单盐以及一种或多种药学上可接受的赋形剂,其中所述组合物包括少于0.2%w/w的阿匹莫德降解产物。在实施例中,在暴露于环境条件,即,25℃/60%RH的受控温度和相对湿度(RH)持续1-3个月或1-6个月的时间段后,所述组合物包括少于0.05%、少于0.1%或少于0.2%w/w的阿匹莫德降解产物。在实施例中,所述阿匹莫德降解产物选自2-乙烯基吡啶和STA-6066中的一者或两者。
式I示出了阿匹莫德游离碱的结构:
阿匹莫德的化学名称为2-[2-(吡啶-2-基)-乙氧基]-4-N′-(3-甲基-苯亚甲基)-肼基]-6-(吗啉-4-基)-嘧啶(IUPAC名称:(E)-4-(6-(2-(3-甲基苯亚甲基)肼基)-2-(2-(吡啶-2-基)乙氧基)嘧啶-4-基)吗啉),并且CAS编号为541550-19-0。阿匹莫德可以例如根据美国专利第7,923,557号和第7,863,270号以及WO 2006/128129中描述的方法制备。
阿匹莫德的二甲磺酸盐形式由于其在水中的高溶解度(831mg/mL)和物理稳定性而最初被选择用于开发。参见例如,WO 2005112938。然而,与阿匹莫德二甲磺酸盐形式本身的稳定性相反,本发明人发现,当与典型的固体赋形剂混合用作胶囊剂型中的干粉时,阿匹莫德主要降解为2-乙烯基吡啶和STA-6066。
因此,本发明提供了单盐,即,酸与阿匹莫德的化学计量为1:1的盐。本文所描述的单盐与二甲磺酸盐形式相比形成酸性较小的盐,并且当在环境条件下与常见的赋形剂调配成干粉时相对更稳定。通过将阿匹莫德在适当溶剂中的溶液加热至50℃并添加1当量的酸来制备阿匹莫德和适当酸的单盐。将溶液冷却至环境温度并搅拌过夜。使用X射线粉末衍射分析来确认盐的结晶性。随后通过暴露于空气或在50℃真空烘箱中用氮气排放或其组合进行真空干燥使盐干燥。
在一些实施例中,本文所描述的阿匹莫德盐选自由以下组成的组:盐酸盐、磷酸盐、乳酸盐、L-酒石酸盐、富马酸盐、马来酸盐、丙二酸盐和乙醇酸盐。在一些实施例中,本文所描述的阿匹莫德盐为盐酸盐、丙二酸盐或L-酒石酸盐。
在实施例中,阿匹莫德是微粒化的。药物颗粒的微粒化可以通过机械方式,如研磨,例如通过流体能量或喷射研磨、销研磨、湿法抛光、球和或卵石研磨、边缘磨机研磨、旋转切割器研磨、端磨机研磨、辊式研磨、锤式研磨、臼和杵、胶体研磨等来实现。产生微粒化药物颗粒的其它技术包含机械连通、喷雾干燥和超临界流体(SFC)。此外,可以采用原位技术直接产生微米或亚微米大小的晶体。
在实施例中,阿匹莫德经受纳米化。用于纳米化的合适方法包含超声沉淀、珠粒研磨、高压均质化、介质研磨和干式共研磨。
药物组合物和调配物
本公开提供了稳定的阿匹莫德的盐形式以及包括其的药物组合物。在此上下文中,“稳定”是指对阿匹莫德的化学降解和降解产物(如2-乙烯基-吡啶和STA-6066)的形成的稳定化。
在实施例中,本公开提供了呈硬或软明胶胶囊、片剂、口服崩解片剂或舌下剂型形式的药物组合物,所述药物组合物包括阿匹莫德以及一种或多种赋形剂。在实施例中,本公开提供了呈硬或软明胶胶囊或片剂形式的药物组合物,所述药物组合物包括阿匹莫德与一种或多种赋形剂的干粉混合物。根据此实施例,所述一种或多种赋形剂可以选自一种或多种稀释剂、润滑剂、助流剂、润湿剂、崩解剂和稳定剂。术语“稀释剂”、“填充剂”和“膨胀剂”在本文中可互换地使用。根据此实施例,粉末混合物中的阿匹莫德的量为10-60wt%,其中剩余部分由一种或多种赋形剂填充。在实施例中,一种或多种赋形剂包含一种稀释剂或多种稀释剂的组合。合适的稀释剂包含乳糖、玉米淀粉和微晶纤维素。在实施例中,除了稀释剂之外,所述一种或多种赋形剂进一步包含助流剂、润滑剂或助流剂和润滑剂两者。通常,助流剂是减少颗粒间摩擦的材料,如胶体无水二氧化硅;并且润滑剂是减少粉末对金属的粘附的材料,如硬脂酸镁。在实施例中,所述一种或多种赋形剂可以进一步包括润湿剂,如十二烷基硫酸钠,以及崩解剂,优选地超级崩解剂,如羟基乙酸淀粉钠、交联羧甲基纤维素或交联聚维酮。
适用于片剂或胶囊的稀释剂的实例包含碳酸钙、乳酸钙、磷酸钙、硅酸钙、硫酸钙、纤维醋丁酯、乙酸纤维素、微晶纤维素、粉状纤维素、硅化微晶纤维素、玉米淀粉、玉米糖浆固体、葡萄糖结合剂、糊精、右旋糖、赤藓糖醇、乙基纤维素、棕榈酸甘油酯、羟丙基纤维素、菊粉、高岭土、乳糖醇、乳糖、乳糖一水合物和聚维酮共处理、乳糖一水合物和粉状纤维素、碳酸镁、氧化镁、麦芽糖醇、麦芽糊精、麦芽糖、麦芽糊精、麦芽糖、甘露醇、中链甘油三酯、聚葡萄糖、聚乙二醇、对羟基苯甲酸丙酯钠、二甲基硅油、碳酸氢钠、碳酸钠、氯化钠、山梨糖醇、淀粉、蔗糖、糖、葵花籽油、滑石粉、海藻糖、木糖醇。
用于片剂或胶囊的合适的崩解剂的实例包含琼脂、海藻酸、天冬酰胺、海藻酸钙、羧甲基纤维素钙、羧甲纤维素钠、纤维素、角豆胶、壳聚糖、胶体二氧化硅、玉米淀粉和预胶凝淀粉、交联羧甲基纤维素钠、交联聚维酮、甘氨酸、瓜尔胶、羟丙基纤维素、羟丙基淀粉、乳糖一水合物和玉米淀粉、镁铝、麦芽糖、甲基纤维素、波拉克林钾(polacrilin potassium)、聚维酮、海藻酸钠、羟乙酸淀粉钠、淀粉。
用于片剂或胶囊的合适的粘合剂的实例包含阿拉伯树胶、琼脂、海藻酸、海藻酸铵、硅镁土、碳酸钙、乳酸钙、聚卡波非钙(calcium polycarbophil)、羧甲基纤维素钙、羟甲基纤维素钠、邻苯二甲酸乙酸纤维素、角豆胶、壳聚糖、松香、共聚维酮、玉米糖浆固体、葡萄糖结合剂、糊精、右旋糖、无水葡萄糖、乙基纤维素、乙二醇和乙烯醇接枝共聚物、明胶、葡萄糖、山嵛酸甘油、瓜尔胶、羟乙基纤维素、羟丙基纤维素、羟乙基甲基纤维素、羟丙甲纤维素、异麦芽酮糖醇、乳糖一水合物、硅酸铝镁、麦芽糖醇、麦芽糊精、麦芽糖、甲基纤维素、聚卡波非(polycarbophil)、聚葡萄糖、聚氧化乙烯、聚甲基丙烯酸酯、聚维酮、对羟基苯甲酸丙酯钠、海藻酸钠、淀粉、蔗糖、糖、植物油、维生素E聚乙二醇琥珀酸酯、玉米醇溶蛋白。
用于片剂或胶囊的合适的润滑剂的实例包含硬脂酸钙、蓖麻油、山嵛酸甘油酯、单硬脂酸甘油酯、棕榈硬脂酸甘油酯、亮氨酸、硬脂酸镁、矿物油、肉豆蔻酸、棕榈油、棕榈酸、泊洛沙姆、聚乙二醇、乙二醇钾、苯甲酸钾、苯甲酸钠、月桂醇硫酸钠、硬脂酸钠、硬脂酸富马酸钠、硬脂酸、蔗糖硬脂酸酯、滑石粉、植物油、硬脂酸锌。
用于片剂或胶囊的合适的助流剂的实例包含纤维素、胶体二氧化硅、疏水性胶体二氧化硅、氧化镁、硅酸镁、三硅酸镁、硬脂酸钠和滑石粉。
在一些实施例中,本文所描述的阿匹莫德盐呈固体口服剂型。在一些实施例中,所述固体口服剂型为口服崩解片剂(ODT)。在一些实施例中,本文所描述的阿匹莫德盐是呈固体口服剂型(例如,作为口服崩解片剂)的盐酸盐、丙二酸盐或L-酒石酸盐。在一些实施例中,固体口服剂型(例如,作为口服崩解片剂)在酸性条件下快速溶解。
在一些实施例中,本文所描述的阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)的固体口服剂型(例如,作为口服崩解片剂)进一步包括一种或多种药学上可接受的赋形剂。在一些实施例中,所述一种或多种药学上可接受的赋形剂包括明胶(例如,鱼明胶)和/或甘露醇。在一些实施例中,所述一种或多种药学上可接受的赋形剂包括鱼明胶和甘露醇。
在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)包括阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)、鱼明胶和甘露醇。在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)是通过使水性组合物冻干来获得的,所述水性组合物包括阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)、鱼明胶、甘露醇和水。在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)是通过使水性组合物冻干来获得的,所述水性组合物包括15%-25%w/w(例如,15%-25%w/w、15%-22.5w/w、15%-20%w/w、15%-17.5%w/w、17.5%-25%w/w、17.5%-22.5%w/w、17.5%-20%w/w、20%-25%w/w、20%-22.5%w/w或22.5%-25%w/w)的阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)、2%-5%w/w(例如,2%-5%、2%-4%、2%-3%、3%-5%、3%-4%、4%-5%、2.5%-4.5%、2%-4%、1.5%-3.5%或3.5%-4%w/w)的鱼明胶、1%-4%w/w(例如,1%-4%、1%-3%、1%-2%、2%-4%、2%-3%、3%-4%、1.5%-3.5%、2%-3%或2.5%-3%w/w)的甘露醇和70%-80%w/w(例如,70%-80%w/w、70%-75%w/w或75%-80%w/w)的水。
在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)是通过使水性组合物冻干来获得的,所述水性组合物包括15%-20%w/w(例如,约15%、15.5%、16%、16.5%、17%、17.5%、17.86%、18%、18.5%、19%、19.5%或20%w/w)的盐酸阿匹莫德、2-5%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%或5.0%w/w)的鱼明胶、1%-4%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%或3%w/w)的甘露醇和72%-78%w/w(例如,约72%、72.5%、73%、73.5%、74%、74.5%、75%、75.5%、75.64%、76%、76.5%、77%、77.5%或78%w/w)的水。在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括15%-20%w/w的盐酸阿匹莫德、3.5%-3.8%w/w的鱼明胶、2.5%-3%w/w的甘露醇和72%-78%w/w的水。
在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)是通过使水性组合物冻干来获得的,所述水性组合物包括18%-22%w/w(例如,约18%、18.5%、19%、19.5%、20%、20.5%、20.99%、21%、21.5%或22%w/w)的丙二酸阿匹莫德、2-5%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%或5.0%w/w)的鱼明胶、1%-4%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%或3%w/w)的甘露醇和70%-75%w/w(例如,约70%、70.5%、71%、71.5%、72%、72.5%、72.51%、73%、73.5%、74%、74.5%或75%w/w)的水。在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括18%-22%w/w的丙二酸阿匹莫德、3.5%-3.8%w/w的鱼明胶、2.5%-3%w/w的甘露醇和70%-75%w/w的水。
在一些实施例中,本文所描述的阿匹莫德盐的固体口服剂型(例如,作为口服崩解片剂)是通过使水性组合物冻干来获得的,所述水性组合物包括21%-25%w/w(例如,约21%、21.5%、22.5 23%、23.05%、23.5%、24%、24.5%或25%w/w)的酒石酸阿匹莫德、2-5%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%或5.0%w/w)的鱼明胶、1%-4%w/w(例如,约2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%或3%w/w)的甘露醇和68%-72%w/w(例如,约68%、68.5%、69%、69.5%、70%、70.5%、71%、71.5%或72%w/w)的水。在一些实施例中,所述固体口服剂型是通过使水性组合物冻干来获得的,所述水性组合物包括21%-25%w/w的酒石酸阿匹莫德、3.5%-3.8%w/w的鱼明胶、2.5%-3%w/w的甘露醇和68%-72%w/w的水。
在一些实施例中,阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)的固体口服剂型(例如,作为口服崩解片剂)中的任一种是冻干的并且不含水(例如,冻干从水溶液中去除水)。在一些实施例中,在阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)的固体口服剂型(例如,作为口服崩解片剂)中的任一种中,阿匹莫德盐是微粒化的。
在一些实施例中,本文所描述的阿匹莫德盐(例如,盐酸阿匹莫德、丙二酸阿匹莫德或L-酒石酸阿匹莫德)的固体口服剂型(例如,作为口服崩解片剂)中的任一种可以如例如美国专利第US7972621号、第US9192580号、第US10548839号和第US10828261号中所描述的产生,所述美国专利中每一个的全部内容通过引用并入本文。
“药物组合物”是呈适于向受试者施用以进行疗法的形式的含有活性药物成分或“API”(如阿匹莫德)以及一种或多种药学上可接受的赋形剂的调配物。术语“药学上可接受的赋形剂”是指可用于制备通常安全、无毒并且在生物学上和其它方面均合乎需要的药物组合物的赋形剂,并且包含对于兽医用途以及人类药物用途而言是可接受的赋形剂。药学上可接受的赋形剂的实例包含但不限于无菌液体、水、缓冲盐水、乙醇、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)、油、洗涤剂、悬浮剂、碳水化合物(例如,葡萄糖、乳糖、蔗糖或葡聚糖)、抗氧化剂(例如,抗坏血酸或谷胱甘肽)、螯合剂、低分子量蛋白质或其合适的混合物。
药物组合物可以采取各种不同形式,例如,液体、气雾剂、溶液、吸入剂、雾剂、喷雾剂;或固体、粉末、软膏、糊剂、乳膏、乳液、凝胶、贴剂等。特定形式通常适用于通过期望的途径施用,如肺部、吸入、鼻内、口腔、经颊、舌下、肠胃外、皮下、静脉内、肌肉内、腹膜内、胸膜内、鞘内、经皮、经粘膜、直肠等。例如,药物组合物可以呈水溶液或粉末的形式以通过吸入或吹入(通过嘴或鼻)进行气溶胶施用;或呈片剂或胶囊的形式以口服施用;或呈用于通过直接注射或通过添加到无菌输注流体中施用的无菌水溶液或分散体的形式以进行静脉内输注;或呈乳液、乳膏、泡沫、贴剂、悬浮液、溶液或栓剂的形式以进行经皮或经粘膜施用。
在实施例中,药物组合物为口服剂型,包含但不限于胶囊、片剂、经颊形式、锭剂、糖锭和呈乳剂、水性悬浮液、分散体或溶液的形式的口服液。胶囊可以含有API与惰性填充剂和/或稀释剂如药学上可接受的淀粉(例如,玉米、马铃薯或木薯淀粉)、糖、人造甜味剂、粉末状纤维素(如结晶和微晶纤维素)、面粉、明胶、树胶等的混合物。还可以添加如硬脂酸镁等润滑剂。当口服施用水性悬浮液和/或乳剂时,API可以悬浮或溶解于油相中,与乳化剂和/或悬浮剂组合。如果期望的话,可以添加某些甜味剂和/或调味剂和/或着色剂。
另外的药学上可接受的赋形剂包含稀释剂、粘合剂、润滑剂、崩解剂、表面改性剂(包含表面活性剂)、悬浮剂或稳定剂,包含硬脂酸镁、硬脂酸、滑石粉、月桂基硫酸钠、微晶纤维素、羧甲基纤维素钙、聚乙烯吡咯烷、明胶、海藻酸、阿拉伯树胶、黄原胶、柠檬酸钠、复合硅酸盐、碳酸钙、甘氨酸、葡聚糖、蔗糖、山梨糖醇、磷酸二钙、硫酸钙、乳糖、高岭土、甘露醇、氯化钠、滑石粉、干淀粉和糖粉。优选的表面改性剂包含非离子和阴离子表面改性剂。表面改性剂的代表性实例包含但不限于泊洛沙姆188、苯扎氯铵、硬脂酸钙、鲸蜡硬脂醇、聚西托醇乳化蜡、脱水山梨糖醇酯、胶体二氧化硅、磷酸盐、十二烷基硫酸钠、硅酸镁铝和三乙醇胺。
可以以散装或以剂量单位形式提供药物组合物。为了易于施用以及剂量的均一性,以单位剂量形式调配药物组合物是特别有利的。术语“单位剂型”是指适于作为待治疗受试者的单位剂量的物理上离散的单位;每个单位含有预定量的API,所述预定量被计算为产生与所需的药物载体相关联的所期望的治疗效果。单位剂型可以是例如安瓿、小瓶、栓剂、糖衣丸、片剂、胶囊、IV袋或气溶胶吸入器上的单泵。在这里所描述的药物组合物的实施例中,单位剂型是胶囊。
在本公开的上下文中,单位剂型通常含有在1-1,000mg,优选地25-500mg范围内的API,如阿匹莫德。例如,所述单位剂型可以含有25mg、50mg、100mg、125mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg或500mg的量的阿匹莫德。在实施例中,药物组合物包括单位剂量为100mg、125mg或200mg的阿匹莫德。
在一些实施例中,当在约25℃和约60%相对湿度(RH)的条件下储存时,固体口服剂型(例如,作为口服崩解片剂)是稳定的,持续至少1个月(例如,至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月或更长)。在一些实施例中,当在约25℃和约60%相对湿度(RH)的条件下储存时,固体口服剂型(例如,作为口服崩解片剂)是稳定的,持续至少3个月。在一些实施例中,当在约25℃和约60%相对湿度(RH)的条件下储存时,固体口服剂型(例如,作为口服崩解片剂)是稳定的,持续至少6个月(例如,至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月或更长)。在一些实施例中,通过HPLC测量和/或分析稳定性。
在一些实施例中,固体口服剂型(例如,作为口服崩解片剂)表现出高生物利用度。在一些实施例中,固体口服剂型(例如,作为口服崩解片剂)在酸性条件下在20分钟内(例如,在20分钟、15分钟、10分钟或5分钟内)实现至少60%(例如,至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高)的溶解。在一些实施例中,固体口服剂型(例如,作为口服崩解片剂)在酸性条件下在15分钟内实现至少80%的溶解。在一些实施例中,其中所述酸性条件的pH为1-2(例如,1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2)。
本公开还提供了如本文所描述的阿匹莫德的药物组合物和/或固体口服剂型(例如,作为口服崩解片剂),其用于治疗有需要的受试者的疾病。
本公开还提供了如本文所描述的阿匹莫德的药物组合物和/或固体口服剂型(例如,作为口服崩解片剂),其用于制备用于治疗有需要的受试者的疾病的药物。
本公开还提供了包括用于本发明的方法的药物组合物的包装和试剂盒。试剂盒可以包括选自由以下组成的组的一个或多个容器:瓶子、小瓶、安瓿、泡罩包和注射器。试剂盒可以进一步包含用于治疗和/或预防本发明的疾病、病状或病症的说明中的一个或多个、一个或多个注射器、一个或多个施涂器或适于重构本发明的药物组合物的无菌溶液。
除非另外指明,否则本文所使用的所有百分比和比率均按重量计。本发明的其它特征和优点从不同实例是显而易见的。所提供的实例展示了在实践本发明时有用的不同组分和方法。所述实例不限制所要求保护的发明。基于本公开,熟练的业内人士可以鉴别并且采用适用于实践本发明的其它组分和方法。
治疗方法
本公开提供了用于治疗有需要的受试者的神经退行性疾病或病症或者癌症的方法,所述方法包括向需要此类治疗的受试者施用如本文所描述的包括稳定的阿匹莫德的盐形式的药物组合物。本公开进一步提供了此类稳定的阿匹莫德的盐形式用于制备可用于治疗神经退行性疾病或病症或者癌症的药物的用途。
可以根据本文所描述的方法治疗的神经退行性疾病和病症包含例如,阿尔茨海默氏病(AD)、肌萎缩性侧索硬化症(ALS)、弥漫性路易体病、路易体痴呆(Lewy bodydementia)、运动神经元疾病、多发性硬化症(MS)、帕金森氏病(Parkinson's disease,PD)、弗里德希氏共济失调(Friedreich's ataxia)、朊病毒病、脊髓小脑性共济失调(SCA)和脊髓性肌萎缩(SMA)。其它可以治疗的不太常见的神经退行性疾病和病症包含例如,克雅二氏病(Creutzfeldt-Jakob disease,CJD)、进行性核上性麻痹(PSP,斯蒂尔-理查德森-奥尔泽夫斯基综合征(Steele-Richardson-Olszewski syndrome))、老年性舞蹈病、亨廷顿氏舞蹈病(Huntington's Chorea)、包含脊髓小脑性共济失调(SCA)在内的脊髓性共济失调、弗里德希氏共济失调、亚急性硬化性全脑炎、额颞叶痴呆(也被称为FTD或额颞叶退行性变)和哈勒沃登-施帕茨病(Hallerrorden-Spatz disease)(泛酸激酶相关神经退行性变,PKAN)。
在一实施例中,神经退行性疾病或病症是ALS。在一治疗ALS或额颞叶痴呆的实施例中,需要治疗的患者是在C9ORF72基因中具有重复序列扩张的患者。C9ORF72基因中的GGGGCC重复序列扩张是肌萎缩性侧索硬化症(ALS)最常见的遗传原因,占全世界ALS病例的约10%,并且占家族性额颞叶痴呆(FTD)的10%。重复序列扩张产生神经毒性物质,包含二肽重复蛋白(DPR)、核RNA焦点和RNA/DNA G-四链体。重复序列扩张还抑制C9ORF72蛋白的产生,所述蛋白通常调节囊泡运输和溶酶体生物发生。在人类诱导的运动神经元中,C9ORF72中的重复序列扩张通过两种机制触发神经退行性变:谷氨酸受体的累积和神经毒性二肽重复蛋白的清除受损。在一治疗ALS的实施例中,需要治疗的患者是患有另一种常见遗传原因SOD1突变的患者。在一治疗ALS或额颞叶痴呆的实施例中,需要治疗的患者是患有TDP-43聚集体的累积的患者,所述聚集体是TARDBP基因的产物,其在许多散发性和家族性ALS中发现。
各种形式的痴呆也可能被认为是神经退行性疾病。通常,术语“痴呆”描述了一组严重影响记忆、思维、语言、言语和社交能力,足以干扰日常功能的症状。因此,本公开还提供了治疗痴呆的方法,所述痴呆包含艾滋病痴呆复合征(ADC)、与阿尔茨海默氏病(AD)相关的痴呆、拳击性痴呆、弥漫性路易体病、额颞叶痴呆、混合性痴呆、路易体型老年痴呆和血管性痴呆。在一实施例中,所述痴呆是额颞叶痴呆。在一治疗额颞叶痴呆的实施例中,需要治疗的患者是在C9ORF72基因中具有重复序列扩张的患者。
可以根据这里所描述的方法治疗的神经肌肉病症包含例如,婴儿脊髓性肌萎缩(SMA1,韦德尼希-霍夫曼病(Werdnig-Hoffmann disease))和青少年脊髓性肌萎缩症(SMA3,库格尔贝格-韦兰德病(Kugelberg-Welander disease))。
在治疗阿尔茨海默氏病的实施例中,所述方法可以包括使用阿匹莫德作为治疗方案的一部分的组合疗法,所述组合疗法包含施用胆碱酯酶抑制剂(例如,Aricept
在治疗肌萎缩性侧索硬化症(ALS)的实施例中,所述方法可以包括使用阿匹莫德作为治疗方案的一部分的组合疗法,所述组合疗法包含施用抗氧化剂,如依达拉奉(edaravone)(Radicava
在实施例中,本公开提供了治疗有需要的受试者的帕金森氏病、帕金森综合征(Parkinsonism syndrome)或多发性硬化症的方法,所述方法包括向所述受试者施用药物组合物,所述药物组合物包括如本文所描述的稳定的阿匹莫德的盐形式。
本公开还提供了治疗癌症的方法,所述方法包括向所述受试者施用药物组合物,所述药物组合物包括如本文所描述的稳定的阿匹莫德的盐形式。在实施例中,所述癌症选自脑癌、神经胶质瘤、肉瘤、乳腺癌、肺癌、非小细胞肺癌、间皮瘤、阑尾癌、泌尿生殖系统癌症、肾细胞癌、前列腺癌、膀胱癌、睾丸癌、阴茎癌、宫颈癌、卵巢癌、希佩尔·林道病(vonHippel Lindau disease)、头颈癌、胃肠道癌、肝细胞癌、胆囊癌、食管癌、胃癌、结直肠癌、胰腺癌、肝癌、黑色素瘤、神经内分泌肿瘤、甲状腺瘤、垂体瘤、肾上腺瘤、血液学恶性肿瘤或白血病。
在实施例中,所述癌症是淋巴瘤。在实施例中,所述淋巴瘤是B细胞淋巴瘤。在实施例中,所述B细胞淋巴瘤选自由以下组成的组:霍奇金氏B细胞淋巴瘤(Hodgkin's B celllymphoma)和非霍奇氏B细胞金淋巴瘤(non-Hodgkin's B cell lymphoma)。在实施例中,所述B细胞淋巴瘤是选自由以下组成的组的非霍奇氏B细胞金淋巴瘤:DLBCL、滤泡性淋巴瘤、边缘区淋巴瘤(MZL)或粘膜相关淋巴组织淋巴瘤(MALT)、小细胞淋巴细胞淋巴瘤(与慢性淋巴细胞白血病重叠)和袍状细胞淋巴瘤。在实施例中,所述B细胞淋巴瘤是选自由以下组成的组的非霍奇氏B细胞金淋巴瘤:伯基特淋巴瘤(Burkitt lymphoma)、伯基特淋巴瘤、原发性纵隔(胸腺)大B细胞淋巴瘤、淋巴浆细胞淋巴瘤,可能表现为华氏巨球蛋白血症(
本公开还提供了治疗病毒感染的方法。在实施例中,所述病毒感染是由冠状病毒引起的。在实施例中,所述冠状病毒选自SARS-CoV-1、MERS-CoV和SARS-CoV-2。在实施例中,所述冠状病毒是SARS-CoV-2。在实施例中,所述病毒感染是由埃博拉病毒或马尔堡病毒引起的。在一个实施例中,所述病毒是埃博拉病毒。在一个实施例中,所述埃博拉病毒属于选自由以下组成的组的株:本迪布焦株、苏丹株、塔伊森林株和扎伊尔株。在一个实施例中,所述埃博拉病毒是扎伊尔埃博拉病毒。
“有需要的受试者”是指需要治疗神经退行性疾病或病症或者癌症的受试者。在实施例中,有需要的受试者是对神经退行性疾病或病症或者癌症的标准疗法“无应答”或“难治”的受试者。在此上下文中,术语“无应答”和“难治性”是指受试者对疗法的应答在临床上不足以缓解与神经退行性疾病或病症或者癌症相关的一种或多种症状。在实施例中,需要治疗的患者是在C9ORF72基因中具有重复序列扩张的患者,例如,在与神经退行性疾病或病症,尤其是肌萎缩性侧索硬化症(ALS)或额颞叶痴呆(FTD)有关的实施例中。
“受试者”通常是指哺乳动物。哺乳动物可以是例如人、灵长类动物、小鼠、大鼠、狗、猫、奶牛、马、山羊、骆驼、绵羊或猪。优选地,所述受试者是人。术语“受试者”和“患者”在本文中可互换使用。
术语“治疗(treatment)”、“治疗(treating)”或“治疗(treat)”描述了如这里所描述的对患有神经退行性疾病或病症或者癌症的受试者的管理和护理,并且包含如这里所描述的治疗剂或其组合的施用,以减缓疾病或病症的进展和/或减轻神经退行性疾病或病症或者癌症的一种或多种症状。在此上下文中,治疗包含施用一定量的有效减轻神经退行性疾病或病症或者癌症的一种或多种症状的治疗剂或药剂的组合。术语“减轻”是指症状的严重程度减轻或降低的过程,但症状可能不一定会消除,尽管可能会在一段时间内或暂时消除。尽管优选消除症状,但其不是必须的。术语“预防(prevention)”、“预防(preventing)”或“预防(prevent)”是指减少或消除症状的发作,尤其是在预防疾病或病症或者癌症的进展的上下文中,其中进展由一种或多种症状的发作定义。
术语“治疗有效量”是指足以治疗神经退行性疾病或病症或者癌症、改善其症状、降低其严重程度或缩短其持续时间或者增强或改善其它疗法的治疗效果的量。受试者的精确有效量将取决于受试者的体重、体型和健康状况;病状的性质和程度;以及被选择用于施用的治疗或治疗的组合。
在实施例中,用于治疗成年人的神经退行性疾病或病症、癌症或病毒感染的阿匹莫德的治疗有效量为100mg/天至400mg/天,优选地约150mg/天至250mg/天。在实施例中,用于治疗神经退行性疾病或病症、癌症或病毒感染的阿匹莫德的治疗有效量为150mg/天、200mg/天、250mg/天或300mg/天。在这里所描述的方法的实施例中,药物组合物可以包括75mg、100mg或125mg阿匹莫德用于成年人受试者的每天两次施用。
根据这里所描述的治疗方法,在对神经退行性疾病或病症或者癌症的治疗中,阿匹莫德可以作为单一疗法施用,其中阿匹莫德是唯一施用的API。这里所描述的方法还可以包括使用阿匹莫德和至少一种另外的API的组合疗法。术语“组合疗法”或“共同疗法”包含施用本文所描述的化合物,例如,阿匹莫德,以及至少一种另外的API,作为旨在通过两种API的共同作用提供有益效果的特定治疗方案的一部分。所述有益效果可能实现减缓神经退行性疾病或病症或者癌症的进展和/或减轻神经退行性病或病症或者癌症的一种或多种症状。组合的有益效果包含但不限于由组合产生的药代动力学或药效动力学共同作用。组合的有益效果也可能与减轻与组合中的另一种药剂相关的毒性、副作用或不良事件有关。“组合疗法”不旨在涵盖施用这些治疗性化合物中的两种或更多种作为单独的单一疗法方案的一部分,所述疗法方案偶然地并且任意地本公开的组合。
在组合疗法的上下文中,API阿匹莫德的施用可以与另外的API的施用同时或依序进行,或者施用可以在另外的API的施用之前、与其同时或在其之后。组合疗法的不同API可以调配成呈单一剂型的共同施用,或者其可以以不同剂型单独施用。当单独施用时,对于组合疗法中的API中的每一者,可以通过相同或不同的施用途径施用。
优选地,组合疗法提供协同应答。术语“协同”是指组合的功效大于单独的单一疗法的叠加效应。组合疗法的协同效应可以准许以比在组合之外的剂量和/或频率更低的剂量和/或更低频率施用组合中的至少一种药剂。协同效应还可以表现为避免或减少与单独使用组合中的任一疗法相关的不良作用或不希望的副作用。
在实施例中,如这里所描述的药物组合物的施用导致正在治疗的疾病或病症的症状或并发症的消除,然而,消除不是必需的。在一个实施例中,症状的严重程度降低。在癌症的上下文中,此类症状可能包含严重程度或进展的临床标志物,包含肿瘤分泌生长因子、降解细胞外基质、血管化、失去对并列组织的粘附或转移的程度以及转移的数量。
实例
实例1:稳定性研究
阿匹莫德的参考固体口服剂型是明胶胶囊中包含的赋形剂和二甲磺酸阿匹莫德的干粉混合物。活性药物成分或API,即二甲磺酸阿匹莫德,以约14wt%存在于粉末混合物中,其中剩余体积主要由填充剂,如微晶纤维素(65%)和乳糖(17%)以及少量另外的赋形剂,如崩解剂、润滑剂和流动助剂构成。
阿匹莫德的二甲磺酸盐形式由于其在水中的高溶解度(831mg/mL)和物理稳定性而最初被选择用于开发。具体地,发现阿匹莫德的二甲磺酸盐在受控室温下稳定持续4年,并且在加速条件下稳定持续6个月。对于这些测试,将二甲磺酸阿匹莫德储存在钢桶中热密封铝涂层袋内的双聚乙烯袋中。在受控温度和相对湿度(RH)(25℃/60%RH)的环境条件下,4年后,药物物质残余的百分比为98.7%,并且2-乙烯基吡啶降解产物的量少于0.03%,如通过高压液相色谱法(HPLC)测定的。即使在40℃/75%RH的“加速”条件下,二甲磺酸阿匹莫德也稳定至6个月,如99.7%的药物物质残余和少于0.03%的2-乙烯基-吡啶量所证明的。
然而,与阿匹莫德二甲磺酸盐形式本身的稳定性相反,本发明人发现,当与如填充剂/膨胀剂、崩解剂、润滑剂和流动加工助剂等典型赋形剂混合时,阿匹莫德开始更快地降解并且产生不可接受的量的降解产物2-乙烯基吡啶和STA-6066。
发现2-乙烯基吡啶(图1A)和STA-6066(图1B)的形成速率与温度有关。在冷藏条件(5℃)下,胶囊中的形成非常缓慢,在1年时为约0.1%或更低,并且在2年时为约0.1%-0.4%,具体取决于降解产物。然而,在环境条件(25℃/60%RH)下储存胶囊引起降解产物2-乙烯基-吡啶和STA-6066两者的形成速率显著加快。如图1A和1B所示,最初,2-乙烯基-吡啶和STA-6066中的每一者的量少于0.10%(低于检测极限),但到1个月时,两种降解产物的量都是可检测的,其中2-乙烯基-吡啶的量为约0.12%,并且STA-6066的量为约0.35%。两种降解产物均随时间推移增加,到9个月时,2-乙烯基吡啶增加至0.71%,并且STA-6066增加至2.9%。在加速储存条件(40℃/75%RH)下,观察到2-乙烯基-吡啶和STA-6066的形成有类似但加速的趋势。因此,最初,2-乙烯基-吡啶和STA-6066中的每一者的量低于检测极限(<0.10%),但到1个月时,2-乙烯基吡啶的量增加至0.85%,并且STA-6066的量增加至3.1%。使用30℃/65%RH的中间条件观察到两种降解产物的形成的中间趋势。
因此,稳定性研究指示,当与常见赋形剂在粉末混合物中调配时,包含在最期望用于长期储存的环境条件(25℃/60%RH)下,二甲磺酸盐形式是不稳定的。尽管不希望受到任何理论的约束,但认为这种不稳定性以及由此形成的不期望的降解产物可能是由二甲磺酸盐形式的一个或多个方面引起的。首先,这种形式是高度酸性的,这可能有助于催化阿匹莫德的化学片段化,以形成2-乙烯基-吡啶和STA-6066化合物,如下图所示。
第二,二甲磺酸盐形式是高度可溶的,使得较少但显著量的阿匹莫德二甲磺酸盐可以溶解于存在于赋形剂中的一种或多种中的痕量的水中,从而为发生阿匹莫德的化学降解提供合适的水性环境。
US 7,745,436教导了需要高度酸性盐,如二甲磺酸盐来提供期望的阿匹莫德的水溶性,使得其例如在作为口服剂型施用时具有充分的生物可利用度。'436专利教导了具有低pKa的酸(甲磺酸(-1.2)、HBr(-7)、HCl(-4.5)和硫酸(-3))是形成具有过量(至少2)当量强酸的二盐所必需的。发现这些二盐具有非常高的溶解度,例如,二甲磺酸盐的水溶性为831mg/mL,并且二氯化物的水溶性为213mg/mL。这些溶解度是对应单盐的溶解度的十倍。此外,'426专利教导了与单盐相比,二盐不太容易降解(颜色更少),并且对光的敏感性更低(光稳定性更好)。因此,正如'436专利所证明的,阿匹莫德的优选的药学上可接受的盐是由具有低pKa的酸形成的二盐,这是公知常识的一部分。
首先试图鉴定其它盐,这些盐提供阿匹莫德的合适的结晶形式以及酸与阿匹莫德之间1:1的化学计量,同时当与用于胶囊剂型的常见赋形剂一起调配时,与二甲磺酸盐相比,在环境条件(25℃/60%RH)下对降解更稳定。此外,试图开发口服生物利用度类似于高可溶性二甲磺酸盐形式的口服生物利用度的调配物。
首先,鉴定了pKa在约1-5范围内的酸,这些酸能够与阿匹莫德形成合适的结晶盐,并维持酸与阿匹莫德之间1:1的化学计量。下表1中所示的酸各自形成结晶固体,其中酸与阿匹莫德的比率为1:1并且各自的熔点高于130℃。此外,在50℃/75%RH的加速条件下,这些盐对晶体结构的变化是物理稳定的,持续至少4周,其中对如通过X射线粉末衍射(XRPD)分析测量的结晶度或如通过DSC测量的熔点没有可观察到的影响。TGA分析表明,这些盐在形成时和4周稳定性测试的持续时间内也是非溶剂化的。
表1
1
X射线粉末衍射(XRPD)。XRPD衍射图是在PANalytical X'Pert Pro衍射仪上使用Ni过滤的Cu Ka(45kV/40mA)辐射和0.03°2θ的步长以及X'celerator
差示扫描量热法(DSC)。用配备有自动进样器和冷藏冷却系统的TA InstrumentsQ100或Q2000差示扫描量热计在40毫升/分钟的N2吹扫下进行DSC。除非另有说明,否则以15℃/分钟在卷曲的Al盘中获得筛选样品的DSC热谱图。除非另有说明,否则以10℃/分钟在卷曲的Al盘中获得输入和放大材料的DSC热谱图。
热重分析(TGA)。用TA Instruments Q50热重分析仪在40毫升/分钟N2吹扫下在Pt或Al盘中获得TGA热重图。除非另有说明,否则以15℃/分钟获得筛选样品的TGA热谱图。除非另有说明,否则以10℃/分钟获得输入和放大材料的TGA热谱图。
HCl盐的制备
将丙酮(50mL;20Vol)添加到亲本阿匹莫德,批次604004(2.515g;6.010mmol)中,并且加热至50℃,得到溶液。添加一当量的HCl水溶液(3M;2.00mL),随后添加HCl盐(批次103173-SU-01)的籽晶,实现快速沉淀。将混合物在50℃下搅拌2小时,并且然后在室温下搅拌过夜。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤并且空气干燥2小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到2.63g(96.2%)的HCl盐。
磷酸盐的制备
将丙酮(50mL;20Vol)添加到亲本阿匹莫德,批次604004(2.514g;6.007mmol)中,并且加热至50℃,得到溶液。添加一当量的磷酸水溶液(3M;2.00mL),并迅速观察到浆液,随后添加磷酸盐(批次103173-SU-10)的籽晶。样品迅速沉淀。将混合物在50℃下搅拌2小时,并且然后在室温下搅拌过夜。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤并且空气干燥2小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到2.46g(79.2%)的磷酸盐。
马来酸盐的制备
将丙酮(60mL;20Vol)添加到亲本阿匹莫德,批次604004(3.002g;7.173mmol)中,并且加热至50℃,得到溶液。添加一当量的马来酸水溶液(3M;2.40mL),得到稀浆液。添加马来酸盐(批次103173-SU-04)的籽晶。将样品在50℃下搅拌2小时,随后在室温下继续搅拌3天。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤,并空气干燥2小时。在过滤后,观察到固体在表面上呈轻微灰白色,而剩余固体呈白色。将样品在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到2.91g(75.9%)的马来酸盐。
丙二酸盐的制备
将丙酮(50mL;20Vol)添加到亲本阿匹莫德,批次604004(2.515g;6.011mmol)中,并且加热至50℃,得到溶液。添加一当量的丙二酸水溶液(3M;2.00mL),随后添加丙二酸盐(批次103173-SU-11)的籽晶。最初观察到浑浊的溶液,并且慢慢地变成浆液。将混合物在50℃下搅拌2小时,随后在室温下继续搅拌三天。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤,并空气干燥2小时。次日,将样品在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到2.80g(89.3%)的丙二酸盐。
L-酒石酸盐的制备
将丙酮(51mL;20Vol)添加到亲本阿匹莫德,批次604004(2.527g;6.038mmol)中,并且加热至50℃,得到溶液。添加一当量的L-酒石酸水溶液(3M;2.013mL)。观察到浆液,并添加L-酒石酸盐(批次103173-SU-09)的籽晶。将混合物在50℃下搅拌2小时,随后在室温下继续搅拌过夜。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤并且空气干燥2小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到3.26g(94.8%)的L-酒石酸盐。
半富马酸盐的制备
将丙酮(61mL;20Vol)添加到亲本阿匹莫德,批次604004(3.067g;7.329mmol)中,并且加热至50℃,得到溶液。添加一当量的富马酸(固体;851mg)以及富马酸盐(批次103173-SU-06)的籽晶,并且观察到淡黄色浆液。将混合物在50℃下搅拌2小时,随后在室温下继续搅拌过夜。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用丙酮洗涤并且空气干燥2小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到3.45g(98.8%)的半富马酸盐。
DL-乳酸盐的制备
将乙腈(31mL;10Vol)添加到亲本阿匹莫德,批次60404(3.085g;7.370mmol)中,并在室温下搅拌,得到浆液。添加一当量的纯DL-乳酸(11.3M;652.2uL),随后添加DL-乳酸盐(批次103173-SU-13)的籽晶。将非常稀的浆液在真空中浓缩至干燥过夜。将乙腈(30mL;10Vol)添加到固体中,随后添加另外的批次103173-SU-13的籽晶。将浆液在室温下搅拌另外一天。第二天,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用乙腈洗涤并且空气干燥2小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到3.35g(89.3%)的DL-乳酸盐。
DL-乳酸盐的制备
将含有2%水的乙腈(总计30.6mL)添加到DL-乳酸盐批次103173-SU-21(3.029g;5.96mmol)中。将浆液在室温下下放置三天。取测试等分试样并通过XRPD测定以确认结晶度。将剩余的样品过滤并用乙腈洗涤并且空气干燥1.5小时,并且然后将其在真空下放置在50℃的烘箱中并进行氮气排放,持续2小时。此实验得到2.35g(77.6%)的DL-乳酸盐。
乙醇酸盐的制备
将乙腈(51mL;10Vol)添加到亲本阿匹莫德,批次604004(5.081g;12.140mmol)中,并在室温下搅拌,得到浆液。添加一当量的乙醇酸(固体;923mg),随后添加乙醇酸盐(批次103173-SU-14)的籽晶。将浆液在室温下搅拌两天。将测试等分试样过滤,并且显示出大量未反应的母体。然后,将样品加热至50℃并搅拌2小时。将另外的测试等分试样过滤,并且没有显示出改善。添加另外当量的乙醇酸溶液(3M于THF中;4.05mL),并且将混合物加热至50℃,持续2小时,随后在室温下继续搅拌过夜。次日,将测试等分试样过滤并通过XRPD测定以确认结晶度。将剩余的样品过滤并用乙腈洗涤,并空气干燥2小时。得到重量为5.26g(87.6%)的乙醇酸盐。
各种pH下的稳定性
接下来,评估阿匹莫德在不同pH下的溶解度。在室温下在0.1N HCl(pH 1)和伯瑞坦-罗宾森缓冲液(Britton-Robinson buffer,BRB)(pH 2、3、4、5、6、7和8)中制备样品。3天后,将每个样品离心30分钟,将溶液过滤,并通过HPLC分析测定阿匹莫德的浓度。使用XTerra MS C18(5μm 4.6x 150mm)柱和18分钟梯度HPLC条件进行HPLC分析。阿匹莫德的UV光谱显示出在232nm、260nm和332nm处具有最大吸光度。结果表明,阿匹莫德在水性介质中出乎意料地表现出依赖于pH的不同溶解度。因此,在pH为大约1时,溶解度大于10mg/mL,但在pH 2时,溶解度降至137μg/mL,并且在更高的pH下,溶解度进一步降低(表2)。
表2
动力学溶解度研究:
在环境温度下,在pH 1.6的禁食状态模拟胃液(FaSSGF)中对表1中提供的各种阿匹莫德盐进行动力学溶解度研究。FaSSGF是一种溶解介质,其具有禁食胃液的平均酸性pH和类似的渗透压。FaSSGF可以帮助揭示口服药物在喝下一杯水后在胃中的作用。在FaSSGF中进行测试所产生的稳定性、溶解度和溶出度数据可以帮助鉴定影响药物在禁食状态下的吸收的关键因素,并且进而有助于为药物选择合适的固体状态和调配方法。
在环境温度下在pH 1.6的FaSSGF中在环境温度下搅拌1小时后,在除了马来酸盐和半富马酸盐之外的所有样品中均观察到100%的溶解。结果示出于图2中。当在FaSSGF中测试时,马来酸盐和半富马酸盐的残余物是结晶的,并且通过粉末衍射(PXRD)分析显示匹配输入盐。
在环境温度下,在pH 6.5的禁食状态模拟肠液(FaSSIF)中进行另外的动力学溶解度研究,并且结果示出于图3中。FaSSIF帮助揭示口服药物在喝下一杯水后如何溶解以及潜在地被吸收到肠上部的流体中。在环境温度下搅拌1小时后,所有样品的溶解度均显著降低,实现以μg/mL为单位的浓度,所述浓度在4小时和24小时后保持不变。搅拌1小时后,所有样品看起来都是浑浊的悬浮液,但在4小时和24小时后,通过PXRD分析,其外观变为乳白色悬浮液。除了阿匹莫德游离碱之外,所有九种盐的残余物都是结晶的,并且当在FaSSIF中测试时与其各自的输入盐不匹配。
总之,在FaSSGF中,除了马来酸盐和半富马酸盐之外,所有盐在>2mg/mL时都是可溶的。在FaSSIF中,所有盐的溶解度均低于10μg/mL,其中与其它盐和游离碱相比,HCl盐在1小时时表现出更高的溶解度。
固有溶解速率
制备用于阿匹莫德游离碱和九种阿匹莫德盐的固定盘。在3900psi下由制剂制备游离碱和九种盐的固有溶解速率。将每个盘放入含有700mL 0.01N HCl介质的平底容器中,所述平底容器配备有Distek溶解槽以及设置为37℃并且桨速为50rpm的Distek循环器/加热器。Opt-Diss 405系统的单一分析波长设置为333nm,其中背景波长设置为400nm,并且每1分钟至35分钟读取一次。表3中提供了盐和阿匹莫德游离碱的代表性固有溶解曲线。尽管二甲磺酸盐IDR曲线高于游离碱或对应盐的IDR曲线,但非甲磺酸盐在固有溶解速率方面表现出显著差异,而半富马酸盐的固有溶解速率是D/L-乳酸盐和HCl盐的固有溶解速率的1/10以上。盐行为的动力学溶解度是不可预测的,并且非甲磺酸盐之间的显著差异是盐的行为中的意外发现。
表3
在IDR分析结束时,通过PXRD分析颗粒表面,并将其与对应的输入API进行比较,以了解任何物理变化。分析了8种非甲磺酸盐和游离碱残余物(表4),并且发现游离碱、HCl、磷酸盐、马来酸盐、丙二酸盐、L-酒石酸盐和半富马酸盐以及与初始输入材料的XRPD模式匹配。乙醇酸盐残余物XRPD图显示出与输入材料一致的图以及较差结晶相。D/L-乳酸残余物XRPD图与游离碱水合物一致。结果指示,溶解度最高的HCl在溶解过程期间也表现出良好的物理稳定性。
表4
总之,这些结果表明,阿匹莫德的单盐(HCl、磷酸盐、马来酸盐、丙二酸盐、L-酒石酸盐和半富马酸盐)对于阿匹莫德的调配物具有合适的固态稳定性和固有溶解度。
实例2:阿匹莫德盐的口服崩解片剂
在本研究中,将微粒化的阿匹莫德盐(盐酸盐、丙二酸盐和L-酒石酸盐)以50mg或125mg的剂量强度掺入到口服崩解片剂中。在相当于阿匹莫德游离碱的16.67%w/w的浓度下对以下三种盐进行评估:盐酸阿匹莫德(d90=3.77μm)、丙二酸阿匹莫德(d90=5.72μm)和L-酒石酸阿匹莫德(d90=7.20μm)。进行此研究以评估微粒化的盐在活性药物成分(API)添加、混合和给药期间的可湿性和分散行为,并测量在0小时悬浮液保持(SH)时间点时给药的125mg剂量强度产物的溶解速率。溶解测试用于确定API的盐形式是否可以在15分钟的目标时间内实现100%的溶解。下表5中示出了调配物细节。
表5:
*
口服崩解片剂的合成
制备所测试的阿匹莫德盐的口服崩解片剂。容易地将API掺入到片剂中。混合后,混合物看起来具有光滑的平滑性,没有可见的团聚物或充气。将混合物给药到气泡内,并在-80.0℃下冷冻,其中冷冻通道停留时间为3分15秒。在产物穿过冷冻通道一次之后将所述产物冷冻。然后将冷冻产物从冷冻通道转移至冰箱,并在-15℃以下储存,直到装载到冷冻干燥机中为止。
颗粒均匀地分布在每个批次中并且来自在0小时和24小时悬浮液保持(SH)时间点时给药的样品。丙二酸阿匹莫德具有针样形态,而盐酸阿匹莫德和L-酒石酸阿匹莫德颗粒的形状更不规则。在24小时SH时间段期间,在调配物中未观察到API的形态变化。
分散时间
表6汇总了所测试的阿匹莫德盐的口服崩解片剂的分散时间结果。分散时间是在大约20℃的温度下,将一个单元添加到一烧杯水中以使其完全润湿所需的时间的测量结果。如可以从表中看到的,所有测试片剂的分散时间对于口服崩解片剂(ODT)来说都是可接受的。
表6:
/>
*
溶解测试
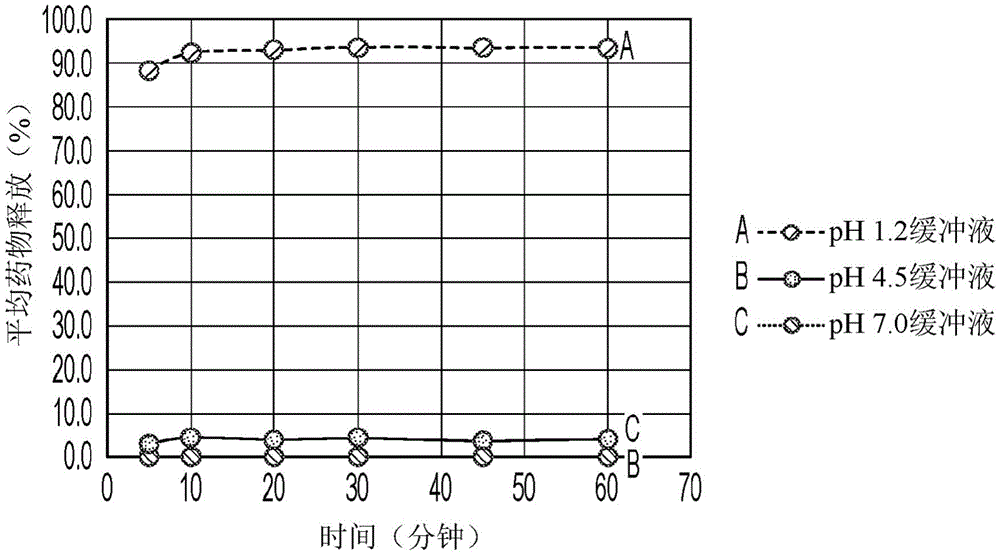
对成品样品进行的溶解测试的结果在图4(阿匹莫德盐酸盐)、图5(阿匹莫德丙二酸盐)和图6(阿匹莫德L-酒石酸盐)中详细说明。游离碱单元的溶解数据进一步提供在图7中用于比较。每种盐的溶解测试在盐酸缓冲液(pH 1.2)、乙酸盐缓冲液(pH 4.5)和磷酸盐缓冲液(pH 7.0)中进行。在500ml体积的每种缓冲液中评估成品的溶解,并在5分钟、10分钟、20分钟、30分钟、45分钟和60分钟后记录药物释放百分比。每溶解培养基进行三次重复。图4-7中显示的结果示出了每种缓冲液每时间点的平均药物释放百分比。
结果表明,所有批次在pH 1.2缓冲液中的溶解最佳。相比之下,在pH 4.5和pH 7.0缓冲液中实现了有限的溶解。对于含有阿匹莫德丙二酸盐或L-酒石酸盐的单元,在10分钟的时间点处,药物释放的平均百分比分别为93.3%和92.0%。此外,与盐酸盐相比,阿匹莫德丙二酸盐和L-酒石酸盐显示出改善的溶解。对于含有盐酸盐的单元,10分钟后药物释放的平均百分比为83.8%。对于盐酸盐,溶解也在稍后的时间点处趋于平稳。然而,所有测试的盐的溶解均优于游离碱的溶解(图4-7)。
等效物和范围
在权利要求中,冠词如“一个/种(a/an)”以及“所述”可以意指一个或多个,除非指明与上下文相反或另外根据上下文是显而易见的。如果组成员中的一个、多于一个或全部存在于、使用于或以其它方式相关于给定的产品或过程,则在所述组的一个或多个成员之间包含“或”的权利要求或描述被认为是满意的,除非指明与上下文相反或另外地根据上下文是显而易见的。本公开包含组中的恰好一个成员存在于、使用于或以其它方式相关于给定的产品或过程的实施例。本公开包含其中所述基团成员中的多于一个或所有存在于、使用于或以其它方式相关于给出的产品或流程的实施例。
此外,本公开涵盖所有变体、组合和排列,其中将来自一项或多项所列权利要求的一个或多个限制、要素、条款和描述性术语引入另一项权利要求中。例如,从属于另一项权利要求的任何权利要求可以修改为包含在从属于同一基本权利要求的任何其它权利要求中发现的一个或多个限制。在要素是以例如马库什组(Markush group)格式等列表形式呈现的情况下,也公开了所述要素的每个子组,并且可以从所述组中去除任何一种或多种要素。应当理解,一般而言,在本公开或本文所描述的方面被称为包括特定要素和/或特征的情况下,本文所描述的某些实施例或本文所描述的各方面由此类要素和/或特征组成,或基本上由此类要素和/或特征组成。为了简单起见,那些实施例没有在本文中具体阐述。还应注意,术语“包括”和“含有”旨在是开放性的并且允许包括另外的要素或步骤。在给出范围时,端值被包含在内。此外,除非另外指示或以其它方式从上下文和本领域普通技术人员的理解显而易见,否则表示为范围的值可以在本文所描述的不同实施例中假定为在所述范围内的任何具体值或子范围,其精确至所述范围的下限单位的十分之一,除非上下文另外清楚地指明。
本申请涉及各种已颁发的专利、已公布的专利申请、期刊文章和其它出版物,所有这些都通过引用并入本文。如果任何并入的参考文献与本说明书之间存在冲突,则以本说明书为准。此外,落入现有技术范围内的本公开的任何特定实施例可以被明确排除在权利要求中的任何一项或多项权利要求之外。因为这样的实施例被视为是本领域的普通技术人员已知的,所以即使没有在本文中明确阐述排除,其也可以被排除。出于任何原因,无论是否与现有技术的存在相关,可以从任何权利要求中排除本文所描述的任何特定实施例。
仅使用常规实验,本领域的技术人员将认识到或者能够确定本文所描述的具体实施例的许多等效物。本文所描述的本发明实施例的范围不旨在限于以上描述,而是如所附权利要求中所阐述的。本领域的普通技术人员将理解,在不背离如以下权利要求所限定的本公开的精神或范围的情况下,可以对此描述作出各种改变和修改。
