用于验证流式细胞术测量的方法和系统
文献发布时间:2023-06-19 18:32:25
本申请要求2020年4月21日提交的美国临时申请号63/013,098的优先权权益,将其全部内容通过引用并入本文。
技术领域
本公开文本涉及基于荧光的分析方法和系统,具体地涉及用于评价基于荧光的分析仪器进行的测量的可信性和再现性的验证方法。
背景技术
基于荧光的细胞分析系统(如流式细胞术和荧光激活细胞分选术(FACS))是测量测试样品中各种细胞元件(如细胞表面受体和细胞内组分)的强大工具。在FACS方法中,使用抗体缀合的荧光色素(荧光染料)对样品进行染色,从而发出诸如细胞受体或其他细胞标记物、肽和核酸的元件的存在和量的信号。多种不同荧光色素的开发允许一次同时使用多于一种荧光色素,其中每种荧光色素具有独特的、可识别的发射光谱。由于它们的组合能力和多功能性,因此流式细胞术和FACS通常用于整个药物开发过程,例如用于免疫分型、受体表达或占用以及其他功能测定。
虽然功能强大,但由于各种原因,流式细胞术和FACS方法通常比其他分析方法验证起来更具挑战性。这些原因包括缺乏方案标准化、缺乏标准化参考材料以及使用复杂且灵敏的仪器装置。通常用于染色的单克隆抗体和多克隆抗体不是标准化的,并且在质量和性能上可能变化很大。因此,研究人员有责任仔细评估所使用的试剂按预期工作。然而,对于执行给定方法和仪器的验证几乎没有给研究人员指导。根据例如US FDA,验证被简单地定义为对方法用于预期应用的适合性的评价,并且建议验证测试过程必须确保测定满足预定标准并且可靠地执行并且适合其预期用途。FDA指南承认,没有通用验证规则是恰当的,并且未提供用于验证测定的具体指南。缺少用于验证的标准或公认的监管指南和参考材料是一个挑战,令人遗憾地是文献没有很好地解决。当样品中目的靶细胞或标记物被认为以非常低的浓度存在时,方法验证的挑战甚至更大。需要改进的验证方法来验证基于荧光的分析方法和系统的性能。
发明内容
本公开文本的各个方面包括一种用于验证基于荧光的分析仪器对测试样品中染色的靶细胞群体的测量的方法,所述方法包括:(a)对包含表达靶细胞标记物的靶细胞的参考样品的第一部分中的细胞进行负染色或已经进行负染色;(b)对所述参考样品的第二部分中的所述靶细胞进行正染色或已经进行正染色;(c)使所述参考样品第一部分通过所述仪器以获得指示所述参考样品第一部分中的靶细胞浓度的荧光测量值,并且使所述参考样品第二部分通过所述仪器以获得指示所述参考样品第二部分中的靶细胞浓度的荧光测量值;(d)基于(c)中获得的所述荧光测量值,制备包含多个稀释样品的稀释系列,每个稀释样品具有标称浓度的所述靶细胞,每个标称细胞浓度大于由(a)中所述负染色的第一部分的荧光测量值指示的靶细胞浓度,其中每个稀释样品中的所述标称浓度不同于每个剩余稀释样品中的所述标称浓度;(e)使来自(d)的所述系列稀释样品通过所述仪器以获得一系列荧光测量值,所述系列荧光测量值包括每个稀释样品的荧光测量值;以及(f)对于每个稀释样品,比较来自(d)的所述标称细胞浓度和来自(e)的所述荧光测量值以定量在所述仪器中所述染色方法的性能。所述仪器可以是例如流式细胞仪。
在另一个方面,本公开文本提供了一种用于验证流式细胞仪对测试样品中染色的靶细胞群体的测量的方法,所述方法包括:(a)对包含表达靶细胞标记物的靶细胞的参考样品的第一部分中的细胞进行负染色或已经进行负染色;(b)对所述参考样品的第二部分中的所述靶细胞进行正染色或已经进行正染色;(c)使所述参考样品第一部分和所述参考样品第二部分都通过所述流式细胞仪,以获得指示所述参考样品第一部分和所述参考样品第二部分中的每一个中的靶细胞浓度的荧光测量值;(d)基于(c)中获得的所述荧光测量值,制备一系列稀释样品,每个稀释样品具有在整个所述稀释系列中系统地变化的标称浓度的所述靶细胞,其中至少一个稀释样品的所述标称细胞浓度大于由(a)中所述负染色的第一部分的荧光测量值指示的靶细胞浓度;(e)使来自(d)的所述系列稀释样品通过所述流式细胞仪以获得一系列荧光测量值,所述系列荧光测量值包括每个稀释样品的荧光测量值;以及(f)对于每个稀释样品,比较来自(d)的所述标称细胞浓度和来自(e)的所述荧光测量值以定量在所述流式细胞仪中所述染色方法的性能。
任何所公开的方法可以包括一个或多个任何以下特征。(f)中的所述比较可以包括例如对每个稀释样品的所述标称细胞浓度和所述荧光测量值之间的差异进行统计计算,以确定所述仪器和所述染色方法的线性、范围、准确度、精密度、检测限(LOD)和最低定量限(LLOQ)中的至少一个。确定LLOQ可以包括例如鉴定与用于精密度的预定标准和用于准确度的预定标准相关联的靶细胞浓度。(a)中对所述参考样品第一部分中的所述靶细胞进行负染色可以包括向所述参考样品第一部分中引入(i)荧光死细胞排除染料;(ii)缀合至荧光色素的非特异性抗体,例如作为同种型对照;和(iii)能够特异性结合所述靶细胞上的靶标记物(抗原)的未缀合至所述荧光色素的特异性抗体。缀合至所述荧光色素用于负染色的所述非特异性抗体可以包括缺乏特异性结合至细胞抗原的能力的抗体,例如像IgD、IgG、IgA、IgM或IgE。所述负染色的第一部分可以在没有细胞耗尽步骤的情况下制备。(b)中对所述参考样品第二部分中的所述靶细胞进行正染色可以包括向所述参考样品第二部分中引入(i)所述荧光死细胞排除染料(与用于负染色相同的染料);和(ii)用于所述负染色的相同特异性抗体,但是不是未缀合至所述荧光色素,而是缀合至用于所述负染色的相同荧光色素(其中所述荧光色素缀合至所述
所述方法可以进一步包括通过针对所述靶细胞的两种或更多种不同靶标记物进行负染色和正染色,或潜在地针对两种或更多种靶细胞的两种或更多种不同靶标记物进行染色来进行多路复用。所述负染色可以进一步包括向所述参考样品第一部分中引入两种或更多种特异性抗体,每种特异性抗体能够特异性结合所述两种或更多种靶标记物中的一种并且未缀合至所述荧光色素。所述正染色可以进一步包括向所述参考样品第二部分中引入所述两种或更多种特异性抗体,每种特异性抗体缀合至所述荧光色素。
(f)中的所述计算可以由与所述仪器或所述流式细胞仪耦合的处理器执行。所述测试样品可以包含以不超过2%、1%、0.5%、0.2%、0.1%、0.05%或0.02%的浓度存在的所述靶细胞。所述稀释系列可以包含具有最高浓度的所述靶细胞的稀释样品,其中所述最高浓度为2%、1%、0.5%、0.2%、0.1%、0.05%或0.02%。在任何方法中,所述系列稀释样品可以包括至少两个、三个、四个、五个、六个、七个、八个、九个或十个稀释样品。
在另一个方面,本公开文本考虑了一种包括指令的非暂时性计算机可读介质,所述指令用于使计算机处理器执行任何所公开的方法的步骤(f)中的所述比较,或执行任何统计计算以确定所述仪器和所述染色方法的线性、范围、准确度、精密度、检测限(LOD)和最低定量限(LLOQ)中的任何一个或多个。
在仍另一个方面,本公开文本提供了一种用于验证基于荧光的仪器进行的测试样品中的荧光测量的系统,所述系统包括:所述基于荧光的仪器;以及与所述基于荧光的仪器耦合并且包括计算机可读介质的计算机,所述计算机可读介质包括如上所述的计算机处理器指令。在所述系统中,所述基于荧光的仪器可以是流式细胞仪。
在又另一个方面,本公开文本描述了一种试剂盒,所述试剂盒包含用于对参考样品中的细胞进行染色以验证用于分析测试样品中的靶细胞的基于荧光的分析方法的试剂,所述试剂盒包含:(i)负染色试剂,其包括:(a)荧光死细胞排除染料、(b)缀合至荧光色素的非特异性抗体、和(c)能够特异性结合所述靶细胞上的靶标记物(抗原)的未缀合的特异性抗体;(ii)正染色试剂,其包括:(a)所述荧光死细胞排除染料、和(b)缀合至所述荧光色素的所述特异性抗体;以及说明书,其用于(a)对所述参考样品的第一部分进行负染色,(b)对所述参考样品的第二部分进行正染色,以及(c)制备包含多个稀释样品的稀释系列,每个稀释样品具有在整个所述稀释系列中系统地变化的标称浓度的所述靶细胞,其中至少一个稀释样品的所述标称细胞浓度大于由所述负染色的第一部分的荧光测量值指示的靶细胞浓度。
下文详述了本公开文本的其他方面和特征。
本申请文件包含至少一张以彩色绘制的照片。在请求并支付必要的费用后,官方将会提供带有彩色照片的本专利申请公开案的副本。
附图说明
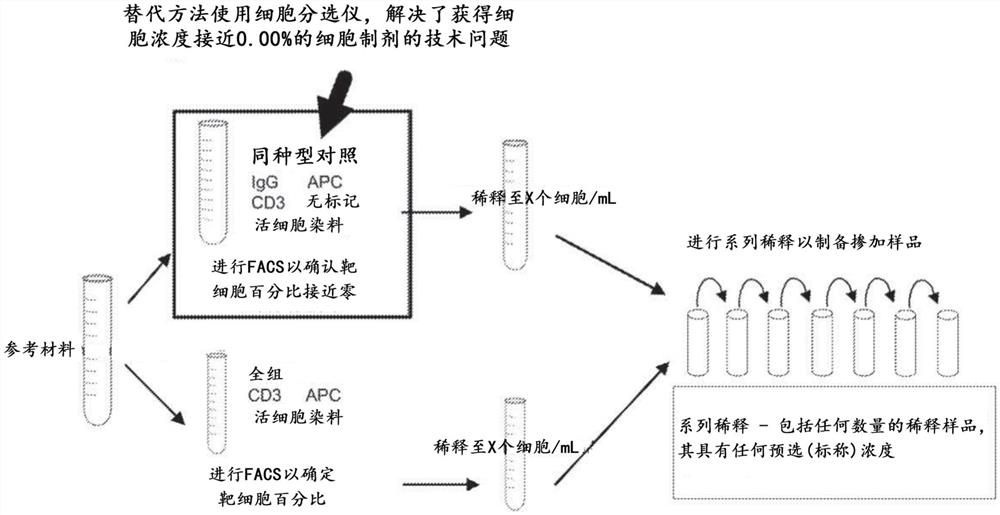
图1提供了根据本公开文本的方法的示意图。
图2是显示用负染色的样品获得的典型结果的FACS图。所显示的事件基于前向散射和侧向散射以及PI(用于死细胞排除)对活细胞进行门控。
图3是显示用正染色的样品获得的典型结果的FACS图。所显示的事件基于前向散射和侧向散射以及PI(用于死细胞排除)对活细胞进行门控。
图4展示了用于制备线性样品的程序流程。
图5展示了用于制备稀释系列的程序流程。
图6展示了在实施例2中指定的三种不同场合下由两名操作人员执行方法评定。
图7是a)未转化数据和b)-f)不同log转化数据的未转化标称CD3%和估计CD3%(结果)的残差图。
图8描绘了估计CD3%与标称CD3%相比的百分比(%)。虚线指示100%±30%回收率。
图9展示了估计的线性样品的回归分析。
具体实施方式
分析方法验证对于评估基于荧光的分析测量的可信性和再现性是关键的。为了使这样的测量有价值,它们必须是可再现的。例如,荧光激活细胞分选术(FACS)是一种专门类型的基于荧光的分析,并且是一种用于基于每个细胞的荧光信号将生物细胞的混合物分选成单独群体的强大方法。与仅对细胞进行计数和分选的流式细胞术相比,FACS使用流式细胞术数据提供定性和定量两种分析。重要的是,基于荧光的分析测量(如使用FACS进行的测量)由于在此类分析技术中使用的抗体的质量和性能的变化而被适当地验证。
一种验证方法依赖于制备多个稀释或掺加样品的稀释系列,每个样品具有已知或标称浓度的靶细胞或标记物。例如,通过掺加已知量的靶细胞来进行系列稀释,以产生具有已知(标称)细胞浓度的多个掺加样品,所述细胞浓度的范围系统地从较高浓度(例如50%)到较低浓度(例如1%)的细胞。使掺加样品通过细胞仪,并且获得每个掺加样品的荧光测量值。将掺加样品与来自细胞仪的测量值进行比较。通过统计计算确定仪器和染色方法的准确度,例如通过计算标称值和测量值的相关性、确定关系的斜率、确定R-sq等来确定。FACS检测限(LOD)和/或定量限(LOQ)可以如已知的那样通过染色和获取一个或多个重复的未掺加样品并使其通过细胞仪以获得阳性事件的测量值来计算。然后可以使用经验证的测定来检测和定量样品中的细胞浓度。
为了准确地制备一系列掺加样品,需要至少两种样品:各自具有已知(标称)浓度的靶细胞或标记物的一个或多个样品,和几乎不含靶细胞或标记物(浓度约为0)的样品。通常使用多于一个掺加样品。例如,使用五(5)个水平验证仪器和染色方法涉及制备包含五个不同标称浓度的靶细胞或标记物(例如,2%、4%、6%、8%和10%)的一系列掺加样品,加上一个包含0%的样品。为了制备一系列掺加样品,将包含已知相对较高浓度的目的靶细胞或标记物的参考材料连续且系统地稀释,以制备具有较低浓度的一系列掺加样品。然而,在许多情况下,制备掺加样品是不容易的,因为没有现成的起始参考材料可用。例如,当目的分析物是细胞如CD3
本公开文本解决了为不存在标准参考材料的情况提供阴性参考和掺加样品的技术问题,并且通过提供低于0.1%的掺加样品的制备,可用于在靶细胞或标记物以低于0.1%的浓度存在时进行验证。例如,取决于所使用的仪器和染色,LLOQ可以低于0.01%。因此,本公开文本涉及用于验证基于荧光的分析仪器(如流式细胞仪)对测试样品中染色的靶细胞群体的测量的方法和系统。
I.
基于荧光的分析仪器包括能够测量荧光信号作为样品中靶分析物或靶细胞类型存在的指标的任何分析仪器。根据所使用的仪器装置和方法,仪器能够基于荧光信号强度定量测试样品中靶分析物或细胞类型的量。基于荧光的分析仪器的一个例子是流式细胞仪。FACS(荧光激活细胞分选术)是一种基于流式细胞术的不同但相关的方法。流式细胞术是一种使用流式细胞仪检查和确定细胞内外分子的表达并定义和表征不同单细胞类型的方法。流式细胞术也可以用于确定其他参数,如分离的细胞样品的细胞大小、体积和纯度。FACS是一种利用用荧光色素标记的特异性抗体获得表达数据并依据许多变量对细胞样品进行分选的流式细胞术技术。
FACS可以使用许多流式细胞仪类型中的任一种进行,所述流式细胞仪类型包括传统的流式细胞仪、声波聚焦细胞仪、细胞分选仪或成像流式细胞仪。最常见的传统细胞仪使用鞘液聚焦样品流,以及常见的激光器,如488nm(蓝色)、405nm(紫色)、532nm(绿色)、552nm(绿色)、561nm(绿黄色)、640nm(红色)和355nm(紫外线)。在声波聚焦细胞仪中,使用超声波来聚焦细胞进行分析,同时防止样品堵塞并允许较高的样品输入。细胞分选仪是一种类型的允许使用者在处理后收集样品的传统流式细胞仪。可以将对所需参数为正的细胞与对参数为负的细胞分开。成像细胞仪是与荧光显微术结合的传统细胞仪,并且都用于在单个细胞和群体两种水平上快速分析样品的形态和多参数荧光。流式细胞仪通常与具有控制仪器功能的处理器的计算机耦合。本文所述的方法和系统可以用于本文所述的任何流式细胞仪的使用。
II.
本文所述的方法解决了在不存在标准参考材料的情况下提供阴性参考和低水平掺加样品的技术问题,因此允许在靶细胞或标记物被认为以低于0.1%或甚至更低的浓度存在于样品中的情况下,可靠地验证例如流式细胞仪(FACS)进行的基于荧光的测量。
图1是所述方法的示意图。使用能够特异性结合靶细胞标记物的抗体(特异性抗体)和“同种型”(非特异性抗体)以及缀合至特异性抗体或非特异性抗体的荧光色素(这取决于进行负染色还是正染色)制备正染色和负染色的参考样品。更具体地,获得参考样品并将其分成两部分。将参考样品的第一部分用(i)荧光死细胞排除染料、(ii)缀合至荧光色素的非特异性抗体(例如作为同种型对照)、和(iii)能够特异性结合靶细胞上的靶标记物(抗原)的特异性抗体进行负染色。对于负染色,特异性抗体未缀合至荧光色素。缀合至荧光色素用于负染色的非特异性抗体是能够结合至细胞的抗体,所述细胞不具有对该抗体特异性的表位,即结合至细胞,但是不是通过如在抗体与细胞上的特异性表位的结合的特异性结合,因此非特异性抗体对标记物也具有高解离常数(Kd),如下文更详细所述。非特异性免疫球蛋白IgD、IgG、IgA、IgM或IgE中的任一种都可以用作非特异性抗体。
将参考样品的第二部分用荧光死细胞排除染料(用于负染色步骤的相同染料)和用于负染色的相同特异性抗体(但是不是未缀合,而是缀合至用于负染色的相同荧光色素)(其中荧光色素缀合至
靶细胞标记物可以是任何细胞标记物,如T细胞、B细胞、NK细胞、红细胞、粒细胞或单核细胞的任何已知标记物。T细胞标记物例如包括但不限于CD3、CD4、CD8、CD69、CD71和CD25。B细胞标记物包括但不限于IL-6、CD19、CD25、CD30、CD27、CD38、CD78、CD138和CD319。在一个方面,例如,靶标记物可以选自作为T细胞标记物的CD3、作为B细胞标记物的CD19、作为红细胞标记物的CD235a、作为自然杀伤(NK)细胞标记物的CD56、作为单核细胞标记物的CD14以及作为粒细胞标记物的CD66b。将理解,通过将所述方法应用于来自相同参考材料的多个样品,在每种情况下使用适当的特异性抗体,可以容易地对细胞群体的多于一种标记物进行验证。通过非限制性举例的方式,为了验证T细胞群体的两种不同标记物的两种不同染色方案,所述方法可以第一次使用特异性结合CD3的抗体进行,并且第二次使用特异性结合至CD4的抗体进行。
将理解,靶标记物的选择驱动染色特异性的选择。抗体与靶标记物的特异性结合是指抗体识别标记物的一个或多个表位的能力,使得所选抗体对标记物表现出高结合亲和力,并且优选地对其他交叉反应种类表现出低结合亲和力。通常,使用解离(或平衡)常数(Kd)描述分子的结合亲和力。解离常数越低,抗体A对分析物(标记物)B的结合亲和力或结合程度越大。因此,针对标记物的特异性抗体对标记物表现出低解离常数(Kd)。确定给定抗体的Kd的方法在文献中有非常好的描述,如下文进一步所述。在低浓度下生成差信号的抗体将具有高变异性(噪声),因此将难以与测量到的较高交叉反应性区分开。如本文所用的“特异性抗体”是指对靶标记物的Kd不大于10nM或更低、不大于7nM或更低、不大于5nM或更低、不大于1nM或更低、不大于0.5nM或更低、不大于0.15nM或者不大于0.1nM或低于0.1nM的抗体。通过非限制性举例的方式,可以选择特异性结合至靶标记物的特异性抗体,其Kd为5nM或更低,如2nM或更低,优选1nM或更低,更优选0.7nM或更低。描述被认为对靶标记物具有特异性的抗体的结合亲和力的Kd值由可商购的抗体的商业供应商提供,或者可以通过熟知的方法确定,所述方法包括但不限于:荧光滴定、竞争ELISA、量热法(如等温滴定量热法(ITC))、流式细胞术滴定分析(FACS滴定)和表面等离子体共振(BIAcore)。此类方法在文献中有很好的描述。(参见例如,Goodrich和Kugel,2007,Binding and Kinetics forMolecular Biologists,Cold Spring Harbour Laboratory Press,Cold SpringHarbour,N.Y.;De Jong,L.A.A.等人,J.Chromatogr.B 829(1-2):1-25(2005);Heinrich,L.等人J.Immunol.Methods 352(1-2):13-22(2010);Williams,M.A.和Daviter,T.(编辑)2013,Protein—Ligand Interactions,Methods and Applications,Springer,New York,N.Y.)。
因此,本公开文本中的特异性抗体是对任何靶细胞标记物的Kd不大于1nM、不大于0.5nM、不大于0.15nM或不大于0.1nM的任何抗体,所述靶细胞标记物包括但不限于本文所述的任何细胞标记物:CD3、CD4、CD8、CD69、CD71和CD25、IL-6、CD19、CD25、CD30、CD27、CD38、CD78、CD138和CD319、CD235a、CD56、CD14和CD66b。特异性抗体可以是多克隆抗体、单克隆抗体、嵌合抗体、人源化抗体或全人抗体。它们可以是单链或多链抗体。虽然合适的特异性抗体可以且通常购自商业供应商,但单克隆抗体也可以从杂交瘤产生,或在含有载体的宿主细胞中产生,所述载体包含编码细胞然后表达的抗体的核酸序列。因此,如本文所述的特异性抗体可以通过如下方式来制备:用至少一种编码特异性抗体的核酸分子转化宿主细胞;在宿主细胞中表达核酸分子;以及分离特异性抗体,所有这些都使用本领域熟知的材料和技术。针对多种细胞标记物的特异性抗体的商业供应商包括但不限于:BD Biosciences、Takara Bio USA(例如,提供单克隆抗CD3(OKT3));BioX Cell(新罕布什尔州莱巴嫩;例如,提供抗人CD19单克隆抗体);Thermo-Fisher Scientific Inc.;BioLegend Inc.;Bio-RadAntibodies等。
在负染色和正染色两个步骤中使用的荧光死细胞排除染料可以是允许区分活细胞与死细胞或垂死细胞的任何染料,并且也被称为活力染料。例如,活力染料包括不可透过膜、不穿过细胞膜的染料。例如,不穿透细胞膜的核酸结合染料将选择性地对死细胞和垂死细胞的可及核酸(例如,DNA)进行染色,而不对具有完整膜的活细胞内的不可及核酸进行染色。可替代地,死细胞排除或活力染料可以是蛋白结合染料(胺活性染料)而不是核酸结合染料。蛋白结合染料既结合至活细胞又结合至死细胞,但是膜破裂的死细胞和垂死细胞被接触更多细胞内蛋白的染料更强烈地染色,因此死细胞和垂死细胞表现出较高的荧光。因此,使用核酸结合染料或胺活性染料,可以通过对包含活细胞的较不强烈染色的群体进行门控来排除死细胞。死细胞排除染料包括许多可容易商购的核酸结合染料和胺活性染料,如但不限于碘化丙啶、DAPI、DRAQ7、7-AAD、TO-PRO-3、活/死可固定染料、eFluor可固定染料、Horizon染料、Biolegend Zombie染料和Ghost染料。胺活性染料包括M1420MP、M1410、D6105、P130、P6114、A10168、M10165、D10161、D374、D126、D1421、B30250、H185、H1428、H1193、P30253、A30000、A30100、C10164、P10163、S6110、D2184、D2183、D3834等。
荧光色素可以是具有特征性可见发射光谱的任何荧光色素,如但不限于目前可商购的许多已知荧光色素中的任一种,如别藻蓝蛋白(APC)、APC C750、APC AF700、亮紫(BV)421、BV510、hilite 7(H7)BV605、BV650、PE CF594、异硫氰酸荧光素(FITC)、R-藻红蛋白(PE或R-PE)、PE-Cy7(与菁染料Cy7偶联的PE)、APC-Cy7(与菁染料Cy7偶联的APC)、APC-H7(与Cy类似物Hilite 7(H7)偶联的APC)。
使用未缀合形式的特异性抗体(即,未与荧光色素缀合或共价连接的特异性抗体)阻断负染色的样品(同种型染色的样品)中的靶标记物结合位点。然后通过使用负染色的细胞掺加至靶标称细胞浓度,使用正染色的样品来制备至少两个或通常多于两个掺加样品。然后在流式细胞仪中分析一系列掺加样品,以从仪器获得每个掺加样品的测量浓度。绘制数据(每个掺加样品的标称浓度和测量浓度)并对相关性进行统计分析,以计算验证参数,如线性、准确度、精密度、LOD和/或LLOQ。将理解,在任何方法中,对比较标称细胞浓度数据和测量到的细胞浓度数据以定量在仪器中染色方法的性能进行分析可以由与仪器耦合的计算机处理器执行,所述计算机处理器如配置有指令的处理器,所述指令用于对每个稀释样品的每个标称细胞浓度和荧光测量值之间的差异执行一种或多种标准统计测试,以确定仪器和染色方法的线性、范围、准确度、精密度、LOD和LLOQ中的至少一个。确定LLOQ可以包括例如鉴定与用于精密度的预定标准和用于准确度的预定标准相关联的靶细胞浓度。
以下实施例1说明了使用碘化丙啶作为死细胞排除染料、抗CD3抗体、IgG作为非特异性抗体和别藻蓝蛋白作为荧光色素用于确定细胞产品样品中的活T细胞浓度的方法。然而,应当理解,在本实施例中的死细胞排除染料、细胞标记物(CD3)和特异性抗体(抗CD3)配对、非特异性抗体(IgG)和/或荧光色素(APC)中的任一种都可以如本文所述被取代。在负染色和正染色后,使用负染色的细胞将正染色的样品稀释至所计划的最高所需掺加水平(靶细胞的最高标称浓度),然后制备系列稀释液以产生具有系统地变化的标称细胞浓度的稀释样品。稀释系列可以包括任何倍数。理论上,甚至可以使用两个稀释样品,然而在实践中,制备至少三个稀释样品,每个稀释样品的标称浓度变化,优选地系统地变化以便于分析。稀释系列可以包括三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个或更多个稀释(掺加)样品。通过非限制性举例的方式,每个稀释(掺加)样品的标称浓度可以从0.1%向下变化到0.003%,但是将理解,标称值的选择将随一系列因素而变化,所述因素如样品中靶细胞或标记物的预期浓度、所使用的掺加样品的数量、仪器装置、所使用的染色方案等。
将进一步理解,本发明的方法和系统解决了为测试样品提供阴性样品的问题,所述测试样品可以包含以不超过2%、1.5%、1%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.25%、0.2%、0.15%、0.1%、0.05%、0.02%或不超过0.01%的浓度存在的靶细胞。可比较地,稀释系列可以包含具有最高浓度的靶细胞的稀释样品,其中最高浓度为2%、1.5%、1%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.25%、0.2%、0.15%、0.1%、0.05%、0.02%或0.01%。例如,本文提供的方法可以用于确定样品中被认为是残留物或杂质的靶细胞或标记物。例如,在自然杀伤细胞的组合物中,CD3+细胞或T细胞可以被认为是残留物或杂质。本发明的方法可以允许确定至非常低水平(如小于2%、1.5%、1%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.25%、0.2%、0.15%、0.1%、0.05%、0.02%或0.01%)的残留物或杂质。
III.
本公开文本还提供了包括任何一个或多个基于荧光的仪器以及用于实现所公开的方法及其各个方面和特征的相关系统组件的系统和装置。系统可以包括例如一个或多个基于荧光的仪器、一个或多个耦合到所述一个或多个仪器的计算机处理器,并且任选地包括任何细胞样品、染料、荧光色素、细胞标记物、抗体或其任何组合中的一种或多种。例如,本公开文本考虑了包括处理器可执行指令的非暂时性计算机可读介质,所述处理器可执行指令用于使处理器对由如本文所述的仪器生成的数据执行任何数据分析或统计计算。用于验证基于荧光的仪器进行的荧光测量的系统可以包括基于荧光的仪器、耦合到其上的计算机以及包含处理器可执行指令的计算机可读介质。如上文进一步详述,仪器可以是流式细胞仪,其可以用于进行FACS。
IV.
本公开文本还考虑了用于进行本文所述的任何验证方法的试剂盒和装置,所述试剂盒和装置包含任何一种或多种细胞样品、染料、荧光色素、细胞标记物、特异性和/或非特异性抗体、缓冲液、稀释剂或其任何组合。试剂盒可以包含例如任何一种或多种试剂,其量为对参考样品中的细胞进行负染色和/或正染色所需,以验证用于分析测试样品中的靶细胞的基于荧光的分析方法。试剂盒可以包含负染色所需的组分,包括荧光死细胞排除染料、缀合至荧光色素的非特异性抗体和如本文所述的能够特异性结合靶细胞上的靶标记物(抗原)的未缀合的特异性抗体中的任何一种或多种。试剂盒可以包含正染色所需的组分,包括荧光死细胞排除染料和如本文所述的缀合至荧光色素的特异性抗体中的任何一种或多种。
将理解,如果给定所选靶细胞标记物,用于负染色和正染色两者的特异性抗体将是相同的。类似地,试剂盒中用于负染色和正染色两者的荧光色素是相同的。试剂盒可以包括硬拷贝或电子格式的书面说明书,其用于参考样品的负染色和正染色,以及用于制备如上文所述的稀释系列。说明书可以另外包括任何一项或多项说明,其用于:使用试剂盒进行本文所述的任何验证方法;制备参考样品;和/或读取、分析和解释验证方法的结果。试剂盒可以有用地包括一个或多个用于制备和/或储存任何试剂以及用于标记它们的组分的容器。
定义
由于在不脱离本发明的范围的情况下可以对上述器械、试剂盒和方法进行各种改变,因此以上描述和下文给出的实施例中包含的所有内容都旨在应当被解释为是说明性的而非在限制的意义上解释。
除非另外定义,否则本文所用的所有技术和科学术语都具有本发明所属领域中的技术人员通常所理解的含义。以下参考文献为技术人员提供了在本发明中使用的许多术语的一般定义:The Cambridge Dictionary of Science and Technology(Walker编辑,1988);The Glossary of Genetics,第5版,R.Rieger等人(编辑),Springer Verlag(1991);以及Hale和Marham,The Harper Collins Dictionary of Biology(1991)。如本文所用,除非另外说明,否则以下术语具有赋予它们的含义。
当介绍本公开文本或其一个或多个优选方面的要素时,冠词“一个/一种(a)”、“一个/一种(an)”、“所述(the)”和“所述(said)”旨在意味着存在一个或多个/一种或多种要素。术语“包含(comprising)”、“包括(including)”和“具有(having)”旨在是包容性的,并且意味着可以存在除所列要素之外的另外的要素。
术语“包含”意指“包括但不必限于”;它具体地指示在如此描述的组合、组、系列等中的开放式包含或成员关系。如本文所用的术语“包含(comprising)”和“包括(including)”是包含性的和/或开放式的,并且不排除另外的未列举的要素或方法过程。术语“基本上由……组成”比“包含”更具限制性,但是不如“由……组成”具有限制性。具体地,术语“基本上由……组成”将成员关系限制于所指定的材料或步骤以及不实质上影响所要求保护的发明的本质特征的材料或步骤。
实施例
仅提供了本文讨论的任何出版物的在本申请的申请日之前的披露内容。本文的任何内容都不应被解释为承认本发明因在先发明而无权早于这样的披露内容。
包括以下实施例以展示本公开文本。本领域技术人员应当理解,以下实施例中公开的技术代表诸位发明人发现的在本公开文本的实践中发挥良好的技术。然而,根据本公开文本,本领域技术人员应当理解,在不脱离本公开文本的精神和范围的情况下,可以在本公开文本中进行许多改变,并且仍然获得相同或相似的结果,因此所阐述的所有内容都应被解释为是说明性的而非在限制的意义上解释。
实施例1.用于验证流式细胞术分析的掺加样品的产生
在本实施例中,产生掺加样品以验证“罕见事件靶标”的流式细胞术分析,用于确定样品中存在的残留物或杂质的LLOQ(最低定量水平)。
I.方法
图1是所述方法的示意图。分别使用“荧光色素缀合的靶标记物”(特异性抗体)和“同种型”(非特异性抗体)制备正染色和负染色的细胞样品。通过使用未缀合形式的特异性抗体(即,未与荧光色素共价连接的抗体)阻断负染色的样品(同种型染色的样品)中的靶标记物结合位点。然后通过使用负染色的细胞,将正染色的样品掺加至靶标称细胞百分比。在流式细胞仪中分析掺加样品以获得测量百分比。然后将数据(掺加样品的标称百分比和测量百分比)用于统计分析,以计算验证参数,如线性、准确度、精密度和LLOQ。
II.样品制备
本实施例描述了使用以下染色组验证细胞产品中的活T细胞百分比:
PI=碘化丙啶并且APC=别藻蓝蛋白
活T细胞被鉴定为PI-CD3+。
a)负染色的样品的制备
将细胞测试样品分成两部分。根据制造商的方案,使用所设计的染色组对一部分进行染色:荧光色素缀合的抗体和死细胞排除染料的组合,这是对目的活细胞群体进行门控所必需的。对于靶细胞群体,在染色混合物中使用同种型对照。在本实施例中,所使用的染色混合物是:
PI=碘化丙啶,IgG=免疫球蛋白G并且APC=别藻蓝蛋白
在染色后,将靶标记物的未缀合抗体添加到最终的细胞溶液中。在本实施例中,未缀合的抗体是经纯化的抗CD3抗体。如图2所示,FACS图显示了用负染色的样品获得的结果。此处显示的事件基于前向散射和侧向散射以及PI(用于死细胞排除)对活细胞进行门控。
b)正染色的样品的制备
从步骤1中的细胞测试样品起,根据制造商的方案,使用所设计的染色组对细胞的另一部分进行染色:
注释:PI=碘化丙啶并且APC=别藻蓝蛋白
如图3所示,FACS图显示了用正染色样品的获得的结果。此处显示的事件基于前向散射和侧向散射以及PI(用于死细胞排除)对活细胞进行门控。
c)低水平T细胞掺加样品的制备
使用来自步骤1)的负染色的细胞,将正染色的样品稀释至所计划的最高掺加水平(靶细胞的标称浓度),然后制备系列稀释液以产生具有系统地变化的标称T细胞百分比的稀释样品。
III.样品分析
如上所述制备掺加样品,并且使用它们来从流式细胞仪获得荧光测量值,每个测量值对应于掺加样品中CD3+细胞的标称浓度。如本文别处所述,对每个标称浓度和来自流式细胞仪的对应荧光测量值进行常规统计常规分析,以评估测量值的准确度和可靠性。
本实施例描述了使用荧光色素缀合的同种型和未缀合的抗体新型地制备负染色的细胞。通常,使用通过磁珠或通过细胞分选仪制备的靶细胞群体耗尽的细胞来制备阴性群体以制备掺加样品。然而,这些耗尽程序很少耗尽高达99.9%的靶群体。因此,阴性群体将贡献至少0.1%的背景,使得不可能制备低于0.1%的掺加样品。验证LLOQ低于0.1%的基于荧光的分析方法(如FACS)具有挑战性。本实施例展示了有效地制备靶细胞浓度低于0.1%的阴性群体,并且允许制备低于0.1%的掺加样品用于验证。根据所使用的仪器装置和染色组,本发明的方法可以提供低于0.01%的LLOQ。
实施例2.K-NK药物产品的T细胞定量方法的评定方案
此方法评定方案提供了T细胞定量方法(方案参考:ATM-3343)的评定程序,所述T细胞定量方法用于定量经刺激的、经扩增的自然杀伤细胞组合物(K-NK药物产品(DP))中的CD3+表达细胞,如PCT公开案WO 2018160673A1中披露的那些,将其披露内容通过引用以其整体并入本文。K-NK DP是CD3+耗尽的供体淋巴细胞制剂,使用21-41bbl质膜(PM21)颗粒(如WO 2018160673A1中描述的颗粒)从其中将NK细胞在体外扩增至高数量和密度。K-NK DP中的主要杂质是残留CD3+表达细胞,如果对患者施用超过临床相关限度,则其可能引起移植物抗宿主病。为了检测和提供K-NK DP中低浓度残留CD3+表达细胞的定量,开发了本文所述的基于FACS的方法以专门检测和/或定量活CD3+细胞的含量。表1和表2中提供的定义在整个以下实施例中使用。
表1:在实施例中使用的定义
表2:在实施例中使用的缩写和首字母缩写
利用健康供体PBMC(RM-PBMC 225398)作为“阳性对照样品”以验证CD3+染色并设置流式细胞术分析的CD3+门。从密度梯度离心制备此PBMC。此阳性对照没有相关的接受标准,但是用于门设置以及CD3-APC抗体添加和反应性的验证。
用于此评定的测试品是冷冻保存的NK细胞样品“20035d14”。通过进一步处理使用PM21颗粒平台扩增的NK细胞产生20035d14样品,并且在第7天后获得并代表K-NK产品。在获得后,将这些细胞在实验室中培养七天,并且在第14天以5x 10
所使用的设备是AttuneTM经典声波聚焦流式细胞仪,并且用于收集和处理数据的软件是Attune细胞计数软件v2.1和JMP v14。
设计分析方法和程序以检测和定量低浓度的CD3+表达细胞。简言之,将高细胞浓度的样品在FACS染色缓冲液中洗涤多次,然后用CD3-APC抗体染色以检测CD3+表达细胞并且用碘化丙啶(PI)染色以检测死细胞。然后,将样品重悬至固定浓度并经由Attune流式细胞仪获取。使用Attune细胞计数软件v2.1处理流式细胞术数据。为了在0.01%细胞含量下获得精确且准确定量的分辨率,获取1x 10
测试样品制备:为了线性、准确度/真实度和精密度分析,将冷冻保存的测试样品20035d14分成两个制剂。将一个等分试样(1x 10
样品制备:根据ATM-3343制备样品并如表3所述按比例放大,包括阳性对照、IgG-APC和CD3-APC样品的染色。由于将1x 10
表3:数据工作表:线性样品基质的制备
表3(续):
表3(续):
表3(续):
表3(续):
表4:用于稀释线性的掺加样品制备
评定参数线性、准确度/真实度、精密度和特异性的数据集由2名操作人员在3种场合下生成,如图6所示。根据以上稀释方案每种场合处理一个测试样品,并且根据下表5所展示的方案执行评定。根据ATM-3343处理样品(系列稀释等同于测试样品)。首先获取稀释水平5,随后获取稀释水平4,并且依次获取至第一稀释水平。每种场合每个水平生成一个数据点。对于此评定活动,每名操作人员对每个水平进行三次测量,每个稀释水平总共六个数据点。
表5:方法评定执行方案
相对准确度/真实度:使用试验材料的平均值相对于每个稀释水平的对应CD3+标称相对百分比来评估相对准确度或真实度。确定每个稀释水平的场合和分析人员的中间精密度。
根据稀释线性活动确定程序范围。根据线性活动定量下限被确定为具有合适水平的精密度和相对准确度的最低稀释度。
用于ATM-3343的抗体和活力染料列于表6中。对于每种样品类型,使用6次测量的平均值(每名操作人员每种场合测量一次)进行比较。
表6:ATM-3343抗体
根据稀释线性活动确定程序范围。根据线性活动定量下限被确定为具有合适水平的精密度和相对准确度的最低稀释度。
线性:进行线性回归分析以通过将所有测定运行的测量相对百分比相对于标称相对百分比拟合为使用JMP的线性混合模型中的固定效应来确定R2值。将来自线性评价的测试样品的每个水平的回收率与使用JMP的线性混合模型中的标称相对百分比进行比较,将场合和操作人员的相互作用设定为随机效应。
精密度(测定间变化):通过将相对百分比拟合到采用JMP的线性混合模型中来计算中间精密度的方差估计值,将场合和操作人员设定为随机效应,并且将标称相对百分比设定为固定效应。
使用采用JMP生成的线性混合模型根据准确度和精密度分析确定分析程序的范围。使用采用JMP生成的线性混合模型根据准确度和精密度分析确定定量下限。LOQ被确定为满足合适准确度和精密度条件的最低样品浓度。
对于方法评定,未建立接受标准,但是目标标准列于表7中。
表7:评定数据报告和目标标准总结
实施例3.用于K-NK药物产品的CD3+T细胞定量测定
目的:本实施例报告了ATM-3343方法评定的结果,其中测试了准确度、精密度、线性、定量限和范围。评定参数和程序在实施例2中列出。设计这些程序以评定来自ATM-3343的灵敏分析结果,并且定义K-NK DP中%CD3+残留T细胞杂质的定量限。本实施例还总结了如实施例2所规定的由两名操作人员在三种场合下生成的方法评定数据。利用比较观察到的和预测的目标测量值的回归分析的结果来定义实施例2评定参数的结果。
材料和试剂:将ATM-3343中描述的材料和试剂用于执行如实施例2中详述的评定方案。所使用的材料和试剂列于表8中。
表8:试剂和一次性用品
所使用的设备包括经典AttuneTM声波聚焦细胞仪和离心机(ThermoScientific)。所使用的软件是Attune细胞计数软件v2.1和JMP v.14.3.0。
利用冷冻保存的PBMC-225398样品作为阳性对照以验证CD3+门控并设置流式细胞术分析的CD3+门。在实施例2中描述了PBMC-225398的制备。
测试品材料:利用冷冻保存的批次20035d14 NK细胞作为此方法评定的测试品。在实施例2中描述了用于此方法评定的20035d14细胞的制备。将20035d14细胞在CD3+耗尽后通过PM21颗粒扩增,并且在此测定中用于标准化样品基质中,因此这些细胞代表K-NK DP。批次20035d14的平均%CD3+含量为1.389%,其是作为使用草案形式的ATM-3343的方法性能测试的一部分而确定的(在2种场合下分析测试品,采用2个样品小瓶和2个重复,n=8)。1.389% CD3+是测试品的预期(标称)值。
从上到下表格部分的箭头随后被包括在随附的统计分析中。
程序:在实施例2中描述了测试线性、准确度/真实度和精密度的方法评定。简言之,按照ATM-3343,将冷冻回收的NK 20035d14样品用同种型-APC和CD3-APC抗体染色。也对同种型染色的细胞进行模拟染色以制备用于CD3+T细胞掺加的样品基质稀释剂。将这些模拟染色的细胞用未标记的经纯化的CD3抗体处理以阻断由于CD3+T细胞掺加期间的任何残余抗体溶液引起的任何CD3-APC结合。因此,根据实施例2中设定的要求(图6),在K-NK DP的样品基质中制备用于CD3+T细胞线性估计的系列稀释液。在JMP v14.3.0统计分析软件中进行数据分析。从两名分析人员各自在三种场合下的报告中整理标称(预测)和估计(结果)%CD3+值。用于掺加的测试品需要通过ATM-3343进行分析,以确定掺加模拟染色的制剂的CD3+含量,并且在每种场合下生成测量值。因此,根据测试方法进行了6次测量,这些数据点作为用于评估线性、准确度、精密度和范围的附加水平(水平0)被包括在方法评定数据分析中。检查未转化和Log(Log10、Log、Logist、Logit百分比和Logit)转化的标称CD3%和估计CD3%的残差图以选择回归模型(图7)。在残差图分析中,未转化数据在数据分散时显示出偏差,在较低水平下分散小,而在较高水平下分散较宽。因此,转化数据用于进一步分析。Log10转化是最简单的转化,其改善残差图中的数据分散。因此,选择具有三个小数位的Log10转化CD3%“标称”和“估计”数据用于进一步分析。将表格中报告的结果提供到三个小数位。
表9:来自两名操作人员和各自三种场合的标称(预测)和结果(估计)%CD3+数据。
结果:通过使用线性混合模型,通过使用“操作人员”和“场合”作为随机因子来分析准确度。根据以下方程计算回收率:
实施例2中列出的相对准确度接受目标标准为100%±30%。标称CD3%稀释水平0.016%-1.389%的回收率在100%±30%接受标准内。0.004% CD3+T细胞水平下的标称CD3%不满足准确度接受标准(表10和图8)。
表10:经计算用于准确度/真实度估计的回收率总结。
精密度:使用采用JMP v14.3.0的线性混合模型,通过使用“操作人员”和“场合”作为随机因子来分析精密度。如实施例2所规定,由于时间限制,没有获取相同样品的连续重复测量值。由于水平5(标称0.004% CD3+T细胞)未达到准确度/真实度接受标准,因此将来自此水平的标称和估计数据从精密度分析中排除。实施例2中列出的接受标准是报告%CV(用于精密度)和<20% CV(用于中间精密度)。“操作人员”、“场合”、“残差”和中间精密度的%CV结果分别为0.288%、2.386%、4.819%和5.386%(表11)。因此,水平0-4(1.389%-0.016% CD3+T细胞)满足精密度分析的接受标准。
表11:精密度和中间精密度分析结果
线性:为了确定CD3+定量的线性,如图5所示,将CD3-APC染色的细胞在K-NK DP样品基质中掺加并连续稀释,以预测%CD3+T细胞估计的五个水平(水平1-5或1.000%-0.004% CD3+T细胞)。样品基质由用同种型-APC和经纯化的未标记人CD3抗体(负染色)处理的模拟细胞组成。包括未标记的(未缀合的)CD3抗体以阻断由于来自向样品基质稀释剂中掺加样品的CD3-APC抗体的残余引起的任何CD3染色。经生成用于掺加的未稀释测试品数据作为用于评价线性的附加水平(水平0)而被包括;因此,从1.389%-0.004% CD3+T细胞评估线性。由于来自标称水平5(0.004% CD3+T细胞)的估计结果不满足准确度接受标准,因此将此水平从采用回归模型的线性分析中排除。回归图和预测残差图示于(图9)中。实施例2中列出的线性目标标准为R2>0.8。在回归分析中观察到的R
表12:回归模型总结。
范围:使用JMP v14.3.0中生成的线性混合模型根据准确度和精密度分析确定%CD3+T细胞定量的范围。在K-NK DP样品基质内的四倍稀释方案中,分析了具有预期1.000%-0.004% CD3+T细胞的五个稀释水平(1-5)的准确度。包含未稀释的测试品增加了额外水平,将范围上限增加至1.389% CD3+T细胞。水平(0-4)即1.389%-0.016% CD3+T细胞的预测%CD3+T细胞定量满足准确度接受标准(100%±30%)。水平5(0.004% CD3+T细胞)不满足准确度接受标准。因此,此方法的范围被定义为1.389%至0.016% CD3+T细胞定量。低于此定量范围的%CD3+T细胞应当被报告为BLOQ(低于定量限),而高于此定量范围的%CD3+T细胞应当被报告为高于ULOQ(定量上限)。必须满足获取1x 10
K-NK DP由使用PM21颗粒从CD3+T细胞耗尽的PBMC群体中体外扩增至高密度的NK细胞组成。K-NK DP中的杂质可以是耗尽后残留的CD3+T细胞,其可以以低于先前建立的分析测定的限定限值的水平存在。因此,开发了基于流式细胞术的ATM-3343以检测低(<0.3%CD3+T细胞)水平的作为K-NK DP中的潜在杂质的残留CD3+T细胞。ATM-3343结合了阻断和洗涤步骤以特异性染色和获取CD3+T细胞。此方法利用人TruStain FcX、CD3-APC和同种型-APC试剂特异性检测和定量K-NK DP中的%CD3+T细胞。利用参考PBMC群体作为阳性对照。考虑到低水平CD3+定量的要求,ATM-3343规定从K-NK DP样品获取1x 10
由两名操作人员各自在三种场合下生成评定参数(包括准确度、精密度、线性和范围)的数据。在每种场合下,除了获取五个水平的预定义的%CD3+浓度外,还获取参考材料和同种型-APC或CD3-APC染色的细胞(表8)。在每种场合下,通过在K-NK DP细胞的模拟(同种型和未标记的CD3处理的)样品基质中掺加CD3+T细胞来制备这些稀释水平。基于ATM-3343和实施例2中列出的顺序门控策略(总事件>MNC>单个细胞>活细胞>CD3+),设置流式细胞术获取参数以从每个样品获取1x 10
表13:ATM-3343评定实施例2的执行
总结:根据实施例2所述的程序“ATM-3343T细胞定量的方法评定方案”执行此方法评定。K-NK药物产品(DP)由从CD3+T细胞耗尽的供体PBMC群体体外扩增至高密度的NK细胞组成。开发了ATM-3343以通过流式细胞术检测和定量1x 10
表14:方法评定总结
结论:评定ATM-3343以定量K-NK DP中的低(≥0.016%)%CD3+T细胞。根据评定参数,0.016%至1.389%之间的%CD3+T细胞定量范围的准确度、精密度和线性被确定为是可接受的。需要ATM-3343测定有效性和系统适合性标准来可靠地测量K-NK DP中的CD3+T细胞杂质。
