目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器
文献发布时间:2023-06-19 18:35:48
技术领域
本发明涉及生物传感器技术领域,具体涉及目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器。
背景技术
现有的技术对于前列腺癌的诊断存在特异性较低、早期诊断率较低的问题。早期诊断前列腺癌可以大大提高患者的生存率,而前列腺癌患者早期多无明显症状。目前确诊前列腺癌还靠的是病理组织活检,活检耗时长、病人更加痛苦。人α-甲基酰基辅酶A消旋酶(α-methyl acyl-CoA racemase,AMACR)已经证实为PCa的可靠生物标志物,穿刺活检中AMACR表达对于PCa检测具有97%的敏感性和100%的特异性。现有的一些方法对于AMACR检测的灵敏度较低,如影像学方法:X线、CT、 MRI仅仅只能从形态学上进行诊断;血清样本的检测,由于AMACR在血清中含量低,检测较为困难。
因此,本发明旨在提供一种目标物触发球形核酸自组装快速激活 CRISPR-Cas12a信号开关的传感器,以解决对于前列腺癌标志物AMACR 检测灵敏度低、时间长的问题,实现高度灵敏且准确地检测AMACR。
发明内容
本发明的目的是为了解决上述问题,提供目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器。
为了达到上述目的,本发明的技术方案如下:目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器,所述传感器包括发光材料和传感器,所述发光材料为具有强且稳定ECL信号的材料 AuAgNCs@MOF-5,且所述材料AuAgNCs@MOF-5表面连接修饰有多巴胺的猝灭探针;
所述传感器包括球形核酸A和球形核酸B,所述球形核酸A和球形核酸B均由发夹和Y形DNA纳米结构构成,其中发夹不仅包含依赖Zn
进一步地,所述传感器的构建方法包括以下步骤:
步骤一、合成具有强且稳定ECL信号的材料AuAgNCs@MOF-5,在材料表面连接修饰有多巴胺的猝灭探针使背景信号降低;
步骤二、传感器的构建:
1)构建两种不同的球形核酸A和球形核酸B,球形核酸A和球形核酸B均由发夹和Y形DNA纳米结构构成;其中,发夹不仅包含依赖Zn
2)在目标物AMACR存在时,AMACR与AMACR适配体结合,Y 形DNA纳米结构解体,导致DNAzyme strands游离,AP
3)游离的DNAzyme strands与发夹互补配对,形成依赖Zn
4)通过磁性分离收集含有激活子的上清液;
5)CRISPR/Cas12a的激活子激活CRISPR/Cas12a蛋白,发挥反式切割能力,对材料AuAgNCs@MOF-5表面的猝灭探针进行切割,使信号恢复,构建成传感器,使血清中少量的AMACR的量放大,实现对目标物准确、灵敏的检测。
本发明还提供所述的目标物触发球形核酸自组装快速激活CRISPR- Cas12a信号开关的传感器应用于在血清中对前列腺癌标志物AMACR的检测。
与现有技术相比,本方案的有益效果:
在本发明中,本发明的传感器能够用于在血清样本中检测前列腺癌标志物AMACR,且能够实现高度灵敏且准确地检测AMACR;本发明的方案中由目标物触发而形成的网络结构,能通过限域增强效应提升反应效率,解决现有技术中对于前列腺癌标志物AMACR检测灵敏度低、时间长的问题。
附图说明
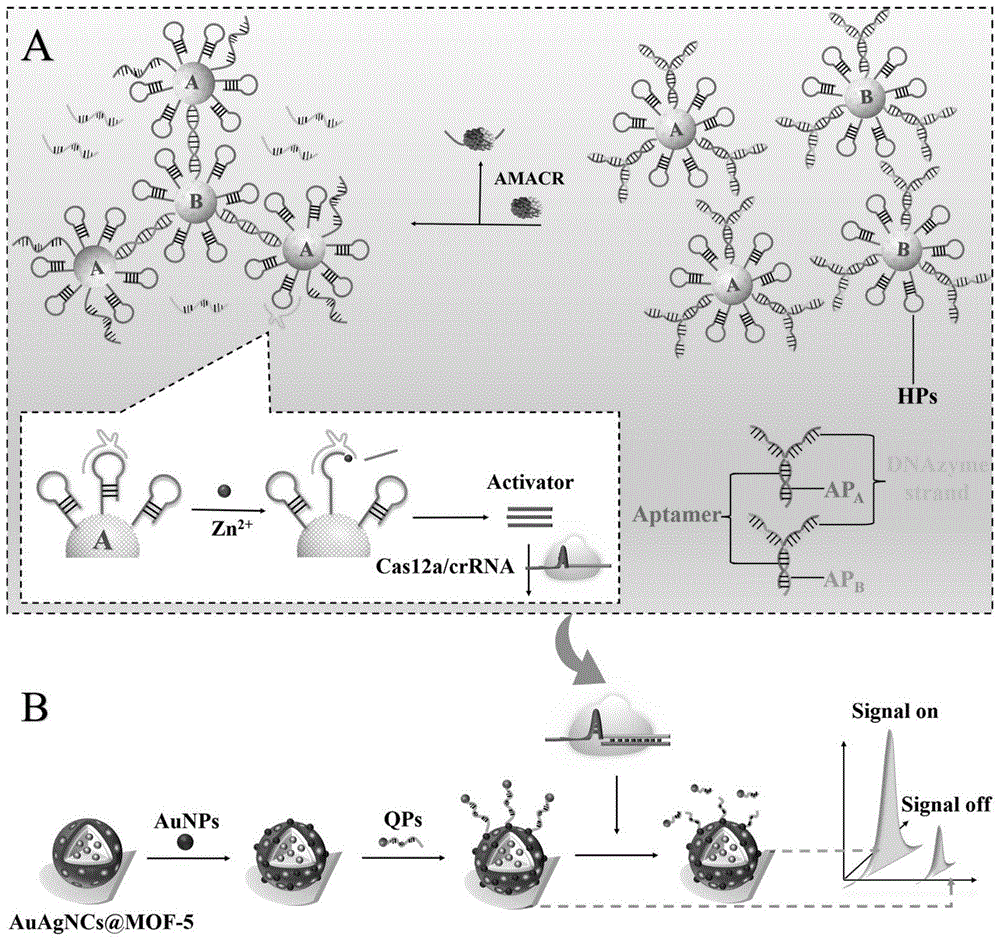
图1是本发明实施例中传感器的构建方法流程图;
图2是本发明实施例中发光材料表征;
图3是本发明实施例中传感器的可行性验证(跑胶、ECL);
图4是本发明实施例中传感器的网络限域增强验证;
图5是本发明实施例中传感器的性能检测。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明的实施例及附图,对本发明的技术方案进行进一步详细地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
实施例:
如图1所示,目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器,传感器包括发光材料和传感器,发光材料为具有强且稳定ECL信号的材料AuAgNCs@MOF-5,且材料AuAgNCs@MOF-5表面连接修饰有多巴胺的猝灭探针;
传感器包括球形核酸A和球形核酸B,球形核酸A和球形核酸B均由发夹和Y形DNA纳米结构构成,其中发夹不仅包含依赖Zn
该传感器的构建方法包括以下步骤:
步骤一、合成具有强且稳定ECL信号的材料AuAgNCs@MOF-5,在材料表面连接修饰有多巴胺的猝灭探针使背景信号降低(如图1B所示);
步骤二、传感器的构建(如图1A所示):
1)构建两种不同的球形核酸A和球形核酸B,球形核酸A和球形核酸B均由发夹和Y形DNA纳米结构构成;其中,发夹不仅包含依赖Zn
2)在目标物AMACR存在时,AMACR与AMACR适配体结合,Y 形DNA纳米结构解体,导致DNAzyme strands游离,AP
3)游离的DNAzyme strands与发夹互补配对,形成依赖Zn
4)通过磁性分离收集含有激活子的上清液;
5)CRISPR/Cas12a的激活子激活CRISPR/Cas12a蛋白,发挥反式切割能力,对材料AuAgNCs@MOF-5表面的猝灭探针进行切割,使信号恢复。通过构建传感器,将血清中少量的AMACR转换和扩增,实现对目标物准确、灵敏的检测。
由于人α-甲基酰基辅酶A消旋酶(α-methyl acyl-CoA racemase, AMACR)已经被证实为PCa的可靠生物标志物,穿刺活检中AMACR表达对于PCa检测具有97%的敏感性和100%的特异性,本发明的目标物触发球形核酸自组装快速激活CRISPR-Cas12a信号开关的传感器能够应用于在血清中对前列腺癌标志物AMACR的检测。
在本实施例中,步骤一种合成具有强且稳定ECL信号的材料 AuAgNCs@MOF-5的方法为:将144mg Zn(NO
步骤二中,构建两种不同的球形核酸A和球形核酸B的方法为:首先,用5μL 1MTris(2-羧乙基)膦(TCEP)还原辅助探针(APs)30分钟。然后,将10μL 10μM AMACR适体,12μL10μM DNA酶链和8μL 10μM APs(AP
以下为本实施例中本发明的传感器性能检测:
如图5所示,在最佳条件下,探讨了该传感器的灵敏度、特异性和稳定性。首先,应用不同浓度的AMACR的ECL响应来分析所提出的生物传感器的灵敏度。如图5A所示,当AMACR浓度在1ng/mL至100μ g/mL范围内时,ECL信号逐渐增强。值得注意的是,在图5B中描述了对数与AMACR浓度之间令人满意的线性关系,线性回归方程表示为:
I=1514.50lgc+9257.75,
其中,I指的是ECL强度,相关系数为0.9942,c指的是AMACR的浓度。此外,限度检测计算为0.10ng/ml。为了评价本发明所构建的生物传感器的特异性,利用PTK-7、MUC1、CD63等潜在的干扰物质及其与AMACR的混合物对其性能进行了验证。如图5C所示,只有在 AMACR存在的情况下,构建的生物传感器显示出较高的ECL信号,否则显示出可忽略不计的ECL反应,表明该生物传感器对AMACR检测具有相对较高的特异性。关于稳定性,本发明的该生物传感器的另一个重要特性,通过连续扫描14个循环,在10μg/mL的AMACR浓度下进行研究。如图5D所示,相对稳定的ECL反应表明生物传感器对AMACR特征量化具有良好的稳定性。
实验样本检测:
为评价该生物传感器在临床应用的可行性,采用标准加入法测定回收率。如下表所示:
将不同浓度的AMACR样品加入到人血清溶液中,然后用所提出的生物传感器进行测定。实验结果显示,相对标准差和定量回收率均可接受。
综上所述,在本发明的上述实施例中,本发明的传感器能够用于在血清中对前列腺癌标志物AMACR的检测,且本发明与现有的对于AMACR 检测的方法对比,本发明提供一种目标物触发球形核酸自组装快速激活 CRISPR-Cas12a信号开关的传感器,能够解决现有的检测方法的灵敏度低、时间长的问题,实现高度灵敏且准确地检测AMACR。
以上具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
