基于胶乳免疫比浊法测定S100A8/9的试剂盒及方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明实施例涉及生物分析技术领域,具体涉及一种基于胶乳免疫比浊法测定S100A8/9的试剂盒及方法。
背景技术
S100A8(MRP8)和S100A9(MRP14)是钙离子结合蛋白,属于S100家族的结合蛋白。这个家族的成员包含一个共同的结构,由两个“EF手形”基序组成,它们本身由两个α链组成,由一个肽环分离,其中离子Ca
总的来说,S100A8和A9蛋白被认为是警报素,否则称为损伤相关分子模式(DAMP)。在炎症条件下,S100A8和S100A9的蛋白表达在多种细胞中被诱导,如内皮细胞、巨噬细胞、破骨细胞、角质形成细胞和树突状细胞。因此,血清S100A8和/或S100A9水平升高在许多炎症病理(银屑病、类风湿关节炎、慢性炎症性肠病等。)中被发现。S100A8和S100A9还可以通过与TLR4受体连接并诱导NF-κB和丝裂原活化蛋白激酶(MAPK)途径,通过分泌促炎细胞因子(TNF、IL6等。)来放大炎症反应。它们也参与ROS依赖的NLRP3炎症小体的激活。除了它们的活性在细胞因子分泌,他们发挥了化学吸引功能,允许招募和白细胞粘附。细胞黏附的过程是通过S100A8和/或A9固定在中性粒细胞TLR4上,提高内皮细胞表达细胞间黏附分子1(IntercellularAdhesion Molecule 1,ICAM-1)和血管细胞黏附蛋白1(Vascular celladhesionprotein 1,VCAM-1)黏附分子,使白细胞黏附于内皮壁。炎症反应在肿瘤发生发展中的重要作用在很大程度上解释了S100A8和A9在肿瘤发生发展中的作用。文献中有充分的证据支持S100A8和A9在许多实体癌中的促癌作用。首先,S100基因1q21位点的扩增在癌症中普遍存在。此外,S100A8和S100A9蛋白在多种实体瘤中促进肿瘤生长、转移发展、血管生成和免疫逃逸。事实上,S100A8和S100A9蛋白的表达在几种肿瘤类型(乳腺、前列腺、结肠、黑色素瘤等。)中上调。S100A8已被证明在侵袭性表型和总生存率低的患者中过表达,表明调节S100A8基因表达是参与癌细胞控制的一种机制。蛋白质S100A8、S100A9或异源寡聚体S100A8/A9也可能通过调节肿瘤微环境促进癌细胞迁移和扩散。同样,关于S100A8和S100A9在血液系统恶性肿瘤尤其是急性白血病(AL)发生发展中的病理作用的数据也越来越多。
Ebbing等人研究了肾肿瘤患者钙卫蛋白的时变变化,这些变化由于肾动脉的短暂钳夹而导致医源性肾缺血再灌注损伤。钙卫蛋白浓度在手术结束时(缺血后约2小时)开始显着增加,术后48小时达到最大水平,钙卫蛋白水平比基线增加69倍。手术后5天钙卫蛋白仍然显着增加。钙卫蛋白的升高已经在其他几种疾病中进行了描述,例如类风湿性关节炎,炎症性肠病,心肌梗塞,癌症和其他几种疾病。在尿钙卫蛋白发现的临床解释中,人们应该意识到,除了AKI之外,还有两种临床环境导致钙卫蛋白的增加:由于钙卫蛋白主要来自中性粒细胞和单核细胞,脓尿会大大增加尿钙卫蛋白。此外,尿路上皮癌与浓度增加有关。
目前S100A8/9的检测方法主要是酶联免疫吸附法(ELISA),ELISA法操作相对繁琐、检测时间长,干扰因素较多,而在生化分析仪上利用胶乳免疫比浊法测定S100A8/9,操作简单、检测方便快捷、灵敏度高,特异性强,重复性也好,且该测试方法可以在各种生化分析仪上使用,具有很强的适用性。
发明内容
为此,本发明实施例提供一种基于胶乳免疫比浊法测定S100A8/9的试剂盒及方法。
为了实现上述目的,本发明实施例提供如下技术方案:
根据本发明实施例的第一方面,本发明提供一种包被有S100A8/9抗体的胶乳微球溶液的制备方法,包括如下步骤:
1)向缓冲液加入胶乳微球,得活化的胶乳微球体系;
2)向所述活化的胶乳微球体系加入S100A8/9抗体,搅拌,之后加入EDC·HCl溶液和NHS溶液,进行偶联反应,得偶联体系;
3)向所述偶联体系加入封闭液进行封闭,之后进行离心,取上清,得混合体系;
4)向所述混合体系加入储存液,过夜保存,得所述包被有S100A8/9抗体的胶乳微球溶液;
其中,所述缓冲液由体积比为1:3~5的MES缓冲液和硼酸缓冲液组成,所述MES缓冲液以水为溶剂,包括MES·H
本发明发现,在采用“二步法”进行偶联反应,缓冲液、物料的添加方式显著影响S100A8/9抗体与胶乳微球的结合,胶乳微球在上述特定缓冲液中进行活化,之后加入S100A8/9抗体,再加入EDC和NHS,有利于提高S100A8/9抗体与胶乳微球的偶联效率。作为优选,所述缓冲液由体积比为1:4的MES缓冲液和硼酸缓冲液组成,所述MES缓冲液以水为溶剂,包括MES·H
进一步地,所述胶乳微球为羧基聚苯乙烯胶乳颗粒,粒径为140~160nm;所述胶乳微球与缓冲液的体积比为1:3.8~4.2。本发明进一步发现,采用粒径较小的羧基聚苯乙烯胶乳颗粒,在上述偶联条件下,更有利于提高S100A8/9抗体与乳胶微球的结合物的稳定性,进而提高试剂盒的检测灵敏度和准确性。
本发明使用的S100A8/9抗体可以为市售抗体。作为优选,本发明采用单B细胞测序技术对免疫的小鼠脾脏进行单细胞测序,根据数据分析筛选基因频率最高的表达,后经过抗原ELISA验证,筛选获得特异性S100A8/9抗体,以进一步提高试剂盒的检测灵敏度和准确性。
具体地,所述S100A8/9抗体包括重链可变区和轻链可变区;所述重链可变区的CDR1的氨基酸序列如SEQ ID No.1的第26-33位氨基酸所示;所述重链可变区的CDR2的氨基酸序列如SEQ ID No.1的第51-58位氨基酸所示;所述重链可变区的CDR3的氨基酸序列如SEQ ID No.1的第97-110位氨基酸所示;所述轻链可变区的CDR1的氨基酸序列如SEQ IDNo.2的第26-31位氨基酸所示;所述轻链可变区的CDR2的氨基酸序列如SEQ ID No.2的第49-51位氨基酸所示;所述轻链可变区的CDR3的氨基酸序列如SEQ ID No.2的第88-97位氨基酸所示。
进一步地,所述重链可变区的氨基酸序列如SEQ ID No.1所示;所述轻链可变区的氨基酸序列如SEQ ID No.2所示。
进一步地,步骤2)中,所述S100A8/9抗体的终浓度为0.04~0.06mg/ml;所述EDC·HCl的终浓度为1.8~2.2mM;所述NHS的终浓度为4.8~5.2mM;
步骤3)中,所述封闭液以水为溶剂,包括终浓度为1.8~2.2mL/L的吐温20、终浓度为0.8~1.2g/L的BSA,pH为7.2~7.5;
步骤4)中,所述储存液以水为溶剂,包括终浓度为1.8~2.2ml/L的吐温20、终浓度为0.8~1.2g/L的BSA和终浓度为0.3~0.6ml/L的Proclin300,pH为7.2~7.5;所述胶乳微球溶液中胶乳微球的体积浓度2%~3%。
根据本发明实施例的第二方面,本发明提供一种包被有S100A8/9抗体的胶乳微球溶液,其由如上任一项所述的方法制成。
根据本发明实施例的第三方面,本发明提供一种基于胶乳免疫比浊法测定S100A8/9的试剂盒,包括试剂R1和胶乳试剂R2,
所述试剂R1的成分和含量为:缓冲液50~150mmol/L,无机盐0.05~0.2mol/L,防腐剂0.01~3%,溶剂为纯水;
所述胶乳试剂R2的成分和含量为:缓冲液50~350mmol/L,稳定剂0.5~5%,表面活性剂0.2~2%,防腐剂0.02~5%,如上所述的包被有S100A8/9抗体的胶乳微球溶液2~3%,溶剂为纯水。
进一步地,在所述试剂R1中,所述缓冲液为Tris-HCl缓冲液,所述无机盐为氯化钠,所述防腐剂为Proclin300;
在所述胶乳试剂R2中,所述缓冲液为Tris-HCl缓冲液,所述稳定剂为BSA,所述表面活性剂为吐温20,所述防腐剂为Proclin300。
进一步地,所述试剂R1的成分和含量为:Tris-HCl缓冲液100mM,氯化钠0.15mol/L,Proclin3000.03%,溶剂为纯水;
所述胶乳试剂R2的成分和含量为:Tris-HCl缓冲液100mM,BSA1%,吐温20 1%,Proclin3000.03%和所述胶乳颗粒溶液3%。
根据本发明实施例的第四方面,本发明提供一种使用如上所述的试剂盒测定S100A8/9的方法,包括如下步骤:
吸取2μL待测样本,加入200μL所述试剂R1,37℃孵育5min;
加入40μL所述胶乳试剂R2,37℃孵育30s,读取吸光度A1;
在37℃下继续孵育5min,读取吸光度A2;
计算ΔA=A2-A1,根据ΔA测算所述待测样本中S100A8/9的含量。
本发明试剂盒的反应原理:
待测样本中的S100A8/9与胶乳试剂R2中特异性的鼠单抗S100A8/9胶乳颗粒结合,发生抗原抗体反应,形成抗原-抗体的复合物,进而引起浊度的变化。通过全自动生化分析仪检测这种浊度变化,并利用标准品绘制线性曲线,可得出相应样本中S100A8/9的含量。
本发明实施例具有如下优点:
本发明提供的基于胶乳免疫比浊法测定S100A8/9的试剂盒,能有效提高检测S100A8/9的灵敏度和特异性,重复性更好,抗干扰能力强,且试剂稳定性良好,实现了在生化分析仪上的自动检测,操作简单、检测方便快捷,便于临床推广。另外,本发明提供的试剂盒对肺癌和纤维化进程检测也更加方便,有利于对肿瘤标志物和预后标志物的检测。
附图说明
为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
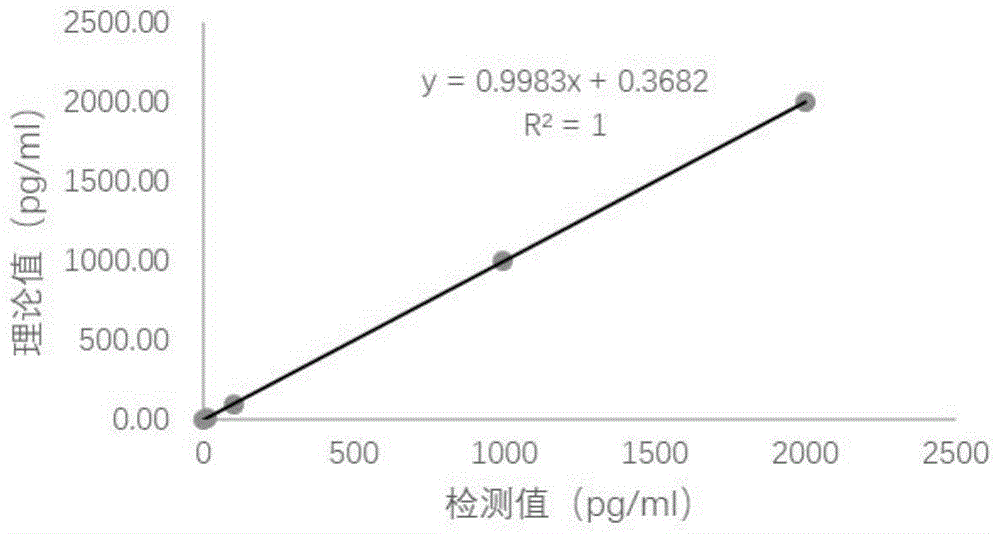
图1为本发明实施例提供的S100A8/9试剂盒的拟合曲线示意图;
图2为本发明实施例提供的正常人与肺癌患者痰液中S100A8/9的含量对比;
图3为本发明实施例提供的正常人与肝纤维化不同等级患者血清中S100A8/9的含量对比。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1S100A8/9抗体的制备
S100A8/9抗体通过抗体测序基因表达频率高的抗体筛选得到,制备流程如下:
动物免疫、B细胞收集和富集、单B细胞导入、单B细胞分析:特异性、功能性和亲和性、单细胞导出、单细胞测序、数据分析和重组抗体表达验证。
抗原免疫情况统计结果见表1。
表1
注:抗原浓度为1.05mg/ml。S100A8/9抗原:将S100A8序列和S100A9序列构建在pcDNA3.1载体上,融合表达异源二聚体的S100A8/9蛋白。
免疫一个月后取小鼠脾脏细胞,进行单细胞测序。B细胞富集和纯化使用SORPFACS Aria 5L18c流式细胞仪,后续使用10X genomics 5'HT Reagent Kits v2进行抗体VDJ文库和5'表达文库检测。建立好的文库使用Illumina二代测序仪进行测序,根据测序结果分选基因表达频率高的抗体基因,合成后使用293T细胞抗体表达,使用ELISA检测抗体表达。
经测序,筛选出的特异性S100A8/A9抗体的H链可变区的氨基酸序列如SEQ IDNo.1所示,L链可变区的氨基酸序列如SEQ ID No.2所示。
其中,H链可变区的CDR1、CDR2、CDR3的氨基酸序列分别为:GFSFTSYA;LTGSGAFT;GKPPRGYNTAPSDY。L链可变区的CDR1、CDR2、CDR3的氨基酸序列分别为:NIASTS;PDS;QVWDHSNEDL。
实施例2包被有S100A8/9抗体的胶乳微球溶液的制备
包被有S100A8/9抗体的胶乳微球溶液的制备方法包括如下步骤:
步骤1、用5ml反应缓冲液(1ml第一反应缓冲液+4mL第二反应缓冲液)悬浮300μL胶乳微球(羧基聚苯乙烯胶乳颗粒,粒径为140nm),整个反应体系保持在28℃恒温条件下反应90min,得到活化的胶乳微球溶液。
本实施例中第一反应缓冲液为MES缓冲液,包括6.52g/L的MES·H
步骤2、向步骤1的反应体系加入实施例1的S100A8/9抗体,终浓度为0.05mg/ml。
步骤3、在28℃条件下,搅拌90min。
步骤4、向步骤3的反应体系依次加入EDC·HCl溶液和NHS溶液。EDC·HCl的终浓度为2Mm,NHS的终浓度为5Mm。NHS溶液现用现配。
步骤5、向步骤4的反应体系加入吐温20和BSA进行封闭。吐温20的终浓度为2mL/L;BSA的终浓度为1g/L,pH为7.4,反应后离心。
步骤6、向步骤5的反应体系加入吐温20、BSA和Proclin300的储存液。吐温20的终浓度为2mL/L、BSA的终浓度为1g/L、Proclin300的终浓度为0.5mL/L,pH为7.2。
步骤7、过夜保存,获得包被有S100A8/9抗体的胶乳微球溶液,其中,胶乳微球的体积浓度为3%。
实施例3试剂盒的制备
试剂盒的制备如表2所示。
表2试剂盒
1)R1、R2的配制
按照表1配制试剂1和试剂2。
2)校准品的制备
将S100A8/9用校准品稀释液配制成一系列校准品,浓度分别为0pg/mL,10pg/mL,100pg/mL,1000pg/mL,10000pg/mL。
3)定标曲线的建立
将S100A8/9校准品,浓度从0到10000pg/mL,分别与配制的S100A8/9胶乳试剂在反应杯中反应,用生化分析仪进行检测,记录反应度。检测波长为570nm,检测透射光强度,采用终点法检测。
实施例4试剂盒的检测方法
1.试剂准备
液体R1、R2试剂开瓶即用。校准品使用前需用1.00mL的纯化水复溶,置10℃~30℃放置30分钟,使冻干物完全溶解后,轻轻混合即可作为原校准品溶液使用。用纯化水将原校准品溶液按下表稀释(体积比),稀释成六个浓度梯度,稀释方法如表3所示。
表3原校准品稀释配比
2.参数设置
3.检测步骤
4.校准程序
采用多点定标校正。
5.计算
对实施例3的试剂盒进行各项指标的检测
一.线性相关性验证
在[0,2000]pg/mL范围内用接近线性区间下限的低值样本稀释接近线性区间上限的高值样本,混合成至少5个不同浓度的样本,每个样本测定3次取平均值,对测定值进行线性回归分析,计算线性回归的相关系数应≥0.9900。
具体数据比对值如表4所示。
表4线性检测结果
图1是线性回归图,如图1所示,直线拟合曲线为y=0.9983x+0.3682,R
二.精密度验证
对实施例3的试剂盒进行批内精密度和日间精密度的测定。选择低值(50)和高值(5000)两个水平的质控血清作为评价样本,批内精密度:在较短的时间内及稳定的条件下连续重复测定20次,记录每次的测定结果并计算均值(Mean)、标准差(SD)、变异系数(CV);日间精密度:每天测定1次评价样本,累积20次结果,计算均值(Mean)、标准差(SD)、变异系数(CV)。实验结果如表5-1和表5-2所示。
表5-1批间重复性检测结果
表5-2日间重复性检测结果
由表5-1和5-2可以得出,试剂盒的批内CV最高为1.2%,日间CV最高为0.53%,符合≤4%的要求。
实施例5应用于肺癌患者痰液中S100A8/9含量检测
由于S100A8/9与肿瘤生长和逃逸有关,因此检测肺癌患者痰液中S100A8/A9含量。采用实施例3的试剂盒,对正常人(n=20)和肺癌患者(n=20)进行检测,结果如表6所示。结果证明S100A8/9在实体瘤发生过程中起促进作用。
表6检测结果统计图
/>
实施例6肝纤维化、肝硬化和肝癌患者血清中S100A8/9含量检测
采用实施例3的试剂盒检测正常人(n=15)、肝纤维化(n=15)、肝硬化(n=15)和肝癌(n=15)60人血清中S100A8/9含量,结果如表7所示。
表7检测结果统计
由结果可知,在纤维化进程中S100A8/9的含量增加,可能是参与炎症反应有关,在肝硬化中,高表达的S100A8/9可能与促进肝癌的形成有关,肝癌阶段增加的含量,可能与肿瘤生成和肿瘤转移相关。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
/>
/>
/>
/>
