新型缩醛磷脂衍生物
文献发布时间:2023-06-19 09:23:00
技术领域
本发明涉及新型化合物,详细而言,涉及与缩醛磷脂类似的新型化合物(缩醛磷脂衍生物)。
背景技术
磷脂作为生物膜的构成成分是重要的,其中,作为醚磷脂的缩醛磷脂占哺乳动物生物膜的磷脂的约18%。该缩醛磷脂尤其大量存在于脑神经、心肌、骨骼肌、白细胞、精子是已知的。
就缩醛磷脂而言,由于与二十二碳六烯酸、花生四烯酸等多元不饱和脂肪酸大量结合,因此成为由这些多元不饱和脂肪酸产生的前列腺素、白三烯等细胞间信号的第二信使的储存所,不仅如此,缩醛磷脂还发挥着细胞融合、离子运输等重要的作用。
另外,逐渐明确了缩醛磷脂自身介由特异性G蛋白偶联受体(GPCR)而参与信号传递。例如,缩醛磷脂通过增强神经细胞的AKT、ERK等蛋白磷酸化酶的活性而抑制神经细胞凋亡(参见非专利文献1),作为其细胞信号传递机制,明确了特定的5种GPCR的参与(参见非专利文献2)。
进而,对小鼠腹腔内注射7天LPS时,在前额叶皮质(prefrontal area)和海马体中,IL-1β及TNF-αmRNA强表达,β淀粉样蛋白(Аβ1-16)阳性神经元表达,并且胶质细胞活化,而若在注射LPS后、向腹腔内同时施予缩醛磷脂,则伴着细胞因子产生的胶质细胞的活化和Аβ蛋白质的蓄积显著减弱。另外,在前额叶皮质和海马体中,虽然缩醛磷脂的含量因LPS而减少,但通过同时施予缩醛磷脂,其减少得以抑制。
即,认为缩醛磷脂具有抗神经炎症作用和淀粉样蛋白生成预防效果,教导了其在阿尔茨海默病的预防或改善(治疗)中的应用(参见非专利文献3)。
对于缩醛磷脂而言,已知在认知症、帕金森病、抑郁症、精神分裂症等脑神经疾病、以及糖尿病、代谢综合征、缺血性心脏病、各种感染症、免疫异常中减少。
例如,1999年报道了,在阿尔茨海默病的脑(尸体的脑)中,乙醇胺型缩醛磷脂在额叶和海马体中非常显著地减少(参见非专利文献4),2007年还报道了,在阿尔茨海默病患者的血清中缩醛磷脂减少(参见非专利文献5)。
另外,报道了,在缺血性心脏病的患者组中,胆碱型缩醛磷脂与正常对照组相比减少(参见非专利文献6)。
认为通过额外补充减少的缩醛磷脂能够期待这些疾病的预防及改善效果,因此以往以来,一直在尝试从动物组织中提取这样的缩醛磷脂。例如,专利文献1中提出了,将乙醇作为提取溶剂对表层的鸡胸肉进行提取处理并回收提取液的方法。
另外,专利文献2中提出了下述方法,其特征在于,利用非极性有机溶剂与支链醇的混合溶剂从扇贝等双壳贝进行提取处理,以及用磷脂酶A1(PLA1)进行处理,将作为夹杂物的二酰基化型甘油磷脂水解而去除。
而且,报道了在以轻症阿尔茨海默病、轻度认知障碍的人为对象的随机双盲临床试验中,经口施予从上述扇贝的裙边提取的缩醛磷脂,结果强烈教导了,对轻症阿尔茨海默病而言认知功能得以改善(参见非专利文献7)。
另一方面,作为缩醛磷脂衍生物的合成例,出于通过使降低的缩醛磷脂水平上升来预防或改善由缩醛磷脂的缺乏引起的各种疾病的目的,提出了在缩醛磷脂的sn-3位结合有α-硫辛酸的新型缩醛磷脂前体物质(参见专利文献3)。而且,显示了这些衍生物对猴子的帕金森病模型有效(参见非专利文献8)。
另外,专利文献4中提出了将sn-1位乙酰化而得的衍生物为二十二碳六烯酸的良好的载体,并报道了对大鼠的急性脑梗模型有效(参见非专利文献9)。
现有技术文献
专利文献
专利文献1:日本专利第5483846号公报
专利文献2:日本特开2016-108466号公报
专利文献3:WO2010-071988号
专利文献4:WO2013-037862号
非专利文献
非专利文献1:Md.ShamimHossain等人,Plasmalogens rescue neuronal celldeath through an activation of AKT and ERK survival signaling.PLoS ONE 8(12):e83508,2013
非专利文献2:Md.Shamim Hossain等人,Neuronal Orphan G-Protein CoupledReceptor Proteins Mediate Plasmalogens-Induced Activation of ERK and AktSignaling.PLoS ONE 11(3):e0150846,2016
非专利文献3:M.Ifuku等人,Anti-inflammatory/anti-amyloidogenic effectsof plasmalogens in lipopolysaccharide-induced neuroinflammation inadultmice.J of Neuroinflammation,9:197,2012
非专利文献4:Z.Guan等人,Decrease and Structural Modifications ofPhosphatidylethanolamine Plasmalogen in the Brain with Alzheimer Disease,JNeuropathol Exp Neurol,58(7),740-747,1999
非专利文献5:D.B.Goodenowe等人,Peripheral ethanolamine plasmalogendeficiency:a logical causative factor in Alzheimer's disease and dementia,JLipid Res,48,2485-2498,2007
非专利文献6:真田竹生等人,缺血性心脏病中的血清缩醛磷脂的药物代谢,动脉硬化,11,535-539,1983
非专利文献7:T.Fujino等人,Efficacy and Blood Plasmalogen Changes byOral Administration of Plasmalogen in Patients with Mild Alzheimer's Diseaseand Mild Cognitive Impairment:A Multicenter,Randomized,Double-blind,Placebo-controlled Trial,EBioMedicine,17:199-205,2017
非专利文献8:L.Gregoire等人,Plasmalogen precursor analog treatmentreduces levodopa-induced dyskinesias in parkinsonian monkeys,Behav Brain Res,286:328-337,2015
非专利文献9:C.Fabien等人,Brain-Targeting Form of Docosahexaenoic Acidfor Experimental Stroke Treatment:MRI Evaluation and Anti-Oxidant Impact,Current Neurovascular Res,8(2):95-102,2011
非专利文献10:P.Wang等人,Improved Plasmalogen Synthesis UsingOrganobarium Intermediates,J.Org.Chem,72:5005-5007,2007
发明内容
发明所要解决的课题
鉴于上述背景,本发明的目的在于提供在sn-1位具有氧原子、氮原子、硫原子等杂原子且显示出与天然的缩醛磷脂同等或其以上的效果的新型化合物。
用于解决课题的手段
本申请的发明人在进行与缩醛磷脂衍生物相关的研究中,设计、合成了在sn-1位的碳链中具有氧原子、氮原子、硫原子等杂原子的新型化合物并供于体外及体内试验,结果发现发挥与缩醛磷脂同等或其以上的效果,从而完成了本发明。
本发明也可以用于具有作为缩醛磷脂其自身的功能、作为缩醛磷脂的前体的功能、促进缩醛磷脂的效果的功能、或作为二十二碳六烯酸的载体的功能的任意化合物。
即,本发明如下所示。
[1]通式(I)所示的化合物、其外消旋体或它们的盐。
[化学式1]
(通式(I)中,X表示氧原子、氮原子、硫原子或碳原子,R
[2]如[1]所述的化合物、其外消旋体或它们的盐,其特征在于,X为氧原子。
[3]如[2]所述的化合物、其外消旋体或它们的盐,其特征在于,Y为氧原子、氮原子或硫原子。
[4]如[1]所述的化合物、其外消旋体或它们的盐,其特征在于,X为氮原子、硫原子或碳原子。
[5]如[4]所述的化合物、其外消旋体或它们的盐,其特征在于,Y为氧原子、氮原子、硫原子或碳原子。
[6]如[1]~[5]中任一项所述的化合物、其外消旋体或它们的盐,其特征在于,R
[7]医药组合物,其特征在于,包含[1]~[6]中任一项所述的化合物、其外消旋体或它们的盐作为有效成分。
[8]如[7]所述的医药组合物,其特征在于,用于预防或改善选择脑神经疾病、糖尿病、代谢综合征、缺血性心脏病、失眠症、感染症、及免疫异常的由生物体内缩醛磷脂水平的降低引起的疾病。
[9]如[8]所述的医药组合物,其特征在于,用于预防或改善选自认知症、帕金森病、抑郁症、及精神分裂症的脑神经疾病。
[10]如[9]所述的医药组合物,其特征在于,用于预防或改善认知症。
[11]如[10]所述的医药组合物,其特征在于,认知症为阿尔茨海默型认知症。
发明的效果
本发明的新型化合物显示出与缩醛磷脂同等或其以上的效果。
附图说明
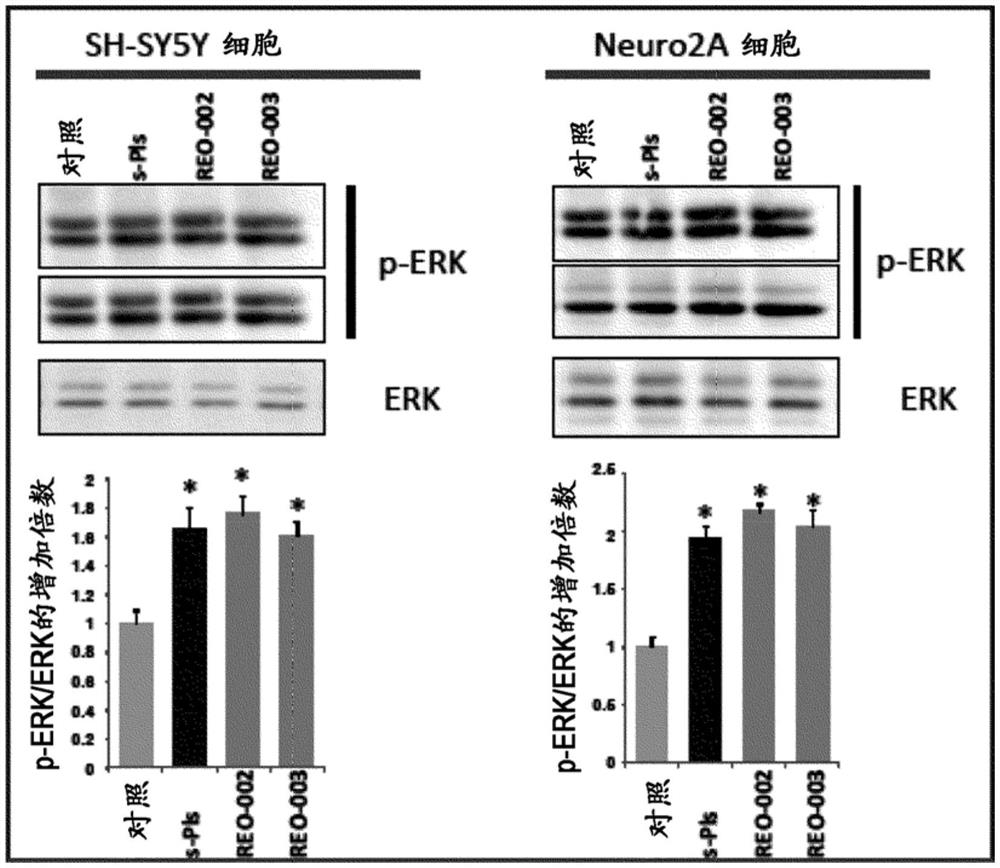
[图1]为示出用本发明的化合物(REO-002,REO-003)进行了处理的神经细胞株(来自小鼠神经母细胞瘤的NEURO2A细胞及来自人神经母细胞瘤的SH-SY5Y细胞)的ERK(ERK1/2)的磷酸化增加活性的图。
[图2]为示出用本发明的化合物(REO-004~007)进行了处理的神经细胞株(来自人神经母细胞瘤的SH-SY5Y细胞)的ERK(ERK1/2)的磷酸化增加活性的图。
[图3]为示出用本发明的化合物(KIT-007)进行了处理的神经细胞株(来自小鼠神经母细胞瘤的Neuro2A细胞)的ERK(ERK1/2)的磷酸化增加活性的图。
[图4]为示出施予了本发明的化合物KIT-007的幼龄小鼠的水迷宫(水迷路)试验的结果的图。
[图5]为示出由本发明的化合物KIT-007施予所引起的体重变化的图。
[图6]为示出施予了本发明的化合物KIT-007及LPS的小鼠的前额叶皮质(PFC,Prefrontal cortex)中的炎性细胞因子IL-1β的测定结果(实时PCR)的图。
[图7]为示出施予了本发明的化合物KIT-007及LPS的小鼠的海马组织中的炎性细胞因子IL-1β的测定结果(实时PCR)的图。
[图8]为示出施予了本发明的化合物KIT-007及LPS的小鼠的前额叶皮质(PFC,Prefrontalcortex)中的炎性细胞因子TNF-α的测定结果(实时PCR)的图。
[图9]为示出施予了本发明的化合物REO-002及LPS的小鼠的海马组织中的Iba-1阳性小胶质细胞数的测定结果的图。
[图10]为示出施予了本发明的化合物REO-002及LPS的小鼠的海马组织中的GFAP阳性星形胶质细胞数的测定结果的图。
[图11]为示出施予了本发明的化合物REO-002及LPS的小鼠的大脑皮质组织中的Iba-1阳性小胶质细胞数的测定结果的图。
[图12]为示出测定施予了本发明的化合物REO-002及LPS的小鼠的每一天的饮水量(第1天及第4天)而得的结果的图。
[图13]为示出测定施予了本发明的化合物REO-002及LPS的小鼠的体重(第3天)而得的结果的图。
具体实施方式
[本发明的新型化合物]
本发明的新型化合物为下述通式(I)所示的化合物、其外消旋体或它们的盐。需要说明的是,通式(I)中的甘油骨架的碳原子可以具有取代基。作为取代基,可以举出碳原子数为1~4的烷基、碳原子数为1~4的烷氧基等。
[化学式2]
通式(I)中,X表示氧原子、氮原子、硫原子或碳原子,优选氧原子或硫原子,特别优选氧原子。
R
R
R
作为R
作为R
对于R
R
R
R
[本发明的新型化合物的制造方法]
对于本发明的新型化合物(X为氧原子的情况)而言,可以将R
(合成方法1)
使作为起始原料的R
[化学式3]
由此,得到下述化合物。(参见实施例1的工序1)。
[化学式4]
接着,用保护基团(Z)保护上述OH基(参见实施例1的工序2)。
[化学式5]
之后,将OTs基置换为OH基,由此得到下述化合物(参见实施例1的工序3)。
[化学式6]
接着,相对于OH基导入包含磷酸基及R
[化学式7]
接着,对保护基团(Z)进行脱保护而形成OH基(参见实施例1的工序5)。
[化学式8]
之后,使经脱保护的OH基与R
[化学式9]
最后,对磷酸基及R
[化学式10]
(合成方法2)
使作为起始原料的R
接着,使R
[化学式11]
由此,得到下述化合物。(参见实施例3的工序3)。
[化学式12]
接着,对上述化合物的丙酮化物进行脱保护,得到下述化合物(参见实施例3的工序4)。
[化学式13]
接着,相对于2个OH基导入保护基团(Z、Z’)(参见实施例3的工序5、6)。
[化学式14]
之后,选择性地对保护基团(Z)进行脱保护而形成OH基(参见实施例3的工序7)。
[化学式15]
接着,导入包含磷酸基及R
[化学式16]
接着,对保护基团(Z’)进行脱保护而形成OH基(参见实施例3的工序9)。
[化学式17]
之后,使经脱保护的OH基与R
[化学式18]
最后,对磷酸基及R
[化学式19]
[本发明的医药组合物]
本发明的医药组合物的特征在于,包含上述通式(I)所示的本发明的新型化合物、其外消旋体或它们的盐作为有效成分。本发明的医药组合物可以包含药学上可接受的其他成分。
作为本发明的医药组合物的有效成分的上述本发明的新型化合物具有与天然的缩醛磷脂类似的结构,显示出与缩醛磷脂同等或其以上的效果,因此本发明的医药组合物也发挥与缩醛磷脂同等或其以上的效果。
对于本发明的医药组合物而言,可以用于预防或改善(治疗)例如认知症、帕金森病、抑郁症、精神分裂症等脑神经疾病、以及糖尿病、代谢综合征、缺血性心脏病、失眠症、各种感染症、免疫异常等由生物体内缩醛磷脂水平的降低引起的疾病。特别是优选可以用于预防或改善(治疗)认知症、帕金森病、抑郁症、精神分裂症等脑神经疾病,对阿尔茨海默型认知症特别有效。
实施例1
进行下述结构式所示的本发明的化合物REO-004、化合物REO-002、化合物REO-006、及化合物REO-005的制造(工序1~7)。以下示出制造工序的概要。
[化学式20]
以下,具体地对各工序进行说明。
[工序1]
下述结构式所示的化合物2的制造
[化学式21]
将化合物1(5.65g,21.1mmol)、(2R)-甲苯磺酸缩水甘油酯(5.57g,21.1mmol)溶解于CH
Mass EI(+):492
[工序2]
下述结构式所示的化合物3的制造
[化学式22]
将化合物2(7.85g,16mmol)、苄基三氯乙酰亚胺酯(3.5ml,19mmol)溶解于二噁烷(20ml),在搅拌下加入三氟甲磺酸(0.08ml,1mmol),在Ar气氛下于室温搅拌一晚。将反应液注入satd.NaHCO
Mass EI(+):582
[工序3]
下述结构式所示的化合物4的制造
[化学式23]
将化合物3(4.4g,7.5mmol)溶解于DMSO(16ml)、DMF(4ml),加入CsOAc(2.75g,14.3mmol),在Ar气氛下于80℃搅拌一晚。冷却后,将反应液注入冷水,用AcOEt对水层进行提取(x2),对提取液进行水洗(x3)后,用MgSO
Mass EI(+):428
[工序4]
下述结构式所示的化合物5的制造
[化学式24]
在PCl
Mass EI(+):665
[工序5]
下述结构式所示的化合物6的制造
[化学式25]
向化合物5(2.37g,4.4mmol)的EtOH(30ml)溶液中加入10%Pd/C(wet,0.4g),在H
Mass FAB(+):576
(2H,d,J=8.7Hz),5.10(1H,br.s,NH),4.2-3.95(5H,m),3.95-3.90(2H,m),3.80(3H,d,J=11.6Hz),3.5-3.4(6H,m),2.97(1H,dlike,OH),2.61(2H,t,J=7.7Hz),1.9-1.7(4H,m),1.45(9H,s),1.4-1.2(10H,m),0.87(3H,t,J=7.5Hz)
[工序6]
下述结构式所示的化合物7a~7d的制造
[化学式26]
(化合物7a的制造)
向化合物6(140mg,0.24mmol)的CH
(化合物7b的制造)
代替EPA而使用DHA,除此以外,与化合物7a的制造同样地操作,得到化合物7b(267mg,y.56%)。
Mass FAB(+):887
(化合物7c的制造)
代替EPA而使用花生四烯酸,除此以外,与化合物7a的制造同样地操作,得到化合物7c(168mg,y.84%)。
Mass FAB(+):862.6
(化合物7d的制造)
代替EPA而使用亚油酸,除此以外,与化合物7a的制造同样地操作,得到化合物7d(52mg,y.26%)。
Mass FAB(+):838.6
[工序7]
下述结构式所示的本发明的化合物REO-004、化合物REO-002、化合物REO-006、及化合物REO-005的制造
[化学式27]
(本发明的化合物REO-004的制造)
向化合物7a(170mg,0.20mmol)的CH
Mass FAB(+):746.5
(本发明的化合物REO-002的制造)
代替化合物7a(170mg,0.20mmol)而使用化合物7b(265mg,0.30mmol),除此以外,与化合物REO-004的制造同样地操作,得到化合物REO-002(88mg,y.40%)。
Mass FAB(+):773
(本发明的化合物REO-006的制造)
代替化合物7a(170mg,0.20mmol)而使用化合物7c(165mg,0.19mmol),除此以外,与化合物REO-004的制造同样地操作,得到化合物REO-006(99mg,y.69%)。
Mass FAB(+):748.6
(本发明的化合物REO-005的制造)
代替化合物7a(170mg,0.20mmol)而使用化合物7d(49mg,0.058mmol),除此以外,与化合物REO-004的制造同样地操作,得到化合物REO-005(31mg,y.73%)。
Mass FAB(+):724.6
实施例2
进行下述结构式所示的本发明的化合物REO-007、及化合物REO-003的制造(工序1~7)。以下示出制造工序的概要。
[化学式28]
以下,具体地对各工序进行说明。
[工序1]
下述结构式所示的化合物10a及化合物10b的制造
[化学式29]
作为起始原料,使用化合物9a及化合物9b,除此以外,与实施例1的工序1同样地操作,得到化合物10a(y.54%)及化合物10b(y.62%)。
(化合物10a)
Mass EI(+):380
(化合物10b)
Mass EI(+):408
[工序2]
下述结构式所示的化合物11a及化合物11b的制造
[化学式30]
与实施例1的工序2同样地操作,得到化合物11a(y.55%)及化合物11b(y.57%)。
(化合物11a)
Mass EI(+):470
(化合物11b)
Mass EI(+):498
[工序3]
下述结构式所示的化合物12a及化合物12b的制造
[化学式31]
与实施例1的工序3同样地操作,得到化合物12a(y.85%)及化合物12b(y.88%)。
(化合物12a)
Mass EI(+):316
(化合物12b)
Mass EI(+):344
[工序4]
下述结构式所示的化合物13a及化合物13b的制造
[化学式32]
与实施例1的工序4同样地操作,得到化合物13a(y.54%)及化合物13b(y.76%)。
(化合物13a)
Mass EI(+):553
(化合物13b)
Mass FAB(+):582
[工序5]
下述结构式所示的化合物14a及化合物14b的制造
[化学式33]
与实施例1的工序5同样地操作,得到化合物14a(y.29%)及化合物14b(y.58%)。
(化合物14a)
Mass EI(+):463
(化合物14b)
Mass EI(+):491
[工序6]
下述结构式所示的化合物15a及化合物15b的制造
[化学式34]
与实施例1的工序6同样地操作,得到化合物15a(y.76%)及化合物15b(y.65%)。
(化合物15a)
Mass FAB(+):774.5
(化合物15b)
[工序7]
下述结构式所示的本发明的化合物REO-007、及化合物REO-003的制造
[化学式35]
与实施例1的工序7同样地操作,得到化合物REO-007(y.80%)及化合物REO-003(y.42%)。
(化合物REO-007)
Mass FAB(+):660.4
(化合物REO-003)
Mass FAB(+):688
实施例3
进行下述结构式所示的本发明的化合物KIT-007的制造(工序1~11)。以下示出制造工序的概要。
[化学式36]
以下,具体地对各工序进行说明。
[工序1]
下述结构式所示的化合物17的制造
[化学式37]
将化合物16(4g,14mmol)溶解于PhMe(25ml),冷却至0℃后,加入Red-Al的PhMe溶液(70%,12ml)。于室温进行16小时搅拌后,将反应液冷却至0℃,加入1N HCl使反应停止。之后,利用柱色谱(Hex/AcOEt:2/1)对将析出的固体滤除并将滤液浓缩而得到的残留成分进行纯化,由此,以白色固体的形式得到化合物17(3g,y.80%)。
IR(ATR)3345,3264,2919,2848,1459,1378,1278,1225,1189,1130,1050,1021,978,748,724cm
MS(ESI)m/z279(M+Na
HRMS(ESI)对C
[工序2]
下述结构式所示的化合物18的制造
[化学式38]
将TsCl(3g,16mmol)、NEt
IR(ATR)2918,2851,1597,1468,1355,1307,1173,1097,1049,944,816,721,665cm
MS(ESI)m/z451(M+Na
HRMS(ESI)对C
[工序3]
下述结构式所示的化合物19的制造
[化学式39]
将
IR(ATR)2923,2853,1457,1378,1255,1212,1117,1054,845,723cm
MS(ESI)m/z411(M+Na
HRMS(ESI)对C
[工序4]
下述结构式所示的化合物20的制造
[化学式40]
向化合物19(2.35g,6.0mmol)中加入乙醇(12ml)、水(1.2ml)。冷却至0℃后,加入TsOH H
IR(ATR)3388,3308,3226,2919,2849,1459,1437,1123,1085,1033,871,727cm
MS(ESI)m/z371(M+Na
HRMS(ESI)对C
[工序5]
下述结构式所示的化合物21的制造
[化学式41]
在化合物20(500mg,1.4mmol)中加入吡啶(0.35ml,4.2mmol)。冷却至0℃后,加入PivCl(0.2ml,1.68mmol)。搅拌27小时后将反应液冷却至0℃,加入缓冲溶液(pH=7)。之后,用CH
IR(ATR)3451,2924,2853,1730,1458,1396,1365,1283,1159,1120,1035cm
MS(ESI)m/z455(M+Na
HRMS(ESI)对C
[工序6]
下述结构式所示的化合物22的制造
[化学式42]
将TBSCl(1.4g,9.6mmol)、咪唑(1g,14mmol)、THF(15ml)的溶液冷却至0℃后,将化合物21(2.1g,4.8mmol)溶解于THF(5ml)并进行添加。升温至室温并搅拌15小时后,将反应液冷却至0℃,加入缓冲溶液(pH=7)。之后,用Et
IR(ATR)2926,2854,1732,1460,1282,1251,1119,1004,831,776cm
MS(ESI)m/z569(M+Na
HRMS(ESI)对C
[工序7]
下述结构式所示的化合物23的制造
[化学式43]
将化合物22(2.2g,4.0mmol)溶解于CH
IR(ATR)2925,2853,1462,1251,1115,1048,1004,834,776,722,669cm
MS(ESI)m/z485(M+Na
HRMS(ESI)对C
[工序8]
下述结构式所示的化合物24的制造(方法1)
[化学式44]
将NEt
下述结构式所示的化合物24的制造(方法2)
[化学式45]
将化合物23(165mg,0.36mmol)、二异丙胺(0.08ml,0.54mmol)、PhMe(1ml)混合,冷却至-78℃后,加入正丁基锂的Hex溶液(1.55M,0.5ml)。搅拌1小时后,加入化合物25(162mg,0.43mmol)的PhMe(1ml)溶液,升温至0℃。搅拌8小时后,加入缓冲溶液(pH=7)使反应停止。用AcOEt对反应液进行提取,用水、饱和食盐水进行清洗,然后进行干燥(Na
IR(ATR)2926,2854,1732,1460,1282,1251,1119,1004,831,776cm
MS(ESI)m/z569(M+Na
HRMS(ESI)对C
[工序9]
下述结构式所示的化合物26的制造
[化学式46]
将化合物24(350mg,0.47mmol)溶解于THF(5ml),冷却至0℃后,加入TBAF的THF溶液(1M,0.5ml)。搅拌1小时后,加入缓冲溶液(pH=7)。之后,用AcOEt进行提取,用水、饱和食盐水进行清洗,并进行干燥(Na
IR(ATR)3348,2924,2854,1713,1522,1458,1366,1250,1171,1117,998cm
MS(ESI)m/z650(M+Na
HRMS(ESI)对C
[工序10]
下述结构式所示的化合物27的制造
[化学式47]
将化合物26(240mg,0.38mmol)、DHA(125mg,0.38mmol)、DMAP(46mg,0.38mmol)、CH
IR(ATR)3011,2925,2853,1738,1714,1517,1457,1366,1267,1170,1000cm
MS(ESI)m/z960(M+Na
HRMS(ESI)对C
[工序11]
下述结构式所示的本发明的化合物KIT-007的制造
[化学式48]
将化合物27(70mg,0.075mmol)溶解于CH
172.44,131.95,129.25,128.51,128.25,128.23,128.21,128.04,128.01,127.80,126.96,71.73,71.04(d,J
IR(ATR)3012,2924,2853,1735,1683,1526,1457,1374,1204,1132,1076,1026cm
MS(ESI)m/z804(M-HCl+Na
HRMS(ESI)对C
以上,使用实施例示出本发明的新型化合物的合成例,但本发明不限定于此。例如,关于在sn-1位的碳链中具有杂原子、且具有乙烯基醚键的本发明的化合物,认为也可以通过应用“P.Wang等人,Improved Plasmalogen Synthesis Using OrganobariumIntermediates,J.Org.Chem,72:5005-5007,2007(非专利文献10)”的5006页、SCHEME1.中的由化合物4向化合物5的转化工序来合成。
实施例4
使用神经细胞株,对本发明的化合物的ERK(ERK1/2)的磷酸化增加活性进行研究。
[试验1]
将神经细胞株(来自小鼠神经母细胞瘤的NEURO2A细胞及来自人神经母细胞瘤的SH-SY5Y细胞)在包含10%FBS(胎牛血清)的DMEM培养基中培养24小时。之后,在包含2%FBS的DMEM培养基中培养一晚(18小时),用5μg/ml的s-Pls(来自扇贝的Pls)、本发明的化合物REO-002、本发明的化合物REO-003分别进行30分钟处理,将细胞供于蛋白质印迹分析。此时,将同量的蛋白质(50μg的蛋白提取物)供于分析,并比较ERK(ERK1/2)的磷酸化(p-ERK)。
将其结果示于图1。如图1所示,在两神经细胞株中,REO-002、REO-003显示出与s-Pls同等的ERK(ERK1/2)的磷酸化增加活性。
[试验2]
将神经细胞株(来自人神经母细胞瘤的SH-SY5Y细胞)在包含10%FBS(胎牛血清)的DMEM培养基中培养24小时。之后,在包含2%FBS的DMEM培养基中培养一晚(18小时),用1μg/ml、5μg/ml的本发明的化合物REO-004~REO-007分别进行30分钟处理,将细胞供于蛋白质印迹分析。此时,将同量的蛋白质(50μg的蛋白提取物)供于分析,并比较ERK(ERK1/2)的磷酸化(p-ERK)。
将其结果示于图2。实施2次后,结果如图2的下段那样,在SH-SY5Y细胞中,本发明的化合物REO-004、REO-006自1μg/ml开始显示出ERK(ERK1/2)的磷酸化增加活性(箭头表示最小有效量)。相对于此,本发明的化合物REO-007的活性低,因此教导了sn-1的长度也是重要的。
[试验3]
将神经细胞株(来自小鼠神经母细胞瘤的Neuro2A细胞)在包含10%FBS(胎牛血清)的DMEM培养基中培养24小时。之后,在包含2%FBS的DMEM培养基中培养一晚(18小时),用s-Pls(来自扇贝的Pls)及本发明的化合物KIT-007的0.01μg/ml~5μg/ml分别进行20分钟处理,将细胞供于蛋白质印迹分析。此时,将同量的蛋白质(50μg的蛋白提取物)供于分析,并比较ERK(ERK1/2)的磷酸化(p-ERK)及总ERK。
将其结果示于图3。实施2次后,结果为在Neuro2A细胞中,均显示出ERK(ERK1/2)的磷酸化增加活性。
实施例5
对本发明的化合物KIT-007给幼龄小鼠的学习功能及记忆功能带来的影响进行研究。
实验中使用雄性C57BL/6J小鼠(3月龄)。将小鼠分为2组(n=3(合计6只)),将本发明的化合物KIT-007溶解于自来水并对给药组施予(1mg/kg),将自来水施予至对照组(2个月)。经过2个月后,1天进行3次水迷宫(水迷路)试验。
将其结果示于图4。如图4所示,通过使用本发明的化合物KIT-007,幼龄小鼠的学习功能及记忆功能提高。
实施例6
研究本发明的化合物KIT-007对小鼠中的LPS诱导神经炎症的改善效果。
实验中使用15只C58BL/6J雄性小鼠(7周龄)。小鼠的重量为24.0~26.7g。将小鼠随机分为5组,在每天11:00~12:00向腹腔内注射试剂,注射7天。
作为试剂,使用下述合计5种:(1)作为对照的生理盐水;(2)溶解于生理盐水的LPS(LPS:250μg/kg)、(3)~(5)在该LPS溶液中以规定浓度(低浓度(1mg/kg)、中浓度(10mg/kg)、高浓度(20mg/kg))添加化合物KIT-007而得的溶液。记录8天小鼠的体重(图5)。第8天处死小鼠。
利用实时PCR,测定前额叶皮质(PFC,Prefrontal cortex)及海马组织中的炎性细胞因子IL-1β、TNF-α(n=2)。
将其结果示于图6~8。如图6~8所示,本发明的化合物KIT-007对LPS诱导神经炎症具有改善效果。
实施例7
研究本发明的化合物REO-002对小鼠脑中的LPS诱导性神经炎症的改善效果。通过冷冻小鼠脑切片的基于免疫组织化学染色(Iba-1,GFAP)的组织学实验来进行研究。
实验中使用20只C58BL/6J雄性小鼠(6月龄)。将小鼠随机分为4组,每天在上午9:00~10:00期间向腹腔内注射试剂,注射7天。
作为试剂,使用下述合计4种:(1)作为对照的生理盐水;(2)溶解于生理盐水的LPS(LPS:250μg/kg);(3)在该LPS溶液中以低浓度(1mg/kg)添加化合物REO-002而得的溶液;(4)在该LPS溶液中以高浓度(5mg/kg)添加化合物REO-002而得的溶液。在实验开始第8天从各组中随机选出3只小鼠并处死,进行心腔灌流并摘取脑,进行免疫组织化学染色。需要说明的是,在第1天及第4天,测定各组小鼠的每一天的饮水量。另外,在第3天测定各组小鼠的体重。
免疫组织化学染色如下进行。
a.用4%多聚甲醛将整个脑固定,蔗糖脱水处理后进行OCT复合物固定。
b.将大脑皮质及海马部位制成20μm厚的切片,在加入了叠氮化钠的PBS中保存。
c.经过基于盐酸的抗原激活、基于Tris盐酸缓冲液的中和,进行Iba-1(小胶质细胞)、GFAP(星形胶质细胞)的染色、核染色。
d.用荧光显微镜确认细胞数及细胞形状。
图9及10中示出由本发明的化合物REO-002带来的对海马组织中的LPS诱导胶质细胞活化的改善效果。如图9及图10所示,在LPS给药组,海马组织中,Iba-1阳性小胶质细胞数、GFAP阳性星形胶质细胞数增加。但是,在组合使用本发明的化合物REO-2的组中,这些增加均被抑制(n=3,p<0.05及p<0.01)。
另外,图11中示出由本发明的化合物REO-002带来的对大脑皮质组织中的LPS诱导小胶质细胞活化的改善效果。如图11所示,在LPS给药组,大脑皮质组织中,Iba-1阳性小胶质细胞数也增加。但是,早组合使用本发明的化合物REO-2的组中,该增加被抑制到与对照组同等程度(n=3,p<0.01)。
图12示出在实验第1天及第4天测定各组小鼠的每一天的饮水量所得的结果。在LPS给药组,饮水量在施予开始1天后减少最多,另外在4天后也减少。另一方面,在组合使用本发明的化合物REO-2的组,就饮水量的减少而言,用量依赖性地恢复(n=5,p<0.01)。
图13中示出在实验第3天测定各组小鼠的体重所得的结果。在LPS给药组,体重在施予开始3天后减少最多。另一方面,在组合使用本发明的化合物REO-2的组,可观察到用量依存性地使体重减少恢复的倾向(n=5)。
产业上的可利用性
本发明的新型化合物显示出与缩醛磷脂同等或其以上的效果,能够用于预防或改善认知症,因此在产业上有用。
- 新型缩醛磷脂衍生物
- 新型过氧二烯缩醛糖苷类衍生物及其制法和其药物组合物与用途
