一种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂及其制备方法
文献发布时间:2023-06-19 09:49:27
技术领域
本发明涉及微生物技术领域,特别涉及一种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂。
背景技术
宁夏是枸杞原产地,栽培枸杞已有500多年的历史。枸杞色艳、粒大、皮薄、肉厚、籽少、甘甜,品质超群,是被载入新中国药典的枸杞品种,国家医药管理局将宁夏定为全国的药用枸杞产地,引入全国十大药材生产基地之一。明代杰出医药学家李时珍所著《本草纲目》中,将宁夏枸杞列为本经上品,称“全国入药杞子,皆宁产也”,意思是宁夏枸杞从药效和营养价值上讲居国内前列。
但是,当前的现有技术中,枸杞种植中普遍使用农药,大量使用一方面使害虫的抗药性不断加大,另一方面也使害虫天敌受到极大的摧残,进而增加了枸杞种植对农药的依赖性,导致枸杞中农残含量较高易引发食品安全问题。随着农药使用量及使用种类的增加,枸杞种植土壤中的、枸杞果实以及枸杞叶片中的农药残留量也在不断升高。
因此,为不断提升宁夏枸杞品牌竞争力,解决农药使用过程中的食品安全问题,亟待找到一种安全、高效、彻底、低成本的去除枸杞中农药残留的技术。
发明内容
根据现有技术中存在的技术缺陷,本发明所要解决的技术问题是:提供一种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂,解决因农药使用量的不断增加,致使枸杞种植土壤中的、枸杞果实以及枸杞叶片中的农药残留量也在不断增加的问题,减少枸杞种植过程中农药污染机残留的情况,提升枸杞品质的同时保护生态环境安全。
为了解决上述技术问题,本发明的技术方案为:
一种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂及其制备方法,所述微生物菌剂的组成及其质量百分比为:微生物菌27-35%,腐殖酸30%,牛肉膏30-40%,助剂1-2%。
作为本发明的进一步改进,所述微生物菌包括蜡样芽孢杆菌、巨大芽孢杆菌以及短小芽孢杆菌;所述蜡样芽孢杆菌,简称GQ-001;所述巨大芽孢杆菌,简称GQ-002;所述短小芽孢杆菌,简称GQ003;这三株菌均是从宁夏枸杞种植地土壤中筛选出的优势菌株。
作为本发明的进一步改进,所述微生物菌的每一种有效菌的活菌数≥3亿/g,有机质含量≥35%。
作为本发明的进一步改进,所述助剂包括腐殖酸钠、黄腐酸钾、磷酸二氢钾和硫酸铵等。
作为本发明的进一步改进,所述微生物菌剂的制备方法包括如下步骤:
(1)菌种活化:将从土壤中筛选出并经过农药耐受实验驯化的低温保存的所述蜡样芽孢杆菌、所述短小芽孢杆菌与所述短小芽孢杆菌菌株分别接种于营养琼脂培养基上,36℃恒温条件下培养24-36h;
(2)一级种子液的制备:配制LB液体培养基,分装于500mL三角瓶中,每瓶装液量为200mL,将分装好的培养基高压灭菌后接入活化好的所述蜡样芽孢杆菌、所述巨大芽孢杆菌与所述短小芽孢杆菌,36℃,240rpm/min摇床培养 20-24h;
(3)二级种子液的制备:配制种子罐培养基,将步骤(2)得到的所述一级种子液,按3-5%的接种量分别接入500L种子罐,温度36℃,转速240rpm/min,通气量0.8V/V·min条件下培养24h;
(4)大规模工业发酵培养:将步骤(3)得到的所述二级种子液,按大规模工业发酵罐所用培养基体积比的5-10%接种量分别接入所述大规模工业发酵罐,所述温度36℃,所述转速240rpm/min,所述通气量0.8V/V·min条件下培养26h,完成发酵,得到蜡样芽孢杆菌发酵液、巨大芽孢杆菌发酵液以及短小芽孢杆菌发酵液;
(5)微生物菌的制备:将步骤(4)得到的所述蜡样芽孢杆菌发酵液、所述巨大芽孢杆菌发酵液以及所述短小芽孢杆菌发酵液,按发酵罐干物质重量比为 1:1添加硅藻土进行吸附,然后进行压滤、浓缩、干燥;
(6)所述微生物菌含菌量的检测:采用稀释平板法检测干燥后滤饼的含菌量;
(7)所述微生物菌剂的制备:按质量百分比,将步骤(5)得到的所述蜡样芽孢杆菌菌剂、所述巨大芽孢杆菌菌剂以及所述短小芽孢杆菌菌剂按比例加入所述硅藻土稀释至芽孢浓度≥60亿个/g,然后与所述腐殖酸30%,所述牛肉膏 30-40%,以及所述助剂1-2%混合均匀,混合后的物料加入气流粉碎机,细度控制300-350目,粉碎后得到所述微生物菌剂。
作为本发明的进一步改进,步骤(5)中所述压滤采用板框压滤机;所述干燥采用沸腾干燥床,所述干燥温度为70-80℃。
此种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂应用,以施加菌剂后土壤中农药残留量的改变为例,其中,所述微生物菌剂处理后的土壤样品中啶虫脒、吡虫啉、氧化乐果残留量检测方法如下:
(1)仪器与参数设置:岛津LC-20A,色谱柱C18;流动相A:0.2%甲酸 5mmol/L的乙酸铵水溶液,流动相B:乙腈;柱温:35℃;波长:液相色谱参数;流速:0.4mL/min;进样量:2μL。流动相洗脱程序见流动相洗脱程序见表1。
表1流动相洗脱程序
检测方式:多反映离子检测模式MRM;离子源条件:AJS ESI源;扫描方式:正模式;雾化气压:35psi,喷嘴电压:500V;干燥气温度与流速:300℃, 7L/min;峭气温度与流速:350℃,11L/min,毛细血管电压:3500V。3种农药定量和定性离子、碰撞能量和碎裂。电压等离子参数见表2。
表2参数设置
(2)绘制啶虫脒、吡虫啉、氧化乐果标准物质的标准曲线;
(3)取20g风干土样于250mL三角瓶中,少量蒸馏水湿润后加35mL甲醇:乙腈=1:3,振荡1h,滤纸过滤,残渣用40mL甲醇分2次洗,合并溶液,于旋蒸仪上减压去掉甲醇+乙腈(40℃);
(4)用0.1mol/L HCL溶液15mL溶解残余物,NaOH调节PH至8-10,分液漏斗上用50mL二氯甲烷分3次萃取,收集下层有机相并加入0.5g无水硫酸镁去除水分,无水硫酸镁沉淀过滤,再次于40℃蒸干二氯甲烷;
(5)溶液快要完全蒸干时加入2mL甲醇继续旋蒸,最后用2mL甲醇定容,滤膜过滤,上样检测,取得结果。
与现有技术相比,本发明的有益效果是:
发明提供的微生物菌剂具有生产周期短、活性高、成本低的优点,有利于工业化生产,应用的三株菌种具有适应性强、稳定性好、增殖速度快,且协同效果显著,应用于枸杞种植过程中,可有效降解土壤中的啶虫脒、吡虫啉、氧化乐果的农药残留,防止枸杞病虫害的发生,改善枸杞果实及叶片的品质,同时促进枸杞的生长。该微生物菌剂应用于土壤中啶虫脒、吡虫啉、氧化乐果的农药降解过程,可有效降低化学农药对枸杞种植土壤的污染;同时有效降低因该类农药的作用而导致的部分病原菌抗药性的增强,保护枸杞种植土壤微生态系统平衡,改善枸杞生存环境并提高其抗病能力,对枸杞的增产和品质提高有着重要意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为啶虫脒标准曲线图;
图2为吡虫啉的标准曲线图;
图3为氧化乐果的标准曲线图;
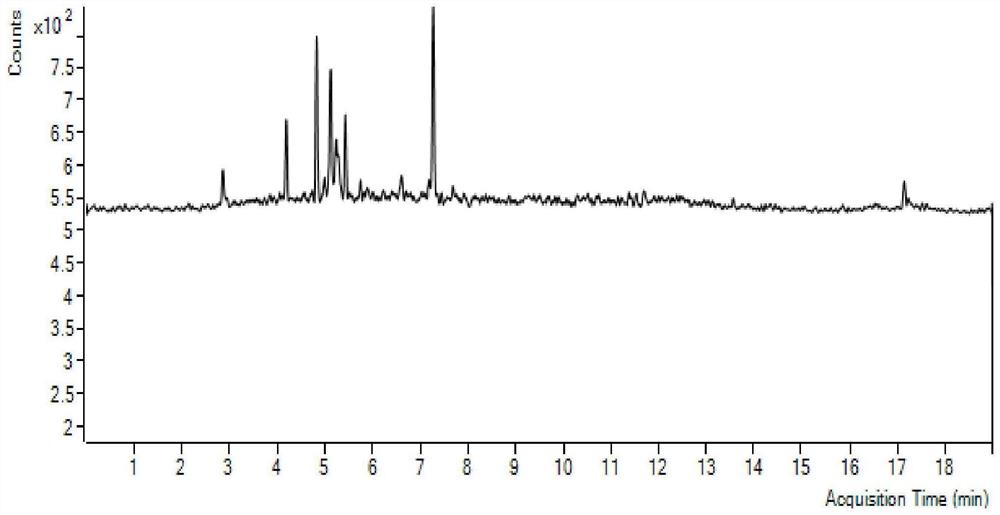
图4为啶虫脒、吡虫啉、氧化乐果标准样品谱图;
图5为未经菌剂处理的啶虫脒、吡虫啉、氧化乐果在枸杞种植地中的残留情况。
图6为经菌剂处理的啶虫脒、吡虫啉、氧化乐果在枸杞种植地中的残留降解情况。
具体实施方式
下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
为对本发明有益效果作进一步阐述,进行了以下具体实施例,特别说明的是,以下具体实施例旨在更好的理解本发明,绝不仅限于本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用实验材料,如无特殊说明,均为常规的生化制剂。以下实施例中的定量试验,均设置三次重复试验,结果取平均值。
本发明所提供的蜡样芽孢杆菌(Bacillus cereus),简称GQ-001;巨大芽孢杆菌(Bacillus megaterium de Bary),简称GQ-002;短小芽孢杆菌(Bacillus pumilus),简称GQ003。这三株菌均是从宁夏枸杞种植地土壤中筛选出的优势菌株。
实施例1:微生物菌剂的制备
1.一种降解枸杞种植过程中施加的啶虫脒、吡虫啉、氧化乐果这三种农药降解的微生物菌剂,其特征在于:所述微生物菌剂的组成成分及其质量百分比为:微生物菌27-35%,腐殖酸30%,牛肉膏30-40%,助剂1-2%。
2.微生物菌剂包括蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacillusmegaterium de Bary)、短小芽孢杆菌(Bacillus pumilus);这三株菌均是从宁夏枸杞种植地土壤中筛选出的优势菌株。
蜡样芽孢杆菌GQ-001、巨大芽孢杆菌GQ-002、短小芽孢杆菌GQ-003鉴定的具体相关内容如下:
蜡样芽孢杆菌GQ-001的鉴定
(1)微生物学特性:菌株在NA培养基,36℃培养18-22h后,菌落表面平滑不透明,乳白色或微黄色,扁平干燥有光泽,边缘不整齐,不产生色素。菌株杆状、具周生鞭毛,革兰氏染色呈阳性,好氧。
(2)将GQ-001的PCR扩增产物于1.5%琼脂糖凝胶电泳检测,并送至生工生物工程(上海)股份有限公司进行测序。PCR产物测序后,经过BLAST比对,与Bacillus cereus同源性为99.98%,选取相似性最高的菌种rDNA-ITS序列,采用最大似然法(Miximum-Likelihood)构建系统发育树,结合GQ-001菌株的形态特征,生理生化特征,确定GQ-001属于蜡样芽孢杆菌(Bacillus cereus)。
巨大芽孢杆菌GQ-002的鉴定
(1)微生物学特性:GQ-002菌体呈杆状,周生鞭毛,革兰氏染色阳性。菌株在NA培养基上36℃培养22h后,菌落圆形,半透明呈白色,表面光滑,中间凸起,不产生色素,有粘性。菌株表现好氧生长。
(2)生理生化实验:
表3巨大芽孢杆菌GQ-002的生理生化特征
注:“+”表示阳性反应,“-”表示阴性反应
(3)分子生物学鉴定:
将GQ-002的PCR扩增产物于1.5%琼脂糖凝胶电泳检测,并送至生工生物工程(上海)股份有限公司进行测序。PCR产物测序后,经过BLAST比对,与Bacillus megaterium同源性为99.33%,选取相似性最高的菌种rDNA-ITS序列,采用最大似然法(Miximum-Likelihood)构建系统发育树,结合GQ-002菌株的形态特征,生理生化特征,确定GQ-002属于巨大芽孢杆菌(Bacillus megaterium)。
短小芽孢杆菌GQ-003的测定
(1)微生物学特性:菌株在NA培养基,36℃培养18h后,菌落较小表面平滑,乳白色,扁平有光泽,边缘整齐。菌株杆状、具周生鞭毛,革兰氏染色呈阳性,好氧。具体生理生化结果见表4。
表4短小芽孢杆菌GQ-003的生理生化特征
(2)将GQ-003的PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序后,经过BLAST比对,与Bacillus pumilus同源性为99.29%,采用最大似然法(Miximum-Likelihood)构建系统发育树,结合GQ-003菌株的形态特征,生理生化特征,确定GQ-003属于短小芽孢杆菌(Bacillus pumilus)。
3、微生物菌的有效活菌数≥3亿/g,有机质含量≥35%;
4、助剂包括腐殖酸钠、黄腐酸钾、磷酸二氢钾和硫酸铵等;
微生物菌剂的制作方法如下:
(1)菌种活化:将从土壤中筛选出并经过农药耐受实验驯化的低温保存的所述蜡样芽孢杆菌、所述短小芽孢杆菌与所述短小芽孢杆菌菌株分别接种于营养琼脂培养基上,36℃恒温条件下培养24-36h;
(2)一级种子液的制备:配制LB液体培养基,分装于500mL三角瓶中,每瓶装液量为200mL,将分装好的培养基高压灭菌后接入活化好的所述蜡样芽孢杆菌、所述巨大芽孢杆菌与所述短小芽孢杆菌,36℃,240rpm/min摇床培养 20-24h;
(3)二级种子液的制备:配制种子罐培养基,将步骤(2)得到的所述一级种子液,按3-5%的接种量分别接入500L种子罐,温度36℃,转速240rpm/min,通气量0.8V/V·min条件下培养24h;
(4)大规模工业发酵培养:将步骤(3)得到的所述二级种子液,按大规模工业发酵罐所用培养基体积比的5-10%接种量分别接入大规模工业发酵罐,温度36℃,转速240rpm/min,通气量0.8V/V·min条件下培养26h,完成发酵,得到蜡样芽孢杆菌发酵液、巨大芽孢杆菌发酵液以及短小芽孢杆菌发酵液;
(5)微生物菌的制备:将步骤(4)得到的所述蜡样芽孢杆菌发酵液、巨大芽孢杆菌发酵液以及短小芽孢杆菌发酵液,按发酵罐干物质重量比为1:1添加硅藻土进行吸附,然后进行压滤、浓缩、干燥;
(6)所述微生物菌含菌量的检测:采用稀释平板法检测干燥后滤饼的含菌量;
(7)所述微生物菌剂的制备:按质量百分比,将步骤(5)得到的所述蜡样芽孢杆菌菌剂、所述巨大芽孢杆菌菌剂以及所述短小芽孢杆菌菌剂按比例加入硅藻土稀释至芽孢浓度浓度≥60亿个/g,然后与所述腐殖酸30%,所述牛肉膏 30-40%,以及所述助剂1-2%混合均匀,混合后的物料加入气流粉碎机,细度控制300-350目,粉碎后得到所述微生物菌剂。
步骤(5)中压滤采用板框压滤机;干燥采用沸腾干燥床,干燥温度为70-80℃。
实施例2:微生物菌剂对啶虫脒、吡虫啉、氧化乐果农药残留降解情况的研究。
土样来源:宁夏中宁枸杞种植基地土壤试样;
实验地点:宁夏回族自治区食品检测研究院大型仪器设备实验室、微生物检测实验室,分子生物学检测实验室。
所述微生物菌剂处理后的土壤样品中啶虫脒、吡虫啉、氧化乐果残留量检测方法如下:
(1)仪器与参数设置:岛津LC-20A,色谱柱C18;流动相A:0.2%甲酸 5mmol/L的乙酸铵水溶液,流动相B:乙腈;柱温:35℃;波长:液相色谱参数;流速:0.4mL/min;进样量:2μL;流动相洗脱程序见表5。
表5流动相洗脱程序
检测方式:离子源条件:AJS ESI源;扫描方式:正模式;检测方式:多反映离子检测模式MRM;雾化气压:35psi,喷嘴电压:500V;干燥气温度与流速:300℃,7L/min;峭气温度与流速:350℃,11L/min,毛细血管电压:3500V。 3种农药定量和定性离子、碰撞能量和碎裂电压等参数见表6。
表6 3种农药定量和定性离子、碰撞能量和碎裂电压等参数
(2)绘制啶虫脒、吡虫啉、氧化乐果标准物质的标准曲线;
(3)取20g风干土样于250mL三角瓶中,少量蒸馏水湿润后加35mL甲醇:乙腈=1:3,振荡1h,滤纸过滤,残渣用40mL甲醇分2次洗,合并溶液,于旋蒸仪上减压去掉甲醇+乙腈(40℃);
(4)用0.1mol/L HCL溶液15mL溶解残余物,NaOH调节PH至8-10,分液漏斗上用50mL二氯甲烷分3次萃取,收集下层有机相并加入0.5g无水硫酸镁去除水分,无水硫酸镁沉淀过滤,再次于40℃蒸干二氯甲烷;
(5)溶液快要完全蒸干时加入2mL甲醇继续旋蒸,最后用2mL甲醇定容,滤膜过滤,上样检测,取得结果。
2、微生物菌剂对啶虫脒、吡虫啉、氧化乐果农药残留降解情况的研究
(1)实验设计:向100g经检测不含有啶虫脒、吡虫啉、氧化乐果的土壤试样中加入200mg/mL啶虫脒、吡虫啉、氧化乐果标准物质1mL,设置对照和平行试验,模拟枸杞种植环境加入纯净水没过土壤表面约5cm,置于实验台上,避免阳光直射,定时加水,分别检测处理7天后和21天后土壤试样中的啶虫脒、吡虫啉、氧化乐果含量。
(2)样品前处理:取20g风干后的经处理的土壤试样置于250mL三角瓶中,用少量蒸馏水湿润后加35mL甲苯+乙腈(1+3),振荡1h,滤纸过滤,残渣用 40mL甲苯+乙腈(1+3)分2次清洗,合并溶液,于旋蒸仪上35℃减压去掉甲苯+乙腈混合液。
用0.1mol/L的HCL溶液15mL溶解残余物,用NaOH调节PH至8-10,在分液漏斗上用50mL二氯甲烷分3次萃取,收集下层有机相并加入0.5g无水硫酸镁去除水分,用滤纸将无水硫酸镁沉淀过滤,再次于40℃蒸干二氯甲烷。
当溶液快要完全蒸干时加入2mL乙腈继续旋蒸,最后用2mL乙腈定容,滤膜过滤上样检测。
实施例3、微生物菌剂大田试验的应用
1、试验药剂
本发明制备的降解枸杞种植过程中所施加的啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂。
2、试验作物与品种
试验作物:枸杞;
作物品种:宁杞7号。
3、试验地点
试验地点:中宁枸杞种植基地。
4、大田试验
(1)试验药剂设置
微生物菌剂(宁夏农垦生物肥料有限公司)、10%啶虫脒乳油剂(天津市汉邦植物保护有限公司),70%吡虫啉水分散立剂(北京华戊生物激素厂),40%氧乐果乳油剂(郑州沙隆达伟新农药有限公司)。微生物菌剂600kg/hm
表7、试验药剂浓度设置
(2)试验设计及安排
试验田排列:按农药残留试验准则要求设试验田,由浓度低到高的顺序随机排列,各实验片区间设保护带,每块面积20m
(3)试验方法
残留试验设计:将微生物菌剂颗粒剂作为底肥填埋施于枸杞种植地,靠于枸杞根系的土壤中,枸杞出芽前,按照表1剂量将10%啶虫脒乳油剂,70%吡虫啉水分散立剂,40%氧乐果乳油剂分别施药,施用后7d、15d和40d分别取样,每块地按照对角线原则,选择5个采样点采集5-20cm土壤样品2kg以及土壤对照样品,除去土壤中的碎石、杂草和植物根茎等杂物,混匀后采用四分法留样 500g,装入样本容器中,粘好标签,田间样品在采集后,8h内运回实验室,并立即制成实验室样品贮存于-20℃冰柜中保存。
土壤实验室样品的制备按SOP FT-04-01的规定进行。
(4)试验结果
本发明微生物菌剂在枸杞田对啶虫脒,吡虫啉,氧化乐果在土壤中的残留量的测定,结果如表8,表9。
表8、土壤中原始啶虫脒、吡虫啉、氧乐果的残留量
表9、微生物菌剂处理后啶虫脒、吡虫啉、氧乐果在枸杞田土壤中的残留量
从表8,表9可以看出,啶虫脒、吡虫啉、氧乐果在枸杞地土壤中施用后 7d、15d和40d的残留量在不同处理中均呈下降趋势,处理后7d,高浓度的啶虫脒、吡虫啉、氧乐果处理残留量高于低浓度处理,其中微生物菌剂+低浓度农药(啶虫脒、吡虫啉、氧乐果)处理的残留量最低,残留量顺序为:农药高浓度>农药高浓度+微生物菌剂>农药低浓度>农药低浓度+微生物菌剂;处理后15d,高浓度的农药处理残留量仍高于低浓度处理,其中低浓度农药单独处理的残留量最低,农药高浓度残留量>农药低浓度>农药高浓度+微生物菌剂>农药低浓度+ 微生物菌剂。处理后40d,所有处理的农药残留量均较低,而且微生物菌剂处理过的各农药残留量均低于未处理的。
微生物菌剂对枸杞土壤中啶虫脒、吡虫啉、氧乐果的残留量的影响,到处理后40d时,微生物菌剂及农药残留的均为最少,证明菌肥处理后的枸杞土壤中低浓度的各农药残留降解量低于未施用菌肥处理的。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 一种用于降解啶虫脒、吡虫啉、氧化乐果农药残留的微生物菌剂及其制备方法
- 一种用于降解土壤中农药残留的铕、硒共掺杂四氧化三铁石墨相氮化碳材料的制备方法
