成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途
文献发布时间:2023-06-19 10:19:37
技术领域
本发明属于生物技术领域,涉及一种成纤维细胞激活蛋白,具体来说是成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途。
背景技术
骨关节炎(Osteoarthritis,OA)是最常见的骨科疾病之一,45岁以上人群OA的患病率高达26%。OA最主要的病理改变是关节软骨退变,合并有骨赘生成、较低水平的炎症以及软骨下骨重塑。OA发病初始关节软骨的机械磨损会促使软骨及滑膜等组织分泌多种促炎因子及基质降解酶,进一步加重软骨基质的降解。早期OA可以通过微骨折、骨软骨镶嵌成形术及自体软骨移植等方式治疗,但疗效尚存争议。终末期OA患者唯有通过关节置换手术改善生活质量。而在非手术治疗方面,国内外指南共同认可的药物治疗目前只有用于缓解症状的非甾体抗炎药和关节腔内注射糖皮质激素,其他包括软骨素和透明质酸在内的药物疗效尚存争议,因此目前OA治疗亟需更多有效的治疗药物。
聚集蛋白聚糖和II型胶原(Type II collagen,Col II)是软骨基质的主要成分。软骨基质中的聚集蛋白聚糖降解主要由ADAMTS家族蛋白酶完成,发生于病变早期且可逆;而Col II的降解主要由基质金属蛋白酶(Matrix Metalloproteinases,MMP)完成,且该过程不可逆。因此MMP本应成为OA治疗的良好靶点,然而现有的非选择性MMP抑制剂在临床试验中产生了剂量依赖的副作用(关节僵硬、炎症及疼痛)。而目前研制的选择性MMP抑制剂具有低溶解度及低渗透性的缺点,阻碍了MMP作为治疗靶点的临床应用价值。除了MMP以外,学者证实了丝氨酸蛋白酶包括凝血酶、蛋白裂解酶(Matriptase)及弗林蛋白酶在OA发病过程中的作用,但目前尚无FDA批准的丝氨酸蛋白酶作为靶点用于治疗OA的药物。
成纤维细胞激活蛋白(Fibroblast activation protein,Fap)是一种膜结合丝氨酸蛋白酶,具有二肽基肽酶和肽链内切酶活性。目前已知的Fap底物包括I型胶原、α2抗纤维蛋白溶酶及成纤维细胞生长因子21等。Fap高表达于激活的成纤维细胞,并参与肿瘤微环境形成、炎症及损伤修复过程。在肌肉骨骼系统中,Fap高表达于骨髓间充质细胞和成骨细胞,具有抑制成骨的作用;遗传学和药理学抑制Fap既可以促进骨生成,又可以抑制骨吸收,是治疗骨质疏松的潜在靶点。在类风湿性关节炎患者的滑膜和滑液中Fap同样呈高表达,且表达水平与类风湿性关节炎严重程度呈正相关。类风湿性关节炎模型中,敲除Fap可以缓解小鼠关节软骨损伤。OA患者的滑膜组织中同样有Fap的表达,但相比类风湿性关节炎表达明显更低,但Fap是否在OA的发病过程中发挥重要作用尚不清楚。
骨凝集素(Osteolectin,Oln)是一种在体外能够促进造血集落形成的生长因子,又名干细胞生长因子或C型凝集素蛋白11a。我们的既往研究显示Oln高表达与骨-软骨谱系细胞,能够通过Wnt通路促进骨生成。我们近期的研究显示Oln能够抑制Fap的酶切活性,进而调控骨生成和成骨分化。作为Fap的体内抑制剂,Oln是否通过抑制Fap的酶活参与OA的疾病进展尚无相关研究。
综上所述,目前OA的药物治疗效果有限,亟需能够有效缓解软骨损伤的药物。一种能够有效缓解软骨损伤的药物既可以改善患者生活质量,又能够减少由置换手术对患者及社会产生的经济负担,具有重大临床意义。
发明内容
针对现有技术中的上述技术问题,本发明提供了成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途,所述的这种成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途要解决现有技术中的药物对于治疗骨关节炎或抑制软骨损伤或骨赘生成或滑膜炎症的效果不佳的技术问题。
本发明提供了成纤维细胞激活蛋白作为靶点在筛选用于治疗骨关节炎或抑制软骨损伤或骨赘生成或滑膜炎症的药物中的应用。
进一步的,所述药物是抑制成纤维细胞激活蛋白的表达水平的药物。
进一步的,所述药物是抑制成纤维细胞激活蛋白的活性的药物。
本发明还提供了成纤维细胞激活蛋白的基因作为药物靶点在筛选用于治疗骨关节炎或抑制软骨损伤或骨赘生成或滑膜炎症的药物中的应用。
本发明还提供了靶向成纤维细胞激活蛋白的抑制剂在制备用于治疗骨关节炎或抑制软骨损伤或骨赘生成或滑膜炎症的药物中的应用。
本发明还提供了成纤维细胞激活蛋白在制备作为骨关节炎患者进行诊断或者预后判断的生物标志物的用途。
本发明还提供了骨凝集素在制备用于治疗骨关节炎或抑制软骨损伤或骨赘生成或滑膜炎症的药物中的应用。
在本发明一些实施方式中,所述药物是用于抑制Fap酶活的药物,其包括但不限于Fap药理学抑制剂、Fap阻断型抗体、Fap的siRNA。
在本发明一些实施方式中,所述药物是用于抑制滑膜细胞和/或软骨细胞和/或关节液中Fap酶活的药物。
在本发明一些实施方式中,所述OA为原发性OA和/或继发性OA。
在本发明一些实施方式中,所述药物是以Fap为靶点的单一药效成分药物。
本发明另一方面提供一种药物组合物,其特征在于,所述药物组合物包括以Fap为靶点的药效成分。
本发明发明人经过大量探索研究,发现将Fap作为治疗OA的药物靶点,抑制Fap的酶切活性,可以缓解OA软骨损伤、骨赘生成及滑膜炎症,也可以抑制Fap对软骨基质Col II的降解,从而达到缓解OA的进展,从而具有良好的产业化前景,并在此基础上完成了本发明。
本发明第一方面提供一种Fap作为OA治疗靶点的应用,所述药物用于:1)治疗OA;和/或,2)抑制软骨损伤;和/或,3)抑制骨赘生成;和/或,4)抑制滑膜炎症。
所述的Fap抑制剂为任何能够降低Fap的酶活、降低Fap的稳定性、抑制Fap的表达、减少Fap的有效作用时间或抑制Fap的转录活加工的物质,包括但不限于Fap特异性抑制剂。在本发明公开的一部分具体实施方式中,所述Fap抑制剂例如为Ac-Gly-BoroPro。
本发明提供的Fap抑制剂溶解在磷酸缓冲盐溶液中(Phosphate BufferedSaline,PBS),使用方式为关节腔内注射,注射量为40μg/kg小鼠体重。
本发明第二方面提供一种药物组合物,所述药物组合物包括Fap抑制剂的组分,所述药物用于:1)治疗OA;和/或,2)抑制软骨损伤;和/或,3)抑制骨赘生成;和/或,4)抑制滑膜炎症。
所述药物组合物还可以包括药学上可接受的载体。所述载体可以包括各种赋形剂和稀释剂,这些载体本身并不是必要的活性成分,且施用后没有过分的毒性。另一方面,在施用所述药物组合物所需要考虑的剂量应当取决于施用频率和模式,受治疗的受试者的年龄、性别、重量和一般状况,治疗的状况和严重性,以及给药途径而异,待治疗的任何伴随性疾病以及对于本领域技术人员显而易见的其他因素。同时,根据受治疗者的情况和其他病理状况,包含本发明的药物组合物可以与一种或多种其他的治疗活性化合物或物质组合施用或应用。
本发明人发现,Fap高表达于OA滑膜,遗传学及药理学抑制Fap活性可以缓解OA模型小鼠的软骨损伤、骨赘形成、滑膜炎症及软骨组织聚集蛋白多糖的表达减低,Fap抑制剂可以用于治疗小鼠OA,进一步的,Fap可以降解软骨基质中的Col II,该效果可以被Fap抑制剂及另一种Fap体内抑制蛋白Oln所抑制。进一步的,Oln敲除小鼠构造OA模型后具有显著升高的软骨损伤、骨赘形成、滑膜炎症及显著降低的软骨组织聚集蛋白多糖的表达,重组Oln可以用于治疗小鼠OA。
本发明还进行了确定Fap在滑膜组织中表达情况的实验,在其中一个实施例中,通过免疫荧光、qRT-PCR和蛋白质印迹实验确定了Fap在OA滑膜中具有高表达,从而确定Fap可能作为OA治疗药物组合物的靶点。
本发明还进行了内侧半月板失稳(Destabilization of Medial Meniscus,DMM)小鼠OA严重程度的检测实验,在其中一个实施例中,通过遗传学和药理学抑制Fap活性,可以缓解OA模型小鼠的软骨损伤、骨赘形成、滑膜炎症及软骨组织聚集蛋白多糖的表达减低;在另一个实施例中,我们在DMM手术后4周后,即小鼠已经存在一定程度骨关节炎后开始每周进行关节腔内注射Fap抑制剂,注射8周后发现软骨损伤、骨赘形成、滑膜炎症同样得到显著缓解,软骨组织聚集蛋白多糖的表达同样显著升高。
本发明还进行了重组Fap与软骨基质主要成分Col II共孵育产物的检测实验,在其中一个实施例中,重组Fap可以降解变性Col II,且该效应具有时间和剂量依赖性。小分子Fap抑制剂及体内Fap抑制剂Oln均可以抑制重组Fap对变性Col II的降解。重组Fap还可以进一步降解MMP13消化后的天然Col II。
本发明还进行了体内FAP抑制剂Oln敲除小鼠OA严重程度的检测实验,在其中一个实施例中,通过敲除Oln可以促进OA模型小鼠的软骨损伤、骨赘形成、滑膜炎症及软骨组织聚集蛋白多糖的表达减低。
本发明还进行了关节腔内注射重组Oln的DMM小鼠OA严重程度的检测实验,在其中一个实施例中,我们在DMM手术后4周后,即小鼠已经存在一定程度骨关节炎后开始每周进行关节腔内注射重组Oln,注射8周后发现软骨损伤、骨赘形成、滑膜炎症同样得到显著缓解,软骨组织聚集蛋白多糖的表达同样显著升高。
附图说明
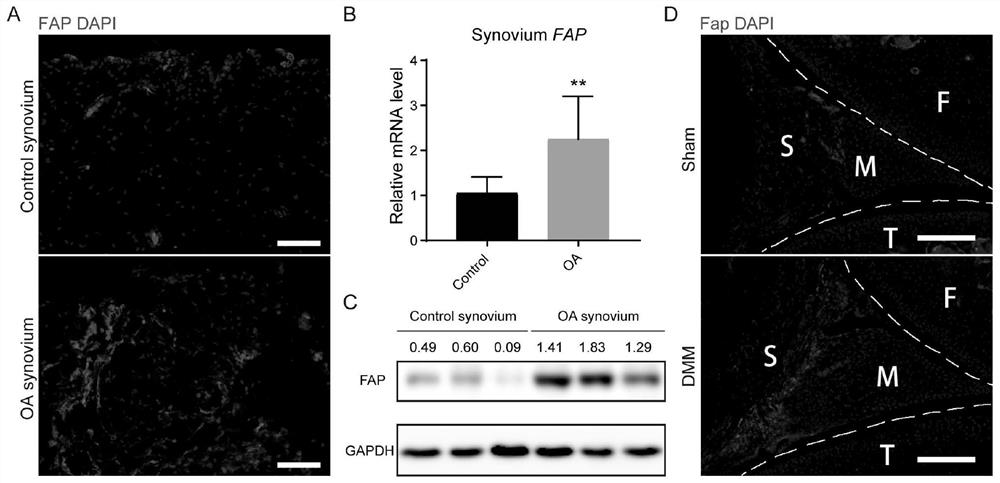
图1显示为Fap在OA滑膜中表达上调的结果示意图;其中,A为免疫荧光检测对照及OA患者滑膜Fap的表达;B为qRT-PCR检测对照及OA患者滑膜Fap的表达;C为蛋白质印迹检测对照及OA患者滑膜Fap的表达;D为免疫荧光检测对照及OA模型小鼠滑膜Fap的表达。
图2显示为遗传学和药理学抑制Fap缓解小鼠OA进展的效果示意图;其中,A-C为构造OA模型的对照及Fap敲除小鼠注射Fap抑制剂/载体8周后膝关节的番红固绿染色,分别显示软骨损伤(A)、骨赘生成(B)和滑膜炎症(C);D为OARSI评分评估各组软骨损伤(A)程度;E为骨赘评分评估各组骨赘生成(B)程度;F为滑膜评分评估各组滑膜炎症(C)程度;G为免疫荧光检测各组聚集蛋白多糖的表达;H为G图聚集蛋白多糖荧光面积的定量分析。
图3显示为关节腔内注射Fap抑制剂对小鼠OA具有治疗作用的效果示意图;其中,A-C为小鼠OA模型注射Fap抑制剂/载体治疗8周后膝关节的番红固绿染色,分别显示软骨损伤(A)、骨赘生成(B)和滑膜炎症(C);D为OARSI评分评估各组软骨损伤(A)程度;E为骨赘评分评估各组骨赘生成(B)程度;F为滑膜评分评估各组滑膜炎症(C)程度;G为免疫荧光检测各组聚集蛋白多糖的表达;H为G图聚集蛋白多糖荧光面积的定量分析。
图4显示为Fap降解变性或基质金属蛋白酶消化后的Col II的效果示意图。其中,A为胶体蓝染色分析变性Col II与不同剂量重组Fap共孵育产物及其灰度定量分析;B为胶体蓝染色分析变性Col II与重组Fap孵育不同时间的共孵育产物及其灰度定量分析;C为胶体蓝染色分析不同剂量Fap抑制剂、重组Fap及变性Col II共孵育产物及其灰度定量分析;D为蛋白质印迹分析免疫共沉淀293T细胞过表达的Fap样本;E为胶体蓝染色分析变性Col II与免疫共沉淀Fap共孵育产物及其灰度定量分析;F为胶体蓝染色分析重组基质金属蛋白酶13消化后的Col II与EDTA及重组Fap共孵育产物及其灰度定量分析;G为F图 55kDa、40kDa和30kDa条带的灰度定量分析。
图5显示为敲除Oln促进OA进展的效果示意图。其中,A-C为野生型及Oln敲除小鼠OA模型8周后膝关节的番红固绿染色,分别显示软骨损伤(A)、骨赘生成(B)和滑膜炎症(C);D为OARSI评分评估各组软骨损伤(A)程度;E为骨赘评分评估各组骨赘生成(B)程度;F为滑膜评分评估各组滑膜炎症(C)程度;G为免疫荧光检测各组聚集蛋白多糖的表达;H为G图聚集蛋白多糖荧光面积的定量分析。
图6显示为关节腔内注射重组Oln对小鼠OA具有治疗作用的效果示意图。其中,A-C为小鼠OA模型造模4周后开始注射重组Oln/载体治疗8周后膝关节的番红固绿染色,分别显示软骨损伤(A)、骨赘生成(B)和滑膜炎症(C);D为OARSI评分评估各组软骨损伤(A)程度;E为骨赘评分评估各组骨赘生成(B)程度;F为滑膜评分评估各组滑膜炎症(C)程度;G为免疫荧光检测各组聚集蛋白多糖的表达;H为G图聚集蛋白多糖荧光面积的定量分析。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
实施例1 Fap在OA滑膜中表达上调
本实施例中通过免疫荧光、qRT-PCR及蛋白质印迹确定Fap在滑膜组织中的表达情况。
收集对照组(非OA性急性损伤)及OA患者滑膜,固定脱水后进行冰冻切片,通过免疫荧光实验检测Fap在滑膜组织中的表达情况,发现Fap在对照组滑膜组织中表达量很低,而在OA患者的滑膜组织中Fap呈高表达(图1A)。
收集对照组及OA患者滑膜,通过qRT-PCR及蛋白质印迹实验检测Fap在滑膜中的表达,发现与免疫荧光的结果一致,OA患者滑膜组织中Fap的mRNA及蛋白水平均显著高于对照组滑膜组织(图1B、1C)。
收集假手术组及DMM组野生型小鼠膝关节,固定脱钙脱水后进行冰冻切片,通过免疫荧光实验检测Fap在小鼠关节中的表达情况,发现与人滑膜组织免疫荧光结果一致,Fap主要表达于滑膜组织,且在DMM手术模拟的OA小鼠滑膜中表达显著升高(图1D)。
实施例2 遗传学和药理学抑制Fap缓解小鼠OA进展
为了研究Fap是否调控OA的进展,我们对野生型及Fap敲除小鼠构造DMM模型模拟小鼠OA,并于手术后第3天开始每周进行膝关节腔内注射Fap特异性小分子抑制剂或载体对照(PBS)。野生型小鼠造模后呈现显著软骨侵蚀、骨赘生成及滑膜炎症,而一方面在Fap敲除小鼠中软骨侵蚀和滑膜炎症则显著减轻,骨赘生成则有减轻的趋势,另一方面关节腔内注射Fap抑制剂的野生型小鼠同样呈现显著减轻的软骨侵蚀、骨赘生成及滑膜炎症(图2A-F)。关节腔内注射Fap抑制剂(Ac-Gly-BoroPro)对Fap敲除小鼠没有治疗效果,提示Fap抑制剂的治疗效果是依赖于Fap的(图2A-F)。聚集蛋白多糖的免疫荧光实验证明遗传学和药理学抑制Fap活性可以缓解关节软骨内聚集蛋白多糖的丢失(图2G、H)。
实施例3 关节腔内注射Fap抑制剂对小鼠OA具有治疗作用
为了检验Fap抑制剂(Ac-Gly-BoroPro)能否在OA发病后缓解OA的关节症状,我们对DMM造模4周后的小鼠每周进行膝关节腔内注射Fap抑制剂(Ac-Gly-BoroPro)或载体对照(PBS)。注射8周后载体对照组相比假手术组有明显的软骨侵蚀、骨赘生成及滑膜炎症,而Fap抑制剂组OA则明显减轻(图3A-F)。聚集蛋白多糖的免疫荧光实验证明Fap抑制剂(Ac-Gly-BoroPro)可以缓解关节软骨内聚集蛋白多糖的丢失(图3G、H)。
实施例4 Fap降解变性或基质金属蛋白酶消化后的Col II
Fap作为一种丝氨酸蛋白酶,能够降解变性I型胶原。为了研究Fap能否降解软骨基质主要成分Col II,我们将重组Fap(R&D Systems, 商品序号为:8647-SE-010)(重组Fap是从R&D Systems公司购买的提纯过的Fap,序列上是与Fap一致的)与热变性Col II(95 ℃10 分钟)进行共孵育,发现重组Fap对热变性Col II具有剂量依赖和时间依赖的降解作用(图4A、B)。而将重组Fap与Fap抑制剂(Ac-Gly-BoroPro)预先进行共孵育半小时后加入热变性的Col II进行孵育,发现Fap抑制剂(Ac-Gly-BoroPro)能够抑制重组Fap对变性Col II的降解(图4C)。利用293T细胞过表达Fap后将Fap免疫共沉淀,而后加入热变性的Col II进行共孵育,发现免疫共沉淀的Fap可以降解变性的Col II;而将Fap与Oln共同过表达后免疫共沉淀的Fap对变性Col II的降解受到抑制(图4D、E)。我们进一步检测Fap能否将MMP13初步降解的天然Col II进行进一步降解。我们将MMP13与天然Col II孵育12小时,而后加入EDTA终止MMP13酶活后加入重组Fap继续孵育12小时,发现Fap能够将MMP13裂解的天然Col II片段进一步降解(图4F-G)。
实施例5 敲除Oln促进OA的进展
在实施例4中我们发现Fap体内抑制剂Oln可以抑制Fap对变性Col II的降解,为了进一步研究Oln是否能够调控OA的进展,我们对Oln敲除小鼠构造DMM模型,对比其与野生型小鼠OA进展的差异。组织形态学分析发现野生型与Oln敲除小鼠在未做DMM的对侧膝关节没有明显差异,提示Oln在稳态时不影响关节发育或功能(图5A-F)。而构造DMM模型的Oln敲除小鼠相比野生型小鼠具有更严重的软骨损伤、骨赘生成及滑膜炎症(图5A-F)。而聚集蛋白多糖的免疫荧光实验同样证明敲除Oln后聚集蛋白多糖的信号显著降低(图5G、H)。
实施例6 关节腔内注射Oln对小鼠OA具有治疗作用
为了检测Oln能否在OA发病后缓解OA的关节症状,我们对构造DMM模型4周后的野生型小鼠进行每周关节腔内注射Oln(可以购买自R&D Systems, 商品序号为:3729-SC-025),注射8周后通过组织形态学分析我们发现Oln注射显著缓解了软骨磨损、骨赘生成及滑膜炎症(图6A-F)。而聚集蛋白多糖的免疫荧光实验同样证明注射Oln后聚集蛋白多糖的信号显著升高(图6G、H)。
- 成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途
- 成纤维细胞激活蛋白抑制剂在制备药物中的用途
