丹曲林和丹曲林前药用于治疗辐射暴露的用途
文献发布时间:2023-06-19 11:57:35
相关申请的交叉引用
本申请要求2018年11月27日提交的美国临时申请第62/772,001号的权益,所述临时申请的全部内容通过引用并入本文。
技术领域
本公开涉及使用丹曲林(dantrolene)、丹曲林前药或其药学上可接受的盐来治疗辐射暴露的方法。
背景技术
急性辐射综合征(Acute Radiation Syndrome,ARS),也称为辐射毒性或辐射病,是一种由全身(或身体的很大一部分)在短时段(通常数分钟)内被高剂量的穿透辐射所辐照而引起的急性医学病状。ARS的主要原因是特定组织中多能细胞的耗竭。ARS通常遵循可预测的临床过程,并且其特征是体征和症状表现为细胞缺陷以及各种组织和器官对电离辐射的反应。全身或大部分身体的高剂量电离辐射暴露经常导致危及生命的损伤,主要是对那些辐射敏感性的自我更新的组织的损伤,但最显著的是对造血系统的损伤。随着辐射暴露的增加,造血综合征患者的生存率降低。死亡的主要原因是骨髓的破坏,导致感染和出血。
需要治疗辐射暴露的方法。
发明内容
本公开涉及治疗已经或将要暴露于辐射的受试者的方法,所述方法包括向所述受试者施用包含治疗有效量的丹曲林或其药学上可接受的盐的药物组合物。
本公开还涉及治疗已经或将要暴露于辐射的受试者的方法,所述方法包括向所述受试者施用包含治疗有效量的式I化合物的药物组合物
其中R是-P(O)(OH)
本公开还涉及治疗已经或将要暴露于辐射的受试者的方法,所述方法包括向所述受试者施用包含治疗有效量的式II化合物的药物组合物
其中R
本公开还涉及治疗已经或将要暴露于辐射的受试者的方法,所述方法包括向所述受试者施用包含治疗有效量的丹曲林、式I化合物、式II化合物或其药学上可接受的盐的任何组合的药物组合物。
附图说明
当结合附图阅读时,将进一步理解本发明内容以及以下详细描述。为了说明所公开的装置、系统和方法的目的,在附图中示出了装置、系统和方法的示例性实施方式;然而,装置、系统和方法不限于所公开的特定实施方式。在附图中:
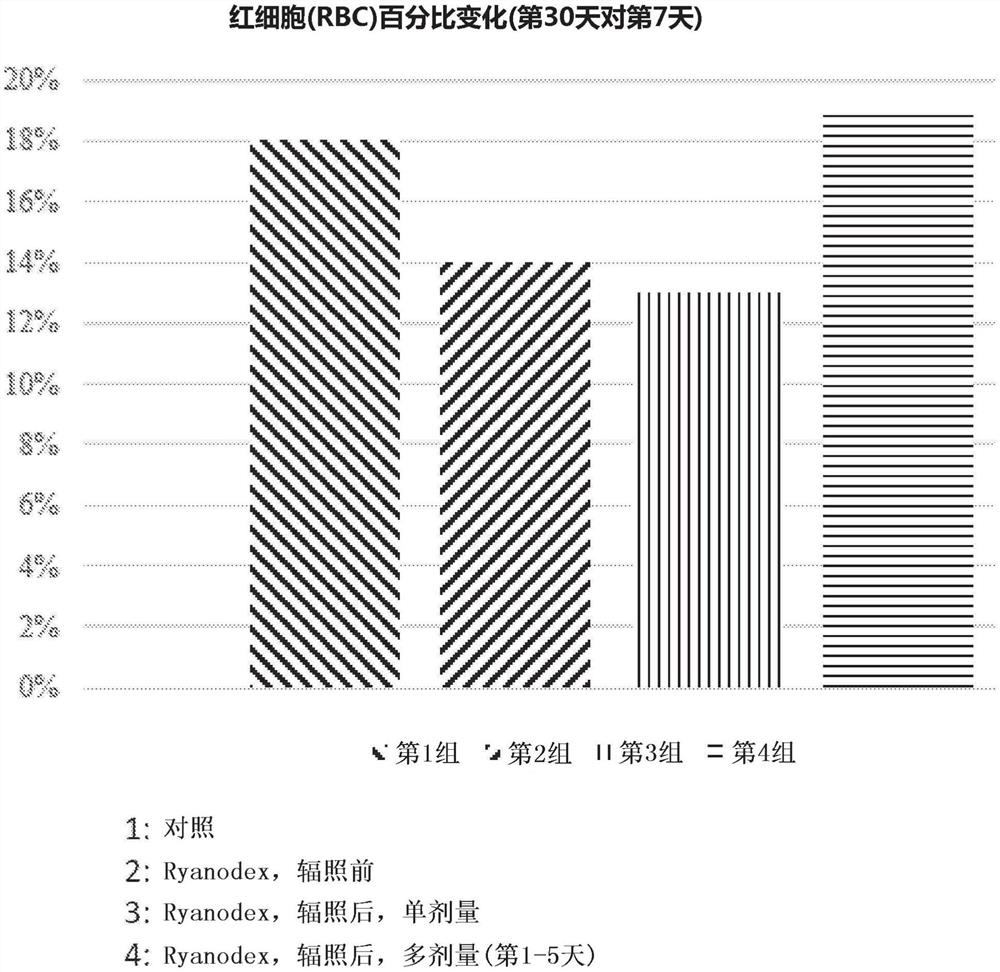
图1是描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的红细胞(RBC)变化百分比的直方图。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图2是描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的白细胞(WBC)变化百分比的直方图。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图3是描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的血液嗜中性粒细胞变化百分比的直方图。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图4是描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的血液淋巴细胞变化百分比的直方图。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图5是描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的血小板变化百分比的直方图。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图6是一系列直方图,描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的血红蛋白(HgB)量度。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图7是一系列直方图,描绘了在第1-4组用Ryanodex治疗的动物中第7天至第30天之间的血细胞比容(HCT)量度。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图8A-8C是一系列的图,描绘了第1-4组在辐照后第3天至第30天相比于基线的平均体重变化百分比。图8A:总体体重变化。图8B:子集A的体重变化。图8C:子集B的体重变化。第1组:对照;第2组:Ryanodex,辐照前;第3组:Ryanodex,辐照后,单剂量;以及第4组:Ryanodex,辐照后,多剂量(第1-5天)。
图9A-9C是一系列的图,描绘了用对照媒介物(无菌水)、辐照前1小时用Ryanodex、辐照后第1天用Ryanodex以及在辐照后第1-5天用Ryanodex治疗的动物在辐照后第1天至第30天的平均组死亡率评分。图9A:总体平均死亡率评分。图9B:子集A的平均死亡率评分。图9C:子集B的平均死亡率评分。
说明性实施方式的详细描述
通过参考以下结合附图和实施例的详细描述,可以更容易地理解本公开,所述附图和实施例构成了本公开的一部分。应当理解,本公开不限于本文描述和/或示出的具体组合物或方法,并且本文所用的术语仅出于以示例的方式描述特定实施方式的目的,而无意于限制所要求保护的公开内容。此外,如在包括权利要求书的说明书中,单数形式“一个”、“一种”和“所述”包括复数,并且对特定数值的指称至少包括该特定值,除非上下文中另有明确说明。所有范围都包含端值并可组合。
修饰词“约”应视为公开了由两个端点的绝对值限定的范围。例如,表述“约2至约4”也公开了范围“2至4”。当用于修饰单个数字时,术语“约”可以指所示数字±10%,并且包含所示数字。例如,“约10%”可以表示9%至11%的范围,并且“约1”是指0.9至1.1。
应当理解,为清楚起见在分开的实施方式的上下文中在此描述的本公开的某些特征也可以组合提供在单个实施方式中。相反,为简洁起见在单个实施方式的上下文中描述的本公开的各种特征也可以分开地或以任何子组合来提供。此外,对以范围陈述的值的指称包括该范围内的每一个值。
如本文所用,术语“药物组合物”是指适于施用于人类并含有药学上可接受的赋形剂例如但不限于稳定剂、填充剂、缓冲剂、载体、稀释剂、媒介物、增溶剂和粘合剂的组合物。如本文所用,药物组合物包括但不限于准备用于皮下注射或输注和肌内注射的液体形式。
“治疗有效量”是指本文所述的活性药剂足以抑制、停止或引起特定受试者或受试者群体中所治疗的病症或病状的改善的量。在某些实施方式中,在人类或其他哺乳动物中,治疗有效量可以在实验室或临床环境中通过实验方式确定,或者可以是针对所治疗的特定疾病和受试者的政府指南所需的量。
如本文所用,“改善”是指特定受试者或受试者群体中所治疗的病症或病状的严重程度减轻。
如本文所用,“患者”或“受试者”旨在是指哺乳动物。因此,本文描述的方法适用于人类和非人类受试者。本文描述的方法特别适用于人类。
如本文所用的术语“药学上可接受的”是指药学上可接受的事物,例如药物组合物的组分(包括容器),不会引起不可接受的药理活性损失或不可接受的不良副作用。药学上可接受的组分的实例提供于1990年在美国马里兰州罗克维尔举行的美国药典大会上通过的《美国药典》(United States Pharmacopeia,USP),《美国国家处方集》(NationalFormulary,NF)以及由美国食品和药品管理局发行的《FDA非活性成分指南》1990,1996(两者均通过引用并入本文,包括任何附图)。也可以使用满足USP/NF以外的必要限制和/或规格的其他等级的溶液或组分。
如本文所用的术语“药学上可接受的盐”是指药学上可接受的并且具有母体化合物的所需药理活性的本公开化合物的盐。特别地,这些盐是无毒的,并且可以是无机或有机酸加成盐和碱加成盐。具体来说,这些盐包括:当存在于母体化合物中的酸性质子被金属离子(例如碱金属离子、碱土金属离子或铝离子)替代时形成的盐;或与有机碱(例如乙醇胺、二乙醇胺、三乙醇胺、N-甲基葡糖胺等)配位时形成的盐。仅举例来说,盐还包括钠盐、钾盐、钙盐、镁盐、铵盐、四烷基铵盐等;并且当化合物含有碱性官能团时,无毒的有机酸或无机酸的盐,例如盐酸盐、氢溴酸盐、酒石酸盐、甲磺酸盐、乙酸盐、马来酸盐、草酸盐等。
如本文所用,短语“由于辐射暴露导致”和“由于辐射暴露”是指作为辐射暴露的直接后果的效应,以及作为辐射暴露的继发后果的效应,以及辐射暴露的间接后果的效应。
术语“C
术语“烷基”是指基团中具有1至12个碳原子(“C
术语“杂环烷基”是指含有至少一个选自O、N和S的杂原子的任何三至十元单环或双环饱和环结构。合适的杂环烷基基团的实例包括但不限于氮杂环庚烷基、氮丙啶基、氮杂环丁烷基、吡咯烷基、哌嗪基、哌啶基、吗啉基、硫代吗啉基等。
术语“芳基”当单独或作为取代基团的一部分使用时,是指在环中具有6或10个碳原子的单环或双环芳族烃环结构。优选的芳基部分包括苯基和萘基。
术语“亚芳基”是指在环中具有6或10个碳原子的单环或双环芳族烃环结构。优选的亚芳基部分包括亚苯基和亚萘基。本公开的化合物可以是手性的,因此,可以作为单一对映异构体或对映异构体混合物存在。本公开考虑了所有对映异构体及其混合物。
尤其,本公开涉及通过施用包含丹曲林或其药学上可接受的盐的药物组合物来治疗已暴露于辐射的受试者的方法。在其他方面,本公开涉及通过施用包含丹曲林或其药学上可接受的盐的药物组合物来治疗将暴露于辐射的受试者的方法。
尤其,本公开涉及通过施用包含式I化合物或其药学上可接受的盐的药物组合物来治疗已暴露于辐射的受试者的方法:
其中
R是-P(O)(OH)
R
R
本公开还涉及通过施用包含式II化合物或其药学上可接受的盐的药物组合物来治疗已暴露于辐射的受试者的方法
其中
R
Z是C
Y是亚芳基;C
R
式I和II的化合物是丹曲林前药,并且描述于2018年10月19日提交的国际专利申请第PCT/US2018/056713号中,所述专利申请的全部内容通过引用并入本文。
在其他方面,本公开涉及通过施用包含丹曲林或其药学上可接受的盐的药物组合物来治疗将暴露于辐射的受试者的方法。在其他方面,本公开涉及通过施用包含式I化合物或其药学上可接受的盐的药物组合物来治疗将暴露于辐射的受试者的方法。在其他方面,本公开涉及通过施用包含式II化合物或其药学上可接受的盐的药物组合物来治疗将暴露于辐射的受试者的方法。
在其他方面,本公开涉及通过施用药物组合物来治疗将暴露于辐射的受试者的方法,所述药物组合物包含丹曲林、式I化合物、式II化合物或其药学上可接受的盐或其组合。
在一些方面,本公开的丹曲林前药是其中R是-P(O)(OH)
式I-A化合物的药学上可接受的盐也在本公开的范围内。优选的盐包括例如式I-A化合物的钠盐。式I-A化合物的锂盐、镁盐、钙盐和钾盐也在本公开的范围内。替代的盐形式包括铵盐、胆碱盐和氨丁三醇(tromethamine)盐。优选的式I-A化合物的盐是单钠盐。另一种优选的式I-A化合物的盐是二钠盐。另一种优选的式I-A化合物的盐是单氨丁三醇盐。另一种优选的式I-A化合物的盐是氨丁三醇(tromethanine)盐。式I-A化合物的药学上可接受的有机盐也在本公开的范围内。
在一些方面,在本公开的方法中使用的丹曲林前药是其中R是-P(O)(OR
在一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的其他方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在式I-B化合物的一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
如果适用,包括式I-A和I-B的化合物的式I化合物可以以药学上可接受的盐的形式存在。这些盐包括钠盐。还设想了钾盐、锂盐、钙盐和镁盐。替代的盐形式包括铵盐、胆碱盐和氨丁三醇盐。
使用式II的丹曲林前药或其药学上可接受的盐的方法也在本公开的范围内
其中
R
Z是C
Y是芳基;
R
R
或者R
在优选的方面,R
或其药学上可接受的盐。
在式II的其他方面,R
其中
Z是C
R
R
或者R
或其药学上可接受的盐。
在式II-B的这些方面,Z可以是C
在式II-B的这些方面,R
在式II-B的这些方面,R
在式II-B的这些方面中的一些方面,R
在式II-B的这些方面中的一些方面,R
优选的式II-B化合物包括例如
及其药学上可接受的盐。
在式II的其他方面,R
其中
Z是C
或其药学上可接受的盐。
在式II-C的这些方面,Z可以是C
优选的式II-C化合物是
及其药学上可接受的盐。
在式II的其他方面,R
其中
Y是亚芳基;并且
Z是C
或其药学上可接受的盐。
在式II-D的这些方面,Y可以是亚苯基或亚萘基,优选亚苯基。
在式II-D的这些方面,Z可以是C
优选的式II-D化合物是
及其药学上可接受的盐。
在其他方面,R
其中
Y是亚芳基;并且
Z是C
或其药学上可接受的盐。
在式II-E的这些方面,Y可以是亚苯基或亚萘基,优选亚苯基。
在式II-E的这些方面,Z可以是C
如果适用,包括式II-A、II-B、II-C、II-D和II-E的化合物的式II化合物可以以药学上可接受的盐的形式存在。这些盐包括钠盐。还设想了钾盐、锂盐、钙盐和镁盐。替代的盐形式包括铵盐、胆碱盐和氨丁三醇盐。式II化合物的药学上可接受的有机盐也在本公开的范围内。
式I和II的化合物,包括式I-A、I-B、II-A、II-B、II-C、II-D和II-E的化合物及其药学上可接受的盐,可以通过将所述化合物与药学上可接受的赋形剂组合而制备为药物组合物。在一些实施方式中,一种或多种额外的药学上可接受的赋形剂选自防腐剂、抗氧化剂或其混合物。在本公开的其他实施方式中,额外的药学上可接受的赋形剂是防腐剂,例如但不限于苯酚、甲酚、对羟基苯甲酸酯、氯丁醇或其混合物。在本公开的其他实施方式中,额外的药学上可接受的赋形剂是抗氧化剂,例如但不限于抗坏血酸、焦亚硫酸钠、棕榈酸、丁基化羟基茴香醚、丁基化羟基甲苯、生育酚或其混合物。
本公开的药物组合物可以悬浮液形式提供。在其他实施方式中,本公开的药物组合物可以溶液形式提供。
用于本公开的方法中的药物组合物可以具有优选在生理pH下以约1mg/ml至约400mg/mL,例如1mg/mL至约200mg/mL、1mg/mL至约300mg/mL,优选5mg/mL至约125mg/mL的浓度存在的本公开化合物。在本公开的特定实施方式中,本公开的化合物以等于或大于约5mg/mL的浓度存在。在其他实施方式中,本公开的化合物以约10至25mg/mL的浓度存在。在其他实施方式中,本公开的化合物以约1mg/mL、5mg/mL、10mg/mL、15mg/mL、20mg/mL、25mg/mL、30mg/mL、35mg/mL、40mg/mL、45mg/mL或50mg/mL的浓度存在。在其他实施方式中,本公开的化合物以约125mg/mL、150mg/mL、175mg/mL、200mg/mL、225mg/mL、250mg/mL、275mg/mL、300mg/mL、325mg/mL、350mg/mL、375mg/mL或约400mg/mL的浓度存在。
在某些实施方式中,本公开的化合物以等于或大于约55mg/mL的浓度存在。在其他实施方式中,本公开的化合物以约55至125mg/mL的浓度存在。在特定实施方式中,本公开的化合物以约75mg/mL、80mg/mL、85mg/mL、90mg/mL、95mg/mL、100mg/mL、105mg/mL、110mg/mL、115mg/mL、120mg/mL或125mg/mL的浓度存在。在其他实施方式中,本公开的化合物以约75mg/mL至95mg/mL、80mg/mL至100mg/mL、90mg/mL至110mg/ml、95mg/mL至105mg/mL、95mg/mL至115mg/mL、100mg/mL至110mg/mL、110mg/mL至125mg/mL(包括其间的所有范围和子范围)的浓度存在。
在针对“将要”暴露于辐射的受试者的治疗方法的那些方面,受试者在不久的将来(即在约1个月内、在约2周内、在约7天内、在约6天内、在约5天内、在约4天内、在约3天内、在约2天内、在约1天内)暴露于辐射的可能性增加。在一些方面,受试者在不久的将来暴露于辐射的可能性是确定的,也就是说,受试者在不久的将来暴露于辐射的可能性为100%。在一些方面,受试者在不久的将来暴露于辐射的概率小于100%,例如,90%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为80%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为70%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为60%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为70%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为60%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为50%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为40%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为30%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为20%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为10%概率或更大概率。在一些方面,受试者在不久的将来暴露于辐射的概率为5%概率或更大概率。
在某些实施方式中,本公开的药物组合物还可以包含稳定剂或两种或更多种稳定剂。在本公开的其他实施方式中,稳定剂选自表面活性剂、聚合物、交联聚合物、缓冲剂、电解质和非电解质。在本公开的其他实施方式中,组合物包含两种或更多种选自表面活性剂、聚合物、交联聚合物、缓冲剂、电解质和非电解质的稳定剂的组合。在本发明的其他实施方式中,稳定剂是表面活性剂,例如但不限于聚环氧乙烷(PEO)、PEO衍生物、聚山梨酯80、聚山梨酯20、泊洛沙姆188、聚乙氧基化植物油、卵磷脂、人血清白蛋白及其混合物。在本公开的特定实施方式中,稳定剂是聚合物,例如但不限于聚乙烯吡咯烷酮(例如但不限于聚维酮K12、聚维酮K17及其混合物)、聚乙二醇3350及其混合物。在本公开的其他实施方式中,稳定剂是电解质,例如但不限于氯化钠、氯化钙及其混合物。在本公开的其他实施方式中,稳定剂是非电解质,例如但不限于右旋糖、甘油、甘露糖醇或其混合物。在本公开的其他实施方式中,稳定剂是交联聚合物,例如但不限于羧甲基纤维素钠(CMC)。在本公开的一些实施方式中,稳定剂是CMC7LF、CMC7MF、CMC7HF或其混合物。
在本公开的其他实施方式中,可以使用非电解质稳定剂和电解质稳定剂的组合。在一些实施方式中,稳定剂的组合可以包含两种或更多种非电解质稳定剂。在其他实施方式中,稳定剂的组合可以包含两种或更多种电解质稳定剂。在其他实施方式中,稳定剂的组合可以包含一种或多种非电解质稳定剂和一种或多种电解质稳定剂。在其他实施方式中,稳定剂的组合可以包含甘露糖醇、右旋糖和氯化钠中的两种或更多种。
在本公开的某些实施方式中,可以使用表面活性剂稳定剂和聚合物稳定剂的组合。在一些实施方式中,稳定剂的组合可以包含两种或更多种表面活性剂稳定剂。在其他实施方式中,稳定剂的组合可以包含两种或更多种聚合物稳定剂。在其他实施方式中,稳定剂的组合可以包含一种或多种表面活性剂稳定剂和一种或多种聚合物稳定剂。在其他实施方式中,稳定剂的组合可以包含聚山梨酯80、聚山梨酯20和泊洛沙姆188中的两种或更多种。在其他实施方式中,稳定剂的组合可以包含聚山梨酯80、聚山梨酯20和泊洛沙姆188中的一种或多种,以及聚维酮K12、聚维酮K17和聚乙二醇3350中的一种或多种。
在本公开的某些实施方式中,组合物包含约0.2mg/mL至约75mg/mL的一种或多种稳定剂,以及它们之间的所有范围和子范围。在本公开的特定实施方式中,组合物包含约0.2至0.7mg/mL、0.5至1mg/mL、1至5mg/mL、2至8mg/mL、5至6mg/mL、5至10mg/mL、8至12mg/mL、10至15mg/mL、15至20mg/mL、20至30mg/mL、30至40mg/mL、40至50mg/mL、45至55mg/mL、50至60mg/mL或60至75mg/mL的一种或多种稳定剂,以及它们之间的所有范围和子范围。在本公开的其他实施方式中,组合物包含约0.2mg/mL、0.5mg/mL、1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、5.5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、12mg/mL、15mg/mL、17mg/mL、20mg/mL、25mg/mL、30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL、55mg/mL、60mg/mL、65mg/mL、70mg/mL或75mg/mL的一种或多种稳定剂。
在本公开的特定实施方式中,组合物还包含一种或多种缓冲剂,例如但不限于NaH
在本公开的某些实施方式中,药物组合物具有约3-10,例如3、4、5、6、7、8、9或10的pH。在本公开的其他实施方式中,组合物具有约5-9的pH。在本公开的其他实施方式中,组合物具有约6至9的pH。在本公开的其他实施方式中,组合物具有约6至7的pH。在本公开的其他实施方式中,组合物具有约6至8.5的pH。在本公开的其他实施方式中,组合物具有约7至8.5的pH。在本公开的其他实施方式中,组合物具有超过7至8.5的pH。在本公开的某些实施方式中,组合物具有约6.0至8.0的pH。在本公开的特定实施方式中,组合物具有约6.0至7.0、6.5至7.0、6.5至7.5、6.7至7.2、7.0至7.2、7.0至7.5、7.0至8.0或7.0至8.5的pH。
在本公开的某些实施方式中,药物组合物具有约280mOsm/L至约310mOsm/L,例如约280、285、290、300、305或约310mOsm/L的摩尔渗透压浓度。在本公开的其他实施方式中,组合物具有约290mOsm/L至约300mOsm/L的摩尔渗透压浓度。在本公开的其他实施方式中,组合物具有约290mOsm/L的摩尔渗透压浓度。在一些实施方式中,可以通过使用适当量的一种或多种在组合物中用作调渗剂(tonicifier)的稳定剂(例如但不限于本文所述的非电解质稳定剂和电解质稳定剂)来选择摩尔渗透压浓度。在一些实施方式中,可以通过使用适当量的一种或多种在组合物中用作调渗剂的缓冲剂(例如但不限于本文所述的缓冲剂)来选择摩尔渗透压浓度。
在针对“将要”暴露于辐射的受试者的治疗方法的那些方面,受试者在不久的将来(即在约1个月内、在约2周内、在约7天内、在约6天内、在约5天内、在约4天内、在约3天内、在约2天内、在约1天内)暴露于辐射的可能性是作为癌症治疗的辐射的结果。
在针对“将要”暴露于辐射的受试者的治疗方法的那些方面,受试者在不久的将来(即在约1个月内、在约2周内、在约7天内、在约6天内、在约5天内、在约4天内、在约3天内、在约2天内、在约1天内)暴露于辐射的可能性是核电站泄漏暴露的结果。在这些方面,核电站的完整性使得在不久的将来发生泄漏的可能性升高。在一些方面,受试者在核电站泄漏场所的100英里半径内。在一些方面,受试者在核电站泄漏场所的75英里半径内。在一些方面,受试者在核电站泄漏场所的50英里半径内。在一些方面,受试者在核电站泄漏场所的40英里半径内。在一些方面,受试者在核电站泄漏场所的30英里半径内。在一些方面,受试者在核电站泄漏场所的20英里半径内。在一些方面,受试者在核电站泄漏场所的10英里半径内。在一些方面,受试者在核电站泄漏场所的9英里半径内。在一些方面,受试者在核电站泄漏场所的8英里半径内。在一些方面,受试者在核电站泄漏场所的7英里半径内。在一些方面,受试者在核电站泄漏场所的6英里半径内。在一些方面,受试者在核电站泄漏场所的5英里半径内。在一些方面,受试者在核电站泄漏场所的4英里半径内。在一些方面,受试者在核电站泄漏场所的3英里半径内。在一些方面,受试者在核电站泄漏场所的2英里半径内。在一些方面,受试者在核电站泄漏场所的1英里半径内。在一些方面,受试者位于核电站泄漏场所。
在针对“将要”暴露于辐射的受试者的治疗方法的那些方面,受试者在不久的将来(即在约1个月内、在约2周内、在约7天内、在约6天内、在约5天内、在约4天内、在约3天内、在约2天内、在约1天内)暴露于辐射的可能性是核武器爆炸的结果。在这些方面,核武器爆炸的可能性升高。在一些方面,由于恐怖主义威胁,核武器爆炸的可能性可能会升高。在一些方面,由于确定了核武器发射,核武器爆炸的可能性可能会升高。在一些方面,受试者在核武器爆炸的100英里半径内。在一些方面,受试者在核武器爆炸的75英里半径内。在一些方面,受试者在核武器爆炸的50英里半径内。在一些方面,受试者在核武器爆炸的40英里半径内。在一些方面,受试者在核武器爆炸的30英里半径内。在一些方面,受试者在核武器爆炸的20英里半径内。在一些方面,受试者在核武器爆炸的10英里半径内。在一些方面,受试者在核武器爆炸的9英里半径内。在一些方面,受试者在核武器爆炸的8英里半径内。在一些方面,受试者在核武器爆炸的7英里半径内。在一些方面,受试者在核武器爆炸的6英里半径内。在一些方面,受试者在核武器爆炸的5英里半径内。在一些方面,受试者在核武器爆炸的4英里半径内。在一些方面,受试者在核武器爆炸的3英里半径内。在一些方面,受试者在核武器爆炸的2英里半径内。在一些方面,受试者在核武器爆炸的1英里半径内。
本公开的方法优选用于治疗哺乳动物。在更优选的方面,本公开的方法用于治疗人类。
可以治疗的辐射暴露(暴露前或暴露后)包括高于环境辐射暴露的任何类型的辐射暴露。在一些方面,辐射暴露是穿透辐射的剂量。在一些方面,辐射暴露是在60分钟或更短的时间段,例如,约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55或约60分钟内的穿透辐射的剂量。在一些方面,辐射暴露足以导致未根据所公开的方法进行治疗的对照受试者中未成熟的实质干细胞的耗竭。在一些方面,辐射暴露是在大于60分钟的时间段(例如2、3、4、5、6、7、8小时或更长时间)内的穿透辐射的剂量。
在一些方面,受试者已经暴露于化学辐射。在一些方面,受试者已被诊断出患有癌症,并且已经暴露于足以治疗受试者的癌症的量的辐射。在一些方面,受试者将要暴露于化学辐射。在一些方面,受试者已被诊断出患有癌症,并且将要暴露于足以治疗受试者的癌症的量的辐射。
在一些方面,受试者已经暴露于由核电站泄漏引起的辐射。在一些方面,受试者将要暴露于由核电站泄漏引起的辐射。
在一些方面,受试者已经暴露于由核武器暴露引起的辐射。在一些方面,受试者将要暴露于由核武器暴露引起的辐射。
在一些方面,辐射是X射线辐射、γ射线辐射、中子辐射或其组合。在一些方面,辐射是X射线辐射。在一些方面,辐射是γ射线辐射。在一些方面,辐射是中子辐射。
在一些方面,受试者已经暴露于高于环境水平的辐射剂量。在一些方面,受试者已经暴露于至少0.3Gy的辐射剂量。在一些方面,受试者已经暴露于至少0.7Gy的辐射剂量。在一些方面,受试者已经暴露于至少6Gy的辐射剂量。在一些方面,受试者已经暴露于至少10Gy的辐射剂量。在一些方面,受试者已经暴露于至少50Gy的辐射剂量。在一些方面,受试者已经暴露于0.3Gy和50Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.7Gy和50Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.3Gy和0.7Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.3Gy和6Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.3Gy和10Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.7Gy和6Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.7Gy和10Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.7Gy和50Gy之间的辐射剂量。在一些方面,受试者已经暴露于0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或约50Gy的辐射剂量。
在一些方面,受试者将要暴露于高于环境水平的辐射剂量。在一些方面,受试者将要暴露于至少0.3Gy的辐射剂量。在一些方面,受试者将要暴露于至少0.7Gy的辐射剂量。在一些方面,受试者将要暴露于至少6Gy的辐射剂量。在一些方面,受试者将要暴露于至少10Gy的辐射剂量。在一些方面,受试者将要暴露于至少50Gy的辐射剂量。在一些方面,受试者将被暴露于0.3Gy和50Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.7Gy和50Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.3Gy和0.7Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.3Gy和6Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.3Gy和10Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.7Gy和6Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.7Gy和10Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.7Gy和50Gy之间的辐射剂量。在一些方面,受试者将要暴露于0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或约50Gy的辐射剂量。
根据任何所描述的方法治疗受试者的丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量应由本领域技术人员确定。治疗有效量可以是用单剂量治疗受试者所需的量。或者,治疗有效量可以是在慢性或长期的治疗过程中用多于一个剂量(例如多剂量)治疗受试者所需的丹曲林的累积量。
在一些方面,以一剂或两剂施用的丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是1mg/kg至约30mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是1mg/kg至约20mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约5mg/kg至约30mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约10mg/kg至约30mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约15mg/kg至约30mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约20mg/kg至约30mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约5mg/kg至约20mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约5mg/kg至约15mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约5mg/kg至约10mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约10mg/kg至约20mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约2mg/kg至约10mg/kg,优选约2mg/kg至约6mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约15mg/kg至约20mg/kg。在其他方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或约30mg/kg。在一些实施方式中,以一剂或两剂施用的丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量大于30mg/kg,例如30mg/kg至约100mg/kg。在一些方面,丹曲林、丹曲林前药或其药学上可接受的盐的治疗有效量是约35、40、45、50、55、60、65、70、75、80、85、90、95或约100mg/kg。
在本公开的一些方面,在暴露于辐射之后,向受试者施用包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物的时间选择可以影响治疗。
在受试者已经暴露于辐射后,可以以两个或更多个剂量将包含丹曲林、丹曲林前药或其药学上可接受的盐的组合物慢性施用于受试者,也就是说,在两周或更多周例如2、3、4、5、6、7、8周或更多周的过程中。在受试者已经暴露于辐射后,可以以一个或多个剂量将包含丹曲林、丹曲林前药或其药学上可接受的盐的组合物急性施用于受试者,也就是说,在少于两周的过程中,例如,在数小时或数天的过程中,例如,在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时内或者在2、3、4、5、6、7、8、9、10、11、12或13天内。
关于包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物的时间选择,在一些方面,在受试者已经暴露于辐射后24小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后20小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后16小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后12小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后8小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后4小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后2小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后1小时或更短时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者已经暴露于辐射后约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23小时内或在约24小时内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。
关于包含丹曲林前药或其药学上可接受的盐的药物组合物的时间选择,在一些方面,在受试者暴露于辐射之前24小时或更长时间内向受试者施用至少一个剂量的包含丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前20小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前16小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前12小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前8小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前4小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前2小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前1小时或更长时间内向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。在一些方面,在受试者暴露于辐射之前约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或约24小时向受试者施用至少一个剂量的包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物。
尽管在一些方面,包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物可以以一个剂量将治疗有效量的丹曲林(或丹曲林代谢物如5-羟基丹曲林)递送至辐射暴露受试者。在其他方面,可能需要两个或更多个剂量的药物组合物,以将治疗有效量的丹曲林递送至辐射暴露受试者。例如,可能需要2、3、4、5、6、7、8、9或10个剂量的药物组合物,以将治疗有效量的丹曲林递送至辐射暴露受试者。这些额外剂量可以与第一剂量基本上同时施用。在其他方面,额外剂量在时间上与第一剂量分开。在其中施用3个或更多个剂量的那些方面,每个剂量可以在时间上与任何其他剂量的施用分开。
在本公开的一些方面,向辐射暴露受试者施用丹曲林是用于辐射暴露的辅助疗法。暴露于辐射的受试者也可以被施用一种或多种辐射疗法。
包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物可以经静脉内施用。在其他方面,包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物可以透皮施用。在其他方面,包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物经肌肉内施用。在其他方面,包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物可以经骨内施用。在其他方面,包含丹曲林、丹曲林前药或其药学上可接受的盐的药物组合物可以经皮下施用。
用于所述方法的优选药物组合物包括丹曲林、丹曲林前药或其药学上可接受的盐,以及一种或多种药学上可接受的赋形剂。优选的药物组合物包含丹曲林、丹曲林前药或其药学上可接受的盐,甘露糖醇,聚山梨酯(例如聚山梨酯80),聚维酮(例如聚维酮K12),任选的pH调节剂(例如NaOH或HCl)和水。
包含丹曲林或其药学上可接受的盐的特别优选的药物组合物是
与未根据任何所述方法治疗的对照受试者相比,本公开的方法导致受试者由于辐射暴露所致的死亡率降低。
在一些方面,与未根据任何描述的方法进行治疗的对照受试者相比,根据本公开的方法的治疗改善了受试者的至少一个血液学参数。血液学参数包括例如白细胞、红细胞、血红蛋白、血细胞比容、平均红细胞体积(Mean Corpuscular Volume)、平均红细胞血红蛋白(Mean Corpuscular Hemoglobin)、平均红细胞血红蛋白浓度、红细胞分布宽度、血小板、平均血小板体积、差异白细胞计数(绝对值)、嗜中性粒细胞绝对值、淋巴细胞绝对值、单核细胞绝对值、嗜酸性粒细胞绝对值、嗜碱性粒细胞绝对值、网织红细胞百分比和网织红细胞绝对计数。
在一些方面,根据本公开的方法的治疗有效治疗受试者由于辐射暴露而发生的造血综合征。
在一些方面,根据本公开的方法的治疗有效治疗受试者由于辐射暴露而发生的胃肠道综合征。
在一些方面,根据本公开的方法的治疗有效治疗受试者由于辐射暴露而发生的心血管综合征。
在一些方面,根据本公开的方法的治疗有效治疗受试者由于辐射暴露而发生的中枢神经系统综合征。
本公开的化合物的同位素变体也在本公开的范围内。如本文所用,术语“同位素变体”是指一种化合物,其在构成该化合物的一个或多个原子上含有比例大于自然丰度的同位素。例如,化合物的“同位素变体”可以进行放射性标记,即含有一种或多种放射性同位素,或者可以用非放射性同位素例如氘(
具体实施方式
实施例
提供以下实施例来说明本公开内描述的一些概念。尽管每个实施例被认为提供了本公开的特定的个别实施方式,但是所述实施例均不应被认为是对本文所述的更一般实施方式的限制。在下面的实施例中,已努力确保所用数字(例如数量、温度等)的精确性,但应考虑一些实验误差和偏差。
实施例1.辐射剂量研究
研究目标。为了在全身辐照的C57BL/6雄性小鼠造血模型中评价静脉内施用Ryanodex以预防或减轻急性辐射综合征的功效。
辐射和剂量测定。对于全身辐照剂量施用,按照SNBL USA SOP在RS-2000X射线生物辐照仪(Rad Source,Suwanee,GA)中对动物进行辐照。
目标剂量。6.0Gy(根据机构致死率曲线计算的Ld50/30)
目标剂量率。约1.325Gy/min
能量。在25mA下160kV(在具有圆形RAD+的RS-2000室的地板上)
铜过滤器尺寸。0.3mm Cu
离子室。RadCal 2086离子室剂量计
计算。剂量(Gy)=剂量率(Gy/min)×时间(min)
测试物和对照物
测试物。用于可注射悬浮液的
对照物/媒介物。注射用无菌水(不含抑菌剂)。储存在室温(15至25℃)。
制备。使用无菌程序,通过添加5mL不含抑菌剂的无菌注射用水(对照物/媒介物)来重配每个测试物小瓶。重配的悬浮液含有丹曲林钠250mg/5mL(50mg/mL)。通过颠倒混合重配的小瓶以确保橙色均匀悬浮液。将制备的测试物保持在室温(15至25℃)下并在重配6小时内施用。
测试系统
物种和品系。C57BL/6小鼠(小家鼠(Mus musculus))。首次用于实验的动物。雄性。(Charles River Laboratories)
体重范围。适应开始时20至30g
年龄范围。适应开始时10至11周
用于适应的动物数目。120个雄性
用于给药的动物数目。108个雄性
动物护理
圈养。将动物圈养在温度和湿度受控的环境中。温度和相对湿度的目标范围分别在20至26℃和30%至70%之间。在目标湿度范围之外的偏移少于4小时被认为是偶然的并且没有报告。设置了自动照明系统以提供12小时亮/暗周期。
在符合动物福利法(Animal Welfare Act)和《实验动物的护理和使用指南》(美国国家研究委员会2011)和SNBL USA SOP中阐述的建议的笼子中,对动物进行社会性圈养(每个笼子不超过3只)。在研究期间,未将已建立的团体圈养装置内的动物引入到新的社会群体。如果动物显示侵略迹象,则在研究期间将它们单独圈养。每周两次更换草垫和食物,并且使小鼠在辐照后回到干净的笼子里。
饮食和喂养。向动物随意提供PMI的
饮用水。根据SNBL USA SOP制备酸化的饮用水(pH 2.5至3.0),并随意提供给所有动物。例行分析源水中的污染物。预计不会存在任何会干扰研究结果的水平的污染物。源水分析记录将保留在测试设施记录中。
环境富集。在整个研究过程中,根据SNBL USA SOP,向动物提供膳食补充剂和笼富集装置(cage enrichment device)。
兽医治疗。进行了兽医评估,但未对动物施用兽医治疗。使用辐照小鼠评分标准SOP确定发病率。
实验设计
动物的选择。在接收动物之前由兽医对供应商提供的预防性健康数据进行审查和批准。接收后,将动物取出并由畜牧业和研究技术人员进行检查。兽医人员对注意到有任何临床异常的动物进行评估。随机分配110只雄性C57BL/6研究小鼠。随机分配10只备用雄性C57BL/6小鼠。在第0天或之后将备用动物放回库存。
随机化。使用结合体重的分层随机化方案将动物分配到各研究组。
适应期。在辐照之前,使所有动物适应研究室最少14天。从所有动物(包括备用动物)收集适应阶段数据。基于在适应阶段内产生的结果,根据需要用备用动物替换分配动物。在第0天或之后将备用动物从研究中移出。不迟于适应的第二天,动物接受酸化的饮用水。
研究设计。将动物分配到各组并按表1所示进行处理。
表1.组分配
SID:每天一次
辐照准备和程序
动物约束。将有意识的动物放置在位于RS-2000室地板上的圆形饼笼中。
辐照暴露水平和剂量测定。将第1-4组中的动物暴露于通过用X射线辐照器辐照提供的6.0Gy的计算LD50/30水平。在辐照动物之前,在辐照的每一天创建剂量图,并在完成当天所有辐照后再次创建剂量图。剂量图与研究数据一起存档。
施用频率。在第0天早晨对第1-4组的每只动物施用一次辐射。
测试物和对照物的施用
剂量水平。0、20或30mg/kg
施用途径。通过向尾静脉中进行静脉内(IV)团注或经由到尾静脉中的临时导管并随后用0.2mL媒介物冲洗,来对所有组给药。记录给药部位、给药开始时间和给药体积。
施用频率。如正文表1中所述施用测试物。在第0天(第2组,辐照前1小时)、第1天(第1、3和5组)以及第1-5天(第4组和第6组)进行剂量施用。
施用持续时间。如表1所述。
观察与检查
观察性ARS评分。按照SNBL USA SOP进行并记录姿势、皮毛和行为参数的评分,在适应期间(第-1天)一次,在第0天辐照前一次,在第1-29天每天两次,以及在第30天一次。在第1-29天,第一次ARS评分在早晨开始,并且第二次ARS评分在早晨ARS评分完成后的4至6小时开始。第30天的ARS评分发生在早晨,在尸检之前。基于ARS评分SOP,如果三个参数评分的总和为8或更高,则从最后一个剂量的测试物后24小时开始,将动物视为濒死动物并按濒死动物SOP进行处理。施用测试物后至多24小时ARS评分为8或更高的动物不被视为濒死的。
死亡率检查。在第1-29天,在完成各自上午和下午的ARS评分后的2-3小时内开始,每天两次根据SOP进行笼边死亡率检查。通过重新评分仅记录明显的濒死动物的个体评估,或通过清除对发现的死亡动物进行个体评估。必要时,进行额外的死亡率检查。
体重。在适应期间,每只动物称重两次,辐照前第0天称重一次,此后每3天称重一次。必要时,可进行额外体重称重。
采血程序
表2.标本采集
血液采集和处理。如表2所述,在按计划的期中尸检中采集血液。
临床病理学
血液学。
动物/组。第1-4组的每个子集的前3只动物。
最小样品体积。0.3mL血液
管类型。0.5mL K2EDTA BD MAP管
分析方法。使用Advia自动分析仪确定血液学参数。在辐照后第7天和第30天评估血液学参数。
参数。
白细胞
红细胞
血红蛋白
血细胞比容
平均红细胞体积
平均红细胞血红蛋白
平均红细胞血红蛋白浓度
红细胞分布宽度
血小板
平均血小板体积
差异白细胞计数(绝对值)
嗜中性粒细胞绝对值
淋巴细胞绝对值
单核细胞绝对值
嗜酸性粒细胞绝对值
嗜碱性粒细胞绝对值
网织红细胞百分比
网织红细胞绝对计数
处置。在分析之前,残留的EDTA处理过的样品在2至8℃下储存至多24小时,并且在分析后被丢弃。
终末程序和病理学
按计划的尸检。在尸检当天,记录第1-4组中存活的动物的终末体重,并按照SNBLUSA SOP进行麻醉,接着根据本文所述的方法采集血液。通过放血使动物安乐死并进行尸检。对第5-6组的动物实施安乐死并丢弃,无需尸检。
非按计划的尸检。记录获准实施安乐死的第1-4组的动物的终末体重,并根据SNBLUSA SOP进行麻醉。如果可能,通过放血对动物实施安乐死并进行尸检。必要时,在尸检之前对动物实施安乐死并冷藏。对获准实施安乐死的第5-6组动物进行安乐死并丢弃,无需尸检。
发现的死亡动物。对发现的死亡动物进行称重,并在24小时内进行尸检。必要时,在尸检之前将动物冷藏。
大体病理学。在尸检期间对所有动物进行全面检查。从所有按计划和非按计划动物采集两个股骨骨髓涂片。没有从发现死亡的动物或尸检之前冷藏的动物采集骨髓涂片。必要时,根据需要将骨髓涂片检查并入研究方案中。
器官重量。仅在按计划的尸检中记录动物的器官重量。相对器官重量计算为最终体重和脑重量的百分比。关于待称重的组织列表,参见表3。
组织收集和保存。从所有动物收集表3中列出的组织,并固定以进行可能的组织病理学检查。除了睾丸用改良戴维森氏液(Modified Davidson's Fluid,MDF)固定之外,所有组织都用10%NBF固定。
表3.组织收集
--=不适用
√=适用
报告
统计分析。SNBL USA提供了来自按计划动物的所有数值数据的摘要统计信息(平均值和标准差)。使用原始数据的全精度进行计算。每组按计划动物数目少于三只的时间点的数据未进行统计分析。没有按计划对照数据的时间点的数据未进行统计分析。使用Kaplan-Meier估计值,在研究过程中整体计算以及对每个剂量组计算存活率。
结果
由于骨髓抑制和血细胞毒性,血液学参数在全身辐照后第7天达到最低值。在辐照后30天评估恢复。
总体而言,用Ryanodex治疗的动物比对照活得更长,并且相比于未处理动物显示出改善的绝对WBC、嗜中性粒细胞、淋巴细胞和血小板计数。(参见图1-5)。
此外,如图6-7所示,在用Ryanodex治疗的动物中,在第7天和第30天对血红蛋白(HgB)和血细胞比容(HCT)进行测量。
从辐照后第3天至第30天,对于用以下处理的动物评估平均体重变化百分比:对照(例如无菌水);Ryanodex,辐照前;Ryanodex,辐照后,单剂量;以及多剂量的Ryanodex,辐照后第1-5天(参见图8A-8C)。
从辐照后第1天至第30天,对于用以下处理的动物评估平均组死亡率评分:对照媒介物(无菌水);Ryanodex,辐照前1小时;Ryanodex,辐照后第1天;以及Ryanodex,辐照后第1-5天。参见图9A-9C。
实施例2.
将丹曲林钠(1当量)溶解在无水二甲基甲酰胺中。加入试剂3(1当量),并将反应混合物在氮气下在60℃下搅拌。4小时后,加入另一当量的试剂3,并将反应物在60℃下搅拌过夜。然后将反应物用乙酸乙酯稀释,并用饱和氯化钠洗涤两次。分离各层。有机层经硫酸钠干燥并真空浓缩。使用硅胶色谱法纯化粗产物。分离出所需产物,纯度为90-95%。
实施例3.
在环境温度下,将化合物4的样品用1ml的三氟乙酸/水的9/1混合物处理20-30分钟。立即使用高真空除去过量的TFA,并通过过滤收集所得固体,用水(5ml)洗涤并风干。通过LC/MS分析起始原料、反应混合物和最终产物,以确定在脱保护条件期间是否有2复原为丹曲林。没有观察到2复原为丹曲林。产物的
实施例4.
将50mg的2与3ml甲醇混合(完全溶解),并施加到1g Na+离子交换柱上。所述化合物用甲醇洗脱,并且在冻干后得到18mg(36%回收率)的橙色固体。将该物质溶解在水中,并通过在搅拌下加入0.1MNaOH的小等分试样而小心滴定至pH 8.5。然后将溶液冻干,得到橙色固体,化合物2a。冻干前后样品的LC/MS相同,这表明在离子交换期间未发生复原为丹曲林。产物的
实施例5.2b的制备
在室温下,向搅拌的2(100mg,0.23mmol)于水(12mL,HPLC级)中的悬浮液中滴加溶于水(5mL)中的Tris(5,57mg,0.47mmol)。最终溶液的pH为6.6。将溶液过滤,并将滤液冻干过夜,得到呈黄色固体形式的标题化合物2b(150mg,95%)。MS(CI)m/z=424.9[M]+。
实施例6.
步骤1:1a用P
步骤2:向7(1.35g,4.29mmol)于水(45mL)中的悬浮液中加入福尔马林(4.35mL,57.45mmol,37%甲醛水溶液),接着加入K
步骤3:在0℃下,向9(615mg,1.78mmol)于DMF:丙酮(40mL,15:25mL)中的溶液中缓慢加入PCl
实施例7.
步骤1:1a用P
步骤2:向7(90mg,0.28mmol)于水(2.6mL)中的悬浮液中加入福尔马林(0.29mL,3.83mmol,37%甲醛水溶液),接着加入K
实施例8.
步骤1:将无水DMF(0.8mL,10.33mmol)溶解在无水四氢呋喃(13mL)中。将该溶液滴加到溶解在四氢呋喃(9mL)中的亚硫酰氯(0.75mL,10.33mmol)的搅拌溶液中,并在冰浴中冷却。完全添加并在冰上30分钟后,移去冰浴,立即添加固体N-羟基琥珀酰亚胺(832mg,7.23mmol)(其完全溶解),接着加入固体预粉状吗啉乙酸(1.0g,6.88mmol)。吗啉乙酸缓慢溶解,得到均匀溶液,该溶液迅速变浑浊。将反应物在室温下剧烈搅拌过夜。用四氢呋喃洗涤白色固体,并在真空下干燥,得到呈白色固体形式的所需化合物11(1.6g,96%)。
步骤2:向9(660mg,1.92mmol)和11(928mg,3.83mmol)于无水DMF(12mL)中的溶液中加入三乙胺(0.39mL,2.8mmol)。将所得混合物在60℃下搅拌过夜。将反应混合物冷却至室温,并通过使用乙腈-水作为洗脱剂的反相柱色谱法纯化。通过HPLC分析柱级分,并将含有产物的级分冻干,得到具有50%纯度的粗化合物。通过使用乙腈-水的制备型HPLC再次纯化该粗产物。将纯级分冻干,得到呈黄色固体形式的标题化合物10(100mg,10%)。
步骤3:在室温下,向搅拌的10(75mg,0.16mmol)于无水1,4-二
MS(CI)m/z=472.1[M]
实施例9.
步骤1:在0℃下,向K
步骤2:1a用P
步骤3:向16(340mg,0.68mmol)于CH
步骤4:在室温下,向搅拌的6(260mg,0.58mmol)于水(36mL,HPLC级)的悬浮液中以400μL等分试样加入0.1N NaOH(5.85mL,0.58mmol),然后立即快速涡旋。最终溶液的pH为6.73。将溶液过滤,并将滤液冻干过夜,得到呈黄色固体形式的标题化合物12a(150mg,55%)。MS(CI)m/z=445.1[M]
实施例10.
步骤1:向化合物9(500mg,1.45mmol)于无水DMF(10mL)中的溶液中加入含化合物18(488mg,1.85mmol)的DMF(2mL),接着加入TEA(0.3mL,2.2mmol)。将所得混合物在室温下搅拌16小时。混合物用EtOAc(50mL)稀释,用水(2×15mL)洗涤。有机层经无水Na
步骤2:向化合物19(200mg,0.32mmol)于MeOH:1,4-二
步骤3:向化合物20(120mg,0.24mmol)和化合物21(26.4mg,0.26mmol)于间二甲苯:1,4-二
步骤4:在室温下,向搅拌的17(5mg,8.4μmol)于水(3mL,HPLC级)中的悬浮液中滴加0.1N Tris(90μL,8.9μmol)。将混合物在室温下搅拌3小时。将溶液过滤,并将滤液冻干过夜,得到呈黄色固体形式的标题化合物17b(6mg,100%)。MS(CI)m/z=594.1[M]
实施例11.
步骤1:在室温下,向23(2.5g,14.28mmol)于DMF(30mL)中的混合物中加入三乙胺(3.47mL,24.93mmol),接着加入24(3.92mL,53.9mmol)。将所得混合物在室温下搅拌40小时。用EtOAc(100mL)和水(50mL)稀释混合物。用水(2×25mL)、5%NaHCO
步骤2:1a用P
步骤3:在室温下,向搅拌的26(210mg,0.41mmol)于无水1,4-二
本文引用的每一个专利、专利申请和出版物的公开内容通过引用整体并入本文。
本领域技术人员应理解,可以对本发明的优选实施方式进行多种改变和修改,并且可以在不脱离本发明的精神的情况下进行这样的改变和修改。因此,意图是权利要求涵盖落入本发明的真实精神和范围内的所有这样的等同变化。
- 丹曲林和丹曲林前药用于治疗辐射暴露的用途
- 丹曲林前药及其用法
