一种超声扰动Piezo1蛋白质的分子动力学模拟分析方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于超声扰动、分子动力学模拟领域,具体涉及一种基于超声扰动的Piezo1蛋白质的分子动力学模拟分析方法。
背景技术
机械敏感离子通道蛋白是一类将机械信号转换为生理信号的蛋白质,在人类的生命活动中扮演着十分重要的角色。其中Piezo机械敏感离子通道是迄今为止发现的最大的机械敏感离子通道蛋白,包括Piezo1和Piezo2两个成员。
Piezo1感受机械力,释放阳离子,诱导细胞激活和信号的传输,参与调解血压等众多生理过程。2018年,Prieto及其同事通过膜片钳技术发现Piezo1对43Mhz和50W/cm2或90W/cm2的连续超声声流引起的细胞膜应力存在激活响应;最近廖等人也发现了激活Piezo1机械敏感离子通道和细胞内钙反应的最佳超声脉冲长度。研究超声扰动下的Piezo1机械敏感离子通道的响应机理,对未来超声治疗以及相关药物设计具有十分重要的意义。
目前分子动力学模拟在研究细胞内分子机理方面得到了广泛的应用。受限于计算资源,使用全原子分子动力学方法研究对于像Piezo1这样超过7000多个氨基酸的蛋白质体系较为困难。为了在有限计算资源下进行跨越微秒到毫秒时间尺度的分子动力学模拟,探究涉及上百万原子的蛋白质构象变化,采取粗粒化建模更能提高模拟效率。
文献[De Vecchis D,Beech D J,Kalli A C.Molecular dynamics simulationsof Piezo1 channel opening by increases in membrane tension[J].BiophysicalJournal,2021,120(8):1510-21.]通过对膜施加横向压力揭示了Piezo1通道可能响应膜张力增加而打开的分子机理;文献[Botello-Smith W M,Jiang W,Zhang H,et al.Amechanism for the activation of the mechanosensitive Piezo1 channel by thesmall molecule Yoda1[J].Nature Communications,2019,10(1):4503.]找到Yoda1结合位点以及提出Yoda1促进力诱导构象改变的分子机制。然而尚未有人使用超声作为机械力通过使用分子动力学模拟方法研究Piezo1。本发明首次采用一种超声扰动的分子动力学模拟方法研究Piezo1蛋白构象的变化,通过模拟研究超声波对细胞膜的影响,进一步模拟超声波对Piezo1蛋白质构象的影响。这种超声扰动机械敏感离子通道蛋白的粗粒化分子动力学模拟方法是对现有方法的重要拓展,为声遗传学应用提供重要的研究思路。
发明内容
本发明旨在解决模拟超声扰动下的Piezo1蛋白现有技术的问题,提出一种在超声扰动的Piezo1的分子动力学模拟分析方法,具体为使用对细胞膜加载不同频率的超声波,拓展了Piezo1的研究方法。
鉴于此,本发明采用的技术方案如下:一种超声扰动Piezo1蛋白质的分子动力学模拟分析方法,包括以下步骤:
步骤一,建立超声波模型,并将其耦合到Gromacs软件中;
步骤二,对蛋白质缺失氨基酸进行补全,并且将其粗粒化后插入到细胞膜中,使用步骤一所述超声模型进行分子动力学模拟分析。
进一步,所述超声波模型为建立6个大小相同、方向不同的超声波速度,速度产生于立体盒子六个面的边缘,每个面的速度产生有一定的时间间隔;6个超声波速度定义如下:
V
进一步,对蛋白质特定缺失小片段区域编写脚本进行缺失氨基酸补全,并使用4对1映射进行粗粒化,将粗粒化后的蛋白质结构嵌入到细胞膜中,构建合适的具有周期性边界的模拟盒子,采用前述超声模型进行超声扰动分子动力学模拟。
进一步,所述分子动力学模拟分析包括:
观察分析细胞膜的形态变化,包括膜厚度和膜面积的变化;
分析膜成分和蛋白质的相互作用时间;
分析蛋白质构象的变化,在超声扰动下细胞变化引起了膜成分和蛋白质的相互作用进一步引起了导致构象的变化。
进一步地,所述膜厚度的计算:首先识别细胞膜内外小叶的脂质,通过识别脂质头组密度的峰间距离Z来计算细胞膜厚度随模拟时间的变化。
进一步地,所述膜面积通过2D Voronoi镶嵌计算,使用Freud的局部模块执行原子位置的镶嵌。
进一步地,所述膜成分和蛋白质的相互作用时间,通过识别蛋白质和膜成分相互作用位点,计算响应位点的停留时间来判断该位点为强相互作用还是若相互作用。
脂质(即膜成分)和蛋白质结合位点的计算:同时与同一脂质分子结合的一组残基,pylipid将一个距离向量,记录每个残基与所有脂质分子的距离作为时间的函数,并且构建一个脂质相互作用网络,其节点是蛋白质残基,权重是它们的距离向量计算的残基对的Pearson相关系数。
相互作用停留时间:由于脂质和蛋白质相互作用,则脂质是不在扩散的。因此pylipid使用双指数计算停留时间来解释脂质松弛的长短衰减,停留时间为
进一步地,所述蛋白质构象的变化,通过脚本计算Piezo1蛋白质在膜中形成的穹顶深度和绘制蛋白质在xy面的二维密度图来观察Piezo1在超声扰动下的结构变化。
本发明还提供一种计算机可读存储介质,该计算机可读存储介质上存储有计算机程序,该计算机程序被处理器执行时实现如前所述的超声扰动Piezo1蛋白质的分子动力学模拟分析方法。
本发明具有以下优点:
(1)本发明首次采用超声扰动粗粒化分子动力学模拟的方法来研究Piezo1机械敏感离子通道,能够观察较长时间内的构象变化;通过分析细胞膜厚度、蛋白质脂质相互作用等多角度阐释超声波对细胞膜的影响,进一步研究细胞膜对Piezo1蛋白的影响。
(2)建立了从整体到局部的分析方法,即通过观察细胞膜的变化,研究细胞膜脂质和蛋白质的相互作用,探讨蛋白质结构变化。
(3)通过计算机模拟超声扰动Piezo1蛋白,可以为电生理实验提供许多实验上难以获得的细节,为未来超声治疗Piezo1相关疾病提供一定的理论指导。
附图说明
图1为蛋白质粗粒化结构图;
图2为蛋白质嵌入细胞膜模型图;
图3为超声扰动下水密度图;
图4为不同超声扰动下细胞膜厚度图;
图5为蛋白质脂质相互作用位点图;
图6蛋白质RMSD图;
图7为蛋白质密度和穹顶深度图;
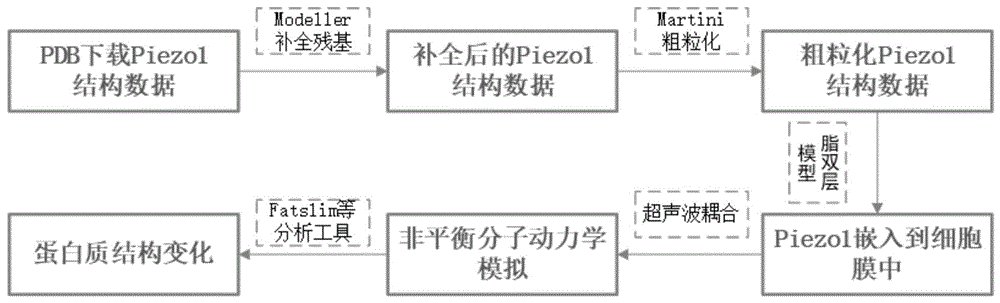
图8为本发明的整体流程框架图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、详细地描述。所描述的实施例仅仅是本发明的一部分实施例。
以下结合附图,对本发明做进一步说明:
如图8所示,一种基于超声扰动的Piezo1蛋白质的分子动力学模拟分析方法,其包括以下步骤:
步骤一:使用蛋白质三维结构比较建模工具Modeller对Piezo1蛋白质进行缺失氨基酸补全。
步骤二:使用Martini粗粒化工具martinize.py对蛋白质进行粗粒化,并使用insane.py工具构建粗粒化细胞膜,然后将粗粒化后的蛋白质插入到该细胞膜中。
步骤三:将超声波模型耦合到GROMACS软件中,通过横向水密度的波动来验证超声波的成功加载,并且计算相应的频率。
步骤四:参考Prieto等人研究证明的的Piezo1超声响应频率,拟模拟10Mhz、20Mhz和35Mhz不同频率的超声波扰动Piezo1蛋白质体系,并与非超声扰动模拟体系进行对比。
步骤五:对上述分子动力学模拟的轨迹进行分析。包括使用lipyphilic工具对细胞膜形态、成分进行分析,使用pylipid对脂质和蛋白质相互作用分析,使用gromacs自带的分析工具对蛋白质结构分析等。
进一步的,所述步骤一:使用蛋白质三维结构比较建模工具Modeller对Piezo1蛋白质进行缺失氨基酸补全:首先从PDB数据库下载的Piezo1多聚体蛋白质,其次通过编写脚本调用蛋白质三维结构比较建模工具Modeller对蛋白质进行序列比对和残基补全,之后在Modeller软件包中以PDB数据中的Piezo1蛋白质三维结构为模板进行结构优化,以确保补全的残基拥有较为正确的蛋白质三级结构,最终蛋白质模型的每条链包含577-717、782-1365、1493-1578、1655-1807和1952-2547片段。
进一步的,所述步骤二:用Martini粗粒化工具martinize.py对蛋白质进行粗粒化,并使用insane.py工具构建粗粒化细胞膜,并将粗粒化后的蛋白质插入到该细胞膜中:首先先将步骤一获得蛋白质三级结构使用Martini粗粒化工具martinize.py对Piezo1蛋白质进行粗粒化,其粗粒化结构如图1;其次使用构建insane.py工具构建粗粒化膜,同时将粗粒化的蛋白质插入到细胞膜中,建立40×40×40nm
进一步的,所述步骤三:使用超声波模型耦合到GROMACS软件中,通过绘制X轴水密度来验证超声波的成功加载,并且计算响应的频率:首先建立超声波模型,产生六个面的冲击波分别照射六个面,其每个超声速度定义如下公式(1)和公式(2),其次建立30×30×30nm
V
图3表示在X轴2nm、4nm、6nm、8nm处的水密度随时间的变化图,在每个X轴的位置处均呈现完整的周期性,说明超声成功加载,并且从不同的X轴的位置的波峰可以看出超声也沿着X轴进行传播。
进一步的,所述步骤四:构建非超声扰动模拟体系和10Mhz、20Mhz、35Mhz超声扰动模拟体系,使用Gromacs软件进行分子动力学模拟:首先使用步骤3的超声模型建立10Mhz、20Mhz、35Mhz的超声扰动模拟体系以及建立非超声扰动模拟体系;其次将这四个模拟体系均进行能量最小化,之后使用NPT系综对四个体系进行500ns平衡,最后使用NPT系综对四个体系进行5us动力学模拟。
进一步的,所述步骤五:对分子动力学模拟轨迹分,包括使用lipyphilic工具对细胞膜形态、成分分析、使用pylipid对脂质和蛋白质相互作用分析、使用GROMACS自带的分析工具对蛋白质结构分析:首先使用lipyphilic工具对细胞膜的膜厚度和每个脂质面积进行分析,其次使用pylipid工具计算各类脂质和蛋白质之间的结合位点、脂质与结合位点和单个氨基酸残基相互作用的停留时间,最后使用GROMACS自带工具分析蛋白结构变化。
膜厚度的计算:首先识别细胞膜内外小叶的脂质,通过识别脂质头组密度的峰间距离Z来计算细胞膜厚度随模拟时间的变化,如图4。
脂质和蛋白质结合位点的计算:同时与同一脂质分子结合的一组残基,pylipid将一个距离向量记录每个残基与所有脂质分子的距离作为时间的函数,并且构建一个脂质相互作用网络,其节点是蛋白质残基,权重是它们的距离向量计算的残基对的Pearson相关系数。
相互作用停留时间:由于脂质和蛋白质相互作用,则脂质是不在扩散的。因此pylipid使用双指数计算停留时间来解释脂质松弛的长短衰减,停留时间为
蛋白质RMSD图计算:使用gromacs自带的rmsd计算工具rms,通过将后续模拟帧的蛋白质结构和第一帧的蛋白质进行比较,其结果如图6所示。
蛋白质密度和穹顶深度:蛋白质密度借助gromacs自带的分子工具densmap,将蛋白质拟合到参考结构蛋白质中央孔区域(残基2105-2547);其穹顶深度借助相应的脚本进行绘制。其结果如图7所示。
