使用材料支架的增强的哺乳动物细胞病毒转导
文献发布时间:2023-06-19 19:30:30
本发明是根据国立卫生研究院(National Institutes of Health)授予的授权号UL1TR002489在政府支持下进行的。政府享有本发明的一定权利。
本申请要求于2020年4月10日提交的美国临时申请第63/008,069号的权益,所述申请通过引用整体并入本文。
背景技术
过继性T细胞疗法利用和重定向患者自身的免疫系统,并且已成为治疗癌症和各种其它疾病的极具前景的个性化治疗方式。最成功的实例是于2017年获得FDA批准的靶向由B细胞衍生的恶性肿瘤表达的CD19的嵌合抗原受体重定向T细胞(CAR-T细胞)的过继性转移。随着CD19特异性CAR-T细胞疗法的引人注目的成功,目前正在努力将CAR-T细胞的应用范围扩大到其它癌症类型。当前CAR-T细胞疗法的关键步骤之一是对T细胞进行体外基因修饰,这赋予T细胞CAR分子的稳定表达,从而将T细胞特异性重定向至肿瘤抗原。
正在探索多种不同的方法来进行离体T细胞基因工程化。其中,基于慢病毒或逆转录病毒载体(RV)的基因转移代表了最成功的方法。当RV用于生成CAR-T细胞时,从患者分离的T细胞首先被激动性抗CD3和抗CD28抗体刺激,并且然后与RV一起温育,因为静止的T细胞对于RV介导的插入是难治性的。由于RV颗粒可以通过布朗运动(Brownian motion)在溶液中传播的距离较短(在一个半衰期内小于600μm),必须在存在转导促进剂的情况下通过离心或旋转接种(spinoculation)使激活的T细胞与RV接触。如聚凝胺和硫酸鱼精蛋白等转导促进剂已经得到了适度成功的应用,而重组纤连蛋白片段CH296(Retronectin)是临床上应用最广泛的RV转导促进剂。retronectin通过其肝素结合结构域与RV结合,并且通过CS-1/RGD结构域与T细胞结合,从而将细胞和RV结合在一起并且促进基因转移。必须在固体表面(如聚苯乙烯板、烧瓶或袋)上预涂覆retronectin,以有效地共同定位RV和T细胞。即使如此,在被动/静态条件下,基因转移和随后的CAR表达仍然是次优的。为了实现高基因表达,将RV接种在涂覆有retronectin的表面上,并且将细胞离心,以使其集中在同一表面上。此类retronectin辅助的旋转接种具有规模限制和显著成本。此外,retronectin是重组蛋白,并且其天然具有生物活性,可以影响细胞的分化和增殖。因此,当RV或其它病毒载体用作基因传递系统时,开发更高效的培养系统,使得T细胞能够在静态条件下进行单在步骤体外处理而无需retronectin或旋转接种,将大大降低CAR-T细胞制造的成本。
发明内容
公开了经修饰的水凝胶或干支架和其在转化细胞以制备例如嵌合抗原受体细胞和治疗癌症中的用途。
在一个方面,本文公开了生物相容性水凝胶基质和/或干支架(例如,包括海藻酸盐的干支架或水凝胶),所述水凝胶基质和/或干支架包括对T细胞受体和/或NK细胞受体具有特异性的一种或多种配体或抗体(包含但不限于抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)。所公开的水凝胶基质和/或干支架可以是用于转导细胞(例如,免疫细胞,包含但不限于T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润NK细胞(TINK)和/或骨髓浸润淋巴细胞(MIL),以及非免疫细胞,例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞)以及制备嵌合抗原受体(CAR)细胞的支架。另外,所述支架可以出于基础研究的目的用于转导癌细胞或任何其它细胞类型。因此,在一个方面,水凝胶基质和/或干支架可以包括载体(例如,慢病毒、逆转录病毒、腺病毒、腺相关病毒、病毒样颗粒、细胞模拟颗粒、转座子、外显子、纳米颗粒、胶束或脂质体),所述载体编码和/或包封外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA,例如,嵌合抗原受体(CAR)基因)。
本文还公开了根据任何前述方面所述的水凝胶基质和/或干支架,其进一步包括激活T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润NK细胞(TINK)或骨髓浸润淋巴细胞(MIL)的一种或多种抗体、细胞因子(例如,IL-2、TNF-α或IFN-γ)和/或共刺激分子。所述水凝胶基质和/或干支架还包括通过T细胞、NK细胞或NK T细胞共刺激受体诱导信号传导的配体或抗体,所述配体或抗体包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。
在一个方面,本文公开了根据任何前述方面所述的水凝胶基质和/或干支架,其进一步包括化疗剂。
本文还公开了治疗、抑制、减少、降低、改善和/或预防受试者的疾病或病状(例如,癌症或转移或移植物抗宿主病(GVHD)、心肌梗塞、缺血、骨/软骨损伤、骨关节炎、癫痫、血友病、严重成骨不全、威斯科特-奥尔德里奇综合征、X连锁严重组合免疫缺陷、β-地中海贫血、肾上腺脑白质营养不良(ALD)、异染性脑白质营养不良(MLD)、癌症或帕金森氏病(Parkinson's disease))的方法,所述方法包括向所述受试者施用根据任何前述方面所述的水凝胶和/或干支架。因此,在一个方面,本文公开了治疗、减少、抑制、改善、降低和/或预防受试者的癌症和/或转移的方法,所述方法包括:a)获得细胞(例如,免疫细胞,包含但不限于T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润NK细胞(TINK)或骨髓浸润淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)和载体(例如,慢病毒、逆转录病毒、腺病毒、腺相关病毒、病毒样颗粒、细胞模拟颗粒、转座子、外显子、纳米颗粒、胶束或脂质体),所述载体编码外源基因(例如,嵌合抗原受体);b)将所述细胞和载体应用支架(例如,生物相容性水凝胶基质和/或干支架,包含但不限于海藻酸盐);c)将所述免疫细胞与水凝胶和/或与干支架一起温育,持续1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天或14天;以及d)在有或没有步骤c中的温育的情况下,向所述受试者施用具有所述细胞的所述水凝胶和/或干支架,或者向所述受试者施用已经与所述水凝胶和/或干支架一起温育的所述细胞。在一些方面,所述支架进一步包括T细胞受体或NK细胞受体的配体或抗体(包含但不限于抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)。因此,在一个方面,本文公开了根据任何前述方面所述的治疗、抑制、减少、降低、改善和/或预防受试者的癌症或转移的方法,其中所述支架(水凝胶基质和/或干支架)中的所述载体转导所述细胞,并且在1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、24天、25天、26天、27天、28天、29天、30天、31天、32天、45天、58天、59天、60天、61天、62天、90天、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月、24个月、36个月、4年、5年、6年、7年、8年、9年、10年的时间段内施用所述支架后,所述支架中的经转导的细胞可以释放到受试者体内的癌症位点处。在一个方面,所述细胞在施用所述水凝胶和/或干支架后约1周至约12周从所述水凝胶中释放。
在一个方面,本文公开了根据任何前述方面所述的治疗、抑制、减少、降低、改善和/或预防受试者的癌症或转移的方法,其中所述支架进一步包括抗癌剂(例如,免疫阻断抑制剂或化疗剂)。
本文还公开了转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、肿瘤浸润淋巴细胞(TIL)、巨噬细胞、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞),包含免疫和非免疫原代细胞,以及细胞系)的方法,以及制备嵌合抗原受体免疫细胞的方法,所述方法包括:a)获得细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、肿瘤浸润淋巴细胞(TIL)、巨噬细胞、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞),包含免疫和非免疫原代细胞,以及细胞系)和载体,所述载体编码和/或包封外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA,例如,嵌合抗原受体(CAR)基因;以及b)将所述细胞应用于支架(例如,生物相容性水凝胶基质和/或干支架,例如,包括海藻酸盐的水凝胶或支架)并且将所述支架、细胞和载体一起温育。在一些方面,所述支架进一步包括T细胞受体或NK细胞受体的配体或抗体(包含但不限于抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)。所述支架、细胞和载体的温育可以发生持续1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天或14天,或者可替代地,在没有温育的情况下植入所述支架和细胞。
在一个方面,本文公开了根据任何前述方面所述的转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、肿瘤浸润淋巴细胞(TIL)、巨噬细胞、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞)、原代细胞或细胞系)的方法,以及根据任何前述方面所述的制备嵌合抗原受体免疫细胞的方法,其中所述细胞是原初细胞,并且其中所述支架进一步包括通过T细胞、NK细胞或NK T细胞共刺激受体诱导信号传导的配体或抗体,所述配体或抗体包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。
本文还公开了根据任何前述方面所述的转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、肿瘤浸润淋巴细胞(TIL)、巨噬细胞、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞),包含免疫和非免疫原代细胞,以及细胞系)的方法,以及根据任何前述方面所述的制备嵌合抗原受体免疫细胞的方法,其中所述支架进一步包括一种或多种细胞因子(例如,IL-2、TNF-α和/或IFN-γ)。
附图说明
并入本说明书中并且构成本说明书的一部分的附图展示了若干实施例,并且与描述一起展示了所公开的组合物和方法。
图1A、1B、1C、1D、1E、1F和1G示出了干大孔支架介导人激活T细胞的逆转录病毒转导。图1A示出了制备大孔海藻酸盐支架的示意图。图1B和1C示出了干大孔支架的SEM图像。图1D示出了接种在干燥的大孔支架上的用逆转录病毒转导的激活的T细胞中的GFP表达(红色)以及通过旋转接种而接种在retronectin涂覆的板上的用逆转录病毒转导的激活的T细胞中的GFP表达(蓝色)。非转导的对照细胞用黑色表示。图1E示出了干纳米多孔支架的SEM图像。图1F示出了用接种在干大孔支架(红色)、水合大孔支架(紫色)和干纳米多孔支架(绿色)上的逆转录病毒转导的T细胞中的GFP表达。对照非转导细胞用黑色表示。图1G示出了GFP
图2A、2B、2C、2D、2E、2F和2G示出了支架生成的CD19.CAR-T细胞在体外示出与retronectin/旋转接种衍生的CAR-T细胞类似的功能活性。图2A示出了与非转导的对照T细胞(NT细胞)相比,在retronectin涂覆的板上或在大孔支架上转导的T细胞中的CD19.CAR表达。图2B示出了在retronectin涂覆的板上或在大孔支架或NT细胞上转导的T细胞的离体扩增。图2C和2D示出了在培养的第12天通过支架介导的或retronectin/旋转接种介导的转导获得的CAR-T细胞和NT细胞的免疫表型组成。对除了NT细胞之外的表达CAR的T细胞进行门控分析。图2E示出了CD19
图3A示出了转导后第3天以各种MOI(1、2、4)用编码逆转录病毒载体的GFP转导的T细胞的FACS分析。以各种MOI在retronectin涂覆的板或支架上用编码逆转录病毒的GFP转导T细胞,并且通过流式细胞术分析GFP表达。
图3B示出了转导后第5天和第9天的T细胞的FACS分析。在retronectin涂覆的板或支架上用编码逆转录病毒的CD19.CAR转导来自三个不同供体的T细胞,并且通过流式细胞术分析CAR表达。
图4示出了来自3个不同供体的CAR-T细胞中的CD4/CD8、CD45RA/CCR7、CD62L/CCR7表达,这些细胞通过支架或retronectin介导的转导产生。对除了NT细胞之外的表达CAR的细胞进行门控分析。
图5示出了来自3个不同供体的CAR-T细胞中的PD-1/LAG3表达(耗竭标志物),这些细胞通过支架或retronectin介导的转导产生。对除了NT细胞之外的表达CAR的细胞进行门控分析。
图6示出了由支架介导的转导产生的CAR-T细胞显示出对CD19+肿瘤细胞的毒性。将CD19+肿瘤细胞以1:5的E:T比率(左图)和1:2的E:T比率(右图)与对照非转导细胞(NT细胞)或由支架介导的转导或retronectin辅助的旋转接种产生的CD19.CAR-T细胞共培养,并且在共培养的第5天通过FACS进行分析。
图7示出了由支架介导的转导产生的CAR-T细胞保留了抗原特异性,并且其对CD19-U937肿瘤细胞没有作用。将CD19-肿瘤细胞以1:5的E:T比率与对照非转导细胞(NT细胞)或由支架介导的转导或retronectin辅助的旋转接种产生的CD19.CAR-T细胞共培养,并且在共培养的第5天通过FACS进行分析。
图8A、8B、8C、8D和8E示出了支架产生的CD19.CAR-T细胞在小鼠淋巴瘤异种移植模型中根除肿瘤。图8A示出了使用FfLuc标记的CD19
图9示出了在第0天用表达荧光素的Daudi细胞接种并且然后在肿瘤接种后第4天用非转导细胞(NT细胞)处理或用通过支架介导的转导或retronectin辅助的旋转接种产生的CD.19CAR-T细胞处理的NSG小鼠的IVIS图像。
图10A示出了DBCO-PEG
图10B和10C示出了DBCO缀合抗体的UV吸收光谱,其在309nm处示出明显的DBCO吸收峰。
图10D示出了叠氮化物修饰的海藻酸盐的合成方案。
图10E示出了每个海藻酸盐链的叠氮化物数量的定量。
图11A、11B、11C、11D、11E、11F和11G示出MASTER(在本文中也被称为CCI-Alg)促进原代人T细胞的激活和逆转录病毒介导的转导。图11A示出了MASTER的合成的示意图。图11B示出了显示整个支架的均质大孔结构的MASTER的SEM图像。图11C示出了描绘细胞沿孔的分布的AF647标记的MASTER中的GFP
图12A和12B示出了示出在10X(12A)和40X(12B)放大下的AF647标记的MASTER中GFP
图13A、13B、13C、13D、13E、13F、13G和13H示出了MASTER介导的基因转移产生高功能性CAR-T细胞。图13A示出了描绘在MASTER上转导的T细胞中的CD19.CAR表达的流式细胞术图。图13B和13C示出了在培养的第12天通过MASTER介导的PBMC的转导或通过激活的T细胞的常规旋转接种获得的CAR-T细胞的免疫表型组成。非转导(NT)细胞用作对照。对除了NT细胞之外的表达CAR的T细胞进行门控分析。图13D示出了表达PD-1和/或LAG-3的CAR
图14示出了转导后第3天和第10天的T细胞的FACS分析。在MASTER上用编码γ逆转录病毒的CD19.CAR转导来自三个不同供体的T细胞,并且通过流式细胞术分析CAR表达。
图15示出了来自3个不同供体的通过MASTER或通过旋转接种产生的CAR-T细胞中的CD4/CD8、CD45RA/CCR7、CD62L/CCR7和PD-1/LAG3表达。对除了NT细胞之外的表达CAR的细胞进行分析。
图16A和16B示出了通过MASTER介导的转导产生的CAR-T细胞对CD19
图17A和17B示出了MASTER作为有效的T细胞释放系统发挥作用。图17A示出了体外释放研究的示意图。图17B示出了从支架中释放的细胞的百分比。
图18A、18B、18C、189D、18E、18F、18G、18H和18I示出了皮下植入的MASTER在淋巴瘤异种移植模型中产生并释放完全功能的CAR-T细胞。图18A示出了移植有FFLuc标记的CD19
图19A、19B和19C示出了用NT细胞(19A)、MASTER(19B)或静脉内输注CAR T细胞(19C)处理的小鼠的个体肿瘤生长曲线。每条线表示一只动物。示出了每个治疗条件下九只小鼠的数据。
图20示出了检测血液、BM或脾脏中的CAR+细胞的门控策略。
图21A示出了示出肿瘤细胞接种后第32天从小鼠(n=3)的血液、骨髓和脾脏中分离的人CD45+CD3+CAR+细胞的代表性的流式细胞术图。
图21B示出了如通过流式细胞术测定的,肿瘤细胞接种后第32天安乐死的小鼠的血液、骨髓和脾脏中的人CD3+CAR+占总细胞的百分比。
图22示出了常规CAR-T细胞疗法(左,约4周过程)与快速MASTER介导的CAR T细胞产生和疗法(右,1天过程)比较的示意图。
图23A示出了MASTER(左)的扫描体积,其中彩色面指示右边所示的横截面。在横截面中,较亮的值指示较高密度(支架),并且较暗的值指示较低密度(空气孔隙率)。
图23B示出了MASTER(左)的CT体积,其中分离了孔并进行了彩色标记(右)。完成了对孔进行颜色标记,使得具有类似体积的孔具有类似的颜色。单独分离和分析孔,并且计算孔隙率为75.8%。
图23C示出了不同尺寸的孔的相对频率。
图23D示出了孔的纵横比,示出大多数孔具有椭圆形状。纵横比为1对应于球体,并且接近0对应于平面或杆。
图23E示出了绘制的表面积与体积的函数关系。MASTER内部的总表面积为大约810mm。
图23F示出了支架中的孔之间的连接性。孔的中心或节点显示为球体,并且绘制了从此球体到其所连接的其它孔的线。连接越多,球体越大,也对球体进行颜色编码,以示出有多少孔连接到此球体。对样品的部分切割显示出连接性(左)和样品中的完整连接性(右)。
图23G示出了样品的连接性,示出大多数孔与0-3个其它孔连接,其中少数孔(约6%)具有大于9个连接。
图24A、24B、24C、24D、24E和24F示出与静脉内输注CAR T细胞相比,MASTER在肿瘤再激发后展现出增强的控制肿瘤的活性。图24A示出了移植有FFLuc标记的CD19+人Daudi肿瘤细胞并且用其再激发的NSG小鼠中淋巴瘤异种移植模型的实验时间线。图24B示出了用MASTER、常规CAR-T细胞或对照非转导(NT)细胞处理的NSG小鼠的体内肿瘤生物发光成像(BLI)。图24C、24D和24E示出了用NT细胞(24C)、MASTER(24D)或静脉内输注CAR T细胞(24E)处理的小鼠的个体肿瘤生长曲线。每条线表示一只动物。图24F示出了如卡普兰-迈耶曲线所示的小鼠的存活率。示出了每处理组六只小鼠。**p<0.01,对数秩(Mantel-Cox)检验,Gehan-Breslow-Wilcoxon检验。
图25示出了MASTER和其组分的生物相容性。C57Bl6/J免疫活性小鼠中皮下植入MASTER、MASTER+小鼠PBMC+GFP编码的γ逆转录病毒四周后以及未经处理的对照的五个主要器官和植入位点的H&E染色切片的代表性图像。
图26示出了MASTER和其组分的生物相容性,如通过对小鼠血液的生化分析所揭示的。将MASTER、MASTER+小鼠PBMC+GFP编码的γ逆转录病毒植入C57Bl6/J免疫小鼠的皮下空间(n=3)。
图27A和27B示出了装载有PBMC和逆转录病毒的MASTER不转导宿主细胞。图27A示出了模拟体内系统的体外transwell模型。图27B示出了接种在transwell板的底部上的成纤维细胞中的GFP表达,其示出当MASTER与PBMC和病毒共接种(MOI 2)时,病毒不会从支架中泄漏。
图28示出了用100万个HEK293T细胞和编码慢病毒的GFP接种干支架(MOI 2)。72小时后从支架分离细胞并测量GFP表达。
具体实施方式
在公开和描述的本发明的化合物、组合物、制品、装置和/或方法之前,应当理解,除非另外指明,否则所述化合物、组合物、制品、装置和/或方法不限于特定的合成方法或特异性重组生物技术方法,或者除非另外指明,否则不限于特定的试剂,因为所述化合物、组合物、制品、装置和/或方法当然可以变化。还应当理解,本文所使用的术语仅出于描述特定实施例的目的,而不旨在是限制性的。
A.定义
在本说明书和随后的权利要求中,将参考许多术语,这些术语应当被限定为具有以下含义:
在说明书和所附权利要求中所用的单数形式“一个/一种(a/an)”以及“所述”包含复数指示物,除非上下文另外清楚地指明。因此,例如,对“药物载体”的提及包含两种或更多种此类载体的混合物等。
在本文中,范围可以表示为从“约”一个特定值和/或到“约”另一个特定值。当表达此类范围时,另一个实施例包含从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”将值表达为近似值时,将理解特定值形成另一个实施例。应进一步理解,所述范围中的每个范围的端点在相对于另一个端点以及独立于另一个端点两个方面都是显著的。还应理解,本文公开了多个值,并且每个值在本文中还被公开为除了所述特定值本身之外,还包含“约”所述值。例如,如果公开值“10”,则还公开“约10”。还应当理解,如本领域的技术人员适当理解的,当公开的值“小于或等于”所述值时,还公开了“大于或等于所述值”以及所述值之间的可能范围。例如,如果公开了值“10”,则还公开了“小于或等于10”以及“大于或等于10”。还应当理解,在整个申请中,以许多不同的格式提供数据,并且此数据表示端点和起点以及数据点的任何组合的范围。例如,如果公开了特定数据点“10”和特定数据点15,则应当理解,认为公开了大于、大于或等于、小于、小于或等于以及等于10和15以及介于10与15之间。还应当理解,还公开了两个特定单元之间的每个单元。例如,如果公开了10和15,则还公开了11、12、13和14。
向受试者的“施用”包含向受试者引入或递送药剂的任何途径。施用可以通过任何合适的途径进行,包含口服、局部、静脉内、皮下、经皮、透皮、肌肉内、关节内、肠胃外、微动脉内、皮内、心室内、颅内、腹膜内、病灶内、鼻内、直肠、阴道、通过吸入、经由植入式储药器、肠胃外(例如,皮下、静脉内、肌肉内、关节内、滑膜内、胸骨内、鞘内、腹膜内、肝内、病灶内和颅内注射或输注技术)等。如本文所使用的,“同时施用(concurrent administration)”、“组合施用”、“同时施用(simultaneous administration)”或“同时地施用”意指化合物在同一时间点施用或基本上一个紧接一个施用。在后一种情况下,两种化合物的施用时间足够接近,以至于观察到的结果与所述化合物在同一时间点施用时所获得的结果难以区分。“全身施用”是指通过将药剂引入或递送到受试者身体的广泛区域(例如大于身体的50%)的途径(例如穿过进入循环系统或淋巴系统的入口)向受试者引入或递送药剂。相比之下,“局部施用”是指通过将药剂引入或递送到施用点的区域或紧邻施用点的区域并且不以治疗显著量全身性地引入药剂的途径向受试者引入或递送药剂。例如,局部施用的药剂可在施用点的局部附近容易地检测,但在受试者身体的远侧部分中不可检测或可检测到的量可忽略不计。施用包含自我施用和由另一个人施用。
“生物相容性”通常是指通常对培养物中的细胞或对接受者生物体无毒并且不会对受试者造成显著副作用的材料和其任何代谢物或降解产物。
“包括”旨在意味着组合物和方法等包含所叙述的要素,但不排除其它要素。当用于定义组合物和方法时,“基本上由...组成”应当意味着包含所叙述的要素,但排除对组合具有任何重要意义的其它要素。因此,基本上由如本文所定义的要素组成的组合物不会从分离和纯化方法和药学上可接受的载体(如磷酸盐缓冲盐水、防腐剂等)中排除痕量污染物。“由...组成”应当意味着排除多于痕量要素的其它成分和用于施用本发明的组合物的大量方法步骤。由这些过渡术语中的每个过渡术语定义的实施例在本发明的范围内。
“对照”是在实验中用于比较目的的替代受试者或样品。对照可以是“阳性的”或“阴性的”。
“控制释放”或“持续释放”是指以受控方式从给定剂型中释放药剂,以便获得期望的体内药代动力学曲线。“控制释放”药剂递送的一方面是操纵调配物和/或剂型的能力,以便建立期望的药剂释放动力学。
药剂的“有效量”是指足以提供期望的效果的药剂的量。“有效”的药剂的量将因受试者而异,这取决于许多因素,如受试者的年龄和一般病状、特定的一种或多种药剂等。因此,不可能总是指定定量的“有效量”。然而,本领域的普通技术人员可以使用常规实验测定任何受试者情况下的适当“有效量”。而且,如本文所使用的并且除非另有明确说明,否则药剂的“有效量”还可以指涵盖治疗有效量和预防有效量的量。达到治疗效果所必需的药剂的“有效量”可以根据如受试者的年龄、性别和体重等因素而变化。剂量方案可以调整以提供最佳的治疗应答。例如,可以每天施用若干个分开的剂量,或者剂量可以成比例减少,如治疗情况的迫切情况所指示的。
“减少”可以指导致更少的基因表达、蛋白质表达、更少量的症状、疾病、组合物、病状或活性的任何变化。当利用物质的基因产物的遗传输出相对于不利用所述物质的基因产物的输出较低时,所述物质还应被理解为减少基因的遗传输出。还例如,减少可以是病症症状的使得症状比先前观察到的更少的变化。减少可以是病状、症状、活动、组合物以统计学显著量的任何个体、中值或平均减少。因此,减少可以是1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的减少,只要减少是统计上显著的。
所公开的水凝胶和干支架可以包括编码外源基因和其它核酸(例如,siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA)的载体。如本文所使用的,术语“外源性”是指来自外部来源的核酸,包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA。
“抑制(inhibit)”、“抑制(inhibiting)”和“抑制(inhibition)”意指减少活性、应答、病状、疾病或其它生物参数。这可以包含但不限于活性、应答、病状或疾病的完全消融。这还可以包含例如与天然或对照水平相比,活性、应答、病状或疾病减少10%。因此,与天然或对照水平相比,所述减少可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或其间的任何减少量。
如本文所使用的术语“预防(prevent)”、“预防(preventing)”和“预防(prevention)”和其语法变体是指部分或完全延迟或阻止疾病和/或一种或多种其伴随症状的发作或复发或者阻止受试者获得或重新获得疾病或者降低受试者获得或重新获得疾病或一种或多种其伴随症状的风险的方法。
“药学上可接受的”组分可以指不是生物学上或其它方面不合需要的组分,即,所述组分可以并入本发明的药物调配物中并如本文所述施用于受试者,而不引起显著的不合需要的生物效应或以有害方式与含有它的调配物的任何其它组分相互作用。当针对施用于人而使用时,所述术语通常意味着所述组分已满足所需的毒理学和制造测试标准,或者所述组分包含在美国食品和药物管理局(U.S.Food and Drug Administration)制定的非活性成分指南(Inactive Ingredient Guide)中。
“药学上可接受的载体”(有时称为“载体”)意指可用于制备通常安全且无毒的药物或治疗组合物的载体或赋形剂,并且包含兽医和/或人类药物或治疗用途可接受的载体。术语“载体”或“药学上可接受的载体”可以包含但不限于磷酸盐缓冲盐水溶液、水、乳剂(如油/水或水/油乳剂)和/或各种类型的润湿剂。如本文所使用的,术语“载体”涵盖但不限于任何赋形剂、稀释剂、填料、盐、缓冲液、稳定剂、增溶剂、脂质、稳定剂或本领域公知的用于药物调配物并且如本文进一步描述的其它材料。
如在“药理学上活性的”衍生物或类似物中的“药理学上活性的”(或简单地“活性的”)可以指具有与母体化合物相同类型的药理学活性并且程度大致相等的衍生物或类似物(例如,盐、酯、酰胺、缀合物、代谢物、异构体、片段等)。
“治疗剂”是指具有有益生物效应的任何组合物。有益生物效应包含:治疗效应,例如,治疗病症或其它不期望的生理病状;和预防效应,例如,预防病症或其它不期望的生理病状(例如,非免疫原性癌症)。所述术语还涵盖本文具体提及的有益药剂的药学上可接受的药理学上活性的衍生物,包含但不限于盐、酯、酰胺、前体药剂(proagent)、活性代谢物、异构体、片段、类似物等。当使用术语“治疗剂”时,或者当具体鉴定特定药剂时,应当理解,所述术语包含药剂本身以及药学上可接受的药理学上活性的盐、酯、酰胺、前体药剂、缀合物、活性代谢物、异构体、片段、类似物等。
组合物(例如,包括药剂的组合物)的“治疗有效量”或“治疗有效剂量”是指有效实现所期望的治疗结果的量。在一些实施例中,所期望的治疗结果是控制I型糖尿病。在一些实施例中,所期望的治疗结果是控制肥胖。给定治疗剂的治疗有效量通常会根据如所治疗的病症或疾病的类型和严重程度以及受试者的年龄、性别和体重等因素而变化。所述术语还可以指有效地促进如疼痛缓解等所期望的治疗效果的治疗剂的量或治疗剂的递送速率(例如,随时间变化的量)。精确的所期望治疗效果将根据待治疗的病状、受试者的耐受性、待施用的药剂和/或药剂调配物(例如,治疗剂的效力、调配物中药剂的浓度等)以及本领域的普通技术人员理解的各种其它因素而变化。在一些情况下,在数天、数周或数年的时间段内向受试者施用多剂组合物后实现所期望的生物学或医学应答。
在本说明书和随后的权利要求中,将参考许多术语,这些术语应当被限定为具有以下含义:
“任选的”或“任选地”意指随后描述的事件或情况可能会或可能不会发生,并且所述描述包含所述事件或情况发生的实例和所述事件或情况未发生的实例。
贯穿本申请,引用了各种出版物。这些出版物的公开内容特此通过引用整体并入本申请中,以更全面地描述本所属领域的现状。对于文献中含有的在文献所依赖的句子中讨论的材料,所公开的参考文献也单独地并且具体地通过引用并入本文。
B.组合物
公开了用于制备所公开的组合物的组分以及在本文公开的方法中使用的组合物本身。本文中公开了这些材料和其它材料,并且应当理解,当公开了这些材料的组合、子集、相互作用、组等时,尽管无法明确地公开对这些化合物的每种各个单独和集体组合和排列的具体引用,但在本文中具体地考虑和描述了每个组合和排列。例如,如果公开并讨论了特定水凝胶基质和/或干支架,并且讨论了可以对包含所述水凝胶基质和/或干支架的多个分子进行的许多修饰,则除非具体地相反地指明,否则具体地设想了所述水凝胶基质和/或干支架的每种组合和排列以及可能的修饰。因此,如果公开一类分子A、B和C以及一类分子D、E和F,并公开了组合分子A-D的实例,则即使未单独叙述每种组合,也单独地且共同地设想了每种组合,从而意味着视为公开了组合A-E、A-F、B-D、B-E、B-F、C-D、C-E和C-F。同样,还公开了这些的任何子集或组合。因此,例如,认为公开了子组A-E、B-F和C-E。此概念适用于本申请的所有方面,包含但不限于制备和使用所公开的组合物的方法中的步骤。因此,如果存在可以执行的各种另外的步骤,则应当理解,可以利用所公开方法的任何特定实施例或实施例的组合来执行这些另外的步骤中的每个步骤。
已经开发了三维(3D)干大孔支架作为用于使用RV载体对T细胞进行工程化的高效的单步骤静态平台。假设具有大孔隙度和高吸水能力的3D支架允许RV颗粒和T细胞的共定位,如通过使用retronectin所实现的。通过钙交联海藻酸盐制备了干大孔支架,其是符合GMP的经FDA批准的生物材料,由于其生物相容性、低毒性、低成本以及二价阳离子的温和凝胶作用,广泛用于许多生物医学应用。观察到干燥的、吸湿的和干的大孔海藻酸盐支架促进RV载体和细胞(包含免疫细胞(如T细胞)和非免疫细胞)的相互作用,并且使得能够在单个步骤中实现高效的核酸转移(包含基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA),而无需旋转接种并且不会影响受体细胞的功能和存活能力。因此,这些支架代表了简单、成本有效并且可调节的平台技术,其用于产生高度功能性工程化细胞,包含但不限于用于过继性细胞疗法的T细胞。
因此,在一个方面,本文公开了生物相容性水凝胶基质和/或干支架(例如,包括海藻酸盐的水凝胶和/或干支架),所述水凝胶基质和/或干支架包括对细胞受体或蛋白质(包含但不限于T细胞受体和/或NK细胞受体,例如抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)具有特异性的一种或多种配体或抗体。所公开的水凝胶基质和/或干支架可以是用于转导细胞(例如,非免疫细胞和免疫细胞,包含但不限于T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润性NK细胞(TINK)和/或骨髓浸润淋巴细胞(MIL))和制备嵌合抗原受体(CAR)细胞的支架。因此,在一个方面,水凝胶基质和/或干支架可以包括载体(例如,慢病毒、逆转录病毒、腺病毒、腺相关病毒、病毒样颗粒、转座子或脂质体),所述载体编码和/或包封外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA,例如,嵌合抗原受体(CAR)基因)。
装置(例如,水凝胶)结构由多种不同的刚性、半刚性、柔性、凝胶、自组装、液晶或流体组合物构建而成,所述组合物如肽聚合物、多糖、合成聚合物、水凝胶材料、陶瓷(例如,磷酸钙或羟基磷灰石)、蛋白质、糖蛋白、蛋白聚糖、金属和金属合金。使用本领域已知的方法将组合物组装成支架,例如,注射模制、预成型结构的冻干、印刷、自组装、相转化、溶剂浇铸、熔融加工、气体发泡、纤维形成/加工、颗粒浸出或其组合。
本文所公开的水凝胶和/或干支架可以使用任何合适的可生物降解聚合物制备。“聚合物”是指相对高分子量的天然或合成有机化合物,其结构可以由重复的小单元单体表示。聚合物的非限制性实例包含聚乙烯、橡胶、纤维素。合成聚合物通常通过单体的加成或缩聚形成。术语“共聚物”是指由两个或更多个不同的重复单元(单体残基)形成的聚合物。作为实例而非限制,共聚物可以是交替共聚物、无规共聚物、嵌段共聚物或接枝共聚物。还设想的是,在某些方面,嵌段共聚物的各种嵌段区段本身可以包括共聚物。术语“聚合物”涵盖所有形式的聚合物,包含但不限于天然聚合物、合成聚合物、均聚物、杂聚物或共聚物、加聚物等。
用于形成装置(例如,水凝胶)的示例性材料包含聚乳酸、聚乙醇酸、聚-丙交酯-共-乙交酯(PLG)、海藻酸盐和海藻酸盐衍生物、明胶、胶原蛋白、纤维蛋白、纤连蛋白、甲基丙烯酰胺、丙烯酰胺、脱细胞组织、透明质酸、富含层粘连蛋白的凝胶、琼脂糖、天然和合成多糖、聚氨基酸、多肽、聚酯、聚酸酐、聚磷嗪、聚(乙烯醇)、聚(氧化烯)、聚(烯丙胺)(PAM)、聚(丙烯酸酯)、经修饰的苯乙烯聚合物、多元醇、泊洛沙姆、聚(糖醛酸)、聚(乙烯基吡咯烷酮)以及上述中任一种的共聚物或接枝共聚物。
一种优选的水凝胶包含RGD修饰的海藻酸盐。在其它实例中,水凝胶包含交联聚合物,例如,交联海藻酸盐、明胶或其衍生物,如作为甲基丙烯酸酯的那些。
在一个方面,水凝胶和/或干支架可以包括生物相容性聚合物(例如,海藻酸盐)。此类聚合物还可以用于将CAR T细胞、CAR NK细胞、TIL和/或MIL缓慢释放到组织中。如本文所使用的生物相容性聚合物包含但不限于:多糖;亲水性多肽;聚(氨基酸),如聚-L-谷氨酸(PGS)、γ-聚谷氨酸、聚-L-天冬氨酸、聚-L-丝氨酸或聚-L-赖氨酸;聚亚烷基二醇和聚亚烷基氧化物,如聚乙二醇(PEG)、聚丙烯二醇(PPG)和聚环氧乙烷(PEO);聚(氧乙基化多元醇);聚(烯醇);聚乙烯吡咯烷酮;聚(羟烷基甲基丙烯酰胺);聚(羟烷基甲基丙烯酸酯);聚(糖);聚(羟基酸);聚(乙烯醇)、聚羟基酸,如聚(乳酸)、聚(乙醇酸)和聚(乳酸-共-乙醇酸);聚羟基烷酸酯,如聚3-羟基丁酸酯或聚4-羟基丁酸酯;聚己内酯;聚(原酸酯);聚酸酐;聚(磷腈);聚(丙交酯-共-己内酯);聚碳酸酯,如酪氨酸聚碳酸酯;聚酰胺(包含合成和天然聚酰胺)、多肽和聚(氨基酸);聚酰胺酯;聚酯;聚(二噁烷酮);聚(亚烷基烷基化物);疏水性聚醚;聚氨酯;聚醚酯;聚缩醛;聚氰基丙烯酸酯;聚丙烯酸酯;聚甲基丙烯酸甲酯;聚硅氧烷;聚(氧乙烯)/聚(氧丙烯)共聚物;聚缩酮;聚磷酸酯;聚羟基戊酸酯;聚亚烷基草酸酯;聚亚烷基琥珀酸酯;聚(马来酸)和其共聚物。生物相容性聚合物还可以包含聚酰胺、聚碳酸酯、聚亚烷基、聚亚烷基二醇、聚亚烷基氧化物、聚亚烷基对苯二甲酸酯、聚乙烯醇(PVA)、甲基丙烯酸酯PVA(m-PVA)、聚乙烯醚、聚乙烯酯、聚乙烯卤化物、聚乙烯吡咯烷酮、聚乙交酯、聚硅氧烷、聚氨酯和其共聚物、烷基纤维素、羟烷基纤维素、纤维素醚、纤维素酯、硝基纤维素、丙烯酸酯和甲基丙烯酸酯的聚合物、甲基纤维素、乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羟丁基甲基纤维素、乙酸纤维素、丙酸纤维素、乙酸丁酸纤维素、邻苯二甲酸乙酸纤维素、羧乙基纤维素、三乙酸纤维素、硫酸纤维素钠盐、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸乙酯)、聚(甲基丙烯酸丁酯)、聚(甲基丙烯酸异丁酯)、聚(甲基丙烯酸己酯)、聚(甲基丙烯酸异癸酯)、聚(甲基丙烯酸月桂酯)、聚(甲基丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸异丙酯)、聚(丙烯酸异丁酯)、聚(丙烯酸十八酯)、聚乙烯、聚丙烯、聚(乙二醇)、聚(环氧乙烷)、聚(对苯二甲酸乙二酯)、聚(乙烯醇)、聚(乙酸乙烯酯)、聚氯乙烯、聚苯乙烯和聚乙烯吡咯烷酮、其衍生物、直链和支链共聚物和其嵌段共聚物和其共混物。示例性生物可降解聚合物包含聚酯、聚(原酸酯)、聚(乙烯胺)、聚(己内酯)、聚(羟基丁酸酯)、聚(羟基戊酸酯)、聚酸酐、聚(丙烯酸)、聚乙交酯、聚(氨基甲酸酯)、聚碳酸酯、聚磷酸酯、聚磷腈、其衍生物、直链和支链共聚物和其嵌段共聚物和其共混物。
在一些实施例中,颗粒含有生物相容性和/或生物可降解聚酯或聚酸酐,如聚(乳酸)、聚(乙醇酸)和聚(乳酸-共-乙醇酸)。颗粒可以含有以下聚酯中的一种多种:均聚物,包含乙醇酸单元,本文中被称为“PGA”,以及乳酸单元,如聚-L-乳酸、聚-D-乳酸、聚-D,L-乳酸、聚-L-丙交酯、聚-D-丙交酯和聚-D,L-丙交酯5,在本文中统称为“PLA”,以及己内酯单元,如聚(e-己内酯),在本文中统称为“PCL”;以及共聚物,包含乳酸和乙醇酸单元,如由乳酸:乙醇酸的比率表征的各种形式的聚(乳酸-共-乙醇酸)和聚(丙交酯-共-乙交酯),在本文统称为“PLGA”;以及聚丙烯酸酯及其衍生物。示例性聚合物还包含聚乙二醇(PEG)和上述聚酯的共聚物,如各种形式的PLGA-PEG或PLA-PEG共聚物,在本文中统称为“聚乙二醇化聚合物”。在某些实施例中,PEG区可以与聚合物共价相关以通过可切割接头产生“聚乙二醇化聚合物”。在一个方面,聚合物包括至少60%、65%、70%、75%、80%、85%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的缩醛侧基。
本文所公开的三嵌段共聚物包括核心聚合物,例如,聚乙二醇(PEG)、聚乙酸乙烯酯、聚乙烯醇、聚乙烯吡咯烷酮(PVP)、聚环氧乙烷(PEO)、聚(乙烯基吡咯烷酮-共-乙酸乙烯酯)、聚甲基丙烯酸酯、聚氧乙烯烷基醚、聚氧乙烯蓖麻油、聚己内酰胺、聚乳酸、聚乙醇酸、聚(乳酸-乙醇酸)、聚(乳酸-共-乙醇酸)(PLGA)、纤维素衍生物,如羟甲基纤维素、羟丙基纤维素等。
在一些情况下,装置(例如,含有水凝胶)的组件被组织成各种几何形状(例如,盘、珠、团粒)、龛、平面层(例如,薄板)。例如,直径为约0.1毫米至约50厘米,例如,直径为0.1毫米、0.2毫米、0.3毫米、0.4毫米、0.5毫米、0.6毫米、0.7毫米、0.8毫米、0.9毫米、1毫米、2毫米、3毫米、4毫米、5毫米、10,毫米、15毫米、20毫米、25毫米、30毫米、35毫米、40毫米、45毫米、50毫米、60毫米、70毫米、80毫米、90毫米、10厘米、15厘米、20厘米、25厘米、30厘米、35厘米、40厘米、45厘米、50厘米的盘皮下植入。盘的厚度可以为0.1毫米至10毫米,例如,1毫米、2毫米、5毫米。盘容易被压缩或冻干,以便向患者施用。用于皮下施用的示例性盘的尺寸如下:直径为8毫米,并且厚度1毫米。多组分装置(例如,含有水凝胶)任选地构建在同心层中,每个同心层的特征在于不同的物理特性(聚合物%、聚合物交联%、水凝胶的化学组成、孔径、孔隙度和孔结构、刚度、韧性、延展性、粘弹性和/或药物组合物)。
本文所公开的支架可以在多孔板(包含384孔、96孔、48孔、24孔、12孔或6孔板)的孔中制造或插入到所述孔中。支架可以在烧瓶(包含T25、T75、T175或T225烧瓶)中制造或插入到所述烧瓶中。支架可以在培养皿(包含35mm、60mm、100mm和150mm皿)中制造或插入到所述培养皿中。支架可以在细胞培养管(包含3mL、5mL、7mL、8mL、12mL、14mL、15mL、16mL、19mL、21mL或50mL容量管)中制造或插入到所述细胞培养管中。支架可以具有任意形状和大小,并且在模具(包含大小在1mm3至0.1m3范围内的模具)中制造或插入所述模具中。支架可以在容量为50mL、100mL、200mL、300mL、500mL、1000mL、2000mL、5000mL、10000mL的细胞培养袋中制造或插入到所述细胞培养袋中。
本文所公开的支架可以在多孔板的孔中或在培养皿中制造,并且因此具有直径在1mm至50cm之间并且厚度在1mm至50cm之间的盘形状。支架可以在边长为1mm至50cm并且厚度为1mm至50cm的方形或矩形模具中制造。另外地,支架可以在作为规则共享或不规则形状模具的模具中制造,并且模具具有规则(包含三角形、五边形、六边形、星形)形状或菱形形状,或者模具可以是不规则形状的。规则或不规则形状的模具的表面积可以为1mm^2至2500cm^2并且厚度可以为1mm至50cm。
支架可以由单个颗粒的集合组成。这些微粒可以通过喷雾干燥、静电纺丝、挤出、乳化/凝胶化、粉碎、旋转干燥或其它已知的颗粒制备技术来制造。构成支架的颗粒的实例可以是直径为50μm、100μm、200μm、500μm、1000μm、2000μm或5000μm的微球。支架也可以由从更大的制造整体上切割的部分组成。原始整体的大小可以为.1平方米至1,000平方米。
支架结构可以含有为微孔或大孔的孔。孔径可以包含10μm、20μm、50μm、100μm、200μm、500μm、1000μm。孔的图案可以是均质的、异质的、对齐的、重复的或随机的。
在一个方面,支架可以是“干支架”。如本文所使用的,“干支架”是指按质量计具有不超过10%的水的任何支架。换句话说,按质量计,干支架具有少于10%的水。在一些情况下,按质量计,干支架具有少于9%、8%、7%、6%、5%、4%、3%、2%或1%的水。例如,按质量计,支架可以包括0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%或10%的水。
如上文所指示的,用于水凝胶的一种优选材料是海藻酸盐或经修饰的海藻酸盐材料。海藻酸盐是通用的基于多糖的聚合物,其可以通过控制分子量、降解速率和支架形成方法调配用于特定应用。海藻酸盐分子由(1-4)-连接的β-D-甘露糖醛酸(M单元)和α-L-古洛糖醛酸(G单元)单体组成,其在沿聚合物链的比例和序列分布可能不同。海藻酸盐多糖是聚电解质系统,其对二价阳离子(例如,Ca
海藻酸盐可以进行化学修饰以产生新的性质。例如,海藻酸盐可以被氧化以提高生物降解速率。可替代地,可以减少海藻酸盐以改善生物相容性。海藻酸盐也可以进行化学修饰以改变其交联行为。例如,海藻酸盐可以用生物正交点击基团进行修饰,以允许点击交联。在另一个实例中,海藻酸盐可以用丙烯酸基团修饰,以允许自由基聚合交联。如另一个实例,海藻酸盐可以用主客体化学修饰,以允许主客体交联。
海藻酸盐聚合物形成各种水凝胶类型。海藻酸盐支架可以由分子量在1,000Da至500,000Da之间变化的海藻酸盐形成。海藻酸盐支架可以由G/M比率介于.5与5之间的海藻酸盐形成。水凝胶调配物的差异控制了水凝胶降解的动力学。药物组合物(例如,小分子、形态发生素或其它生物活性物质)从海藻酸盐水凝胶中释放的速率由水凝胶调配物控制,从而以空间和时间控制的方式呈现药物组合物。这种控制释放消除了全身副作用和多次注射的需要。
除了海藻酸盐之外的有用多糖包含但不限于琼脂糖和微生物多糖,如:真菌普鲁兰多糖(Fungal Pullulan)、硬葡聚糖、甲壳素、壳聚糖、埃尔辛南(Elsinan)、细菌黄原胶、热凝胶多糖、右旋糖酐、明胶、左聚糖(Levan)、Emulsan、纤维素、透明质酸等。
在一个方面,水凝胶基质和/或干支架可以进一步包括受体(表皮生长因子受体(EGFR)、血小板衍生生长因子受体(PDGFR))、配体(包含但不限于表皮生长因子(EGF)、血小板衍生生长因子、粒细胞巨噬细胞集落刺激因子(GM-CSF)、血管内皮生长因子(VEGF)、粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞集落刺激因素(GM-CSF)、巨噬细胞集落刺激因子(M-CSF)、成纤维细胞生长因子(FGF)、胰岛素样生长因子(IGF)1(IGF-1)和/或IGF-2)、骨形态发生蛋白(BMP)、肝配蛋白(A1、A2、A3、A4、A5、B1、B2、B3)、红细胞生成素、成纤维细胞生长因子(FGF1、FGF2、FGF3、FGF4、FGF5、FGF6、FGF7、FGF8、FGF9、FGF10、FGF11、FGF12、FGF13、FGF14、FGF15、FGF16、FGF17、FGF18、FGF19、FGF20、FGF21、FGF22、FGF23)、胶质细胞系源性神经营养因子(GDNF)、肝细胞生长因子(HGF)、神经营养素(BDNF、NGF、NT-3、NT-4)、T细胞生长因子(TCGF)、转化生长因子(TGF-α、TGF-β)、肿瘤坏死因子-α(TNF-α)、Wnt信号传导通路、整联蛋白(包含VLA-1、VLA-2、VLA-3、VLA-4、VLA-5、VLA-6、FLJ25220、RLC、PRO827、HsT18964、FLJ39841、HUMINAE、LFA1A、MAC-1、VNRA、MSK8、GPIIb)、钙粘蛋白(例如,E-钙粘蛋白)和/或免疫激活和/或维持抗体、趋化因子和细胞因子(例如,IL-2、IL-6、IL-7、IL-15、IL-21、TNF-α或IFN-γ)。
应当理解并且在本文中设想的是,为了完全激活免疫细胞,可能需要共刺激信号。因此,在一个方面,本文公开了水凝胶基质和/或干支架,其进一步包括激活T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润NK细胞(TINK)或骨髓浸润淋巴细胞(MIL)的一种或多种共刺激分子,包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。因此,水凝胶基质和/或干支架还可以包括通过T细胞、NK细胞或NK T细胞共刺激受体诱导信号传导的配体或抗体,所述配体或抗体包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。
1.组合物递送到细胞
免疫细胞的转导可以通过本领域已知的任何方式进行。在一个方面,免疫细胞的转导可以通过编码转基因(例如,CAR)的载体发生。因此,在一个方面,是本文所公开的水凝胶和/或干支架中的任何水凝胶和/或干支架,其进一步包括载体(例如,慢病毒、逆转录病毒、腺病毒、腺相关病毒、病毒样颗粒、脂质体或转座子),所述载体编码转基因,例如,嵌合抗原受体(CAR)。
有许多组合物和方法可以用于在体外或体内将核酸递送到细胞。这些方法和组合物主要可以分为两类:基于病毒的递送系统和基于非病毒的递系统。例如,核酸可以通过多种直接递送系统递送,如电穿孔、脂质感染、磷酸钙沉淀、质粒、病毒载体、病毒核酸、噬菌体核酸、噬菌体、粘粒、病毒样颗粒(VLP)、转座子(例如,包括睡美人转座子(Sleeping Beautytransposase)、青蛙王子(Frog Prince)、piggyBac、Tol2和其它Tc1/mariner型转座子的II类转座元件)、锌指核酸酶、巨核酸酶、转录激活物样效应子(例如,TALEN)、三链体、表观遗传修饰的介体以及CRISPR和rAAV技术)、微环DNA,或者通过在细胞或载体中转移遗传物质,如病毒样颗粒、细胞模拟颗粒、转座子、外泌体、纳米颗粒、胶束或脂质体。合适的转染方法,包含载体、化学转染子或物理-机械方法(如电穿孔和DNA的直接扩散),描述于以下文献中:例如,Wolff,J.A.等人,《科学(Science)》,247,1465-1468,(1990);以及Wolff,J.A.《自然(Nature)》,352,815-818,(1991)。此类方法在本领域中是众所周知的并且很容易适用于与本文所述的组合物和方法一起使用。在某些情况下,这些方法将被修改为专门用于大DNA分子。进一步地,这些方法可以用于通过利用载体的靶向特性来靶向某些疾病和细胞群。
(1)逆转录病毒载体
逆转录病毒是属于逆转录病毒科的病毒科的动物病毒,包含任何类型、亚科、属或向性。通常,逆转录病毒载体由以下文献描述:Verma,I.M.,用于基因转移的逆转录病毒载体(Retroviral vectors for gene transfer)。可以用作载体的逆转录病毒的实例包含但不限于人T嗜淋巴细胞病毒(HTLV)-1(HTLV-1)、HTLV-2、HTLV-3、HTLV-4、猿泡沫病毒、人泡沫病毒、猿免疫缺陷病毒(SIV)、人免疫缺陷病毒(HIV)和Rous肉瘤病毒。
逆转录病毒本质上是包装,其中已装入核酸货物。核酸货物携带包装信号,所述包装信号确保复制的子分子将被有效地包装在包装外壳内。除了包装信号外,还有许多顺式所需的分子,用于复制和包装复制的病毒。通常,逆转录病毒基因组含有参与蛋白质外壳形成的gag、pol和env基因。通常被外源DNA替代的gag、pol和env基因将被转移到靶细胞。逆转录病毒载体通常含有用于掺入包装外壳的包装信号、指示gag转录单元的开始的序列、逆转录所必需的元件,包含:引物结合位点,其用于结合逆转录的tRNA引物;末端重复序列,其在DNA合成过程中指导RNA链的转换;富含嘌呤的序列5'到3'LTR,其用作合成DNA合成的第二链的引发位点;以及靠近LTR末端的特定序列,其使逆转录病毒的DNA状态能够插入宿主基因组中。去除gag、pol和env基因后,约8kb的外来序列可以插入到病毒基因组中,变成逆转录的,并且在复制后被包装成新的逆转录病毒颗粒。取决于每个转录物的大小,此数量的核酸足以递送一对多的基因。优选的是,在插入物中包含阳性或阴性可选择标志物以及其它基因。
由于大多数逆转录病毒载体中的复制机器和包装蛋白已被去除(gag、pol和env),因此通常通过将它们置于包装细胞系中来产生载体。包装细胞系是已经用含有复制和包装机器但缺乏任何包装信号的逆转录病毒转染或转化的细胞系。当携带所选DNA的载体被转染到这些细胞系中时,通过辅助细胞以顺式方式提供的机器,含有所关注基因的载体被复制并包装成新的逆转录病毒颗粒。用于机器的基因组没有被包装,因为它们缺乏必要的信号。
慢病毒载体(LV),包含但不限于人免疫缺陷(HIV)载体和猿免疫缺陷病毒(SIV)载体,是用于细胞培养或体内基因转移到分裂和非分裂细胞中的通用载体。此系统的优点是灵活转导一系列肺癌细胞,而无需花费时间选择稳定表达。复制缺陷型VSV G-假型慢病毒载体(由GeneCopoeia公司按订单生产)可以用于转导细胞。
(2)腺病毒载体
已经描述了复制缺陷型腺病毒的构建(Berkner等人,《病毒学杂志(J.Virology)》61:1213-1220(1987);Massie等人,《分子细胞生物学(Mol.Cell.Biol.)》6:2872-2883(1986);Haj-Ahmad等人,《病毒学杂志》57:267-274(1986);Davidson等人,《病毒学杂志》61:1226-1239(1987);Zhang“通过脂质体介导的转染和PCR分析产生和鉴定重组腺病毒(Generation and identification of recombinant adenovirus by liposome-mediatedtransfection and PCR analysis)”《生物技术(BioTechniques)》15:868-872(1993))。使用这些病毒作为载体的好处是它们可以传播到其它细胞类型的程度受到限制,因为这些病毒可以在初始感染的细胞内复制,但不能形成新的感染性病毒颗粒。已显示重组腺病毒在体内直接递送至气道上皮、肝细胞、血管内皮、CNS实质和许多其它组织部位后实现高效基因转移(Morsy,《临床研究杂志(J.Clin.Invest.)》92:1580-1586(1993);Kirshenbaum,《临床研究杂志》92:381-387(1993);Roessler,《临床研究杂志》92:1085-1092(1993);Moullier,《自然遗传学(Nature Genetics)》4:154-159(1993);La Salle,《科学》259:988-990(1993);Gomez-Foix,《生物化学杂志(J.Biol.Chem.)》267:25129-25134(1992);Rich,《人类基因疗法(Human Gene Therapy)》4:461-476(1993);Zabner,《自然遗传学》6:75-83(1994);Guzman,《循环研究(Circulation Research)》73:1201-1207(1993);Bout,《人类基因疗法》5:3-10(1994);Zabner,《细胞(Cell)》75:207-216(1993);Caillaud,《欧洲神经科学杂志(Eur.J.Neuroscience)》5:1287-1291(1993);以及Ragot,《普通病毒学杂志(J.Gen.Virology)》74:501-507(1993))。重组腺病毒通过与特定细胞表面受体结合来实现基因转导,然后病毒通过受体介导的内吞作用以与野生型或复制缺陷型腺病毒相同的方式内化(Chardonnet和Dales,《病毒学(Virology)》40:462-477(1970);Brown和Burlingham,《病毒学杂志》12:386-396(1973);Svensson和Persson,《病毒学杂志》55:442-449(1985);Seth等人,《病毒学杂志》51:650-655(1984);Seth等人,《分子细胞生物学》4:1528-1533(1984);Varga等人,《病毒学杂志》65:6061-6070(1991);Wickham等人,《细胞》73:309-319(1993))。
病毒载体可以是基于去除了E1基因的腺病毒的载体,并且这些病毒在如人293细胞系等细胞系中产生。在另一个优选实施例中,从腺病毒基因组中去除E1和E3基因。
(3)腺相关病毒载体
另一种类型的病毒载体基于腺相关病毒(AAV)。这种有缺陷的细小病毒是优选的载体,因为它可以感染许多细胞类型并且对人类没有致病性。AAV型载体可以运输约4kb至5kb,并且已知野生型AAV稳定插入到染色体19中(例如,在AAV整合位点1(AAVS1)处)。优选含有这种位点特异性整合性质的载体。这类载体的特别优选的实施例是由加利福尼亚州旧金山市的阿维根公司(Avigen,San Francisco,CA)生产的P4.1 C载体,其可以含有单纯疱疹病毒胸苷激酶基因HSV-tk和/或标志物基因,如编码绿色荧光蛋白GFP的基因。
在另一种类型的AAV病毒中,AAV含有一对反向末端重复序列(ITR),其侧接至少一个盒,所述盒含有指导与异源基因可操作地连接的细胞特异性表达的启动子。本文中的异源是指非AAV或B19细小病毒天然的任何核苷酸序列或基因。
通常已删除AAV和B19编码区,从而产生安全、无细胞毒性的载体。AAV ITR或其修饰赋予感染性和位点特异性整合,但不赋予细胞毒性,并且启动子指导细胞特异性表达。美国专利第6,261,834号通过引用并入本文,用于与AAV载体相关的材料。
因此,所公开的载体提供了能够整合到哺乳动物染色体中而没有实质性毒性的DNA分子。
病毒和逆转录中的插入基因通常含有启动子和/或增强子以帮助控制所需基因产物的表达。启动子通常是相对于转录起始位点在相对固定的位置起作用的一个或多个DNA序列。启动子含有RNA聚合酶和转录因子基本相互作用所需的核心元件,并且可以含有上游元件和应答元件。
(4)大型有效负载病毒载体
利用大型人疱疹病毒进行的分子遗传学实验提供了可以在允许感染疱疹病毒的细胞中克隆、繁殖和建立大型异源DNA片段的方式(Sun等人,《自然遗传学》8:33-41,1994;Cotter和Robertson,《分子治疗学新见(Curr Opin Mol Ther)》5:633-644,1999)。这些大型DNA病毒(单纯疱疹病毒(HSV)和艾普斯登-巴尔病毒(EBV))具有将>150kb的人异源DNA片段递送到特定细胞的潜力。EBV重组体可以在感染的B细胞中维持大片段的DNA作为游离型DNA。携带至多330kb的人基因组插入物的单个克隆表现出遗传稳定性。这些游离体的维持需要特定的EBV核蛋白EBNA1,在感染EBV期间组成性表达。另外地,这些载体可以用于转染,其中可以在体外瞬时产生大量蛋白质。疱疹病毒扩增子系统也被用于包装>220kb的DNA片段,并感染可以稳定维持DNA作为游离体的细胞。
其它有用的系统包含,例如,复制和宿主限制的非复制牛痘病毒载体。
2.表达系统
递送至细胞的核酸通常含有表达控制系统。例如,在病毒和逆转录病毒系统中插入的基因通常含有启动子和/或增强子,以帮助控制期望的基因产物的表达。启动子通常是相对于转录起始位点在相对固定的位置起作用的一个或多个DNA序列。启动子含有RNA聚合酶和转录因子基本相互作用所需的核心元件,并且可以含有上游元件和应答元件。
a)病毒启动子和增强子
控制来自哺乳动物宿主细胞的载体的转录的优选启动子可以从各种来源获得,例如,病毒的基因组,如:多瘤病毒、猿病毒40(SV40)、腺病毒、逆转录病毒、乙型肝炎病毒和最优选的巨细胞病毒,或从异源哺乳动物启动子,例如,β肌动蛋白启动子获得。SV40病毒的早期和晚期启动子方便地以还含有SV40病毒复制起点的SV40限制性片段的形式获得(Fiers等人,《自然》,273:113(1978))。人类巨细胞病毒的立即早期启动子方便地以HindIII E限制性片段的形式获得(Greenway,P.J.等人,《基因》18:355-360(1982))。当然,来自宿主细胞或相关物种的启动子也可用于本发明。
增强子通常是指在距离转录起始位点无固定距离处发挥作用并且可以位于转录单位的5'(Laimins,L.等人,《美国国家科学院院刊》78:993(1981))或3'((Lusky,M.L.等人,《分子细胞生物学》3:1108(1983))处的DNA序列。此外,增强子可以在内含子内(Banerji,J.L.等人,《细胞》33:729(1983))以及在编码序列本身内(Osborne,T.F.等人,《分子细胞生物学》4:1293(1984))。增强子的长度通常介于10bp与300bp之间,并且增强子以顺式发挥作用。增强子用于增加来自附近启动子的转录。增强子还通常含有介导转录调节的应答元件。启动子还可以含有介导转录调节的应答元件。增强子通常决定基因表达的调节。虽然现在已知许多来自哺乳动物基因的增强子序列(珠蛋白、弹性蛋白酶、白蛋白、-甲胎蛋白和胰岛素),但通常会使用来自真核细胞病毒的增强子进行一般表达。优选的实例是复制起点后侧的SV40增强子(bp 100-270)、巨细胞病毒早期启动子增强子、复制起点后侧的多瘤增强子和腺病毒增强子。
启动子和/或增强子可以通过触发其功能的光或特定化学事件而被特异性地激活。系统可以通过如四环素和地塞米松等试剂进行调节。还有一些方法可以通过暴露于辐射(如γ辐射)或烷基化化疗药物来增强病毒载体基因表达。
在某些实施例中,启动子和/或增强子区可以充当组成型启动子和/或增强子以使要转录的转录单元区的表达最大化。在某些构建体中,启动子和/或增强子区在所有真核细胞类型中都具有活性,即使它仅在特定时间在特定类型的细胞中表达。此类型的优选启动子是CMV启动子(650个碱基)。其它优选启动子是SV40启动子、巨细胞病毒(全长启动子)和逆转录病毒载体LTR。
已经表明,可以克隆所有特异性调节元件并用于构建在特定细胞类型(如黑色素瘤细胞)中选择性表达的表达载体。胶质纤维乙酸蛋白(GFAP)启动子已被用于在胶质起源的细胞中选择性表达基因。
在真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或有核细胞)中使用的表达载体也可以含有可能影响mRNA表达的转录终止所必需的序列。这些区域被转录为编码组织因子蛋白的mRNA的非翻译部分中的多腺苷酸化片段。3'非翻译区还包含转录终止位点。优选的是,转录单元还含有多腺苷酸化区域。此区域的一个好处是它增加了转录单元像mRNA一样被加工和运输的可能性。表达构建体中多聚腺苷酸化信号的鉴定和使用已被充分确立。优选的是,在转基因构建体中使用同源多聚腺苷酸化信号。在某些转录单元中,多腺苷酸化区域源自SV40早期多腺苷酸化信号,并且由约400个碱基组成。还优选的是,转录单元含有单独或与上述序列组合的其它标准序列,提高构建体的表达或稳定性。
b)标志物
载体可以包含编码标志物产物的核酸序列。该标志物产物用于确定基因是否已被递送到细胞并且一旦递送即被表达。优选的标志物基因是编码β-半乳糖苷酶的大肠杆菌(E.Coli)lacZ基因和绿色荧光蛋白。
在一些实施例中,标志物可以是可选择标志物。适用于哺乳动物细胞的可选择标志物的实例是二氢叶酸还原酶(DHFR)、胸苷激酶、新霉素、新霉素类似物G418、水霉素和嘌呤霉素。当此类可选择标志物被成功地转移到哺乳动物宿主细胞中时,如果置于选择性应激下,经转化的哺乳动物宿主细胞可以存活。有两种广泛使用的不同类别的选择性方案。第一类基于细胞的新陈代谢并使用缺乏独立于补充培养基生长的能力的突变细胞系。两个实例是:CHO DHFR-细胞和小鼠LTK-细胞。这些细胞在不添加如胸苷或次黄嘌呤等营养物的情况下缺乏生长能力。由于这些细胞缺乏完整核苷酸合成通路所必需的某些基因,因此除非在补充培养基中提供缺失的核苷酸,否则它们无法存活。补充培养基的另一种替代方案是将完整的DHFR或TK基因引入缺乏相应基因的细胞中,从而改变它们的生长要求。未用DHFR或TK基因转化的单个细胞将无法在未添加补充剂的培养基中存活。
第二类别是显性选择,其是指在任何细胞类型中使用的选择方案并且不需要使用突变细胞系。这些方案通常使用药物来阻止宿主细胞的生长。那些具有新基因的细胞会表达一种传递耐药性的蛋白质,并能在选择中存活下来。此类主要选择的实例使用药物新霉素(Southern P.和Berg,P.,《分子与应用遗传学杂志(J.Molec.Appl.Genet.)》1:327(1982))、霉酚酸(Mulligan,R.C.和Berg,P.《科学》209:1422(1980))或潮霉素(Sugden,B.等人,《分子细胞生物学》5:410-413(1985))。这三个实例分别采用真核控制下的细菌基因来传递对适当药物G418或新霉素(遗传霉素)、xgpt(霉酚酸)或潮霉素的抗性。其它包含新霉素类似物G418和普拉霉素。
3.药物载体/药物产品的递送
如上文所描述的,组合物也可以在药学上可接受的载体中体内施用。“药学上可接受的”意指不是生物学上或其它方面不期望的材料,即,所述材料可以与核酸或载体一起施用于受试者,而不引起任何不期望的生物学效应或以有害的方式与包含它的药物组合物的任何其它组分相互作用。如本领域的技术人员所熟知的,载体将被自然地选择来最小化活性成分的任何降解并且最小化受试者中的任何不良副作用。
组合物可以口服、肠胃外(例如,静脉内)、通过肌内注射、通过腹膜内注射、透皮、体外、局部等施用,包含局部鼻内施用或通过吸入剂施用。如本文所使用的,“局部鼻内施用”意指组合物通过鼻孔中的一个或两个递送到鼻和鼻道中,并且可以包括通过雾化机制或液滴机制或通过核酸或载体的气雾化的递送。通过吸入剂施用组合物可以是经由喷雾或液滴机制的递送通过鼻或口。递送还可以通过插管法直接到达呼吸系统的任何区域(例如,肺)。根据受试者的物种、年龄、体重和一般病状,所治疗的过敏性病症的严重程度,使用的具体的核酸或载体,其施用方式等,所需组合物的确切量将随受试者而变化。因此,不可能为每种组合物指定确切的量。然而,鉴于本文的教导,本领域的普通技术人员仅使用常规实验便可以确定适当的量。
组合物的肠胃外施用(如果使用的话)通常通过注射来表征。可以以常规形式(作为液体溶液或悬浮液的形式、适于在注射前溶解或悬浮于液体中的固体形式或作为乳剂的形式)制备注射剂。用于肠胃外施用的最近修订的方法涉及使用缓释或持续释放系统,使得维持恒定的剂量。参见例如,美国专利第3,610,795号,所述美国专利通过引用并入本文。
这些材料可以在溶液、悬浮液中(例如,结合到微粒、脂质体或细胞中)。这些材料可以通过抗体、受体或受体配体靶向特定的细胞类型。以下参考文献是使用此技术将特异性蛋白质靶向肿瘤组织的实例(Senter等人,《生物共轭化学(Bioconjugate Chem.)》,2:447-451,(1991);Bagshawe,K.D.,《英国癌症杂志(Br.J.Cancer)》,60:275-281,(1989);Bagshawe等人,《英国癌症杂志》,58:700-703,(1988);Senter等人,《生物共轭化学》,4:3-9,(1993);Battelli等人,《癌症免疫学免疫疗法(Cancer Immunol.Immunother.)》,35:421-425,(1992);Pietersz和McKenzie,《免疫学评论(Immunolog.Reviews)》,129:57-80,(1992);以及Roffler等人,《生物化学药理学(Biochem.Pharmacol.)》,42:2062-2065,(1991))。媒剂如“隐形(stealth)”和其它抗体缀合的脂质体(包含脂质介导的靶向结肠癌的药物)、受体介导的通过细胞特异性配体对DNA的靶向、针对淋巴细胞指导的肿瘤靶向以及在体内对鼠神经胶质瘤细胞的高度特异性治疗性逆转录病毒靶向。以下参考文献是使用此技术将特异性蛋白质靶向肿瘤组织的实例(Hughes等人,《癌症研究(CancerResearch)》,49:6214-6220,(1989);以及Litzinger和Huang,《生物化学与生物物理学报(Biochimica et Biophysica Acta)》,1104:179-187,(1992))。通常,受体涉及组成型或配体诱导的内吞作用的通路。这些受体聚集在网格蛋白涂覆的凹坑中,通过网格蛋白涂覆的囊泡进入细胞,穿过其中对受体进行分类的酸化的内体,并且然后循环到细胞表面,变成在细胞内储存,或在溶酶体中降解。内化通路具有多种功能,如营养吸收、激活蛋白的去除、大分子的清除、病毒和毒素的机会性进入、配体的解离和降解以及受体水平调控。根据细胞类型、受体浓度、配体类型、配体价和配体浓度,许多受体遵循超过一种细胞内通路。已经综述了受体介导的内吞作用的分子和细胞机制(Brown和Greene,《DNA和细胞生物学(DNA andCell Biology)》10:6,399-409(1991))。
a)药学上可接受的载体
包含抗体的组合物可以与药学上可接受的载体组合在治疗上使用。
以下中描述了合适的载体和其调配物:《雷明顿:药学科学与实践(Remington:TheScience and Practice of Pharmacy)》(第19版)A.R.Gennaro编辑,宾夕法尼亚州伊斯顿市的麦克出版公司(Mack Publishing Company,Easton,PA)1995。通常,在调配物中使用适当量的药学上可接受的盐以使得调配物是等渗的。药学上可接受的载体的实例包含但不限于盐水、林格氏溶液(Ringer's solution)和右旋糖溶液。溶液的pH优选地为约5至约8,并且更优选地约7至约7.5。另外的载体包含如含有抗体的固体疏水性聚合物的半渗透基质等续释制剂,这些基质呈成形制品的形式,例如膜、脂质体或微粒。对本领域技术人员来说显而易见的是,某些载体可能是更优选的,这取决于例如施用途径和所施用的组合物的浓度。
药物载体是本领域的技术人员已知的。这些最典型地是用于向人施用药物的标准载体,包含如无菌水、盐水和处于生理pH的缓冲溶液等溶液。所述组合物可以肌内地或皮下地施用。其它化合物将根据本领域的技术人员使用的标准程序施用。
除了所选分子之外,药物组合物还可以包含载体、增稠剂、稀释剂、缓冲液、防腐剂、表面活性剂等。药物组合物还可以包含一种或多种活性成分,如抗微生物剂、抗炎剂、麻醉剂等。
根据是否期望局部还是全身性治疗以及待治疗的区域,可以以许多方式施用药物组合物。施用可以是局部(包含眼部、阴道、直肠、鼻内)、口服、吸入或肠胃外施用,例如通过静脉滴注、皮下、腹膜内或肌内注射。所公开的抗体可以静脉内、腹膜内、肌肉内、皮下、腔内或透皮施用。
用于肠胃外施用的制剂包含无菌水溶液或非水溶液、悬浮液和乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油(如橄榄油)以及可注射有机酯(如油酸乙酯)。水性载体包含水、醇性/水溶液、乳液或悬浮液,包含盐水和缓冲介质。肠胃外媒剂包含氯化钠溶液、林格氏右旋糖(Ringer's dextrose)、右旋糖和氯化钠、乳酸林格氏液或固定油。静脉内媒剂包含流体和营养补充剂、电解质补充剂(如基于林格氏右旋糖的那些补充剂)等。也可以存在防腐剂和其它添加剂,如例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
用于局部施用的调配物可以包含油膏剂、洗剂、乳膏剂、凝胶剂、滴剂、栓剂、喷雾剂、液体和粉末。常规的药物载体、水性、粉末或油性基质、增稠剂等可能是必要的或期望的。
用于口服施用的组合物包含粉末或颗粒剂、在水或非水性介质中的悬浮液或溶液、胶囊、囊剂或片剂。增稠剂、调味剂、稀释剂、乳化剂、分散助剂或粘合剂可以是期望的。
所述组合物中的一些组合物可以潜在地呈药学上可接受的酸加成盐或碱加成盐形式施用,所述酸加成盐或碱加成盐是通过与以下各酸反应形成:无机酸,如盐酸、氢溴酸、高氯酸、硝酸、硫氰酸、硫酸和磷酸;和有机酸,如甲酸、乙酸、丙酸、乙醇酸、乳酸、丙酮酸、草酸、丙二酸、琥珀酸、马来酸和富马酸;或通过与以下各碱反应形成:无机碱,如氢氧化钠、氢氧化铵、氢氧化钾;和有机碱,如单烷基胺、二烷基、三烷基胺和芳基胺以及经取代的乙醇胺。
b)治疗用途
用于施用组合物的有效剂量和方案可以凭经验测定,并且进行此类测定在本领域的技术范围内。施用组合物的剂量范围是足够大到以产生其中病症症状受影响的期望效果的剂量范围。剂量不应大到引起不良副作用,如不想要的交叉反应、过敏反应等。通常,剂量将随着患者的年龄、状况、性别和疾病程度、施用途径或者其它药物是否包含在方案中而变化,并且可以由本领域的技术人员确定。在任何禁忌症的情况下,可以由个体医师调整剂量。剂量可以变化,并且可以每天一次或多次剂量施用来施用,持续一天或数天。可以在文献中找到针对给定类别的药物产品的适当剂量的指导。例如,可以在有关抗体治疗用途的文献中找到选择适当的抗体剂量的指南,例如,《单克隆抗体手册(Handbook ofMonoclonal Antibodies)》,Ferrone等人编辑,新泽西州帕克里奇的诺伊斯出版社(NogesPublications,Park Ridge,N.J.),(1985)第22章和第303-357页;Smith等人,《人诊断和疗法中的抗体(Antibodies in Human Diagnosis and Therapy)》,Haber等人编辑,纽约的雷文出版社(Raven Press,New York)(1977)第365-389页。根据上文所提及的因素,单独使用的抗体的典型日剂量范围可以在每天约1μg/kg体重到至多100mg/kg体重或更多。
C.使用组合物的方法
1.转导免疫细胞以及制备嵌合抗原受体细胞的方法
在一个方面,本文公开了转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞),包含免疫和非免疫原代细胞,以及细胞系)的方法,以及制备嵌合抗原受体免疫细胞的方法,所述方法包括:a)获得i)细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)、非免疫细胞(例如,间充质干细胞(MSC)、造血干细胞(HSC)、树突状细胞、神经干细胞、诱导多能干细胞或胰岛细胞),包含免疫和非免疫原代细胞,以及细胞系)和ii)载体,所述载体编码和/或包封外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA,例如,嵌合抗原受体(CAR)基因;b)将所述细胞和载体应用于支架(例如,生物相容性水凝胶基质和/或干支架,例如,包括海藻酸盐的水凝胶和/或干支架),并且在一些方面,将所述支架、细胞和载体一起温育。在一些方面,所述支架进一步包括T细胞受体或NK细胞受体的配体或抗体(包含但不限于抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)。
应当理解并且在本文中设想的是,经转导的细胞可以在施用之前与支架一起温育,以确保经转导的细胞合并到支架中并且通过载体转导。在一个方面,免疫细胞与支架一起温育,持续至少1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天或14天。在一个方面,细胞和支架可以在没有温育的情况下施用。
在一个方面,本文公开了转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)以及任何可商购获得的细胞或细胞系)的方法,以及制备本文所公开的嵌合抗原受体免疫细胞的方法,其中所述细胞是原初细胞。如上所述,经转导的细胞可以是来自可商购获得的细胞系的细胞。可以转导的示例性细胞包含但不限于NCI-H295R、5637、HT-1376、J82、SW 780、T24、T24-Luc-Neo、T24P、BT142、D54-Luc、DBTRG(肿瘤)、DBTRG-05MG、Gli36-DsRed-R-Luc(救出)、LN-18、LN-229、LN-827(pMMP-LucNeo)、M059K、SF-295、SF-539、SF-767、SNB-19、U-251、U-251-Luc-mCh-Puro、U-87MG、U-87MG-Luc、Ca Ski、HeLa、KB、C2BBe1、Caco-2、COLO 205、COLO 205-Luc#2、DLD-1、HCC2998、HCT-116、HCT-116-Luc、HCT-15、HCT-8、HT-29、HT-29-Luc、LoVo、LoVo-6-Luc1、LS 174T、LS411N、NCI-H508、SW-480、SW-620、A-431、HEKn、HEL、HEL 92.1.7、HEL 92.1.7-Luc-Neo、HEL-Luc-Neo、TF-1a-Luc-Neo、OE33、A4573、Hs 895.T、NHDF(正常人皮肤成纤维细胞)、TE353.Sk、TE 354.T、GIST-T1、NCI-N87、NUGC-4、SNU-5、CAL 27、FaDu、L1210、M-NFS-60、HL-60、EOL-1、Kasumi-1、Kasumi-3、Kasumi-3-Luc-mCh-Puro、KG-1-Luc-mCh-Puro、MOLM-13、MV-4-11、MV-4-11-Luc-mCh-Puro、NOMO-1、THP-1、NALM6、NALM6-Luc-MCh-Puro、Reh、Reh(pMMP-Luc-Neo)、K-562、K-562-Luc2、ARH-77、CCRF-CEM、DND-41-Luc-mCh-Puro、Jurkat、Jurkat-克隆E6-1、MOLT-4、MOLT-4-Luc-MCh-Puro、Hep 3B2.1-7、Hep G2、LL、LL/2、LL/2-Luc-M38、NCI-H596、Calu-6、NCI-H322M、A549、A549-Luc-C8、Calu-1、Calu-3、HCC827、HCC827-Luc-mCh-Puro、NCI-H125、NCI-H125-Luc、NCI-H1299、NCI-H1650、NCI-H1703、NCI-H1703-Luc-mCh-Puro、NCI-H1975、NCI-H1975-Luc、NCI-H2110、NCI-H2122、NCI-H23、NCI-H292、NCI-H3122、NCI-H441、NCI-H460、NCI-H460-Luc2、NCI-H522、PC-9、DMS 114、NCI-H446、NCI-H69、NCI-H82、SHP-77、EBC-1、SK-MES-1、RL、DB、DB/M2、GRANTA-519、Farange、B-JAB、Daudi、Daudi-Luc-mCh-Puro、NAMALWA、Raji、Raji-Luc、Ramos、Ramos-Luc、HuT78、HT、SU-DHL-6、SU-DHL-6-Luc-mCh-Puro、OCI-Ly1 LN、OCI-Ly19-Luc-Neo、OCI-Ly3-Luc-mCh-Puro、OCI-Ly7-Luc-mCh-Puro(救出)、OCI-Ly7-Luc-Neo、Pfeiffer、SU-DHL-10、SU-DHL-10-LN-高、SU-DHL-16、SU-DHL-4-Luc-mCh-Puro、SU-DHL-8、TMD8、Toledo-Luc-Neo、WSU-DLCL2、WSU-FSCCL、WSU-FSCCL-CMV-Luc-Puro、WSU-FSCCL-MSCV-Luc-Puro-copGFP、NK-92MI、KARPAS 299、BT-20、BT-474、HCC1395、HCC70、Hs 578Bst、Hs 578T、MCF 10A、MCF-7、MCF7-Luc-mCh-Puro、MDA-MB-231、MDA-MB-231-2LMP、MDA-MB-231-Luc-D3H1、MDA-MB-231-Luc-D3H2、MDA-MB-231-Luc-D3H2LN、MDA-MB-231-Luc-D3H3、MDA-MB-361、MDA-MB-453、MDA-MB-468、MX-1、MX-1-Luc、SK-BR-3、T47D、UISO-BCA-1、ZR-75-1、A2058、A375、COLO 829、G-361、LOX-IMVI、M14、MDA-MB-435S、OCM-1、OCM-1-Luc-mCh-Puro、PA-NUT、SK-MEL-28、SK-MEL-28-Luc-mCh-Puro、SK-MEL-5、UACC-62、WM-115、WM-266-4、JJN-3-Luc、MM.1S(pMMP-Luc-Neo)、NCI-H929、NCI-H929-Luc-mCh-Puro、OPM-2、RPMI 8226、U266B1、SK-N-AS、SK-N-FI、SK-N-SH、MKL-1、A2780、A2780-Luc、IGROV1、IGROV1-Luc-Mch-Puro、OVCAR-4、OVCAR-5、OVCAR-5-Luc-mCh-Puro、OVCAR-8、OVCAR-8-Luc-mCh-Puro、SK-OV-3(皮下)、SK-OV-3-Luc-D3(腹膜内)、Bx-PC-3、BxPC-3-Luc2、Capan-1、Capan-2、KP4、MIA PaCa-2、MIA PaCa-2-Luc、PANC-1、PANC-1-Luc、SU-86.86、SW 1990、22Rv1、CWR-22-R、DU 145、DU 145-Luc、LnCap、LnCap克隆FGC、PC-3、PC-3-Luc、PC-3M-Luc-C6(心脏内)、PC-3M-Luc-C6(原位)、PC-3M-Luc-C6(胫前)、PC-3M-Luc-C6(SC-腋窝)、VCaP、769-P、786-O、786-O-Luc-Neo(救出)、A-498、ACHN、Caki-1、TK-10、A-673、HT-1080、MG-63、Saos-2、SJSA-1、SW 872、MB-1、TT、SK-LMS-1、293T、HEK293或HeLa细胞。还应理解并且在本文中设想的是,经转导的细胞可以是贴壁细胞(例如,HEK细胞)或非贴壁细胞(例如,T细胞)或细胞系。
可以以此方式转导的细胞的其它实例包含人或动物来源的原代细胞。此类原代细胞的实例包含但不限于造血细胞、单核细胞(外周血单核细胞、脐带血单核、巨噬细胞等)、胚胎细胞、原始生殖细胞、卵母细胞、卵原细胞、卵细胞、精母细胞、精子、红细胞前体细胞、淋巴母细胞、成熟血细胞、淋巴细胞(包含但不限于B细胞、CD4 T细胞、CD8 T细胞、γδT细胞、NK细胞、NK T细胞)、成纤维细胞、神经母细胞、神经细胞、内皮细胞、血管内皮细胞、肝细胞、上皮细胞、角质形成细胞、胰岛细胞、成肌细胞、骨骼肌细胞、平滑肌细胞、癌细胞、骨髓瘤细胞和白血病细胞。
应当理解并且在本文中设想的是,为了完全激活免疫细胞,可能需要共刺激信号。因此,在一个方面,本文公开了根据本文所公开的转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润性NK细胞(TINK)或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL))的方法中的任何方法,以及本文所公开的制备嵌合抗原受体免疫细胞的方法中的任何方法,其中所述支架进一步包括通过T细胞、NK细胞或NK T细胞共刺激受体诱导信号传导的配体或抗体,所述配体或抗体包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。
本文还公开了本文公开的转导细胞(例如,免疫细胞(例如,T细胞、自然杀伤(NK)细胞、NK T细胞、肿瘤浸润淋巴细胞(TIL)、巨噬细胞、肿瘤浸润性NK细胞(TINK)和/或骨髓浸润性淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL))的方法中的任何方法,以及本文所公开的制备嵌合抗原受体免疫细胞的方法中的任何方法,其中所述支架进一步包括一种或多种细胞因子(例如,IL-2、TNF-α和/或IFN-γ)。
2.治疗癌症的方法。
应当理解并且在本文中设想的是,所公开的水凝胶和/或干支架可以用于癌症或转移的治疗、抑制、减少、改善和/或预防。因此,本文公开了治疗、抑制、减少、降低、改善和/或预防受试者的癌症和/或转移的方法,所述方法包括向所述受试者施用本文所公开的水凝胶基质和/或干支架中的任何水凝胶基质和/或干支架(包含但不限于包括激活免疫细胞受体的配体或抗体以及编码嵌合抗原受体的载体的支架,免疫细胞已经应用于所述支架并且合并到所述支架中)。因此,在一个方面,本文公开了治疗、减少、抑制、改善、降低和/或预防受试者的癌症和/或转移的方法,所述方法包括:a)获得i)细胞(例如,免疫细胞,包含但不限于T细胞、自然杀伤(NK)细胞、NK T细胞、巨噬细胞、肿瘤浸润淋巴细胞(TIL)、肿瘤浸润NK细胞(TINK)或骨髓浸润淋巴细胞(MIL),包含但不限于从自体、同种异体和/或单倍体相同供体来源获得的T细胞、NK细胞、NK-T细胞、巨噬细胞、TIL、TINK和/或MIL)和ii)载体(例如,慢病毒、逆转录病毒、腺病毒、腺相关病毒、病毒样颗粒、细胞模拟颗粒、转座子、外泌体、纳米颗粒、胶束或脂质体),所述载体编码和/或包封外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化的基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA,例如,嵌合抗原受体(CAR)基因;b)将所述细胞和所述载体应用于支架(例如,生物相容性水凝胶基质和/或生物相容性干支架,包含但不限于包括海藻酸盐的支架和水凝胶);c)将所述免疫细胞与水凝胶和/或干支架一起温育;以及d)向所述受试者使用具有所述免疫细胞的所述水凝胶和/或干支架,或者向所述受试者施用已经与所述水凝胶一起温育的所述免疫细胞。在一些方面,具有免疫细胞的水凝胶和/或干支架可以在施用前在没有温育的情况下施用。在某一方面,支架可以进一步包括细胞受体(如T细胞受体或NK细胞受体)的配体或抗体(包含但不限于抗CD3抗体、CD1d、免疫球蛋白的Fc片段或抗Fcγ受体(FcγRIII)抗体)或任何所关注蛋白质。
应当理解并且在本文中设想的是,经转导的细胞可以在施用之前与支架(包含本文所公开的任何干支架或水凝胶)一起温育,以确保细胞合并到支架中并且通过载体转导。在一个方面,免疫细胞与支架一起温育,持续至少1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天或14天。在一个方面,细胞和支架可以在没有温育的情况下施用。
应当理解并且在本文中设想的是,为了完全激活免疫细胞,可能需要共刺激信号。因此,在一个方面,本文公开了本文所公开的治疗、抑制、减少、降低、改善和/或预防受试者的癌症或转移的方法中的任何方法,其中所述支架进一步包括通过T细胞、NK细胞或NK T细胞共刺激受体诱导信号传导的配体或抗体,所述配体或抗体包含但不限于抗CD28、B7-1、B7-2、抗诱导型共刺激物(ICOS)、ICOS配体、抗CD27、CD70、4-1BBL、抗41-BB、抗CD40L、CD40、抗DAP10、抗CD30、CD30L、抗TIM-1、抗TIM-2、抗TIM-3、抗CD44、抗NK1.1、凝集素样转录物-1(LLT-1)、抗CD137、CD48、MICA、抗2B4和抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)。
应当理解并且在本文中设想的是,支架的一个优点是经转导的细胞(即,免疫或非免疫细胞)的缓慢释放,所述经转导的细胞现在用外源基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA和/或编码所述siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA、miRNA的DNA(包含但不限于工程化基因、siRNA、tasiRNA、lncRNA、shRNA、mRNA、gRNA和/或miRNA)转化并且用细胞受体(例如,免疫细胞受体)的配体或抗体激活到肿瘤微环境中。因此,在一个方面,本文公开了治疗、抑制、减少、降低、改善和/或预防受试者的癌症或转移的方法,其中所述支架(水凝胶基质和/或干支架)中的所述载体转导所述免疫细胞,并且在至少1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、54小时、60小时、66小时、72小时、84小时、96小时、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、24天、25天、26天、27天、28天、29天、30天、31天、32天、45天、58天、59天、60天、61天、62天、90天、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月、24个月、36个月、4年、5年、6年、7年、8年、9年、10年的时间段内施用所述支架后,所述支架中的经转导的免疫细胞可以释放到受试者体内的癌症位点处。在一个方面,所述免疫细胞在施用所述水凝胶和/或干支架后约1周至约12周从所述水凝胶和/或干支架中释放。
所公开的水凝胶和/或干支架还可以包括额外的药剂,以刺激患有癌症的受体受试者的内源性免疫应答。因此,在一个方面,本文公开了治疗、抑制、减少、降低、改善和/或预防受试者的癌症或转移的方法,其中所述支架进一步包括抗癌剂(例如,免疫阻断抑制剂或化疗剂)。
应当理解并且在本文中设想的是,在所公开的治疗、预防、抑制和/或减少癌症或转移的方法中使用的所公开的水凝胶基质和/或干支架可以进一步包括一种或多种免疫阻断抑制剂和/或化疗剂。可以用于所公开的水凝胶基质和/或干支架中的化疗剂可以包括本领域已知的任何化疗剂,包含但不限于阿贝西利(Abemaciclib)、醋酸阿比特龙(Abiraterone Acetate)、甲氨蝶呤(Abitrexate/Methotrexate)、紫杉醇(Abraxane)(紫杉醇(Paclitaxel)白蛋白稳定纳米颗粒调配物)、ABVD、ABVE、ABVE-PC、AC、AC-T、本妥昔单抗(Adcetris/Brentuximab Vedotin)、ADE、阿多曲妥珠单抗美坦新(Ado-TrastuzumabEmtansine)、阿霉素(Adriamycin)(盐酸多柔比星(Doxorubicin Hydrochloride))、马来酸阿法替尼(Afatinib Dimaleate)、飞尼妥(Afinitor)(依维莫司(Everolimus))、奥康泽(Akynzeo)(奈妥吡坦(Netupitant)和盐酸帕洛诺司琼(Palonosetron Hydrochloride))、艾达乐(Aldara)(咪喹莫特(Imiquimod))、阿地白介素(Aldesleukin)、艾乐替尼(Alecensa)(艾乐替尼(Alectinib))、艾乐替尼(Alectinib)、阿仑单抗(Alemtuzumab)、爱宁达(Alimta)(培美曲塞二钠(Pemetrexed Disodium))、安列库帕(Aliqopa)(盐酸库潘尼西(Copanlisib Hydrochloride))、用于注射的爱克兰(Alkeran)(盐酸美法仑(MelphalanHydrochloride)、爱克兰片剂(美法仑)、阿乐喜(Aloxi)(盐酸帕洛诺司琼(PalonosetronHydrochloride))、布吉他滨(Alunbrig)(布吉替尼(Brigatinib))、苯丁酸氮芥(Ambochlorin/Chlorambucil)、苯丁酸氮芥(Amboclorin/Chlorambucil)、氨磷汀(Amifostine)、氨基乙酰丙酸(Aminolevulinic Acid)、阿那曲唑(Anastrozole)、阿瑞匹坦(Aprepitant)、阿可达(Aredia)(帕米膦酸二钠(Pamidronate Disodium))、瑞宁得(Arimidex)(阿那曲唑(Anastrozole))、阿诺新(Aromasin)(依西美坦(Exemestane)),阿仑恩(Arranon)(奈拉滨(Nelarabine))、三氧化二砷(Arsenic Trioxide)、Arzerra(奥法木单抗(Ofatumumab))、菊欧文氏菌天冬酰胺酶(Asparaginase Erwinia chrysanthemi)、阿特朱单抗(Atezolizumab)、阿瓦斯丁(Avastin)(贝伐珠单抗(Bevacizumab))、阿维单抗(Avelumab)、阿昔替尼(Axitinib)、阿扎胞苷(Azacitidine)、阿维单抗(Bavencio/Avelumab)、BEACOPP、Becenum(卡莫司汀(Carmustine))、贝利司他(Beleodaq)(贝利司他(Belinostat))、贝利司他、盐酸苯达莫司汀(Bendamustine Hydrochloride)、BEP、Besponsa(奥英妥珠单抗(Inotuzumab Ozogamicin))、贝伐单抗(Bevacizumab)、贝沙罗汀(Bexarotene)、百克沙(Bexxar)(托西莫单抗(Tositumomab)和碘I 131托西莫单抗)、比卡鲁胺(Bicalutamide)、BiCNU(卡莫司汀(Carmustine))、博莱霉素(Bleomycin)、博纳吐单抗(Blinatumomab)、百利妥(Blincyto)(博纳吐单抗(Blinatumomab))、硼替佐米(Bortezomib)、Bosulif(博舒替尼(Bosutinib))、博舒替尼、本妥昔单抗(BrentuximabVedotin)、布加替尼(Brigatinib)、BuMel、白消安(Busulfan)、白舒非(Busulfex)(白消安)、卡巴他赛(Cabazitaxel)、卡博替尼(Cabometyx)(苹果酸卡博替尼(Cabozantinib-S-Malate))、苹果酸卡博替尼、CAF、坎帕斯(Campath)(阿仑单抗(Alemtuzumab))、伊立替康(Camptosar)(盐酸伊立替康(Irinotecan Hydrochloride))、卡培他滨(Capecitabine)、CAPOX、查拉克(Carac)(氟脲嘧啶(Fluorouracil)-外用)、卡铂(Carboplatin)、卡铂-紫杉醇(CARBOPLATIN-TAXOL)、卡非佐米(Carfilzomib)、卡莫司汀(Carmubris/Carmustine)、卡莫司汀、卡莫司汀植入(Carmustine Implant)、康士得(Casodex)(比卡鲁胺(Bicalutamide))、CEM、色瑞替尼(Ceritinib)、柔红霉素(Cerubidine)(盐酸柔红霉素(Daunorubicin Hydrochloride))、希瑞适(Cervarix)(重组HPV二价疫苗)、西妥昔单抗(Cetuximab)、CEV、瘤可宁(Chlorambucil)、瘤可宁-泼尼松(CHLORAMBUCIL-PREDNISONE)、CHOP、顺铂(Cisplatin)、克拉屈滨(Cladribine)、环磷酰胺(Clafen/Cyclophosphamide)、氯法拉滨(Clofarabine)、克罗拉滨(Clofarex)(氯法拉滨)、Clolar(氯法拉滨)、CMF、考比替尼(Cobimetinib)、卡博替尼(Cometriq)(苹果酸卡博替尼(Cabozantinib-S-Malate))、盐酸库潘尼西、COPDAC、COPP、COPP-ABV、可美净(Cosmegen)(更生霉素(Dactinomycin))、可泰利(Cotellic)(考比替尼(Cobimetinib))、克唑替尼(Crizotinib)、CVP、环磷酰胺、Cyfos(异环磷酰胺(Ifosfamide))、欣锐泽(Cyramza)(雷莫芦单抗(Ramucirumab))、阿糖孢苷(Cytarabine)、阿糖胞苷脂质体(Cytarabine Liposome)、赛德萨-U(Cytosar-U)(阿糖孢苷)、环磷酰(Cytoxan/Cyclophosphamide)、达拉菲尼(Dabrafenib)、达卡巴嗪(Dacarbazine)、达克金(Dacogen)(地西他滨(Decitabine))、更生霉素(Dactinomycin)、达雷木单抗(Daratumumab),达拉他滨(Darzalex)(达雷木单抗(Daratumumab))、达沙替尼(Dasatinib)、盐酸柔红霉素(Daunorubicin Hydrochloride)、盐酸柔红霉素和阿糖胞苷脂质体、地西他滨(Decitabine)、去纤苷钠(Defibrotide Sodium)、去纤维钠(Defitelio)(去纤苷钠)、地加瑞克(Degarelix)、地尼白介素(Denileukin Diftitox)、狄诺塞麦(Denosumab)、阿糖胞苷(DepoCyt)(阿糖胞苷脂质体)、地塞米松(Dexamethasone)、盐酸右雷佐生(Dexrazoxane Hydrochloride)、达妥昔单抗(Dinutuximab)、多西他赛(Docetaxel)、多喜(Doxil)(盐酸多柔比星脂质体(Doxorubicin HydrochlorideLiposome))、盐酸多柔吡星(Doxorubicin Hydrochloride)、盐酸多柔比星脂质体、Dox-SL(盐酸多柔比星脂质体)、DTIC-Dome(达卡巴嗪)、度伐利尤单抗(Durvalumab)、宜肤涤(Efudex)(氟脲嘧啶-外用)、癌立克(Elitek)(拉布立酶(Rasburicase))、Ellence(盐酸表柔比星(Epirubicin Hydrochloride))、艾洛珠单抗(Elotuzumab)、乐沙定(Eloxatin)(奥沙利铂(Oxaliplatin))、伊屈泼帕乙醇胺(Eltrombopag Olamine)、止敏吐(Emend)(阿瑞匹坦(Aprepitant))、Empliciti(艾洛珠单抗)、甲磺酸恩西地平(Enasidenib Mesylate)、恩杂鲁胺(Enzalutamide)、盐酸表柔比星、EPOCH、爱必妥(Erbitux)(西妥昔单抗)、甲磺酸艾日布林(Eribulin Mesylate)、爱维德(Erivedge)(维莫德吉(Vismodegib))、盐酸埃罗替尼(Erlotinib Hydrochloride)、Erwinaze(菊欧文氏菌天冬酰胺酶)、Ethyol(氨磷汀)、凡毕复(Etopophos)(磷酸依托泊甙(Etoposide Phosphate))、依托泊苷、磷酸依托泊苷、Evacet(盐酸多柔比星脂质体)、依维莫司、易维特(Evista)(盐酸雷洛昔芬(RaloxifeneHydrochloride))、优维宁(Evomela)(盐酸美法仑(Melphalan Hydrochloride))、依西美坦(Exemestane),5-FU(氟脲嘧啶(Fluorouracil)注射液)、5-FU(氟脲嘧啶-外用)、法乐通(Fareston)(托瑞米芬(Toremifene))、Farydak(帕比司他(Panobinostat))、法洛德(Faslodex)(氟维司群(Fulvestrant))、FEC、弗隆(Femara)(来曲唑(Letrozole))、非格司亭(Filgrastim)、氟达拉滨(Fludara)(磷酸氟达拉滨(Fludarabine Phosphate))、磷酸氟达拉滨、氟脲嘧啶(氟脲嘧啶-外用)、氟脲嘧啶注射液、氟脲嘧啶-外用、氟他米特(Flutamide)、重氮片(Folex)(甲氨蝶呤)、重氮片PFS(甲氨蝶呤)、FOLFIRI、FOLFIRI-贝伐单抗、FOLFIRI-西妥昔单抗、FOLFIRINOX、FOLFOX、服瘤停(Folotyn)(普拉曲沙)、FU-LV、氟维司群(Fulvestrant)、加德西(Gardasil)(重组HPV四价疫苗)、加德西9(重组HPV无价疫苗)、癌即瓦(Gazyva)(奥滨尤妥珠单抗(Obinutuzumab))、吉非替尼(Gefitinib)、盐酸吉西他滨(Gemcitabine Hydrochloride)、吉西他滨(GEMCITABINE)-顺铂、吉西他滨-奥沙利铂、吉妥珠单抗奥佐米星(Gemtuzumab Ozogamicin)、健择(Gemzar)(盐酸吉西他滨)、吉泰瑞(Gilotrif)(马来酸阿法替尼)、格列卫(Gleevec)(甲磺酸伊马替尼(ImatinibMesylate))、Gliadel(Carmustine Implant),格立得植入剂(Gliadel Wafer)(卡莫司汀植入膜剂(Carmustine Implant))、羧肽酶(Glucarpidase)、醋酸戈舍瑞林(GoserelinAcetate)、贺乐维(Halaven)(甲磺酸艾日布林)、Hemangeol(盐酸普萘洛尔(PropranololHydrochloride))、赫赛汀(Herceptin)(曲妥珠单抗(Trastuzumab))、HPV二价疫苗、重组无价疫苗、重组HPV四价疫苗、重组和美新(Hycamtin)(盐酸托泊替康(TopotecanHydrochloride))、爱治(Hydrea)(羟基脲(Hydroxyurea))、羟基脲、地塞米松(Hyper-CVAD)、爱博新(Ibrance)(帕博西尼(Palbociclib))、替伊莫单抗(IbritumomabTiuxetan)、依鲁替尼(Ibrutinib)、ICE、英可欣(Iclusig)(盐酸帕纳替尼(PonatinibHydrochloride))、盐酸伊达比星(Idamycin/Idarubicin Hydrochloride)、盐酸伊达比星、艾代拉里斯(Idelalisib)、Idhifa(甲磺酸恩西地)、Ifex(异环磷酰胺(Ifosfamide))、异环磷酰胺、异环磷酰胺(Ifosfamidum/Ifosfamide)、IL-2(阿地白介素)、甲磺酸伊马替尼(Imatinib Mesylate)、亿珂(Imbruvica)(依鲁替尼(Ibrutinib))、英飞凡(Imfinzi)(度伐利尤单抗)、咪喹莫特(Imiquimod)、Imlygic(Talimogene Laherparepvec)、英立达(Inlyta)(阿昔替尼)、奥英妥珠单抗、干扰素(Interferon)α-2b、重组白介素-2(阿地白介素)、干扰素A(重组干扰素α-2b)、碘I 131托西莫单抗和托西莫单抗、伊匹木单抗(Ipilimumab)、易瑞沙(Iressa)(吉非替尼(Gefitinib))、盐酸伊立替康(IrinotecanHydrochloride)、盐酸伊立替康脂质体(Irinotecan Hydrochloride Liposome)、Istodax(罗米地辛(Romidepsin))、伊沙匹隆(Ixabepilone)、枸橼酸艾沙佐米(IxazomibCitrate)、易莎平(Ixempra)(伊沙匹隆(Ixabepilone))、捷恪卫(Jakafi)(磷酸鲁索替尼(Ruxolitinib Phosphate))、JEB、去癌达(Jevtana)(卡巴他塞(Cabazitaxel))、贺癌宁(Kadcyla)(阿多曲妥珠单抗美坦新)、克洛昔芬(Keoxifene)(盐酸雷洛昔芬(RaloxifeneHydrochloride))、凯望斯(Kepivance)(帕利夫明(Palifermin))、可瑞达(Keytruda)(派姆单抗(Pembrolizumab))、击癌利(Kisqali)(瑞博西尼(Ribociclib))、Kymriah(Tisagenlecleucel)、Kyprolis(卡非佐米)、醋酸兰瑞肽(Lanreotide Acetate)、二甲苯磺酸拉帕替尼(Lapatinib Ditosylate)、乐除瘤(Lartruvo)(奥拉单抗(Olaratumab))、来那度胺、甲磺酸乐伐替尼(Lenvatinib Mesylate)、乐卫玛(Lenvima)(甲磺酸乐伐替尼)、来曲唑(Letrozole)、亚叶酸钙、瘤可宁(苯丁酸氮芥(Chlorambucil))、醋酸亮丙瑞林(Leuprolide Acetate)、克拉屈滨(Leustatin/Cladribine)、Levulan(氨基乙酰丙酸(Aminolevulinic Acid))、Linfolizin(苯丁酸氮芥)、LipoDox(盐酸多柔比星脂质体)、洛莫司丁(Lomustine)、朗斯弗(Lonsurf)(三氟尿苷(Trifluridine)和地匹福林盐酸盐(Tipiracil Hydrochloride))、利普安(Lupron)(醋酸亮丙瑞林)、利普安Depot(醋酸亮丙瑞林)、利普安Depot-Ped(醋酸亮丙瑞林)、令癌莎(Lynparza)(奥拉帕尼(Olaparib))、Marqibo(硫酸长春新碱脂质体(Vincristine Sulfate Liposome))、甲基苄肼(Matulane)(盐酸丙卡巴肼(Procarbazine Hydrochloride))、盐酸氮芥(MechlorethamineHydrochloride)、醋酸甲地孕酮(Megestrol Acetate)、麦欣霓(Mekinist)(曲美替尼(Trametinib))、美法仑(Melphalan)、盐酸美法仑(Melphalan Hydrochloride)、巯嘌呤(Mercaptopurine)、美司钠(Mesna)、美司钠(Mesnex)(美司钠)、替莫唑胺(Methazolastone/Temozolomide)、甲氨蝶呤(Methotrexate)、甲氨蝶呤LPF(甲氨蝶呤)、溴化甲基纳曲酮(Methylnaltrexone Bromide)、氨甲喋呤钠(Mexate)(甲氨蝶呤)、氨甲喋呤钠-AQ(甲氨蝶呤)、米哚妥林(Midostaurin)、丝裂霉素C(Mitomycin C)、盐酸米托蒽醌(Mitoxantrone Hydrochloride)、丝裂霉素(Mitozytrex)(丝裂霉素C)、MOPP、释倍灵(Mozobil)(普乐沙福(Plerixafor))、Mustargen(盐酸氮芥(MechlorethamineHydrochloride))、突变霉素(Mutamycin)(丝裂霉素C)、马勒兰(Myleran)(白消安(Busulfan))、Mylosar(阿扎胞苷(Azacitidine))、麦罗塔(Mylotarg)(奥英妥珠单抗)、纳米粒紫杉醇(Nanoparticle Paclitaxel)(紫杉醇白蛋白稳定的纳米颗粒调配物)、诺维本(Navelbine)(酒石酸长春瑞滨(Vinorelbine Tartrate))、耐昔妥珠单抗(Necitumumab)、奈拉滨(Nelarabine)、Neosar(环磷酰胺)、马来酸来那替尼(Neratinib Maleate)、来那替尼(Nerlynx)(马来酸来那替尼)、奈妥吡坦(Netupitant)和盐酸帕洛诺司琼(PalonosetronHydrochloride)、倍血添(Neulasta)(培非格司亭(Pegfilgrastim))、优保津(Neupogen)(非格司亭(Filgrastim))、蕾莎瓦(Nexavar)(甲苯磺酸索拉非尼(Sorafenib Tosylate))、Nilandron(尼鲁米特(Nilutamide))、尼罗替尼(Nilotinib)、尼鲁米特(Nilutamide)、恩莱瑞(Ninlaro)(枸橼酸艾沙佐米(Ixazomib Citrate))、甲苯磺酸尼拉帕尼一水合物(Niraparib Tosylate Monohydrate)、纳武单抗、Nolvadex(枸橼酸他莫昔芬(TamoxifenCitrate))、恩沛板(Nplate)(罗米司亭(Romiplostim))、奥滨尤妥珠单抗(Obinutuzumab)、Odomzo(索尼德吉(Sonidegib))、OEPA、奥法木单抗(Ofatumumab)、OFF、奥拉帕尼(Olaparib)、奥拉单抗、高三尖杉酯碱(Omacetaxine Mepesuccinate)、昂卡司帕(Oncaspar)(培门冬酶(Pegaspargase))、盐酸昂丹司琼(Ondansetron Hydrochloride)、安能得(Onivyde)(盐酸伊立替康脂质体)、昂塔克(Ontak)(地尼白介素(DenileukinDiftitox))、欧狄沃(Opdivo)(纳武单抗)、OPPA、奥斯替尼(Osimertinib)、奥沙利铂、紫杉醇(Paclitaxel)、紫杉醇白蛋白稳定的纳米颗粒调配物、PAD、帕博西尼(Palbociclib)、帕利夫明(Palifermin)、盐酸帕洛诺司琼(Palonosetron Hydrochloride)、盐酸帕洛诺司琼和奈妥吡坦、帕米膦酸二钠(Pamidronate Disodium)、帕尼单抗(Panitumumab)、帕比司他(Panobinostat)、Paraplat(卡铂)、卡铂(Paraplatin/Carboplatin)、盐酸帕唑帕尼(Pazopanib Hydrochloride)、PCV、PEB、培门冬酶(Pegaspargase)、培非格司亭(Pegfilgrastim)、聚乙二醇干扰素α-2b(Peginterferon Alfa-2b)、PEG-干扰素(聚乙二醇干扰素α-2b)、派姆单抗(Pembrolizumab)、培美曲塞二钠(Pemetrexed Disodium)、帕捷特(Perjeta)(帕妥珠单抗(Pertuzumab))、帕妥珠单抗、Platinol(顺铂)、Platinol-AQ(顺铂),普乐沙福(Plerixafor)、泊马度胺(Pomalidomide)、铂美特(Pomalyst)(泊马度胺)、盐酸帕纳替尼、搏癌莎(Portrazza)(耐昔妥珠单抗)、普拉曲塞特(Pralatrexate)、强的松(Prednisone)、盐酸丙卡巴肼(Procarbazine Hydrochloride)、普留净(Proleukin)(阿地白介素)、普罗利亚(Prolia)(地诺单抗(Denosumab))、艾曲波帕(Promacta)(艾曲波帕乙醇胺(Eltrombopag Olamine))、盐酸普萘洛尔、普列威(Provenge)(西普鲁塞(Sipuleucel)-T)、巯基嘌呤(Purinethol)(巯嘌呤)、巯嘌呤(Purixan)(巯嘌呤)、二氯化镭223(Radium223Dichloride)、盐酸雷洛昔芬(Raloxifene Hydrochloride)、雷莫芦单抗(Ramucirumab)、拉布立酶(Rasburicase)、R-CHOP、R-CVP、重组人乳头瘤病毒(HPV)二价疫苗、重组人乳头瘤病毒(HPV)无价疫苗、重组人乳头瘤病毒(HPV)四价疫苗、重组干扰素α-2b、瑞戈非尼(Regorafenib)、乐立适(Relistor)(溴化甲基纳曲酮(MethylnaltrexoneBromide))、R-EPOCH、雷利米得(Revlimid)(来那度胺)、甲氨蝶呤(Rheumatrex)(甲氨蝶呤(Methotrexate))、瑞博西尼(Ribociclib)、R-ICE、瑞图宣(Rituxan)(利妥昔单抗(Rituximab))、利妥昔单抗透明质酸酶(Rituxan Hycela)(利妥昔单抗和人类透明质酸酶(Rituximab and Hyaluronidase Human))、利妥昔单抗、利妥昔单抗和人类透明质酸酶、盐酸罗拉吡坦(Rolapitant Hydrochloride)、罗米地辛(Romidepsin)、罗米司亭(Romiplostim)、红比霉素(Rubidomycin)(盐酸柔红霉素)、芦卡帕尼(Rubraca)(瑞卡帕布樟脑磺酸盐(Rucaparib Camsylate))、瑞卡帕布樟脑磺酸盐(Rucaparib Camsylate)、磷酸鲁索替尼(Ruxolitinib Phosphate)、里达普(Rydapt)(米哚妥林)、无菌滑石粉气雾剂(Sclerosol Intrapleural Aerosol)(滑石(Talc))、司妥昔单抗(Siltuximab)、西普鲁塞-T(Sipuleucel-T)、索马杜林(Somatuline Depot)(醋酸兰瑞肽(Lanreotide Acetate))、索尼德吉(Sonidegib)、甲苯磺酸索拉非尼(Sorafenib Tosylate)、施达赛(Sprycel)(达沙替尼)、STANFORD V、无菌滑石粉(Sterile Talc Powder)(滑石)、Steritalc(滑石)、癌瑞格(Stivarga)(瑞戈非尼)、苹果酸舒尼替尼(Sunitinib Malate)、索坦(苹果酸舒尼替尼)、Sylatron(聚乙二醇干扰素α-2b)、斯尔万(Sylvant)(司妥昔单抗)、Synribo(高三尖杉酯碱(Omacetaxine Mepesuccinate))、泰博洛依(Tabloid)(硫鸟嘌呤(Thioguanine))、TAC、达拉菲尼(Tafinlar)(达拉菲尼(Dabrafenib))、泰瑞沙(Tagrisso)(奥斯替尼)、滑石、Talimogene Laherparepvec、枸橼酸它莫西芬(Tamoxifen Citrate)、塔拉宾PFS(TarabinePFS)(阿糖孢苷)、特罗凯(Tarceva)(盐酸埃罗替尼)、塔革雷汀(Targretin)(贝沙罗汀)、达希纳(Tasigna)(尼罗替尼)、泰素(Taxol)(紫杉醇)、泰素帝(Taxotere)(多西他赛(Docetaxel))、癌自禦(Tecentriq)(阿特朱单抗)、帝盟多(Temodar)(替莫唑胺(Temozolomide))、替莫唑胺、替西罗莫司、沙利度胺(Thalidomide)、沙利度胺(Thalidomide)(沙利度胺)、硫鸟嘌呤(Thioguanine)、噻替哌(Thiotepa)、Tisagenlecleucel、Tolak(氟脲嘧啶-外用)、盐酸托泊替康、托瑞米芬(Toremifene)、驮瑞塞尔(Torisel)(替西罗莫司)、托西莫单抗和碘I 131托西莫单抗、Totect(盐酸右雷佐生(Dexrazoxane Hydrochloride))、TPF、曲贝替定(Trabectedin)、曲美替尼(Trametinib)、曲妥珠单抗、Treanda(盐酸苯达莫司汀)、三氟尿苷和地匹福林盐酸盐(Trifluridine andTipiracil Hydrochloride)、Trisenox(三氧化二砷)、泰克博(Tykerb)(二甲苯磺酸拉帕替尼)、优尼图希(Unituxin)(达妥昔单抗)、尿苷三乙酸酯(Uridine Triacetate)、VAC、凡德他尼(Vandetanib)、VAMP、Varubi(盐酸罗拉吡坦)、维克替比(Vectibix)(帕尼单抗(Panitumumab))、VeIP、Velban(硫酸长春碱(Vinblastine Sulfate)、万珂(Velcade)(硼替佐米)、Velsar(硫酸长春碱)、维莫非尼(Vemurafenib)、维奈托克(Venclexta)(维奈托克(Venetoclax))、维奈托克)、捷癌宁(Verzenio)(玻玛西尼(Abemaciclib))、Viadur(醋酸亮丙瑞林)、维达扎(Vidaza)(阿扎胞苷)、硫酸长春碱、Vincasar PFS(硫酸长春新碱)、硫酸长春新碱、硫酸长春新碱脂质体、酒石酸长春瑞滨(Vinorelbine Tartrate)、VIP、维莫德吉(Vismodegib)、Vistogard(尿苷三乙酸酯(Uridine Triacetate))、维拉莎(Voraxaze)(谷卡匹酶(Glucarpidase))、伏立诺他(Vorinostat)、帕唑帕尼(盐酸帕唑帕尼)、Vyxeos(盐酸柔红霉素和阿糖胞苷脂质体)、亚叶酸钙(Wellcovorin/Leucovorin Calcium)、截剋瘤(Xalkori)(克唑替尼)、希罗达(Xeloda)(卡培他滨)、XELIRI、XELOX、癌骨瓦(Xgeva)(地诺单抗)、镭治骨(Xofigo)(二氯化镭223)、安可坦(Xtandi)(恩杂鲁胺)、益伏(Yervoy)(伊匹木单抗)、Yondelis(曲贝替定)、柔癌捕(Zaltrap)(阿柏西普(Ziv-Aflibercept))、Zarxio(非格司亭)、则乐(Zejula)(甲苯磺酸尼拉帕尼一水合物)、泽波拉夫(Zelboraf)(维莫非尼)、泽娃灵(Zevalin)(替伊莫单抗)、辛卡德(Zinecard)(盐酸右雷佐生)、阿柏西普、Zofran(盐酸昂丹司琼(Ondansetron Hydrochloride))、诺雷德(Zoladex)(醋酸戈舍瑞林)、唑来膦酸(Zoledronic Acid)、Zolinza(伏立诺他(Vorinosta))、择泰(Zometa)(唑来膦酸)、思得适锭(Zydelig)(艾代拉里斯(Idelalisib))、立克癌(色瑞替尼)和/或泽珂(Zytiga)(醋酸阿比特龙)。检查点抑制剂包含但不限于阻断以下的抗体:PD-1(例如,纳武单抗(BMS-936558或MDX1106)、CT-011、MK-3475)、PD-L1(例如,MDX-1105(BMS-936559)、MPDL3280A或MSB0010718C)、PD-L2(例如,rHIgM12B7)、CTLA-4(例如,伊匹单抗(MDX-010)、曲美木单抗(CP-675,206))、IDO、B7-H3(例如,MGA271、MGD009、奥博妥单抗(omburtamab))、B7-H4、B7-H3、具有Ig和ITIM结构域的T细胞免疫受体(TIGIT)(例如,BMS-986207、OMP-313M32、MK-7684、AB-154、ASP-8374、MTIG7192A或PVSRIPO)、CD96、-和T-淋巴细胞衰减子(BTLA)、T细胞激活的V结构域Ig抑制剂(VISTA)(例如,JNJ-61610588、CA-170)、TIM3(例如,TSR-022、MBG453、Sym023、INCAGN2390、LY3321367、BMS-986258、SHR-1702、RO7121661)、LAG-3(例如,BMS-986016、LAG525、MK-4280、REGN3767、TSR-033、BI754111、Sym022、FS118、MGD013和Immutep),以及阻断支配PD-1、CTLA-4、LAG-3、TIGIT、CD96、BTLA、B7-H3、VISTA和TIM-3的配体的抗体,包含但不限于阻断PD-L1、纤维蛋白原样蛋白1(FGL1)、CD112、CD155、疱疹病毒进入介质(HVEM)和Ceacam-1与其各自受体结合的抗体。
所公开的组合物可以用于治疗发生不受控制的细胞增殖的任何疾病,如癌症。可以使用所公开的组合物来治疗的代表性但非限制性癌症列表如下:淋巴瘤、B细胞淋巴瘤、T细胞淋巴瘤、蕈样真菌病、霍奇金氏病(Hodgkin's Disease)、骨髓性白血病、膀胱癌、脑癌、神经系统癌、头颈癌(head and neck cancer)、头颈部鳞状细胞癌、如小细胞肺癌和非小细胞肺癌等肺癌、成神经细胞瘤/胶质母细胞瘤、卵巢癌、皮肤癌、肝癌、黑色素瘤、口腔、咽喉、喉部和肺的鳞状细胞癌、宫颈癌(cervical cancer)、宫颈癌(cervical carcinoma)、乳腺癌以及上皮癌、肾癌、泌尿生殖系统癌症、肺癌(pulmonary cancer)、食管癌、头颈癌(headand neck carcinoma)、大肠癌、造血系统癌症;睾丸癌;结肠癌、直肠癌、前列腺癌或胰腺癌。
D.实例
提出以下实例以便向所属领域的普通技术人员提供如何制备和评估本文所要求保护的化合物、组合物、制品、装置和/或方法的完整公开和描述,并且旨在单纯作为示例而非意图限制本公开。已经做出努力来确保关于数字(例如,量、温度等)的准确性,但应考虑到一些误差和偏差。除非另外指明,否则份数为重量份数,温度是以℃为单位或处于环境温度下,并且压力处于或接近大气压。
1.实例1:支架介导的T细胞静态工程化用于CAR-T细胞疗法
已经开发了三维(3D)大孔支架作为用于使用载体对细胞进行工程化(例如,使用RV载体对T细胞进行工程化)的高效的单步骤静态平台。发现具有大孔隙率和高吸水能力的3维支架可以使病毒载体和T细胞共定位,这与使用retronectin和旋转接种所获得的效果类似。通过钙交联海藻酸盐制备了大孔支架,其是符合GMP的经FDA批准的生物材料,由于其生物相容性、低毒性、低成本以及二价阳离子的温和凝胶作用,广泛用于许多生物医学应用。观察到干燥的、吸湿的和大孔海藻酸盐支架促进载体和细胞(例如,RV载体和T细胞)的相互作用,并且使得能够在没有旋转接种的单个步骤中实现高效的基因转移,并且不会影响工程化细胞(例如,工程化T细胞)的功能和存活能力。因此,这些支架代表了简单、成本有效并且可调节的平台技术,其用于产生用于过继性细胞疗法高度功能性T细胞。
大孔海藻酸盐支架通过温和冷冻凝胶化制备(图1A)。通过SEM的成像揭示整个支架上连接良好的100-200μm孔(图1B和1C)。使用RV颗粒测试海藻酸盐支架用于人T细胞转导。用激动性抗CD3和抗CD28抗体激活从三个不同健康供体的外周血获得的T细胞。然后将激活的T细胞接种在常规旋转接种的RV retronectin涂覆的板上或接种到海藻酸盐支架中的RV颗粒上。使用编码GFP的逆转录病毒对感染复数(MOI)为1、2和4时的转导效率进行初步筛选(图3A),证明了有效的转导,并且选择MOI为2进行进一步实验。如图1D所示,与RV颗粒一起温育72小时后,支架上的表达GFP的T细胞与retronectin涂覆的板和旋转接种中的T细胞相当(85%±3%对90%±5% GFP
为了评估支架的大孔隙度是否影响RV颗粒与T细胞之间的相互作用,制造了纳米多孔支架(图1E),其可以吸收RV颗粒和T细胞,但缺乏允许T细胞进入支架的大孔。为了测试在RV颗粒和T细胞之间创建接近是否也需要海绵样效应,测试了水合大孔支架,所述支架具有大孔,但缺乏流体进入内部孔的主动流动。发现与干大孔支架相比,干纳米多孔支架和水合大孔凝胶均不允许有效的基因转移(图1F和1G)。
接下来评估使用干大孔支架生成的CAR-T细胞在体外是否具有功能。对于这些实验,使用编码CD19抗原特异性CAR(CD19.CAR)的RV颗粒。将从三个健康供体获得的激活的T细胞接种在负载RV颗粒的海藻酸盐支架或retronectin涂覆的板上。从支架或retronectin中取出后,将T细胞维持在培养物中,并在转导后第3天和第9天分析CAR表达。如图2A所示,支架和retronectin两者都促进了可比较的转导效率,并且CAR表达到第9天扩增后保持不变(图2A、图3B)。还通过流式细胞术分析CAR-T细胞的免疫组成。没有观察到CD4、CD8或记忆(CD45RA、CCR7)或衰竭(PD-1、Lag3)标志物的表达的差异(图4和5)。接下来,为了评估体外抗肿瘤效果,将通过支架介导或retronectin介导的转导产生的对照非转导T细胞(NT细胞)和CD19.CAR-T细胞与CD19阳性靶细胞(Daudi)和CD19阴性靶细胞(U937)共培养。NT细胞不能消除任何肿瘤细胞,而使用支架或retronectin转导的CD19.CAR-T细胞消除了CD19
体外观察到的CAR-T细胞的抗肿瘤活性在体内肿瘤模型中得到证实。向非肥胖糖尿病严重联合免疫缺陷/γc-/-(NSG)小鼠静脉内(i.v.)注射用萤火虫荧光素酶(FfLuc)标记的Daudi细胞,并且四天后,向小鼠静脉内输注对照非转导(NT)细胞或通过支架或retronectin介导的转导产生的CD19.CAR-T细胞。如通过测量肿瘤生物发光强度所评估的,通过两种方法产生的CD19.CAR-T细胞控制了肿瘤细胞的生长(图8B、8C和图9)。肿瘤的控制与总体生存率的提高相关(图8E),并且无明显毒性,如通过体重变化所评估的(图8D)。因此,支架产生的CAR-T细胞在体内的功能与通过常规retronectin/旋转接种方法产生的CAR-T细胞等同。
总之证明了生物相容的大孔海藻酸盐支架由于其大孔隙度和吸湿性,在产生用逆转录病毒工程化的T细胞方面与可商购的retronectin一样有效。开发的干支架无需对涂覆有retronectin并接种有逆转录病毒颗粒的板进行旋转接种,从而简化了制造过程。在大孔海藻酸盐凝胶上通过静态转导产生的CAR-T细胞完全维持其功能性。这些数据支持使用易于合成和低成本的转导平台以使得能够产生用于过继性细胞疗法的高度功能性T细胞的潜力。这个简单的平台也可能解决对其它难治性细胞类型有用的有效转导方法的需求。
a)材料与方法
(1)大孔海藻酸盐支架的制备
制备大孔海藻酸盐支架。将2%超纯海藻酸盐(Pronova,MVG)于水中的溶液与4%葡萄糖酸钙剧烈搅拌15分钟。然后将所得混合物(最终钙浓度0.01M)浇铸在24孔板(1mL/孔)中,在-20℃下冷冻过夜,并且冻干。在体外或体内实验中使用之前,立即使用支架或在4℃下储存支架。
(2)干纳米多孔海藻酸盐支架的制备
将钙交联海藻酸盐凝胶浇铸在24孔板中并使其凝胶化过夜。然后将凝胶与浓度增加的乙醇(10%、30%、50%、70%、90%和100%v/v)进行多步骤溶剂交换,然后用超临界CO
(3)扫描电子显微镜:
用涂覆有70nm AuPd(Au:60%,Pd:40%)的锋利剃刀以7纳米/分钟切割干大孔支架,持续10分钟,并在日立(Hitachi)S-3200N变压SEM上进行分析。通过场发射扫描电子显微镜FESEM(Verios FE1)分析纳米多孔支架的表面形貌。
(4)细胞系和retronectin介导的CAR-T细胞产生。
将表达萤火虫荧光素酶的Daudi细胞维持在补充有10%胎牛血清(吉博科公司(Gibco))、2mmol/L GlutaMax(吉博科公司)、青霉素(100单位/mL)和链霉素(100mg/mL;吉博科公司)的RPMI 1640(吉博科公司)中。所有细胞维持在37℃和5% CO
(5)支架介导的CAR-T细胞的产生。
通过Amicon离心(MWCO 100Kda,密理博公司(Milipore))在4℃下将含有GFP编码或人CD19.CAR编码的γ逆转录病毒的逆转录病毒上清液浓缩20倍,2500g,持续15-20分钟。将干海藻酸盐支架转移至非组织培养涂覆的24孔板(Falcon)。将总体积为300μL培养基中的浓缩逆转录病毒(2mL的病毒上清液浓缩至200μL)和1x10
(6)流式细胞术和抗体
人CD3(APC-Cy7,557832)、CD4(APC-Cy7,561839)、CD8(PerCP-Cy5.5,565310)、CD20、CD45RA(PE,555489)、CD62L(BV421,563861)、LAG3(PE,565617)、PD-1(FITC,561035)和TIM3(BV421,565563)特异性单克隆抗体购自BD生物科学公司,并且CCR7(FITC,FAB197F-100)购自R&D系统公司(R&D Systems)。使用抗独特型scFv单克隆抗体检测CD19.CAR的表达。使用BD LSRII分析所有样品,并且每个样品获得至少10,000个事件。使用FlowJo 9(Flowjo有限责任公司(Flowjo LLC))分析结果。
(7)通过CAR-T细胞产生细胞因子。
将CAR-T细胞与Daudi肿瘤细胞以1:5的效应子与靶细胞[E:T]的比率共培养24小时,并且收集培养上清液。使用制造商的方案(R&D系统公司)通过ELISA定量IL-2和IFN-γ。
(8)体外细胞毒性。
将肿瘤细胞(Daudi)以每孔1×10
(9)体内抗肿瘤活性。
向八至十周龄雌性非肥胖糖尿病严重复合免疫缺陷/γc-/-(NSG)小鼠静脉内注射1x10
(10)统计分析。
所有统计分析均使用双尾学生t检验、单向ANOVA或双向ANOVA,以及使用图板棱镜的Tukey事后分析完成,并在图中标注为*=p<0.05、**=p<0.01、***p<0.001。
2.实例2:多功能生物材料支架快速通道CAR-T细胞疗法
CAR T细胞疗法在对抗表达CD19的B细胞恶性肿瘤方面取得了前所未有的成功,获得了两项FDA批准并且激发了数百项正在进行的临床试验。尽管CAR-T细胞疗法具有治疗人类恶性肿瘤的革命性潜力,但生产临床级CAR-T细胞所需的复杂程序和费用是广泛临床应用的主要障碍。治疗性CAR-T细胞制造需要一系列广泛的步骤,包含:(i)通过白细胞去除术从患者采集T细胞,并将其运送到制造中心;(ii)在良好操作规范(GMP)条件下进行劳动密集型程序,使用载体激活、扩增和工程化T细胞;(iii)所生产的细胞的质量控制;以及(iv)将最终的CAR-T细胞产品运送到医院并重新输注到患者体内。完整的制造过程可能花费至多50万美元,并且可能需要若干周时间。这种延迟是有问题的,因为许多癌症的侵袭性可能不允许有足够的时间来完成生产。此外,广泛的离体培养与T细胞分化有关,这通过损害CAR-T细胞在体内的移植和持久性而损害其效力。
迫切需要更快的方法来产生具有高治疗潜力的CAR-T细胞。封闭式和自动化的制造装置已经实现,以减少离体制造CAR-T细胞所需的劳动力,但这种方法仍然需要大量的离体细胞操纵。同种异体的现成CAR-T细胞可以克服为每个个体患者制造CAR-T细胞的需要,但可能导致危及生命的移植物抗宿主病,或者可能被宿主的免疫系统迅速消除。最后,已经提出了使用纳米颗粒或慢病毒在体内将CAR构建体系统地递送到T细胞。然而,此方法受到系统输注病毒的血浆半衰期短和纳米颗粒的非特异性靶向的限制。由于这些局限性,用最少的离体操纵原位产生CAR-T细胞仍然极具吸引力。如与同种异体CAR-T细胞产品相比,此类方法消除了对大量离体培养的需要,防止施用前CAR-T细胞的终末分化,并且便于使用自体T细胞。
本文描述了用于T细胞工程化和释放的一体式大孔海藻酸盐支架(MASTER在本文中也被称为CCI-Alg),其以最小的体外操纵提供体内CAR-T细胞产生。MASTER可以直接装载患者衍生的T细胞和编码CAR的病毒颗粒,并在同一天植入以在体内产生CAR-T细胞(图22)。MASTER旨在:(i)容纳T细胞和病毒颗粒;(ii)刺激T细胞激活和增殖;(iii)促进T细胞转导;以及(iv)将完全功能性CAR-T细胞持续释放到循环中以控制肿瘤生长。
海藻酸盐因为其生物相容性、生物降解性、温和凝胶化要求以及作为用于细胞培养的3D结构的广泛应用而被选择作为这些多功能支架(MASTER,在本文中也被称为CCI-Alg)的基础。为了促进支架内的T细胞激活,通过温和且有效的无铜点击化学将环辛炔缀合的抗CD3和抗CD28抗体固定在叠氮化物修饰的海藻酸盐上(图10)。为了激活和扩展支架内的T细胞,将细胞因子IL2物理地包裹在支架中。最后,海藻酸盐支架的大孔隙率是使用温和冷冻凝胶化实现的(图11A)。在整个支架上配置大孔对于最初提供细胞与逆转录病毒之间有效接触的界面以及随后向增殖的CAR-T细胞大量转移营养物至关重要。如图11B所示,MASTER的SEM图像揭示整个支架上连接良好的100-200μm孔。通过在AF-647标记的MASTER上接种表达GFP的T细胞来评估支架内的细胞分布。3D共聚焦显微镜示出,T细胞(直径为约12μm)均匀分布在整个支架的孔中(图11C、图12)。
有效的T细胞激活和转导对于CAR-T细胞制造至关重要。为了确保装载在MASTER中的T细胞接收用于逆转录病毒介导的基因转移所必需的适当激活线索,测试了与MASTER缀合的激动性抗CD3和抗CD28抗体(0μg、0.5μg、1μg、2μg或4μg,每mg海藻酸盐1:1w/w)的递增剂量。将来自三个不同供体的人外周血单核细胞(PBMC)接种在MASTER中,并且在18小时后分析早期T细胞激活标志物CD69的表达。如图11D所示,如与接种在无抗体的海藻酸盐支架上的细胞相比,接种在MASTER上的细胞表现出CD69表达增加约10倍。在抗体浓度为1μg/mg海藻酸盐时,CD69表达最高,并且此密度用于另外的研究。为了测试MASTER介导的非激活T细胞的同时激活和转导,将原初PBMC和编码GFP的逆转录病毒添加到MASTER(图11E)和缺少抗体的支架对照中,并且将所得CAR-T细胞群与使用常规旋转接种(离心到retronectin涂覆的板上)产生的细胞群进行比较。温育72小时后,当非激活PBMC和病毒在空白支架上温育或旋转接种时,几乎检测不到GFP表达(<0.4%)。相比之下,在MASTER上温育未激活的PBMC产生20%的T细胞转导(图11F和11G),指示MASTER通过逆转录病毒基因转移作为T细胞激活和静态转导的平台发挥作用。
接下来,使用编码CD19特异性CAR(CD19.CAR)的逆转录病毒评估MASTER内产生的CAR-T细胞的功能。将PBMC和CD19.CARγ逆转录病毒颗粒装载在MASTER上并且温育3天或10天。如图13A所示,在第3天在22%±1%的T细胞中检测到CAR表达,并且在第10天保持稳定(图14)。由于T细胞表型是CAR-T细胞的成功移植和持续的重要决定因素,分析MASTER产生的CAR-T细胞的表型组成,并与使用常规临床程序产生的CAR-T细胞进行比较(在retronectin涂覆的板上旋转接种激活的T细胞和逆转录病毒)。两组CAR-T细胞含有类似量的CD4
为了评估体外抗肿瘤效果,将对照非转导T细胞(NT细胞)和通过MASTER或旋转接种产生的CD19.CAR-T细胞与CD19
接下来评估MASTER是否释放驻留性T细胞。用PBMC(1x 10
出于上述结果表明MASTER作为用于T细胞激活、转导、扩增和释放的一体式平台发挥作用,在体内异种移植肿瘤模型中测试了MASTER产生的CAR-T细胞的抗肿瘤活性。用PBMC和CD19.CAR编码的逆转录病毒颗粒接种MASTER,温育一小时,并且在移植有Ffluc标记的Daudi细胞的NSG小鼠中皮下植入。用常规产生的CAR-T细胞静脉内输注处理的荷瘤小鼠充当阳性对照(图18A)。仅接种PBMC或静脉内输注非转导细胞的皮下植入MASTER的小鼠充当阴性对照。在用对照非转导细胞处理的小鼠中,肿瘤生长迅速,而MASTER产生的CAR-T细胞和常规静脉内输注的CAR-T细胞同样地控制肿瘤进展,一直到第45天,体重没有明显变化(图18B-18D、图19)。在100天时,静脉内输注400万个常规产生的CAR-T细胞实现16.6%的无肿瘤存活率。相比之下,植入MASTER和200万个PBMC使无肿瘤存活率提高至50%(p=0.15,图18E)。还检查了CAR-T细胞的体内持久性。在第14天和第22天对小鼠进行放血。在第32天,当对照小鼠达到人道终点时,对来自每个CAR-T处理组的3只小鼠进行安乐死,并收集血液、骨髓(BM)和脾脏。分析细胞悬浮液中的人CD45
总之,产生了多功能支架,其将CAR-T细胞制造和交付的各关键方面集中在一个平台上,从而将整个过程缩短到一天。支架包含保证T细胞充分激活和增殖的锚定的抗CD3和抗CD28抗体以及IL2,而大孔隙率有利于T细胞的均匀分布,为病毒颗粒与T细胞之间的相互作用创造了界面,并且有助于在体内释放完全功能性重编程的CAR-T细胞。MASTER系统是对先前生物材料的重大改进,因为它不局限于外源接种的CAR-T细胞的局部释放,相反,MASTER提供高度功能性CAR-T细胞的原位重编程和释放。此外,MASTER是模块化平台技术,其可以用于对其它免疫细胞进行重编程或递送免疫调节因子以协同支持细胞功能。
a)实验部分
(1)抗体的DBCO修饰
将10倍摩尔过量的NHS-PEG4-DBCO(A134-10,点击化学工具(Click ChemistryTools),美国)添加到抗CD3或抗CD28抗体中(图11),并在室温下温育1小时。然后,在4℃下将溶液通过amicon离心(MWCO 10kDa)以10000g纯化10分钟,直到流通物不含NHS-PEG4-DBCO(使用Nanodrop通过DBCO部分在309nm处的特有吸光度测量)。使用以下等式,根据纯化的缀合物(235-400nm)的吸光度扫描测定DBCO并入的程度(即,每个抗体的DBCO数量)。
(DBCO的摩尔浓度)/(抗体的摩尔浓度)=(A_309DBCO xε_280Ab)/(ε_309DBCO xA_280c Ab)
A309 DBCO=DBCO-Ab缀合物在309nm处的吸光度
ε280Ab=210,000M-1cm-1
A280C Ab=缀合物在280nm处的校正吸光度=A280-(A309 x CF DBCO)
ε309DBCO=12000M-1cm-1
A280Ab=DBCO-Ab缀合物在280nm处的吸光度
CF DBCO=280nm处的DBCO校正系数=1.089
(2)CCI-Alg(MASTER)的制备
制备叠氮化物修饰的海藻酸盐。为了制备MASTER,将2%(w/v)的叠氮海藻酸盐于分子生物学级水中的溶液与DBCO修饰的CD3和CD28抗体(1μg/mg海藻酸盐)在4℃下温育过夜。接下来以0.2ug/mg海藻酸盐浓度添加重组人IL2并将溶液搅拌15分钟。最后,将所得溶液与等体积的4%葡萄糖酸钙一起剧烈搅拌15分钟,浇铸在24孔板(1mL/孔)中,在-20℃下冷冻过夜并冻干。立即使用MASTER或在4℃下储存,并且在一周内用于体外或体内实验。
(3)扫描电子显微镜(SEM):
用涂覆有70nm AuPd(Au:60%,Pd:40%)的锋利剃刀片以7纳米/分钟切割干大孔支架,持续10分钟,并在日立S-3200N变压SEM上进行分析。
(4)共聚焦显微镜:
AF647 DBCO(点击化学工具)被点击缀合到用抗CD3和抗CD28抗体修饰的海藻酸盐上。通过相对水透析1天去除过量的未结合染料。如上文所描述的,制造AF647标记的支架。将1x10
(5)细胞系和CAR-T细胞产生
将表达萤火虫荧光素酶的Daudi细胞维持在补充有10% FBS(Gibco)、2mmol/LGlutaMax(吉博科公司)和青霉素(100单位/mL)和链霉素(100mg/mL;吉博科公司)的RPMI1640(吉博科公司)中。所有细胞维持在37℃和5% CO2下。
(6)常规CAR-T细胞产生
使用Lymphoprep培养基(精密化学科技公司)从血沉棕黄层(墨西哥湾地区血液中心)分离外周血单核细胞,并在涂覆有1mg/mL CD3(美天旎生物技术公司)和CD28(BD生物科学公司)mAb的板上激活。激活后2天,用逆转录病毒上清液在retronectin涂覆的24孔板(塔卡拉生物公司)上转导激活的T细胞。将经转导的T细胞在补充有10% HyClone FBS(通用电气医疗集团)、2mmol/L GlutaMax(吉博科公司)、青霉素(100单元/mL)和链霉素(100mg/mL;吉博科公司)以及10ng/mL IL7和5ng/mL IL15(派普泰克公司)的50%克里克培养基(欧文科技公司)和50% RPMI-1640中扩增,持续培养的10天至14天,然后用于功能性测定。
(7)支架介导的CAR-T细胞的产生
通过在4℃下以2500g持续15-20分钟的amicon离心(MWCO 100Kda,密理博公司)将含有GFP编码或人CD19.CAR编码的γ逆转录病毒(RV)的293T培养基浓缩10倍。将干的冻干MASTER支架转移到非组织培养物涂覆的24孔板(Falcon)上,并将200μL的浓缩RV和从Buffycoat分离的1x10
(8)流式细胞术和抗体
人CD3(APC-Cy7,557832)、CD4(APC-Cy7,561839)、CD8(PerCP-Cy5.5,565310)、CD20(FITC,555622)、CD45RA(PE,555489)、CD62L(BV421,563861)、LAG3(PE,565617)、PD-1(FITC,561035)和TIM3(BV421,565563)特异性单克隆抗体购自BD生物科学公司,并且CCR7(FITC,FAB197F-100)购自R&D系统公司。使用抗独特型scFv单克隆抗体检测CD19.CAR的表达。在BD LSRII上获得所有样品,并且每个样品获得至少10,000个事件。在FlowJo 9(Flowjo有限责任公司)上分析样品。
(9)通过CAR-T细胞产生细胞因子
将CAR-T细胞与Daudi肿瘤细胞以1:5的效应子与靶细胞[E:T]的比率共培养24小时,并且收集培养上清液。按照制造商的方案(R&D系统公司)通过ELISA定量IL-2和IFN-γ。
(10)体外细胞毒性
将肿瘤细胞(Daudi)以每孔1x10
(11)体外T细胞释放测定:
用1x10
(12)体内抗肿瘤活性
向十周至十二周龄的雌性免疫受损NSG小鼠(NOD.Cg-Prkdc
为了分析血液、骨髓或脾脏中的CAR+细胞,用抗人CD45、抗人CD3和CAR.19抗体对来自这些器官的单细胞悬浮液进行染色,并通过流式细胞术进行分析。通过70μm细胞网将器官切碎,获得脾脏的单细胞悬浮液。通过在ACK裂解缓冲液(龙沙集团(Lonza))中重新悬浮脾细胞来裂解红细胞。通过用含有PBS的注射器冲洗骨头获得骨髓单细胞悬浮液。使细胞悬浮液穿过70μm细胞网,并且通过在溶解缓冲液(BD Pharm Lyse)中再悬浮细胞来裂解红细胞。类似地,将通过脸颊出血收集的血液与裂解缓冲液(BD Pharm Lyse)一起温育,用PBS洗涤,并在用抗体染色之前穿过70μm细胞网。第22天脸颊出血失败使一只用MASTER支架互利的小鼠被排除在外。
3.实例3:MASTER的物理特征
为了更好地了解MASTER的物理特征,拍摄了MASTER的横向和截面CT图像(图23A和23B)。截面图像和横截面图像的密度较高的区域(支架)通过较亮的值指示,并且较暗的区域表示具有空气孔隙率的区域。使用CT扫描来分离孔,并基于大小对孔进行颜色编码,能够计算出孔隙率为75.8%。接下来,计算各种孔尺寸的相对频率(图23C)。近60%的孔的平均直径为101-200μm。第二大孔组的直径<100μm(大约25%)。如图23D所示,如根据孔的纵横比所测定的,大多数孔呈椭圆形状。接下来,计算MASTER内部的总表面积(图23E)。通过将表面积作为绘制体积的函数,MASTER的内表面积显示为大约810mm。通过观察孔的连接性,能够将孔的节点显示为球体,其中线在孔之间移动。孔的连接越多,球形表示越大(图23F)。计算连接的数量,大约50%的孔具有少于3个连接,大约28%的孔具有4-6个连接,并且10%的孔具有7-9个连接(图23G)。极少数孔(大约6%)具有多于9个连接。
a)方法
X射线计算机断层扫描(CT)扫描在Xradia Versa 510中进行,采集参数见下表。
表1.X射线CT实验的图像采集参数。
在每个样品中扫描2.50x2mm的圆柱形体积。这些体积用于计算样品的孔隙率和孔的尺寸。提取10x1mm的较小子体积,以计算并显示细胞之间的连接性。这样做是为了减小计算的规模并增强结果的可视化。
使用蜻蜓(Dragonfly)[蜻蜓2020.1[计算机软件]软件分析CT数据。加拿大蒙特利尔的对象研究系统公司(Object Research Systems(ORS)Inc,Montreal,Canada),2018。为了分割样品,使用直方图阈值和掩模技术为每个样品手动创建训练数据集。一旦创建了训练数据,其用于训练被称为U-net的深度学习图像分割模型。然后使用所得模型将完整样品分割成支架和孔隙度。为了计算孔之间的连接性,使用名为openPNM的开源软件包。
4.实例4:MASTER在肿瘤再激发模型中通过CAR-T细胞的静脉内输注改善了肿瘤控制。
为了观察MASTER对肿瘤控制所表现出的影响,使用淋巴瘤异种移植物再激发模型将MASTER与静脉内输注CAR T细胞进行了比较。向NSG小鼠移植FFLuc标记的CD19+人Daudi肿瘤细胞。在移植后4天,向小鼠植入MASTER或使小鼠接受CAR T细胞的静脉内输注;并且在移植后29天,对小鼠进行再激发(图24A)。图24B示出了用MASTER、常规CAR-T细胞或对照非转导(NT)细胞处理的NSG小鼠的体内肿瘤生物发光成像(BLI)。然后绘制了用NT细胞(图24C)、MASTER(图24D)或静脉内输注CAR T细胞(图24E)处理的小鼠的个体肿瘤生长曲线。每条线表示一只动物。最后,绘制了每个组随时间推移的存活率(图24F)。移植后第30天,100%的NT小鼠已经死亡(即,没有存活足够长的时间以致于无法经受再激发)。相比之下,所有接受MASTER或静脉内输注CAR T细胞的小鼠均存活到再激发。然而,再激发后,两组的功效差异变得明显。到第60天(激发后30天),静脉内输注组仅50%存活,并且到第80天,少于20%存活。接收静脉内输注CAR T细胞的小鼠的存活率急剧下降,与在移植后至少80天(再激发后50天)仍示出100%存活率的MASTER组形成鲜明对比。
5.实例5:MASTER的生物相容性
还想研究MASTER和其组分在不同组织(肝脏、心脏、肾脏、肺、脾脏和皮肤)中的生物相容性。对皮下植入MASTER、MASTER+小鼠PBMC+GFP编码的γ逆转录病毒四周后的C57Bl6/J免疫活性小鼠以及未经处理的对照采集组织样品并且进行H&E染色(图25)。进一步分析了小鼠血液(图26)。在示出竞争性生物相容性的任何治疗组之间均未观察到差异。
6.实例6:装载PBMC和逆转录病毒的MASTER不转导周围宿主细胞
接下来观察装载PBMC和逆转录病毒的MASTER是否转导宿主细胞(图27)。使用模拟体内系统的体外transwell模型,接种在transwell板底部的成纤维细胞中的GFP表达表明当MASTER与PBMC和病毒共接种(MOI 2)时,病毒不会从支架中泄漏。简而言之,装载有PBMC和逆转录病毒的MASTER不转导宿主细胞。
7.实例7粘附细胞的慢病毒转导。
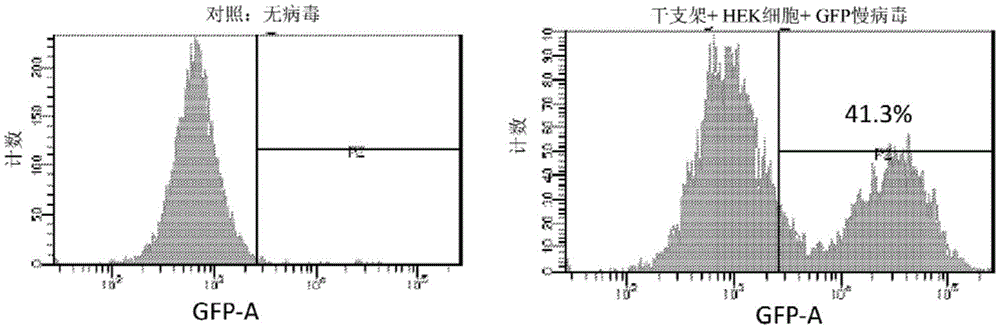
为了研究慢病毒对粘附细胞的转导能力,用100万个HEK293T细胞和GFP编码慢病毒(MOI 2)接种干支架(图28)。72小时后从支架分离细胞并测量GFP表达。41.3%的HEK293T细胞表达GFP。
E.参考文献
Agarwal S,Weidner T,Thalheimer FB,Buchholz CJ.体内生成的人CAR T细胞清除肿瘤细胞(In vivo generated human CAR T cells eradicate tumor cells).《肿瘤免疫学(Oncoimmunology)》.2019;8:e1671761。
Andersen T,Auk-Emblem P,Dornish M.海藻酸盐水凝胶中的3D细胞培养(3DCell Culture in Alginate Hydrogels).《微阵列(巴塞尔)(Microarrays(Basel))》.2015;4:133–161。
Andreadis ST,Palsson BO.逆转录病毒介导的基因转移的动力学:逆转录病毒的细胞内半衰期的重要性(Kinetics of retrovirus mediated gene transfer:theimportance of intracellular half-life of retroviruses).《理论生物学杂志(JTheor Biol)》.1996;182:1-20。
Baldino L,Concilio S,Cardea S,Reverchon E.通过超临界干燥的天然聚合物气凝胶的互穿(Interpenetration of Natural Polymer Aerogels by SupercriticalDrying).《聚合物(Polymers)》.2016;8.doi:10.3390/polym8040106
Brudno Y,Desai RM,Kwee BJ,Joshi NS,Aizenberg M,Mooney DJ.通过点击化学的体内靶向(In vivo targeting through click chemistry).《化学生物化学(ChemMedChem)》.2015;10:617-620。
Cheung AS,Zhang DKY,Koshy ST,Mooney DJ.模拟抗原呈递细胞的支架使得原代T细胞能够离体扩增(Scaffolds that mimic antigen-presenting cells enable exvivo expansion of primary T cells).《自然生物技术(Nat Biotechnol.)》2018;36:160-169。
Chuck AS,Palsson
Diaconu I,Ballard B,Zhang M,Chen Y,West J,Dotti G等人诱导型胱天蛋白酶-9选择性地调节CD19特异性嵌合抗原受体修饰的T细胞的毒性(Inducible Caspase-9Selectively Modulates the Toxicities of CD19-Specific Chimeric AntigenReceptor-Modified T Cells).《分子疗法》.2017;25:580-592。
Fesnak AD,June CH,Levine BL.工程化的T细胞:癌症免疫疗法的前景和挑战(Engineered T cells:the promise and challenges of cancer immunotherapy).《癌症自然评论(Nat Rev Cancer)》.2016;16:566-581。
García AJ,Vega MD,Boettiger D.通过纤连蛋白构象的底物依赖性变化调节细胞增殖和分化(Modulation of cell proliferation and differentiation throughsubstrate-dependent changes in fibronectin conformation).《分子细胞生物学(MolBiol Cell)》.1999;10:785-798。
Grupp SA,Kalos M,Barrett D,Aplenc R,Porter DL,Rheingold SR等人《嵌合抗原受体修饰的T细胞用于急性淋巴细胞白血病(Chimeric Antigen Receptor–Modified TCells for Acute Lymphoid Leukemia)》.《新英格兰医学杂志》.2013;368:1509-1518。
Hanenberg H,Xiao XL,Dilloo D,Hashino K,Kato I,Williams DA.逆转录病毒和靶细胞在特定纤连蛋白片段上的克隆化增加哺乳动物细胞的遗传转导(Colocalizationof retrovirus and target cells on specific fibronectin fragments increasesgenetic transduction of mammalian cells).《自然医学(Nat Med)》.1996;2:876-882。
Havenga M,Hoogerbrugge P,Valerio D,van Es HH.《逆转录病毒干细胞基因疗法(Retroviral stem cell gene therapy)》.《干细胞(Stem Cells)》.1997;15:162-179。
Hollyman D,Stefanski J,Przybylowski M,Bartido S,Borquez-Ojeda O,Taylor C等人用于自体过继性细胞疗法的靶向CD19抗原的生物功能性T细胞的制造验证(Manufacturing validation of biologically functional T cells targeted to CD19antigen for autologous adoptive cell therapy).《免疫治疗学杂志》.2009;32:169-180。
Hwang CM,Sant S,Masaeli M,Kachouie NN,Zamanian B,Lee S-H等人用于组织工程的三维多孔细胞-满载水凝胶的制造(Fabrication of three-dimensional porouscell-laden hydrogel for tissue engineering).《生物制造(Biofabrication)》.2010;2:035003。
Jackson HJ,Rafiq S,Brentjens RJ.推动CAR T细胞向前发展(Driving CAR T-cells forward).《自然评论临床肿瘤学(Nat Rev Clin Oncol)》.2016;13:370-383。
Jena B,Maiti S,Huls H,Singh H,Lee DA,Champlin RE等人临床试验中嵌合抗原受体(CAR)特异性单克隆抗体用于检测CD19特异性T细胞(Chimeric antigen receptor(CAR)-specific monoclonal antibody to detect CD19-specific T cells inclinical trials).《公共科学图书馆·综合》.2013;8:e57838。
June CH,Riddell SR,Schumacher TN.过继性细胞疗法:冲向终点线(Adoptivecellular therapy:a race to the finish line).《科学转化医学期刊(Sci TranslMed)》.2015;7:280ps7。
Korin YD,Zack JA.在T细胞中完成人免疫缺陷病毒1型逆转录需要进展到细胞周期的G1b期(Progression to the G1b phase of the cell cycle is required forcompletion of human immunodeficiency virus type 1reverse transcription in Tcells).《病毒学杂志(J Virol)》.1998;72:3161-3168。
Lamers CHJ,van Elzakker P,van Steenbergen SCL,Sleijfer S,Debets R,Gratama JW.《良好操作规范条件下的原代人T淋巴细胞的retronectin辅助的逆转录病毒转导:组织培养袋很大程度上确定细胞产率(Retronectin-assisted retroviraltransduction of primary human T lymphocytes under good manufacturing practiceconditions:tissue culture bag critically determines cell yield)》.《细胞疗法(Cytotherapy)》.2008;10:406-416。
Lamers CHJ,Willemsen RA,Luider BA,Debets R,Bolhuis RLH.用于癌症的临床免疫基因疗法的人T淋巴细胞的基因转导和扩增方案(Protocol for gene transductionand expansion of human T lymphocytes for clinical immunogene therapy ofcancer).《癌症基因疗法(Cancer Gene Ther)》.2002;9:613-623。
Lan MA,Gersbach CA,Michael KE,Keselowsky BG,García AJ.呈现不同表面化学性质的纤连蛋白涂覆的自组装单层上的成肌细胞增殖和分化(Myoblast proliferationand differentiation on fibronectin-coated self assembled monolayerspresenting different surface chemistries).《生物材料》.2005.第4523-4531页.doi:10.1016/j.biomaterials.2004.11.028
Lee DW,Kochenderfer JN,Stetler-Stevenson M,Cui YK,Delbrook C,FeldmanSA等人表达CD19嵌合抗原受体的T细胞用于儿童和青年急性淋巴细胞白血病:1期剂量递增试验(T cells expressing CD19 chimeric antigen receptors for acutelymphoblastic leukaemia in children and young adults:a phase 1dose-escalationtrial).《柳叶刀(Lancet)》.2015;385:517-528。
Lee KY,Mooney DJ.海藻酸盐:性质和生物医学应用(Alginate:properties andbiomedical applications).《聚合物进展科学(Prog Polym Sci)》.2012;37:106-126。
Leyfman Y.嵌合抗原受体:开启抗癌疗法的新时代(Chimeric antigenreceptors:unleashing a new age of anti-cancer therapy).《癌细胞国际(CancerCell Int》).2018;18:182。
Lichtman EI,Dotti G.用于B细胞恶性肿瘤的嵌合抗原受体T细胞(Chimericantigen receptor T-cells for B-cell malignancies).《转化研究(Transl Res)》.2017;187:59-82。
Lin P,Correa D,Lin Y,Caplan AI.聚凝胺在慢病毒转导期间抑制人骨髓间充质干细胞增殖(Polybrene inhibits human mesenchymal stem cell proliferationduring lentiviral transduction).《公共科学图书馆·综合》.2011;6:e23891。
Ma Q,Safar M,Holmes E,Wang Y,Boynton AL,Junghans RP.抗前列腺特异性膜抗原设计师T细胞用于前列腺癌疗法(Anti-prostate specific membrane antigendesigner T cells for prostate cancer therapy).《前列腺(Prostate)》.2004;61:12-25。
Maiti SN,Huls H,Singh H,Dawson M,Figliola M,Olivares S等人睡美人系统将T细胞特异性重定向至人应用(Sleeping beauty system to redirect T-cellspecificity for human applications).《免疫治疗学杂志》.2013;36:112-123。
Maude SL,Frey N,Shaw PA,Aplenc R,Barrett DM,Bunin NJ等人用于白血病持续缓解的嵌合抗原受体T细胞(Chimeric antigen receptor T cells for sustainedremissions in leukemia).《新英格兰医学杂志》.2014;371:1507-1517。
Maus MV,June CH.制备用于过继性T细胞疗法的更好的嵌合抗原受体(MakingBetter Chimeric Antigen Receptors for Adoptive T-cell Therapy).《临床癌症研究(Clin Cancer Res)》2016;22:1875-1884。
Morgan RA,Boyerinas B.T细胞的遗传修饰(Genetic Modification of TCells).《生物医药(Biomedicines)》.2016;4.doi:10.3390/biomedicines4020009
Nakazawa Y,Huye LE,Dotti G,Foster AE,Vera JF,Manuri PR等人用于人T淋巴细胞持续性遗传修饰的PiggyBac转座子系统的优化(Optimization of the PiggyBactransposon system for the sustained genetic modification of human Tlymphocytes).《免疫治疗学杂志》.2009;32:826-836。
Nakazawa Y,Saha S,Galvan DL,Huye L,Rollins L,Rooney CM等人piggyBac修饰的人T淋巴细胞中的长期转基因表达的评价(Evaluation of long-term transgeneexpression in piggyBac-modified human T lymphocytes).《免疫治疗学杂志》.2013;36:3-10。
Neelapu SS,Locke FL,Bartlett NL,Lekakis L,Miklos D,Jacobson CA等人Kte-C19(抗CD19 CAR T细胞)诱导患有难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的完全缓解:来自关键2期Zuma-1的结果(Kte-C19(anti-CD19 CAR T Cells)Induces CompleteRemissions in Patients with Refractory Diffuse Large B-Cell Lymphoma(DLBCL):Results from the Pivotal Phase 2Zuma-1).《血液》.2016.p.LBA–6.doi:10.1182/blood.v128.22.lba-6.lba-6
Newick K,O'Brien S,Moon E,Albelda SM.用于实体瘤的CAR T细胞疗法(CAR TCell Therapy for Solid Tumors).《医学年评(Annu Rev Med)》.2017;68:139-152。
Parker LL,Do MT,Westwood JA,Wunderlich JR,Dudley ME,Rosenberg SA等人抗卵巢癌嵌合受体转导的T细胞的扩增和特性(Expansion and characterization of Tcells transduced with a chimeric receptor against ovarian cancer).《人类基因疗法》.2000;11:2377-2387。
Patel S,Jones RB,Nixon DF,Bollard CM.用于HIV的T细胞疗法:临床前的成功和当前的临床策略(T-cell therapies for HIV:Preclinical successes and currentclinical strategies).《细胞疗法》.2016;18:931-942。
Pettitt D,Arshad Z,Smith J,Stanic T,
Plumridge H.新的昂贵的癌症治疗在走进患者方面遇到障碍(New costlycancer treatments face hurdles getting to patients).《华尔街杂志(Wall St J)》.2014;6。
Pollok KE,Hanenberg H,Noblitt TW,Schroeder WL,Kato I,Emanuel D等人重组纤连蛋白片段的转导介导了向正常和腺苷脱氨酶缺乏T淋巴细胞的高效基因转移(High-efficiency gene transfer into normal and adenosine deaminase-deficient Tlymphocytes is mediated by transduction on recombinant fibronectinfragments).《病毒学杂志》.1998;72:4882-4892。
Prasad V.免疫疗法:替沙仑赛-第一个批准的CAR-T细胞疗法:对支付者和决策者的意义(Immunotherapy:Tisagenlecleucel-the first approved CAR-T-cell therapy:implications for payers and policy makers).《自然评论临床肿瘤学》.2018;15:11-12。
Prasad V.替沙仑赛-第一个批准的CAR-T细胞疗法:对支付者和决策者的意义(Tisagenlecleucel—the first approved CAR-T-cell therapy:implications forpayers and policy makers).《自然评论临床肿瘤学(Nature Reviews ClinicalOncology)》.2018.第11-12页.doi:10.1038/nrclinonc.2017.156
Qin Y.海藻酸盐纤维的凝胶溶胀性质(Gel swelling properties of alginatefibers).《应用聚合物科学杂志(J Appl Polym Sci)》.2004;91:1641-1645。
Quintas-Cardama A,Yeh RK,Hollyman D,Stefanski J,Taylor C,Nikhamin Y等人γ逆转录病毒基因转移到人T淋巴细胞中的多因素优化的临床应用(Multifactorialoptimization of gammaretroviral gene transfer into human T lymphocytes forclinical application).《人类基因疗法》.2007;18:1253-1260。
Ramanayake S,Bilmon I,Bishop D,Dubosq M-C,Blyth E,Clancy L等人使用piggyBac基因转移和患者衍生材料的良好操作规范级的表达T细胞的CD19特异性嵌合抗原受体的低成本生成(Low-cost generation of Good Manufacturing Practice–gradeCD19-specific chimeric antigen receptor–expressing T cells using piggyBacgene transfer and patient-derived materials).《细胞疗法》.2015.第1251-1267页.doi:10.1016/j.jcyt.2015.05.013
Ramos CA,Ballard B,Zhang H,Dakhova O,Gee AP,Mei Z等人CD30特异性嵌合抗原受体重定向淋巴细胞后的临床和免疫应答(Clinical and immunological responsesafter CD30-specific chimeric antigen receptor–redirected lymphocytes).《临床研究杂志》.2017;127:3462-3471。
Ramos CA,Savoldo B,Dotti G.CD19-CAR试验(CD19-CAR trials).《癌症杂志(Cancer J)》.2014;20:112-118。
Robinet E,Certoux JM,Ferrand C,Maples P,Hardwick A,Cahn JY等人用于人T淋巴细胞离体转导和扩增的封闭式培养系统(A closed culture system for the exvivo transduction and expansion of human T lymphocytes).《血液疗法杂志(JHematother)》.1998;7:205-215。
Rosenberg SA,Restifo NP.《作为人类癌症的个性化免疫疗法的过继性细胞转移(Adoptive cell transfer as personalized immunotherapy for human cancer)》.《科学(Science)》.2015;348:62-68。
Salter AI,Pont MJ,Riddell SR.嵌合抗原受体修饰的T细胞:CD19和未来之路(Chimeric antigen receptor--modified T cells:CD19 and the road beyond).《血液》.2018;131:2621-2629。
Savoldo B,Dotti G.从工作台到床边的嵌合抗原受体(CAR)(Chimeric antigenreceptors(CARs)from bench-to-bedside).《免疫学快报(Immunol Lett)》.2013;155:40-42。
Savoldo B,Ramos CA,Liu E,Mims MP,Keating MJ,Carrum G等人CD28共刺激改善淋巴瘤患者的嵌合抗原受体修饰的T细胞的扩增和持久性(CD28 costimulationimproves expansion and persistence of chimeric antigen receptor–modified Tcells in lymphoma patients).《临床研究杂志》.2011;121:1822-1826。
Seo S,Smith C,Fraser C,Patheja R,Shah SP,Rehan S等人用于儿童巨细胞病毒相关视网膜炎的过继性T细胞疗法(Adoptive T-cell therapy for pediatriccytomegalovirus-associated retinitis).《血液进展(Blood Adv)》.2019;3:1774-1777。
Shapiro L,Cohen S.用于细胞培养和移植的新型海藻酸盐海绵(Novel alginatesponges for cell culture and transplantation).《生物材料》.1997;18:583-590。
Sharma P,King GT,Shinde SS,Purev E,Jimeno A.阿基仑赛用于复发性/难治性B细胞非霍奇金氏淋巴瘤的治疗(Axicabtagene ciloleucel for the treatment ofrelapsed/refractory B-cell non-Hodgkin's lymphomas).《今日药物(Drugs Today)》.2018;54:187-198。
Smith TT,Stephan SB,Moffett HF,McKnight LE,Ji W,Reiman D等人使用合成DNA纳米载体原位编程白血病特异性T细胞(In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers).《自然纳米技术(NatNanotechnol)》.2017;12:813-820。
Tonks A,Tonks AJ,Pearn L,Mohamad Z,Burnett AK,Darley RL.优化的逆转录病毒转导方案保留了人造血细胞的原始亚群(Optimized retroviral transductionprotocol which preserves the primitive subpopulation of human hematopoieticcells).《生物技术进展(Biotechnol Prog)》.2005;21:953-958。
Turtle CJ,Hanafi L-A,Berger C,Gooley TA,Cherian S,Hudecek M等人成人B细胞ALL患者中定义的CD4+:CD8+组成的CD19 CAR-T细胞(CD19 CAR–T cells of definedCD4+:CD8+composition in adult B cell ALL patients).《临床研究杂志》.2016;126:2123-2138。
Verhoeyen E,Costa C,Cosset F-L.慢病毒载体基因转移到人T细胞中(Lentiviral Vector Gene Transfer into Human T Cells).《造血干细胞的遗传修饰(Genetic Modification of Hematopoietic Stem Cells)》.2009.第97-114页.doi:10.1007/978-1-59745-409-4_8
Watanabe K,Kuramitsu S,Posey AD Jr,June CH.扩大实体瘤CAR T细胞疗法的治疗窗口:CAR T生物学的已知和未知(Expanding the Therapeutic Window for CAR TCell Therapy in Solid Tumors:The Knowns and Unknowns of CAR T Cell Biology).《免疫学前沿(Front Immunol)》2018;9:2486。
Xu Y,Zhang M,Ramos CA,Durett A,Liu E,Dakhova O等人密切相关的T记忆干细胞与CAR.CD19-T细胞的体内扩增相关并且通过IL-7和IL-15保存(Closely related T-memory stem cells correlate with in vivo expansion of CAR.CD19-T cells andare preserved by IL-7and IL-15).《血液》.2014;123:3750-3759。
Zhao Y,Moon E,Carpenito C,Paulos CM,Liu X,Brennan AL等人多次注射表达嵌合抗原受体的电穿孔自体T细胞介导人播散性肿瘤的消退(Multiple injections ofelectroporated autologous T cells expressing a chimeric antigen receptormediate regression of human disseminated tumor).《癌症研究(Cancer Res)》.2010;70:9053-9061。
Zhou P,Lee J,Moore P,Brasky KM.通过结合32℃离心与CH-296涂覆的板的猕猴原代T淋巴细胞的高效基因转移:基因转移方案对T细胞归巢受体表达的影响(High-Efficiency Gene Transfer into Rhesus Macaque Primary T Lymphocytes byCombining32℃ Centrifugation and CH-296-Coated Plates:Effect of Gene TransferProtocol on T Cell Homing Receptor Expression).《人类基因疗法》.2001.第1843-1855页.doi:10.1089/104303401753153901
Bach,P.B.CAR-T疗法的全国覆盖率分析-政策、证据和支付(National CoverageAnalysis of CAR-T Therapies—Policy,Evidence,and Payment).《新英格兰医学杂志(New England Journal of Medicine)》第379卷1396-1398(2018)。
Caffrey,M.随CAR T细胞疗法的批准而来的下一个挑战:支付者覆盖率(Withapproval of CAR T-cell therapy comes the next challenge:payer coverage).《美国管理护理杂志(Am.J.Manag.Care)》24,SP35–SP36(2018)。
Coon,M.E.,Stephan,S.B.,Gupta,V.,Kealey,C.P.和Stephan,M.T.用CAR-T细胞功能化的镍钛诺薄膜用于实体肿瘤治疗(Nitinol thin films functionalized withCAR-T cells for the treatment of solid tumours).《自然生物医学工程(Nat BiomedEng)》4,195–206(2020)。
Depil,S.,Duchateau,P.,Grupp,S.A.,Mufti,G.和Poirot,L.(‘现成’异基因CART细胞:发展与挑战‘Off-the-shelf’allogeneic CAR T cells:development andchallenges).《自然评论药物发现(Nat.Rev.Drug Discov.)》1-15(2020)。
Enblad,G.等人使用CD19靶向第三代CAR T细胞用于淋巴瘤和白血病的I/IIa期试验(A phase I/IIa trial using CD19-targeted third-generation CAR T cells forlymphoma and leukemia).《临床癌症研究》24,6185–6194(2018)。
Gattinoni,L.,Klebanoff,C.A.和Restifo,N.P.干细胞特性的途径:构建最终的抗肿瘤T细胞(Paths to stemness:building the ultimate antitumour T cell).《自然综述:癌症(Nat.Rev.Cancer)》12,671–684(2012)。
Ghassemi,S.等人减少离体培养提高嵌合抗原受体(CAR)T细胞的抗白血病活性(Reducing Ex Vivo Culture Improves the Antileukemic Activity of ChimericAntigen Receptor(CAR)T Cells).《癌症免疫学研究(Cancer Immunol Res)》6,1100–1109(2018)。
Hernandez,I.分析确定CAR T细胞疗法的真实成本(Analysis determines truecost for CAR T-cell therapy).Helio-In the Journals Plus.12月3日访问,(2018)。
Hori,Y.,Winans,A.M.和Irvine,D.J.原位凝胶并共同传递免疫调节因子的基于海藻酸盐溶液/微球混合物的模块化可注射基质(Modular injectable matrices basedon alginate solution/microsphere mixtures that gel in situ and co-deliverimmunomodulatory factors).《生物材料学报(Acta Biomater)》.5,969–982(2009)。
Maude,S.L.等人患有B细胞淋巴细胞白血病的儿童和年轻成人中的司利弗明(Tisagenlecleucel in Children and Young Adults with B-Cell LymphoblasticLeukemia).《新英格兰医学杂志》.378,439-448(2018)。
Mock,U.等人使用CliniMACS prodigy自动制造用于过继性免疫疗法的嵌合抗原受体T细胞(Automated manufacturing of chimeric antigen receptor T cells foradoptive immunotherapy using CliniMACS prodigy).《细胞疗法(Cytotherapy)》18,1002–1011(2016)。
Park,J.H.等人CD19 CAR疗法用于急性淋巴细胞白血病的长期随访(Long-TermFollow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia).《新英格兰医学杂志》.378,449-459(2018)。
Pettitt,D.等人CAR-T细胞:临床试验前景的系统综述和混合方法分析.《分子疗法》.26,342-353(2018)。
Plumridge,H.新的昂贵的癌症治疗在走进患者方面遇到障碍.《华尔街杂志》.6,(2014)。
Ramos,C.A.等人靶向恶性肿瘤相关κ轻链的T淋巴细胞的临床应答(Clinicalresponses with T lymphocytes targeting malignancy-associatedκlight chains).《临床研究杂志》.126,2588-2596(2016)。
Rosenblum,D.,Joshi,N.,Tao,W.,Karp,J.M.和Peer,D.癌症治疗靶向递送的进展和挑战(Progress and challenges towards targeted delivery of cancertherapeutics).《自然通讯(Nat.Commun.)》9,1410(2018)。
Savina,I.N.,Ingavle,G.C.,Cundy,A.B.和Mikhalovsky,S.V.用于产生用于先进生物技术、医疗和环境应用的大体积3D大孔水凝胶的简单方法(A simple method for theproduction of large volume 3D macroporous hydrogels for advancedbiotechnological,medical and environmental applications).《科学报告(Sci.Rep.)》6,21154(2016)。
Shah,N.N.和Fry,T.J.CAR T细胞疗法耐药的机制(Mechanisms of resistanceto CAR T cell therapy).《自然综述:临床肿瘤学(Nat.Rev.Clin.Oncol.)》16,372-385(2019)。
Simmons,A.和Alberola-Ila,J.T细胞和T细胞前体的逆转录病毒转导(Retroviral Transduction of T Cells and T Cell Precursors).《分子生物学方法(Methods Mol.Biol.)》1323,99-108(2016)。
Smith,T.T.等人共传递工程化T细胞的生物聚合物和STING激动剂可以消除异质性肿瘤(Biopolymers codelivering engineered T cells and STING agonists caneliminate heterogeneous tumors).《临床研究杂志》.127,2176-2191(2017)。
Stock,S.等人retronectin介导的T细胞激活对CD19特异性嵌合抗原受体T细胞的扩增和表型的影响(Influence of Retronectin-Mediated T-Cell Activation onExpansion and Phenotype of CD19-Specific Chimeric Antigen Receptor T Cells).《人类基因疗法》29,1167-1182(2018)。
Tang,J.,Hubbard-Lucey,V.M.,Pearce,L.,O'Donnell-Tormey,J.和Shalabi,A.癌症细胞疗法的全球前景(The global landscape of cancer cell therapy).《自然评论药物发现》.17,465-466(2018)。
Vera,J.等人针对人免疫球蛋白κ轻链重定向的T淋巴细胞有效杀伤成熟的B淋巴细胞衍生的恶性细胞(T lymphocytes redirected against the kappa light chain ofhuman immunoglobulin efficiently kill mature B lymphocyte-derived malignantcells).《血液》108,3890–3897(2006)。
Xu,Y.和Dotti,G.选择偏差:维持低分化T细胞用于过继免疫治疗(Selectionbias:maintaining less-differentiated T cells for adoptive immunotherapy).《临床研究杂志》第126卷35–37(2016)。
- 甲基-β-环糊精在提高杆状病毒对哺乳动物细胞转导效率中的应用
- 甲基-β-环糊精在提高杆状病毒对哺乳动物细胞转导效率中的应用
